Contents
コロナウイルス病の時代のコロナウイルスの神経病因と神経学的症状2019
jamanetwork.com/journals/jamaneurology/fullarticle/2766766
SARS-CoV-2 SARS-CoV-2ウイルスは、SARS-CoV-1ウイルスと密接な配列相同性を持っている。どちらのウイルスも、哺乳類宿主細胞上のアンジオテンシン変換酵素2(ACE2)受容体に結合するためにウイルス表面のスパイク蛋白質を使用し、その後、スパイクをプライムするためにセリンプロテアーゼ膜貫通プロテアーゼセリン2(TMPRSS2)を使用する。
ヒトでは、ACE2は気道上皮、腎臓細胞、小腸、肺実質、血管内皮に発現しており、全身および中枢神経系に広く分布している(図1)。
脳内ACE2
ヒトの脳内での特定の細胞および空間的な局在に関する情報が出てきている。最近の報告35(査読なし)では、ACE2はニューロン、アストロサイト、オリゴデンドロサイトで発現していることがわかった。また、ACE2の発現は黒質、脳室、中側頭回、後帯状皮質、嗅球にも高濃度に発現していた35。
他のマウスモデルでは、ACE2 の発現は、運動野、ニューロンの細胞質、グリア細胞、脳幹の交感神経経路で確認されている36,37 。神経細胞培養では、ACE2 は表面膜と細胞質の両方で発現している38。
神経侵入の潜在的なメカニズム COVID-19患者における神経学的合併症の報告があるが、SARS-CoV-2がヒトにおいて神経刺激性を有するかどうかは不明である。
ウイルス侵入経路
ウイルスの神経侵入は、感染したニューロン(図2)、嗅神経を介した侵入(図2)、血管内皮への感染(図3)、血液脳関門(BBB)を介した白血球の移動(図3)など、いくつかの経路によって達成される可能性が高い。
神経シナプスの逆行経路
ヒトおよび非ヒトのコロナウイルスが末梢神経末端に侵入し、神経シナプスに沿って逆行的に拡散し、中枢神経系に侵入するという証拠が増えてきている(図 2)12,39 。
ウイルスのシナプスを介した移動は、HCoV-OC43、ヘマグルチン化脳脊髄炎ウイルス 67(HEV67)、鳥類気管支炎ウイルスなど、いくつかの CoV について実証されている12。例えば、HEV67 は鼻腔内に侵入し、子豚やラットの鼻粘膜、肺上皮、小腸に感染する。その後、末梢神経に感染し、背側根神経節に逆行性に広がり、髄質ニューロンに到達する。
同様の小胞媒介分泌経路により、HEV67 はニューロンと衛星細胞の間で拡散することができる。単純ヘルペスウイルス、HIV、および HCoV-OC43 はすべて、逆行性の高速軸索輸送を用いてニューロンの細胞体に感染することが示されている42 。
COVID-19 の発生時には、呼吸器症状を伴うか否かにかかわらず、嗅覚喪失(無嗅覚)および味覚喪失(加齢臭)が単発的に報告されている43 。ACE2 を発現するトランスジェニックマウスモデルでは、マウスに SARS-CoV-1 を経鼻接種したところ、ウイルスが転写経路を介して中枢神経系に侵入したことが示された44,45 。
SARS-CoV-2が転写経路を介して同様に中枢神経系に拡散するかどうかは不明である。
新たな報告46,47(査読なし)では、嗅上皮のustentacularおよび幹細胞はACE2を発現しており、SARS-CoV-2感染に対して脆弱であることが示唆されているが、嗅覚ニューロンはACE2を発現しておらず、SARS-CoV-2は神経細胞にアクセスできないことが示唆されている。
これらの予備的な知見は、嗅覚上皮の損傷が、神経細胞の損傷ではなく、臨床的な無感覚症の原因となっていることを示唆している。
血液脳関門の拡散
SARS-CoV-2がBBBを介して拡散するには、2つのメカニズムが考えられる。
BBBは血管内皮細胞、アストロサイト、ペリサイト、細胞外マトリックスから構成されている48 。血管内皮細胞はタイトジャンクションによって結合し、BBBの透過性を調節している。
血管内皮細胞
第一のメカニズムは、血管内皮細胞への感染および血管内皮細胞間の輸送を介したものである(図 3)。全身の血管内皮細胞はACE2を発現しており、SARS-CoV-2による感染のリスクがある。
ある剖検例研究では、前頭葉標本の毛細血管内皮およびニューロンにSARS-CoV-2ウイルス粒子が存在することが実証されている49 。インドでは、ウイルス粒子が拡張した小胞に包まれていることが確認された。電子顕微鏡によるイメージングでは、内皮細胞を横切るウイルス粒子のエンドサイトーシスまたはエキソサイトーシスが実証されている。
アルボウイルスは、内皮細胞に侵入し、BBBを越えてCNSに侵入するために、複製を伴わない同様の活性輸送メカニズムを用いている50 。ウイルスが血管やニューロン組織に侵入すると、ウイルスの出芽のサイクルが始まり、ウイルスがニューロン、グリア、血管上のACE2と接触することで、血管やニューロン組織にさらなる損傷を与える可能性がある51 。
白血球感染
第二のメカニズムは、BBB を通過する白血球への感染によるもので、トロイの木馬メカニズムと呼ばれている(図 3)52 。このメカニズムは HIV でよく知られており、感染した免疫細胞が血液から BBB を通過して中枢神経系に感染するというものである42,53 。
57 COVID-19を特徴づける全身性の炎症はBBBの透過性を高め、それによって感染した免疫細胞、サイトカイン、およびおそらくウイルスが中枢神経系に通過することを可能にしている可能性が高い。
COVID-19 SARS・MERS:神経学的な視点
www.ncbi.nlm.nih.gov/pubmed/32417124
神経学的合併症
COVID-19、SARS、MERSの神経学的合併症 最近の証拠は、COVID-19の病態生理が神経系にも関与している可能性を示唆しています。200人以上の参加者が参加した中国でのレトロスペクティブ研究では、COVID-19患者のサブセットが神経学的症状を経験していることが明らかになった [9]。
これらの症状には意識障害、急性脳血管障害および骨格筋症状が含まれ、中枢神経系(CNS)と末梢神経系(PNS)の両方が関与していることが示唆された。観察された症状は、重篤な疾患を有する患者では、より多くの可能性があった。
他のPNS症状としては、低痛症や低汗症などが考えられた。これらの神経学的症状と患者の転帰との関連は、発表時にはまだ急性期の入院患者であったため、調査できなかった。
同じグループによる別の研究では、13人の患者でCOVID-19感染に続いて、虚血性脳卒中、脳静脈洞血栓症、脳出血などの急性脳血管障害が起こったと報告している[10]。これらの特徴は、重症化した患者や高齢の患者では再びより一般的であった。
中国で得られた知見と一致するように、フランスで行われた第2の研究でも神経学的症状が報告されており、この研究では急性呼吸窮迫症候群により入院したCOVID-19患者58人を追跡調査した[11]。
84%がICU入院から神経筋遮断薬の中止まで、さまざまな時点で神経学的症状を経験していた。神経学的特徴には、脳症、皮質脊髄路機能障害、動揺、せん妄が含まれていた。少数の患者に実施されたMRIと灌流脳画像検査では、錐体部の増強と両側性前頭側頭前部低灌流が認められ、2名の患者では小規模な急性虚血性脳卒中が認められた。
COVID-19に関連する神経学的症状をさらに特徴づけるための追加研究を待つ中で、COVID-19患者におけるギラン・バレー症候群や急性骨髄炎から急性出血性壊死性脳症に至るまでの急性神経学的障害を記述した症例報告が増加している[12-18]。
過去のSARS
過去のコロナウイルス感染症では、神経学的関連は比較的少なかったのですが、COVID-19患者では、神経学的関連が認められている[12-18]。
SARS患者の症例報告では、痙攣、ミオパチー、横紋筋融解症の発症が報告されている[19-23]。206人のSARS患者を対象としたある研究では、5例の急性脳血管障害が報告されている [24]。これがSARSとCOVID-19の病態生理の間に平行線を引くことに値するかどうかは、しかしながら議論の余地がある。
これらの症状はまれなものであり、場合によっては鑑別診断と関連していることを認めると、脳脊髄液(CSF)[19,21]と剖検脳組織[23]の両方にウイルスRNAが存在することは、それにもかかわらず、SARSコロナウイルスに神経栄養成分があることを示唆している。 神経障害もまた、MERSの発生中に報告されており、神経障害、せん妄、急性脳血管障害がいくつかの症例報告で報告されている。
MERS
70人のMERS患者を対象とした別の研究では、参加者のうち18人と6人にそれぞれ混乱と発作が報告されている[28]が、このような所見の解釈には再び注意が必要である。
SARSとは対照的に、CSF中のMERSコロナウイルスの存在を示す証拠は現在ほとんど存在しない。これはCOVID-19の場合にも当てはまるようであるが、CSF中のウイルスの存在を示す証拠はまだ1例の症例報告に限られており[15]、他の研究ではこれらの所見を再現することができなかった[11,12,18]。
ACE2受容体
ACE2受容体 MERS-CoVがジペプチジルペプチダーゼ4(DPP4)受容体に結合して細胞に感染するのに対し、SARS-CoVはアンジオテンシン変換酵素2(ACE2)受容体を介して作用する[4]。ACE2は、骨格筋や脳を含むさまざまな臓器に発現する膜結合型タンパク質である[29,30]が、最近、SARS-CoV-2の機能的な受容体であることも明らかになった[31]。
SARS-CoV-2は、SARS-CoVと同様に、スパイクタンパク質と宿主ACE2受容体との相互作用を介して宿主細胞膜に接着する[32,33]。注目すべきことに、SARS-CoV-2スパイク蛋白質のACE2への結合親和性は、SARS-CoVスパイク蛋白質よりも有意に高いことが明らかにされている[32]が、このことの意味合いはまだ確立されていない。
ACE阻害薬とイブプロフェンはACE2レベルを上昇させる可能性があり[34]、COVID-19感染を促進する可能性があり、片頭痛の管理に使用されていることから関心を集めている。
中枢神経系に侵入経路
神経刺激性 SARS-CoV-2がどのようにしてヒトの中枢神経系に侵入するのかは、現在のところ不明である。示唆されているメカニズムの1つは、血行性播種によるものであり、それによってウイルスは血流から内皮細胞または白血球に感染して中枢神経系に侵入する [35]。
別の経路として考えられるのは、ウイルスが末梢神経細胞に感染することで中枢神経系へのアクセスを得る逆行性神経経路を介したものである[35]。動物実験では、SARS-CoVが嗅覚経路を介して脳に到達し、神経変性を促進することが実証されている [33]。
また、嗅覚領域に存在する細胞の特定のサブセットによって、ACE2受容体とSARS-CoV-2の侵入にも必要なスパイクプロテインプロテアーゼTMPRSS2の両方が発現していることを示す一致した結果が得られている[36,37]。
SARSに関連した嗅覚神経障害の報告はまばらであるが [38]、無感覚および低感覚は、COVID-19感染の重要な特徴として認識されつつあり、多くの場合、症状として現れることが多い [9,39-43]。したがって、これらの研究は、SARS-CoV-2ニューロトロピズムの理解を深めることを目的とした将来の研究のための有望な道筋を提供する可能性がある。
COVID-19の神経学的発現の可能性のあるメカニズム
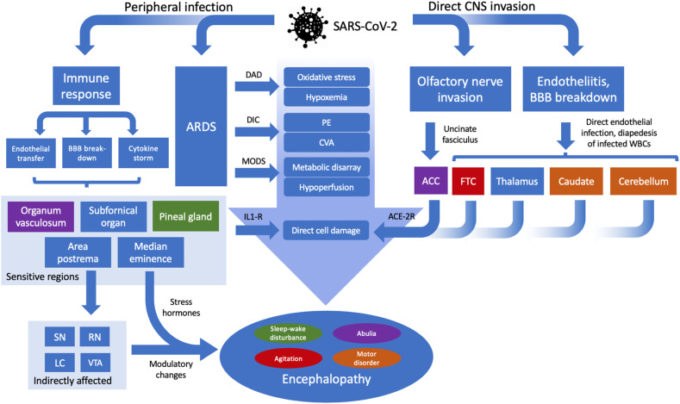
SARS、MERSおよびCOVID-19におけるヒト神経系の関与は様々な証拠から支持されているが、異なる神経学的特徴が全体的な病態生理とどのように関連しているのか、すなわち、それらが直接的または間接的にウイルス感染に起因するのか、あるいは低酸素症、敗血症、多臓器不全などの他のメカニズムを介して生じるのかを確認することは依然として困難である。
1つの可能性のあるメカニズムは、免疫関連経路を介したものである。 COVID-19は重要な免疫成分を有しているようであり、いくつかの研究でCOVID-19患者におけるリンパ球減少やC反応性蛋白(CRP)レベルの上昇などの所見が報告されている [6,44,45]。
二次性血球貪食細胞性リンパ組織球症(sHLH)を含むサイトカインストーム症候群は、COVID-19患者、特に重症患者ではまれではあるが致死的な合併症として最近注目されている [46]。そのため、重症のCOVID-19患者では、高炎症を示唆するフェリチン値の上昇をモニターすることが多くなっている。
低いリンパ球・血小板レベル
特筆すべきは、ある研究では、CNS症状を呈するCOVID-19患者のリンパ球レベルと血小板数が、CNS病変のない患者と比較して低いことが報告されていることである[9,10]。
また、重症の患者では、高凝固状態と内因性線溶のマーカーであるD-ダイマーのレベルが高いことが明らかになっており、これが、急性脳血管障害がこのような患者でより一般的に発症する理由を説明している可能性がある[9,10]。
したがって、抗炎症経路を早期に標的とし、急性脳血管疾患のリスクを低減することが示唆されている[10]。
SARSやMERSを含む過去のほとんどの研究は、主に小規模な患者サンプルを対象としているが、COVID-19に関する最新のエビデンスは、かなりの割合の患者で神経学的イベントが発生する可能性があることを示唆している。
COVID-19による神経精神症状の潜在的メカニズム
www.sciencedirect.com/science/article/pii/S088915912030489X
われわれは、COVID-19による精神神経疾患後遺症の巨大な波に直面しているのか?
過去のパンデミックでは、さまざまな種類の神経精神症状が、急性ウイルス感染を伴っており、回復した患者でも数週間、数か月、またはそれ以上、神経症状が長く続いてきた。COVID-19症例における急性神経精神症状の証拠が浮上してきている。
中国武漢の217人の入院患者の最初の報告では、脳血管合併症(脳卒中など)、脳症、筋肉の損傷など、重症感染症のほぼ半数で神経症状が示された。
興味深いことに頭痛、めまい、運動失調などを示す患者では、リンパ球数は有意に低い。筋肉痛などの症状を示す患者でもリンパ球数が低く、CRPの上昇が見られた。
過去のメタ分析では、集中治療室でサイトカインストームを経験した患者では3割がせん妄を発症し、退院したせん妄患者は、最大で18ヶ月まで認知障害が示された。
・中枢神経系へのウイルスの浸潤
・サイトカインストームネットワークの調節不全(CNS浸潤不要)
・末梢免疫細胞の遊走 感染した単球による神経炎症
・感染後の異常な自己免疫応答
・コルチコステロイドなど免疫調節治療の影響
・腸内微生物(腸脳軸)
www.bmj.com/content/350/bmj.h2538
中枢神経系に侵入したウイルスがニューロンに変化を引き起こす可能性は、SARS犠牲者の剖検で証明されている。COVID-19での急性壊死性脳症患者症例があり、おそらくCNS内のサイトカインストームと関連。呼吸逼迫は呼吸中枢へのウイルス浸潤が加担しているかもしれない。
jns-journal.com/article/S0022-510X(20)30160-X/pdf
pubs.acs.org/doi/10.1021/acschemneuro.0c00201
COVID-19パンデミックの神経精神医学的側面 選択的レビュー
想定されるメカニズム
神経学的症状は、コロナウイルスによる直接的な神経侵入による影響、または二次的な影響でもあり得る。多くの呼吸器ウイルスと同様に、コロナウイルスは、神経系に直接影響を及ぼすことが観察されている(Desforgesら、2014年;Desforgesら、2019年;Natoliら、2020年)。
嗅神経経路
広がりは、血液性経路を介して起こり得るが、最も一般的に報告されている侵入は、嗅神経経路を介してである(Wuら、2020)。この侵入は、髄膜炎、脳症、または軽度の場合には発作をもたらす可能性がある(Desforgesら、2019; Zhouら、2020)。
ACE2
直接的な侵入は、毛細血管および神経内皮の両方で発現するアンジオテンシン変換酵素2(ACE-2)受容体の活性化を介して可能であるかもしれない(Wuら、2020;Hammingら、2004)。
免疫応答の調節異常
二次的な免疫変化は、慢性的な神経精神医学的後遺症の根底にあると仮説されている(Severanceら、2011;Qinら、2020;Needhamら、2020)。
過度の炎症をもたらす調節不能な免疫応答は、感染の重症度において重要な役割を果たすと推測されている(Qinら、2020;Toljan、2020)。
髄質ニューロンの破壊
髄質ニューロンの直接的な破壊の可能性は、重症患者の呼吸不全を促進する可能性がある(Li et al., 2020a; Tassorelli et al., 2020)。
ウイルスの神経侵入
感覚障害またはせん妄の変化は、ウイルスによる直接的な神経侵入、中枢性免疫活性化、多臓器不全、低酸素、代謝異常、および治療に関連した二次的なものであるかもしれない(Wu et al., 2020; Kotfis et al., 2020)。
プロトロンビン・凝固障害
さらに、患者はまた、最終的に血栓症または出血に寄与する可能性のあるプロトロンビン時間の増加および凝固障害を示す(Wang and Li, 2020)。
HPA軸
ウイルス発生時のストレスは、ステロイドの増加レベルを放出する視床下部-下垂体-副腎軸を活性化すると推測される。放出されたステロイドは免疫系の機能を低下させ、感染を促進したり、重症度を悪化させたりする可能性がある。
ウイルス感染はさらに神経衰弱や慢性疲労を引き起こする。
薬剤副作用
精神症状もまた、オセルタミビル、コルチコステロイドおよびインターフェロンのようなCOVID-19の治療に使用される薬剤の副作用に二次的に現れる可能性がある(Russellら、2020年;上田ら、2015年;HaqueおよびNizami、2017年)。
あるファーマコビジランス研究では、クロロキンへの曝露に関連した健忘症、せん妄、幻覚、抑うつ、意識消失などの有意な神経精神医学的副作用が報告されている(Sato et al. クロロキンおよび他の抗ウイルス薬は、中毒性神経障害およびミオパチーを引き起こす可能性がある(Cortegianiら、2020年;GuidonおよびAmato、2020年)。
HPA軸
SARSにおけるHPA軸の関与の生化学的証拠は、Leow らによって最初に報告された。
SARS集団発生の61人の生存者が、回復してから3か月、定期的に評価された。患者の40%は中枢性副腎皮質機能低下症の証拠があり、その大部分は1年以内に回復した。
患者のごく一部では、中枢甲状腺機能低下症と低レベルのDHEA-Sを示した。著者らは、一過性の視床下部下垂体機能障害の状態につながる可能性のある可逆的な下垂体炎または直接的な視床下部の損傷の可能性を提案した。
剖検研究の視床下部では、SARS-CoVゲノムとともに、無症候性、浮腫、および神経変性が確認されている。視床下部組織、下垂体組織はACE2を発現するため、ウイルスの標的になる可能性がある。
視床下部-下垂体へのウイルスが侵入するポータルは、血行経路を介して直接篩状板を通過する可能性がある。
それにもかかわらず、副腎皮質機能低下症が活動性SARS(またはCOVID-19)の患者で記録されたことはない。
副腎不全の人は、呼吸器感染症に関連した死亡率が高くなる。
コロナウイルス感染から生き残ったオリゴデンドロサイトが中枢神経系の炎症反応を延長させる
www.pnas.org/content/early/2020/06/18/2003432117.long
遺伝的要因と環境的要因の両方、特にウイルスが多発性硬化症の発症に寄与している可能性がある。本研究では、オリゴデンドロサイト(OL)が神経栄養コロナウイルス(マウス肝炎ウイルス)に感染しても少なくとも150日間生存していることを明らかにした。
注目すべきことに、炎症性細胞の浸潤の程度と、それに続く正常なOLの形態を回復する能力は、中枢神経系(CNS)の解剖学的位置に応じて変化した。これらの結果から、感染した細胞が中枢神経系で生存する能力が予想外に高いことが明らかになり、炎症反応と再石灰化に寄与する能力が中枢神経系の異なる領域で異なることが示唆された。
要旨
コロナウイルスの一種であるマウス肝炎ウイルス(MHV)の神経刺激性株は、ヒトの多発性硬化症と類似した急性・慢性脱髄性脳脊髄炎を引き起こす。ここでは、系統追跡システムを用いて、いくつかの細胞、主にオリゴデンドロサイト(OL)とオリゴデンドロサイト前駆細胞(OPC)が急性MHV感染後も生き残り、脱髄領域に関連し、少なくとも150日間中枢神経系(CNS)に留まることを示した。
注目すべきことに、炎症性細胞の浸潤の程度は変動し、CNS内の解剖学的位置に依存し、生存細胞数との明らかな相関関係はなかった。T細胞やミクログリア/マクロファージの数が多い領域では、浸潤細胞の数が少ない領域に比べて脱髄が多かった。
逆に、炎症の少ない領域では、先に感染したOLは、正常な骨髄化機能と一致して、より迅速にプロセスを拡張していた。以上の結果から、OLは宿主免疫応答の誘導因子であると同時に標的でもあることが明らかになった。また、CNS感染が治癒した後であっても、CNS領域に依存した再髄化障害を伴う炎症性変化の長期化を引き起こす可能性があることが示された。
関連記事