Contents
SARS-CoV2とナチュラルキラー細胞
NK細胞の多面的な抗ウイルス活性
- インターフェロンγなどの炎症性サイトカインの産生
- 感染細胞の溶解
- 抗原提示細胞の利用可能なプールの編集により適応抗ウイルス応答を形成しT細胞応答を直接阻害する。
- 抗ウイルスT細胞のメモリー機能を開発できる。
- 抗体依存性細胞傷害(ADCC)を介して抑制ウイルス複製に対してB細胞と協働することができる。
www.ncbi.nlm.nih.gov/pmc/articles/PMC6476651/
NK細胞ベースの免疫チェックポイント阻害
ナチュラルキラー細胞の枯渇
腫瘍の進行、慢性感染症はNK細胞の枯渇につながる。 エキソソーム、抑制性サイトカイン、低酸素症なども、活性化受容体の下方制御と抑制性受容体の上方制御につながる。 抑制性受容体NKG2Aは肝細胞癌患者で増加、IL-10とも相関し、予後不良を予測。
www.ncbi.nlm.nih.gov/pmc/articles/PMC5487399/
TGFβR1の遮断 PD-1
TGFβR1の遮断は、NK細胞活性化受容体、CD226、NKp30、NKG2D、および細胞溶解分子、TRAIL、パーフォリン、およびグランザイムAのTGF-β誘発ダウンレギュレーションを回復 in vitro
pubmed.ncbi.nlm.nih.gov/27496729/
免疫チェックポイント
COVID-19におけるナチュラルキラー細胞の薬剤性抑制性免疫チェックポイントの同定
www.nature.com/articles/s41423-020-0493-9
SARS-COV-2 への感染は COVID-19 の原因であり、世界的に未曾有の健康危機を引き起こしている。SARS-COV-2 感染の過程で生じる免疫反応の解析と理解は、治療法の提案に役立つ可能性がある。
ナチュラルキラー(NK)細胞は抗ウイルス免疫応答に重要な役割を果たしていることから、我々は82人のコホートから血液中のNK細胞を解析した2。
健常対照者(HC)10人、無症候性COVID-19患者(pauci)10人、肺炎患者(pneumo)34人、SARS-CoV-2感染によるARDS患者28人の計82人のコホートから血液中のNK細胞を解析した。末梢血NK細胞、B、CD4+およびCD8+ Tリンパ球の絶対数は、肺炎およびARDS群では、健康な対照群に比べて低かったが、これは以前に発表された結果と一致していた3(図1a)。
さらにNK細胞サブセットを調査したところ、CD45+CD3-CD56+の全NK細胞のうち、CD16とCD57細胞表面受容体の発現に基づいて定義されるサブセットである成熟NK細胞の割合は、ARDS患者で著しく低いことがわかった(図1b)。成熟NK細胞がウイルス感染における役割を果たすことを考えると、成熟NK細胞の喪失は、COVID-19の最も重篤な症例で発生する肺合併症に寄与している可能性がある。
次に、我々は、SARS-CoV-2クリアランスを促進するためにNK細胞の抗ウイルス活性を向上させる可能性のある分子経路に着目し、いくつかの免疫チェックポイントの発現を解析した。
がん治療のために開発されたPD-1,4 NKG2A,5,CD396の免疫抑制機能をブロックする治療用モノクローナル抗体が入手可能であることから、我々のコホートでは、これらの分子のNK細胞上での発現を解析した。
PD-1とNKG2Aは細胞表面受容体であり、それぞれのリガンドであるPD-L1とHLA-Eとの結合により、T細胞とNK細胞の機能を阻害する。CD39は、ウイルス感染時に死細胞から放出される細胞外ATPやADPを切断してアデノシンを生成するエクト酵素であり、T細胞やNK細胞に強い免疫抑制作用を持つ。
COVID-19はリンパ球減少症と機能不全のNK細胞表現型と関連している。
肺炎およびARDS群のCOVID-19患者の血液中にCD39を発現するNK細胞集団が存在することが観察されたが、HC群および無症候群には存在しなかった。さらに、低酸素によってアップレギュレーションされることが知られているCD39の細胞表面密度は、HCからのCD39発現NK細胞の数の少なさに示されているように、このサブセットでは正常な状態で観察されるよりもはるかに高かった(図1c)。
IL-6は腫瘍浸潤NK細胞にCD39の発現を誘導し、癌との関連でNK細胞の機能低下に関与している可能性がある。7 したがって、COVID-19患者のNK細胞におけるCD39の発現は、疾患の重症度に応じて上昇する循環IL-6のレベルによって説明できるかもしれない。
同様に、PD-1受容体はCOVID-19患者のNKリンパ球上でアップレギュレートされており、いくつかの肺炎およびARDS COVID-19患者ではPD-1を発現しているNK細胞のサブセットが特に多かった。NK細胞上でのPD-1の発現は、いくつかのヒト癌で報告されているが、重症のCOVID-19患者の末梢血で観察されたようなPD-1+NK細胞の高頻度はまれである。
我々は、NKG2A発現NK細胞サブセットが、ARDS患者ではNKG2Aの細胞表面密度がアップレギュレーションされているにもかかわらず、より小さいことを発見した(図1c)。
対照的に、CMV感染の制御に関与するHLA-Eの活性化受容体であるNKG2Cの発現は、COVID-19患者では変化しなかった(図1c)。
また、HLA-Cの阻害・活性化受容体のうち、KIR2DL1/S1の発現はARDS患者のNK細胞でも強く、KIR2DL2/L3/S2の発現は変化していなかった(図1c)。このように、COVID-19患者の循環NK細胞は、疾患の重症度に関連する抑制性受容体NKG2Aのアップレギュレーションを示しており、最近の結果と一致している。
さらに、CD39、PD-1およびNKG2Aの高レベルの発現もまた、ARDS COVID-19患者のBALFから単離されたNK細胞において観察され、これらのレベルは、試験された患者の血球において観察されたレベルよりもさらに高かった(図1e、f)。これらの結果は、一緒に、これらの結果は、COVID-19患者の血液およびBALF中のNK細胞が、少なくともある程度までは、癌において記載されたものに類似した機能不全の徴候を示すことを示している。
CD39、PD-1、またはNKG2Aの遮断は、がんにおけるNK細胞免疫を利用することが示されており、COVID-19では、NK細胞が媒介するウイルスクリアランスを強化するために関心があるであろう。
そこで我々は、COVID-19患者から分離されたNK細胞が機能的に残っているかどうかを分析し、再活性化することができるかどうかを調べた。その結果、ARDSのCOVID-19患者の血液から分離されたNK細胞は細胞毒性機能を保持しており、HLA-Eとの相互作用を阻害する抗NKG2A mAbであるモナリズマブ5をインキュベートすることで、NK細胞の殺傷能力を発揮できることがわかった(図1g)。
これらのデータは、治療的介入がNK細胞の機能を改善し、ウイルスの排除を促進する可能性を示唆しており、COVID-19の阻害分子を標的としたmAb治療薬の再利用を支持するものである。COVID-19では免疫系がウイルス排除に重要な役割を果たしているが、感染肺におけるミエロイド細胞の浸潤と活性化もARDSの発症に重要であることが明らかになりつつある9。
10 しかし、COVID-19患者の血液と肺でNK細胞数の減少と機能不全状態を示した我々のデータは、ARDSで観察される過剰な炎症反応にNK細胞が関与していないことを示唆している。したがって、PD-(L)1、NKG2AおよびCD39を標的とした治療法は、SARS-CoV-2感染の初期段階の患者におけるNK細胞の抗ウイルス免疫を高める手段として研究されるべきである。
NKG2A
抑制性受容体であるNKG2Aは慢性ウイルス感染症でNK細胞の消耗を誘発することが示されている。
SARS-CoV-2感染は、細胞傷害性リンパ球でのNKG2Aの発現と関連。SARS-CoVの-2感染の初期段階でNKG2Aをターゲットにすると、細胞傷害性リンパ球の機能的な消耗を防ぐことができ、その結果、SRAS-CoV-2感染の初期段階でのウイルス除去に貢献することができる。
www.nature.com/articles/s41423-020-0402-2
5人のCOVID-19患者では治療前と比べて回復期にNK細胞のNKG2A割合が減少した。NKG2AのダウンレギュレーションがCOVID-19患者の疾患制御と相関している可能性がある。
www.nature.com/articles/s41423-020-0402-2?proof=trueIn%25EF%25BB%25BF
ナチュラルキラー細胞は、インターフェロンγを分泌することによりウイルス感染から保護する。いくつかの抑制性受容体はこれらの応答と期間を制御する。
NKG2Aはウイルス感染時のT細胞活性化のレベルを制御し、過剰な活性化と細胞死を防止することがマウスで示されている。
pubmed.ncbi.nlm.nih.gov/26680205/
NKG2AはVav1、p55 PI3K、ERK2のリン酸化、IFN- γ分泌を大幅に減少させた。
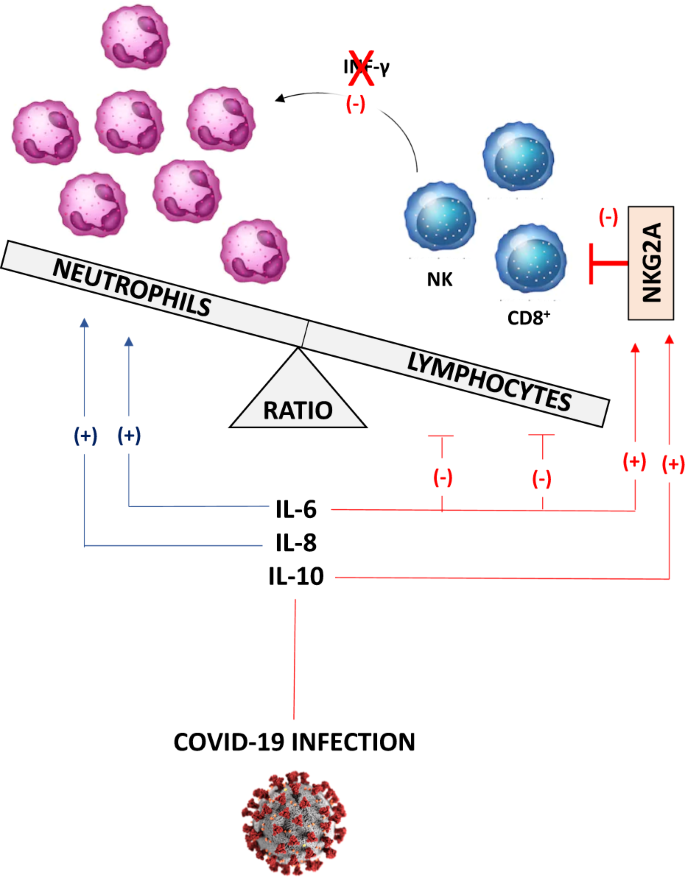
COVID-19感染患者の高い好中球へのリンパ球比(NLR)に役割を果たすNKG2A仮説の概略図
www.nature.com/articles/s41423-020-0450-7
COVID-19を含むウイルス感染症患者における免疫チェックポイント阻害薬の使用について
jitc.bmj.com/content/8/2/e001145.long
On the use of immune checkpoint inhibitors in patients with viral infections including COVID-19
序論
がん細胞は、腫瘍細胞に対する免疫応答を抑制する役割を果たす免疫チェックポイント経路の活性化など、様々なメカニズムを通じて免疫監視から逃れることができる。免疫チェックポイント阻害薬(免疫チェックポイント阻害薬(ICI))は、抑制性のシグナル伝達経路を遮断することで抗腫瘍免疫応答を増強し、免疫介在性の腫瘍細胞の殺傷を促進する。
2011年に導入された免疫チェックポイント阻害薬(ICI)は、多くの固形がんや血液悪性腫瘍(例:メラノーマ、メルケル細胞がん、扁平上皮がん、大腸がん、腎細胞がん、尿路上皮がん、ホジキンリンパ腫)の治療において画期的なマイルストーンとなった。
1-3 現在、細胞障害性Tリンパ球抗原-4(CTLA-4;イピリムマブ)、プログラムされた細胞死タンパク質-1(PD-1;ペンブロリズマブ、ニボルマブ、セミプリマブ)、プログラムされた細胞死タンパク質リガンド-1(PD-L1;デュルバルマブ、アテゾリズマブ、アベルマブ)の3種類の阻害性チェックポイントタンパク質を標的とした抗体が、様々なタイプの悪性腫瘍の第一選択薬、第二選択薬、第三選択薬として承認されている1-4。
Tリンパ球の完全な活性化は、主にいくつかの異なるシグナルに依存している。実際、Tリンパ球の活性化は、免疫チェックポイントとして知られているコスティミュレーターとコインヒビターの両方によって制御されている5 。
コスティミュレーター受容体(CD28)の活性化に伴う抗原-主要組織適合性複合体(MHC)とT細胞受容体(TCR)の結合は、Tリンパ球の増殖、分化、特定の抗原への移動を可能にする。
対照的に、抗原-MHCおよびTCR結合が共刺激性受容体(すなわち、CTLA-4)のシグナル伝達に関連している場合、T細胞の活性化は抑制される。CTLA-4は、ナイーブTリンパ球では発現しないが、T細胞活性化では速やかに誘導される。
重要なことに、CTLA-4はリンパ系臓器の初期プライミング段階でのT細胞活性化の振幅を支配的に制御している1 3 5 。CTLA-4のB7タンパク質への結合は、CD28のシグナルと直接競合しており、CD28とCTLA-4の結合の比率は、Tリンパ球の活性化対アレルギーを決定し、過剰な免疫応答を防ぐための重要なメカニズムを表している。
したがって、CTLA-4の主な仕事は、自己反応性Tリンパ球の活性化の初期段階で、主にリンパ系組織で自己反応性Tリンパ球を停止させ、自己免疫を予防することである5 。
Tregsと同様に、PD-1は末梢組織における免疫応答を制限する上で重要な役割を果たしている。PD-1とそのリガンド(PD-L1/2)との相互作用は、TCRによって媒介されるT細胞の増殖とサイトカインの分泌を抑制する。
PD-L1は、腫瘍細胞や骨髄細胞、リンパ球細胞、上皮細胞などの宿主細胞を含むいくつかの細胞で発現している。PD-1とPD-L1の相互作用は、CD8+細胞傷害性T細胞の増殖と生存を阻害し、腫瘍浸潤性リンパ球のアポトーシスを誘導し、CD4+ Tリンパ球のTregへの分化を促進する1 5 6。
このプロセスは、正常な抗がん免疫応答を制限し、免疫逃避を助けることができる。したがって、免疫チェックポイント阻害薬(ICI)は腫瘍細胞を直接殺す結果にはならないが、免疫応答および内因性の抗腫瘍活性を増強または回復させる。
Tリンパ球の枯渇は、がんや感染症の原因となるT細胞の活性を弱める最も重要な因子である。T細胞の枯渇は、HIVやB型肝炎ウイルス(HBV)感染など、多くの慢性ウイルス感染症の特徴である。7 8 その後、同様の表現型を持つTリンパ球が腫瘍微小環境でも検出された2。
疲弊したTリンパ球は、インターロイキン2(IL-2)産生の喪失、増殖障害、細胞毒性の低下、および炎症性サイトカインの産生の変化によって機能的に特徴づけられる2 7-9 さらに、PD-1およびCTLA-4を含む免疫チェックポイント受容体の過剰発現が特徴である。
がんに対する免疫反応と慢性感染症との間に類似性があることを考えると、感染症を有する腫瘍患者にとって免疫チェックポイント阻害薬(ICI)の使用は有害ではないか、あるいは有益であるかもしれないという仮説を立てることができる。
免疫チェックポイント阻害薬(ICI)治療中の後天性感染症に関しては、臨床研究ではリスクの増加は観察されていない。これらは免疫関連有害事象(免疫関連有害事象(irAE))と呼ばれ、自己免疫性大腸炎、肺炎、体液減少症、肝炎、甲状腺炎などが含まれる10-12。
免疫関連有害事象(irAE)は高用量のコルチコステロイドや腫瘍壊死因子(TNF)α遮断薬などの免疫抑制療法を必要とすることがあるため、慢性または潜伏性のウイルス感染(例:HBVやC型肝炎ウイルス(HCV))への感染や再活性化のリスクが二次的に高まる可能性がある10-12。
-12 この点で、持続性ウイルス性疾患の罹患率の多くは、ウイルスクリアランスの不能に伴う慢性反応性炎症による巻き添え被害によって引き起こされていることにも留意すべきである。本レビューでは、COVID-19を含むウイルス感染症患者における免疫チェックポイント阻害薬(ICI)使用の是非についての情報を提示する。
COVID-19
重症および致死的疾患の臨床検査での予測因子には、乳酸脱水素酵素、プロカルシトニン、D-ダイマーの上昇、サイトカインIL-6、IL-10、腫瘍壊死因子-α(TNF-α)の血清レベルの上昇、リンパ球数の減少、特にCD8+ TおよびNK細胞の減少が主に含まれる。
実際、Biaoら71は最近、COVID-19患者において末梢血中の総Tリンパ球数が有意に減少したことを示した。
これは特に高齢の患者および集中治療室(ICU)での治療を必要とする患者で顕著であった。重要なことに、リンパ球減少は患者の生存率と否定的に関連していた。
Biaoら69-71は、回復した患者のT細胞数が増加した一方で、IL-6、IL-10およびTNF-αレベルが減少したことも示している。71 さらに、末梢血のフローサイトメトリーで評価したところ、重症患者のT細胞は健常対照者よりもはるかに高いPD-1の発現を特徴としている。
PD-1およびTim-3を含むT細胞枯渇の重要な抑制性チェックポイント蛋白質の発現、およびTNF-α、IL-10およびその他のサイトカインの増加(これらは実際にはすべてPD-1およびTim-3の発現を調節する可能性がある)は、プログラムされた細胞死を介してCOVID-19患者のT細胞リンパ減少を媒介している可能性が高い73。
74-77 免疫チェックポイント阻害薬(ICI)治療によるCD8+リンパ球上のPD-1+の遮断は、COVID-19患者において、機能的なT細胞の枯渇を防ぎ、腫瘍とウイルス抗原の両方に対して活発なTリンパ球の細胞毒性を回復させるためには、妥当であるかもしれない。
しかし、Chiappelliら(75)が議論しているように、これは細胞障害性T細胞におけるPD-1の発現が低レベルから中レベルの範囲にある初期および中間段階でのみ機能する可能性がある。より進行した段階では、CD8+ Tリンパ球でPD-1の発現が高い場合、Tリンパ球の枯渇は不可逆的である可能性が高いため、免疫チェックポイント阻害薬(ICI)はもはや効果を発揮しないであろう。
サイトカインの過剰は、サイトカイン放出症候群(CRS、「サイトカインストーム」)、すなわち、サイトカイン(例えば、IL-6、IL-10、TNF-α)が感染因子に反応して急速に大量に産生される大規模炎症反応の現象に関しても大きな意味を持つ71。
SARS-COVや中東呼吸器症候群(MERS-COV)と同様に、SARS-COV-2は血清中の炎症性サイトカインの増加と関連しており、これは肺の炎症と広範な肺障害を引き起こすと考えられている72 。
SARS-COV-2は主に気道の上皮細胞を標的とし、重度の肺胞損傷をもたらす。さらに、SARS-COV-2は、SARS-COVやMERS-COVと同様に、誘導された免疫反応がウイルス(例えば、スパイク表面タンパク質)と宿主タンパク質エピトープの両方に交差反応するため、自己免疫のリスクをもたらす可能性がある。
Lyons-Weiler58 は最近、ヒトタンパク質との相同性に基づいて、自己免疫を含むこのような病原性プライミングが SARS-COV-2 でも起こるのではないかという仮説を立てた。以前のSARS-COV動物実験の結果と同様に、Agrawallら78は、MERS-COVワクチンを接種したマウスが、ワクチン接種後のMERS-COVチャレンジ後に、肺にTh-2主導の重篤な免疫病理を発症したことを報告している58。
79 80 さらに、抗PD-1をベースとした免疫チェックポイント阻害薬(ICI)で観察される免疫関連有害事象(irAE)の一つに自己免疫性肺炎があり、これは治療を受けた全患者の最大5%に発生する可能性がある。81 免疫関連有害事象(irAE)誘発性肺炎の臨床症状やX線所見はCOVID-19肺炎と類似しているため、適切な管理の基礎となる適切な診断結論を得ることが困難な場合もある。
免疫関連有害事象(irAE)の発生には、全身性コルチコステロイドや、マイコフェノレート酸やTNF-αブロッカーなどの他の免疫抑制・免疫調節薬の使用が必要となることが多い。
全身性コルチコステロイドの使用がCOVID-19の設定で有害であるかどうかは不明である。SARS-COV関連およびMERS-COV関連肺炎患者におけるグルココルチコイドの使用は、既存の文献で報告されている臨床結果が異なるため、いまだに論争の的となっている82 。
それにもかかわらず、低用量のメチルプレドニゾロンの早期かつ短時間の使用は、SARS-COV-2関連肺炎および呼吸窮迫症候群において、1つの実現可能なアプローチであると思われる83。
COVID-19の進行期におけるサイトカイン過剰(例:TNF-α)の観察から、インフリキシマブのようなTNF-α遮断薬は、免疫チェックポイント阻害薬(ICI)誘発性免疫関連有害事象(irAE)の管理だけでなく、COVID-19の管理にも有益である可能性があると推測される84 。トシリズマブは、キメラ抗原受容体T細胞治療後に発生するCRSの治療薬として米国で既に承認されている。
さらに、切除不能なIII期またはIV期のメラノーマ患者における免疫関連有害事象(irAE)を減少させるために、トシリズマブと抗PD-1/CTLA-4療法との併用を検討している第II相試験が現在進行中です(NCT03999749)。
CD200免疫チェックポイントは、抗炎症性サイトカインであるIL-2やIFN-үの分泌を抑制し、抗がん剤や抗ウイルス免疫応答の低下に関与する骨髄由来の抑制細胞やTregsの産生を亢進させる。
85 マウスのコロナウイルスモデルでは、チェックポイント阻害性のCD200-CD200R1システムは、ミエロイド由来細胞の一本鎖RNAウイルスセンサーのトール様受容体7をダウンレギュレートすることが示されており、それぞれの介入はIFN-үレベルを回復させ、その結果、ウイルスの排除を強化した。
新規感染症COVID-19の患者における免疫チェックポイント阻害薬(ICI)の使用については、経験とエビデンスが増えてきている。化学療法と比較して、免疫チェックポイント阻害薬(ICI)は免疫抑制作用があるとは考えられない。
免疫チェックポイント阻害薬(ICI)による血液学的異常反応は非常にまれであり、報告されている症例はわずかである。88 以前に報告された免疫チェックポイント阻害薬(ICI)治療下でのウイルス感染症(サイトメガロウイルス、B型肝炎)の再活性化は、ほとんどが免疫関連有害事象(irAE)の免疫抑制療法後に観察されている。
したがって、免疫チェックポイント阻害薬(ICI)治療を受けている患者は、免疫チェックポイント阻害薬(ICI)治療を受けていない患者と比較して、SARS-COV-2や他の感染体に感染するリスクが高いと考えるのは妥当ではないように思われる76。
予備的な基礎研究データとCOVID-19患者における臨床観察に基づいて、SARS-CoV-2に感染しているがん患者、さらにはCOVID-19でさえも免疫チェックポイント阻害薬(ICI)を安全に使用できると考えることができる。
しかし、明確な証拠がない限り、それは上記で議論された多くの要因、特に癌および/またはCOVID-19がどの程度進行しているかという点に関して、ケースバイケースのシナリオであることに変わりはない76 79 89-91 Quaglinoら91は最近、2020年3月の初めに免疫チェックポイント阻害薬(ICI)を受けた80人のメラノーマ患者における経験を報告した。
Quaglinoら91は、彼らの観察は、メラノーマ患者(n=80)において免疫チェックポイント阻害薬(ICI)を継続する可能性を支持するものであると結論づけている。その結果、Luoら92は、PD-1遮断薬への曝露は肺がん患者におけるCOVID-19の重症化リスクの増加とは関連していないことを観察している89。
このプロスペクティブ対照無作為化多施設共同試験の目的は、COVID-19を有する進行性または転移性のがんで、蘇生治療を受ける資格のない患者において、クロロキン類似物質、ニボルマブ、トシリズマブの併用投与と標準治療との有効性を比較することである(ClinicalTrials.gov: NCT04333914)。
患者は2つの異なるコホートに無作為に割り付けられる。
(1)無症状または軽度の症状:クロロキンアナログ対ニボルマブ対標準治療(1:1:1)、(2)中等度/重度の症状:クロロキンアナログ対トシリズマブ対標準治療(1:1:1)の2種類のコホートに無作為に割り付けられる。
しかし、ヒドロキシクロロキンの使用は効果がないか、あるいは死亡率の上昇との関連性さえ報告されていることを強調しなければならない。
さらに、がんを伴わないCOVID-19患者における免疫チェックポイント阻害薬(ICI)を検討する2つのプロトコールがClinicalTrials.govに登録されている。
第II相無作為化試験では、CORIMUNO19-NIVOプロトコールでは、ICUに入院しているCOVID-19患者におけるニボルマブ単独投与と標準治療との比較で、ニボルマブの有効性と安全性を評価する(NCT04343144)。
結論
このレビューに示されたデータに基づき、また、Study Group for Infections in Compromised Hostsの勧告に沿って、PD-1/PD-L1および/またはCTLA-4をベースとした免疫チェックポイント阻害薬(ICI)治療は、独立して感染リスクを高めたり、よりウイルス性の疾患経過を引き起こしたりするようには見えないと仮定している27。
しかし、免疫チェックポイント阻害薬(ICI)治療の期間中は、免疫チェックポイント阻害薬(ICI)に関連した免疫関連有害事象(irAE)を治療するために免疫抑制療法が必要となることがあり、その結果、新たなウイルス感染症や持続するウイルス感染症の再活性化のリスクが高まる可能性がある。
したがって、免疫チェックポイント阻害薬(ICI)誘発性免疫関連有害事象(irAE)の治療のために免疫抑制剤を投与されている患者を治療する医師は、新規感染や既往のウイルス感染の悪化を示唆する症状や徴候の発生を注意深く監視する必要がある。
したがって、免疫チェックポイント阻害薬(ICI)は、このような患者に効果的な抗腫瘍治療レジメンであるだけでなく、ウイルス感染症そのものの管理においてもアプローチの可能性があることを示唆する証拠が増えている。
NK細胞の増加と活性
NK細胞を増強させるビタミン・天然化合物
- ビタミンA NKG2Dリガンド
- ビタミンC
- ビタミンD NKp30、NKp44、NKG2Sの活性、抑制性であるCD158のダウンレギュレーション
- ビタミンE
- ゲニステイン
- クルクミン
- 朝鮮人参
- にんにくエキス[R]
- レスベラトロール NKG2D受容体の発現をアップレギュレート
- アシュワガンダ
- インゲノールメブテート
- キンカン果皮エキス
- プロストラチン
- レクチン
- 多糖類
www.hindawi.com/journals/jir/2018/4868417/
亜鉛・セレン
academic.oup.com/ajcn/article/71/2/590/4729286
メラトニン
immunityageing.biomedcentral.com/articles/10.1186/1742-4933-2-17
アスタキサンチン
腫瘍マウスモデルでナチュラルキラー細胞亜集団と血漿インターフェロン-γ濃度の上昇
pubmed.ncbi.nlm.nih.gov/20651366/
アストラガルス
アストラガルスは、Tヘルパー細胞2型サイトカインの数を増加させ、腫瘍壊死因子とインターロイキン6のレベルを増加させることにより、細胞性免疫を強化。マクロファージおよびナチュラルキラー細胞活性を刺激することが示されている。
www.sigmaaldrich.com/life-science/nutrition-research/learning-center/plant-profiler/astragalus.html
スピルリナ(フィコシアノビリン)
げっ歯類ヒトでの換算で大さじ2杯/日
pubmed.ncbi.nlm.nih.gov/18158824/
エキナセア
pubmed.ncbi.nlm.nih.gov/11439845/
マッサージ
ランダム化比較試験 29人のゲイの男性(20人のHIV +、9人のHIV-)1か月間、毎日マッサージを受けたところ、ナチュラルキラー細胞数、ナチュラルキラー細胞の細胞毒性、可溶性CD8、およびCD8細胞の細胞毒性サブセットの大幅な増加が示された。
pubmed.ncbi.nlm.nih.gov/8707483/
運動
乳房切除を受けた40人の女性患者 比較試験
運動プログラムを実行したグループでは、3ヶ月後に運動しないグループよりも有意な循環ナチュラルキラー細胞傷害活性(NKGA)の増加を示した。
www.sciencedirect.com/science/article/pii/S2314853513000334
メンタルヘルス
被験者をライフスタイルとメンタルヘルス状態の4つのグループに分けたところ、ライフスタイルが不良または中程度で精神状態が不安定であると報告された被験者はNK細胞活性が最も低く、ライフスタイルが良好で精神状態が安定していると報告された被験者はNK細胞活性が最も高かった。
www.sciencedirect.com/science/article/pii/S0048969700007828
ミリセチン
ミリセチンは、ベリー、くるみ、赤ワインなどに含まれる天然フラボノール。 in vitro研究では、ミリセチンが用量依存的にナチュラルキラー細胞の活性を増強することが示された。ケルセチンでは活性効果は示されなかった。
NKG2Aの阻害
適度な運動
成人13名のNKG2Aを発現する血清ナチュラルキラー細胞の割合は、サイクル運動1時間後の安静時に減少した。
モナリズマブ
jitc.biomedcentral.com/articles/10.1186/s40425-019-0761-3
老化
NKG2A発現はDNAメチル化によって調節されている。
ビタミンB12は、DNAメチル化レベルを維持するために重要な役割を果たす。ビタミンB12レベルが低い高齢の被験者の1人では NK細胞のCD94 /NKG2Aとキラー細胞免疫グロブリン様受容体(KIR)バランスは、他の高齢被験者と同様であったが、CD94とNKG2AはCD56 + T細胞での発現は比較的低かった。
MHCクラスI分子とCD94 / NKG2またはKIR受容体の間の相互作用は、自己免疫疾患、移植、感染症、および癌の結果に強力な影響を及ぼす。高齢者におけるNK受容体発現のバランスの変化が、感染性、炎症性、および腫瘍性疾患に対する感受性に影響を与える可能性がある。
www.ncbi.nlm.nih.gov/pmc/articles/PMC3394430/
健忘性MCI
NK細胞は健忘性軽度認知障害ではNKG2Aが活性化されているが軽度アルツハイマー病患者では活性化されない。
pubmed.ncbi.nlm.nih.gov/25720398/
パーキンソン病
NKG2A受容体の発現は、パーキンソン病患者では有意に低く、NK細胞の受容体を介して標的細胞に結合すると、NK細胞が活性化の状態になりやすくなる。
pubmed.ncbi.nlm.nih.gov/17702627/
NKG2Aの活性・影響なし
セレン酸
亜セレン酸媒介の腫瘍抗原HLA-Eの損失が原因である可能性がある。この分子はNK細胞のCD94 / NKG2A受容体に結合し、それによって殺腫瘍活性を抑制できる。
pubmed.ncbi.nlm.nih.gov/21890659/
ビタミンE
openarchive.ki.se/xmlui/handle/10616/39501
アストラガロシド
アストラガロシドIIIの効果的な抗腫瘍機能は、NK細胞の免疫応答のアップレギュレーションと、NKG2D、Fas、およびIFN-γ産生の上昇を通じて達成された。しかしNKG2Aには影響を与えなかった。
europepmc.org/article/PMC/670128

