Contents
関連記事

COVID-19の制御における抗菌薬光線力学療法
www.mdpi.com/2079-6382/9/6/320/htm
要旨
フェノチアジン類、例えばメチレンブルー(MB)やポルフィリン類、例えばプロトポルフィリン-IX(PP-IX)のような、よく知られた安全で費用対効果の高い光増感剤を用いた抗菌性光力学療法(光殺菌療法(aPDT))は、COVID-19を軽減し、感染を予防したり、人工光や自然光の下で、表面、空気、廃水を消毒するための光活性ファブリック(例えばマスク、スーツ、手袋)を開発するのに役立つかもしれない。
本文
世界が直面しているコロナウイルス感染症2019(COVID-19)のパンデミックは,有効な治療法のない,感染力の強い呼吸器疾患である。重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)の拡散は、人から人への感染だけでなく、空気中の飛沫、感染した物体、表面からも起こる[1,2,3,4,5]。そのため,COVID-19患者の治療にはクロロキンやその類縁体(ヒドロキシクロロキンなど)[6,7,8,9,10]やレムデシビル[11,12,13]などの古い治療法が用いられ,SARS-CoV-2ウイルスを不活化したり空気を殺菌したりするために表面に古い消毒剤(アルコール系溶液や次亜塩素酸塩溶液など)が塗布されてきた。世界保健機関(WHO)欧州疾病予防管理センター(ECDC)米国疾病予防管理センター(CDC)などの当局や団体は、声をそろえて、SARS-CoV-2の伝播を緩和するために、手指衛生、呼吸エチケット、環境の洗浄・消毒が最も重要であること、また、社会的隔離を維持し、人と人との身体的距離を広げることの重要性を強調している。しかし、COVID-19による致死性を考慮すると、この種の感染症に対する最も有効な対策とされるワクチンや有効な新規抗ウイルス剤が存在しない中で、他のアプローチを検討する必要がある。さらに、SARS-CoV-2がRNAウイルスであり、変異の可能性が高いことを考えると、これらの対策の重要性は増す。つまり、近い将来にワクチンが開発されたとしても、中長期的には効果が期待できない可能性があるということである。
SARS-CoV-2に対しては、光線力学的療法(PDT)を用いた治療法が検討されるべきである。PDTには光増感剤(PS)が必要である。光増感剤とは、可視光で励起された後、酸素(3O2,大気中の酸素)と反応して、一重項酸素(1O2)やスーパーオキシドアニオン、ヒドロキシルラジカル、過酸化水素などの活性酸素種(ROS)を生成する分子である。これらの活性酸素は、生体分子(タンパク質、脂質、核酸など)と反応してその酸化を引き起こし、その結果、細胞や組織にダメージを与える。PDTはすでに承認されており、がん治療(基底細胞がん(BCC)食道がん、肺がんなど)だけでなく、加齢黄斑変性症(AMD)などの非がん性疾患にも日常的に使用されている。さらに、ここ数年、このアプローチは、COVID-19の原因物質が属するグループである、グラム陽性およびグラム陰性の細菌、真菌、寄生虫、ウイルスなど、あらゆる種類の微生物に対して非常に有効であることが示されている[14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32]。
この広域スペクトル活性は、COVID-19のような新興感染症の治療に役立つことは明らかである[21,33]。
微生物を不活性化する光線力学的治療(抗菌光線力学的治療、(aPDT)と呼ばれる)の主な利点は、微生物の特異性がなく、耐性メカニズムの発達がないことである。これらの特徴は、aPDTの作用様式および影響を受ける生化学的標的の種類に起因する[34,35,36,37,38,39,40,41]。微生物の中には、スーパーオキシドディスムターゼ、カタラーゼ、ペルオキシダーゼなどの抗酸化酵素を産生し、いくつかのROSに対する防御を与えるものもあるが、PSが産生する主なROSである一重項酸素(1O2)[42]についてはそうではない[14]。さらに、一重項酸素は、これらの抗酸化酵素を分解する能力があることさえ証明されている[43]。
光力学的作用の主な標的は、細胞壁、細胞膜、あるいはウイルスのカプシドやエンベロープなど、微生物の外部構造である[14]。aPDTの主な標的は外部構造物であるため、PSは微生物内に侵入する必要はなく、外部構造物にPSが特異的かつ適切に付着していれば、光で活性化されたときにその破壊には十分である。このようにして、対象となる微生物は、薬剤の取り込みを止めたり、代謝による解毒や排出を促進したりすることで、耐性を獲得する機会を得ることができない。
aPDTのマルチターゲット性は、耐性発現のリスクを最小限に抑えることにも重要な役割を果たしており、従来の抗菌剤と比較して優位性がある。aPDTでは、生存を確保するために必要な分子変化の数が非常に多く、微生物が耐性を獲得するためには様々な場所で変異を起こすことが必要となる。これらは、一般的な抗菌剤である抗ウイルス剤や抗生物質のように、1カ所に変異がある場合に比べて起こりにくい事象である。光不活性化プロセスで形成された活性酸素は、タンパク質、脂質、核酸など、さまざまな重要な分子標的に作用する[34,44]。活性酸素によって引き起こされる酸化ストレスは,外部構造のタンパク質や脂質に不可逆的な損傷を与える[36,38,45]。しかし、核酸が活性酸素の影響を受けるのは、微生物がすでに不活化されているか、あるいは生存していない場合のみである[37,46,47,48]。したがって、微生物がこの種の処理に対して耐性メカニズムを発達させる可能性は非常に低いか、あるいは存在しない。
aPDTは広範囲の微生物に対して有効であることに加えて、薬剤耐性のある微生物に対しても有効である。実際、aPDTによる抗菌剤耐性微生物の不活性化に関するすべての研究では、それらの微生物は本来の微生物と同等の感受性を持つことがわかっている[49,50,51,52,53,54,55,56]。さらに、DPDTは、慢性感染症の原因となる多くの微生物種のデフォルトの生活様式である、微生物バイオフィルムの複雑なマトリックスを分解するのにも有効であることが証明されている[18]。実際,aPDTは,デンタルバイオフィルム,人工呼吸器関連肺炎,慢性創傷感染症,口腔カンジダ症,慢性鼻副鼻腔炎など,臨床的に重要なバイオフィルムの対策として最近提案された[57]。aPDTはタンパク質や脂質に不可逆的な損傷を与えるため、プロテアーゼ、α-ヘモリシン、スフィンゴミエリナーゼ、リポポリサッカライドなどの病原性因子の発現にも影響を与える[58,59,60,61]。ウイルス性因子は,感染過程で微生物から分泌される可能性があるだけでなく,宿主に深刻なダメージを与える毒素のように,感染していない状態でも分泌されることがあるため,その破壊は極めて重要である。
宿主によるPSの取り込みと比較して、微生物の標的となる外部構造にPSが速やかに取り込まれること(数分対数時間)および局所的に標的となる照明を適用することにより、抗ウイルス剤や抗生物質などの従来の抗菌剤と比較して、このアプローチの選択的な治療上の利点が得られる[14,44]。
さまざまなクラスのPS,すなわち,天然および合成のテトラピロリック大環状化合物(プロトポルフィリン-IX,クロロフィル,バクテリオクロロフィル,メソ-テトラアリールポルフィリン,コロール,フタロシアニンなど),フラーレン,フェノチアジニウム染料のような複素環状化合物(トルイジンブルーO,メトキシルブルーOなど)の光線力学的効果は,以下のようになっている。トルイジンブルーO,メチレンブルー,ニューメチレンブルーなど)やプソラレンが評価され,抗菌剤としての役割が確認されている[62]。実際,フェノチアジン系色素であるメチレンブルー(MB),フォトフーリン®,精製ヘマトポルフィリン混合物であるプロトポルフィリン-IX(PP-IX),その前駆体である5-アミノレブリン酸(ALA)などのPSは,すでにがん治療への使用が認められている分子であり,安全性についてもよく知られている。さらに、ALA [46]とヘマトポルフィリン(PP-IXの誘導体) [63,64]は、apDTの文脈でも承認されており、結果として、これらの分子はコロナウイルスを不活化するための有望なPSとなるはずである。
実際、COVID-19の治療に現在使用されているクロロキン[65,66,67,68]は、メチレンブルーと構造的に関連している。最近の研究の予備データでは、メチレンブルーがCOVID-19などのインフルエンザ様疾患の治療に有効である可能性が示唆されている[69]。この研究では、がん(乳がん(40%)肺がん(20%)前立腺がん(10%)子宮がん(10%)大腸がん(8%)肝臓がん(6%)雑多ながん(6%))に対して、標準療法とα-リポ酸、ヒドロキシクエン酸、メチレンブルー(75mgを1日3回)を組み合わせて治療したフランス人患者2500人のコホートを報告している。試験実施日(2020年3月27日)時点で、これらの患者にCOVID-19やインフルエンザ様症候群の登録例はなかった。腫瘍患者の治療にメチレンブルーを使用したことで、インフルエンザウイルスによる感染を防ぐことができたと考えられる。著者ら[69]が述べているように、メチレンブルーは、クロロキンなどの毒性の低い現代の抗マラリア薬の祖先と考えられている以外にも、他の潜在的な治療的用途があるかもしれない。例えば、精神医学や臨床心理学における心理療法的介入を促進するための神経保護剤として使用することができる。さらに,低レベルの近赤外光は,虚血性脳卒中後のヒトの神経学的転帰を改善し,持続的注意やワーキングメモリなどの感情や神経認知機能も改善すると考えられている[69]。また,メチレンブルーを可視光で効果的に活性化すると,ウイルス,細菌,真菌を不活性化することを示すいくつかの研究がある[70,71,72,73,74,75]。
SARS-CoV-2は主に下気道系,すなわち肺に感染するため,光ファイバを用いて内視鏡的にこれらの内臓を照射することは比較的容易である。これは鼻から導入することができるので、aPDTが肺のウイルスの不活性化を媒介できることを示唆している。実際、PDTは何年も前から肺がんの治療に承認されており、優れた結果を出している[76,77,78,79]。抗菌性光線力学療法に基づいたナノマテリアル(固定化PS)は、ウイルス、細菌、真菌感染を抑制する新しい方法として研究されており[62]、複雑な解剖学的構造を持つ領域へのアクセスを可能にしている。すなわち、ナノマテリアルがモノクローナル抗体と結合していれば、肺組織を特異的に標的とし、隣接する組織へのダメージを少なくすることができる[78]。さらに、コロナウイルス群(CoV)は、一般的に人間の上気道および下気道の障害に関連する非常に一般的なウイルスである。したがって、aPDTは、PSを添加した後に鼻孔を照射すれば、SARS-CoV-2や他のコロナウイルス株、さらには他の呼吸器系ウイルスの上気道系からの侵入を防ぐことができる。実際、鼻孔内の細菌をapDTで不活化する応用例がすでにある[80]。
布地や表面を含む物体の消毒に関しては、人工的な白色光の他に、自然の太陽光をコロナウイルスを不活化するための光源として使用することができる。光源としての太陽光の使用は、低コストで世界中で利用可能な可視光線の使用に基づいているため、安価なapdtの手順であることがわかる。さらに、MBやPP-IXをベースにした誘導体のような光増感剤は、微生物を不活性化することはできても、太陽光にさらされることで分解されるため、環境中に蓄積されることはない[14,62,81]。
最近では、さまざまな国の廃水でSARS-CoV-2の存在が検出されている[82,83,84,85]。この結果は、地域社会におけるCOVID-19の拡散をモニタリング・緩和するために、廃水中のSARS-CoV-2ウイルスを調査する上で、さまざまな機会をもたらした。例えば、排水中のSARS-CoV-2の検出は、この病気の新たな発生の警告となることが期待されており、その結果、いくつかの国ではすでにこの問題を調査している。これらの研究では、SARS-CoV-2が排水中に確認されることが示されているため、下水道はコロナウイルス環境の汚染源となり得る。実際、ウイルスを含む病原性微生物を多く含む廃水が、自然の受水の質、ひいては人間の健康に影響を与えることが懸念されている分野であることはよく知られている。
従来の排水処理は、一次処理、二次処理、三次処理と、物理的、化学的、生物的プロセスを組み合わせて行われてきた。通常、都市部からの廃水は二次処理され、三次処理されることはほとんどない。通常、廃水の二次処理は十分と考えられているが、二次排水にはまだ感染濃度の高い微生物が含まれている。さらに、SARS-CoV-2のような新興の病原体は、廃水が適切に処理されない場合に深刻なリスクをもたらし[86]、新興微生物の広範な拡散を助長した[87]。廃水中の病原体濃度を低減するために,二次処理された廃水は,通常,塩素(世界中で主に使用されている方法),オゾン(O3),または紫外線(UV)による殺菌処理[88]が施される[81]。塩素(Cl2)やオゾンは、モノクロラミンなどの有毒な生成物の形成につながる可能性があり、紫外線は微生物に変化をもたらし、耐性遺伝子の選択に寄与する可能性があり、オゾンや紫外線は機器のメンテナンスや交換コストを必要とする[89,90,91]。微生物の濃度を下げるために使用される従来の三次消毒処理は、高価であったり、水生生物に有害であったり、微生物の遺伝子損傷を誘発したりする可能性があるため、排水の汚染除去のための新しい技術の開発も急務である。
SARS-CoV-2が廃水中で長期間生存し、糞口感染を促進するかどうかはまだ明らかになっていないが、この伝達性の高いウイルスを効果的に不活性化する廃水処理プロセスを開発することは最も重要である。文献によると、他のRNAウイルスも廃水汚染によって頻繁に人に感染している[92]。aPDTは真の抗菌性を備えているため、新たな/未知の病原体に対しても有効であり、廃水中のコロナウイルスを不活化するための代替アプローチとなることが期待される。
コロナウイルスのようなエンベロープを持つウイルスの不活性化に関するAPDTの有望な結果[29,33]に加え、ナノ/マイクロ粒子、フィルム、ポリマーなどの不溶性不活性材料に容易に調製できるPSを固定化できる可能性[28,31,93,94,95,96]は、この原理がSARS-CoV-2を含む微生物を不活性化するための廃水処理に応用できることを示唆している。文献によると、すでにさまざまなPSが、二次処理された廃水のサンプル中のウイルスを含む微生物を光不活化するのに有効であることが証明されている[97,98,99]。これらの研究は,低濃度のPS(5~10μM)を用いて,人工白色光の低照度(380~700nm,4mW cm-2)または自然太陽光の条件下で行われた。さらに,異なるポルフィリンを固定化した磁性ナノ粒子が報告されており,これらの光活性物質は,白色光照射下でもウイルスに対する有効性を維持したまま,水のマトリックスから容易に回収してその後の再利用が可能であることが研究で示されている[28,34]。
さらに,セルロースやその他の類似物質のような合成繊維や天然繊維にPSを固定化することで,効果的な抗菌機能を持つ繊維製品を得ることができる。このことは、マスク、ガウン、寝具、創傷被覆材などの供給を維持するために、医療業界にとって高い関連性があると考えられる。この技術により、院内感染の発生を最小限に抑え、医師や看護師などの医療従事者を保護することが期待されている[62]。
これらの研究は、aPDTが、臨床および非臨床の状況下で、従来の抗菌剤に耐性のある病原性微生物を不活性化する優れたアプローチであることを示している。しかし、現在のパンデミックの状況下で、DPDTで得られたすべての知識をより実用的なアプリケーションに変換するためには、基礎研究者(化学者、生化学者、生物学者、材料技術者など)と技術者、臨床医、製薬会社との協力関係を強化し、国内外の機関からの資金援助を受けられるようにすることが基本的かつ緊急に必要である。このようにして、aPDTの背後にある優れた研究は、多剤耐性微生物やウイルスとの戦いに貢献し、新たなパンデミックの危機を防ぐための最前線のツールの一つとなることができる。
結論として、MBやPP-IXなどのよく知られた安全で費用対効果の高いPSを用いたapDT治療は、感染した患者の治療、機能的な光活性繊維の開発、表面の自動消毒、水や空気の消毒のいずれにおいても、COVID-19を軽減するのに役立つかもしれない(図1)。
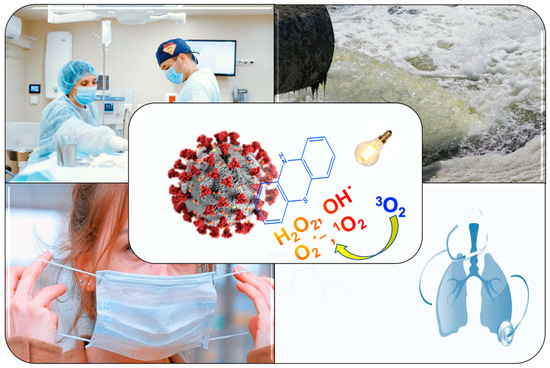
メチレンブルーとインフルエンザ
癌治療のためにメチレンブルーで治療されたフランス人患者2500人のコホートの症例を報告。COVID-19流行中、インフルエンザ様の病気は発生しなかった。この感染の抑制は偶然の可能性もあるが、メチレンブルーがCOVID-19感染に対して予防効果を持つ可能性がある。
メチレンブルー誘導体であるクロロキンの抗ウイルス活性と一致している。
メチレンブルーは、ヘルペスウイルスなど特定のウイルスに対して抗ウイルス効果があることがテストされている。メチレンブルーは、ウイルスに対して選択的な光毒性をもつ。一重項酸素をウイルスへ届けることで、フリーラジカルのように働く。
メチレンブルーは、光の増感剤として作用する。赤色光線療法とメチレンブルーの組み合わせ治療が考えられるが、これは太陽の光で代用が可能であり、病院を出て屋外で浴びるだけで良いかもしれない。メチレンブルーは、TNF-α、IL-6レベルを低下させる。NLRP3インフラマソーム、一酸化窒素シンターゼと環状GMP酵素を阻害する。メチレンブルーは、大きなブレークスルーとなる可能性が非常に高いかもしれない。
赤色波長(665nm)
メチレンブルーを介したウイルスの不活化には、酸素だけでなく光も重要であることが指摘されている。光によって励起一重項状態に活性化される、抗ウイルス作用を発揮する。
水中でのメチレンブルーの吸収スペクトルは、赤色の波長領域664〜666 nmに鋭いピークを示す。(効果的な波長は665 nm)。また、UVから近紫外線領域、特に284〜300 nm領域にも、強度の低いピークがある。しかし、赤い波長領域が、レイリー散乱の影響を受けず、より光が深く浸透する。
pubmed.ncbi.nlm.nih.gov/15168794/

www.ncbi.nlm.nih.gov/pmc/articles/PMC3921873/
輸血へのメチレンブルーと可視光によるコロナウイルスの不活化能力
pubmed.ncbi.nlm.nih.gov/31930543/
COVID-19からの急性呼吸窮迫症候群。フリーラジカルからのパーフェクト・ストーム?新しい治療法の提案
Acute respiratory distress syndrome from Covid-19: A perfect storm from free radicals? Proposal for a new treatment
www.sciencedirect.com/science/article/pii/S0306987720310082
COVID-19のパンデミックは私たちの都市の生活を一変させ、今もなお多くの死者を出し続けている。軽症であることが多いが、急性呼吸窮迫症候群(ARDS)、心血管障害、ショック、または多臓器不全を発症する症例が頻繁に発生しており、全身性の炎症反応を示している[1]。
炎症反応は単球および肺胞マクロファージの活性化によって引き起こされ、これらの単球は活性酸素種(ROS)、活性窒素種(RNS)およびサイトカインを含む生理活性メディエーターを産生し、細胞外コンパートメントに放出する。これらのメディエーターの産生が組織の中和能力を超えると、酸化ストレスが発生し、肺胞細胞死および血管内皮傷害の主な原因となる。血管内皮の損傷は、多臓器機能障害につながる可能性がある[2]。この炎症反応は敗血症性ショックを含む多くの疾患に共通している[3]。サイトカインストームに対抗する薬剤(アナキンラ、トシリズマブ)がCOVID-19関連ARDSの治療に提案されているが[4]、他の治療戦略を検討する必要がある。
動物実験からのデータは、活性酸素とRNSがARDSの病因において基本的な役割を果たしていることを示しており[5]、高レベルのRNSが敗血症性ショックの多臓器不全に関与していることを示している[6]。それにもかかわらず、これらの種の有害な影響を最小限に抑える薬剤は臨床に導入されていない。
メチレンブルーは、現在メトヘモグロビン血症の治療に使用されている古い抗マラリア薬であるが、敗血症性ショックの治療には副作用を最小限に抑えて成功裏に使用されている[7]。メチレンブルーは、強い酸化性窒素系分子の前駆体である一酸化窒素[8]の生物学的利用能を低下させることで、RNSの抗酸化剤として効果的に作用する。また、メチレンブルーはキサンチンオキシダーゼの作用を阻害することで、活性酸素の産生を抑制する[9]。
これらのデータに基づいて、メチレンブルーは、ARDSの最初の症状が現れたときにCOVID-19関連肺炎と対比してみる価値があるように思われる。投与量に関しては、敗血症性ショック患者にはメチレンブルーを1~2mg/kgの単回ボーラスまたは低用量輸液で投与しているが、メチレンブルーは肺血管抵抗性に用量依存的な影響を及ぼすため、2mg/kgを超える用量の静脈輸液は慎重に避けるべきである[10]。
継続的に注入することで、反応に基づいた滴定が可能になり、全体的に低用量で済むようになる。したがって、敗血症性ショック[11]で経験したのと同様に、1mg/kgをボーラスで投与し、2時間後に0.5mg/kg/hを4時間かけて点滴することが適切な開始点であることを提案する。治療開始が早ければ早いほど期待される結果が得られ、最初のCOVID-19の症状から低用量メチレンブルー(120~180mg/日を10~15日間経口投与)を服用することで、ARDSの発症を予防し、入院の必要性を回避できる可能性がある。
LLLT
ncbi.nlm.nih.gov/pmc/articles/PMC5995606/
老化したヒトの胸腺機能を維持し活性化するためのLLLT(PBM)照射について。
胸腺への照射は二相性の反応を示し、累積線量に応じて免疫刺激にも免疫抑制にもなる可能性がある。
0.2 mW /cm2 波長632.8 nm1分の照射時間が10日を超えない場合、マウスの免疫細胞の活性を誘発した
光線療法の概説 COVID-19
www.sciencedirect.com/science/article/pii/S1011134420303419
光生体調節と急性肺障害
新たなデータは、赤色および近赤外光スペクトルの光が、肺の炎症、肺線維症、肺炎、急性呼吸障害、およびコロナウイルス感染症の他の重篤な合併症を減少させることができることを示している。
COVID-19感染の重大な合併症である急性呼吸窮迫症候群(ARDS)[81,84]は、しばしば気道浮腫、肺炎、肺線維症を特徴とするが、実験動物での初期の結果で証明されているように、光生物学的調節によって改善されうることが示唆されている[[85], [86], [87]]。
例えば、de Limaら[85]は、ラットで肺炎を誘導した後、炎症を起こした気管支の皮膚に1.3J cm-2の連続波(CW)赤色650nmレーザーを1時間後に単回照射すると、肺水腫が抑制され、炎症のいくつかの指標がダウンレギュレートされることを示した。この治療により、好中球の活性化と流入、内皮細胞骨格の損傷、肺および気管支肺胞液中のTNF-α、IL-1βの量が減少した。
同様の研究で、Brochettiら[86]は、マウスに肺線維化を誘導し、次いで、14日目から8日間、毎日、赤色660±20 nmの光(5 J cm-2放射暴露、33 mW cm-2照射)で動物を処置した。その結果、肺胞内のコラーゲン産生と炎症性細胞数が減少し、間質肥厚が減少し、静的および動的な肺の弾力性が低下することがわかった。
さらに、動物から得られた肺細胞と線維芽細胞の培養では、肺のプロ炎症性細胞とコラーゲン沈着物のダウンレギュレーションが示された[86]。同じマウスモデルの別の研究では、赤外線780nmの光は、マウスの肺の炎症とコラーゲン沈着を減少させ、プロ炎症性サイトカインをダウンレギュレートし、線維芽細胞と肺細胞からのIL-10の分泌をアップレギュレートしたことが示された。さらに、それは肺の総TGFβを有意に減少させた[87]。
光生体調節 COVID-19に光を当てる
概要
目的 光がCOVID-19の致死率を低下させる可能性があるという仮説を評価すること。
方法 COVID-19の拡散と致死率を予測するためのモデルの多くは、周囲の温度を考慮に入れているが、光は無視されている。最近のCOVID-19の作用機序の理解の進展により、COVID-19は全身感染を引き起こし、造血系と止血に大きな影響を与えることが明らかになった。
COVID-19患者では、ヘモグロビンが減少し、プロトポルフィリンが増加しており、血流中に非常に有害な鉄イオンの蓄積が発生し、体内の激しい炎症プロセスを誘発し、結果としてC反応性タンパク質とアルブミンが増加する。
環状ポルフィリン環の不飽和特性を観察すると、主に可視領域の放射線を吸収して放出することができる。この特性は、赤色および近赤外放射(R-NIR)を用いたアデノシン三リン酸(ATP)および紫外線B(UVB)放射を用いたビタミンDの産生を増加させるための光生物学的調節を介して、このシステムの不均衡のイベントでこのプロセスを変更するための重要な差動を表すことができる。
これら2つの化合物は、免疫系の防御機構を活性化し、ウイルスによる攻撃に対する抵抗力を高めるという主な役割を持っている。感光性分子の電子励起理論によれば、ヘモグロビンのヘムと同様に、光吸収後はピロール環の中心と鉄イオン結合の安定性が高まり、ヘム機能の酸素輸送(HbO2)の損失を防ぐことができる。
また、光はR-NIR領域のチトクロムc酸化酵素に吸収され、その結果、電子輸送が増加し、酵素活性を調節し、その結果、ミトコンドリアの酸素速度消費量が大幅に増加し、ATP産生が増加する。
結論
本研究では、シトクロム c 酸化酵素とポルフィリンが 640nm を中心に吸収ピークを持つ R-NIR 領域と 900nm を中心に吸収ピークを持つ HbO2 領域の間の領域が最も好ましい光領域であると考えられる。これらのメカニズムから、光がCOVID-19の致死性を低下させるのではないかという仮説が立てられた。
近年、COVID-19の作用機序の解明が進み、COVID-19は全身感染を引き起こし、造血系や止血に大きな影響を与えることが明らかになってきている1 。このように、患者のヘモグロビンが減少し、プロトポルフィリンが増加しているため、血流中に非常に有害な鉄イオンの蓄積が発生し、体内の激しい炎症プロセスを誘発することができる3。
LiuとLi3は、新しいコロナウイルスにおける特定のタンパク質の生物学的役割を比較した。その結果、ORF8とウイルス表面糖タンパク質がポルフィリンと結合できることが明らかになった。さらに、ORF1AB、ORF10、およびORF3aタンパク質は、ヘモグロビンβ-1鎖へのヘム攻撃を調整して鉄を解離させ、それによってプロトポルフィリンを形成することができる。
したがって、ヘモグロビンは、酸素と二酸化炭素を輸送する能力を失うことになる。
ターンでは、肺細胞は、強烈な急性炎症プロセスと一緒にガス交換能力(CO2とO2)が低下している。侵害された酸素の輸送は、補助的な酸素療法を補助しても、多くの患者が臨床状態の好ましい進化を示さない理由であるかもしれない低酸素を誘導する。
環状ポルフィリン環の不飽和特性は、それが主に可視領域で放射線を吸収し、放出することを可能にする。
この特性は、このシステムの不均衡の場合に、治療を生成するために光の吸収を介して、このプロセスを変更するために重要な差を表すことができる、または診断を行うことができるように、光の放出を介して、そのダイナミクスを評価するために。
感光性分子における電子励起の理論4 や、光子吸収後のヘモグロビンのヘム分子の観察された特性から、ヘム分子に付着した電子が励起されて電子密度の分布が変化し、電子の移動が促進されることが示唆されている5 。
これと並行して、光はシトクロムc酸化酵素に赤・近赤外放射(R-NIR)領域で吸収され、その結果、電子輸送が増加し、酵素活性を調節し、組織ミトコンドリアの酸素消費率を大幅に増加させる6。
ビタミンDは290~315nmの波長のUVB放射を吸収し、この活性化にはこのプロセスが不可欠である。ビタミンDは、1,25-ジヒドロキシビタミンD7,8やディフェンシンからヒトカテリシジンLL-37を含む抗菌ペプチドを誘導することで、部分的には自然細胞免疫を増加させる。
12 これらの2つの化合物、ATPとビタミンDは、免疫系の防御機構を活性化する主な役割を持っている、ウイルスによる攻撃に対する個々の大きな抵抗力を可能にする。
UVBは、ビタミンDの活性化が皮膚の角質層で発生した後、表皮で表在的に吸収される13この場合、ポルフィリンを照射するための最も有利な波長は、赤色領域である14,15血液循環ポルフィリン、私たちの主要なターゲットは、UVBと比較した場合、より高い組織浸透に起因するこの領域でより良い吸収を提示するためである。
これらの分子を照射するためには、シトクロムc酸化酵素とポルフィリンの吸収ピークが640 nm-λ1を中心とした赤色領域で作用するものと、HbO2の吸収ピークが900 nm-λ2を中心とした近赤外領域で作用するものの2つのオプションがより適している(図1)。
図1に示すように、HbO2の吸収ピークは、6400nm-λ1を中心とする吸収ピークと、900nm-λ2を中心とする吸収ピークを有する近赤外領域とがある(図1)。
FIG.1. 光生物学的調節機構
ポルフィリンピロリン環の中心と鉄イオン結合が強化されていることを考えると、λ1がポルフィリン分子に直接作用し、λ2がHbO2分子に作用するという2つの波長が興味深い。
また、λ1がチトクロームc酸化酵素に作用してATP産生を増加させ、λ2が細胞膜透過性に作用して細胞内カルシウムの流れを増加させ、結果としてビタミンDの増加をもたらすことから、免疫系を強化する可能性もある。
しかし、最近の研究では、光照射されたミトコンドリアによるATP合成の増加について、異なる仮説が提示されている。著者らによると、ミトコンドリアATPの光誘発性アップレギュレーションの主な原因は、チトクロームc酸化酵素による吸収ではなく、照射されたミトコンドリアの界面水層粘度の低下を伴う物理的なプロセスに関係しているという。
この情報は、ミトコンドリアのATP合成は、LEDやレーザーの異なる波長によって刺激することができるという事実を正当化することができる。
この前提に基づき、我々の研究グループが細菌性肺炎患者に対して部分的に行った結果、10人中9人の患者の在院日数が7日から2日に短縮された18。この装置を使用する患者は、中間状態、半臨界状態、臨界状態の患者である。
この装置を使用する患者は、ポルフィリアスを呈する患者は、近赤外の放射線のみを放射する装置を使用し、プロトポルフィリンの光生物学的調節を防止する。
COVID-19に関する最近の研究では、高い温度(21℃まで)がCOVID-19の感染を1%の有意水準で減少させることが証明されている19。だが、考慮されるべきもう一つの要因は、ウイルスの拡散と致死性の予測では考慮されなかったが、光の存在である。当然のことながら、ある地域の地表での光の発生率が高いほど、その地域の周囲温度の上昇に直結するからである。
これら2つの変数は関連しているとはいえ、独立もしており、COVID-19の普及と致死性の研究において重要な役割を担うことができる。
前述のメカニズムに基づいて、我々の仮説は、光がCOVID-19の致死率を低下させるのに大きな役割を果たしているということである。
PDTはCOVID19患者の治療に可能性があるのか?
ハイライト
- 呼吸器感染症の抗菌PDT
- 気管支肺感染症のためのPDTの進行中の作業。
- COVID-19の呼吸器感染症におけるPDTの使用の根拠。
- COVID-19の呼吸器感染症の可能性のある方法論
要旨
コロナウイルスの大パンデミックをきっかけに、感染拡大の予防、早期診断、治療を目的とした研究が盛んに行われている。
また、近年、ヨークシャーレーザーセンターでは、慢性気管支拡張症にPDTを適用する方法論の開発に取り組んでいる。私たちの方法論は、メチレンブルー(MB)を媒介としたPDTを気道内に局所的に使用することに基づいている。
この方法の目新しさは、光増感剤を送達するためにネブライザーを使用することである。
我々は、我々のプロトコルと方法は、COVID -19の呼吸器感染症での使用のために修飾され得ることを示唆している。
背景
PDTは通常、がん治療のために検討されている[1]。しかし、1990年代初頭以降、抗菌薬の利用可能性と感染生物の多剤耐性の上昇とのミスマッチのため、抗菌薬(a-PDT)の可能性への関心が高まってきている[2]。
2009年[3]にMark Wainwright氏は、利用可能な実験室と実験データに基づいて、a-PDT試験は臨床試験で実施すべきであると主張したが、歯科でのいくつかの試験では、a-PDTは実験室にロックダウンられていた。
2. 方法とコメント
我々の研究の候補者は、広範囲の慢性気管支拡張症患者のコホートの中から選ばれることになっていた。
我々の優先事項は、このコホートでPDTを適用するための禁止要因を特定し、研究室から診療所に移行することであった[4]。これらは以下の通りであった。
・薬剤(PS)と光についての重要な情報。
・気管支樹へのPSおよびマッチングライトの送達に適した装置。
・トランスレーショナルリサーチにおける規制障壁の遵守
実験モデルを立ち上げる過程で、PSと光を届ける方法を探すために何度も試行錯誤した結果、私たちは次のような結論に至った。
・気道内PDTに最も適切なPSは、臨床使用のための様々な治療パッケージでかなりの経験があり、安全性のための良い実績を持っているメチレンブルー(フェノチアジン誘導体)であるように思われる。薬物は650-660 nmの光で活性化される。
・呼吸器へのPSの送達に最も適した方法は、ネブライザーを介しての送達であり、その詳細は現在調査中である。
・細いカテーテルを使用して、クリコ甲状腺膜を介して光を送達することができる。この方法は、局所麻酔薬に使用されてきた歴史がある。
・気管切開をしている人には、気管切開を通して薬剤と光が届けられる。
・局所的にMB-PDTを投与することは、予想される罹患率を伴わず安全である。
3. COVID 19 呼吸器感染症における我々の方法の使用の根拠
- これまでにCOVID 19 [[5][6][7][8][9]について学んだことから。]感染は呼吸器を介して行われる。
- その生理学的病理学と怪我は気管支の木と肺を通っている。
- 初期の場合、機械的な換気は必要ないかもしれないが、ネブライザーは禁忌ではないようである。
- 肺実質に影響を及ぼす症例では、疾患の影響を受けた部分に圧密と換気、灌流、拡散の欠如が見られ、その結果、酸素欠乏による肺不全や多臓器不全を引き起こする。
- 場合によっては、酸素を維持するために機械的換気が必要となる。しかし、場合によっては、高圧換気を行うことで、肺バロトラウマが発生し、肺不全をさらに悪化させてしまうことがある。
我々の仮説・提案
- COVID 19の治療法がないことを考えると、MB媒介PDTは早期および進行した気管支肺感染症の治療に試みられる可能性がある。
- 結果 ウイルスを破壊し、より良い臨床結果を得ることができるかもしれない。
- 抗菌PDTはチャンスを与えられるべきである;コロナウイルス呼吸器感染症はちょうどそのチャンスかもしれない。

