Contents
コロナウイルス グルタチオン
関連記事

COVID-19肺炎に伴う呼吸困難の緩和におけるグルタチオン療法の有効性:2症例の報告
要約
目的
COVID-19への感染は、重度の呼吸困難、急性呼吸窮迫症候群(ARDS)、劇症型心筋炎、および播種性血管内凝固を伴うか否かにかかわらず多臓器不全を伴う新型コロナウイルス肺炎(NCP)を引き起こし、「サイトカインストーム症候群」による重篤な転帰および死亡をもたらす可能性がある。
COVID-19に関連する炎症および呼吸器症状を適切にコントロールすることが示された治療法は,酸素療法および人工呼吸補助療法を除いて,これまでに発表されたものはない.我々は、COVID-19肺炎に続発する呼吸困難を有する2名の患者を対象に、高用量のグルタチオンを経口および/または静脈内投与した場合の効果を評価した。
方法
ニューヨーク市(NYC)在住でライムとマダニ媒介感染症の既往歴のある2人の患者が咳嗽と呼吸困難を経験し,新規コロナウイルス肺炎(NCP)と一致する放射線学的所見を示した。両患者に2gのPOまたは静脈内グルタチオンを試験的に使用したところ、使用後1時間以内に呼吸困難が改善された。グルタチオン2000mgのPOおよび静脈内投与は、呼吸器症状のさらなる緩和に効果的であった。
結論
経口および静脈内グルタチオン、グルタチオン前駆体(N-アセチルシステイン)およびαリポ酸は、NF-κBをブロックし、COVID-19肺炎患者における「サイトカインストーム症候群」および呼吸窮迫に対処するための新規な治療アプローチを表す可能性がある。
3. 議論
いくつかの重要な臨床症状から、我々の患者ではCOVID-19に曝露されている可能性が高いことが示唆されており、発熱、喉の痛み、咳、息切れに加えて、無嗅覚、低嗅覚、および味覚障害の初期の前駆症状が見られた。神経変性疾患とは別に、嗅覚喪失の3大原因は、外傷、鼻副鼻腔炎/鼻ポリープ、およびウイルス感染である[48]。嗅覚および味覚機能障害は、現在、コロナウイルス疾患(COVID-19)の軽度から中等度の形態の臨床症状として報告されている[49]。
COVID-19の危険因子には、免疫抑制および基礎となる感染症を有する患者が含まれる[[13], [15]]。活動性ライム病患者は、免疫グロブリンおよびサブクラスの欠損を伴う免疫抑制[50]に加えて、潜在的に炎症プロセスを駆動する複数の炎症源を有している可能性がある[51]。このことは、治療成績を複雑にする可能性のある危険因子のリストの中で考慮する必要がある。
例えば、患者1は、フリーラジカル/酸化ストレスを増加させることが知られているCOVID-19に罹患する前に水銀レベルが上昇していたと診断された[52]。グルタチオンとαリポ酸はともに水銀毒性の緩和および重金属の調節において重要であることが示されている [53]。
彼はまた、移動性疼痛と複数の陽性炎症マーカー(陽性ANA、リウマチ因子)を伴う活動性ライム病と一致する症状を有していた。移動性疼痛は、他の鑑別診断上の可能性が除外された場合、ボレリア・ブルグドルフェリの活動性感染の特徴的な症状の一つである[54]。この患者は、陰性の環状シトルリン化ペプチドを有する関節リウマチ、および陰性の二本鎖DNAとスミス抗体を有するエリテマトーデスを除外したが、これも移動性疼痛の別の可能性がある[54]。
ライム病および再発性熱性ボレリア症の患者は、抗生物質の投与を開始すると、しばしばヘルクスハイマー反応を経験する [55]。これらは、COVID-19のウイルス感染中に発現する同じサイトカインの一部である[24]。グルタチオンおよびアルカリ化して酸性副産物を減少させることは、この集団の患者の症状を減少させるのに有用であることが示されている[57]。
グルタチオン代謝はまた、B. burgdorferi感染の最も重要な標的であることが発見されており、この経路は、おそらくグルタチオン化を介して、サイトカイン産生に不可欠である[58]。グルタチオンおよびGSH(αリポ酸)の再生を助ける抗酸化剤を含むGSH前駆体(NAC)は、数十年にわたり、我々のマダニ媒介集団におけるサイトカインストームおよびヘルクスハイマー反応を治療するための効果的な主力であった[[59], [60]]。
両患者とも、病気のピーク期である10/11日目に初めてグルタチオンを服用した。最近発表された研究[61]によると、疾患経過中に重度の呼吸困難を伴わない患者では、症状の最初の発症から約10日後に胸部CT上で最も重篤な肺の異常が認められる。そのため、両患者ともに、高用量の経口グルタチオンを投与することで、疾患のピーク時の呼吸困難を緩和することができ、大きな効果があった。
私たちの患者には、亜鉛を1日40~50mg、ビタミンCを1~2g TID(一日3回)で投与した。亜鉛は免疫系で中心的な役割を果たすことが知られており、亜鉛欠乏者は様々な病原体に対する感受性が高くなる[62]。
亜鉛は好中球やナチュラルキラー細胞などの非特異的免疫を媒介する細胞の正常な発生と機能に重要であり[62]、亜鉛補給後、感染症の発生率、腫瘍壊死因子αの生成、酸化ストレスマーカーは、亜鉛補給群ではプラセボ群に比べて有意に低いことが示されている。
健康なヒトを対象とした亜鉛の補給はまた、血漿中の酸化ストレス関連副産物の濃度を低下させ、単核細胞(MNC)におけるTNF-αおよびIL-1β mRNAの生体外誘導を抑制し[63]、単核細胞におけるTNF-α誘導性核因子κβ活性化からの保護を提供した[64]。マクロファージは亜鉛欠乏によって悪影響を受け、これは細胞内殺傷およびサイトカイン産生の調節を阻害する可能性がある[63]。
また、αリポ酸とNACを持つもう一つの主要なフリーラジカルスカベンジャーであるビタミンCを使用した。免疫系では、ビタミンCの主要な役割は、抗酸化剤として、感染症[65]、特に肺に影響を与える感染症[65], [66]によって引き起こされる酸化ストレスから宿主細胞を保護することであるように思われる。
ビタミンCの他の効果としては、食細胞の機能亢進、Tリンパ球の増殖、インターフェロンの産生が挙げられ、一方でウイルスの複製を減少させる[67]。アルファリポイックはビタミンCと同時に投与され、抗酸化剤であり気道炎症を抑制する[41]こととは別に、酸化されたグルタチオンからの放出を介してGSHを増加させ、GSH合成を増加させ、同時に転写因子Nrf2を活性化させ、NF-κBの発現を低下させる[68]。
最後に、グルタチオンの前駆体であるNACは、無作為化比較試験において、細胞内GSHを増加させ、急性呼吸窮迫症候群を改善する一方で、市中後天性肺炎患者の炎症反応を低下させることが示されているため、1200~2400mg/日のPO用量で投与された[69]。
グルタチオンはほとんどの細胞に豊富に存在するが、気道上皮内膜液に最も豊富に存在する抗酸化物質であり、酸化ストレスから保護する重要な細胞内および細胞外抗酸化物質として作用し、肺のプロ炎症プロセスを減少させるのに役立つ[71]。
急速なターンオーバーを持ち、以下の方法で速やかに補充される。(1) 2つの酵素の連続的な作用によるde novo合成。最初のGCS(γ-グルタミル-システイン合成酵素(リガーゼ)は速度制限的であり、通常はGSHによるフィードバック阻害のため、GSHの要求に迅速に応答しながら、その最大容量よりも実質的に少ない量で機能する[47]。
さらに、GSH合成は、速度制限基質であるシステインの十分な利用可能性があれば、Nrf2を介してGCS転写を増加させることにより、酸化ストレスによって劇的に増加する[70]。我々の患者は、クルクルミンとスルフォラファン・グルコシノレートという2つのNrf2活性化剤を服用していた。
Nrf2は前炎症性サイトカインの転写をブロックすることでマクロファージの炎症反応を抑制する[72]が、クルクミンとスルフォラファンはともに強力なNrf2活性化剤であり、IL-6を含む広範な炎症性サイトカインを減少させることが示されている[73]ので、炎症を低下させるのに役立つ[74], [75]。
高齢者ではCOVID-19への曝露によるリスクが高いことが示されている[13]。GCS活性は加齢とともに減少し、GSSGからの減少したGSHのリサイクルが減少することから減少する。システインの十分な供給があれば、細胞はGSH産生を増加させ、酸化ストレスに対抗するための大きな予備能力を持つことができる[47]。
したがって、NACおよびグルタチオンを亜鉛、ビタミンCおよびNrf2活性化剤とともに大量に投与することで、酸化ストレスおよび炎症性サイトカイン産生を低下させ、その結果、呼吸困難および臨床症状を急速に改善させた可能性がある。
しかし、サンプルサイズが小さいことを除けば、我々の研究の限界は、酸化ストレスマーカー(過酸化脂質)、炎症性マーカー(CRP、フェリチン、Dダイマー)、LDHなど、GSH投与後の変化を示す可能性のある検査ができなかったことである[[76], [77], [78]]。GSH、グルタチオン前駆体と炎症性/酸化ストレスマーカーとの無作為化対照試験を将来実施し、NF-κBのブロック効果を完全に解明し、COVID-19肺炎およびARDSの臨床経過に対するGSHおよび抗酸化剤の効果を決定すべきである。
4. 結論
核内因子κB(NF-κB)の活性化は、ARDS に関連する多くの炎症性メディエーターの遺伝子の転写に必要であることが示されている。NF-κBが主要な役割を果たす無傷の炎症反応は、ウイルス[79]や細菌性肺炎の後期段階での適切な宿主防御にも必要である[80]。
敗血症や急性肺損傷の前臨床モデルでは、プロ炎症性サイトカインや他のメディエーターの急速かつ大量の増加に関連して、NF-κB活性化の抑制が生存率の改善につながることが示されている[[81], [82]]。NAC、α-リポ酸およびGSHはすべて、TNF-α誘導NF-κB活性化を阻害する。
経口および静脈内グルタチオンおよびグルタチオン前駆体(N-アセチルシステイン、α-リポ酸)は、したがって、NFKappaBをブロックし、COVID 19肺炎に苦しむ患者の「サイトカインストーム症候群」および呼吸窮迫に対処するための新しい治療アプローチである可能性がある。
亜鉛、ビタミンCおよびNRF 2活性化剤もまた、炎症反応を低下させ、サイトカイン産生を低下させるのに役立つかもしれない。COVID-19肺炎およびARDS患者の治療におけるこれらの新規治療法の有効性を評価するために、無作為化比較試験が実施されるべきである。
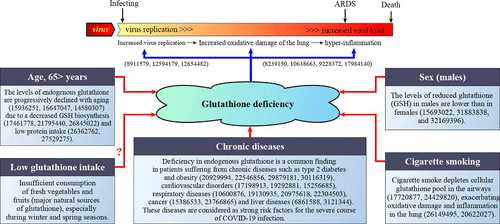
グルタチオン欠乏症がCOVID-19患者の重篤な症状と死亡の最も説得力のある説明であるという仮説
男性の方が女性よりも血漿中の還元型グルタチオン(GSH)濃度が低く、男性は酸化ストレスや炎症の影響を受けやすくなっている。いくつかの研究では、グルタチオン濃度が活性型ビタミンDと正の相関があると報告されている。
グルタチオンの抗ウイルス性、抗炎症性、抗凝固作用
いくつかの研究では、グルタチオンのレベルが高いと、ウイルス感染に対する個人の反応性が改善される可能性があることが示されている。特に、グルタチオンは、その抗酸化メカニズムを介して宿主免疫細胞を保護することが知られており、また、免疫システムの一部である様々な細胞の最適な機能にも関与している。
グルタチオンがウイルスのライフサイクルの様々な段階で様々なウイルスの複製を阻害するという証拠があることに注意することが重要であり(図1)、GSHのこの抗ウイルス特性は、ウイルス負荷の増加およびそれに続く炎症性細胞の肺への大量放出(「サイトカインストーム」)を防止するように思われる。
グルタチオンの抗ウイルス活性は、De Floraら(17)の研究で実証されており、彼は、N-アセチルシステイン(NAC、グルタチオン前駆体)の6ヶ月間の予防投与により、特に高齢者のハイリスク者において、臨床的に明らかなインフルエンザおよびインフルエンザ様エピソードの発生率が有意に減少したことを示した。
また、重症ARDS患者の肺細胞傷害や炎症などの病態生理的状態がNAC治療の対象として同定された。特に、ARDS患者の肺胞液中の還元型グルタチオンの欠乏は、活性酸素/酸化ストレスや炎症による肺細胞傷害を促進することが明らかになり、NACの投与により、この傷害を効果的に予防・治療することが可能となった(図1)。
グルタチオン欠乏はCOVID-19病を悪化させる。私の観察
クルスク州立医科大学は、2016年12月から2型糖尿病(T2D)における酸化還元恒常性の遺伝学に関するプロジェクトに取り組んできた。
2020年4月、対照群から4人の患者がCOVID-19を有することが確認された。患者から血液サンプルを採取し、採血直後の血漿中総ROSおよびGSHレベルを測定するために使用した。4人の患者はすべて女性であり、非喫煙者であり、慢性疾患を有していなかった。表1に症例の説明を示す。
中等度および重度のCOVID-19疾患を有する患者は、軽症の患者に比べてグルタチオンのレベルが低く、血漿中のROSおよびROS/GSH比が高かったことから、明らかに重症の疾患症状を有する患者のグルタチオン欠乏および酸化ストレス徴候を示した。
特筆すべきは、重症でグルタチオンが著しく低下している患者だけがまだ重症であるのに対し、GSHのレベルが高い/中等度の他の患者は回復していることである。
仮説
内因性グルタチオン欠乏症は、SARS-CoV-2によって誘発される肺の酸化的損傷を促進する重要な因子であると考えられ、その結果、COVID-19患者では急性呼吸窮迫症候群、多臓器不全、死亡などの重篤な症状を引き起こす。GSHの抗ウイルス活性を考慮すると、グルタチオン欠乏症の人は、SARS-CoV-2ウイルスの制御されない複製を受けやすく、それによってウイルス負荷が増加しているように思われる。
COVID-19患者における臨床症状の重症度は、減少したグルタチオンの欠乏と活性酸素産生の増加に起因するレドックスホメオスタシスの障害の程度によって決定されるようである。
この仮定は、我々の知見によって支持され得る。特に、中等症および重症のCOVID-19患者は、軽症のCOVID-19患者に比べて、グルタチオンのレベルが低く、ROSのレベルが高く、酸化還元状態(ROS/GSH比)が高かった。
著しいグルタチオン欠乏症の患者の1人にCOVID-19感染の長期的かつ重篤な症状が見られたことから、グルタチオンの減少の程度がウイルスの複製率と負の相関を示し、ウイルス負荷の増加が肺の酸化的損傷を悪化させることが示唆された。
この知見は、細胞内グルタチオンのレベルが高いとウイルスが積極的に複製できないことを示唆しており、したがって、ウイルス負荷が低い場合には、より穏やかな臨床症状が観察される。
グルタチオン欠乏症は、加齢、男性性、併存疾患、および喫煙の単独または組み合わせなどの危険因子の影響を受けた内因性GSHプールの生合成の低下および/または枯渇の増加に起因する後天的な状態である。
N-アセチルシステインの長期経口投与は、呼吸器ウイルス感染症の有効な予防策として既に試験されている(1) 。さらに、NACまたは還元型グルタチオン(GSHはNACよりも生物学的に利用可能である)の非経口注射は、重症のCOVID-19患者に対する効率的な治療法であり得る。Horowitzら(18)は、この仮説を確認する論文を発表したばかりである:著者らは、COVID-19肺炎に伴う呼吸困難の緩和におけるグルタチオン療法の有効性を報告している。
COVID-19によって引き起こされる重度の炎症反応を防御するグルタチオンの役割
The Role of Glutathione in Protecting against the Severe Inflammatory Response Triggered by COVID-19
www.mdpi.com/2076-3921/9/7/624/htm
要旨
多くの場合、高齢化、糖尿病、高血圧などの疾患がある場合、ウイルスは致死的なサイトカインストームを引き起こし、患者は急性呼吸窮迫症候群で死亡するが、多くの場合、疾患は軽度か無症状で進行している。
COVID-19に関連するすべての病態に共通しているのは、活性酸素種(ROS)蓄積の原因となる酸化還元恒常性の障害であるように思われる。したがって、すべての組織における重要な抗酸化物質の保護者であるグルタチオン(GSH)のレベルは、COVID-19における臓器不全の引き金となる悪化した炎症を鎮める上で重要であると考えられる。
本レビューでは、GSHによって相殺された重症COVID-19の致命的な炎症につながるメカニズムを生化学的に検討した。GSHを競合させる経路は、内因性GSHストックの枯渇を引き起こすために同時進行するイベントを説明するために記述されている。
重症化した疾患と臨床的に関連する主な状態でGSHのレベルが低下していることを示す文献からの証拠を引き出し、最も脆弱な被験者をCOVID-19の重篤な症状から守るためにGSHのレベルを回復させることの重要性を強調する。
最後に、COVID-19の予防と制圧に利用可能なGSHレベルの増加の実現可能性について、現在のデータについて議論する。
1. 序論
肺の炎症は、いわゆる「サイトカイン放出症候群(CRS)」によって特徴づけられるSARS-CoV-2感染の重症段階では、生命を脅かす呼吸器疾患の主な原因となる。
この有害な炎症反応に対抗するための鍵となるのは、以下の点である。(i) ACE2タンパク質への結合および不活性化を媒介としたウイルスの細胞内への侵入機構の解明、(ii)炎症反応の悪化との対比。標準的な薬理学的アプローチとしては、ウイルスの複製を阻害する目的で抗ウイルス剤を使用するか、あるいは他の慢性疾患の炎症経路の阻害剤として以前に有効性が確認されている薬剤を利用することが提案されている。残念ながら、これらの薬剤はSARS-CoV-2の最も重篤な症例の治癒には効果がなく、さらに、いくつかの副作用がある。この疾患の不可解な側面は、重篤な症状から無症状の進行まで、患者間の反応の大きな不均一性である。この疾患の防御機構とその失敗の理由を理解することは、治療法の探求における突破口を提供する可能性がある。
炎症反応は、その受容体ACE2を介したウイルスの侵入経路にまで遡ることができる。アンジオテンシン変換酵素2(ACE2)は、その仲間であるアンジオテンシン変換酵素ACEとともに、レニン-アンジオテンシン系(RAS)に関与するプロテアーゼである。これらのプロテアーゼは細胞表面に局在し、同じ基質であるアンジオテンシンIとIIをめぐって競合する。ACE2は、アンジオテンシンII(ANGII)の量を減少させ、ANG(1-7)ペプチドを増加させることにより、ACEの活性に対抗する。2つの酵素の下流効果は逆効果である。ACE活性は血管収縮、酸化ストレス、炎症、アポトーシスを引き起こすのに対し、ACE2は血管拡張、血管新生、抗炎症、抗酸化、抗アポトーシス作用を引き起こす[1]。ACE活性によって生じる酸化ストレスは、その生成物であるANGIIの作用によるもので、NADPHオキシダーゼの活性化とペルオキシナイトライトアニオンの生成により活性酸素種(ROS)の産生を増加させる。対照的に、ACE2活性によって合成されたANG(1-7)ペプチドは、プロオキシダント経路のダウンレギュレーションをもたらし、酸化ストレスによって誘発される細胞損傷を予防または減衰させる。
ACEとACE2のバランスは人によって異なり、ACEが優位になると炎症を起こしやすくなる。これが起こると、さらにSARS-CoV-2に感染すると、関連するコロナウイルス[2]からの証拠が示唆しているように、細胞表面上のACE2の豊富さがダウンレギュレートされ、その結果、ANGIIの毒性の過剰蓄積、炎症の悪化、そして最終的には急性呼吸窮迫症候群と劇症型心筋炎が発生する(図1)。ACE/ACE2の異なるバランスは、同じウイルスによって引き起こされる感染に対する不均一な反応を説明することができる。RASカスケードの調節障害とSARS-CoV-2感染の可能性または重症度との間のリンクは、最近のいくつかの研究[3,4]で議論されており、RAS阻害剤の効果が議論される際には重要な問題である[5]。
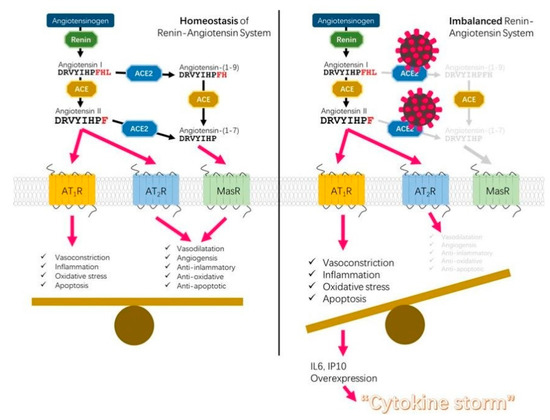
図1. レニン-アンジオテンシン系(RAS)に関与する分子間の相互作用の包括的なスキーム
ACEとACE2の間の不均衡に起因する二次的な酸化ストレスを減少させることは、COVID-19の予防と治療のための最良のアプローチである可能性がある。酸化ストレスは、チェックで活性酸素と反応性窒素種を維持するための抗酸化防御システムの失敗を構成している。活性酸素は、プロ炎症性サイトカインの放出を誘導するシグナル伝達分子であり[6]、この反応の調節障害は炎症の発症に不可欠な役割を果たしている[7]。
グルタチオン(GSH)は、すべての組織で「マスター抗酸化物質」の機能を持っている;還元型(ミリモル)の高濃度は、解毒、タンパク質フォールディング、抗ウイルス防御、免疫応答などの多くのプロセスの制御における中心的な役割を強調している[8]。
本レビューの目的は、ACE/ACE2の不均衡に伴うCOVID-19によって引き起こされた炎症の悪化に対するGSHの保護作用の概要を提供することである。さらに、最も脆弱な被験者をCOVID-19から保護する試みにおいてGSHレベルを回復させることの関連性を検討することを意図して、この疾患の重篤な転帰に関連した状態で発見されたGSHの低レベルの証拠について議論する。
2. 細胞内GSHホメオスタシス
グルタチオンは、グルタミン酸、システイン、グリシンからなるトリペプチドで、ほとんどの生物に遍在する抗酸化分子である。細胞内のGSHバランスは、de novo合成、酸化された形態からの再生、GSSG、および細胞外へのGSHの取り込みによって維持されている。腸球、γ-グルタミルトランスフェラーゼ(γ-GT)、ジペプチダーゼ(DP)などの輸送上皮細胞では、細胞外GSHの加水分解は、その構成アミノ酸であるグルタミン酸、システイン、グリシンに触媒される。この3つのアミノ酸は、トランスポーターによって吸着される。さらに、腸管上皮細胞は、特定の形質膜トランスポーターを介して内腔から無傷のGSHを輸入することができる。
GSHの細胞質合成は、グルタミン酸-システインリガーゼ(GCL)とグルタチオン合成酵素(GS)によって触媒される2つのATP依存性反応で行われる。これらの酵素の活性は多くの経路によって調節されており、GSHの合成は多くの環境条件に対応しなければならないことが示唆されている。TGFβ1はGSHのレベルを低下させるGCL発現の主要なリプレッサーの一つである[9]。サイトカイン活性は活性酸素によって誘導され、線維化を引き起こすので[10,11]、このことは、プロ線維化環境では、GSHの枯渇は酸化または合成の低下によって、複数のメカニズムを介して起こることを示唆している[12]。さらに、低酸素は2つの重要な生合成酵素であるGCLとGSの活性を低下させるため、GSH合成の阻害シグナルとなる[13]。一方、ビタミンDはGCLとグルタチオン還元酵素遺伝子の発現を誘導し[14]、GSHのレベルを上昇させる。また、活性酸素種や一酸化窒素種への曝露によってもGLC遺伝子の発現が誘導される[15]。
グルタチオンは還元状態(GSH)と酸化状態(GSSG)で存在する。還元状態では、システインのチオール基は、活性酸素のような他の不安定分子に還元当量(H+ + e-)を供与することができる。電子を供与する際に、グルタチオン自体は反応性になるが、別の反応性グルタチオンと容易に反応してグルタチオンジスルフィド(GSSG)を形成する。このような反応は、細胞内のグルタチオンの濃度が比較的高い(肝臓では5mMまで)ために可能である。GSSGからのGSHの再生は、GSHの酸化還元サイクルにおけるグルタチオン還元酵素(GR)によって触媒される。GSSGの還元は、グルコース酸化からのペントースリン酸経路(PPP)によって生成されるNADPHを犠牲にして起こる。ミリモル濃度で存在する細胞内GSHプールは、様々なGSH依存性反応に関与している。ミトコンドリア、核、小胞体内でのGSHのコンパートメント化は、異なる独立して制御された細胞内レドックスプールを形成する。
グルタチオンは、いくつかのメカニズムを介して細胞保護の役割を果たしている。還元剤として、それは、グルタチオンペルオキシダーゼ(GPXs)によって触媒される過酸化水素(H2O2)および脂質ヒドロペルオキシド(LOOH)の還元における主要な細胞抗酸化剤である。活性酸素からの保護反応では、グルタチオンの役割は過酸化物の還元によって示される。
2 GSH + R2O2 → GSSG + 2 ROH
R=Hまたはアルキル基であり、フリーラジカルの中和により
GSH+R→0.
GSH はグルタレドキシン(GRXs)触媒によるタンパク質ジスルフィド(PrSSG)の還元にも関与している。また、化学反応を触媒する酵素であるプロテインジスルフィド還元酵素 (グルタチオン) (EC 1.8.4.2) によるプロテインジチオールの保存にも利用されている。
2 グルタチオン+タンパク質ジスルフィド↔グルタチオンジスルフィド+タンパク質ジチオール。
この酵素は、ジスルフィド橋の切断によって不活性化されるインスリンのような異なる基質、またはタンパク質ジスルフィドに作用し、タンパク質ジチオールへの還元によって触媒活性が回復し、酸化ストレスから細胞を保護する。
グルタチオンのもう一つの重要な機能は、いくつかの基質への共役によって媒介される。無害化防御システムでは、GSHはグルタチオン-S-トランスフェラーゼ(GST)によって触媒される共役反応に参加している。水銀や鉛などの多くの重金属は、多くの膜ATPアーゼを含む多くの酵素のSH基への不可逆的な結合を防ぐために、GSH抱合体として排除される。鉛への亜急性曝露は、GSHプールの枯渇と脂質過酸化産物の蓄積をもたらし、GR、GSTおよびグルコース-6-リン酸脱水素酵素などのグルタチオン関連酵素の活性を修飾する[16]。多くの親油性の異生物学的物質は、それらの排泄または更なる代謝を促進するためにGSHと結合している。共役化合物はGSHトランスポーターによって細胞外に排出され、活性なポンピングにはATPを必要とする[17]。特に、多剤耐性関連タンパク質(MRP/ABCC)は、GSHの輸出と恒常性を媒介していると考えられている。MRPタンパク質はGSHの流出を媒介するだけでなく、酸化されたグルタチオン誘導体(グルタチオン二硫化物(GSSG)、S-ニトロソグルタチオン(GS-NO)、グルタチオン-金属錯体など)や他のグルタチオンS共役体の輸出も行っている[18]。さらに、GSHはタンパク質のS-グルタチオン化(PSSG)と呼ばれる過程でタンパク質に結合することができる。PSSGは、タンパク質のシステインが過剰に酸化されて再生されにくいスルフィン系およびスルホン系の種になるのを防ぐ。S-グルタチオン化はまた、タンパク質の構造と機能を変化させる。
GSHの強力な細胞保護効果のために、GSHの恒常性の変化は、神経変性疾患、AIDS、肝臓および心臓病、老化、糖尿病および癌と関連している([19,20,21]でレビューされている)。
3. GSHの保護作用
グルタチオンは、フリーラジカル、過酸化物、脂質過酸化物、または有機汚染物質や重金属などの活性酸素やその誘導体によって引き起こされる重要な細胞成分の損傷を防ぐことができる。さらに、-SH基の特異な反応性により、GSHは、ジスルフィド橋の還元から内因性分子や異種生物学的物質との共役まで、いくつかの化学反応に関与している。利用可能なGSH分子のプールは固定されているため、GSHの利用が予想外に増加すると、遊離分子が減少し、競合する経路が障害されることになる。例えば、GSHが共役化されると、その分子を補酵素または基質として使用して酵素から盗まれる。この観察は、GSHの欠乏が起こり、重度のウイルス症状に関与する経路に影響を与え得る理由を説明するのに関連している。GSHの多くの機能の中で、COVID-19で起こっている炎症の悪化や、この病気で発症した症状への影響に関連して、いくつかの機能について言及する価値がある。
GSHは、炎症性疾患の進行に重要な役割を果たす重要なシグナル伝達分子である活性酸素を中和(すなわち、還元)することで細胞を保護する。活性酸素産生と炎症性サイトカイン活性化との関係は、十分に確立されている[22]。炎症部位での多形核好中球による活性酸素生成の亢進は、内皮機能障害および組織傷害を引き起こす[23]。
グルタチオンS-トランスフェラーゼ酵素は、親油性の外来物質へのGSHの共役を触媒し、多くの薬物の排泄または更なる代謝を促進する。この共役プロセスは、N-アセチル-p-ベンゾキノンイミン(NAPQI)の代謝によって示される。NAPQIは、パラセタモール(アセトアミノフェン)に対するチトクロムP450の作用によって形成される反応性代謝物である。グルタチオンはNAPQIと共役し、その結果生じる生成物は排泄される [24]。
多くの酵素は GSH を補酵素または基質として使用する。例えば、GSHを主要な補因子として必要とする反応は、プロスタグランジンH合成酵素によって触媒され、血管機能の必須の調節因子であるプロスタグランジンとトロンボキサンの産生の律速酵素である[25]。さらに、ロイコトリエンC(4)合成酵素は、LTA(4)とGSHを共役して、システイニル・ロイコトリエンの親化合物であるロイコトリエンLTC(4)を形成する [26];これらの分子は気道狭窄の強力なメディエーターである。
GSHは、一酸化窒素(NO)シグナル伝達において重要な役割を果たし、生物学的に利用可能なNOの供給源である内因性S-ニトロソチオールであるS-ニトロソグルタチオン(GSNO)を合成するために使用される。GSNOの生成は、適切にNOシグナル伝達を行うことができる安定したNOプールとして機能することができる[27]。一酸化窒素合成酵素eNOSおよびnNOSによって生成されたNOは、GSHの存在下で、血管および神経細胞の機能を効果的に調節し、局所的なカルシウム流入に応じて血流を調節することができる。
これらおよび他の多くのGSHを消費する経路間の競争の結果として、一方では、ウイルス感染によって引き起こされる猛烈な炎症および酸化ストレスが、NO依存性血管拡張などのコア機能からGSHを奪い;他方では、他の生化学的経路がGSHを消費しているとき、患者は、致命的であることを証明することができる炎症から保護されていない。
4. ACE/ACE2の不均衡によって引き起こされる炎症に対するGSHの有益な効果
ANGIIの有害な増加は、多くの要因に依存する。第一に、それは、GSHの影響を受けないレニン活性の増加に起因することができる。その代わりに、ACEの発現と活性はグルタチオンによって調節される;実際、酸化型のGSSGはACE活性に活性化効果を示すが、還元型のGSHは抑制効果を与える[28]。最後に、ANGII産生の増強は、ACE2の発現および活性の低下に起因する可能性がある;これは、ACE2をその細胞外結合部位として認識するコロナウイルス感染の場合のケースである[29]。SARS-COV-1と比較して、SARS-CoV-2はACE2に対する親和性が約4倍高い[30]。ACE2を結合するSARSウイルスによる細胞の感染は、ACE2活性の阻害と感染細胞におけるACE2発現の低下という2つの効果をもたらす [29,31,32]。ANGIIの増加は、AT1Rへの結合を介して、NADPHからO2へ電子を移動させるNADPHオキシダーゼを活性化し、いくつかのラジカル種を発生させ、これらはGSHによって消去される。活性酸素が介在する酸化は、シグナル伝達カスケードの誘導や転写因子との相互作用を介して遺伝子発現を変化させることができる[33]。これらの因子の中でもNF-κBは、重症急性呼吸器症候群(SARS)の炎症に関与することが、SARS-CoV感染培養細胞やマウスで実証されている[34]。NF-κBの活性化を阻害する薬剤は、炎症や肺の病態を改善することが期待されている。NF-κBは複数のメカニズムを介して炎症に関与している。試験管内試験(in vitro)では、ウイルス核カプシド(N)タンパク質は、遺伝子のプロモーター領域でNF-κBが結合することにより、インターロイキン-6(IL-6)の発現を活性化する[35]。肺病変を伴う急性期のIL-6の高レベルは、SARS患者で確認されている[36]。活性酸素の産生を減少させることにより、GSHはNF-kBの活性化を抑制し、結果としてサイトカインストームを抑制する。GSHの効果を図2に示す。
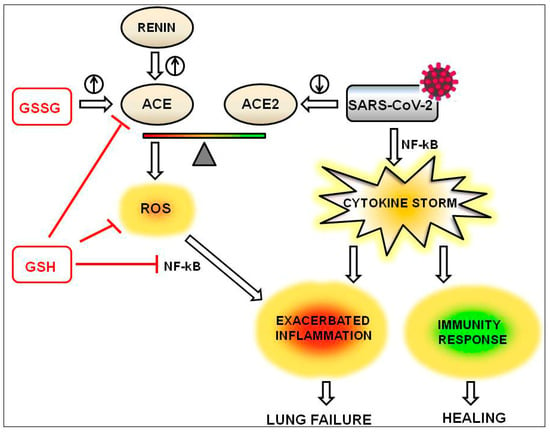
図2。還元グルタチオン(GSH)の抗炎症効果は、ACE活性の抑制、活性酸素種(ROS)産生の減少、NF-κB活性化の減少(赤線)を介して発揮される。ACE/ACE2のバランスは、グルタチオンの酸化型(GSSG)やレニン(上向きの丸印の矢印はACEの誘導を示す)、ウイルス感染(下向きの丸印の矢印はACE2のダウンレギュレーションを示す)によってACEの方にシフトしている。
酸化剤/抗酸化剤のアンバランスはSARSに特有のものではないが、NF-kBなどのレドックス感受性転写因子の活性化がGSHによって低下するすべての炎症性肺疾患に共通している[37]。酸化ストレスの動物モデルでは、NF-κB結合活性は肝臓グルタチオンと逆相関し、緑茶抽出物の経口投与によりさらに抑制された[38]。
5. 低グルタチオンに関連する条件
GSHは、ヒトの疾患の病態生理において中心的な役割を果たしている([39]でレビュー)。GSHの不均衡は、肺感染症、HIV、糖尿病、癌、加齢に伴う疾患を含む幅広い病態で観察される[20,40]。重度のCOVID-19疾患に臨床的に関連する状態を考えると[41,42,43]、GSHの補充が乱れている証拠を見つけることができる。
1. 年齢
年齢はCOVID-19患者における罹患率と死亡率の両方の主要な危険因子である[44,45]。実験動物では、GSH含量の加齢に伴う変化が異なる組織で測定されている。老齢マウスは、いくつかの臓器において若いマウスよりもGSHが低かった。肺での急激な減少は、加齢と大気汚染の合計が非常に低いGSHにつながる可能性があるため、非常に顕著である[46]。動物で得られたデータと同様に、ヒトでも加齢とともにGSH濃度が低下することがいくつかの研究で報告されている[47,48,49,50,51,52]。
2. 性の違い
COVID-19の重症度は性別と厳密に相関している。男性も女性も感染の有病率は同じであるが、COVID-19を有する男性は年齢とは無関係に、より悪い転帰や死亡のリスクが高い。公的データセットでは、COVID-19で死亡した男性の数は女性の2.4倍である(70.3対29.7%、p = 0.016)[53]。いくつかの研究では、女性と比較して男性のGSHレベルが低下していることが報告されている。フリーラジカルおよび過酸化脂質産生に対する性ホルモンの影響を調査した研究では、赤血球グルタチオンレベルが健康な男性の方が健康な女性よりも低いことが明らかになり、GSH濃度の低下は産生量の減少の結果ではなく、テストステロンによって引き起こされる酸化ストレスの増加に対してより迅速に利用された結果であろうと結論づけられた[54]。別の研究では、新生児組織はグルタチオン代謝の性差に依存した変調を示すことが報告されている。実際、酸化ストレスに応答して、女児の気管吸引液由来の細胞と内皮細胞は、男児由来の組織と比較して、グルタチオン還元酵素の活性が高かった [55]。運動誘発性酸化ストレスに対する性別と抗酸化物質の補給の影響を調べることを目的とした研究では、補給前は女性の方が男性に比べて還元型グルタチオンと総グルタチオンが高かったと報告されている[56]。
文献で報告されたデータから、GSH含有量の性差はホルモンに関連しているか、薬物代謝酵素の有意な性差に起因している可能性がある。
エストロゲンはACE/ACE2システムの不均衡によって引き起こされる活性酸素の産生を抑制することができる;したがって、女性はGSH枯渇のリスクが低い。実際、ACE2発現は性ホルモンによって調節される。エストロゲンは、ACEのダウンレギュレーションおよびACE2、AT2Rおよびang(1-7)受容体発現レベルの同時アップレギュレーションを介して、局所的なレニンアンジオテンシン系を調節する [57]。エストラジオールは、分化した気道上皮細胞を含む様々な組織でACE2の発現を直接活性化する[57,58,59]。さらに、女性の子供の血清ACEは12歳以降、男性に比べて有意に低い[60]。17β-エストラジオールは、プロゲステロンやテストステロンなどの他の性ホルモンではなく、GSH依存性タンパク質ジスルフィド還元酵素の含有量を増加させ、酸化ストレスから内皮細胞を保護する[61]。末梢組織におけるエストラジオールの産生は、ステロイドスルファターゼによって硫酸DHEA(DHEAS)から産生される前駆体DHEAの局所的な利用可能性に依存している。ステロイドスルファターゼは、高齢者ではエストロゲン合成の制限酵素となり、若い男性の血清DHEASは女性よりもはるかに高いのに対し、閉経後は非常に似たような値を示する。高齢女性のステロイドスルファターゼの過剰発現は、閉経後も男性よりも高いエストロゲン産生につながる可能性がある。
コルチゾールもグルタチオンの恒常性に影響を与えるようである。実際、急性呼吸窮迫症候群(ARDS)の症例における抗炎症性グルココルチコイドの投与を分析した研究では、ヒドロコルチゾンの投与後にグルタチオンが枯渇し、肺胞上皮II型細胞のグルタチオン還元酵素活性が低下し、有益な効果が得られなかったことが示されている[62]。これらの観察結果から、高齢女性では高齢男性に比べて尿中遊離コルチゾール排泄量が低いことから、GSH値の性差にコルチゾールの役割があると推察される[63]。
また、代謝酵素の活性の性差については、雌マウスの異化酵素γ-グルタミルトランスペプチダーゼの特異的活性が雄マウスの73%であったことから、雄の方がグルタチオンのターンオーバーが速いことが、酸化的傷害に対する感受性が高いことを示唆している[64]。アセトアミノフェン投与後、雄マウスと雌マウスの両方で肝皮質および腎皮質のグルタチオンの時間依存的な減少が観察されたが、雄マウスの減少は雌マウスよりも有意に大きかった[65]。このことは、基底状態ではGSHレベルが同じであっても、GSH依存性解毒系を必要とする薬物や汚染物質に挑戦した後では、GSHの減少は雌よりも雄の方が顕著であることを意味している。
イタリア北西部の成人を対象とした大規模なサンプルでは、ビタミンDレベルは男性よりも女性の方が有意に高く、冬よりも夏の方が高く、65歳以上の高齢者に比べて64歳未満の人の方が高いことがわかった[66]。ビタミンDはGCLとGR遺伝子[14]の発現を誘導し、したがってGSHのレベルを上昇させるので、これらの小さいが有意な差は、重度のCOVID-19の予防因子としても考慮しなければならない。
3. 糖尿病
低GSHと糖尿病との間の相関関係は十分に確立されている。糖尿病は、酸化的損傷、GSSG/GSH比の増加、および異なる組織におけるGSH含量の減少と広く関連している[67,68]。GSHの減少は、ほとんどの場合、NF-kBの活性の増加と関連している[69]。Samiecらの研究では、総グルタチオンとその還元型のレベルが高齢者の血漿中では低く、糖尿病患者ではさらに低いことが示された[70]。糖尿病では、抗酸化分子としてのGSHの役割は、上述したように、NOの主な供与体であるGSNOのレベルを維持することへの寄与と同様に重要である。インスリン抵抗性は、内皮NO合成酵素(eNOS)の活性と負の関係があり、したがって、代謝性疾患と心血管疾患との間に関連を生じさせる。NO産生の低下は、インスリン抵抗性と高血圧の両方を誘導する[71]。筋肉、脂肪細胞、肝臓におけるインスリン感受性の上昇は、純粋なNOよりもGSNOに依存している[72,73]。
4. 高血圧症。
糖尿病と高血圧は、死期を迎える患者において最も頻度の高い併存疾患であると考えられている[74]。高血圧は複数の要因に依存している可能性があり、その中でもビタミンDの低下に伴うレニン過剰発現によるレニン-アンジオテンシン系の活性化、eNOSの活性低下、GSHレベルの低下を挙げることができる。糖尿病についてはすでに述べたように、低GSH/低NOの組み合わせは、動物モデルでも実証されているように、血管収縮を伴う血管壁および平滑筋へのカルシウム流入の増加をもたらす[75]。高血圧患者では、GSHの低レベルはコンパニオン酵素(カタラーゼ、GSH-ペルオキシダーゼ、GST)の減少および脂質過酸化物の増加を伴うことが多いため、GSHの減少は、炎症性プロセスの二次的な活性酸素産生のバーストによるものであるというのが一般的な仮説である[76]。GSHの枯渇が慢性的な酸化ストレスを誘導し、正常ラットで高血圧を引き起こすことが実証されている。これは、活性酸素によるNOの不活性化と隔離を伴い、NOのバイオアベイラビリティの低下につながる[77]。
5. 肥満
最も一般的な併存疾患である高血圧(56.6%)および糖尿病(33.8%)とともに、肥満もまた、米国の医療システムに入院している患者においてCOVID-19(41.7%)と密接に関連していることが判明した[78]。多くの研究は、肥満の被験者において、酸化ストレスおよび慢性炎症が、糖尿病および心血管疾患などの多くの病態の発症につながる重要な基礎的要因であることを示唆している。いくつかの研究では、肥満患者では酸化ストレスがグルタチオンレベルの低下[79,80]とGSH/GSSG比の低下[81]と関連していることが報告されている。また、高脂肪高炭水化物食による栄養ストレスは、脂質過酸化生成物の増加、抗酸化システムの低下、グルタチオンレベルの低下によって明らかなように、酸化ストレスを促進する[82,83]。
6. 薬物療法
グルタチオンS-トランスフェラーゼ(GST)酵素は、GSHと親油性の有害物質との共役を触媒し、これにはほとんどの薬物が含まれている。アセトアミノフェン(パラセタモール)は、このメカニズムによってGSHレベルに影響を与える最もよく知られた薬物である(この相互作用に関するPubMedには600以上の項目が掲載されている)。他の多くの薬物は、酸化ストレスを誘発するためにGSHレベルを低下させるが、例えば、ドキソルビシン(アドリアマイシン)、抗マラリア薬、クロロキン(クロロキン)、エトポシド、アヘン、エタノール[84]および抗うつ薬[85]などである。クロロキンの使用は、その化学的特性のために特別な注意に値する。GSH枯渇を引き起こすそのプロオキシダント活性に加えて [86]、クロロキンはリソソームに蓄積し、リソソームのアルカリ化を引き起こし、トランスフェリン結合鉄を含む多くの栄養素の血中からの取り込みを阻害する。神経における鉄欠乏は、チトクロームC合成、呼吸鎖活性およびATP合成を低下させる。この毒性は治療不可能であり、失明にまで進行する可能性がある[87]。
これらの観察に基づいて、我々は、多くの一見些細な健康問題が、ウイルス感染によって悪化し、COVID-19の重篤な転帰につながる可能性のある抗酸化防御における個人の脆弱性を作り出すことに一致しうると結論付けている。
6. GSHとチオールによる治療
抗酸化療法は、酸化還元恒常性の障害に起因する炎症を特徴とする多くの疾患に有益な効果を発揮する [88,89,90]。炎症性疾患の文脈では、全身性酸化ストレスは、総遊離チオールレベル(アルブミンなどのタンパク質中のシステインの遊離スルフヒドリル基、および低分子遊離チオール、例えばシステイン、グルタチオン、ホモシステインおよび関連種)の低下として検出される。最近の研究では、低分子量の全身性遊離チオールは、慢性閉塞性肺疾患(COPD)と心血管疾患の両方に関与する炎症性および酸化ストレス経路で役割を果たしている可能性があると結論づけている[91]。全身の遊離チオールのレベルは、栄養学的または治療的介入によって影響を受ける可能性がある [92]。これらの理由から、多くの臨床試験では、N-アセチルシステイン(NAC)投与の有効性が評価されており、現在も多くの臨床試験が進行中である(714試験、349試験終了)ほか、GSH補給の効果も評価されている(162試験、100試験終了)(https://clinicaltrials.gov/)。
NACは抗酸化作用を持つチオールであると同時に、GSH生合成の基質の一つでもある。抗酸化物質である NAC の投与によるマウス喘息モデルの保護効果は、2 つの研究で実証された。NAC の投与は動物の GSH/GSSG の比率の低下を減衰させることができ [93] 、NAC によるグルタチオンプールの再補充は、アレルゲンによって誘発された気道反応性/炎症を打ち消し、酸化抗酸化バランスを回復させた [94]。
ヒトでは、NACとGSHの補給は、いくつかの病態においてその有効性を実証しており、最も興味深い結果は、心血管疾患、肺疾患、およびウイルス性疾患において得られている。
NACは急性心筋梗塞(AMI)で有効であることが確認されている[95]。実際、NACの経口投与は、線溶療法を受けているAMI患者のいくつかの炎症性マーカーのレベルを低下させ、これらの患者の管理を成功させるための治療オプションと判断された。
高血圧患者と糖尿病患者における抗酸化剤の急性降圧効果を調査した研究では、抗酸化剤GSHは、おそらく硝酸酸化物-フリーラジカル相互作用を制御することにより、有意な降圧効果を示したことが明らかになった[96]。
いくつかの慢性肺疾患では、酸化ストレスと病因の相関関係が記述されている。特発性肺線維症(IPF)患者の肺液および血漿中のGSHレベルが著しく低下していることが報告されている。数多くの研究で、様々な抗酸化物質の投与が特発性肺線維症の発症を予防することが証明されているが、中でもGSH前駆体であるNACの有効性を検証する試験では、結果は異なるものの、肺GSHレベルの増強と酸化ストレスの緩和に有効であることが報告されている([97]にレビュー)。多くの研究が COPD 患者において NAC の有益な効果を発見しているが([98]でレビュー)、疾患の重症度を軽減する NAC の有効性は、GSH 前駆体としての機能よりも NAC の粘液分解活性に起因するとされているが [97]。GSHレベルおよびいくつかのGSH依存性酵素の変化も喘息で報告されている [97]。
酸化ストレスのレベルもまた、ウイルスに対する免疫応答において重要である。ウイルス感染時には、細胞内GSHの枯渇は複数のメカニズムによって媒介され、ウイルスの複製に不可欠である[99]。いくつかの試験管内試験(in vitro)および生体内試験(in vivo)の研究で、GSHの投与がウイルスの複製を阻害することが示されているが、現在までのところ、生体内試験(in vivo)での呼吸器ウイルス感染症におけるNACの薬理学的使用を支持する臨床試験は非常に少ない([100]でレビューされている)。GSH治療は有望なアプローチであるが、細胞や組織への輸送が悪いため、治療効果を得るためには高用量のGSHが必要である。GSHの送達は、異なる長さの疎水性鎖を有するいくつかの誘導体、またはNACとs-アセチル-β-メルカプトエチルアミン(MEA)の共役体であるI-152によって改善され、NACおよびMEAを放出し、GSH含有量を増加させることができる[100]。
GSHは肺気腫の治療に局所的に使用されており、実験的証拠の断片は、α-1-プロテイナーゼ阻害剤の活性の酸化的ダウンレギュレーションがグルタチオンによって抑制されたことを実証しており、研究の著者らは、この治療法がCOPDによる急性呼吸器危機のための選択肢として考慮され得ることを示唆している[101]。ネブリングされたGSHの以前の臨床試験では、1日2回600mgまでのバイオアベイラビリティと安全性が実証されている[101]。現在、COVID-19における活性酸素産生の増加が有力な仮説であるため、このアプローチはこの場合にも適している可能性がある。
GSHは、私たちの体内でより代表的な分子の一つである:その濃度は2〜5 mMであり、そのような血液中のグルコース(5 mM)や細胞内ATP(5〜10 mM)などの非常に豊富な分子種に匹敵する。平均2.5mMのGSH(約750mg/L)を持つ40kgの組織を想定すると、全身に30gのGSHがあることになる。GSHの半減期は48時間で、その寿命は約10日であり、組織は1日に3gのGSHを失うことになるので、完全に補充するための食事のサポートは、1日に約1.5gのグルタミン酸、0.75gのグリシン、1.20gのシステイン(N-アセチル-l-システイン、NACと仮定した場合は1.63g)である。体内GSH濃度は、グルタミン酸の体内利用可能性が通常制限されていないので、GSH、またはGSHのアミノ酸成分で濃縮されたタンパク質、または2つの制限アミノ酸であるシステインとグリシンの補充のいずれかの経口摂取で増加させることができる。GSHの経口投与は、システインとグリシンのサプリメントよりも高価であり、その全身的なバイオアベイラビリティは、腸内での分解のために不良である可能性がある;したがって、大規模な集団での使用のためのその適合性は限られている可能性がある。興味深いことに、症例報告研究では、グルタチオンの2000mgの経口投与と静脈内注射の両方の反復使用がCOVID-19の重篤な呼吸器症状の緩和に有効であったことが示されており、COVID-19に対するこの抗酸化療法の有効性が初めて示されている[102]。
グルタチオン前駆体であるシステインおよびグリシンを適切な条件で食事に補充すると、グルタチオンの合成および濃度が完全に回復する。いくつかの観察では、老化や低GSH濃度に関連する疾患における酸化ストレスを減少させるためのこの実用的かつ効果的なアプローチをサポートしている[103]。高齢者の被験者は、若年者の対照群と比較して、GSHの赤血球濃度が著しく低い(53%)ことが実証された。0.81 mmol システイン(132 mg NAC)-kg-1-d-1 と 1.33 mmol グリシン(100 mg)-kg-1-d-1 を 14 日間経口投与したところ、高齢者の GSH 濃度は若年対照者の GSH 濃度に達した[103]。
現在、N-アセチルシステインとグリシンの併用による効果を評価する臨床試験が5件行われている(https://clinicaltrials.gov/)。
NACは過去に気管支炎の治療薬として主に使用されていた。13の研究と合計4155人のCOPD患者を評価したメタアナリシスでは、1日あたり1200ミリグラムのN-アセチルシステインの標準用量は、プラセボと比較して発作(増悪として知られる)の発生率と重症度を減少させると結論づけられている[104]。NACがGSH生合成の基質の一つであることを考慮すると、グリシンの化学量論的用量は約1000mg(正確には938mg)であるべきである。この量は、ほぼ健康な人の一日のターンオーバーに対応しており、予防的または治療的アプローチのいずれかのために、副作用のない合理的な用量と思われる。
7. 結論
概要は、SARS-CoV-2がACE2のダウンレギュレーションを介して肺のレニン-アンジオテンシン系の高活性のバランスを崩すことができる方法を説明し、フリーラジカル媒介炎症に続いて、GSHの保護的役割を明らかにした;COVID-19疾患に対するこの生化学的アプローチは、関与する分子メカニズムを理解することを目的としたさらなる調査のための新しい道を開く。
我々の生化学的解析で報告されたいくつかの証拠は、GSHの低レベルが重度のCOVID-19症状に関連した過剰な炎症反応の主な原因の一つである可能性を示唆しており、体内GSHを増加させることで症状のある患者の数を減らすことができることを示唆している。COVID-19患者のGSHレベルを調査する将来の臨床研究が、この可能性を探る出発点となるかもしれない。

