Contents
唾液腺におけるFURIN遺伝子発現は唾液を介したSARS-CoV-2感染と関係があるのか?
jcp.bmj.com/content/early/2020/07/12/jclinpath-2020-206788
dx.doi.org/10.1136/jclinpath-2020-206788
SARS-CoV-2 の宿主細胞への侵入機構の解明は世界中の研究者の努力を必要としており、アンジオテンシン変換酵素2(ACE2)が主要な受容体として認識されているものの、多くの課題が残されている1。
驚くべきことに、ACE2とウイルスの侵入に必要なSARS-CoV-2のスパイク(S)グリコシル化タンパク質との相互作用が、結晶学的手法を用いて発見された。Sタンパク質には受容体結合ドメイン(RBD)、より具体的には受容体結合モチーフ(RBM)が存在し、ACE2表面の2つのウイルス結合ホットスポットへの接着を仲介している。SARS-CoV-2 RBMのアミノ酸構造はSARS-CoVと非常に相同性が高いが、いくつかの違いがあり、特に482-485位の4残基モチーフ(Gly-Val-Glu-Gly)がACE2との親和性を高め、2つの分子の間に緊密な関係をもたらしている2。
しかし、三量体のクラスI融合タンパク質であるSタンパク質は、転移可能なプレフュージョン構造に維持されており、RBDは大部分が横たわった状態にあり、受容体にアクセスできない状態にあり、免疫の逃避を容易にしている。
最近の研究では、SARS-CoV-2が宿主細胞に侵入するために他の分子戦略が利用されていることが明らかになり、その高い感染力の理由が明らかになった。興味深いことに、Shangらは、膜貫通型プロテアーゼ、セリン2(TMPRSS2)、カテプシンとの相乗効果により、フーリンによるウイルスの事前活性化が可能であることを報告している4。
フーリンは、プロ蛋白質変換酵素ファミリーの一員であり、その構成要素は様々な蛋白質の調節を媒介している。フーリンは、細菌の毒素やウイルス分子として、内因性と外因性の両方の異なる基質を切断することができる; したがって、それはコロナウイルスによって引き起こされるものを含む多くの感染症に関与している5。
FURINの発現はむしろユビキタスであるが、異なるアイソフォームの組み合わせは、ヒト組織で見つけることができる。
注目すべきことに、FURIN遺伝子は、3つの異なる代替転写開始部位と8つのFURINアイソフォームを生成する3つのプロモーター(P1、P1A、P1B)を提示する。興味深いことに、P1AおよびP1Bは、構成的ハウスキーピング遺伝子のものと類似しているが、P1は、IFN-γ、TGF-βおよびIL12としてサイトカインによって刺激されることができる。フーリンは翻訳後修飾され、開裂により活性化され、エンドソームやゴルジ網を介して細胞内だけでなく、細胞膜レベルでも局在し、細胞外環境でも分泌される5。
ここでは、Human Protein Atlas (HPA)6、Genotype-Tissue Expression GTEx7、Functional Annotation of Mammalian Genomes 5 (FANTOM5)8という異なるオンラインリポジトリを用いて、異なるヒト組織におけるFURIN遺伝子の発現を調査している。
まず、先に述べた3つのリポジトリから生成されたコンセンサスデータセットを調べた。FURINはほとんどが唾液腺レベルで発現しており(337 NX=normalised expression)、腺細胞による高いタンパク質産生と相関している6。
この知見に基づいて、我々は、唾液腺におけるFURINの発現パターンをさらに探求するために、3つのデータセットに単独で焦点を当てた。
HPAは、FURINが主に唾液腺で産生されていることを示している(1キロベース百万分の141.1百万転写物);具体的には、45%~55%が腺細胞、15%~25%が管腔細胞、5%が脂肪細胞、5%が内皮細胞であり、また、20%が未同定細胞型で転写されていることを示している6(https://www.proteinatlas.org/about/assays+注釈)。
これらの観察は、唾液腺がACE2とTMPRSS2に加えて高レベルのFURINを発現していることから、唾液腺がSARS-CoV-2の重要な標的である可能性が高いことを指摘している10。
注目すべきことに、フーリン切断部位の出現は、高病原性鳥インフルエンザAウイルス(HPAIV)のような他のウイルスの病原性の劇的な増加にリンクしている。HPAIVは、低病原性インフルエンザAウイルスに関して、細胞膜へのウイルス結合および融合を可能にするために切断されるべきインフルエンザAウイルスヘマグルチニン(HA)に、より多くのフーリン部位を宿している。
さらに、別のウイルスであるヒト乳頭腫ウイルス(HPV)を考えると、標的細胞内のHPV L2タンパク質に対するフーリンの作用は、ウイルスの宿主への侵入を可能にするために極めて重要である。フーリンの細胞内活性はHIV-1感染にも重要であり、実際、フーリンモチーフはウイルスのエンベロープタンパク質にも存在し、その前駆体gp160はフーリンによって処理され、ウイルスの組み立て前にgp120とgp41を収容している。
フーリンの切断パターンは、鳥感染性気管支炎ウイルス、マウス肝炎ウイルス5、MERSなどの他のコロナウイルスのSタンパク質で観察されたが、SARS-CoVでは観察されなかった12。これらの観察結果は、SARS-CoV-2の高い透過性は、フーリンが全身、特に呼吸器系で強く発現しており、ACE2やTMPRSS2と共局在していることにも依存していることを示唆していると考えられる5。
SARS-CoV-2 RNA は唾液中で発見され、その結果、コロナウイルス疾患 2019 (COVID-19) を評価するための可能な診断生物学的流体であり、さらに、驚くべきことに、唾液腺管から直接引き出された唾液は、重篤な疾患と相関している,13
私たちのin silicoの所見も示したように、おそらくフーリンによって促進される粘膜バリアを介してウイルスの浸潤性を示唆している。また、唾液中のフーリンの存在は、ウイルスの事前活性化を役立てることができるので、くしゃみや咳を介してそれらよりもより多くの感染性のウイルスの唾液滴を介して迅速な拡散を支持している(図1)。
唾液腺は、COVID-19の無症候性感染を広める上で重要な役割を果たしているか?
我々は、公開データベースを用いた唾液腺におけるアンジオテンシン変換酵素2(ACE2)および膜貫通型セリンプロテアーゼ2(TMPRSS2)の発現の評価に関するSongらの論文1を大変興味深く読んだ。
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によるコロナウイルス疾患2019(COVID-19)2の急速な普及を促進するために、未診断の感染が報告された。SARS-CoV-2は、細胞の侵入とプライミングのためにACE2とTMPRSS2に依存している3.
唾液腺でACE2とTMPRSS2が発現していることが明らかになった。このことから、ウイルスは唾液腺に侵入している可能性があると考えられます。これを裏付けるように、他の通信5 では、ACE2 と TMPRSS2 は唾液腺でわずかに発現していることが確認されています。
Song et al.1,1 Xu et al.4,Pascolo et al.5によるデータベース(Genotype-issue Expression portal and Human Protein Atlas repository)での解析は、SARSCoV-2による唾液腺感染の仮説を補強するものとして有効である6。
私たちの知る限りでは、利用可能な出版物の数が多いことに加えて、文献には、SARS-CoV-2による唾液腺感染の文脈でこの情報がまだ不足している。 唾液はSARS-CoV-2検出のための重要な生物学的流体であるにもかかわらず、唾液中のウイルスのソースは、ほとんどの研究ではまだ完全に調査されていない。
Chenら6は、COVID-19患者の31人の確定症例の顎下唾液腺管から直接唾液を採取した。興味深いことに、SARS-CoV-2の発現は4人の患者(12.90%)にのみ認められ、重症例(3/4)で高かった。このことから、唾液腺から直接来るSARS-CoV-2は、疾患の後期段階での高ウイルス負荷によるものである可能性が示唆され6、軽度、限定的、または症状のない個体からのものではないことが示唆された。
歯科診療が、患者の気道との密接な接触やエアロゾル生成手順の実施により、SARS-CoV-2感染のリスクを高めることが広く報告されている10-12。
13,14 いくつかの歯科医療施設では、緊急および緊急治療への予約が閉鎖されたり、制限されたりした。15-17 軽度で限定された無症状の感染は、自覚症状を伴わない個人からの感染であることが広く報告されている。
口腔ケアの維持は重要な問題であり、注意と適切な対策が必要である23 。口腔内のウイルス負荷を軽減するための予防対策を歯科医療の場で採用することは、COVID-19感染時の無症候性患者の選択的治療に役立つ可能性がある。
COVID-19の病態生理はまだ十分に解明されていないため、COVID-19の無症候性感染症や感染経路における唾液腺の真の役割を理解するための研究が必要である。
唾液腺 COVID-19無症候性感染症の潜在的な貯留層
journals.sagepub.com/doi/10.1177/0022034520918518
コロナウイルス疾患2019(COVID-19)。歯科・口腔医学の新たな展開と今後の課題
コロナウイルス疾患2019(COVID-19)に関する最新の報告書によると、著者らは、無症状の患者が何度も言及されている歯科リスクに注目していた(Meng et al 2020)。
以前、研究者らは、COVID-19感染における口腔粘膜の役割を示した(Xu, Zhong, et al. 無症候性感染症のパンデミック過程における唾液腺に注目したい。
ACE2はCOVID-19の重要な受容体である(Xu, Chen, et al. 2020)。重症急性呼吸器症候群コロナウイルス(SARS-CoV)に関する先行研究では、ACE2の発現が高い唾液腺上皮細胞が感染していた(Liu et al. GTExポータル(https://www.gtexportal.org/home/gene/ACE2#geneExpression)でヒト臓器におけるACE2の発現を解析した。
小唾液腺におけるACE2の発現は肺よりも高かった(肺培地PTM [transcripts per kilobase of exonmodel per Million mapped reads] = 1.010、小唾液腺培地PTM = 2.013)ことから、唾液腺がCOVID-19の標的となりうる可能性が示唆された。
さらに、SARS-CoV RNAは、肺病変が現れる前に唾液中で検出され得る(Wang et al 2004)。これは、無症状感染の存在を説明することができるかもしれない。
SARS-CoVについては、唾液腺は唾液中のウイルスの主要な供給源であり得る(Liu et al. 患者の唾液中のCOVID-19の陽性率は91.7%に達することがあり、唾液サンプルは生きたウイルスを培養することもできる。
このことから、無症候性感染によって感染するCOVID-19は、感染した唾液に由来する可能性が示唆されている。したがって、無症候性感染の原因は唾液腺からである可能性がある。唾液だけでの感染性の可能性を無視してはならない。
TMPRSS2とfurinは共にヒト気道細胞におけるSARS-CoV-2のタンパク質分解活性化に必須である
TMPRSS2 and furin are both essential for proteolytic activation of SARS-CoV-2 in human airway cells
www.life-science-alliance.org/content/3/9/e202000786
要旨
新規に出現したSARS-CoV-2は、世界中に急速に広がり、呼吸器系の急性感染症(COVID-19)を引き起こし、重症化や致死率の高い疾患を引き起こす可能性がある。SARS-CoV-2が細胞内に侵入するためには、その表面糖タンパク質スパイク(S)が宿主細胞のプロテアーゼによって2つの異なる部位で切断される必要があり、そのため、創薬標的となる可能性がある。
本研究では、S1/S2部位ではプロ蛋白質変換酵素フーリン、S2′部位では膜貫通型セリンプロテアーゼ2(TMPRSS2)によってSが切断されることを示した。我々は、TMPRSS2の発現をアンチセンスでノックダウンすることにより、TMPRSS2がCalu-3ヒト気道上皮細胞におけるSARS-CoV-2 Sの活性化に必須であることを明らかにした。
さらに、ヒト気道上皮細胞では、合成フーリン阻害剤MI-1851によりSARS-CoV-2の複製が強く阻害された。対照的に、E64dによるエンドソームカテプシンの阻害はウイルスの複製に影響を与えなかった。
様々なTMPRSS2阻害剤とフーリン阻害剤MI-1851を組み合わせることで,SARS-CoV-2に対する抗ウイルス活性は,等モル量のセリンプロテアーゼ阻害剤を用いた場合よりも高いものとなった.したがって、このアプローチはCOVID-19の治療に大きな可能性を秘めていると考えられる。
序論
2019年12月、新しいコロナウイルス(CoV)が出現し、世界中に急速に広がり、これらのウイルスではかつて観測されなかったパンデミックを引き起こしている。このウイルスは、2002年の重症急性呼吸器症候群(SARS)-CoVも含むベータコロナウイルス属の系統bの新たなメンバーであることが確認され、世界保健機関(WHO)によりSARS-CoV-2と命名された。このウイルスによる呼吸器疾患は、コロナウイルス疾患2019(COVID-19)に指定された。
CoVsは、ニドウイルス目(Nidovirales)に属するエンベロープ型一本鎖ポジティブセンスRNAウイルスの大家族であり、幅広い哺乳類や鳥類に感染し、呼吸器疾患や腸管疾患を引き起こす。CoVは、主要な表面タンパク質であるスパイク(S)タンパク質を有しており、このタンパク質が受容体に結合し、ウイルスの脂質エンベロープと細胞膜との融合によって感染を開始する。他の多くのウイルスの融合タンパク質と同様に、Sタンパク質は細胞プロテアーゼによって活性化される。CoV Sの活性化は、2つの異なる部位、S1/S2およびS2′(図1)でのSのタンパク質分解的切断を必要とする複雑なプロセスであり、非共有結合のままのサブユニットS1およびS2を生成する(1、2、3)。S1サブユニットは受容体結合ドメインを含みますが、S2サブユニットは膜に固定されており、融合機構を保持している。疎水性融合ペプチドのすぐ上流に位置するS2′部位での切断は、Sの膜融合活性を誘発することが提案されている(4, 5)。一方、S1/S2部位でのSの切断の関連性はまだ完全には理解されていない。CoVのSの処理は、S1/S2部位での開裂が最初に起こり、その後S2′での開裂が起こるように、順次起こると考えられている。S1/S2部位での開裂は、受容体の結合および/またはその後のウイルス侵入の段階での宿主プロテアーゼへのS2′部位の暴露に必要とされる構造変化に重要であるかもしれない(参考文献6、7、および8を参照のこと)。
図1.
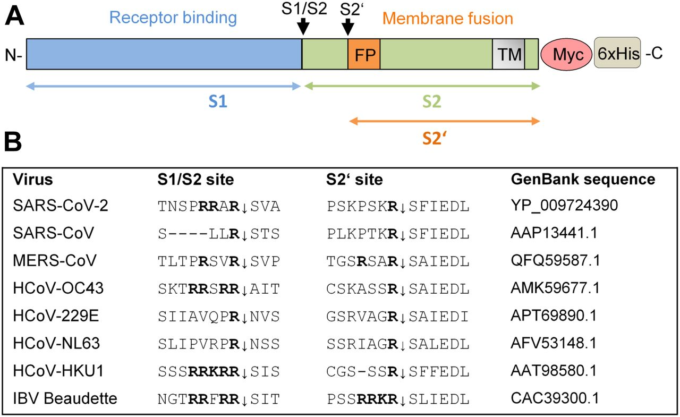
図1. コロナウイルスSタンパク質の切断。
A)SARS-CoV-2前駆体とS1およびS2サブユニットの模式図。融合ペプチド(FP)、および膜貫通ドメイン(TM)を示す。S1/S2およびS2′の開裂部位およびサブユニットS1、S2およびS2′は、それぞれ黒矢印および色付き矢印で示されている。免疫化学的検出のために、組換え体Sは、我々の研究では、C末端融合Myc-6×Hisタグペプチドで発現されている。B)異なるヒトコロナウイルス(HCoV)および鳥感染性気管支炎ウイルス株ボーデットのSタンパク質のS1/S2およびS2′切断部位のアミノ酸配列のアラインメント。
多くのプロテアーゼが試験管内試験(in vitro)でCoVを活性化することが見出されており、その中には、furin、カテプシンL、および膜貫通型セリンプロテアーゼ2(TMPRSS2)、TMPRSS11A、およびTMPRSS11Dなどのトリプシン様セリンプロテアーゼが含まれている(文献6、7、および8でレビューされている)。これらの中でも、TMPRSS2およびfurinは、広範なウイルスのタンパク質分解活性化において主要な役割を果たしている(参考文献9、10、および11でレビュー)。TMPRSS2は、呼吸器、消化管、および泌尿生殖器管の上皮細胞で広く発現しているII型膜貫通型セリンプロテアーゼ(TTSP)である(11、12)。TMPRSS2の生理的な役割はまだ不明であるが、TMPRSS2欠損マウスでは、機能的な冗長性を示唆する明確な表現型が見られない(13)。2006年に我々は、TMPRSS2がヒトインフルエンザAウイルスの表面糖タンパク質HAを切断することを明らかにし、ウイルス活性化プロテアーゼであることを初めて明らかにした(14)。その後、TMPRSS2は、ヒトメタニューモウイルス、ヒトパラインフルエンザウイルス、およびSARS-CoVや中東呼吸器症候群(MERS)-CoVなどのCoVを含む多くの他の呼吸器ウイルスの融合タンパク質を試験管内試験(in vitro)で活性化することが示された(参考文献8および11)。TMPRSS2は単一のアルギニン残基またはリジン残基(R/K↓)で切断され、いわゆる一塩基切断部位でウイルス融合タンパク質を活性化する。さらに最近の研究では、TMPRSS2欠損マウスが特定のインフルエンザAウイルス株、SARS-CoVおよびMERS-CoVに感染しても、子孫ウイルスのタンパク質分解活性化を阻害し、その結果、気道に沿ってウイルスが拡散するのを阻害するため、病理学的に問題がないことが示された(15, 16, 17, 18)。これらの研究により、TMPRSS2がこれらの呼吸器ウイルスにとって不可欠な宿主細胞因子であることが明らかになり、さらに、ウイルスを活性化する宿主細胞プロテアーゼ、特にTMPRSS2を阻害することが、呼吸器ウイルス感染症を治療するための治療法の開発に有望なアプローチを提供することが実証された。プロ蛋白質変換酵素フーリンは、真核生物の組織および細胞でユビキタスに発現しているタイプI膜貫通型タンパク質である。フーリンは、ホルモン、成長因子、細胞表面受容体、および接着分子を含む広範なタンパク質の前駆体を、分泌経路に沿って輸送中に、好ましいコンセンサス配列R-X-R/K-R↓の多塩基モチーフで切断する(参考文献10)。さらに、フーリンは、高病原性鳥インフルエンザAウイルス(HPAIV)、HIV、エボラウイルス、麻疹ウイルス、黄熱病ウイルスを含む広範なウイルス、および滋賀毒素や炭疽菌毒素のような細菌毒素の多塩基モチーフでの融合タンパク質の活性化プロテアーゼとして同定されている(文献9、10、および19を参照)。塩基性アミノ酸の挿入による多塩基性開裂部位の獲得は、家禽における鳥インフルエンザAウイルスの病原性の主要な決定因子であることが長い間知られてきた。フーリンによるHPAIVの表面糖タンパク質HAの活性化は、感染の全身的な広がりをサポートし、しばしば致死的な結果をもたらす。一方,低病原性鳥インフルエンザAウイルス(LPAIV)のHAは,トリプシン様セリンプロテアーゼによって一塩基性の切断部位で活性化される.適切なプロテアーゼは鳥類の呼吸器や腸管にのみ発現しており、これらの組織への感染拡大を制限していると考えられている。
最近の研究では、TMPRSS2がSARS-CoV-2 Sタンパク質の活性化にも関与していることが示されている(20、21)。ベロ細胞におけるTMPRSS2の一過性の発現は、カテプシンに依存しないSARS-CoV-2偽型の侵入をサポートしている。さらに、ヒトCaco-2結腸細胞およびヒト気道細胞を、TMPRSS2活性を阻害することができる広範な阻害剤であるカモスタットメシル酸塩で前処理すると、SARS-CoV-2およびSARS-CoV-2 Sタンパク質を含む水胞性口内炎ウイルス疑似型の侵入が著しく減少した。このことから、トリプシン様セリンプロテアーゼがSARS-CoV-2の細胞内への侵入に重要であることが示唆された。しかしながら、SARS-CoV-2 Sタンパク質の配列解析は、フーリンもS処理に関与している可能性があることを示唆している(図1B;(22、23))。SARS-CoV-2 Sタンパク質のS1/S2部位は、SARS-CoVのSタンパク質とは対照的に、最小限のフーリン切断部位(R-R-A-R685↓)を提供する4つのアミノ酸の挿入を含む。代わりに、SARS-CoV-2のS2′切断部位は、SARS-CoVと同様に、Sタンパク質は、トリプシン様セリンプロテアーゼによって認識される単一のKRセグメント(KR815↓)と対をなす二塩基モチーフを有する。
本研究では、SARS-CoV-2のSタンパク質がTMPRSS2とfurinによって活性化されることを明らかにした。また、両プロテアーゼに対する阻害剤がヒト気道上皮細胞におけるウイルス複製を強力に抑制し、両タイプの阻害剤の組み合わせが相乗的にウイルスを減少させる効果をもたらすことを示す。これらの結果は、このアプローチがCOVID-19の治療に大きな可能性を秘めていることを示している。
結果
原文参照
議論
CoV Sのタンパク質分解処理は、2つの異なる部位での開裂を必要とする複雑なプロセスであり、まだ完全には理解されていない。S1/S2およびS2′切断部位のアミノ酸配列はCoV間で異なっており(図1B)、異なるプロテアーゼが異なるCoVの活性化に関与している可能性を示唆している。SARS-CoV-2の出現したSタンパク質の配列解析は、S1/S2部位のR-R-A-Rモチーフがフーリンによる切断に敏感である可能性を示唆しているのに対し、S2′部位は、TMPRSS2のようなトリプシン様セリンプロテアーゼによって切断され得る単一のR残基を含んでいることを示唆している(20, 22, 23)。
本研究では、SARS-CoV-2 Sタンパク質がfurinおよびTMPRSS2によって切断されることを実証する。さらに、TMPRSS2とfurinの活性を阻害することで、ヒト気道細胞におけるSARS-CoV-2の多サイクル複製が強力に抑制されることを示した。我々のデータは、furinがS1/S2部位で切断するのに対し、TMPRSS2はS2′部位で切断することを示している。また、SARS-CoV-2のP6-P3′セグメントに由来する様々なFRET基質の開裂率を比較することにより、furinがS1/S2部位を効率的に処理することを確認した。
その結果、4-mer PRRAの挿入により、SARS-CoV-2のS部分には、IBV CoVの配列と同様にフーリンによる切断に適した部位が存在し、SARS-CoVの類似基質はフーリンによって処理されないことが明らかになった。合成フーリン阻害剤MI-1851によるCalu-3細胞におけるSARS-CoV-2複製の強力な阻害は、さらに、TMPRSS2がS1/S2部位でのフーリン切断を補償していないことを示唆している。
同様に、T-ex5 PPMOを用いたTMPRSS2活性のノックダウン、またはCalu-3細胞をアプロチニン、MI-432およびMI-1900でそれぞれ処理することによるSARS-CoV-2複製の強力な阻害は、S活性化におけるTMPRSS2の欠如をfurinが補うことができないことを示している。これは、SARS-CoV-2 Sタンパク質のS2′切断部位に由来する類似のFRET基質を使用することによってさらに確認された(図S2)。
キネティック測定により、この基質はフーリンによって切断されないことが明らかになった(図S2)。このように、我々は、開裂部位のアミノ酸配列から予想されるように、フーリンがS1/S2部位のみを活性化することを初めて実験的に実証することができた(22, 23)。
これらのデータから、furinとTMPRSS2は異なる部位でSを切断し、両方のプロテアーゼによる切断が、ウイルスの侵入と膜融合を媒介するSタンパク質を活性化するために重要であることがわかった(図6)。Iwata-Yoshikawaら(2019)(18)は、TMPRSS2欠損マウスがSARS-CoVおよびMERS-CoVに感染しても疾患症状を発症しないことを示した。
このデータは、TMPRSS2が、我々および他の人が特定のインフルエンザAウイルス株について観察したものと類似した方法で、これらのCoVの多サイクル複製および拡散に不可欠であることを示した(15、16、17)。しかしながら、TMPRSS2のノックアウトがSARS-CoVおよびMERS-CoVのSタンパク質の両部位、S1/S2およびS2′での切断を妨げるのか、あるいは別のプロテアーゼがSの切断に関与しているのか、我々がここでSARS-CoV-2について観察したのと同様に、別のプロテアーゼがSの切断に関与しているのかどうかは、まだ明らかにされていない。
拡大表示 ・図S2。furinによるSARS-CoV-2 S2′部位の開裂解析。
図6.
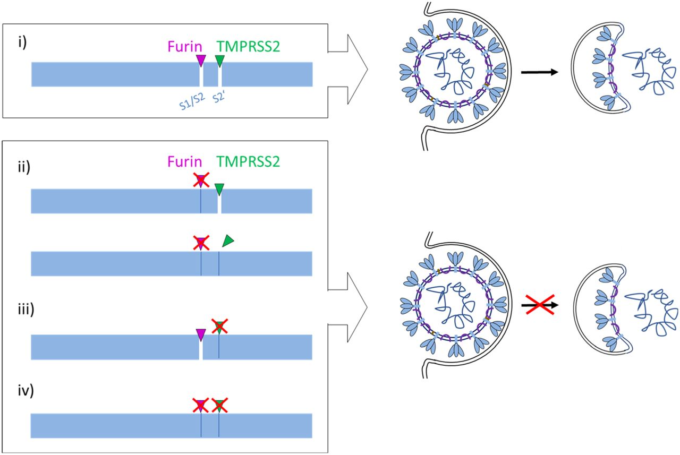
図6.
TMPRSS2およびfurinによるSARS-CoV-2スパイクタンパク質Sの提案された処理。
(i) Sは、ウイルス侵入時にウイルス膜と細胞膜の融合を誘発してウイルスゲノムを宿主細胞に放出するために、2つの部位、S1/S2およびS2′で切断されなければならない。CoV Sの切断は、S1/S2部位での切断が最初に起こり、その後にS2′部位での切断が起こることで、順次起こると考えられている。フーリンはS1/S2部位を処理するのに対し、TMPRSS2はS2′部位で切断し、両方のプロテアーゼは互いに補うことができない。フーリン(ii)またはTMPRSS2(iii)のいずれかを阻害するか、または両方のプロテアーゼ(iv)を同時に阻害すると、Sタンパク質融合体は不活性化され、ウイルスの侵入を防ぐことができる。TMPRSS2の阻害は、S2′サブユニットのN末端における融合ペプチドの露出を防止する(iii、iv)。S1/S2部位でのフーリン切断の阻害は、コンフォメーション変化の立体的遮断により、ウイルスの侵入および膜融合を直接的に阻害する可能性がある(ii、上段のスキーム)、またはS2′部位のTMPRS2への露出を阻害する可能性がある(ii、下段のスキーム)
細胞培養において、CoVは、2つの異なる経路を介して細胞に入ることができる:カテプシンによってSが切断される後期エンドソーム、またはS切断のためにトリプシン様プロテアーゼを使用する細胞表面または初期エンドソームを介して((2、32)参考文献7でレビューされている)。しかしながら、いくつかの最近の研究により、ヒトCoV(HCoV)の臨床分離株は、トリプシン様セリンプロテアーゼによる活性化を達成し、細胞培養において適切なトリプシン様プロテアーゼが存在しない場合にのみ、エンドソームカテプシンを使用することが明らかにされた(33、34)。
このように、カテプシンによる活性化は、細胞培養物中での複数回の通過中にウイルスによって獲得されるメカニズムであるように思われる(34)。相反的に、Zhouら(2015)(35)は、マウスにおけるSARS-CoVの病原性は、トリプシン様セリンプロテアーゼの広範な阻害剤であるカモスタットによって強く阻止されたが、エンドソームカテプシンの阻害剤によっては阻止されなかったことを示した(35)。
ここでは、カテプシンLおよびBも阻害するシステインプロテアーゼ阻害剤E64dがCalu-3細胞におけるSARS-CoV-2複製に影響を与えなかったことを示し、ヒト気道細胞におけるSARS-CoV-2の活性化には、エンドソームカテプシンが分散可能であるか、あるいは全く関与していないことを示している。
ユビキタスに発現するフーリンによって処理され、したがって、感染の全身的な広がりをサポートする多塩基切断部位の存在は、家禽におけるニューカッスル病ウイルスの病原性と同様に、HPAIVの病原性の重要な決定因子であることが長い間知られてきた(参考文献11および36にレビューされている)。IBV株ボーデットのSタンパク質は、S1/S2およびS2′部位に多塩基モチーフを含む(図1B)。IBVはガンマコロナウイルス属に属し、ニワトリの高伝染性急性呼吸器疾患を引き起こす。IBV Sタンパク質のS2′部位でのフーリンによる切断は、ニワトリの神経栄養症と関連している(37)。
相反的に、ここでは、IBVボーデットSタンパク質のS1/S2およびS2′部位のFRET基質は、フーリンによって効率的に切断された(図2BおよびS2B)。しかしながら、S1/S2および/またはS2′部位におけるフーリン切断可能な多塩基モチーフの多サイクル複製、細胞トロピズムおよびHCoVsの病原性に対する寄与は、まだ決定されていない。HCoV-OC43およびHCoV-HKU1は、S1/S2部位にフーリン切断モチーフを有する。一方、2002年SARS-CoV、HCoV-229E、およびHCoV-NL63のSタンパク質は、両方の切断部位に単一のアルギニン残基を有している(図2BおよびS2Aも参照)。
興味深いことに、ヒトに感染した7つのCoVのSタンパク質のうち、SARS-CoV SだけがS1/S2部位の4-mer挿入部を欠いている(図1B;(23))。MERS-CoVのSタンパク質は、S1/S2部位とS2′部位の両方に配列R-X-X-X-Rの二塩基性モチーフを含んでいる。しかしながら、ヒト気道上皮細胞においてMERS-CoVがフーリンによって活性化されるかどうかはまだ議論の余地がある(38, 39, 40, 41)。セリンプロテアーゼmatriptase/ST14のような他のプロテアーゼが関与している可能性があり、また、P1およびP4位置にアルギニンを有する配列を好む。マトリプターゼは、幅広い細胞および組織で発現しており、開裂部位モチーフR-S-S-Rを有するH9N2インフルエンザAウイルスのHAを活性化することが示されている((42)、参考文献11でレビューされている)。
興味深いことに、Parkらによる研究では、S1/S2部位のfurinまたは他のプロタンパク質変換酵素によるMERS-CoV Sの開裂は、ウイルス放出前にウイルス産生細胞で行われ、膜融合の細胞内局在化および新しい細胞へのウイルスの侵入に影響を与え得ることが示されている(43)。S1/S2部位でのMERS-CoVの切断は、ヒト気道細胞の表面または初期エンドソームに存在する宿主プロテアーゼによるS2′部位でのSの後続の切断の前提条件として想定されており、したがって、後期エンドソームでのカテプシンによるSの切断とは無関係にウイルスの侵入を促進する。しかしなが et al 2002年のSARS-CoVを含む他のHCoVは、感染した細胞からSが切断されていない状態で放出されることが報告されている。したがって、S1/S2およびS2′の両部位でのSの切断は、これらのウイルスの侵入の段階で行われなければならない。
本研究は、TMPRSS2およびfurinがCOVID-19の治療のための有望な薬物標的であることを示している。フーリンおよび/またはTMPRSS2阻害剤は、これらのプロテアーゼのいずれかまたは両方を標的とするために、単独でまたは組み合わせて使用され得る。
TMPRSS2阻害剤MI-432およびMI-1900、ならびにフーリン阻害剤MI-1851は、さらなる薬物開発のための有望な化合物を提供する。MI-1900およびMI-1851は、接種菌を除去した後に一度だけ細胞を処理したにもかかわらず、72時間p.i.でもウイルス力価を著しく低下させた。アプロチニンまたはMI-432で処理した細胞では、48時間後にウイルス力価の増加が観察され、72時間後には対照細胞と同様のウイルス力価が観察された。24時間後にプロテアーゼ阻害剤で細胞を追加処理することで、それ以降の時点でのウイルス阻害と増殖の効率的な阻害がサポートされている可能性がある。
これは、今後の研究でより詳細に調査する必要がある。SARS-CoV-2感染症に対する適切な抗ウイルス療法の探索において、他の用途で承認されているプロテアーゼ阻害剤は、COVID-19を治療するための薬物再利用のために有望であるかもしれない。アプロチニンは、ウシ肺から単離された広範なセリンプロテアーゼ阻害剤であり、周術期出血を減少させるための線溶阻害剤として使用されており(参考文献44参照)、細胞培養およびマウスの生体内試験(in vivo)におけるインフルエンザAウイルスの活性化および複製を阻害することが古くから知られている(30)。
臨床試験では、インフルエンザおよびパラインフルエンザ患者におけるエアロゾル化されたアプロチニンの吸入は、副作用を引き起こすことなく症状の持続時間を著しく減少させた(30)。このように、アプロチニンはTMPRSS2の阻害剤であり、COVID-19の治療薬としてのさらなる試験および開発を検討する価値がある。
COVID-19治療のためのもう一つの有望なTMPRSS2阻害剤候補は、幅広いプロテアーゼ阻害剤であるカモスタットメシル酸塩であり、これは膵炎の治療薬として承認されている(45, 46)。カモスタットメシル酸塩は、細胞培養および実験的に感染したマウスにおいて、異なるCoVの複製を効率的に阻害することが示されている(35、47、48)。最近、Hoffmannら(2020)(20)は、ヒトCaco-2結腸細胞およびヒト気道細胞をカモスタットメシル酸塩で前処理すると、SARS-CoV-2およびSARS-CoV-2 Sタンパク質を含む水胞性口内炎ウイルス偽型の侵入が著しく減少することを示した(20)。
しかしながら、これらの化合物はいずれも多数のトリプシン様セリンプロテアーゼを阻害するため、様々な副作用を引き起こす可能性があることに留意すべきである。急性SARS-CoV-2感染時にTMPRSS2活性を特異的に阻害することは、宿主細胞プロテアーゼによるウイルス活性化を阻害することにより、副作用を軽減するための最も有望なアプローチとなるであろう。
TMPRSS2欠損マウスは識別可能な表現型を示さず、宿主の他のプロテアーゼによる機能的冗長性や生理機能の補償を示唆している(13)。残念ながら、これまでのところ、TMPRSS2の結晶構造は存在しないため、構造に基づいた合理的なプロテアーゼ阻害剤の設計は不可能である。しかし、最初の相同性モデルが確立されており、これは将来的に改良されたTMPRSS2阻害剤の開発に役立つかもしれない(49、50 Preprint)。
PPMOは、標的遺伝子発現の高度に選択的な阻害剤である。それらは、標的mRNAの相補的な配列に結合し、翻訳開始またはプレmRNAスプライシングの立体的な阻害によって遺伝子発現に影響を与えることができる。本研究でT-ex5 PPMOの有効性が示されたことから、一般的なmRNA指向のアプローチ、特にPPMOによるTMPRSS2の発現抑制は、さらなる検討に値するものであると考えられる。重要なことに、他の呼吸器ウイルス感染症および疾患の様々な実験動物モデルにおいて、PPMOは、経鼻投与後に肺組織に輸送することができ、ウイルス増殖およびウイルス誘発性病理学の強力な減少をもたらした(51、52、53、54)。
C末端4-アミジノベンジルアミド残基を含む非常に効果的なフーリン阻害剤が近年開発されている。これらの類似体のいくつかは、H5N1インフルエンザAウイルス、チクングニアウイルス、西ナイルウイルスおよびデングー2ウイルス、ムンプスウイルスまたは呼吸器合胞体ウイルスのような多数のフーリン依存性ヒト病原性ウイルスの複製を阻害するために使用されることに成功している(参考文献49、55、および56にレビューされている)。
これまでのところ、これらの阻害剤は、ウイルス感染細胞培養物においてのみ使用されており、動物モデルにおいては使用されていない。しかしながら、それほど強力ではないフーリン阻害剤ヘキサ-D-アルギニンは、マウスおよびラットで使用され、緑膿菌エクソトキシンAおよび炭疽菌毒素血症から保護されてきた(57、58)。したがって、フーリンの多くの生理的機能にもかかわらず、例えばMI-1851または構造的に関連する化合物の吸入処理による気道および肺における特異的なフーリン阻害が、重篤な副反応なしに可能であることが推測され得る。
ここで、TMPRSS2阻害剤アプロチニンまたはMI-432と、フーリン阻害剤MI-1851との組み合わせは、ヒト気道細胞におけるSARS-CoV-2に対する高い抗ウイルス活性を示し、各阻害剤単独での治療と比較して、低用量でのウイルス増殖の強力な減少を支持した。したがって、TMPRSS2およびフーリン阻害剤の組み合わせは、抗ウイルス効果を増強するだけでなく、阻害剤の用量を減少させることを可能にすることにより、薬剤毒性および望ましくない副作用を減少させる可能性がある、SARS-CoV-2感染症の治療のための有望な治療戦略を提供するものである。
特筆すべきことに、TMPRSS2およびfurinの阻害は、同じ標的に作用し、我々のデータは、2つの部位のうちの1つでのS切断の阻害が、不活性なSを含む感染性前駆体ウイルスの産生を減少させることによってSARS-CoV-2複製を抑制するのに十分であることを示しており、したがって、TMPRSS2およびfurin阻害剤の組み合わせは、1つまたは2つの部位でのS切断が阻止されるまで、相乗的に作用し得る。プロテアーゼ阻害剤と抗ウイルス化合物との組み合わせは、より低い薬剤投与量でさらに相乗的な抗ウイルス活性を産生する可能性があり、さらに薬剤耐性ウイルスの発生を排除する可能性があるアプローチを提供する。
TMPRSS2およびフーリン阻害剤とノイラミニダーゼ阻害剤オセルタミビルカルボキシレートとの組み合わせは、それぞれの阻害剤の単独投与と比較して、各阻害剤の濃度が著しく低い場合に、ヒト気道細胞におけるインフルエンザAウイルスの複製を阻害することが示されている(59)。
フーリン阻害剤とオセルタミビルカルボキシレート、抗ウイルス化合物であるリバビリンとファビピラビルをそれぞれ併用することで、H5N1およびH7N1亜型のHPAIVの多サイクル複製を細胞培養物中で効率的にブロックした(60, 61)。このように、プロテアーゼ阻害剤(例えば、アプロチニンまたはカモスタット)と抗ウイルス剤の組み合わせは、COVID-19の治療に有望な戦略を提供し、細胞培養物および動物モデルで試験されるべきである。
要約すると、我々は、TMPRSS2およびfurinが、ヒト気道上皮細胞における新規に出現したSARS-CoV-2の活性化および増殖に必須であり、COVID-19の治療のための有望な創薬標的を提供することを示している。TMPRSS2およびfurinは、広範なウイルスのタンパク質分解活性化に関与することが示されている。
しかしながら、ウイルス感染症の予防および/または治療戦略としての宿主プロテアーゼ阻害剤の開発は、これまでのところほとんど行われていない。我々のデータは、SARS-CoV-2の治療薬としてのプロテアーゼ阻害剤の高い可能性を示し、一般的なウイルス感染症および新興のCoV感染症、特にウイルス感染症の治療のための薬物開発と宿主プロテアーゼ阻害剤の再利用の合理性を強調している。

