Contents
発熱の免疫な感染症へのメカニズム 解熱鎮痛薬の影響
発熱と疾患の関係
pubmed.ncbi.nlm.nih.gov/32450193/
臨床症状は約80%が軽症、15%が中等症~重症、5%が重症である[1-3]。 COVID-19の最も一般的な症状は、発熱、倦怠感、筋肉痛、乾いた咳である[1-3]。
患者によっては、鼻づまり、悪寒、咽頭痛、下痢を示すこともある[1-3]。2020年3月のベルギー暫定ガイドラインでは、入院を必要とする症状のある患者(発熱・呼吸器症状)のみならず、発熱・呼吸器症状のあるすべての医療従事者(医療従事者)のスクリーニングを推奨している[4]。
我々は、発熱を SARS-CoV-2 RT-PCR の陽性の予測因子として使用することの影響を評価した。 1000床の当院の第三次病院の医療従事者を対象に、2020年3月16日から2020年4月24日までの間に実施したSARS-CoV-2のRT-PCRの結果を、臨床症状(発熱、乾いた咳、喉の痛み、息切れからなる呼吸器症状)とともにすべて収集した。
2つの期間を分析した。2020年3月30日以前の第1期では、医療従事者労働者は発熱と呼吸器症状があった場合のみ検査を受けた(ただし、発熱のない医師もいる)、2020年3月30日以降の第2期では、医療従事者が発熱の有無にかかわらず呼吸器症状があった場合に検査を受けた。
我々は合計 536 人の 医療従事者 を対象とした。表1に2つの期間の臨床データをまとめた。第1期には158人の医療従事者がSARS-CoV-2のスクリーニングを受けたが、その中には発熱がないにもかかわらず検査を受けた呼吸器症状のある50人が含まれていた。81人(81/158、51%)の医療従事者がSARS-CoV-2の陽性と判定された(表1)。
陽性と判定された者のうち、60/81人(74%)が発熱を有していた。第2期には、検査を受けた378人の医療従事者のうち、陽性となったのは94/378人(25%)のみであった。
陽性者のうち49/94(52%)が発熱していた。発熱があったのは、第2期に陰性と判定された63/284人(22%)のみであった。最後に、調査した2つの期間で陽性となったのは、発熱症状のない医療従事者のうち66/175人(38%)のみであった。
我々の結果は、発熱が SARS-CoV-2 の RT-PCR の収率にプラスの影響を与えていることを示している。 しかし、検査の基準として発熱を必要とする場合、症状が複合していても、COVID-19陽性例の割合は見逃される。
これは、発熱と呼吸器症状に基づく医療従事者のスクリーニングでは不十分であることを最近明らかにしたChowらによって認められている [5]。このグループでは、悪寒、筋肉痛、コリザ、倦怠感が最も一般的な症状であった。研究者らは、発熱、咳、息切れ、または喉の痛みのみのスクリーニングでは、症状のある医療従事者の17%を見逃した可能性があり、筋痛や悪寒などの基準を追加しても10%を見逃した可能性があると結論付けている [5] 。
これらのデータは、特に在宅介護施設や老人病棟で働く 医療従事者 にとって非常に興味深いものであり、流行が発生すると脆弱な高齢者に壊滅的な影響を及ぼす可能性がある。 また、2つのフェーズ間のRT-PCR陽性率の違いは、3月末にユニバーサルマスクの着用からなる病院での手順が採用されたことにも起因することに注意することが重要である。
それにもかかわらず、我々の結果に示されているように、選択基準として発熱を使用することは、スクリーニングの効率を向上させることにつながっています。このことは、検査材料の不足に直面している地域や、SARS-CoV-2検査戦略の拡大に伴い、低リスクの症状を持つ人を含めた優先的な検査を可能にするために特に重要である。[5]
COVID-19患者の死亡率と体温の相関性
pubmed.ncbi.nlm.nih.gov/32503659/
入院中のCOVID-19患者の大多数に共通する要因の一つは発熱である。熱の上昇の程度は炎症の重症度を反映しているかもしれない。しかし、体温(体温)を潜在的な予後マーカーとして検討した研究は現在のところ発表されていない。
我々は、COVID-19陽性患者の死亡率推定に体温のモニタリングがどのように役立つかを解析しようとした。われわれは、2020年5月3日時点でニューヨーク地域のマウントサイナイおよびその関連病院でCOVID-19が疑われる患者の非同定データベースの体温データを解析した。
合計9417人の患者がRT-PCR検出によりSARS-CoV-2ウイルスに陽性と判定された。体温データが欠落している患者(n = 1802)を除外した後、7614 人の患者が解析に含まれた(表 1)。
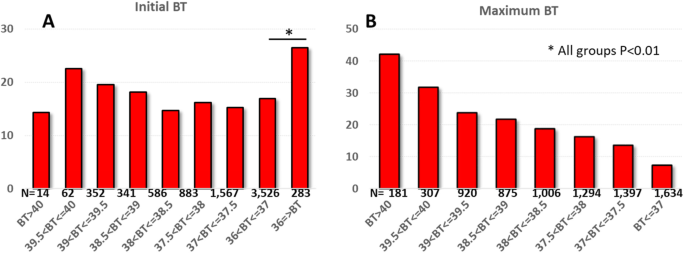
50%の患者は初診時に 体温 > 37 ℃であり、78.5%の患者は疾患の経過中に 体温 > 37 ℃を発症した。
全死亡率は16.9%で、初診時から死亡までの期間の中央値は7日であった。
初診時の体温が高値であっても、死亡率との有意な関連は認められなかった。
重要なのは、体温≦36℃の患者が最も高い死亡率(26.5%、36℃<体温≦37℃との相対的なP=0.003)を示し、体温≦35.5℃の患者(44%)に限定して解析すると、これはさらに高くなり、初診時の低体温が予後不良のマーカーであることを示している。
一方、COVID-19感染時の最大体温は死亡率と有意な相関を示した。体温が0.5℃上昇するごとに死亡率の有意な上昇がみられ、最大体温>40.0℃の患者では死亡率が42%と高かった。
COVID-19患者の体温と死亡率
a 初診時の高体温は死亡率と有意な相関はなかった。
b COVID-19の投与期間中、最大体温が0.5℃上昇するごとに死亡率が有意に増加した(Holms検定)。
我々の結果は、SARS-CoV-2 ウイルス陽性患者の半数のみが初診時に 体温 > 37 ℃を呈していることを示している。しかし、体温上昇は一般的であり、SARS-CoV-2感染の過程で最高体温が高いことは予後不良の重要な前兆であった。
実際、最高体温が39.5℃以上に達した患者の3人に1人が死亡した。これは、体温が37℃を超えなかった患者と比較して死亡率が約5倍に増加した。対照的に、最初に低体温(35.5℃未満)を呈した患者のほぼ半数が死亡した。
したがって、我々の結果は、COVID 19病期における体温のコントロール不良は予後不良のマーカーであり、体温は容易に得られる予後指標として使用できることを示唆している。重症COVID-19患者の高熱をコントロールすることで炎症反応が緩和され、予後が改善されるかどうかは不明である。
SARS-CoV-2の体温と宿主種の嗜好性
Body temperature and host species preferences of SARS-CoV-2
pubmed.ncbi.nlm.nih.gov/32688067/
SARS-CoV-2の人獣共通感染症レパートリーについては、現在のところ不明な点がある。
Shiらは、猫は感受性が高いことを観察した。
犬とフェレットは中間的な脆弱性を示している。
この病原体は豚、鶏、アヒルでは感染も複製もしなかった[1]。
これらのデータは、この病原体の優性種が体温に関係している可能性を強く示唆している。好ましい宿主であるヒトやネコの平均体温は、体温が39℃から42℃の間にあるブタやニワトリ、アヒルなどの抵抗性の高い宿主の平均体温よりも低い(表1)。
同様のパターンは、疑われる宿主である東南アジアのコウモリ、チャイニーズ・パンゴリン、マスクド・パームド・シベット(Paguma larvata)でも観察されており、いずれも体温のヘテロ・ホメオ温度は控えめである(表1)。
コウモリは体温のかなりの日周変動と季節変動を示しているが、特に冬眠や冬眠の期間中に急激な低下を示している。これは、それらをウイルスの貯蔵庫として動作するようにidonaous宿主をレンダリングすることができる。また、Shiらは、SARS-CoV-2感染性ウイルスは上気道でのみ分離され、接種後の他の内臓では分離されなかったと報告している[1]。
さらに、ウイルスは上気道でしか複製できなかった。これは、ドッキングACE2酵素受容体がフェレットの気道と肺全体に存在するという事実とは関係ない。実際、ex vivoではSARS-CoV-2はフェレットの気管支細胞に結合した[1]。
フェレットの体温は、好ましい宿主であるヒトや猫の体温よりも高く、豚やアヒルの体温よりも低いということは注目に値する(表1)。明らかに上気道は体温よりも低い温度にあり、上気道のSARS-CoV-2の素因を説明する可能性がある。
ヨーロピアンミンクもまた、SARS-CoV-2に脆弱であることが判明しており、オランダの2つのミンク農場では、このウイルスのために動物が大幅に減少していることが確認されている[2]。驚くべきことに、ヨーロピアンミンクの体温は36.2℃から38.4℃の間で記録されている(表1)。
このSARS-CoV-2の体温現象をさらに裏付けるものとして、ウイルスは先祖代々のSARS-CoV-1よりも非常に温度に弱いことが示されている。
Ouらは、ACE2との結合に関与するSARS-CoV-2のS表面タンパク質が特に温度感受性が高く、37.5℃C3以上になると活性が急激に低下することを示した。
興味深いことに、Wanらは、ブタ、フェレット、ネコのACE2が「重要なウイルス結合残基」においてヒトのACE2と同一または非常に類似していることを発見した[4]。
しかし、Shiらは、ネコだけが明確な宿主であることを示した。豚のACE2は猫やフェレットのACE2よりもヒトのACE2との相同性が高いが、後者の2つだけが宿主であることが示されている[1,4]。
さらに、ネコとフェレットのACEはウイルス結合残基が同一であるにもかかわらず、ネコは寛容な宿主であり、フェレットは部分的にしか脆弱である。したがって、SARS-CoV-2の種親和性はACE2の形態のみでは説明できない。SARS-CoV-2の温度耐性は免疫回避に関係している可能性がある。
Ouらは、SARS-CoV1と2のSタンパク質は37℃でも失活することを示した[3]。SARS-CoV-2のSタンパク質は、SARS-CoV-1のSタンパク質に比べて、この失活の影響を受けやすかった。SARS-CoV-2のSタンパク質は、変性する前のこれらの温度で血中にわずかに存在しているため、宿主が包括的な免疫反応を起こすのを妨げている可能性がある。
あるいは、熱分解によって変化したSタンパク質への血清転換が起こり、それによって準デコイ抗原となる可能性もある。

証拠は、SARS-CoV-2に対する初期の免疫反応というよりはむしろ不協和音の免疫反応を示唆しており、潜在的にスパイク蛋白質の温度に対する脆弱性によって切り捨てられている可能性がある。
要約すると、SARS-CoV-2のSタンパク質の温度脆弱性は宿主のレパートリーを制限する可能性があるが、同様に病原体の宿主免疫への曝露を切り捨て、一次免疫に関与する細胞および分子イベントの増幅的な連鎖を抑制する可能性がある。
NSAID
COVID-19とNSAIDS:既知と未知のナラティブレビュー
pubmed.ncbi.nlm.nih.gov/32447629/
NSAID ナプロキセン
COVID-19の管理における非ステロイド性抗炎症薬; 現在の証拠に関する系統的レビュー
pubmed.ncbi.nlm.nih.gov/32460369/
MERSとSARS中東呼吸器症候群(MERS)と重症急性呼吸器症候群(SARS)患者の管理におけるNSAIDs処方の有効性と安全性を評価することを目的とした臨床試験はなかった。その結果、COVID-19、SARS、MERSを対象とした臨床試験は実施されていないことが示された。ライノウイルスについては、イブプロフェンとナプロキセンが風邪症状のコントロールに好影響を与えるだけでなく、重篤な副作用を引き起こさないことが3つの研究で報告されている。
また、インフルエンザによる肺炎に対するクラリスロマイシン、ナプロキセン、オセルタミビルの併用療法の効果を評価した臨床試験では、死亡率や入院期間の減少につながることが示されている。
最近の症例報告では、イブプロフェンの処方がCOVID-19患者4名の症状を悪化させたことが明らかになり、摂取しないことが推奨されている(5)。さらに調査のため、本研究の研究者はCOVID-19患者の治療に関する既存の報告をすべて評価した結果、1件の臨床試験(4)と12件の症例報告・症例シリーズ研究(1, 3, 20-34)を発見した。これらの研究では、NSAIDsの処方についての言及はなかった。これは、NSAIDが処方されていないことによるものかもしれないが、これは非常に可能性が低いだ。
ナプロキセン
今回のシステマティックレビューのために検索した結果、SARSおよびMERS患者におけるNSAIDsの使用に関する臨床試験は実施されていない。インフルエンザA型(H3 N2)を対象とした試験は1件のみであり、ナプロキセンの軽度から中等度の有効性が報告されている。COVID-19は他のウイルスとは病態や感染経路が異なり、SARSやMERS等の同系統のウイルスであっても有意差を示すことから、他のウイルスを対象とした研究結果はCOVID-19には一般化できない可能性がある。
また、COVID-19でイブプロフェンを使用しないことを推奨する症例報告が最近発表されており、、NSAIDsは注意して使用すべきである。 ナプロキセンは、患者の発熱をコントロールするためのイブプロフェンの適切な代用品となり得る。
本研究に含まれる臨床試験では、ナプロキセンはウイルス性呼吸器感染症のコントロールに有効で安全な薬剤であることが判明した。さらに、ナプロキセンの抗ウイルス性を示す前臨床試験の証拠がある。 例えば、Zhengらは、インフルエンザを発症したマウスにおいて、ナプロキセンが幅広い抗ウイルス効果を示すことを示している(8)。
ナプロキセンは核タンパク質のRNAへの結合を阻害し、その結果、ウイルスの複製を阻害する(35)。 COVID-19はRNAウイルスであることから、ナプロキセンはCOVID-19感染による発熱の治療に適していると考えられる。結論COVID-19,SARS,MERS感染症におけるNSAIDsの有効性と安全性を評価することを目的とした臨床試験は行われていないことが示された。
Accepted ArticleThis article is protected by copyright. ライノウイルスやA型インフルエンザを対象とした臨床試験が行われており,呼吸器感染症の管理に安全かつ有効な治療薬としてナプロキセンが導入されている。 既存のエビデンスに基づき、NSAIDsはインフルエンザやライノウイルスによる呼吸器感染症の治療に有効であるとされているが、COVID-19を対象とした臨床試験がなく、症例報告や臨床経験からCOVID-19患者の治療期間の延長や臨床経過の悪化が示唆されていることから、発熱や炎症のコントロールにはアセトアミノフェンなどの代替品を使用し、十分なエビデンスが得られるまではNSAIDsのCOVID-19患者の管理には慎重になることが推奨されている。
COVID-19患者で臨床試験を行う場合には、ナプロキセンが良い候補となりうる。
イブプロフェン
COVID-19患者におけるイブプロフェンの使用と臨床成績
pubmed.ncbi.nlm.nih.gov/32535147/
本研究には、年齢中央値45歳のCOVID-19の確定症例403例が含まれていた。コホート全体のうち、44例(11%)が呼吸器サポートを必要とし、12例(3%)が死亡した。197人(44%)の患者が発熱し、32%がパラセタモール、22%がイブプロフェンを症状緩和のために使用していた。
イブプロフェン群では3名(3.4%)の患者が死亡したが,非イブプロフェン群では9名(2.8%)の患者が死亡した(P=0.95).イブプロフェン群では9例(10.3%)が呼吸補助を必要とし、非イブプロフェン群では35例(11%)が死亡した(P=1)。パラセタモールの排他的使用者と比較した場合、イブプロフェンを使用している患者では死亡率や呼吸器サポートの必要性に差は認められなかった。
結論。COVID-19患者のこのコホートにおいて、イブプロフェンの使用は、パラセタモールまたは解熱剤を使用しない場合と比較して、臨床転帰の悪化とは関連していなかった。
レビュー記事 COVID-19と頭痛医療
headachejournal.onlinelibrary.wiley.com/doi/full/10.1111/head.13903
非ステロイド性抗炎症薬(NSAID)とコルチコステロイドの使用に関するナラティブレビュー
専門家の意見やメディアを通じて公表された逸話的証拠に基づき、最近ではNSAIDsがCOVID-19感染症の症状を悪化させるのではないかという懸念が提起されている6,17。イブプロフェンなどのNSAIDsがCOVID-19感染者の臨床転帰を悪化させているかもしれないという懸念は、フランスの保健大臣オリヴィエ・ベラン氏のツイートをきっかけに国際的な議論の話題となった18 。
英国医学雑誌(BMJ)のウェブサイトに掲載された非査読のニュース記事は、臨床医にイブプロフェンの使用を警告し、その後、多くの編集者への書簡を発表した。6 BMJのその後の非査読版の論説では、基礎となる呼吸器感染症の文脈でNSAIDsの使用に遭遇した潜在的な危害の証拠を引用しているが、NSAIDsの断続的な使用はCOVID-19患者にとって有用であるかもしれないと結論づけている19。
20 疾病管理センター(CDC)は、NSAIDsの使用とCOVID-19患者の臨床成績の悪化との間には関連性がないと述べている。
11 最近では、NIHは、COVIDの抗解熱効果についてNSAIDsとアセトアミノフェンの使用に違いはないと述べている1912 疼痛管理のコミュニティは、NSAIDsの使用が感染症の初期徴候を覆い隠す可能性があると述べる以外に、慢性疼痛状態に対するNSAIDsの使用について決定的な勧告を行っていない。
4 Month 2020 重度のウイルス性疾患における非ステロイド性抗炎症薬の理論的なリスクとしては、腎血流の低下による肺水腫のリスクの増加、高血圧や高ナトリウム血症の原因となる腎血流の低下、感染症の最初の兆候の隠蔽、ウイルスの複製を永続させる可能性のある体温の低下などが挙げられる。
ウイルス性または細菌性の下気道感染症の前または最中にNSAIDsを使用すると、複雑な肺炎、胸水、長引く病気、腹膜膿瘍、感染または膿瘍の広がり、副鼻腔炎、髄膜炎、中耳炎などの合併症の発生率が高くなることを示す弱い証拠がある25,26。
NSAIDsはシクロオキシゲナーゼ-1(COX-1)およびCOX-2を阻害し、それにより好中球のリポキシンおよびレゾルビンの合成を阻害し、その結果、COX-2が動物モデルにおける急性肺損傷の治癒において重要な役割を果たしていることから、炎症の治癒を遅らせたり、損なわせたりすると考えられている19,27。
COVID-19パンデミック時のNSAIDSに関する潜在的な懸念は、SARS-CoV2ウイルスの細胞侵入部位であるACE2のアップレギュレーションにより、感染症に感染するリスクが高まることである28。
28,29 アンジオテンシンII受容体1型ブロッカーを服用している糖尿病患者がイブプロフェンを同時に服用していると、COVID-19感染症に感染するリスクが高まるのではないかという憶測があるが、イブプロフェンとACE2のこの相関関係は糖尿病ラットで評価されたものであり、ヒトでの研究には翻訳されていない。
2003年の重症急性呼吸器症候群(SARS-CoV)パンデミックの原因となったコロナウイルスは、COX-2プロモーターに結合することでプロスタグランジン(PG)産生を増加させた。
SARS-CoVに対するインドメタシンの効果を評価した2006年の犬を対象とした生体内試験(in vivo)試験では、インドメタシンは強力な抗ウイルス活性を有し、ウイルスの複製を阻害することが明らかになった8。
フランスで集中治療室でCOVID-19患者を調査した症例シリーズでは、入院前にNSAIDsを服用していなかった患者9人のうち、死亡した患者の在宅薬リストによると、入院前にNSAIDsを服用していなかったことが明らかになっている。
35 3/27/20に発表されたSARS-コロナウイルスとCOVID-19の両方におけるNSAIDsの使用に関する文献のシステマティックレビューでは、「特にCOVID-19の治療中にイブプロフェンを使用することについての強い証拠や反対の証拠は確認されていない」7 コルチコステロイド。
頭痛医療におけるステロイドの利点には、救急部退院後の重度の急性片頭痛の再発を減らす可能性が含まれている15 。10 NIHもまた、難治性敗血症性ショック12 での低用量コルチコステロイドの使用を除き、COVID-19 の機械的換気または入院患者へのステロイドの使用を推奨しているが、これは Surviving Sepsis Campaign と一致している。
さらに、WHOは、COVID19の喘息や慢性閉塞性肺疾患(COPD)の増悪に対してステロイドを投与してもよいと助言している。
専門家は、慢性疾患のためにコルチゾンやその他のステロイドを服用している人は、医師の助言がある場合を除き、それらを中止すべきではないと推奨している41 。疼痛管理コミュニティは、COVID-19パンデミック中の慢性疼痛に対するステロイドの使用について勧告を行っている。
21 注目すべきことは、以前のSARSCoVのパンデミックを取り巻くいくつかの研究で、ステロイドが炎症反応の点でプラスの結果と関連していることが示されていることである7。中国の武漢で行われた非査読のレトロスペクティブレビューでは、COVID-19患者にメチルプレドニゾロンを5~7日間投与することで、発熱の持続時間と補助酸素の使用が減少し、胸部CT(Computed Tomography)での圧迫部位の改善が見られたと報告されている。
44 武漢の別の大規模なレトロスペクティブレビューでは、急性呼吸窮迫症候群(ARDS)患者はメチルプレドニゾロンによる治療を受ける可能性が高く、ARDS患者の中でメチルプレドニゾロンによる治療を受けた患者は、コルチコステロイドを投与されなかった患者に比べて死亡リスクが統計学的に有意に減少したことが報告されている45。これと一致して、Surviving Sepsis Campaignは、ARDSを持つ機械換気患者にステロイドを使用することを推奨している。
しかし、この研究では、ステロイドを投与された患者は、投与されなかった患者32人に対して、9人しかいなかったという不均衡な比較がなされている。ステロイドを投与された患者では、ARDS、ショック、急性腎障害の発生率が高かったが、すでにショックやARDSを経験している患者にステロイドが投与されたかどうかはデータからは不明である。
6/16/20には、英国を拠点とするRECOVERY(Randomized Evaluation of COVID-19 thERapY)試験(NCT04381936)47の速報が、「通常の治療のみ」と比較して、デキサメタゾン6mgを1日1回投与することで、人工呼吸をしている患者と補助酸素を投与されている患者の死亡リスクが低下すると報じた。呼吸サポートを必要としないCOVID-19患者では有益性は認められなかった48 。
さらに、clinicaltrials.govの試験の説明によると、患者が低酸素と「炎症状態」によって証明された「進行性のCOVID-19」であれば、2回目の無作為化を受け、トシリズマブを受けるか、追加治療を受けないかのどちらかを選択できるようになっているようである47。
10 あるレトロスペクティブなコホート研究では、ステロイドを投与された患者では、ステロイドを投与されなかった患者に比べて、COVID-19のウイルスが便中に排出される時間が長くなることが確認されている。
COVID-19パンデミック時のステロイド使用のリスクや利点は、疾患経過中の投与時期に依存する可能性がある。
表1は、2020年6ヶ月の表1をハイライトしている。
-COVID-19パンデミック時の偏頭痛またはクラスター頭痛にNSAIDsまたはステロイド(経口または非経口)を利用することの潜在的なリスクと利点 COVID-19パンデミック時のNSAIDまたはステロイドの使用 潜在的なリスク 潜在的な利点 まとめ 非ステロイド性抗炎症薬 – 腎灌流の低下→高血圧症。
高ナトリウム血症 → 肺水腫 – 感染症の最初の兆候を隠すことができる – ウイルスの複製を促進する可能性がある低体温 – ウイルスまたは細菌性の下部気道感染症の前または中にNSAIDsを使用すると、合併症の割合が増加するという弱い証拠がある25。
26 – 非経口製剤の投与には救急部または外来の輸液センターを必要とするため、COVID-19への患者曝露のリスクを高めたり、医療資源に負担をかけたりする可能性がある – 急性片頭痛治療を含む頭痛医療における経口および非経口使用のエビデンスに基づく適応症。
NSAIDsへの曝露がCOVID-19に感染するリスクを増加させたり、臨床経過を悪化させたりすることを示す説得力のあるデータは現在のところ存在しない。
処方前にすべての患者とリスクとベネフィットについて話し合うことを推奨する – 他の禁忌薬がない COVID-19 を有する患者または COVID-19 の疑いがある患者の頭痛に対するベネフィットが証明されている場合に、NSAIDs の使用を制限するためのエビデンスは今のところない。
非経口製剤の投与には救急部または外来の輸液センターが必要であり、患者の COVID-19 への曝露リスクを高めたり、医療資源に負担をかけたりする可能性がある。
手続き的投与(例:後頭神経ブロック)では、患者がCOVID-19に曝露するリスクを高める可能性があるため、対面での診察が必要となる – 頭痛医療における経口および非経口投与のエビデンスに基づく適応症としては、救急外来退院後の片頭痛の再発抑制や、クラスター性頭痛における経過的治療が挙げられる15。
36-38 – COVID-19に曝露される可能性のある医療現場への曝露を減らすために、在宅で投与可能な経口製剤 – 外来で投与すれば、救急部の受診および/または入院を防ぐことができる – 処方に先立ち、すべての患者とリスクとベネフィットについて話し合うことを推奨する – COVID-19またはCOVID-19が疑われる患者ではステロイドを避けることを示唆する限られたエビデンスがある。
COVID-19またはCOVID-19が疑われる患者ではステロイドを避けることを示唆する限られたエビデンスがあるが、基礎となる喘息やCOPD、敗血症性ショック、急性呼吸窮迫症候群の治療など、特定の例外は存在する。
COVID-19 パンデミック時の片頭痛、再発片頭痛、およびクラスター性頭痛の移行期治療のための NSAIDs およびコルチコステロイドの使用に関する頭痛 7 の潜在的なリスクと便益。
頭痛患者を含め、誰もがCOVID-19に感染する可能性があることを考えると、NSAIDsとステロイドを処方したり、使用を勧める前に、NSAIDsとステロイドの使用の潜在的なリスクと利点について話し合うことが重要である。
このような話し合いは、患者中心のケアの実践と一致し、信頼とアドヒアランスを高める。
様々な形態のNSAIDsやステロイドを使用する第一の目的は、痛みの緩和である。これらのエビデンスに基づいた治療法を早期に投与することは、患者を助けるだけでなく、痛みが適切にコントロールされていれば、医療利用を減らすことにもつながる。
最も安全なシナリオは、既知のCOVID-19陰性患者にNSAIDsやステロイドを投与することであるが、実際の臨床では、症状スクリーニングで無症状の患者を見逃す可能性があり、検査が制限されていることもあるため、常に確認できるとは限らない。
リスクを必ずしも排除することはできないので、投与経路(経口 vs 非経口)や投与場所(在宅、外来、救急部、入院)を考慮してリスクを最小化しなければならない。
理論的には、医療環境への曝露を制限することは、コロナウイルスへの曝露のリスクを減少させ、COVID-19に感染するリスクを減少させるべきである;しかしながら、提供者と患者のための適切なPPEを用いて、対面での手続き的訪問が安全に行えるのであれば、緊急部門の訪問と入院を制限することができ、同時にCOVID-19に罹患している患者のための病院のベッドを空けることができるかもしれない。
全体的に、パンデミック中にNSAIDsまたはステロイドのいずれかを使用するかどうかの決定は、特定の患者に個別化されるべきである。現時点では、COVID-19の有無にかかわらず、経口または非経口のNSAIDsの使用を否定する具体的な証拠はない。
常識的な判断は、NSAIDs の使用を制限する可能性のある共存する病状を持つ患者の最前線にあるべきである。過去のウイルス発生時のステロイド使用に関するデータと現在のパンデミックから得られる情報を比較すると、COVID-19患者にステロイドを投与した場合に利益があるのか害があるのかは不明なままである。
リウマチ学の文献によると、ステロイド投与による感染のリスクは用量依存性であるとされている。
NSAIDsとステロイドについて懸念が提起されているが、頭痛管理における他の一般的な薬剤の使用は、COVID-19の影響を受けるシステムに基づいて考慮する必要があるだろう;例えば、血管作動性薬剤(例:トリプタンやエルゴート)、QTc延長薬剤(例:神経弛緩薬)、肝系に影響を及ぼす可能性のある薬剤(例:バルプロ酸)の使用などである。
韓国におけるCOVID-19で入院した成人のNSAIDs使用と有害臨床転帰との関連 全国規模の研究
academic.oup.com/cid/article/doi/10.1093/cid/ciaa1056/5876905
背景
非ステロイド性抗炎症薬(NSAIDs)は、SARS-CoV-2が細胞内に入る際に結合する酵素をアップレギュレートすることにより、COVID-19を悪化させ、関連する転帰を悪化させる可能性がある。我々の知る限りでは、NSAIDの使用とCOVID-19関連転帰のリスクとの関連を検討した研究はない。
方法
2020年4月8日時点でCOVID-19の検査を受けた全被験者(n=69,793)のデータを含む韓国の全国医療データベースを用いてコホート研究を行った。COVID-19で入院した成人を同定し、ここでコホートエントリーは入院日とした。NSAIDs使用者は、コホートエントリーの前後7日間にNSAIDsを処方された者とし、非使用者はこの期間にNSAIDsを処方されなかった者とした。主要アウトカムは院内死亡、集中治療室入院、機械換気の使用、敗血症の複合であり、副次的アウトカムは心血管系合併症と急性腎不全であった。交絡因子を最小化するために、治療の重み付けの逆確率を用いてロジスティック回帰分析を行い、オッズ比(OR)を95%信頼区間(CI)で推定した。
結果
COVID-19で入院した成人1,824人(平均年齢49.0歳;女性59%)のうち、非ステロイド性抗炎症薬(NSAIDs)使用者は354人、非使用者は1,470人であった。非使用者と比較して、NSAIDsの使用は主要複合アウトカム(OR 1.54 [95%CI 1.13-2.11])のリスクの増加と関連していたが、心血管系合併症(1.54 [0.96-2.48])または急性腎不全(1.45 [0.49-4.14])とは有意ではなかった。
結論
確認試験の結果を待っている間、COVID-19患者ではNSAIDsの使用に関連した有害性がこの集団での利点を上回る可能性があるため、NSAIDsを注意深く使用することを推奨する。
その他の抗炎症剤
COVID-19におけるサイトカインストーム:治療に用いられる抗炎症剤の病態と概要
クロロキン、ヒドロキシクロロキン、IL-6阻害剤、IL-1阻害剤、TNF-α阻害剤、コルチコステロイド、静脈内免疫グロブリン、コルヒチンなど

