免疫活性化が制御されていない疾患におけるエピガロカテキン-3-ガレート(EGCG)の保護効果。このようなシナリオはCOVID-19に対抗するのに役立つだろうか?
Protective Effect of Epigallocatechin-3-Gallate (EGCG) in Diseases with Uncontrolled Immune Activation: Could Such a Scenario Be Helpful to Counteract COVID-19?
www.mdpi.com/1422-0067/21/14/5171/htm
要旨
一部のコロナウイルス疾患2019(COVID-19)患者は、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)感染に応答してサイトカインストーム症候群を引き起こす可能性のある急性肺炎を発症する。これまで重症COVID-19に用いられてきた最も有効な抗炎症薬は,多くの自己免疫疾患の管理に広く用いられているサイトカイン誘導型生物学的製剤に属する。
本論文では、緑茶に多く含まれ、抗酸化物質として知られるエピガロカテキン3-ガレート(EGCG)のサイトカイン産生量が多い自己免疫疾患に対する有効性を解析した。実際、多くの研究では、EGCG がシグナル トランスデューサーと活性化転写 (STAT) 1/3 と活性化 B 細胞 (NF-κB) 転写因子の核因子κ-光鎖-エンハンサーを阻害することが登録されているが、その活性は下流のプロ炎症性シグナル伝達経路の多重性で重要である。
重要なことに、EGCG/緑茶抽出物のサプリメントの安全性は、このレビューで議論されているように、多くの臨床試験でよく文書化されている。EGCGは、多くの異なる自己免疫疾患における自然免疫学的恒常性を回復することができるため、我々はここでCOVID-19患者におけるEGCGの補充療法を提案する。
いくつかの抗ウイルスおよび抗敗血症作用に加えて、EGCGの主な利点は、その抗線維化効果と同時に多くの炎症性メディエーターの発現とシグナル伝達をダウンレギュレートする能力にある。
結論として、EGCGは、COVID-19で成長している高炎症を打ち消すための潜在的な安全な天然サプリメントと考えることができる。
キーワード
緑茶抽出物;EGCG;COVID-19;サイトカイン;JAK/STAT;NF-κB;関節リウマチ;多発性硬化症;炎症性腸疾患;抗ウイルス活性
1. 序論
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)感染によって引き起こされる新興コロナウイルス疾患2019(COVID-19)は、無症状型から軽症または重症までの幅広いスペクトルの症状および臨床経過を特徴とする。
残念なことに、一部の患者は、臓器機能を損なうことができる全身性免疫反応に伴う激しい肺炎からなる急性呼吸窮迫症候群(ARDS)を発症し、しばしば致命的なイベントにつながることがある[1]。COVID-19の増悪に関与する病原性機序は、その出現から数ヶ月の間に深く理解されなかった。
いずれにしても、COVID-19のARDSは、宿主の免疫反応の異常が主な決定因子であると認識されている他の2つのコロナウイルス伝染病、重症急性呼吸器症候群(SARS)や中東呼吸器症候群(MERS)と類似していると考えられる。
実際、COVID-19の超重症患者では、インターロイキン(IL)-6、IL-1β、IL-17、IL-8、腫瘍壊死因子(TNF)-α、インターフェロン(IFN)-γおよびその他の炎症性メディエーターの分泌量が増加するサイトカインストーム症候群を呈している[1,2]。
このような炎症性サイトカインの過剰産生は、病原体の侵入者であるSARS-CoV-2によって誘導されたものよりも、宿主細胞に大きなダメージを与える。
サイトカインの大量放出に加えて、関連する全身機能の悪化が登録されており、総循環リンパ球の減少、肺における単球/マクロファージおよび好中球の浸潤、高凝固性を伴う血管炎、C反応性蛋白、トランスアミナーゼ、フェリチンおよびクレアチニンの血清レベルの上昇が認められている。これらの特徴はすべて、多臓器障害が発生していることを示唆している[3]。したがって、COVID-19の死亡率を回避するためには、炎症の亢進を予防または解消することが重要な決定要因であることは明らかである。
現在のところ特異的な治療法はなく、疾患の管理は支持療法のみであるため、研究コミュニティ全体では、COVID-19におけるARDSのようなシナリオを持つ、よりよく知られている他の症候群に注目している。実際、観察データは、サイトカインの大量放出を特徴とするいくつかの自己免疫疾患と重なる臨床的特徴を示している。
マクロファージ活性化症候群(MAS)とも呼ばれる二次性血球貪食細胞性リンパ組織球症(sHLH)は、最終的にサイトカインストームにつながる強烈な超免疫応答を特徴とする重篤な障害として知られている。sHLH/MASは、免疫機能障害のいくつかの徴候の存在によって記述されており、例えば、(i)感染または自己免疫刺激後の抗原をクリアすることができないナチュラルキラー細胞;(iii)抗原提示の持続。(iii)調節性T(Treg)細胞の機能抑制、(iv)組織マクロファージ(組織球)の活性化と増殖、(v)活性化された組織球による炎症性サイトカインの分泌など、いくつかの免疫機能障害がみられる[4,5]。
sHLHの臨床的特徴および臨床検査データには、持続的な発熱、脾腫、高フェリチン血症、汎血球減少症、線溶性消耗性凝固症および肝機能障害が含まれており[6]、これらは重症COVID-19で記載されたものに非常に近いものである。
エプスタイン-バーウイルスおよびサイトメガロウイルス、最も頻繁に、または影響およびデング感染は、より少ない範囲で、sHLHを誘発することができる[7]。自己免疫疾患の中でも、sHLHは主に全身性若年性特発性関節炎またはその成人に相当する成人発症スティル病の合併症に由来するが、他の全身性炎症性疾患(全身性エリテマトーデス、川崎病、周期性発熱症候群など)でも発症する可能性がある[5,6]。
sHLHに加えて、ナイーブなTヘルパー(Th)細胞がTh2およびTreg細胞よりもむしろTh1およびTh17サブセットで優先的に分化する重度のCOVID-19と他のより一般的な自己免疫疾患との間の類似性もまた文書化されている。
実際、Th1およびTh17細胞の異常な活性化は、IFN-γ、IL-2、TNF-α、IL-1β、IL-17、IL-21およびIL-6の分泌の増加をもたらし、これが炎症を誘発する。さらに、Tregの機能低下は、炎症反応をオンに保つのに役立つ[8]。関節リウマチ、シェーグレン症候群、多発性硬化症、炎症性腸疾患はその特異性を呈している。
2. 自己免疫疾患とCOVID-19における従来の治療法と生物学的治療法
長い間、コルチコステロイド薬は、寛解誘導剤としての役割と幅広いスペクトルの抗炎症作用のために、自己免疫疾患の管理に主に使用されてきた[9]。グルココルチコイドの主な作用は、サイトカイン、ケモカイン、細胞接着分子、酵素をコードするいくつかのプロ炎症性遺伝子を阻害して炎症過程に対処し、恒常性を回復させることである。
炎症を抑制する効果は十分に認められているが、副腎皮質ステロイド薬は、合併症、特に感染症を発症するリスクが高いなど、多くの有害事象を示している[10]。したがって、炎症性の特徴を示す感染症におけるコルチコステロイドの役割に関する臨床研究の結果は、まだ議論の余地がある。
コルチコステロイドは、SARSやMERSコロナウイルス感染症の発生時にも広く使用されている。SARS、MERSの試験、およびCOVID-19の臨床実験の最初の結果を検討した最近のメタアナリシス研究では、最終的な反応はまだ明らかにされていないものの、コルチコステロイドによる治療は死亡率を高め、ウイルスクリアランスを減少させることが報告されている[11]。
サイトカインの生物学的作用を打ち消す薬剤は、現在ではリウマチ科や他の自己免疫疾患で主に使用されており、その有効性が実証されている。抗IL-1抗体、抗TNF-α抗体、抗IL-6モノクローナル抗体は、それぞれの特異的な標的を枯渇させ、サイトカインストームを遅らせることができる。
IL-6受容体拮抗薬であるトシリズマブは、自己免疫疾患の治療に使用されており、サイトカイン放出症候群を呈する様々な臨床症状の治療に承認されている[9] 、重症のCOVID-19でも有望な結果が得られている[12]。
バリシチニブは、関節リウマチ治療に用いられる経口薬である。バリシチニブは、I/II型IFNやIL-6シグナル伝達に関与するシグナル伝達物質・転写活性化因子(STAT)の上流活性化酵素であるヤヌスキナーゼ(JAK)の阻害剤として機能している[13]。
JAK阻害剤の使用は、忍容性が高く、多数の炎症性サイトカインシグナル伝達経路を同時に標的とする機会を与えるので魅力的である[14,15]。
結論として、特定のサイトカイン作用をブロックする生物学的薬剤は、SARS-CoV-2によって誘発された炎症性宿主反応を打ち消すために再利用されている[16]。実際に、その有効性を証明するために多くの臨床試験が行われている。
3. 自己免疫疾患におけるエピガロカテキン-3-ガレート(EGCG
緑茶抽出物(GTE)に最も多く(約50%)含まれる活性カテキンであるEGCGは、抗炎症作用、抗がん作 用、抗菌作用、免疫調節作用など、幅広い有益な効果を示している[17,18]。
3.1. 関節リウマチ
関節リウマチ(RA)は、滑膜関節の持続的な炎症を伴う自己免疫疾患であり、関節骨や軟骨の破壊につながる可能性がある[19]。
Haqqiらは、RAのコラーゲン誘導性関節炎(CIA)マウスモデルにおいて、緑茶ポリフェノール(飲料水0.2%GTE溶液)の保護効果を最初に報告しており、その結果、関節炎の発生率が減少し、炎症性メディエーター(IFN-γ、TNF-α、シクロオキシゲナーゼ2など)のダウンレギュレーションが認められた[20]。
Ahmedらは、アジュバント誘発マウス関節炎の改善を報告しており、EGCG(100 mg/kg、腹腔内注射(i.p.)で7日目から16日目まで毎日投与)がgp130 IL-6-co-receptorの可溶型を産生することにより、IL-6合成を阻害し、そのシグナル伝達を抑制することを示している[21]。
飲料水に添加されたGTE(8g/L、2/週)は、アジュバント誘発性関節炎のラットモデルにおいても、IL17の減少とIL-10の血清レベルの上昇を示し、関節リウマチの症状を軽減した。ここで忘れてはならないのは、高いTh17/Treg比がRAの特徴であるということである[23]。したがって、Th17とTregのバランスを回復させることができる分子は、RA管理のための重要なツールとなり得る。
Th17減少のメカニズムについては、CIAマウスモデルで検討されており、EGCG投与(40 mg/kg, 3/週, i.p.)はphospho-STAT3陽性T細胞の数を減少させることができた[24]。同様のデータは、STAT3活性とTh17細胞の分化の両方の抑制を証明したBrunらによって報告されている(EGCGの20 mg/kg、3/週、i.p.)[25]。
さらに、Leeらは、EGCG(20-50 mg/kg、3/week、i.p.)がTh17クローンの増殖を抑制し、STAT3活性を抑制することを確認したが、細胞外シグナル調節キナーゼ(ERK)リン酸化、核内因子エリスロイド2関連因子2(Nrf-2)活性、ヘムオキシゲナーゼ1(HO-1)発現の増加も記録している[26]。
特筆すべきことに、Th17クローンの増殖にはSTAT3依存性のIL-6シグナル伝達が必要である[27]ことから、これらのグループによって得られた実験データは、以前にAhmedら[21]によって報告されたIL-6発現およびシグナル伝達の減少と一致している。
最後に、RA発症の危険因子を評価するために、米国アイオワ州の既往歴のない3万人の高齢女性を対象とした前向きコホート研究の結果に注目しなければならない。
1日3杯以上お茶を飲んでいる女性は、RA発症のリスクが逆相関していることが示された[28]。これは有望な結果であるが、ヒトのRAにおけるEGCGの予防・治療効果を証明するためには、さらなる臨床実験が必要である。
3.2. シェーグレン症候群
シェーグレン症候群(SS)は、涙腺および唾液腺の炎症を特徴とする比較的一般的な自己免疫疾患である。SSでは、自己抗原の発現とアポトーシス細胞死が分泌機能の喪失につながる重要な病因因子である[29,30]。
EGCGは、SS症候群の非肥満糖尿病マウスモデルの唾液腺の自己免疫誘発性苦痛を保護することができる。EGCG 投与(飲料水に 0.1~0.2% EGCG 溶液)は、唾液腺内のリンパ球浸潤を減少させ、アポトーシスや細胞増殖を抑制した[29]。
Hsuらは、GTE(0.2%GTE溶液を飲料水に溶かしたもの)が動物血清中の自己抗体レベルを低下させることを示し、EGCGがex vivoの唾液腺細胞におけるTNF-α誘導細胞毒性を抑制できることを示した[30]。
Saitoらは、MRL-Fas-lprマウスの自己免疫性唾液腺炎モデルを用いて、酸化的損傷が唾液腺細胞のアポトーシスを誘発することを明らかにした。損傷を受けた腺は、水チャネルアクアポリン 5(AQP5)の発現が低下し、その結果、ピロカルピン刺激後の唾液の低外分泌フローを表示した。
EGCG(飲料水中592μg/マウス、57日間)は、AQP5の発現レベルを復元することができ、最終的に腺の機能を改善した。EGCGによる保護作用(2 mg/kg、10 mg/kg、飲料水、10日間)は、活性化B細胞の核内因子κ-光鎖エンハンサー(NF-κB)とc-Jun N末端キナーゼの両方の不活性化、およびプロテインキナーゼA活性の保存によって媒介されていた[31]。
いずれのデータも、炎症性障害が発生していた身体のわずかではあるが十分に定義された領域にもEGCGの補給が有効であることを示唆している。
3.3. 多発性硬化症
多発性硬化症(MS)は、神経系が関与し、炎症、脱髄、軸索損傷、およびグリア症を表示するT細胞依存性の自己免疫疾患である[18]。ヒトMSのよく特徴づけられたげっ歯類モデルは、実験的自己免疫性脳脊髄炎(EAE)であり、この疾患はミエリン由来のタンパク質を用いた動物免疫によって誘導される。MSと同様に、EAEの病理組織学は、血管周囲の炎症性病変と中枢神経系(中枢神経系)の脱髄の徴候を示した[8]。
EGCG の神経保護作用は、脳内のスーパーオキサイドディスムターゼやカタラーゼなどの抗酸化酵素活性を高めることで知られている[32]。Aktas らは EAE モデルにおいて、EGCG(100 µL/マウス、生理食塩水、3/ダイ、経口投与)が脳の炎症を抑制し、症状や神経細胞の損傷を減少させることを初めて実証した [33]。
これらの保護効果は、NF-κB 活性とその標的遺伝子 TNF-αの発現の両方を阻害することによって媒介されていた[33]。このことから、NF-κB は炎症性メディエーターをコードする遺伝子を制御し、疾患発症時に中枢神経系の常駐細胞で重要な役割を果たす転写因子であることが明らかになった[34]。
Wangらは、EGCGを用量依存的に(0.15-0.6%、30日間経口投与)投与すると、EAEマウスの臨床症状が改善され、発症が遅延し、炎症性浸潤や脱髄損傷が減少することを確認している[35]。メカニズム的には、EGCGはT細胞サブセット間のバランスを変化させ、Th1およびTh17プロ炎症性T細胞を減少させ、Treg細胞集団を促進し、結果としてIFN-γおよびIL17産生を減少させた。
IL-6の低レベルの発現は、トランスフォーミング成長因子β(TGF-β)によって誘導されたナイーブT細胞をTh17サブタイプではなくTregサブタイプにリダイレクトするために重要であるため、IL-6の分泌を測定した。
EGCGはIL-6の産生を抑制し、ICAM1の発現や白血球の浸潤を抑制することが示された。重要なことは、免疫後7~12日後にEGCGを投与してもEAEの改善がみられたことから、EGCGの効果は予防ではなく治療効果が大きいと考えられ、EGCGはMS治療に適している可能性があると結論づけている。
さらに、いくつかの研究では、EGCG(300μg、1 日 2 回、50 日間経口投与)と他の天然物、例えば、EAE モデルの酢酸グラチラマー [36,37]、または MS 患者のココナッツオイル [38] との関連性が促進された。これらすべての研究において、併用療法の相乗効果が確認されている。
EGCGと酢酸グラチラマーは、中枢神経系における脳由来神経栄養因子(BDNF)と有益なサイトカインの発現を改善し [36]、HO-1の発現レベルの上昇を促進する [37]。
MS患者におけるEGCGを用いた臨床試験を表1に示す。
表 1. エピガロカテキン-ガレートを用いた臨床試験。
原文参照
結論として、MS における EGCG の治療効果は有望である。その有益な影響は、その複数の分子標的活性と良好な中枢神経系のバイオアベイラビリティーによって支持された。
3.4. 炎症性腸疾患
クローン病および潰瘍性大腸炎は、免疫異常によって媒介される慢性炎症性腸疾患(IBD)である[39]。IL-1β、IL-6、IL-8、TNF-α、およびIFN-γのアンバランスは、消化管の恒常性を阻害する慢性炎症状態を引き起こし、最終的には下痢、腹部膨満感、ガス、出血、および腹痛を引き起こする[40]。さらに、IBDは酸化ストレスや硝酸ストレス、白血球浸潤、大腸内の細胞間接着分子1(ICAM-1)発現の上昇によって特徴づけられる[41]。
EGCG投与がIBDに有用であるかどうかを証明するために、いくつかの研究が行われてきた。ヒトT細胞株キット225は、一次Th17細胞サブタイプと同様に、IL-17およびTNF-αを含む他のプロ炎症性サイトカインを分泌することができる。非刺激またはIL-23刺激T細胞キット225のいずれかでは、EGCG処理はIL-17およびTNF-α発現を阻害した[42]。
緑茶ポリフェノールの保護効果は、酢酸誘発性大腸炎モデルでは、EGCG(50 mg/kg/die、経口投与による)は、劇的にTNF-α、IFN-γ、およびNF-κB発現レベルを減少させ、一酸化窒素(NO)産生およびマロンジアルデヒド活性を減少させることにより、ラットの粘膜炎症を改善したことが確認された[43]。
実験的大腸炎の別のラットモデルにおいて、ジニトロベンゼンスルホン酸を大腸内に注入して誘導したところ、GTE(50 mg/kg/die, i.p.)を投与すると下痢と体重減少が有意に減少することが示された。
これらの効果は、ミエロペルオキシダーゼおよびTNF-α産生の有意な減少を伴う、破壊された大腸構造の顕著な改善と関連していた。GTEはまた、ニトロチロシン組織免疫反応性の出現とICAM-1の発現の両方を減少させた[41]。
IL-2ノックアウトC57BL/6マウスは、ヒト潰瘍性大腸炎に匹敵する結腸炎を発症し、サイトカインプロファイルは、IFN-γおよびTNF-α発現レベルの上昇につながるTh1型宿主免疫応答と一致している[44]。
ラミナ前庭リンパ球は、緑茶ポリフェノールで処理したか否かを問わず、IL-2 KOマウスの大腸から分離し、その後、ex vivoで培養した。GTE(飲料水で5g/L)はリンパ球のIFN-γ産生を著しく減少させた。著者らは、腸内のTh1媒介応答を調節することができる緑茶ポリフェノールは、Th1の特徴を示すクローン病の治療において重要な臨床的関連性を持つ可能性が高いとコメントしている[44]。
実験的大腸障害の別のタイプでは、デキストラン硫酸ナトリウムの投与は、潰瘍性大腸炎の臨床症状をもたらす大腸上皮の浸食と透過性の増加を誘導することができる。このモデルでは、EGCG投与(20および50mg/kg/日、経口投与)により結腸の短縮が抑制され、腸管透過性と病理組織学的変化の両方が改善された。特に、EGCGによる大腸病変の減衰は、IL-6、MCP-1、TNF-αの抑制およびマクロファージ浸潤の抑制を伴っていた[45]。
Ozらは、野生型とIL-10欠損ラットを用いた同じ動物モデルにおいて、EGCG(0.12-0.5%/日の食事に組み込む)がスルファサラジンと同等の方法で大腸炎の重症度を有意に減少させたことを報告している[46]。
著者らは、IBD治療に一般的に使用されているスルファサラジンには重篤な副作用があることから、この有望な結果は、EGCGまたはGTEがヒトIBDの代替安全な治療法になる可能性を示唆していると結論づけている。
4. COVID-19高炎症に対抗するEGCGの分子機構
急性炎症の多くの実験モデルにおいて、GTEに含まれるポリフェノールの抗炎症効果が証明されている[41,47,48,49,50]。特に、カラギーナン誘発性胸膜炎のマウスモデルでは、GTE(25 mg/kg, i.p.)がICAM-1およびTNF-α発現、STAT-1活性化、ニトロチロシンおよびポリADP-リボシルタンパク修飾、肺における多形核白血球(PMN)蓄積を低下させることで、肺損傷を減衰させることが報告されている[47]。
我々はまた、肺損傷に続いて肝機能、腸機能、腎機能、心臓機能障害を特徴とする多臓器機能障害症候群(MODS)の動物モデルも使用した。MODSは、全身性の炎症反応を誘発する補体、凝固、線溶性カスケードの同時トリガーをもたらす。後者は、食細胞や内皮細胞を活性化させ、多くのサイトカインやその他の炎症性メディエーターを放出させる[51]。
MODSは、COVID-19のARDSと同様の特徴を示す。マウスにザイモサンを投与したこのモデルでは、GTEが(i)ザイモサン誘発性腹膜炎の発症、(ii)肺および腸におけるPMNsの浸潤、(iii)腎機能障害、および(iv)肝、肺、膵臓および腸の傷害を減少させるという証拠を提供した[48]。
GTE の保護効果を示す分子機構については、A549 肺胞細胞や DLD1 結腸細胞を含むヒト上皮細胞株を用いた 試験管内試験(in vitro) 実験で検討されてきた。その結果、EGCGは5~20μMの範囲で、GTEは4~40μg/mLの範囲で、IFN-γをトリガーとしたSTAT1活性化を強力に阻害することが明らかになった。
EGCG/GTEは、JAK2が誘発するSTAT1リン酸化を抑制する効果を示し、標的遺伝子である誘導性一酸化窒素合成酵素、ケモカイン(C-X-Cモチーフ)リガンド(CXCL)9、CXCL10、ICAM1、およびクラスII大組織適合性複合体HLA-DRの発現を阻害した [52,53,54]。
EGCGの抗炎症作用は、N-アセチルシステインおよびアスコルビン酸が無効であったため、その抗酸化活性によって媒介されなかった[54]。
IFNは炎症や病原体感染症において重要なサイトカインである。それらは、重複または特異的な機能を持つ異なるクラスに属している。細胞外分泌型I型IFN(IFN-α/IFN-β)は、ウイルス感染症に対する最初の戦いを担う。実際、感染した細胞から分泌されるI型IFNは、STAT1およびSTAT2を活性化する膜貫通受容体に結合し、IFN刺激遺伝子(ISG)発現を誘発して、細胞の抗ウイルス状態を急速に発生させる [55]。
一方、II型IFN-γは、マクロファージ活性化、自己免疫、およびTh1応答において重要な役割を果たすため、免疫および炎症の重要なメディエーターである。IFN-γシグナルは、STAT1経路を利用して、IFN-γ誘導性遺伝子の転写活性化を達成し、そのうちのいくつかはプロ炎症性サイトカインおよびケモカインをコードしている[56]。
それにもかかわらず、ウイルスは不十分な宿主応答を誘導して免疫系を盲目にすることができる。実際、SARS-CoVはSARS患者において有能なIFN応答を誘導することができなかった[57]。SARS-CoV-2感染に対するIFN応答は十分に特徴づけられていないが、最初の重要な実験データが現在出てきている。
アンジオテンシン変換酵素2(ACE2)は、宿主細胞におけるSARS-CoV-2の内部化を可能にする細胞受容体である。Zieglerらは、ACE2をインターフェロン刺激遺伝子として同定した。実際、鼻粘膜の初代基底細胞では、IFN-α2およびそれ以下の範囲ではIFN-βまたはIFN-γ刺激の後にACE2の有意な誘導が認められた[58]。
したがって、ヒトではあるがマウスではないACE2は、そのプロモーター上のSTAT1、STAT3、IRF8、およびIRF1結合部位の存在のために、正準的なISGと考えなければならない[58]。
別の基礎的研究では、8人のCOVID-19患者の気管支肺胞ラバージ液(BALF)を、健常対照または非COVID-19肺炎患者のいずれかと比較して分析した[59]。SARS-CoV-2感染患者では、健常者と比較しても、SARS-CoVまたは他の病原体誘発性肺炎患者と比較しても、遺伝子発現の明確なパターンが認められている。
SARS-CoVおよびMERS-CoVの発生から得られたデータによると、これらのコロナウイルスはJanusキナーゼ/シグナル伝達物質および転写活性化因子(JAK/STAT)シグナル伝達を阻害することにより、I型IFN応答を抑制することが明らかにされている[16]。
逆に、SARS-CoV-2は、いくつかのISGの発現を増加させることにより、堅牢なIFN応答を誘発する[59]。それにもかかわらず、いくつかのISGの保護能力は、おそらく上述のACE2のスーパー誘導のために、ウイルスの複製を抑制することができないであったが、代わりに肺の炎症の悪化が発生した。
この点に関して、COVID-19患者のBALF細胞のゲノム解析を行ったところ、Zhou er al)。好中球再結合メディエーターであるCXCL8、CXCL1、CXCL2、CXCL10、ケモカイン(C-Cモチーフ)リガンド(CCL)2を含む炎症制御クラスターに属するISGメンバーが高い濃縮度であることを示した。
CCL7および単球および免疫細胞CXCL6、CXCL11、CCL2、CCL3、CCL4、CCL7、CCL8の他の誘引因子、ならびに正のフィードバックによって炎症状態の持続を導くSTAT1自体 [59]。COVID-19患者では、すべてのデータは、抗ウイルス反応を発現させる代わりにIFNに対する反応において、プロ炎症性目的の優勢を示唆している[59]。
これは、そのようにして、IFNがサイトカインストームをサポートすることができるので、劇症的である可能性がある。これらのデータと一致して、Majorらは、コロナウイルス感染マウスにおけるI型およびIII型IFNのシグナル伝達が肺の病理を悪化させるメカニズムを報告している[60]。
さらに、Brodgiらは、ウイルス認識後に肺樹状細胞によって産生されるIII型IFN-λが、肺上皮の修復を阻害することでバリア障害を誘発することを報告している[61]。これらの結果はすべて、JAK阻害剤のようなJAK/STAT活性を阻害することができる分子をCOVID-19治療に使用するための強い合理性を提供する。
実際、JAK阻害剤の有効性を試験するために多くの臨床試験が進行中である(すなわち トファシチニブ、NCT04412252、NCT04415151、NCT04332042;バリシチニブ、NCT04390464、NCT0439051、NCT04373044、NCT04321993、NCT043452893、NCT04320277、NCT04340232。ルキソリチニブ、NCT04362137、NCT04414098、NCT04331665、NCT04377620、NCT04338958、NCT04334044、NCT04348071)。) 上記の臨床試験をさらに調べるために、Luoら[15]のレビューで提示された表1を想起する。
JAK/STAT経路阻害の利点は、いくつかのサイトカインおよびケモカインの合成および分泌の遮断に存在するはずである[62]。したがって、自己免疫疾患[62]およびCOVID-19[15]の両方において、JAK/STAT阻害剤は、シグナル伝達経路対複数の標的を同時にアブログするための魅力的な治療ツールである。
EGCG/GTEは、試験管内試験(in vitro)でも前臨床試験でも低マイクロモル濃度で、合成JAK阻害剤と同様にSTAT1阻害剤として作用する。
いくつかの研究で、EGCG/GTEの幅広い抗炎症作用が支持されているが、これは有害な酸化物質を消去し、STAT-1活性を阻害することに限定されるものではない。既に報告されているように、EGCGおよびGTEの投与により、STAT3の活性化も低下した[24,25,26]。
STAT1 [53] と同様に、STAT3 阻害に関与する分子機構は、表面プラズモン共鳴(SPR)アッ セイおよびin silicoドッキングモデルにより解明された[63]。SPR アッセイでは、EGCG がマイクロモル濃度で STAT3 ペプチド結合を有意に阻害し、ドッキング実験では、EGCG が STAT3 SH2 ドメインに競合的に結合して STAT3 リン酸化およびシグナル伝達を阻害することが示された [63]。
重要なことに、免疫系では、IL-6、IL-10、IL-21、およびIL-23の受容体を含むほとんどのサイトカイン受容体がSTAT3を活性化しうることから、STAT3が免疫応答および自己免疫の調節のための重要な核内因子であることが示されている[64]。また、COVID-19の高炎症状態では、高レベルのIL-6が予後不良の主な予後因子であると考えられていることも知られている。
実際、トシリズマブのようなIL-6シグナル伝達を阻害することができる薬剤の使用は、疾患の進行をブロックすることができ[12]、同様に、EGCGはSTAT3経路の強力なブロッカーであるため、EGCGも有望である可能性がある。
また、EGCGG/GTE は、多くの免疫学的プロセスにおいて重要な役割を果たす炎症性シグナルの主要な構築物である NF-κB [31,33,43,65,66,67,68,69] の活性化を防ぐことができる。NF-κBは、サイトカインストーム症候群[70,71]およびCOVID-19[72,73]において誘導されるIL-1β、TNF-α、IL8、IL-6を含む多くのプロ炎症性サイトカインの発現を制御する。
EGCG/GTEの抗炎症作用はまた、特に神経細胞[74]、関節炎[75]、およびアテローム性動脈硬化症[76]における保護効果につながるNrf2核転座およびHO-1活性を活性化する能力に由来している。このように、EGCG/GTEは、高炎症状態を回復させることを目的として、COVID-19に再利用されるべきである。
5. EGCGは肺線維化に対して保護的である
また、肺線維症をターゲットにすることの重要性についても議論している。ARDSを発症した患者のかなりの割合が、進行性の肺線維症のために死亡する。重要な線維化メディエーターには、血管内皮増殖因子(VEGF)とサイトカイン放出に関連するマトリックスメタロプロテアーゼが含まれ、上皮および内皮傷害を誘導する[77]。
COVID-19患者の肺線維化は、SARS-CoV-2感染がTGF-βの産生と活性化を伴う好中球の肺への浸潤の大規模な増加を誘導するために起こる。TNF-α、IL-6、IL-1βなどの炎症性サイトカインの助けを借りて、活性化したTGF-βが制御されずに増加すると、急速で大規模な浮腫と線維化が生じ、気道を再構築して最終的には閉塞し、最終的には肺機能不全に至る [78]。
実際、SARS-CoV-2感染後の線維化性肺疾患では、線維化していない肺疾患よりも予後不良のリスクが高い。さらに、線維性肺疾患の世界的な負担は、年齢、男性の性、高血圧や糖尿病などの併存疾患があると著しく増加する[79]。したがって、重症COVID-19の肺線維化を緩和する治療法が急務となっている[79]。
肺線維症の異なるモデルにおけるEGCG/GTEの保護効果を思い起こさなければならない。特発性肺線維症(IPF)は致死的な慢性進行性肺疾患であり、TNF-αトランスジェニックマウスはヒトIPFの動物モデルである。これらのマウスは肺のみにTNF-αを過剰発現させ、GTEの保護効果を検証していた。
TNF-αの過剰発現は連続的で、IL-1αとIL-1βは初期にのみ過剰発現し、IL-6産生は間質性肺炎の進行とともに増加した。これらのデータは、IL-6分泌がTNF-αとともに本疾患の発症に寄与していることを示唆している[80]。
GTEを投与した後、TNF-αおよびIL-6のmRNAおよびタンパク質レベルはそれぞれ70%および80%減少したことから、緑茶はTNF-α関連疾患に対する有意な予防効果を有することが示唆された[80]。
さらに、ブレオマイシン誘発ラットの肺線維症モデルに対して、EGCG(20 mg/kg、i.p.、28日間)の有益な効果が報告されており、肺のリソソソームヒドロラーゼおよび超微細構造の変化が改善されている[81]。
同じモデルにおいて、Sriramらは、EGCG(20 mg/kg、i.p.、28日間)の補給がNF-κB活性、TNF-α、IL-1β発現を低下させ、Nrf2シグナル伝達を誘導することを示した[82]。
さらに、EGCGはTGF-β1シグナル伝達をダウンレギュレーションすることにより、線維芽細胞の活性化およびコラーゲン蓄積を抑制した[83]。結論として、EGCG/GTEは強力な抗線維化剤と考えられる。
6. 多くの臨床応用のためのEGCG/GTE試験
予防または治療目的での EGCG 補給の安全性と利点を検証するために、いくつかの臨床試験が実施されている(表 1)。
EGCG は、いくつかの発がん性シグナル伝達経路を標的とする能力から、抗がん作 用を有する化学予防製品として浮上しており、最近では臨床試験の様々な段階で試験が行われている [84]。
ポリフェノンE製剤に含まれるEGCGは、第II相試験において慢性リンパ性白血病患者に良好な忍容性を示した。大多数の患者において、総リンパ球数およびリンパ節腫脹の持続的な減少が観察された[85]。
EGCGの臨床試験は、乳がんを発症するリスクの高い閉経後女性を対象に実施されている。健康な閉経後女性を対象とした二重盲検無作為化プラセボ対照介入試験で報告されているように、EGCGはLDL-コレステロール、グルコース、インスリンを調節するという点で利益をもたらす可能性がある[86]。
低密度リポタンパク質コレステロール(LDL-C)を下げるためにEGCGの能力のための文献の系統的なレビューが行われた。データは、緑茶EGCGの消費はLDL-Cの有意な減少をもたらし、効果の大きさはわずかに被験者のベースライン脂質レベルに依存していたことを示した[87]。
二重盲検、無作為化、プラセボ対照試験では、さらに健康な閉経後の女性の血中脂質にEGCGの利益を確認した[88]。最後に、メタアナリシスは、緑茶の摂取量と心血管疾患や虚血関連疾患のリスクとの関連を評価するために行われた。この研究は、緑茶の消費が良好な転帰[89]と関連しているという証拠を提供している。
すべての研究は、有意な副作用を報告し、多くの異なる病理学の自然な恒常性を復元するためにEGCG/GTEの能力を登録していなかった。それらの低毒性リスクと大規模な消費を考えると、EGCGとGTEは、予防のため、または炎症の特徴を持ついくつかの疾患の治療のためのいずれかの安全な天然のサプリメントとしての使用の可能性を持っている。
結論として、COVID-19では、転写因子(すなわち、STAT1、STAT3、NF-κB、Nrf2)活性およびそれらの標的遺伝子の発現の両方の調節因子としてのそれらのマルチターゲット作用のためにEGCG/GTEの補充は有利であるはずである(図1)。
EGCG/GTEは、IFNsやサイトカインの炎症作用や肺線維症の発症を打ち消す組織の恒常性を回復させることができた(図1)。
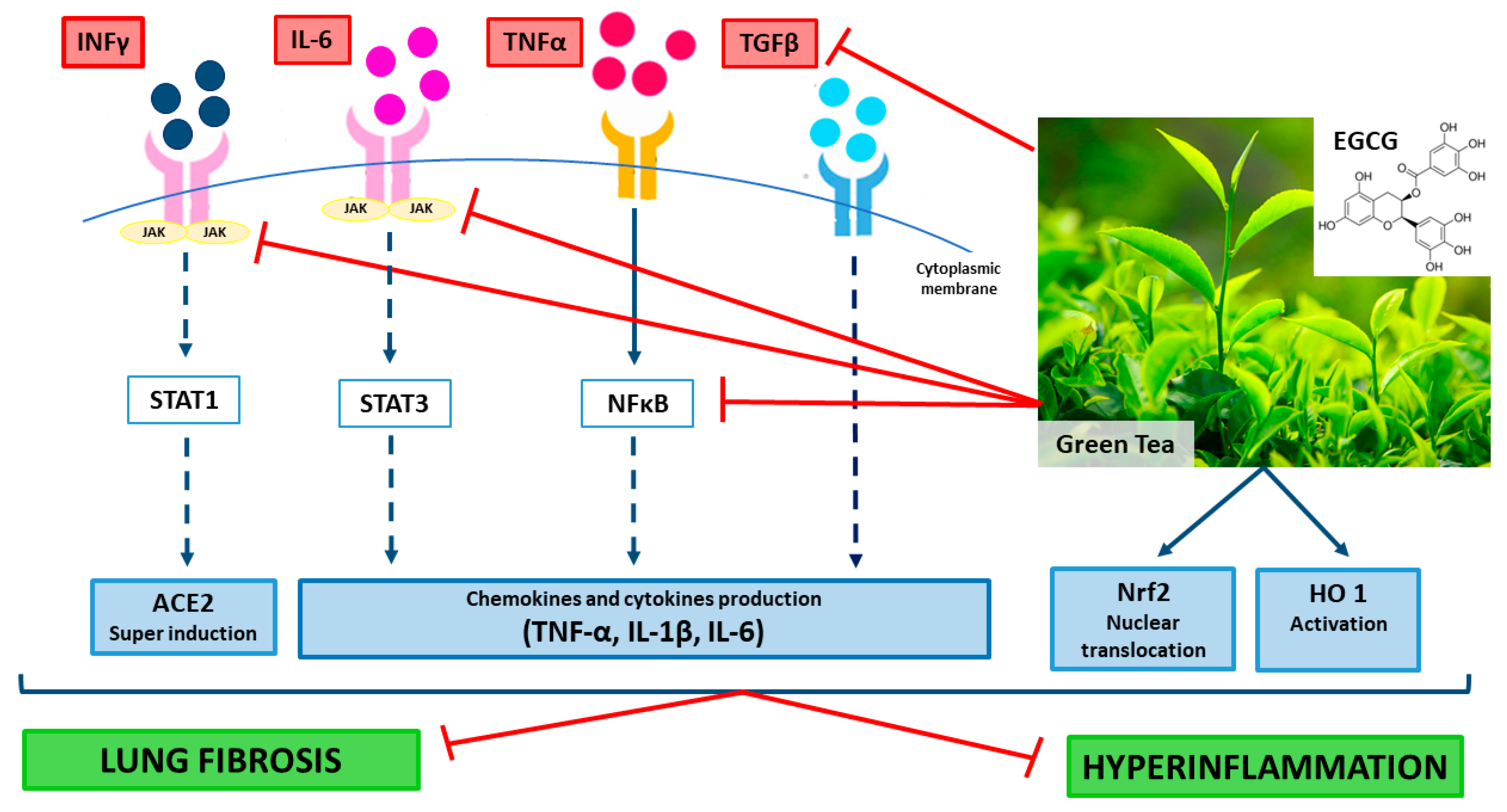
コロナウイルス疾患2019(COVID-19)患者における緑茶抽出物およびエピガロカテキン-3-ガレート(EGCG)の潜在的な有益な効果のメカニズム。
7. 実験的敗血症におけるGTE/EGCGの保護効果
敗血症は、細菌またはウイルス感染に対する宿主の反応が異常に制御されていることに起因する全身性の炎症症候群であり、炎症性メディエーターの過剰な蓄積と恒常性回復の障害によって特徴づけられる。
組織損傷は、病原体と損傷に関連した分子パターンによって部分的に誘発される。その中でも、活性化された単球/マクロファージから放出され、エンドトキシン血症や敗血症の後期メディエーターとして機能する高移動度グループボックス1(HMGB1)が重要な役割を果たしている[93]。
実際、組換えHMGBをマウスに投与すると敗血症の臨床症状が現れ、逆に、抗HMGB1抗体またはその阻害剤は、リポ多糖(LPS)誘発性の急性組織傷害および致死的敗血症からマウスを保護する [93,94]。
IL-1β、IL-1R type 1、IL-18、阻害剤κBキナーゼβを選択的に欠失させた場合、また、炎症ソームの構成要素であるNLRファミリーパイリンドメイン含有3(NLRP3)を欠失させた場合、実験的敗血症の生存を促進したり、重度の免疫不全を誘発したりすることはできない[95]。この文脈では、生理学的な防御免疫応答を維持しながら、ダメージを媒介とする炎症、特にHMGB1を選択的に標的とすることの重要性が強調されるべきである[95]。
エンドトキシン誘発敗血症のマウスモデルにおいて、GTE が致死に対する保護を与えることは以前から知られており [96]、EGCG の投与(10 mg/kg、i.p.)は、NF-κB 活性化と誘導性 NO シンターゼ(iNOS)発現の両方を阻害することにより、ポリ微生物ラット敗血症を改善することが知られている [97]。
最近、Wangらのデータでは、急性LPS誘発性肺損傷マウスにEGCGを10mg/kg投与すると、TNF-α、IL-1β、IL-6、Toll様受容体-4レベル、およびNF-κB活性化が低下するという保護効果が確認されている[98]。
重要なことに、EGCG は実験的敗血症に対して 4 mg/kg (i.p.) の遅延投与、すなわち盲腸結紮穿刺 (CLP) の 24 時間後または 48 時間後に投与することで、敗血症からマウスを有意に長期的に保護し、ヒト敗血症の臨床管理における EGCG の治療法の可能性を支持している [99]。
Liらは、EGCGがCLP後のマウスのIL-6とHMGB1の血清レベルを減少させることを再確認し、10μMのEGCGはHMGB1で刺激されたマウス腹膜マクロファージにおけるIL-6、TNF-αおよび一酸化窒素の分泌を減少させることを示した[99]。
最後に、エンドトキシン刺激マクロファージモデルにおけるEGCGのプロオートファジー活性(2-20μMの範囲で)もまた、オートファジーHMGB1の分解とエンドトキシン血症に対する保護をもたらし、登録された[100]。
別の潜在的な分子機構は、HMGB1血清レベルを減少させるEGCG能力を説明することができる。特に、JAK/STAT1は、その分泌前に核から細胞質へのHMGB1の転座を制御する重要なシグナル伝達機構を表している可能性がある[95]。
致死性エンドトキシン血症と実験的敗血症の両方でSTAT1 [101]の遺伝子欠失によるJAK/STAT1経路の阻害、またはIRF3 [102]のノックアウトによるIFN-β発現の阻害は、有意にHMGB1の放出を減少させ、動物の生存率を向上させる[95,103]。
すでに報告されているように、我々は、EGCGが試験管内試験(in vitro)および前臨床試験の両方でSTAT1活性化を阻害することを実証した[47,50,52,53,54]。したがって、HMGB1分泌に対するEGCGの阻害効果は、カテキンがSTAT1活性を阻害し、結果としてHMGB1の細胞質への転座を阻害することによって媒介されている可能性が示唆される。
敗血症はCOVID-19の一般的な特徴であり、これはしばしば敗血症誘発性凝固障害と関連しており、播種性の血管内凝固を引き起こし、高い関連死亡率をもたらする[104]。
重要なことに、COVID-19患者における2つのアラーミンS100A8/A9およびHMGB1の血清中での過剰産生は、サイトカインストームの明確なシグネチャーと関連していた。これらのパラメータの血清レベルは臨床的に非常に重要であり、予後不良のCOVID-19患者を同定するために利用することができる [105]。
これらの結果と一致して、最近、一部の研究者は、HMGB1をCOVID-19治療における重要な治療標的とみなすべきであると提案した [106,107]。
これらの知見は、HMGB1を標的とすることが有益である可能性があり、Wyganowska-Swiatkowskaら[108]によってすでに示唆されているように、GTE/EGCGはいくつかのメカニズムでその劇症効果を打ち消すことによって敗血症の予防と減少の両方にも有用であることを示している。
8. EGCGと他の緑茶ポリフェノールの抗ウイルス活性
同様に、その抗菌特性に、緑茶ポリフェノールは、DNAとRNAウイルスの広い範囲に対して抗ウイルス活性を有することが知られている。天然カテキンの中で、EGCGは、最も強力なウイルス阻害剤であることが判明し、3-ガロイルと5′-OH基は、この活性[109,110]のために重要な表示される。
特に、EGCGはマイクロモル濃度で単純ヘルペスウイルス(HSV)、C型肝炎ウイルス(HCV)、インフルエンザAウイルス、ヒト免疫不全ウイルス(HIV)、ジカウイルス、デングウイルス、その他多くのウイルスの感染を抑制する[111]。
EGCGの幅広い抗ウイルス特性は、EGCGがヘパラン硫酸またはシアル酸と競合してウイルスの最初の付着を行うため、ウイルス表面タンパク質への高い親和性があるが非特異的な結合によるものである[111,112]。
EGCGのより安定な形態(EGCG-パルミトイルエステル)は、H1N1インフルエンザウイルス、エボラウイルスおよびHSV-2をブロックするために、ネイティブEGCGの8〜24倍の効果があり、長時間(48時間まで)の保護作用を有する[113]。
ところで、EGCG-パルミチン酸塩は、現在、抗菌効果の一般的な増加のために、さまざまな製品の成分として使用されている[113]。
緑茶カテキンは、試験管内試験(in vitro)での結果[116]に加えて、臨床試験[114,115]で明らかになっているように、ヒトにおけるインフルエンザ感染症の予防に有効であることは注目に値する。
したがって、EGCGおよび他の緑茶ポリフェノールは、ヒトおよび動物のウイルス感染症[113]の広い範囲を予防することができる非毒性の薬剤として優れた候補である可能性がある。
一方、緑茶カテキンは、感染した細胞内のウイルスのライフサイクルをブロックすることができる。それはHIV-AIDSに関するものとして、EGCGは、HIV-1逆転写酵素[117,118]をブロックすることにより、試験管内試験(in vitro)でヒト末梢血細胞におけるHIVの複製を防ぐことができる。
さらに、EGCGはCD4受容体の発現をダウンレギュレートし、HIVウイルスのDNAインテグラーゼ結合を減少させることができる[112,119]。さらに、EGCGはHCVのセリンプロテアーゼ活性を8.5 µMのIC50で阻害する[120]だけでなく、HCVの細胞間拡散を阻害する[121]。
また、FDAがカテキン由来の薬剤であるVeregenを、パピローマウイルス性器病変の外用治療薬として承認したことも忘れてはならない(Food and Drug Administration 2006 www.accessdata.fda.gov/drugsatfda_docs/nda/2006/021902s000TOC.cfm)。
コロナウイルス(CoV)は、広範囲の動物宿主に感染するポジティブセンスの一本鎖RNAウイルスである。SARSおよびMERSのCoVと同様に、SARS-CoV-2ゲノムは、ウイルスの複製サイクルに必要な2つのペプチドをコードするORF1aおよびORF1abオープンリーディングフレームを含んでいる[122]。
これらのペプチドのタンパク質分解処理は、パパイン様プロテアーゼと3-キモトリプシン様プロテアーゼ(3-CLpro)をコードするCoVのライフサイクルにおける重要なステップの一つである[123,124]。
Chenらは、EGCGではなくテアフラビン-3,3′-ジガレートが主要なSARS-CoVプロテアーゼ3CLProの阻害剤であり、IC50が7μMであることを報告した[123]。
代わりに、Nguyenらは、IC50が50~80μMの範囲であるケルセチン、EGCGおよびガロカテキンガレート(GCG)が、Pichia pastorisで発現したSARS-CoV-3CLproに対して試験管内試験(in vitro)で阻害活性を示したことを示した[125]。
最近、Khanらは、7つのSARS-CoV-2タンパク質と、以前に抗SARS-CoV剤であると認識されていた18の仮説的阻害剤との分子ドッキングを行った[126]。著者らは、EGCGが3CLProを含む試験したすべてのSARS-CoV-2タンパク質と強い分子間相互作用を示すことを報告した。このin silico研究では、EGCGは抗SARS-CoV-2治療薬として承認されているレムデシビルおよびクロロキンよりもさらに活性が高いことが判明した[126]。
同様に、Bhardwajらは、分子動力学シミュレーションにより、ウーロンホモビスフラバン-A、テアシンセンシン-D、テアフラビン-3-o-ガレートなどの他の茶抽出物成分が、COVID-19療法で使用されている再利用抗ウイルス薬であるアタナザビル、ロピナビル、ダルナビルよりも高いドッキングスコアを有することを報告している[127]。
さらに、Lungらは、カテキンの酸化によって得られ、主に紅茶に含まれるテアフラビンが、SARS-CoV-2 RNA依存性RNAポリメラーゼの触媒ポケットにドッキングすると、より低い結合エネルギーを持つことを発見した[128]。
最後に、Ghoshらは、EGCG、エピカテキンガレートおよびGCGがSARS-CoV-2-3CLProの触媒ポケットのHis41および/またはCys145と強い相互作用を示すことを示したので、これらのカテキンは、潜在的な3CLPro阻害剤である可能性がある[129]。
要約すると、緑茶抽出物に存在する活性分子は、再利用された抗ウイルス薬との複合体よりも多くの水素結合を形成し、重要なウイルス酵素との強い相互作用と安定性を示唆している[127]。
高い期待にもかかわらず、それはこれらの有望な結果は、緑茶ポリフェノールの効果的な抗SARS-CoV-2剤を考慮する前に、細胞と動物モデルの両方で検証する必要があることをここで思い出すべきである。
緑茶カテキンと、特に、EGCGは毒性と良好な人間の腸内吸収を提示しないので、これらの研究は、COVID-19に対する新しい抗ウイルス薬の開発のための試験管内試験(in vitro)および生体内試験(in vivo)実験を設定するための合理性を与える。
9. 結論
EGCGおよび/またはGTEのヒトにおけるすべての特性と安全性プロファイルを考慮すると、カテキンの補充は、SARS-CoV-2感染で生じる炎症損傷を制御するのに少なくとも部分的に有効であると推測することができる。
EGCG投与がCOVID-19の転帰を改善するという仮説を支持する直接的な証拠は今のところ存在しないことを忘れてはならない。この仮説の限界は、本レビューで報告された結果が、免疫活性化が制御されていない他の感染症や疾患からのものであるという事実にある。いずれにしても、COVID-19に対する有効性は評価されるべきである。
そこで、増悪したサイトカインの放出を抑制することを目的としたマルチタスク型抗炎症剤として、抗ウイルス剤や他の抗炎症剤に加えてEGCGを用いたCOVID-19の臨床試験を設定することを提案する。
COVID-19患者さんへのEGCGの適時投与が最も重要であることを考慮し、症状が悪化し、血中C反応性蛋白などの炎症マーカーが上昇した時点で、EGCGを600~900mg/日の用量で経口投与することを推奨する。
EGCGの投与により、炎症マーカーの低下につながる症状のさらなる悪化を防ぐことができると期待している。最後に、EGCG投与により、敗血症や肺線維症に関連した凝固症も改善されることを忘れてはならない。

