Contents
SARS-CoV-2スパイク蛋白質を中心に、特にCOVID-19脳感染と神経症状に注目して検討する
概要
スパイクタンパク(Sタンパク質)は、ヒトアンジオテンシン変換酵素2(ACE2)に強力に結合することが報告されているように、細胞に感染するためのウイルスの「鍵」である。実際、スパイクの構造と機能は、脳への侵入だけでなく、細胞感染にも非常に重要であることが知られている。異なるタイプのコロナウイルスは呼吸器系に影響を与えるだけでなく、中枢神経系(中枢神経系)にも侵入する可能性があることを示す証拠が増えてきている。
しかし、COVID-19が脳内に存在することについては、これまでのところほとんど報告されておらず、このウイルスが肺と脳の軸を利用して神経細胞に到達する可能性については、完全には理解されていない。
本論文では、SARS-CoVおよびSARS-CoV2のスパイクタンパク質の配列、構造、および静電ポテンシャルを計算機的アプローチを用いて評価した。その結果、SARS-CoV-2とSARS-CoVのSタンパク質は非常によく似ており、77%の配列同一性を共有していることがわかった。
また、SARS-CoV-2のSタンパク質は、SARS-CoVのSタンパク質に比べて、正に帯電している残基が4つ多く、負に帯電している残基が5つ少ないことから、正に帯電している残基がわずかに多いことが分かった。Sタンパク質の宿主ACE2受容体への結合を解析したところ、SARS-CoV-2はSARS-CoV Sタンパク質よりも30%高い結合エネルギーを示した。
これらの結果は,SARS-CoV-2による中枢神経系感染症に関連した細胞の侵入機構,血液脳関門の横断,臨床的特徴の理解に有用であると考えられる。
結果と考察
今回の研究により、SARS-CoV-2 Sタンパク質はSARS-CoVタンパク質よりもわずかに正に帯電しており、正に帯電している残基が4つ多く、負に帯電している残基が5つ少ないことが明らかになった。SARSCoV-2とSARS-CoVのSタンパク質の間の電荷の差が小さくても、ウイルス粒子上に存在するSタンパク質の数が多いと、この効果が増幅される。
SARS-CoV-2とSARS-CoVのSタンパク質の間の電荷のこの違いは、細胞の接着と血液脳関門28,29を横断する際に大きな影響を与える可能性がある。
一方、ヒトACE2結合界面は、主に負の静電ポテンシャルを持つ傾向があり(図4)、したがって、オープンおよびクローズの両方のコンフォメーションにおいて、SARS-CoV-2 Sタンパク質とより強く相互作用する。SARS-CoV-2とSARS-CoV Sタンパク質の配列、3次元構造、および静電ポテンシャルを比較すると、両タンパク質は保存された配列と構造的特徴を持っているが、その外表面と宿主との相互作用界面の両方で異なる静電特性を持っていることが明らかになった。
前述のように、SARS-CoV-2 Sタンパク質は、SARS-CoVのそれよりもこれらの領域でわずかに正に帯電しており、これは、非特異的かつ特異的な相互作用を介して他の分子の負に帯電した領域に結合する親和性の増加につながるであろう。
さらに、RBD-ACE2界面におけるSタンパク質のアミノ酸含量のいくつかの違いは、宿主受容体とのより特異的な相互作用の確立につながる可能性がある。
したがって、SARS-CoV-2は、非特異的相互作用および特異的相互作用の両方を介して、SARS-CoVよりも、人体全体で異なる標的との相互作用を確立する可能性が高い。
このすべてのことは、最終的には、SARS-CoV-2がヒト細胞に入る能力を高め、SARS-CoVに関してBBBのような負の電荷障壁に結合することができる。ここ数ヶ月の間、Sタンパク質の構造および静電特性は、多くの調査の対象となっている。
以前に説明したように、スパイクタンパク質とACE2は、キーではなく、排他的ではなく、細胞内へのウイルスのエントリのサイトを表し、したがって、神経細胞のウイルス感染のための非ACE2経路も排除することはできない37。
COVID-19は、ニューロン、アストログリア細胞に感染し、エンドサイトーシスによってアストロサイトに入るかどうかは研究されていない。
全体的に、この研究で行われた計算アッセイを考慮すると、スパイクタンパク依存性経路は、細胞の侵入とBBB交差には、クラスリン依存性エンドサイトーシスよりも重要であると考えられることを示唆している。
したがって、Spike依存性経路は、特定の抗体の治療戦略やワクチン生産研究において考慮されるべきである。
ウイルスがどのように脳内に侵入するかにかかわらず、COVID-19患者には考慮すべきいくつかの中枢神経系合併症がある。脳幹内のウイルスの存在は、呼吸だけでなく、呼吸中枢のニューロンと同様に呼吸に関連する化学反応を感知する神経細胞に影響を与える可能性があり、このように肺の換気機能にダメージを与える37 。
これは、SARS-CoVが複製に依存する方法でACE2タンパク質の発現をダウンレギュレートすることが示されている38。これらの知見を裏付けるように、SARS-CoV 感染と SARS-CoV の Spike タンパク質が ACE2 発現を低下させ、マウスに SARS-CoV Spike を注射すると生体内で急性肺不全が悪化することが明らかになっている39 。
SARS-CoV と COVID-19 の類似性が高く、COVID-19 の結合エネルギーが SARS-CoV S タンパク質よりも高いことから、SARS-CoV-2 も脳を含む様々な臓器で ACE2 をダウンレギュレートする可能性があるという仮説が立てられている40,41 。このダウンレギュレーションは、この複雑な物語の一部である可能性がある。
ACE2 の活性を阻害すると、心拍数を制御する圧受容器反射の感度が低下し、交感神経の緊張が高まり、最終的には血圧上昇や心機能障害を引き起こす。
一方、肺損傷時の炎症性サイトカインの増加、低酸素血症、ACE2 ダウンレギュレーションによる交感神経緊張の上昇は、中枢神経系の亢進をもたらし、神経障害後の生命を脅かす合併症である神経性肺水腫(NPE)42 の病因形成に重要な役割を果たしている可能性がある43 。
脳感染の考えを支持するものとして、最近の症例報告では、過去の病歴のない患者がCOVID19感染によるものと思われる頻回の発作を示したことが報告されている44。発作の病因については、脳組織への直接浸潤、ウイルスによる毒素の産生、脳による炎症性サイトカインの増加など、いくつかの機序が考慮されている45。
最近では、COVID-19が炎症性カスケードを開始し、その結果、サイトカインストーム症候群と呼ばれる炎症性サイトカイン46を放出することが報告されている47。これらのサイトカインはグルタミン酸受容体の活性化を介して神経細胞の興奮性を亢進させ、急性発作の発症に関与していることが報告されている48-50 。
また、症例報告研究では、SARS-CoV-2を合併した自己制限型脳症の一例が紹介されている。著者らは、ウイルスのクリアランスとマンニトールの使用で、脳脊髄液 の圧力が徐々に減少し、患者の意識が改善される可能性があることを示唆した51 。
最近の研究では、入院した重症のCOVID-19患者の神経学的特徴が報告されている。この評価では、13人の患者に脳の磁気共鳴画像(MRI)が実施された。これらの患者には脳卒中を示唆する病巣徴候はなかったが、原因不明の脳症的特徴があったためにMRIを受けた。脳MRIを受けた13人の患者のうち2人には単発性の急性虚血性脳卒中が認められた。
著者らは、これらの特徴のうち、重篤な疾患に関連した脳症、サイトカイン、薬物の効果や休薬に起因するものと、SARS-CoV-2感染に直接起因するものを認識するにはデータが不十分であると結論づけた。
COVID-19患者では、嗅覚機能障害52,53および老年期障害54とも呼ばれるウイルス後無呼吸症が他の神経学的症状として報告されている。最近では、イランの10.069例を対象とした横断的研究では、COVID-19のパンデミックと嗅覚機能障害の一致が報告されている55。これに関連して、最近、Lechienらは、軽度から中等度のCOVID-19感染者では嗅覚・味覚機能障害がパンデミックしていることを報告している56。
この関連性を説明するためにいくつかのメカニズムが提唱されているが、その中には、1)鼻の屋根や中枢嗅覚処理系の嗅覚受容体細胞の神経上皮レベルでの損傷55 2)中枢嗅覚経路や脳の他の領域の損傷57-59 3)炎症や正常な嗅覚機能に必要な鼻の上皮細胞への損傷の可能性60などがある。
そのため、上皮細胞の損傷と中枢神経系の関与の両方が原因として報告されているが、その正確な病態生理は未だ解明されていない53,61 。
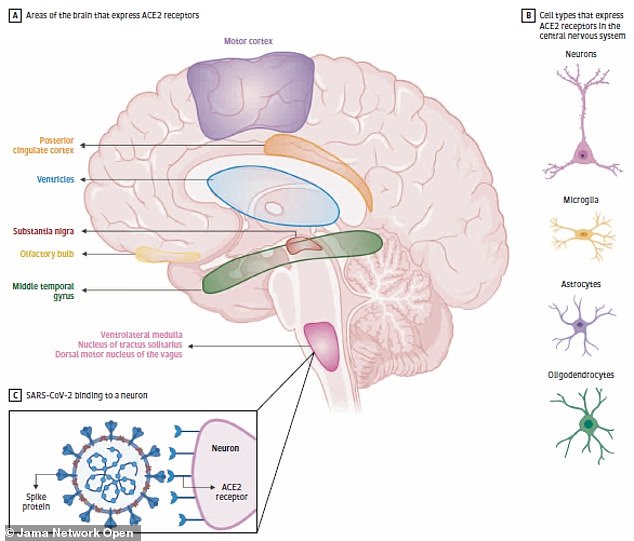
Baig et al.10が提案した神経栄養学的メカニズムによれば、他の中枢神経系を標的とした病原体で報告されているように、転写経路を介してCOVID-19が脳にアクセスすると仮定し、嗅球からウイルスが侵入し、血液の微小循環を利用して、COVID-19が大脳循環にアクセスし、神経細胞上に発現しているACE2受容体と相互作用する可能性があると考えられる。
結論
COVID-19患者の神経学的症状を考慮すると、本研究で得られたバイオインフォマティクスの結果から、COVID-19はSARS-CoVよりも正電荷を帯びたスパイク蛋白質の構造とSARS-CoV-2:ACE2相互作用の結合自由エネルギーが高いことから、COVID-19はSARS-CoVよりも高い効率で細胞内に侵入し、脳に到達することが推測される。
このような神経侵襲性の特性を考慮して、基礎研究や臨床研究を進めるとともに、治療法の優先順位付けや個別化を図ることが必要である。
脳血管疾患および虚血性脳卒中の高リスク群におけるCOVID-19受容体ACE2発現の変化
www.sciencedirect.com/science/article/pii/S0006291X20311505
ハイライト
- COVID-19受容体ACE2のアップレギュレーションは、MCAO後の脳における
- タバコの煙によるACE2のアップレギュレーション、脳血管疾患の高リスク因子。
- 糖尿病患者のマウス脳とヒト血管におけるACE2の増加。
要旨
コロナウイルス病2019(COVID-19)は世界的なパンデミックである。ヒト間での感染率が高く、世界的な公衆衛生の脅威となっている。しかし、有効な予防薬や治療薬は存在しない。本疾患に対する適切な保護とケアのためには、脆弱で影響を受けやすいグループを特定する必要がある。
最近の研究では、COVID-19が機能性受容体としてアンジオテンシン変換酵素2(ACE2)を有しており、糖尿病や喫煙などの脳血管疾患の危険因子を有する患者において、脳卒中を含む重篤な脳血管疾患(脳血管疾患)の発症につながる可能性があることが報告されている。
このため、世界保健機関(WHO)は、喫煙者や心血管疾患を含む基礎臨床症状を有する患者に対して、COVID-19の投与に注意するよう勧告している。ここでは、ラット中大脳動脈閉塞(MCAO)モデルの脳内でACE2の発現を観察し、血管内のACE2発現に及ぼすタバコ煙抽出物(タバコ煙抽出物)と糖尿病の影響を評価した。
その結果、ACE2発現量は虚血性脳梗塞後の大脳皮質五分脊椎において増加することが明らかになった。タバコ煙抽出物投与はヒトの脳血管においてACE2発現を有意に上昇させた。糖尿病の初代培養ヒト血管では、健康なコントロールと比較してACE2発現が上昇していることを明らかにした。
本研究は、糖尿病や喫煙にさらされた虚血脳や血管においてACE2発現が上昇し、COVID-19感染に対して脆弱になることを示している。
序論
Zhouらは、SARS-CoV-2がSARS-CoVと同じ受容体であるACE2を共有していることを報告している[7]。しかし、SARS-CoV-2は別のコロナウイルス受容体であるジペプチジルペプチダーゼ4(DPP4)を使用していないのに対し、MERS-CoVは使用している[8]。
SARS-CoV-2のSタンパク質がACE2に結合するという考えを支持する証拠が増えている。これらの研究は、SARS-CoV-2の細胞内への侵入がACE2を介して媒介されていることを示唆している。
SARS-CoV-2の感染は肺に重篤な損傷を与えることから、SARS-CoV-2ウイルスは肺胞上皮層の肺胞細胞で発現しているACE2を利用して感染する可能性がある。しかし、SARS-CoV-2は内皮機能障害を有する臓器だけでなく[9]、死後の脳でも観察されることが臨床研究で明らかになってきている[10]。
ACE2を発現する細胞はSARS-CoV-2感染のリスクを持つ可能性があるため、脳内の様々な条件下でACE2発現プロファイリングを行うことで、COVID-19と神経疾患を含む心血管合併症の発症過程を理解することができる。
COVID-19患者のうち、喫煙や糖尿病などの危険因子を持つ人では、新規発症脳血管疾患が増加する。中国疾病管理予防センターは、糖尿病を有するCOVID-19患者では死亡率が高いと報告している[11]。
韓国では4月30日時点で247人の死亡が発生しており、そのうち244人が基礎疾患による死亡であるとKCDCが報告している。その中で、糖尿病、脳卒中、高血圧などの代謝性疾患や心血管疾患を基礎疾患とするCOVID-19患者の死亡率は高い[12]。
COVID-19患者を特徴づける臨床データは、喫煙および糖尿病を含む脳血管疾患危険因子がCOVID-19の負の進行および有害転帰と関連している可能性が高いことを示す証拠を与えている[13]。
最近では、喫煙者の脳内で高レベルのACE2が観察されている[14]。このことから,喫煙と糖尿病は,ACE2の高発現からSARS-CoV-2の脳内への侵入・感染能力を高めていると考えられる.
本研究では、虚血性脳卒中患者の脳におけるACE2発現の変化、およびタバコ煙抽出物や糖尿病などの脳血管疾患危険因子がACE2発現に及ぼす影響を調べた。その結果、虚血性脳梗塞の大脳皮質前庭でACE2発現が変化していることを明らかにした。また、タバコ煙抽出物に曝露された脳微小血管や糖尿病患者由来の内皮細胞では、ACE2発現が高度に増加していた。
4. 議論
我々のデータは、SARS-CoV-2の機能受容体であるACE2が脳血管疾患の脳内でアップレギュレーションされ、その危険因子は糖尿病とタバコの煙であることを示している。結論を出すには大規模な臨床研究が必要であるが,糖尿病患者,脳卒中患者,喫煙者をSARS-CoV-2感染症に罹患しやすい集団として特定し,適切な保護とケアを行う必要がある.
ACE2は、肺、動脈、心臓、腎臓、腸、脳を含むすべての組織で発現している。それは、アンジオテンシン1-7(血管拡張剤)にアンジオテンシンII(血管収縮剤)の加水分解を介して血圧を調節する。
過剰なアンジオテンシンIIは、炎症、フリーラジカルの生成、および炎症性細胞のリクルートに関連する多様な細胞シグナル伝達経路を活性化する。したがって、ACE2の欠乏はアンジオテンシンの増加を引き起こし、反応性酸化ストレスと炎症の異常な産生を介して臓器障害を引き起こす[18]。
ACE2の欠乏は、アンジオテンシンIIによって誘導される高血圧の増悪および心肥大と関連している[19]。
ACE2とアルツハイマー病
いくつかの研究では、ACE2の欠損が脳卒中、アルツハイマー病(AD)[16]、高血圧症[20]の進行に関与していることが示されている。逆に、ACE2の過剰発現は、ADの病態に関連する炎症反応性をブロックする。したがって、疾患の進行におけるACE2の欠乏は、制御されていないサイトカイン産生を引き起こす可能性がある。
WHOは喫煙や糖尿病がCOVID-19感染の高リスク因子であることを示唆しており、これらの高リスク群における脳血管疾患におけるACE2発現パターンを調査することになった。今回のデータでは、脳卒中後の再酸素化の際にACE2のmRNAとタンパク質量が徐々に増加し、虚血後21日目には偽コントロールと比較してタンパク質量が有意に増加していることが示された(図2)。
我々のデータを支持する研究では、ACE2発現が増加した虚血性脳卒中後にACE2/アンジオテンシン1-7/MAS受容体シグナル伝達軸が活性化されており[21]、血管拡張および抗炎症反応において治療的な役割を果たしている可能性がある[22]。ACE2由来のAng1-7を投与することで、酸化ストレスや炎症を抑制し、虚血性脳卒中後の神経障害を改善することが示唆されている[23,24]。
脳卒中患者のACE2上昇
このように、今回のデータでは、虚血性脳梗塞後の亜急性期および慢性期におけるACE2の増加は、傷害細胞の修復や血圧低下以外にも有益な効果をもたらす可能性があると考えられる。つまり、脳卒中患者や脳卒中を経験したことのある人の脳では、ACE2が上昇している可能性があることを示している。しかし、このような虚血性傷害に続くACE2発現の誘導は、COVID-19の感受性につながる可能性がある。
in vivoでの研究では、SARS-CoVを介した内在化によるACE2発現の調節は肺不全を悪化させることが予測された [25]。したがって、脳卒中患者はCOVID-19のパンデミックの間は特に注意が必要であろう。
COVID-19は、喫煙や糖尿病などの危険因子を有する人に新たに発症する脳血管疾患を引き起こす。しかし、COVID-19が脳卒中を含む脳血管疾患をどのように誘発するかについては、現在のところ十分なエビデンスがない。
血栓症
最近の報告では、COVID-19が血液中の血栓形成など、脳血管疾患の病理学的進行に関与する炎症を誘発する可能性が示唆されている[26]。血液凝固は、ヒストン[27]、HMGB1[28]、微小粒子[2]、分泌された顆粒タンパク質[29]などの細胞成分によって形成され、これらは内皮細胞から放出されたプロ線溶剤によって分解され得る[30]。このように、内皮機能障害の表面では、細胞や蛋白質物質が会合し、結果として血栓を生成する[30]。
二型糖尿病
特に、II型糖尿病患者では、血栓の増加やBBB障害が観察されている[31]。今回のデータでは、T1DおよびT2D患者では、健常者と比較して血管内ACE2レベルが増加していることが示された(図4)。これらの結果は、ACE2を介したSARS-CoV-2の血管への細胞侵入により、糖尿病発症前よりも血管が弱くなり、血栓を介して脳への血液供給が阻害される可能性を示唆している。
しかし、COVID-19誘導性脳血管疾患の正確なメカニズムは必要とされている。糖尿病と同様に、喫煙は脳血管疾患だけでなく、慢性閉塞性肺疾患(COPD)を含む肺疾患の危険因子として知られている。
タバコ煙抽出物のBBBに対する劇症的影響は、ICAM1やVCAM1などの炎症関連遺伝子をアップレギュレートすることが知られている。血管では、プロ炎症性サイトカインに反応してICAM1やVCAM1が増加することで、好中球やマクロファージを含む白血球の接着に重要な役割を果たし、BBBの破壊や脳の炎症を引き起こす。
しかし、タバコの喫煙に伴うACE2の発現については議論の余地がある。最近の臨床研究では、喫煙者の気道でACE2発現が増加しており、これはニコチンアセチルコリン受容体のα7サブタイプの発現と相関していることが示された[26]。
ニコチンのACE2発現の低下
一方、タバコの成分であるニコチンは、脳血管疾患の一次神経細胞やグリア細胞でACE2の発現を低下させた[32]。しかし、本研究では、脳内皮細胞とアストロサイトにおいて、タバコ煙抽出物後のACE2発現のアップレギュレーションが明らかに認められた(図3)。同じ条件で、タバコ煙抽出物 はヒトの脳血管の ICAM1 蛋白質レベルを増加させた(図 3)。
タバコ抽出物の脳炎症誘導
さらに、我々の先行研究では、タバコ煙抽出物がアストロサイトの再活性化を介して脳の炎症を誘導するという証拠が得られている[15]。これらの結果から、喫煙歴のあるCOVID-19患者では血管系が弱く、重篤な症状になりやすいことが示唆された。
本研究では、脳卒中後の脳でACE2発現が増加していることを示した。マウス脳や糖尿病を有するヒト血管では、ACE2発現が上昇していた。血管内のACE2発現に対するタバコ煙抽出物のin vitro効果を示した。
最後に、本研究で得られたデータのin vivoでの妥当性については、ヒト集団を用いて検証する必要があるが、脳卒中、糖尿病、喫煙などの基礎疾患を有する患者では、COVID-19の使用には注意が必要であると考えられる。