Contents
日常生活中での慢性炎症 緩和因子としての食生活の変化
pubmed.ncbi.nlm.nih.gov/32531935/
要約
西洋社会のほとんどの人が採用しているライフスタイルは、代謝性疾患(糖尿病、癌、心血管疾患、神経変性疾患など)の傾向に重要な影響を与えている。
これは、STAT3(シグナル変換器および転写活性化因子3)、IKK(IκBキナーゼ)、MMP9(マトリックスメタロペプチダーゼ9)、MAPK(マイトジェン活性化プロテインキナーゼ)、COX2(シクロオキシゲナーゼ2)、およびNF-Kβ(活性化B細胞の核因子κ-軽鎖-エンハンサー)などの様々な分子経路の活性化によって駆動される、慢性的な低悪性度炎症を伴うことが多い。
複数の介入研究により、ライフスタイルの変化が炎症の減少と健康の改善につながることが実証されている。これは、人間が少量の食事因子と複雑な組み合わせ(例えば、ポリフェノール、繊維、多価不飽和脂肪酸など)に継続的にさらされていることから、実生活のリスクシミュレーションの概念と結びつけることができる。
1日に一定量の食物繊維を摂取している患者では、炎症バイオマーカーが改善される;一部の患者では体重が減少している。カロリー制限と組み合わせた断食は、m-TOR、FOXO、NRF2、AMPK、サーチュインなどの分子メカニズムを調節し、最終的には炎症性マーカーレベルの有意な低下と代謝マーカーの改善につながる。
個人レベルで、また学校や病院などの公的機関で、より健康的な食生活を送ることができれば、公衆衛生の向上、医療費の削減、そして主に代謝性疾患を持つ個人に影響を与える伝染病(COVID-19など)に対するコミュニティの回復力の向上につながると考えられる。
1. 前書き
慢性炎症
慢性炎症は、神経変性疾患(アルツハイマー)、悪性疾患、自己免疫疾患を含む多くの代謝性疾患(例えば、肥満、メタボリックシンドローム、糖尿病、脂質異常症など)に関与する中心的なプロセスである。
すべての慢性炎症性疾患ではないにせよ、ほとんどの場合、白血球の大量流入による炎症の解決が広範囲に失敗しており、炎症を解決しようとする白血球は、プロ炎症性分子の合成を刺激し、高度に炎症性の微小環境を確立し、広範な線維化と組織損傷を引き起こする[1]。
慢性的な低悪性度炎症は、インスリン抵抗性や脂質異常症などの代謝障害を誘発または悪化させ、他の合併症の発症に寄与することが示されている[2]。自己免疫疾患の場合、免疫系が自己耐性を失い、体の細胞や組織を攻撃すると、代謝障害が疾患進行の主な要因となるという証拠が蓄積されている。
1型糖尿病
1型糖尿病の予知・予防研究の結果から、1型糖尿病では代謝障害が自己抗体陽性への血清転換に数ヶ月から数年先行していることが示された[3,4]。多くの慢性炎症性疾患は、バランスのとれていない食生活に起因するか、またはその発症を促進している。
正確なメカニズムは不明のままであるが、De Rosaらは、カロリー摂取量の増加の結果としての代謝圧力が、脂肪組織の恒常性の変化につながることを示唆している。この結果、アディポカインの合成が行われ、栄養感知メカニズムの過剰活性化が促進され、プロ炎症性および調節性T細胞間のバランスが変化し、最終的には免疫耐性の喪失につながる[5,6,7]。
腸内細菌叢
さらに、食事成分は、腸内細菌代謝の調節を通じて免疫応答に影響を与える能力を有しており、消化管で直接、あるいは一般代謝に影響を与える他のより遠い臓器で慢性疾患を発症するリスクに影響を与える [8,9,10,11]。
農薬・食品添加物
最近の研究では、農薬、食品添加物、食品コーティング材料に含まれる添加物など、現代の生活習慣の一部となりうる化学物質の低用量混合物への長期暴露を調査し、軽微な生化学的障害から異なる障害が現れることを証明してきた。これらの初期の変化は一般的に、曝露の期間に応じて酸化ストレスの誘導と臓器障害が続く[12,13,14,15,16,17]。
ストレス
最近では、ストレス因子への長期曝露が、微生物やウイルス感染に対する集団の脆弱性の増加と正の関係を持つことが示されている[18]。
メタボロミクス
メタボロミクスは、生物学的マトリックス中の代謝物と呼ばれる多数の低分子を同定し、同時に測定することを可能にする新興の生物学分野である。代謝の不均衡を検出する最も正確な方法となっており、病気の予防や早期発見に有用である。さらに、メタボロミクスは臨床現場での幅広い応用が期待されている[19]。
ターゲットメタボローム解析は、内因性代謝の正常な機能、食事摂取量、マイクロバイオータ、薬物代謝、および栄養素の適切性に関する洞察を提供する[20]。早期診断に関する慢性炎症性疾患の課題は、高リスク集団を識別できるバイオマーカーを同定することで、メタボロミクスを用いて取り組むことができる。
自己免疫疾患患者のグループでは、脂肪酸ベースの代謝プロファイルと身体活動や飲酒などの生活習慣因子が自己免疫疾患の貴重な予測マーカーであることが明らかになった[21]。
低用量暴露
人間は、食品、水、化粧品、空気などから多数の物質に低レベルで曝露されており、それぞれが累積的/相乗的な効果を誘導することができる。これまでの研究では、実験動物に単一の物質を中高用量で投与した場合の効果に着目した研究が多く行われてきた。
最近では、個々の成分では効果が得られなかった濃度の化学物質の混合物を個別に試験した場合に悪影響を及ぼすというエビデンスが増えてきたことから、実生活リスクシミュレーションという概念が登場してきた[14]。
現実のリスクシミュレーションの概念は、食事介入を取り入れることも可能である。なぜなら、私たちは食生活の中で多様な量の無数の物質に体をさらすからである[14,22,23]。
炎症調節因子
炎症調節因子の発見は、低悪性度慢性炎症をクリアするための治療法に新たな窓を開いた。多数の生理的プロセスが炎症を調節する生理的プロセスを促進する。このようなアプローチの開発は、主に適切なヒトモデルの欠如および炎症性疾患の不均一性によって妨げられている、炎症の間に自然に起こる内因性プロセスの刺激を対象としている。
もう一つの限界は、炎症と代謝物の異なる段階を捉えることができる感度の高い測定法がないことである[24,25,26,27,28]。
本論文では、食事が免疫応答に与える影響を評価することを目的としており、特にライフスタイルの変化が低悪性度炎症の緩和にどのように役立つかに注目している。
この分析は、現在のSARS-COV-2のウイルス感染拡大の文脈では、炎症が再び急性病理学的反応の最前線にあることから、非常に関連性が高いと考えられる。免疫応答を調節する戦略を特定することは、気道へのウイルスの影響を軽減し、各患者や一般的な医療システムへの影響を軽減するために有用であることが証明されるかもしれない。
2. 食事頻度調査、食事性炎症指数、メタボロミクス
栄養評価
食生活、代謝、および栄養摂取量を評価する研究の大部分は、食品頻度調査票に基づいている。しかし、食物頻度調査票(FFQ)には、食物の選択に関する回答が一貫していないことなど、いくつかの制限があるが、その多くは回答者の記憶に依存するためである。
さらに、訓練を受けた医療専門家ではなく回答者が記入するFFQは、多量栄養素の摂取量の概要を提供するだけで、その人の微量栄養素の状態を完全に把握しているわけではない [29]。
微量栄養素欠乏
微量栄養素の欠乏は、世界保健機関(WHO)[30]によると、開発途上国と富裕国の両方で一般的であり、世界で20億人に影響を与えている。微量栄養素不足または「隠れた飢餓」の主な原因は、微量栄養素の食事摂取不足であるが、その他の社会経済的要因も重要な役割を果たしている[31]。
食餌性炎症指数(DII)
炎症状態を評価するための食事と栄養素の評価ツールがいくつか開発されている。食餌性炎症指数(DII)は文献データに基づいており、回答者が親炎症性または抗炎症性の食事をしているかどうかを評価することを目的としている。その開発以来、DIIへの関心が高まっているが、同様の有効性を持つ他の指標も開発されている[32]。
これらの指標の重要な限界は、人の症状との因果関係や直接的な関連性がないことである。したがって、これらの指標の臨床応用は妨げられている。
自己記入式質問表
欧州栄養医学研究所(European Institute Of Nutritional Medicine)によって開発された新しい経験的なクローズドエンドの自己記入式質問票は、自律神経系と炎症との相互作用を捉えた炎症状態スコアを提供している[33]。
自律神経系の不均衡が様々な疾患に見られる局所的または全身的な炎症を反映しており、食事や生活習慣の要因が交感神経と副交感神経の活動[34,35,36,37]の調節因子として作用することができるという証拠が増えてきている。23問の質問シリーズを通して、回答者はさまざまな身体システムにおける炎症反応の有無および状態に関するデータを提供する。
栄養医学テスト(Numex)
全体として、栄養医学テスト(Numex)は118問の問題で構成され、炎症、栄養、知覚ストレス、酸化、糖代謝、アミノ酸代謝、腸内マイクロバイオームの7つのカテゴリーで栄養欠乏の状態を評価する。
医師や栄養士によって設計されたこの経験的検査の目的は、自律神経系の変化に基づいて全体的な炎症状態を評価し、目標とする生活習慣の変化の後にその進行を追跡するために、個人と医療従事者を支援することである。
分子レベルでは、メタボロミクスは代謝の時間依存性の小さな変動を捉えることができる唯一の方法であり、NCDに関連した代謝の不均衡を示している[21]。全体的に、FFQ や DII を含む伝統的で確立された食事と栄養の評価方法は、本レビューで議論されているように、特定の食品が健康と疾患に果たす役割について貴重な情報を提供してきた。
高度なツールの出現により、メタボロミクスは標準的なアプローチを補完し、その時々の個人の特定のニーズに応じたオーダーメイドの推奨事項を提供するようになった。
3. 炎症を抑える方法としての食生活習慣の変化
最近の文献では、BMIのカットオフ値は、肥満に関連する代謝障害を十分に描写していないと考えられている。BMIは数学的な近似値であり、体脂肪と総体筋肉または骨量との間の総体脂肪の割合を反映していない。そのため、BMIは心代謝リスクを反映していない。
より包括的な分類は、肥満の個人のための 4 つの表現型を記述する
- 正常体重肥満(NWO)
- 代謝的に肥満の正常体重(MONW)
- 代謝的に健康な肥満(MHO)
- 代謝的に不健康な肥満(MWO)、または MS との「リスクで」肥満。
この分類は、BMI、脂肪質量、およびウエスト周囲だけでなく、一般的な生化学的パラメータ (例えば、空腹時血漿グルコース、総コレステロール、LDL、HDL、トリグリセリド) [38,39,40,41,42,43] を考慮に入れている。
4つのクラスはすべて、炎症性経路の異なる重症度の障害によって特徴づけられる[38,40]。
ライフスタイルと栄養は、慢性炎症の調節において遺伝学と相互作用し、前述の合併症につながる修正可能な因子である。
ウエスタンダイエット・加工食品
西洋社会における栄養パターンの変化は、脂肪およびエネルギー密度の高い加工食品の多量摂取だけでなく、繊維、果物、および野菜の摂取量が少ないことに起因しており、喘息、アレルギー、および炎症性機序を伴う自己免疫疾患の有病率の上昇と関連している[44,45]。
高脂肪食
高脂肪食は、特に次のようなことを決定する:腸内炎症、グラム陰性腸内細菌からのリポ多糖類(LPS)吸収を促進し、インスリン抵抗性および炎症を誘導するリポペルオキシデーションを増加させる。
飽和脂肪酸
飽和脂肪酸とLPSは、トール様受容体4(TLR4)のシグナル伝達経路を活性化し、全身の炎症とその結果として生じる代謝障害の促進にさらに貢献している[46,47,48,49,50,51,52](図1)。
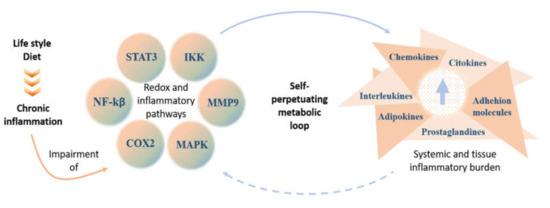
図1. ライフスタイルに関連した低悪性度慢性炎症における代謝経路の障害。
- STAT3(signal transducer and activator of transcription 3)
- IKK(IκB kinase)
- MMP9(matrix metallopeptidase 9)
- MAPK(mitogen-activated protein kinases)
- COX2(cyclooxigenase 2)
- NF-Kβ(nuclear factor kappa-light-chain-enhancer of activated B cells)
- 生活習慣や食事誘発性の炎症は、いくつかの細胞経路に影響を与え、様々なプロ炎症性分子の合成と分泌を刺激する。これは最終的に低悪性度の炎症状態を維持する。
果物・野菜、繊維質
興味深いことに、果物、野菜、および繊維質を豊富に含む食事を摂取している集団は、欧米の集団と比較して炎症性疾患の発症率が低い [53,54]。
地中海式ダイエット
オリーブオイル、魚、野菜、果物をベースとした地中海式の食事は、無数の有益なファイトケミカルを組み込むことに加えて、心血管疾患を抑制する[55,56,57,58]。
オーガニック食品
有機農業から食品を調達することは、慢性腎臓病を持つ男性患者の有機および非有機の地中海料理を比較する研究で示唆されたように、さらに地中海料理の有益な健康効果を向上させることができる[59]。
動物実験では、農薬混合物への暴露が毒性の源になり得ることが繰り返し発見されているので、これは、農薬への暴露が減少したことに起因すると仮定された[16]。しかし、ほとんどの研究では、有機食品の消費者の方が健康的であることがわかっているが、健康上の利点が合成農薬への暴露の減少に帰することができるかどうかは明らかではない[60]。
葉酸とメチオニン/エピジェネティクス
特定の代謝物を含む食事の変化は、DNAメチル化またはクロマチンリモデリング(例えば、ヒストンアセチル化または脱アセチル化)などのエピジェネティックな修飾を介して遺伝子発現を調節することができる。例えば、葉酸とメチオニンが豊富な食事は、肥満に関連する炎症に関連する分子経路に直接影響を与える宿主のエピゲノムを形成することができる。
DNAメチル化
さらに、肥満の被験者に由来する脂肪細胞におけるグローバルなDNAハイペルメチル化は、炎症性相互作用に関与する遺伝子の発現と相関している[61,62]。例えば、高脂肪食を与えた肥満マウスの脂肪細胞では、アディポネクチン遺伝子のプロモーター部位の上流1kbでのハイペルメチル化が観察されたが、ヒトの脂肪細胞でも観察された。
DNA メチルトランスフェラーゼ1(DNMT1)の発現は、アディポネクチン遺伝子のメチル化と相関しており、肥満マウスではアディポネクチンの発現が低下し、健康マウスでは発現が増加した。ヒト脂肪細胞を対象とした研究では、DNMT1発現とBMIとの間に相関関係があり、肥満がアディポネクチン遺伝子のメチル化亢進の原因または補因子であることが示唆されている[63,64]。
過剰な活性酸素
また、エピジェネティックな変化を誘発するもう一つの要因として、肥大化した脂肪組織での活性酸素の過剰産生があり、ヒストンのアセチル化/脱アセチル化平衡に影響を与え、NFκBの活性化を誘発することが示唆されている[65,66,67]。
栄養制限
一方、栄養制限は、AKT(プロテインキナーゼB)活性を低下させ、FOXO(フォークヘッドボックスO転写因子)活性を刺激することで、細胞代謝、オートファジー、ストレス応答に関与するタンパク質の発現を刺激し、炎症の解消に寄与する[61,62]。絶食レジメンは、体重減少と関連しているかどうかにかかわらず、インスリン感受性の上昇、血圧の改善、炎症状態の改善と相関している。
例えば、15日間の断続的な絶食は、体重の有意な減少を伴わずに、痩せた若い男性(BMIが25kg/m2)において、グルコース取り込み率の増加と抗炎症性アディポネクチンの有意な増加を誘導した。これらの結果は動物実験のデータと一致していた [68,69]。
腸内細菌と慢性炎症
主に生活習慣に影響される低悪性度炎症の重要な原因因子は、腸内細菌叢の障害である。バクテロイデット類と定着菌は腸内細菌叢の約90%を構成しているが、その均衡は加齢とともに、また食事構成によって根本的に変化している。
加齢による多様性の低下
加齢や肥満者では、微生物相の多様性の低下が起こる。腸内細菌叢の異常は、肥満、糖尿病、心血管疾患、神経変性疾患などのいくつかの炎症性病態に見られる。腸内マイクロバイオームは自然免疫応答と密接に関連しているため、これは慢性的な低悪性度炎症の誘発と関連している可能性がある[70,71,72]。
腸内微生物叢と宿主免疫
腸内マイクロバイオームと宿主免疫系との関係は、生活習慣の介入によって影響を受ける。例えば、定期的な絶食後に分泌性IgAレベルが上昇する。これは腸内マイクロバイオーム組成の変化と関連しており[14,73]、プロテオバクテリアが適応性体液性局所応答を調節している。
いくつかの研究では、マイクロバイオームの組成と多様性が集団の一般的な健康状態に大きな影響を与えることが示されている。例えば、ヨーロッパ人とアフリカの農村部(ブルキナファソ)の子供たちの糞便マイクロバイオータを比較すると、ヨーロッパ人の被験者がいない後者のグループでは、プレボテラとキシラニバクター(繊維の消化および短鎖脂肪酸(SCFAs)の生成に関与する)の割合が高くなっていた。これらの観察は、アフリカの農村部に比べてヨーロッパ人集団の炎症性疾患の有病率が高いことと相関している可能性がある[74,75]。
ゼノバイオティクス(環境汚染・食品添加物など)
環境汚染物質や食品添加物への慢性的な暴露もまた、炎症を促進する慢性的な病態に素因する可能性がある[76]。ゼノバイオティクス(薬、毒物などの生体外物質)は慢性炎症を促進するが、これは脂質毒性状態の発生、すなわち非アルコール性脂肪性肝疾患の発症につながると考えられている[77]。これは、定期的な絶食などの生活習慣の介入によって緩和できる[78]。
重金属、農薬、ナノ粒子、多環芳香族炭化水素、ダイオキシン、フラン、ポリ塩化ビフェニル、人工甘味料
重金属、農薬、ナノ粒子、多環芳香族炭化水素、ダイオキシン、フラン、ポリ塩化ビフェニル、または非カロリーの人工甘味料などの外来生物学的物質への曝露もまた、腸内微生物叢を乱すことで慢性炎症を促進する可能性がある[77,79,80]。
COVID-19パンデミック
炎症性負荷の減少
炎症性負荷を減少させることは、COVID-19パンデミックの間、これまで以上に重要である。これは、日常的な行動(例えば、ライフスタイル、食事、禁煙、体重減少、スポーツなど)によって達成することができる。
慢性疾患と炎症
COVID-19の合併症のリスクについては、科学界では多くの情報が入手可能である;死亡の可能性さえも、炎症性プロファイルの障害(例えば、肥満、II型糖尿病、高血圧、慢性肺疾患など)と関連したいくつかの慢性疾患によって非常に高くなっている。
文献データは、併存疾患のない人は、SARS-COV-2感染の結果として重篤な症状のリスクがはるかに低いことを示している[83]。
亜鉛・ビタミンD
一方、プロ炎症性転帰を伴う炎症性マーカーサイトカインのレベルの上昇は、COVID-19患者における有害転帰の予測因子を構成する[84]。亜鉛やビタミンDのようないくつかの食事要素は、ウイルス負荷に対する保護効果をもたらす可能性があることがエビデンスによって証明されている[84]。
このように、これは健康的な食事によって炎症負荷を軽減し、(RLRSの原則に基づいて)いくつかの保護成分(例えば、食物繊維、ポリフェノール、PUFA、ビタミンなど)を関連付けることで、様々な免疫課題からより良く保護される可能性を常に高めている。
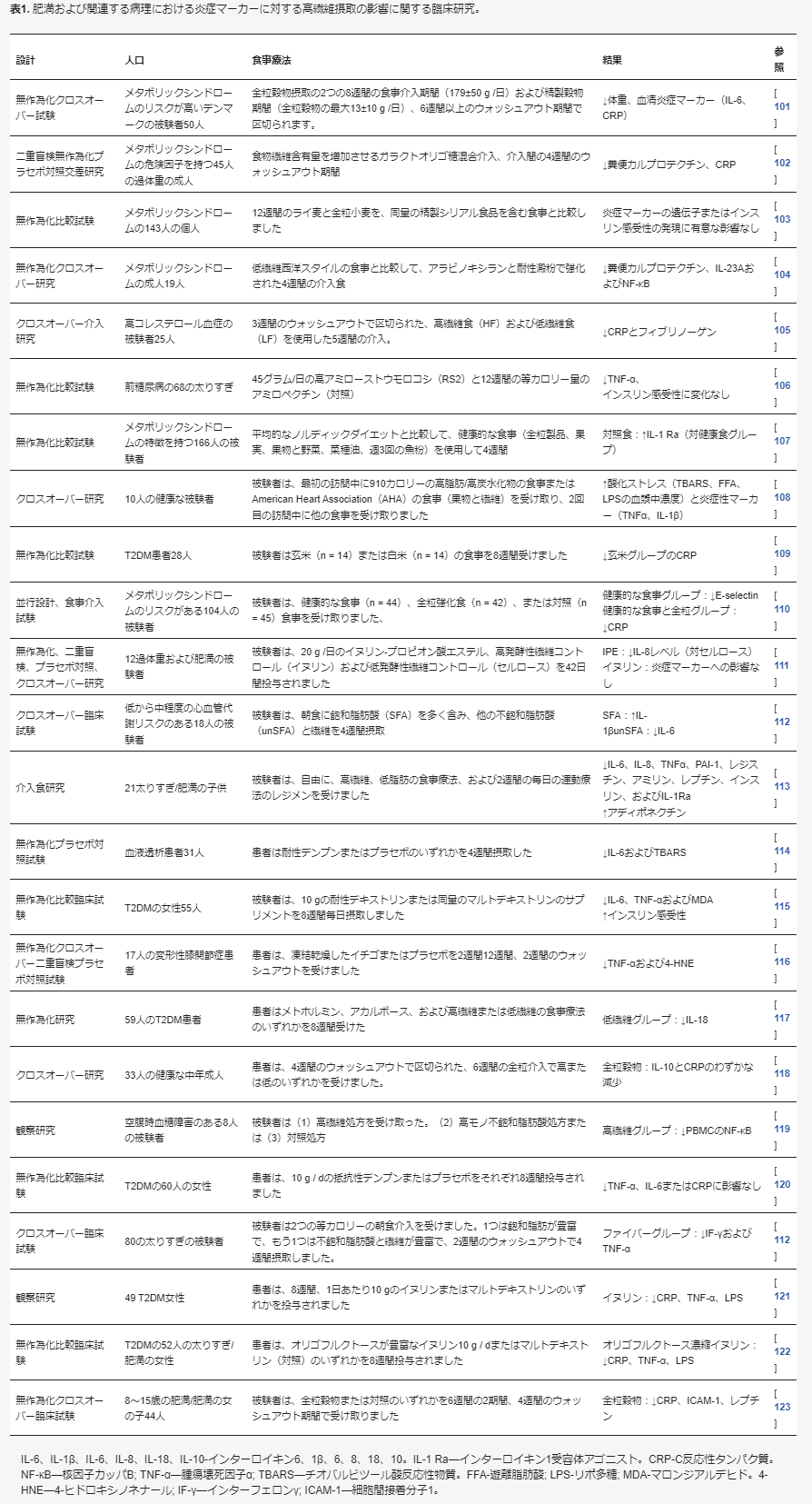
4. 炎症を抑える食物繊維の重要性
発酵性食物繊維・短鎖脂肪酸
発酵性食物繊維は小腸では酵素的に消化されず、大腸に入り、腸内細菌によってSCFAに変換される [85,86]。大腸遠位部におけるSCFA-アセテート、プロピオン酸、および酪酸(最も豊富)-の全身的な分布および生成は、炎症性シグナルを抑制するために重要である。無菌動物モデルは、組織/血液中のSCFAが存在しないために、炎症性フレアを特徴としていた[87,88,89]。
酪酸
酪酸は、SCFAsの代表的なメンバーであり、全身に見られる異なるGタンパク質共役型受容体(GPCR)に対して高い親和性を有する。GPR41は脂肪組織および免疫細胞に見出され、GPR43は免疫細胞に見出される。しかし、GPR109Aは大腸細胞に存在し、GPR41とGPR43は酪酸によって活性化され、ペプチドYY(PYY)の産生を促進する。
これは、胃の空っぽ化および腸管通過阻害に寄与し、それによって食欲を減退させ、グルカゴン様ペプチド1(GLP-1)を促進する。これらの結果は、間接的にインスリン分泌を刺激する。GPR109Aは、大腸マクロファージおよび樹状細胞の炎症関連経路を活性化し、IL-10産生T細胞の分化および腸管上皮細胞からのIL-18の放出を誘導する [85,90,91]。
腸のバリア機能
食事中の食物繊維の存在は非常に重要である(表1)。それはSCFAを生成し、腸管上皮への病原性細菌のアクセスを制限して、常在菌の増殖を促進するからである。さらに、SCFAsは、腸表面の保護効果を高め、バリア機能を適切に維持する上皮粘液の分泌を促進する[92,93]。
SCFAは、核内転写因子PPARγ(ペルオキシソーム増殖因子活性化受容体γ)に結合し、その結果、NF-kB経路を阻害する抗炎症作用を有する[94,95]。これは最終的にVCAM-1(血管接着分子1)およびICAM-1(細胞内接着分子1)の発現を低下させ、TNF-α、IL-6、およびIFN-γ(インターフェロンγ)の合成を低下させる[96]。
HDAC阻害作用
ヒストンの主な生理的役割は、DNAと相互作用し、その構造を安定化させることである。ヒストンがアセチル化されると、これによりヒストンとDNAの接触が緩み、DNA構造が解かれて転写が活性化される。ヒストンのアセチル化過程は、ヒストンアセチルトランスフェラーゼ(HAT)の誘導とヒストン脱アセチル化酵素(HDAC)の阻害のバランスの結果である。
同じアセチル化過程で、DNAはSTAT3(転写3のシグナル伝達物質・活性化因子)、NF-Kβ(活性化B細胞の核内因子κ-光鎖エンハンサー)、FoxP3などの転写因子と結合する。その結果、炎症タンパク質を含む遺伝子発現を調節する[97,98]。
SCFAs(酪酸が最も効果的、酢酸が最も効果的)は、ヒストン脱アセチル化酵素(HDACs)の阻害剤として作用し、炎症性タンパク質の転写抑制に寄与している[99,100]。
表1. 肥満および関連病理における炎症性マーカーに対する高繊維摂取の効果に関する臨床研究
5. 断食の抗炎症効果
断食は何千年も前から知られているプロセスである。古代ではかなり頻繁に行われていたが、それは食料へのアクセスが困難であり、その結果、個体は再び食料が入手できるようになるまで、食料なしで生き延びることを余儀なくされたからである[124]。
絶食は、動物[125,126]と人間の両方において生存メカニズムであり、特に食糧保全が普及していない国では[127]。世界の他の地域では、宗教的な信念のためか、ウェルネスセンターで断食が採用されている。
1960年以降、病的な肥満および関連疾患に対処するために使用されている方法の1つが「ゼロカロリーダイエット」であり、したがって、何世紀にもわたる断食によって生成された科学的データを臨床の実践に翻訳している。
断食は3つの大まかなカテゴリーに分けることができる。
- 2日から数週間続く定期的な断食。
- 間欠的な断食は、16~20時間の継続を毎日または毎週または週2回行うことができる。
- ファスティングに擬態した食事療法、その有益な効果を得るために断食を擬態した食事療法で、カロリーや特定の食品(例:脂肪)の制限が必要である[128,129,130]。
寿命の増加
断食の健康への有益な効果を示す研究は数多くあり、さまざまな病理学的状態にも効果があることが示されている。断食は、酵母S. Cerevisiaeや線虫C. Elegansなどの原核生物において寿命を延ばした[128,131,132,133,134]だけでなく、長期間断食を行った動物モデル(ロイヤルペンギンなど)においても寿命を延ばした[135]。
脳機能の改善・筋肉量の維持
他のモデルでは、脳機能の改善[136,137]、寿命と長寿の増加[138,139,140]、および絶食後の筋肉量の維持の改善[141]が示されている。
ガンへの有益な効果
動物モデルの研究では、薬物治療と併用した補完的な疾患管理戦略として、断食ががんに対して有益な効果をもたらすことが明らかにされている [142,143,144,145]。
神経栄養因子の増加
動物モデルの研究では、断食後の神経変性疾患の改善が示されているが、他の研究では、断続的な断食ダイエットが抗酸化防御、神経栄養因子(BDNFS、H-70、FGF2)、適応応答に関与するタンパク質(HSP-70、GRP-78)のレベルを高め、プロ炎症性サイトカインレベル(TNFa、IL-1β、およびIL-6)を低下させることが証明されている [146,147,148,149,150]。
メタボの予防・インスリン感受性の増加
断続的な絶食は、げっ歯類のメタボリックシンドロームのあらゆる側面を予防し、逆転させることができることがわかっている:体脂肪、炎症、血圧が減少し、インスリン感受性が上昇し、神経筋系および心血管系の機能的能力が改善される[151,152,153]。
心臓の虚血性障害からの保護
間欠絶食はまた、糖尿病性げっ歯類モデル[154]および心筋梗塞モデルにおいて、この種のレジメンによって心臓が虚血性障害から保護されるため、高血糖を改善することが明らかにされている[155]。
レプチン感受性を高める
レプチンレベルの上昇は通常、炎症前の状態を予測するが、アディポネクチンとグレリンは炎症を抑制し、インスリン感受性を高める可能性がある[150,156]。断食は、インスリンおよびレプチン感受性を高め、炎症を抑制し、オートファジーを刺激することにより、メタボリックシンドロームによって引き起こされるあらゆる主要な異常を逆転させることができる[157,158]。
成長ホルモン・グルカゴンの増加
エネルギーのための脂肪およびケトン体の使用量の増加[159,160]、および成長ホルモンおよびグルカゴン分泌の増加[161,162,163]を示すいくつかの研究があり、血糖値、インスリン、およびIGF-1レベルの低下を伴う。
血圧の低下・肥満の改善・グルコース代謝の改善
間欠絶食後は、総脂肪、腹囲脂肪、血圧が低下し、肥満者ではグルコース代謝が改善される[69,164,165,166,167]。さらに、定期的な絶食はヒトの腸内マイクロバイオータの組成を著しく変化させる[73]。
最後に、最も重要な研究では、主にがんとの戦いにおいて、断続的な断食の効果が、古典的な治療と一緒にサプリメントとして、有望な結果を伴って示されている[168,169]。以下では、断食と炎症の相互関係の効果と関連する分子メカニズムを分析する。
5.1. 断食の分子メカニズム
ファスティングは体重減少をもたらすだけでなく、多くの代謝経路に影響を与える生存メカニズムである[128,161,170]。ファスティングの多くの利点は、主要な分子経路の調節に関連している。
IGF-1・mTOR
最初は、絶食中に、インスリン様成長因子-1(IGF-1)および哺乳類ラパマイシン標的(mTOR)のダウンレギュレーションが起こる。これらの経路は、栄養素を感知し、したがって同化代謝を活性化するので、食物過剰の存在下ではアップレギュレーションされる。数時間の間食物が不足している場合、異化過程が活性化される。
長寿はIGF-1シグナル伝達の減少によって増強されるため、老化はインスリン様成長因子-1受容体シグナル伝達系の変化によって調節されているようである[171,172,173]。IGF-1シグナルはmTOR活性化を誘導する。
FoxO
mTOR活性の低下は、様々な生物における寿命の延長に関連している[174]が、mTORがFoxOタンパク質の活性化を誘導するためである。FoxOタンパク質は核に輸送され、オートファジーに関連する遺伝子を活性化する[175]ことから、オートファジーとFoxOタンパク質の間の関連性が強調される。
AMPK
AMP/ATP比が高いと、AMPK経路が活性化される[176];その結果、エネルギー産生が増加し、ATP利用率が低下する。
ミトコンドリア
さらに、ミトコンドリアのバイオジェネシスとマイトファジーが損傷したミトコンドリアを修復し、交換する。その結果、細胞は「若く」、より効率的なミトコンドリアを有する。
寿命の延長
前述の条件に加えて、この経路の活性化は、C.エレガンスとショウジョウバエメラノガスターの両方における様々な研究において、寿命の増加と関連している[177,178]。
哺乳類では、絶食はAMPK活性化に影響を与えないようであるが、より確実な結論を導き出すためにはさらなる研究が必要である[179]。
サーチュイン
AMPKと同様に、サーチュインは生命 [180] およびオートファジー [181] に関連している。サーチュインの中には、細胞質に存在するもの(SIRT2)、DNA修復作用を持つ核内のもの(SIRT1)、ミトコンドリアに存在するものがある。一般に、サーチュインは、ミトコンドリアのバイオジェネシスと損傷したミトコンドリアのミトファジーに関連しており、それによってミトコンドリア細胞を問題なく強化し、エネルギー生産においてより効率的である[132,182]。
SIRT1
SIRT1はNAD+レベルによって調節され、NAD+がセンサーとなるエネルギー枯渇状態(絶食や運動など)で増加し、NF-Kβのダウンレギュレーションや関連する転写因子を介して炎症の軽減に寄与する[132,182,183]。
酸化ストレスとホルミシス仮説
ラットを用いた研究では、空腹時に炎症が減少することが示された[184]。他の研究では、NF-Kβの阻害とNrf2、サーチュイン、SOD2の変調、寿命の増加が示されている[185,186,187,188]。2017年の研究では、断続的な絶食はコルチコステロン(CORT)、インターロイキン6(IL-6)、腫瘍壊死因子α(TNF-α)レベルを有意に低下させるようである[189]。
Nrf2は酸化ストレスと毒性において重要な役割を果たしている;活性酸素レベルの適切なバランスは、ミトコンドリアおよび他のすべての経路が適切に機能するために非常に重要である。しかし、活性酸素が存在しない場合、Nrf2は活性化されず、その結果、ARE(抗酸化反応)は活性化されない。
したがって、臨界量の活性酸素(「ホルメシス仮説」)は、AREのアップレギュレーションに必要であり、これにより、細胞およびミトコンドリアが酸化ストレスおよび様々な種類の毒素に対処できるようになり[190]、結果的に寿命が延びる[191](図2)。
図2. 絶食の分子機構
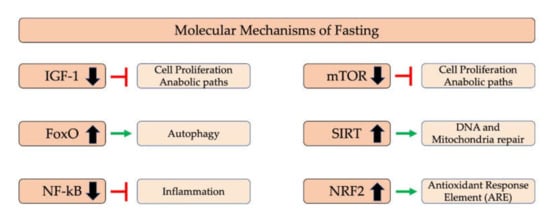
IGF-1、インスリン様成長因子1、FoxO、フォークヘッドボックスプロテイン、NF-Kβ、核因子Kβ、mTOR、哺乳類ラパマイシン標的、SIRT、サーチュイン、NRF2、核因子エリスロイド2関連因子2。
5.2. 断食のヒトへの影響
過去数十年の間に、代謝に関連するいくつかのマーカーに対するファスティングの効果について多くの研究が行われてきた。それらの研究のほとんどは、断食が体重に与える影響を決定している。しかし、脂質代謝および炭水化物代謝の変化、ならびに上記に影響を与える主要なホルモン(例えば、インスリン)の変化を明らかにした研究もいくつかある。
最近では、TNF-α、インターロイキン、CRP、BDNFなどの炎症性マーカー、アディポネクチンやレプチンなどのホルモンに対する断食の効果に焦点を当てた研究もある。
ブッヒャー・ウィルヘルミ断食
断食の効果に関する最大の研究は、1422人の被験者を含む観察研究であり、4~21日間の断食期間後の代謝変化が記述されている [159,170]。参加者は全員、1日のカロリー摂取量200-250kcalとさまざまなライフスタイルの変化(例えば、食事のアドバイス、身体運動)を含むブッヒャー・ウィルヘルミ断食ガイドラインに従って断食を行った。断食の有益な調節効果は、血中脂質、グルコース調節、および全体的な健康関連の血液パラメータに観察された。さらに、体重、腹囲、血圧の低下と関連していた。
同じ絶食ガイドラインを使用した別の研究では、定期的な絶食後に代謝マーカーの改善が観察され、その中には腸内マイクロバイオーム組成の変化に関連した血糖値の低下も含まれている[73]。この研究では、10日間の定期的な絶食後の腸内マイクロバイオームを分析したところ、絶食によりLachnospiraceaeやRuminococcaceaeなどの食事性多糖類を分解することが知られている細菌の量が減少し、それと同時に宿主由来のエネルギー基質を利用することが知られているBacteroidetesやプロテオバクテリアが増加していることが示された。
一日おきの20時間断食
健康な非肥満男性8人の研究では、1日おきに20時間の断食を15日間行ったところ、アディポネクチンが増加し、レプチンが減少したが、IL-6やTNF-αには変化が見られなかったことを発見した。プロトコルにより、彼らは通常の運動を維持することができたが、体重を安定させるために食物を消費することもできた[69]。
カロリー制限
Redmanらは、カロリー摂取量を減らした食事(15%)に従った34人の2年間の研究で、レプチンの減少を観察した。これらの人たちは平均8.7kg減量したのに対し、対照群は同期間に平均1.8kg増加した[192]。
一日おきのカロリー20%断食
8人の女性と2人の男性を含む別の研究では、全員が喘息を持つ太りすぎの患者で、1日おきに絶食し、絶食日にはカロリーを通常の摂取量の20%以下に減らすことで、8週間にわたってTNF-αとBDNFの減少がみられたが、CRPには変化がみられなかったことが示された。この研究では、患者は研究期間中に初期体重の8%の減量を達成した。喘息症状は、酸化ストレスのいくつかの指標(8-タンパク質カルボニル、イソプロスタイン、ニトロチロシン、4-ヒドロキシノネナール付加体)と同様に改善した[193]。
一日おきのカロリー25%断食
2013年に行われた別の研究[194]では、体重過多または正常体重の成人30人を対象に、1日おきに12週間カロリー摂取量を減らした結果、CRP値の低下、アディポネクチン値の上昇、レプチン値の低下が見られた。絶食日には、通常の毎日の消費カロリーの25%しか消費しなかった。さらに、彼らの体重は3.6±0.7kgと有意に減少し、TGの濃度が低下することで冠動脈性心疾患のリスクが改善された。
ラマダン
別の研究[195]では、イランのラマダン期間中に多嚢胞性卵巣症候群(PCOS)を持つ27人の女性の高感度-C-反応性タンパク質(hs-CRP)の減少を発見し、18歳から40歳、平均年齢27.5歳の参加者は、29日間、毎日16.5時間の断食、等カロリーの食事を続けた。
16時間断食
毎日16時間の断食を行い、8週間イソカロリックダイエットを行い、8時間の食事窓に必要なエネルギーを100%消費した34人の男性(抵抗訓練を受けた)を対象とした重要な研究では、アディポネクチンの増加とIL-6とIL-1βのレプチンの減少があったことが示されている[196]。
14~15時間断食
健康なボランティア50人(男性21人、女性29人)を対象としたFarisの研究では、毎日14~15時間の断食を21日間行ったところ、IL-6、IL-1β、TNF-α、全白血球、顆粒球、リンパ球、単球の減少が認められた[197]。
16時間断食(ラマダン断食)
非アルコール性脂肪性肝疾患の20~50歳の患者42人を対象とした別の研究[198]では、ラマダン断食(毎日16時間の断食を29日間行う)を行ったところ、断食を行わなかった41人のボランティアと比較して、IL-6およびhs-CRPの低下が認められた。これらの研究および他の研究を表2に詳細に示す。
断食が多くの健康上の利点を持ち、心血管疾患、代謝性疾患、免疫疾患の発症を予防または管理するために使用できることを示す研究が増えている。
長期間の断食は、医学的なアドバイスがなければ難しいかもしれないが、最近の研究では、時間制限付きの食事を日課として安全に実践できることも示されている。例えば、最近の研究では、10時間の時間制限食を12週間続けると、メタボリックシンドローム患者の心血管健康が改善されたことが示された[199]。
表2. ファスティングと炎症に関する最近の報告。
6. 6.結論
世界の人口の大部分が様々な代謝障害に苦しんでいることを考えると、これらの状態に対処するための非薬理学的な方法を探すことが重要である。ライフスタイルのターゲットを絞った変更、特に食事療法は、早期に代謝障害の発症を軽減するための経済的なツールとなり得る。
これらの変更には、現在の西洋の食生活と比較して繊維とポリフェノールの摂取量を増やすだけでなく、代謝障害のリスクを軽減することができるよく構造化された、パーソナライズされた断食プロトコルが含まれている(図3)。
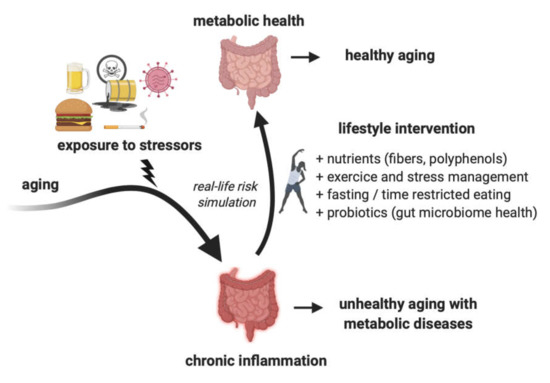
ライフスタイルの変化は、ストレス因子の悪影響を緩和することで、健康的な老化を促進することができる。生涯を通じて様々なストレス因子(加工食品、過食、環境毒性物質、感染剤、薬物)にさらされることで、慢性炎症や代謝障害の発症が促進される可能性がある。
多数の実生活リスクシミュレーション研究により、これが生活習慣の介入によって緩和されることが示されている。これは、学校、病院、刑務所、政府機関、高齢者センターなどで提供される食品の栄養の質を向上させることで、様々な施設で実施することができる。
病院でより健康的な食事の選択肢を増やすことは、最終的には患者の健康状態を改善し、医療費を削減するのに役立つかもしれない。
食生活の改善は、RLRSの特徴である免疫反応にプラスの効果をもたらす可能性がある。炎症はCOVID-19やその他の感染症に対する急性病理学的反応と関連しているため、免疫反応と炎症性マーカーの改善は、ウイルスや細菌などの感染因子による障害に対する生理的回復力の向上につながり、症状の軽度化につながる可能性がある。

