ウィザフェリンA:COVID-19感染症の治療薬候補
Withaferin A: a potential therapeutic agent against COVID-19 infection
ovarianresearch.biomedcentral.com/articles/10.1186/s13048-020-00684-x
要旨
新型コロナウイルス病2019(COVID-19)の発生と継続的な蔓延は、全世界で1,150万人以上の感染をもたらし、世界的な健康上の脅威となっている。さらに、このパンデミックは世界中で53万人以上の命を奪っている。患者の年齢と併存疾患の存在が、患者の死亡率の重要な決定要因であることがわかっている。
そのような併存疾患の1つは、がんの悪性腫瘍の存在であり、がん患者の死亡率は約2倍に増加している。データが不足しているため、がん患者の診断および治療のための最良の方法については、コンセンサスが得られていない。
興味深いことに、2つの独立した研究グループが、抗炎症作用と抗腫瘍作用を持つステロイドラクトンであるウィザフェリンA(ウィザフェリンA)が、SARS-CoV-2のウイルススパイク(S-)タンパク質に結合する可能性があることを発見した。
さらに、我々の研究グループの予備的なデータでは、ウィザフェリンAは腫瘍を持つ雌マウスの肺でACE2の発現を変化させないことが示されている。ACE2のダウンレギュレーションは、COVID-19の重症度を増加させることが最近明らかになっている。
したがって,ウィザフェリンAは,ウイルスのSタンパク質と宿主の受容体との結合を阻害することが報告されており,肺におけるACE2の発現には影響を及ぼさないことから,COVID-19の治療薬または予防薬としての可能性を示している。
はじめに
新型コロナウイルス疾患2019(COVID-19)は、2019年12月に中国の武漢市内で病因不明の肺炎として初めて報告されて以来、世界中に急速に広がっている[1]。世界保健機関(WHO)によって用語化された重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)は、コロナウイルスに関連した3番目の大規模なパンデミックを表している[1]。この病気は中国国内で最初に報告されたが、その後のレトロスペクティブ研究では、SARS-CoV-2が中国の武漢で最初に報告される4日前と、フランスでの最初の公式症例の1ヶ月前にフランス国内で広がっていたという証拠が発見されている[2]。最初の発見以来、SARS-CoV-2は世界中に広がり、1,150万人以上に感染し、2020年7月6日時点で53万人以上の死者を出している[3]。本疾患の重症度は、無症状の状態から急性呼吸窮迫症候群(ARDS)を呈する患者まで幅広く、患者の死を防ぐためには重大な医療介入が必要となる[4]。その後、アンジオテンシン変換酵素2(ACE2)がSARS-CoV-2スパイク(S-)タンパク質の機能的な受容体であり、ウイルスの細胞内への侵入を可能にしていることが発見された [5]。ACE2はレニンアンジオテンシン系(RAS)の強力なネガティブレギュレーターであり、RASの恒常性維持に重要である。
ACE2遺伝子は805個のアミノ酸で構成されており、I型のインテグラル膜糖タンパク質である。ACE2は、強力な血管収縮因子であるアンギオテンシン(Ang)-II(抗炎症性で線維化を促進する)を分解し、Ang(1-7)に変換する[6]。Ang(1-7)は血管拡張因子であり、増殖やアポトーシスも抑制する[6]。血圧調節に対する全身的な効果のほかに、ACE2は心臓、腎臓、肺を含むいくつかの臓器の病理学的変化において局所的な調節効果を有する[7]。ACE2は肺胞細胞で高発現しており、ウイルスのヒト宿主への主要な侵入部位となっている[8]。ACE2は肺胞細胞での発現に加えて、以下のような様々な組織でも発現している。血管系(内皮細胞、遊走性血管新生細胞、血管平滑筋細胞)、心臓(心筋細胞、心筋細胞、内皮細胞、周皮細胞、心外膜脂肪細胞)、腎臓(糸球体内皮細胞、podocytes、近位尿細管上皮細胞)などの様々な組織でも発現している。肝臓(胆管細胞および肝細胞)、網膜(色素上皮細胞、桿体および円錐体光受容体細胞、ミュラーグリア細胞)、腸の腸球、中枢神経系の円周臓器、および上気道(杯体および繊毛上皮細胞) [9]。
SARS-CoV-2 S-proteinには2つのサブユニットがあり、S1サブユニットは宿主細胞の受容体ACE2と結合する受容体結合ドメインを持ち、S2サブユニットはウイルスと宿主膜の融合調節に関与している[10]。SARS-CoV-2はSARS-CoVに比べてACE2に対する親和性が10倍高いことが報告されており、これはSARS-CoV-2の感染効率の高さと一致している[11]。現在のところ治療法は見つかっていないが、COVID-19に対する最も効果的な治療レジメンを決定するために、いくつかの臨床試験が実施されており、Gosainらによるレビュー[12]では、可能性のある治療法の広範なリストが詳細に記載されている。現在、患者の管理には、支持療法とウイルスのさらなる拡散を防ぐための対策が含まれている [13]。ヨーロッパと中国では患者集団の特徴に違いがあるにもかかわらず、両群で認められた患者の死亡リスクの主な決定要因は、年齢と併存疾患の存在の2つである [14、15]。COVID-19患者の死亡率の増加に関連するそのような基礎疾患の1つは、がんの存在である [16]。
がん患者とCOVID-19のパンデミック
免疫不全の可能性があるため、がん患者の適切な治療は、患者がSARS-CoV-2感染を経験しているかどうかにかかわらず、腫瘍医が直面している現実的かつ深刻な問題である[16]。4つのSARS-CoV-2ホットスポット(米国、イタリア、スペイン、中国)からのデータによると、新型コロナウイルスに感染したがん患者は、集中治療室(ICU)への入院や機械換気を必要とするリスクが有意に高く、患者の死亡率も増加することが示されている[15, 17, 18, 19]。レトロスペクティブ研究では、COVID-19に感染した中国のがん患者の死亡率は約28%であることが明らかにされている[20]が、中国の全症状死亡率1.4%または粗死亡率4.5%と比較しても明らかにされている[21]。おそらく驚くべきことではないが、SARS-CoV-2の肺がん患者の致死率はかなり厳しく、ニューヨークのコホート研究では55%の致死率が示されている[19]。現在、がん患者とその腫瘍医は、SARS-CoV-2に感染するリスクと医療従事者が利用できるリソースの減少のため、患者の原疾患の治療を開始すべきか継続すべきかというジレンマに直面している [22]。癌の特定の病因に関する情報は、いくつかのSARS-CoV-2研究の中では乏しい。しかしながら、肺がん、乳がん、消化器がん、および血液がん(リンパ腫など)は、米国[19]、イタリア[23]、および中国[18]のCOVID-19コホート研究で報告されている。さらに、これらの研究では、子宮頸がん患者およびその他の特定不能な婦人科悪性腫瘍の患者が報告されている [18、19、23]。
厳選された文献資料からは、示された腫瘍学的パラダイムが垣間見えるが、評価対象となる患者集団はすでに少数であるため、腫瘍学的タイプ別に層別化するとさらに減少する。これは、死亡リスクを評価し、COVID-19陽性のがん患者の管理のためのガイドラインを提供する上で大きな限界である。同様に、卵巣がん患者におけるCOVID-19感染についてはほとんど知られていない。本稿執筆時点で、このテーマに関するPubMed論文は22本あり、そのうち20本は卵巣がん患者によりよいサービスを提供するためにがん診療所が直面する潜在的な変化や課題について述べている。残りの2本の論文では、合計3人の卵巣がん患者と、現在のパンデミック[24、25]のために治療がどのように変更されたかについて論じている。3人の卵巣がん患者のうち2人だけが新型コロナウイルスに陽性であることが判明し、化学療法に関連した血小板減少症の発症により血小板による補助療法を必要とした[24]。議論した残りの卵巣癌患者はSARS-CoV-2感染症で陰性であったが、患者の症状および臨床所見(例:COVID-19患者における肺炎と一致するCTスキャン異常所見)から陽性であると推定された。[25]. この患者のがんレジメンは、発症した非定型肺炎が解消するまで延期されたが、それ以外の場合はアジュバント療法を受けていない [25]。現在、利用可能なデータが不足しているため、パンデミックの状況下でのがん患者管理に対処するための世界的に認められたガイドラインは存在しない [26]。最近、国際共同研究により、がん患者の診断および治療のための一連の実践的アプローチが提案されている[26]。しかし、より多くの情報またはSARS-CoV-2に対する有効な治療レジメンが利用可能になるまでは、がん患者はCOVID-19のパンデミックにより非常に高い死亡リスクにさらされ続けることになるだろう[26]。
前向きな治療法としてのウィザフェリン
ウィザフェリンAは、アシュワガンダとしても知られる植物Withania somniferaから単離されたステロイド性ラクトンである[27]。ウィザフェリンAは、抗炎症作用や抗腫瘍作用を有することが知られている[28,29,30]。最近の研究では、COVID-19感染症は大きな免疫成分を持っており、サイトカインストームと呼ばれる、生命を脅かす可能性のある免疫反応を引き起こす可能性があることが実証されている。我々の研究室では、卵巣癌の転移モデルにおいて、ウィザフェリンAが様々な炎症性サイトカイン(例:TNF-α、IL-6、IL-8、IL-18)の分泌を減少させることが可能であることを実証している[30]。ウィザフェリンA治療は、報告されている抗炎症性の特性により、サイトカインストームの激しさを和らげることができる可能性がある。興味深いことに、少なくとも3つの独立した研究グループは、植物Withania somniferaに見出されたフィトケミカルが、分子ドッキングアプローチを用いてCOVID-19感染症に対する治療薬として開発され得ることを示唆している[32,33,34]。2つのグループは、ウィザフェリンAのような様々なWithanolidesが、ウイルスのSタンパク質受容体結合ドメインに結合し、それによって宿主ACE2受容体との相互作用をブロックまたは減少させることができるはずであると報告した[32,33]。第三のグループは、ウィザフェリンAと別個のウィザノライドであるウィザノンがSARS-CoV-2のメインプロテアーゼと相互作用することを予測しているが、ウィザフェリンAはベースラインドッキングスコアに使用される確立されたN3プロテアーゼ阻害剤よりも結合親和性が低いと予測されていることを報告した[34]。
関連のない研究では、我々のグループは、がん幹細胞の標的化やがん誘発性悪液質(筋消耗性障害)を含む、がん治療のための潜在的な治療法としてウィザフェリンAを研究してきた。Ang-II シグナルは骨格筋の萎縮[35]を媒介することが知られているため、我々は悪液質に関連する Ang-II シグナルに対する ウィザフェリンA の効果を調査した。我々の研究室からのデータ(出版中)は、ウィザフェリンA治療が癌誘発性悪液質の実験モデルにおいてアンジオテンシンIIの循環レベルを減少させることができることを示している。この研究では、我々は卵巣癌細胞株A2780(100μlの滅菌PBSに再懸濁された8.0×105ローパッセージ細胞)を5〜6週齢の雌NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ(NSG;ジャクソンラボストレイン#005557)マウスに腹腔内でキセノングラフトした。腫瘍のないコントロールは、滅菌生理食塩水の等価なi.p.注射を受けた。卵巣癌細胞の移植を可能にするための8日間の不応期の後、腫瘍のない動物および腫瘍を有する動物は、4週間の期間(移植後)にわたって、3日に1回、ウィザフェリンA(2mg/kg)またはビヒクル(10%ジメチルスルホキシド、90%グリセロールトリオクタノエート)のi.p.注射を受けた。
qPCR と遺伝子特異的プライマーを用いて、二元分散分析(ANOVA)に続いて、Tukey の多重比較検定のポストホック分析によって決定された腫瘍サンプルにおける AT1R(アンジオテンシン II 受容体 1 型)の相対 mRNA 発現を、ウィザフェリンA 処置がビヒクル処置群と比較して減少させることを発見した。我々の所見と独立して報告された分子ドッキング研究に基づいて、我々は、腫瘍がない状態と腫瘍がある状態で、ウィザフェリンA治療が肺におけるACE2の発現を変化させるかどうかを調査した。興味深いことに、我々は、ウィザフェリンA治療に応答してACE2の相対的なmRNA発現に有意差(NSD、すべての比較のためのp値> 0.80)を発見しなかった双方向ANOVA(図1)によって決定された。ACE2 の主要な発現部位の一つである肺では、qPCR による ACE2 の mRNA 発現に有意な差が認められなかったため、他の臓器での ACE2 の発現は調査していない。しかし、最近、SARS-CoV-2感染の副産物として、病気の過程でACE2の発現が低下し、多臓器障害の発生を促進することが報告されている[36]。この効果により、SARS-CoV-2のACE2受容体への結合を阻害することは、AT1Rシグナル伝達に対するACE2の拮抗効果により、ACE2発現を増強するよりも、ウイルスと戦うためのより有益な戦略である可能性があることが示唆されている[9]。この理論的根拠に基づき、分子ドッキング研究[32, 33]に基づいて、ウィザフェリンAがウイルスSタンパク質との相互作用を通じてCOVID-19をブロックまたは阻害することは可能であり、(我々のデータで報告されているように)ACE2発現に影響を与えずに(病理学的状態を悪化させることなく)可能性の範囲内である。
図1
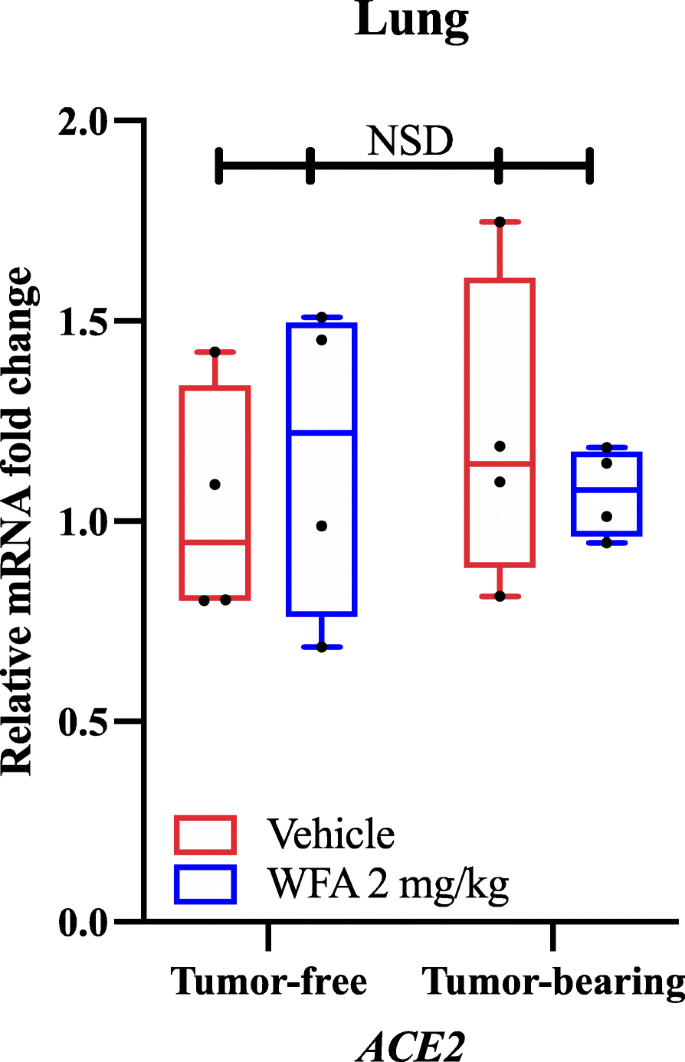
図1 ACE2 mRNA発現に対するウィザフェリンAの効果。
A)ビヒクルまたはウィザフェリンA(2mg/kg)で処置した腫瘍のないマウスおよびA2780卵巣腫瘍を有する雌のNSGマウスの肺サンプルにおけるACE2の相対的なmRNAレベル。グループあたりN = 4-5匹のマウス。黒丸は個々のデータポイントを示す。NSD = 有意差なし
結論
COVID-19の発生は、一般集団と医療従事者の両方にとって、世界的に重要な臨床上の脅威となっている。さらに、がん患者および高齢者は、疾患関連の致死率が高い非常にハイリスクな集団であることに変わりはない。このウイルスに関する知識はまだ限られているが、現在、100以上の臨床試験が行われており、このパンデミックと闘う手段を見つけるのに役立っている。ウィザフェリンAは免疫不全に陥る可能性があり、死亡率も高いことから、がん患者やその他の高リスクの合併症を持つ患者に対する治療法を開発する際には、特別な配慮が必要であると考えられる。ウィザフェリンAは単独で、あるいはヒドロキシクロロキン、デキサメタゾン、その他の治療薬(臨床試験中)との併用により、一般の患者さんやがん患者さんにとって魅力的な治療薬として開発される可能性がある。
アシュワガンダ成分の解析
Withania somnifera(Ashwagandha)からの生理活性分子のSARS-CoV-2主要プロテアーゼ阻害剤としての同定
www.tandfonline.com/doi/full/10.1080/07391102.2020.1790425
伝統的な医療従事者は、インドの薬用植物Withania somnifera (Ashwagandha)の天然成分であるWithanolidesと呼ばれる成分を、様々な病気を治すために広く使用している。
SARS-CoV-2のメインプロテアーゼ(Mpro)は、その複製に必要なポリプロテインを処理することにより、病気の伝播に重要な役割を果たしている。
本研究では、SARS-CoV-2 のメインプロテアーゼ(Mpro)の機能を解析し、その機能性を明らかにした。本研究では、SARS-CoV-2の主要なプロテアーゼに対する阻害剤の可能性を探るために、アシュワガンダの40種類の天然化学成分の可能性を計算機的アプローチを用いて評価した。
その結果、アシュワガンダの4つの成分、Withanoside II (-11.30 Kcal/mol), Withanoside IV (-11.02 Kcal/mol), Withanoside V (-8.96 Kcal/mol), Sitoindoside IX (-8.37 Kcal/mol)が、選択された天然成分の中で最も高いドッキングエネルギーを示すことがわかった。
さらに、100nsのMDシミュレーションにより、ウィザノシドVはタンパク質活性部位との強い結合親和性と水素結合相互作用を有しており、活性部位での安定性を示した。また、結合自由エネルギースコアは、他の化合物と比較して最も高いスコアである-87.01±5.01 Kcal/molと相関している。
結論として、我々の研究は、アシュワガンダに含まれるウィザノシドVが、COVID-19に対抗するSARS-CoV-2のMproに対する潜在的な阻害剤として役立つ可能性があり、nCoVに対する抗ウイルス効果を有する可能性があることを示唆している。

