Contents
COVID-19 and Neurological Impairment: Hypothalamic Circuits and Beyond
pubmed.ncbi.nlm.nih.gov/33802995/
発行:2021年3月17日
概要
2019年12月、中国湖北省の首都である武漢で、重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)と呼ばれる新規コロナウイルスが出現した。このウイルス感染症であるコロナウイルス感染症2019(COVID-19)は、世界のほぼすべての国が感染していることから、世界的な関心事となっている。
臨床報告では、COVID-19の患者に頭痛、嘔吐、吐き気などのいくつかの神経学的症状が確認されており、中枢神経系(CNS)および末梢神経系(PNS)の関与が示されている。コロナウイルスの神経浸潤は新しい現象ではなく、同様の神経症状を呈した重症急性呼吸器症候群コロナウイルス(SARS-CoV)患者の過去の剖検例でも証明されている。
視床下部は、多くの核と多様な神経細胞群からなる複雑な構造をしている。視床下部は、多くの核と多様な神経細胞群から構成される複雑な構造をしており、中枢神経系と中枢神経系との間で緻密なコミュニケーションを行う視床下部内回路が特徴的である。視床下部の回路は、ウイルス感染に対する免疫反応を含む恒常的な課題の維持に不可欠である。
本稿では、SARS-CoV-2の神経系への侵入経路とそのメカニズムについて、特にCOVID-19感染時に見られる神経症状を媒介する視床下部回路の役割に焦点を当ててレビューする。
キーワード
COVID-19, SARS-CoV-2, 神経症状, 視床下部回路, 嗅球, 呼吸中枢, 視床下部-下垂体-副腎皮質軸, ウイルス感染症
1. はじめに
2019年12月第3週、中国湖北省の省都である武漢で、現在は重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)として知られる新規コロナウイルスが出現した[1]。このウイルスは,肺不全や肺炎などの重篤な呼吸器疾患を引き起こすもので,世界保健機関(WHO)ではCOVID-19と正式に命名されている[2]。SARS-CoV-2は,重症急性呼吸器症候群コロナウイルス(SARS-CoV)と相同性の高い配列を有しているため,その臨床症状はSARS-CoVで報告されているものと類似している[3]。このパンデミックは、世界のほぼすべての国が影響を受け 2020年12月末までに7,900万人以上の確定症例が報告されており、世界的な健康問題となっている[2]。COVID-19感染症の一般的な臨床症状は、発熱、咳、疲労、喀痰、頭痛、喀血、下痢、呼吸困難、リンパ球減少などです[4,5]。さらに、この感染症の患者は、全身および局所的な免疫反応の誘発と炎症レベルの上昇に関連する症状を示する[6]。さらに、約34%の患者が神経症状を呈しており、中枢神経系(CNS)と末梢神経系(PNS)の症状に分類される[7]。前者には,頭痛,めまい,意識障害,急性脳血管障害,てんかんなどの臨床症状が,後者には,味覚低下,嗅覚低下,食欲低下などの症状が関連している[7]。
神経学的症状を示す患者数が驚くほど継続的に増加していることは、神経学的な障害や中枢神経系への悪影響が大きいことを反映している。したがって、COVID-19の感染に関連する中枢メカニズムを理解し、COVID-19の神経学的病因に関与している可能性のある中枢神経系内の領域を特定することが重要である[8]。一連の神経学的症状から、COVID-19の中枢神経系および末梢神経系の症状に関連する症状の発現には、視床下部回路が重要な役割を果たしていると考えられる。視床下部回路は、SARS-CoV-2に直接さらされている嗅覚系から多くの入力を受け、中枢神経系内外の様々な核と連絡し、視床下部-下垂体-副腎皮質軸を介して末梢神経系に到達する。
そこで、本稿では、視床下部回路と、ウイルス感染、特にCOVID-19に関連する神経学的症状への関与の可能性について検討した。さらに、SARS-CoV-2とSARS-CoV感染症の間の重大な共通点を考慮して、これらの神経学的症状の原因となる潜在的なメカニズムを提案した。
2. 中枢神経系とウイルス感染。中枢神経系へのウイルス感染
中枢神経系へのウイルス感染は,意識や平衡感覚などの重要な機能を維持する他の重要なシステムへの取り返しのつかないダメージを避けるために,宿主の免疫系が効率的に解決する必要があるユニークな課題である[9,10]。コロナウイルス(CoV)は当初,呼吸器系の病原体として認識されていたが,いくつかの研究では,重大な中枢神経系症状を呈したSARS-CoV患者から採取した脳組織標本にSARSコロナウイルスが存在することが明らかにされている[11]。CoVによる神経浸潤は,SARS-CoV,MERS-CoV,SARS-CoV-2を含むほとんどすべてのβ-CoVで記録されており,頭痛,意識障害,低臭症,感覚異常などの同様の症状の発現につながっている[8,12]。ウイルス感染による神経学的症状は,主に感染した脳の部位と細胞に依存する。そのため,運動系や感覚系の感染症は,大脳辺縁系の感染症と比較して,異常や明確な身体症状をもたらす[13]。また,ドーパミン神経細胞は,皮質神経細胞やミクログリアと比較して,SARS-CoV-2の感染に対して感受性が高いことが明らかになっている[14].
CoVの向神経性作用と中枢神経系神経浸潤の実験的証拠は、大規模なヒト脳の剖検サンプルを用いて示され、COVID-19の病理学的所見では、脳組織の浮腫と神経細胞の変性が明らかになっている[15,16]。他にも,SARS-CoVの受容体であるアンジオテンシン変換酵素2(ACE2)を気道などの上皮に発現させたトランスジェニックマウスにCoVを鼻腔内接種すると,気道や脳に感染することが示されている[17].ウイルス感染症がさまざまな経路で中枢神経系に侵入することはよく知られており,血液脳関門(BBB),脳脊髄液関門(脳脊髄液),神経軸索内の逆行性輸送などのルートが考えられている。臨床研究では脳脊髄液中に有意なレベルのウイルスRNAが検出されなかったことから、SARS-CoV-2の主要な輸送経路として脳脊髄液が関与しているのではないかとの疑念が持たれている[18]。
BBBと血液脳脊髄液バリア(血液脳脊髄液関門)は、ウイルスを含む有害物質から中枢神経系実質を守る非常に複雑なネットワークである。しかし、これらは、ウイルスが中枢神経系に侵入するための主要な経路であると考えられている[19]。いくつかのウイルスは、この障害を克服するために、血管内皮細胞に感染し、これらの障壁を越えて中枢神経系への直接の通路を作ることに適応している[20,21,22]。さらに、脈絡叢や視床下部を含む脳室周囲の器官など、中枢神経系の一部の領域はBBBによって完全に保護されておらず、ウイルスの侵入口として機能する可能性がある[23,24]。また、感染した造血細胞を「トロイの木馬」として利用することも、ウイルスが血液を介して中枢神経系に侵入する手段の一つである[25,26]。また、全身性のウイルス感染により、炎症によってBBBや血液脳脊髄液関門が破壊されると、ウイルスが柵状の部分をすり抜けて中枢神経系に侵入することができる[27]。
中枢神経系への第2の主要な侵入経路として、ウイルスは、末梢感覚神経の逆行性軸索輸送を利用して、あるいは鼻の中で鼓舞された空気に直接さらされる嗅覚ニューロンの樹状突起を介して、中枢神経系に輸送されることがある[28]。さらに、SARS-CoV-2のように吸入されたウイルスは、粘膜上皮のバリアを素早く通過し、口腔咽頭組織に感染する可能性がある[12]。ウイルスは、主に末梢神経ルートを利用して中枢神経系に侵入するが、両方のルートを同時に利用する場合もあることに注意する必要がある[29,30]。髄膜や脳室内の細胞内に留まっているウイルスは、しばしば髄膜炎を引き起こすが、中枢神経系実質に感染したウイルスは、髄膜脳炎、脳炎、脊髄炎を引き起こす[31]。
Beyroutiらは最近、COVID-19患者の炎症性免疫反応の亢進により急性虚血性脳卒中が連続して6例発生し、中枢神経系機能に障害が生じたことを報告した[32]。別の研究では、COVID-19感染の結果、急性壊死性脳炎を発症し、視床下部回路を含む意識や記憶機能に関連する脳の領域に病変が生じたことが報告されている[33]。
3. 視床下部回路とウイルス感染
視床下部は,脳の基底部に位置する複雑な構造体であり,多数の細胞群と神経回路が相互に強く結びついて構成されている[34].視床下部は、視床下部内の複雑な結合以外にも、脳内のさまざまな領域に投射し、大きなニューロンネットワークを形成している。視床下部の主要な核には,室傍核(PVN),角膜周辺部(PFA),背内側視床下部(DMH),外側視床下部(LHA),尾側視床下部(CH)などがある [35,36,37] (図1)。これらの構造は,呼吸,ストレス反応の統合,体温調節,心血管調節,血糖値,神経内分泌調節,意識など,幅広い生理機能の調節に関与している[37,38,39,40,41,42,43,44,45,46]。視床下部はリレーステーションとして、嗅覚系を含む様々なソースからの膨大な末梢感覚入力を受けて、脳のほぼ全ての領域、特に脳幹と通信している[47]。
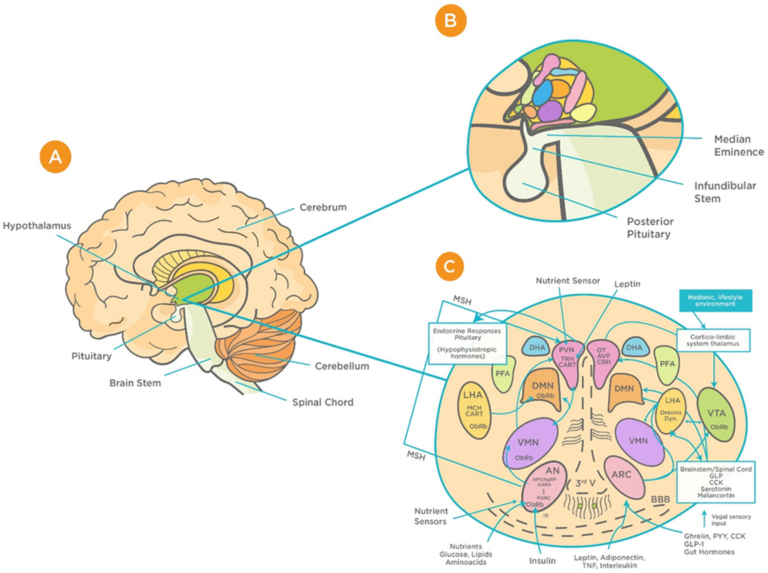
図1 視床下部回路の機能的構造の模式図
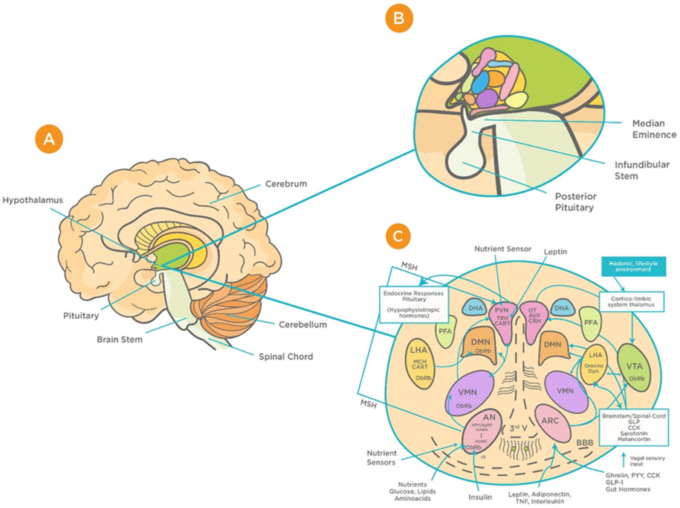
(A) 間脳の腹側にある視床下部の位置。B)正中隆起、赤芽球茎、下垂体との関係における視床下部の位置。C)視床下部の核間の機能的な相互作用のパターン([48]からの許可を得て転載)。略語は以下の通り。AN:弓状核;AgRP:アグーチ関連タンパク質;AVP:アルギニンバソプレシン;BBB:血液脳関門 血液脳関門;CART:cocaine and amphetamine-regulated transcript;CRH:コルチコトロフィン放出ホルモン;GLP-1:グルカゴン様ペプチド-1;VMN:間隙内核;OT:オキシトシン;DMN:背内側核;PVN:脳室周囲核;DHA:視床下部背側部;IR:インスリン受容体;PFA:角膜周囲部;LHA:視床下部外側部;MCH: メラニン濃縮ホルモン;MSH:メラノサイト刺激ホルモン;CN:視交叉上核;SON:視交叉上核;POA:視索前野;POMC.プロオピオメラノコルチン;PPY: ポリペプチド;ObRb: レプチン受容体、MB:乳管小体、ME:正中乳頭、NPY:神経ペプチド、III-V:第三脳室、TRH:チロトロピン放出ホルモン。
視床下部のBBB毛細血管は、タイトジャンクションが少なく柵状になっているため、ウイルスを含む血液中の物質に対して高い伝染性を示す[49,50]。そのような領域の一つが、視床下部の弧状核(AN)に隣接する正中乳頭(ME)である[50]。視床下部の障壁のユニークなデザインにより,MEとANは「プライベートな空間を楽しむ」ことができ,MEは門脈血に,ANは脳脊髄液にアクセスすることができる[50]。このことから、ME/ARCの境界にあるBBBは、視床下部のニューロンがウイルスを含む全身的な因子にどのようにさらされるかを決定する上で、大きな役割を果たしていると言えるだろう[50,51]。脳内のウイルス量が増加していることを発見した動物実験は、ウイルスがこの漏出性を利用してBBBを通過する能力があることを示唆している[51]。このような感染症にかかると、必須の成長ホルモンや代謝ホルモンが欠乏する。その結果、成長、記憶、骨の健康、生殖能力、下垂体の機能、ひいては生活の質に長期的な悪影響を及ぼす可能性がある[51,52,53]。このような結果を考慮すると、ウイルス感染が、正常な中枢神経系機能に不可欠な視床下部の機能とそれに関連する神経内分泌シグナル、および下垂体の機能に及ぼす潜在的な影響を検討することが重要である。これらの知見は,ジカウイルスなどの他のウイルス感染症でも認められることから[52],COVID-19との関連性を強調することが重要である.
解剖学的および電気生理学的研究により、嗅覚系と視床下部の間には強い神経接続があることが示されている[54]。前向性および逆向性の軸索追跡研究により、嗅覚系からの投射は、視床よりも外側の視床下部へより顕著であることが明らかになった[54]。さらに,後外側視床下部の4つの主要領域(前嗅覚核,嗅球,梨状皮質,扁桃体前皮質核)が嗅球からのこの入力を受け取ることが示された[54]。
最近の研究では,CoVの神経への侵入経路として,末梢神経経路,血行性経路,リンパ系経由などの異なる経路が示唆されている[12].しかし,感染した脳の非神経細胞にウイルス粒子が存在しないことから,特に感染の初期段階では,血行性ルートやリンパ系ルートの関与が疑われている[15,55,56].そこで我々は,SARS-CoV-2が視床下部を経由して中枢神経系に運ばれる際に,嗅覚系が重要な役割を果たしているのではないかと考えた。この仮説は、COVID-19と診断された患者のSARS-CoV-2に関連した神経学的症状を調査した最近の報告によって支持された[57]。その結果、SARS-CoV-2のRNAがRT-PCRにより鼻咽頭スワブ検体から検出されたが、脳脊髄液からは検出されなかったことから、中枢を経由した神経侵入は嗅覚系を経由する可能性が高いことがわかった。さらに,画像診断の結果,視床下部,乳頭体,背側中脳への浸潤が確認された[57]。このことは、視床下部と他の脳構造との間に神経細胞の接続があることを考えると、ウイルスの神経細胞を介した拡散をさらに裏付けるものであった。
4. 視床下部と嗅覚系とのクロストーク
嗅球は,ウイルスが脳に侵入する際の主要なゲートウェイであると考えられている[58].SARS-CoV受容体(ACE2)のトランスジェニックマウスを用いたこれまでの研究では、鼻腔内接種後のウイルス抗原の分布を調べ、中枢神経系へのウイルス侵入部位が嗅球であることを確認している[58]。最近では,CRISPR/Cas9ノックイン技術を用いてヒトACE2(hACE2)を発現させたマウスモデルが開発され,このモデルを用いた実験では,鼻腔内感染時に脳内で高いウイルス量が確認されており,SARS-CoV-2の神経浸潤に嗅覚系が関与していることがさらに強調されている[59].同時に、ウイルス抗原は、嗅球と1次または2次の神経接続を持つ中枢神経系の他の領域でも検出された。これらの領域には、大脳皮質、基底核、中脳、および視床下部が含まれる[17,58]。CoVが侵入するメカニズムとしては,エンドサイトーシスによる神経末端への内在化,逆行性輸送,軸索輸送,他の脳領域への経シナプス性拡散などが示唆されている[60].
視床下部が嗅球と解剖学的・機能的に複雑な関係にあることが明らかになっている。ゴナドトロピン放出ホルモン,ニューロペプチドY,レプチン,アディポネクチン,オレキシンなどのいくつかの神経ペプチドは,これらの結合の調節に関与している[61,62,63,64,65,66](図2)。さらに,CoVといくつかの共通点を持つインフルエンザウイルスに関する研究では,鼻腔内感染時に嗅球でのウイルス抗原の高発現と嗅球および視床下部でのサイトカイン誘導が示されている[67]。これらのサイトカインには,腫瘍壊死因子α(TNF-α)やインターロイキン1β(IL-1β)などが含まれ,ウイルス感染に対する急性期の反応を引き起こすのに重要な役割を果たしていることが注目されている[68].これまでの報告と同様に、最近では、COVID-19患者の嗅覚皮質にMRIの変化が認められ、ウイルスの神経侵入に嗅覚系が関与していることが示された[69]。これは、3次元および2次元の流体減衰反転回復画像を用いてより明らかになり、右直回の皮質の高輝度と嗅球の高輝度が示された[69]。
図2 重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)の神経浸潤と視床下部と嗅覚系の相互関係の提案
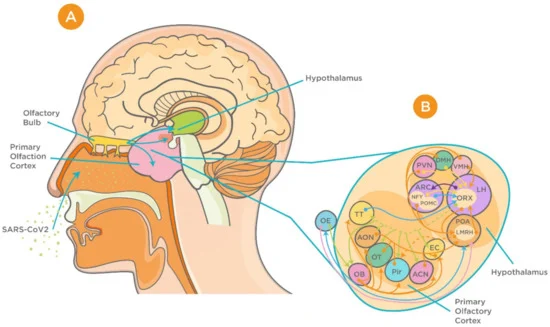
(A) 嗅球、一次嗅覚皮質、視床下部の矢状図。(B) 視床下部の回路と一次嗅覚皮質の間の複雑な接続([70]からの許可を得て複製)。略語の説明 ACNは扁桃体皮質核、AONは前部嗅覚核、ARCは弧状核、DMHは視床下部背内側核、EBOPは外嗅覚経路、ECは内嗅覚皮質、LHは外側視床下部。OB, 嗅球; OE, 嗅上皮; OT, 嗅球; Pir, ピル状皮質; POA, 視索前野; PVN, 視床下部傍室核; TT, 視床下部外延核; VMH, 視床下部内延核.
5. 視床下部核と呼吸の調節機構
視床下部が呼吸の調節に中心的な役割を果たしていることは、よく知られている。早くも1962年には,ネコを使った病変・切断実験で,視床下部の不活性化・破壊により,覚醒したネコの換気量が大幅に減少することが実証された[71]。その後,電気生理学,神経薬理学,脳のマッピングなど,より洗練されたアプローチを用いた実験により,視室傍核(PVN),角膜周辺部(PFA),背内側視床下部(DMH),視床下部の外側および後部が,呼吸調節に関与する主要な視床下部領域であることが明らかになった[37]。PVNは、曖昧核(NA)孤路核(NTS)腹側延髄(VLM)迷走神経背側運動核など、ベースライン呼吸の駆動や呼吸の制御に重要と考えられるいくつかの脳領域と連絡している[35,72,73,74]。さらに,PVNは化学反射の活性化を介して低酸素に反応する際の重要な構造とみなされている[74,75,76]。他の重要な視床下部領域は,PFAとDMHであり,これらの領域は,NTSやVLMなどの脳幹構造といくつかの神経接続を有しており,動物およびヒトのストレスに対する呼吸活動の調節に顕著に関与している[43,77,78]。さらに,外側および後方の視床下部が,協調的な呼吸活動の中枢制御に関与していることも明らかになっている[79]。視床下部は、低酸素や過呼吸などのストレス刺激に対する呼吸反応の調節に大きな役割を果たしていることが強調されている[80,81]。これらは、COVID-19に関連する呼吸困難の主な特徴と考えられている[5]。このような苦痛の主な原因は、中枢神経系ではなく肺系の機能不全であることはよく知られているが、我々の仮説は、視床下部内の呼吸中枢の機能不全が結果に寄与しているのではないかというものである[82]。これらの示唆を確認するには,さらなる実験が必要である。
一方、COVID-19に関する最近の疫学データによると、最初の症状から呼吸困難に至るまでの期間の中央値は約5日、入院や集中治療までの期間はそれぞれ8日と10日であった[83]。これは確かに肺の合併症に先立つウイルスの潜伏期間によるものであるが、この潜伏期間は、ウイルスが呼吸の調節に関与する脳領域に侵入し、その機能を損なうことができるという見解を裏付けるものであるとも考えられる[60,79]。
6. 視床下部におけるACE2の発現
ACE2は,アンジオテンシン変換酵素(ACE)のホモログであり,アンジオテンシンII(AII)からアンジオテンシン-(1-7)ペプチドへの変換を触媒し,視床下部で高発現していることが知られている[84]。視床下部では、ACE2は高血圧の抑制にも関与しており、視床下部のACE2とACEのバランスが血圧の決定要因となることが知られている[85,86,87]。さらに,ACE2を過剰発現させると,視床下部の局所的な炎症が抑制されるが,AIIレベルが上昇すると炎症が誘発され,炎症性サイトカインであるTNF-α,IL-1β,IL-6のmRNAレベルが上昇する[87,88]。興味深いことに,我々の最近の研究では,遺伝子の発現を翻訳レベルで制御する小さなヌクレオチドである視床下部のmiRNAが,ACE2および膜貫通型セリンプロテアーゼ2(TMPRSS2)に対して結合部位を持ち,強い結合力を持つことが明らかになった[89]。
SARS-CoVの両サブユニット(S1およびS2)は,非免疫細胞(内皮細胞,呼吸器および腸管上皮細胞,腎臓細胞,脳神経細胞)および免疫細胞(肺胞単球/マクロファージ)に存在するACE2のヒト受容体に結合することが知られている[90]。S2サブユニットがACE2受容体に結合すると、ACE2受容体がダウンレギュレーションされ、その結果、AIIが過剰に産生され、肺血管系の伝染性が増大する[90,91]。SARS-CoV-2がACE2に結合することによる炎症系の増幅は、高齢者や心血管疾患のある人がCOVID-19感染のリスクを高め、それに伴う重症度や死亡率が高くなることが示されている[92,93]。また、高血圧や糖尿病を患っている人にも同様のプロファイルが見られる。これらの患者は、通常、ACE2レベルを上げるためにACE阻害剤/AT1Rブロッカー(ACEI/ARB)治療を受ける。しかし、SARS-CoV-2がACE2に結合すると、ACE2の細胞表面の発現がさらに低下し、肺でのAIIシグナルがアップレギュレートされ、急性肺傷害が引き起こされる[93]。このように、通常はACE2タンパク質レベルが低い視床下部において、ACE-AII-AT1R軸が亢進すると、機能障害が起こりやすくなる。また、空気中の匂いを感覚ニューロンに伝える鼻の感覚細胞でのACE2の発現は、COVID-19感染の最初の症状の一つである匂いの一部または全部の喪失を引き起こすことにも関係しているとされている[94]。これは、視床下部周辺に漏れたBBBがあることで、神経内分泌シグナル分子の体内輸送に有利であることから、さらに強化されている。
7. ウイルスに対する視床下部-下垂体-副腎皮質のストレス反応
視床下部は、いくつかの止血機能の制御に関与しており、その範囲は中枢環境にとどまらない。様々なホメオスタシス上の課題に対する視床下部の主な反応の一つがストレス反応であり、これはウイルス感染などのストレス要因に対する統合的な反応と考えられている[38]。ストレス反応は,主にPVN内の視床下部ニューロンの活性化とコルチコトロフィン放出ホルモン(CRH)の放出によって引き起こされる。CRHは,下垂体前葉のコルチコトロピン産生細胞であるコルチコトロフを刺激して副腎皮質刺激ホルモン(ACTH)を合成・分泌させ,その結果,副腎を刺激してコルチゾールを分泌させる [95]。
視床下部-下垂体-副腎皮質(HPA)軸が、ウイルス感染に対する宿主の感受性の調節に重要な役割を果たしていることは、よく知られている。特に、IL-1β、IL-6,TNF-αなどの高濃度の炎症性サイトカインが、ウイルス感染の初期段階でHPA軸を活性化し、副腎皮質グルココルチコイド(GC)の放出を促して、攻撃的な炎症攻撃を抑制し、免疫反応を制御することがわかっている[96,97]。他の研究では、IL-1などの様々な炎症性サイトカインが、ウイルスによって誘発されるストレス反応の刺激に果たす役割が強調されている[98]。このことは、COVID-19を含むウイルス誘発性呼吸器疾患の治療薬として、デキサメタゾンなどのGCを使用する根拠となっている[99,100](図3)。さらに、GCは、細胞性(Th1/炎症性)から体液性(Th2/抗炎症性)への免疫反応のシフトを引き起こすことで、下流の獲得免疫反応の調節という、より重要な役割にも関与している[101]。さらに、GCは、下垂体に直接作用する負のフィードバックループを刺激することで、制御不能な免疫反応から恒常性システムを保護する。
図3 ウイルス感染時の視床下部-下垂体-副腎皮質(HPA)軸のメカニズム
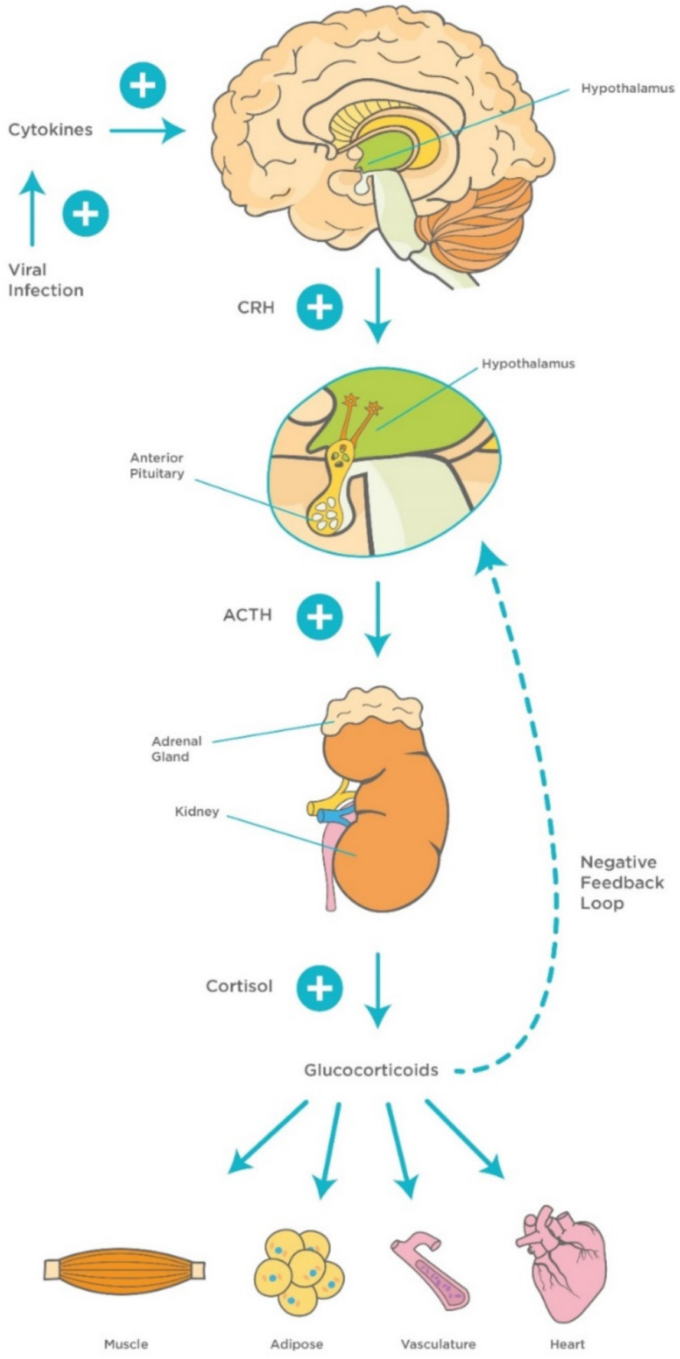
ウイルス感染により、先天性の炎症性サイトカイン(TNF-α、IL-1,IL-6)やインターフェロン、後天性のT細胞サイトカイン(IL-2,IFN-γ)が活性化され、HPA軸が活性化されてGCが放出される。これが今度は、負のフィードバックループを刺激して、免疫反応をコントロールする。略語の説明 ACTH(副腎皮質刺激ホルモン)CRH(コルチコトロピン放出因子)TNF-α(腫瘍壊死因子-α)IL-1(インターロイキン-1)IL-6(インターロイキン-6)IL-2(インターロイキン-2)IFN-γ(インターフェロン-ガンマ)GC(グルココルチコイド)。
注目すべきは、SARS-CoVが副腎で確認されたことで、ウイルスの直接的な細胞毒性作用が示唆されていることである[102]。さらに、SARS-CoV患者の剖検では、副腎皮質細胞の変性や壊死が確認されている。したがって、SARS-CoVとSARS-CoV-2の両方がストレス反応を操作し、その結果、コルチゾールの動態を変化させている可能性が示唆されている[94]。これは、宿主の反応を抑制するためにウイルスが用いる主要な免疫侵襲的戦略の一つと考えられている[3,102]。SARS患者を対象とした研究では、中枢性コルチゾール低下症とデヒドロエピアンドロステロン硫酸レベルの低下が確認されており、視床下部-下垂体回路の損傷を示している[103,104]。一方、リンパ球減少症は、COVID-19の主要な血液学的特徴と考えられ、HPAの活性化およびGCsレベルと強く関連している[104,105]。後者は、脾臓の萎縮、T細胞のアポトーシス、ナチュラルキラー細胞の欠乏を含む一連のイベントを引き起こし、その結果、造血幹細胞の増殖が骨髄系にシフトし、リンパ球減少症を引き起こす[106,107]。
8. 今後の方向性
本レビューでは、ウイルス感染プロセスにおける視床下部ネットワークの重要性を強調し、COVID-19に関連した中枢神経系症状の発現における視床下部ネットワークの関与の可能性を示唆している。我々の以前の研究では、視床下部のマイクロRNAが、食物摂取、エネルギーバランス、グルコースのホメオスタシスなど、複数の機能において重要な役割を果たしていることが示されている[39]。したがって、今後の研究では、COVID-19の病態におけるこれらのマイクロRNAの役割を調べることに重点を置くべきだと考えている。最近,我々はin silico解析を行い,ACE2とTMPRSS2の制御を介してCOVID-19患者の神経症状を治療するための治療標的となりうる視床下部マイクロRNAの可能性を明らかにした[89]。後者の存在と発現により、ある患者には中枢神経系症状が現れ、他の患者には現れないという選択性が説明できるかもしれない。COVID-19に関連する神経学的機能障害の素因に関する知識は限られているが、次のような要因が役割を果たしていると推測できる:既往症、投薬、ウイルス暴露量、ウイルスの亜種株[108]。
9. 結論
COVID-19に関連する神経学的障害は、SARS-CoV-2の神経浸潤に関連する可能性が高い。視床下部の回路は、嗅球を経由してウイルスの侵入口となり、重要な呼吸器系ネットワークと連絡していることを強調することが重要である。また、視床下部は、視床下部-下垂体-副腎皮質軸を介して、中枢神経系を超えて末梢にまで及んでいる。COVID-19の中枢神経系への影響を振り返ると、COVID-19感染に伴う神経障害の発症に関与している可能性のある視床下部の回路を正確に特定するために、集中的な研究努力を確立することの重要性が注目される。