Contents
COVID-19 and Alzheimer’s Disease
www.mdpi.com/2076-3425/11/3/305/htm
- 1イタリア、90127,パレルモ、パレルモ大学生物医学・神経科学・高度診断学科臨床生化学・臨床分子医学・実験室医学研究所
- 2イタリア、パレルモ、90127パレルモ、大学病院「P.ジャコーネ」臨床検査医学科
- 3イタリア、パレルモ、90127パレルモ、パレルモ大学臨床生化学ユニット
- 4イタリア、パレルモ、90127パレルモ、パレルモ大学生物医学・神経科学・高度診断学科神経学ユニット
受理された。2021年2月5日 / 改訂:2021年2月22日 / 受理:2021年2月24日 / 掲載:2021年2月27日
要旨
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)は、神経侵襲性の高い神経向性ウイルスである。実際、患者の3分の1以上は、錯乱、頭痛、および味覚減退/無味覚を含む神経学的症状を発症する。
しかし、長期的な神経学的影響は、呼吸器、心血管、および腎臓の症状と比較して、ほとんど注目されていない。アルツハイマー病などの神経変性疾患の発症につながる可能性のあるSARS-CoV-2の神経学的傷害を説明するために、いくつかのメカニズムが提案されている。
アルツハイマー病とCOVID-19との間には、相互に関係があるように思われる。COVID-19患者はアルツハイマー病を発症しやすいようであり、一方で、アルツハイマー病患者は重度のCOVID-19に罹患しやすいと考えられる。
本レビューでは、アルツハイマー病発症リスクの高いCOVID-19患者を早期に同定するための貴重なツールとなりうるバイオマーカーの役割を中心に、アルツハイマー病とCOVID-19の関係を概観することを試みた。
キーワード
アルツハイマー病; バイオマーカー; SARS-CoV-2; 神経炎症; 神経変性疾患; 神経系
1. 序論
Severe Acute Respiratory Syndrome Coronavirus 2(SARS-CoV-2)はCOVID-19感染症の原因となる病原体であり、発熱や咳から多臓器の機能障害まで、幅広い症状を特徴としている[1]。さらに、SARS-CoV-2は、直接的または間接的に、異なる臓器を含むいくつかの合併症を誘発する可能性がある[2,3]。現在、感染症の臨床経過は予測不可能であり、個体間のばらつきが大きいことが特徴である。しかし、COVID-19患者の80%以上は、感染の初期に発症し、本疾患の病理学的特徴を示す老衰または無表情を呈している [4]。
SARS-CoV-2は、ヒトコロナウイルス(CoV)ファミリーのすべてのメンバーと同様に、中枢神経系(CNS)の日和見病原体である [5]。SARS-CoV-2感染に関連する神経学的徴候および症状、例えば、錯乱、頭痛、低痛・低明視、低汗・低麻酔、めまい、てんかん、急性脳血管障害[4]は、中枢神経系へのウイルスの直接侵入と、それに続くSARS-CoV-2スパイク蛋白質とアンジオテンシン変換酵素2(ACE2)との相互作用によって引き起こされる[6,7,8]。死後の研究により、COVID-19患者の脳組織にSARS-CoV-2抗原とRNAの両方が存在することが明らかになった [9]。
ACE-2の発現は、ウイルスのトロピズムとCOVID-19感染症因の重要な決定因子である。脳内では、ACE-2は神経細胞およびグリア細胞のほか、内皮細胞および動脈平滑筋細胞にも発現している。ACE-2 は側頭葉や海馬にも発現しており、アルツハイマー病の発症に関与する大脳領域である[6]。
SARS-CoV-2は、直接的な神経毒性、あるいは宿主免疫応答の活性化を介した間接的な損傷により中枢神経系にダメージを与え、脱髄、神経変性、細胞老化を引き起こす可能性があると考えられている。そのため、脳の老化を加速させ、認知症を含む神経変性疾患の発症を促進する可能性がある[10]。しかし、SARS-CoV-2感染が急性回復期を経て、老化の促進や加齢に伴う神経変性疾患にどのような長期的影響を及ぼすのかは、実際には不明である。注目すべきは、SARS-CoV-2はアルツハイマー病患者の認知機能低下を悪化させる可能性があることである。
一方、認知症はCOVID-19の重症度と死亡率の重要な危険因子であることが予備的に報告されている[11,12]。したがって、SARS-CoV-2感染とアルツハイマー病との間には相互関係が仮説として立てられる。図1は、アルツハイマー病とSARS-CoV-2感染との間に考えられる関連を、可能性のある基礎となるメカニズムを要約して示しており、それらは次の段落で説明される。
このレビューでは、バイオマーカーの潜在的な役割に焦点を当てて、アルツハイマー病とCOVID-19の関係についての概要を提供することを求めた。これは、今後の研究の出発点となるものである。
図1 アルツハイマー病とSARS-CoV-2感染の複雑な関係
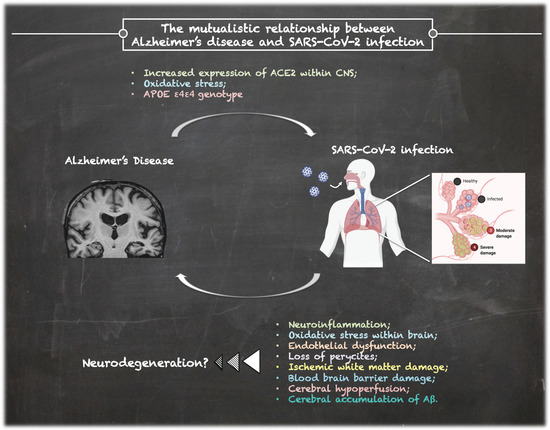
2. アルツハイマー病におけるCOVID-19
アルツハイマー病は世界的に最も一般的な認知症の形態である [13]。認知症という用語は、日常生活の中で対象者の自律性を損なう記憶、自己の方向付け能力、人格や行動の変化など、いくつかの機能の進行性の変化につながる、全体的で慢性的な、一般的に不可逆的な認知機能の低下を特徴とする幅広い疾患を指す[13,14]。認知症の発症率は一般人口で増加している。実際 2016年の世界保健機関(WHO)とアルツハイマー病国際報告書では、世界的な公衆衛生上の優先事項として定義されている[15]。認知症の患者は虚弱であり、日常生活動作を介護者に依存しており、身体運動や理学療法などのいくつかのサービス資源の支援を必要とする[16]。したがって、現在のCOVID-19パンデミックの間に政府当局が導入した、閉じこもりや隔離などの措置は、認知機能の低下を悪化させる可能性がある。さらに、アルツハイマー病と軽度認知症の患者は、短期記憶喪失と全体的な認知機能障害の重症度のために、手を消毒する、咳をするときは口と鼻を覆う、他人と物理的な距離を保つなどの公衆衛生当局からの勧告に従うことを嫌がるか、できないかもしれない[17]。
アルツハイマー病患者の脳は、アミロイドプラークの沈着と神経細胞の損傷とシナプスの損失だけでなく、オリゴデンドログリアの変性とミエリン障害を誘発する神経原線維のもつれの存在によって特徴づけられる[18]。
死後の研究では、対照群と比較してアルツハイマー病患者の脳内でACE-2の発現が増加していることが示された[19]。さらに、ゲノムワイド関連解析(GWAS)により、アルツハイマー病患者の脳組織ではACE-2遺伝子の発現が上昇し、重度のアルツハイマー病患者では発現量が増加していることが示された[20]。したがって、ACE-2遺伝子の発現亢進は、アルツハイマー病患者におけるCOVID-19感染の危険因子である可能性がある。アルツハイマー病と酸化ストレスを介したACE-2発現との間には直接的な関連があると考えられている。具体的には、加齢は酸化ストレスにつながる過剰な活性酸素種(ROS)の発生や抗酸化システムの機能不全を特徴とする酸化還元状態のアンバランスをもたらす[21]。アルツハイマー病患者は、アミロイドβの異常な著明な蓄積と神経原線維のもつれの沈着に関連した脳内酸化的損傷のかなりの程度を示している[21]。興味深いことに、ACE2阻害剤は最近、アルツハイマー病を含む神経変性疾患の潜在的な治療法として示唆されている[22]。
注目すべきことに、アルツハイマー病とCOVID-19は、年齢、性別、高血圧、糖尿病、APOE ε4発現などのいくつかの危険因子および併存疾患を共有している。このような証拠は、アルツハイマー病患者におけるSARS-CoV-2感染の有病率の増加を部分的に説明することができる。しかしながら、アルツハイマー病とCOVID-19をリンクさせる病態生理学的メカニズムを明らかにするためには、さらなる研究が必須である。
3. COVID-19を持つ患者はアルツハイマー病を発症する可能性があるか?
全体的に、COVは、嗅覚ニューロンや腸管ニューロンを介した逆行性軸索輸送、または感染したリンパ球が障害された血液脳関門(BBB)を通過するなど、さまざまな経路で中枢神経系に入ることができる[23]。
老化は、BBBの完全性が徐々に失われることを特徴としている[24]。したがって、高齢者はSARS-CoV-2感染時に神経侵襲を受けやすくなる可能性がある。
SARS CoV-2は嗅神経細胞に感染し、嗅粘膜の神経上皮を介して視床下部の嗅球に到達する [5,25]。嗅球にSARS-CoV-2が存在すると、マスト細胞、ミクログリア、アストロサイトなどの非神経細胞が活性化され、炎症性サイトカインが組織内で放出される。SARS-CoV-2は、感染した細胞のリン脂質を利用して独自のエンベロープを構築する。その結果、細胞、特に自然免疫細胞は、過剰な反応性を制御するために重要な役割を持つオートコイド局所傷害アンタゴニストアミド(ALIアミド)の合成のための前駆体を失うことになる[26]。その結果、結果として生じる神経炎症は、特に免疫系の反応が効率的でない高齢者において、制御不能になる可能性がある[27,28]。強烈な酸化ストレスに伴う神経炎症は、神経変性を誘発し、潜在的にアルツハイマー病などの神経変性疾患の発症を促進する可能性がある[25,29]。糖尿病、アテローム性動脈硬化症、不顕性認知症などの炎症性疾患を合併した高齢のCOVID-19患者は、アルツハイマー病発症のリスクが高くなる可能性がある。
COVID-19患者におけるアルツハイマー病発症リスクの増加には、いくつかの病理学的メカニズムが関与しているように思われる。
神経炎症の役割を示唆する証拠が増えている。全身性の炎症はミクログリアとアストロサイトの活性化を誘導し、その結果、IL-1β、IL-6,IL-12,TNF-αを含むプロ炎症性サイトカインを分泌する。このようなバイオマーカーは、シナプス機能障害に関与し、神経変性を誘発し、潜在的にアルツハイマー病につながる可能性がある [30]。
COVID-19患者では低酸素性変化および脱髄性病変が報告されている [31,32,33]。神経放射線学的研究では、回復したCOVID-19患者の3ヵ月後の追跡調査で、特に海馬における脳の機能的完全性の変化が示された。海馬は、実験研究[34]で示されているように、呼吸器ウイルス感染に対して特に脆弱な部位である。海馬の萎縮は認知機能の低下と関連しており、アルツハイマー病患者の一般的な特徴を表している[35,36]。さらに、変化したBBBは免疫細胞の浸潤を可能にし、COVID-19患者の認知機能低下や認知症に寄与する可能性がある。さらに、COVID-19の特徴である内皮機能障害と周皮細胞の喪失は、アミロイドβペプチドを含む脳代謝物のクリアランスを損なう可能性がある。老人斑、特に海馬におけるアミロイドβタンパク質の過剰および蓄積は、アルツハイマー病の基礎となる主な病態生理学的メカニズムを表している。重症COVID-19の共通の特徴である高凝固性と播種性血管内凝固(DIC)による二次的な灌流の低下により虚血性白質障害を呈することを報告した著者もいた。神経イメージングや実験的研究では、虚血性白質障害はアルツハイマー病の非常に初期の段階で発生し、疾患の進行を加速させ、認知機能の低下に寄与することが示されている[37,38]。さらに、脳低灌流はタウのリン酸化率を上昇させる可能性がある[39]。
重症のCOVID-19では、いわゆる「サイトカインストーム」によって特徴づけられる全身性の炎症が、血液脳関門の障害、および長期的な後遺症に関与しうる神経細胞およびグリア細胞の損傷をもたらす。全身性炎症は、アルツハイマー病の基礎となる病態生理学的メカニズムとして認識されている[40]。また、プロ炎症性サイトカインは、ミクログリア細胞の食細胞のβアミロイドに対する能力を変化させ、アミロイドプラークの蓄積を促進する[41]。血液脳関門の伝染性の増加により中枢神経系にアクセス可能なメディエーターの大量放出と関連したウイルス誘発性の全身性炎症性嵐は、神経炎症を増幅させ、神経変性プロセスに寄与する可能性がある [42]。
もう一つの興味深い証拠は、COVID-19患者におけるアルツハイマー病リスクの潜在的な増加が、抗菌ペプチドとして作用することができるアミロイドβに関連している可能性を示唆している。したがって、SARS-CoV-2の神経侵入は、免疫応答の一部としてアミロイドβの生成を促進し、βアミロイド沈着につながるβアミロイドカスケードを促進しうると推測される[43]。しかし、これは証明されなければならない仮説にすぎない。
McLoughlinらは、入院中にせん妄を発症したCOVID-19入院患者は、1ヶ月の退院後に認知スコアが低下したことを示した[44]。しかし、神経心理学的評価を行うことの難しさは、SARS-CoV-2感染の神経学的影響の理解不足につながる。全体的に、ARDSは重症患者における長期的な認知機能障害の高い有病率と関連している[45]。具体的には、ARDS中に十分なガス交換を維持するための標準的な治療である機械的換気は、重症COVID-19患者においても、長期的な認知機能障害に寄与する可能性がある[46,47,48,49]。実験的研究では、短期的な機械的換気が、アミロイドβペプチドの脳内蓄積、全身性および神経学的炎症、および血液脳関門機能障害を促進することにより、アルツハイマー病の神経病理を誘発することが示された[50]。
COVID-19の長期的な合併症は、今後10~15年の間に予想される。現在では、昨年からパンデミックが始まったため、それらを評価することはできない。しかし、今後は、特に高齢者や重症化した患者におけるCOVID-19の長期的な神経学的後遺症のリスクを評価することが極めて重要になるであろう。
COVID-19患者の認知障害に関与する可能性のあるメカニズムは、以下のようにまとめることができる。(i)中枢神経系におけるSARS-CoV-2の直接感染;(ii)SARS-CoV-2に対する全身性高炎症反応;(iii)内皮機能障害による脳血管虚血;(iv)重度の凝固障害;(v)ARDSまたは重症化した疾患による機械的換気;(vi)末梢臓器機能障害。
表1は、SARS-CoV-2感染とアルツハイマー病の発症を関連付ける可能性のあるメカニズムをまとめたものである。
4. COVID-19患者における認知機能低下のバイオマーカー
4.1. 神経細胞の損傷
タウタンパク質、ニューロフィラメント軽鎖タンパク質(NfL)グリア線維性酸性タンパク質(GFAp)などの脳脊髄液(脳脊髄液)中の神経変性のバイオマーカーは、COVID-19患者で増加し、神経学的症状および疾患の重症度の両方と関連している [53,54,55,56,57]。
T-tauは神経細胞死のバイオマーカーである。T-tauのレベルは、アルツハイマー病を含むいくつかの神経変性疾患で増加している。具体的には、アルツハイマー病の生化学的診断は、アミロイドβ1-42(アミロイドβ1-42)の減少、アミロイドβ1-42/1-40の比、およびt-Tauおよびp-Tauレベルの増加によって特徴づけられる脳脊髄液バイオマーカープロファイルの検出に依存している[13]。いくつかの著者は、COVID-19患者では脳脊髄液のt-Tauレベルが上昇し、神経細胞障害の存在を示唆していることを発見した。しかし、これまでのところ、このような患者でアミロイドβのレベルが調査されたことはない。
脳細胞に発現する中間フィラメントのうち、GFApとNeurofilmanentsがCOVID-19患者で評価されている。
GFAPはアストロサイトで高発現しており、アストロサイトの活性化/傷害のバイオマーカーを表している[58]。アルツハイマー病は、反応性アストロサイトに囲まれたアミロイド斑を特徴とし、GFAPを含む中間フィラメントの増加発現を示す[58]。これまでのところ、COVID-19患者におけるGFApの役割を評価した研究は2件のみである[53,54]。著者らは、重度のCOVID-19患者では対照群に比べてGFApの血漿中濃度が高いことを示した。
ニューロフィラメントは神経細胞の細胞骨格タンパク質であり、特に軸索に多く存在する。ニューロフィラメントは、ニューロフィラメント軽鎖(NF-L)ニューロフィラメント中鎖(NF-M)ニューロフィラメント重鎖(NF-H)の3つのサブユニットから構成されている。このうち、NF-Lが最も多く存在している。
軸索損傷後、NFは脳脊髄液中に放出される。このように、NF-Lsは軸索損傷と神経細胞死のバイオマーカーとなっている。脳脊髄液 NFsレベルは、アルツハイマー病を含むいくつかの神経障害で増加している [59]。血清および脳脊髄液-Lのレベルの上昇は、重度のCOVID-19患者で発見されている [53,54,55,56,57,60]。
COVID-19患者におけるt-Tauを評価した研究は1件のみで、重症症例でのt-Tauの増加を報告している。
これまでのところ、そのような生体液の入手が困難なため、COVID-19患者の脳脊髄液生化学的プロフィールを評価した著者は少ない。しかし、予備的な文献的証拠は、COVID-19後の長期的な神経学的後遺症の可能性についての認識を高めている。重度のCOVID-19患者では、神経細胞および軸索の損傷を示す脳脊髄液生化学的変化がみられるが、認知障害について決定的な結論を出すことはできない。潜在的な神経学的後遺症とアルツハイマー病発症のリスクを評価するためには、長期的な研究が必要である。
4.2. 遺伝的変異
アルツハイマー病 の最も重要な既知の素因となる危険因子は多型 APOE ε4 であり、ε4ε4(ホモ接合)遺伝子型は アルツハイマー病 リスクの 14 倍の増加と関連している。具体的には、APOE ε4は、アルツハイマー病患者における神経炎症と同様に、低脳血流および皮質下虚血性白質損傷と相関している[51]。Kuoらは、APOE ε4をホモ接合で保有する個体はSARS-CoV-2感染の有病率が高いことを示した。さらに、APOE ε4 ε4対立遺伝子は、認知症とは無関係に、重度のCOVID-19を発症するリスクの増加、および心血管疾患や2型糖尿病を含む他の併存疾患と関連していた [52]。したがって、APOE ε4は、アルツハイマー病およびSARS-CoV-2感染の共通の危険因子を表している。APOE ε4は、ウイルス感染および神経変性に対する脆弱性を促進する可能性がある。したがって、SARS-CoV-2感染は、感受性の高い遺伝子変異を持つ個人の神経変性を促進する因子である可能性があると推測される[52]。
しかし、APOE ε4,COVID-19,アルツハイマー病との関係については解明が必要である。
4.3. 炎症性バイオマーカー
IL-6,IL-1,およびガレクチン-3(Gal-3)を含むいくつかの炎症性バイオマーカーは、COVID-19とアルツハイマー病との間の関連として提案されている。
IL-6は、COVID-19において最も研究されているサイトカインの一つである。循環中のIL-6の増加したレベルは、重度のCOVID-19の発症および死亡率の高いリスクと関連している。したがって、IL-6はSARS-CoV-2感染における信頼性の高い予後バイオマーカーである[61]。IL-6はまた、アルツハイマー病の予後バイオマーカーでもある。実際、IL-6のレベルの上昇は、疾患の進行および認知パフォーマンスの悪化と関連している[62]。したがって、IL-6はCOVID-19とアルツハイマー病の共通のバイオマーカーである。
IL-6は、免疫細胞、上皮細胞および肝細胞の膜上に発現するか、または可溶性の形態で存在することができるIL-6Rとの相互作用によってその生物学的効果を発揮する。後者は、IL-6のアゴニストを表す。IL-6/IL-6Rの複合体は、免疫炎症反応に関与する細胞内経路を活性化することができる[62,63]。
IL-6およびIL-6R遺伝子の変化は、COVID-19などの感染症、およびアルツハイマー病などの神経変性疾患を含むいくつかの疾患の発症および進行に関与している可能性がある[64,65,66]。Strafellaらが行った「疾患と機能の解析」では、IL-6とIL-6Rがアルツハイマー病の病態形成における神経炎症、シナプス損傷、ミクログリアの活性化、認知機能障害に関与している可能性が示された[63]。
IL-6と同様に、IL-1はSARS-CoV-2感染の予後バイオマーカーを示し、レベルの増加は予後の悪化と関連している[67,68]。IL-1は、グリアおよびニューロンを含むいくつかの細胞型によって産生される炎症促進性サイトカインである。IL-1レベルはアルツハイマー病の脳で増加することがわかっている[69]。試験管内試験研究では、IL-1は神経細胞への直接的な影響、または神経毒物質のグリア産生による間接的な影響により、神経細胞死を誘導しうることが報告されている。さらに、IL-1 は海馬の可塑性と記憶過程の生理的調節にも関与している。文献的には、IL-1レベルの変化は、正(増加)と負(減少)の両方で、記憶機能の低下と関連していることが示されている。したがって、COVID-19患者で発見されたIL-1レベルの増加は、認知機能の低下を促進し、アルツハイマー病の発症につながる可能性がある[70]。
Gal-3はレクチンファミリーに属する炭水化物結合タンパク質である。それは、炎症や線維化を含むいくつかの生理学的および病理学的プロセスにおいて重要な役割を持つ多元的な機能を持っている[71,72,73]。Gal-3の増加したレベルは、重度のCOVID-19患者で発見されている。Gal-3は、びまん性肺胞損傷、浮腫、および低酸素症の急性期に関連した、過剰炎症反応および肺線維化を支持することにより、COVID-19の進行を促進すると推測されている[74]。Gal-3の増加したレベルはまた、アルツハイマー病患者の血清中に記載されている[75]。アルツハイマー病動物モデルの研究では、Gal-3がアミロイドβ凝集とアミロイドプラーク形成に関与している可能性が示された[76]。したがって、COVID-19患者におけるGal-3のレベルの増加もまた、アルツハイマー病の発症につながる損傷に関与している可能性があるという仮説が立てられる。しかし、このような仮説を確認するためにはさらなる研究が必要である。
5. 結論
現在、「SARS-CoV-2感染はアルツハイマー病の発症リスクを高めるのか?このような疑問を解決するための前向きな研究が急務となっている。
アルツハイマー病につながる認知障害を含む神経学的な後遺症は、COVID-19の重要な合併症である可能性がある。さらなる詳細な臨床研究、実験室研究、神経病理学的研究は、COVID-19の神経学的合併症の基礎となる病態生理学的メカニズムを解明するのに役立つであろう。COVID-19患者、特に高齢者や重症例の縦断的な追跡調査は、SARS-CoV-2感染による長期的な神経学的影響を検出するために必要である。このようなシナリオにおいて、バイオマーカーは、COVID-19患者の早期モニタリングおよびアルツハイマー病などの神経学的後遺症を発症するリスクの高い患者の早期発見のための信頼性の高いツールである。現在のところ、決定的な結論を導き出すための文献的証拠はまだほとんどない。しかしながら、アルツハイマー病とCOVID-19の間には重要な関係が存在するようである。
