Contents
集団間のACE2遺伝子変異の解析により、COVID-19関連の神経合併症との関連性の可能性が明らかに
Analysis of ACE2 Genetic Variability among Populations Highlights a Possible Link with COVID-19-Related Neurological Complications
www.mdpi.com/2073-4425/11/7/741/htm
要旨
アンジオテンシン変換酵素2(ACE2)は、新規な重症急性呼吸器症候群コロナウイルス2(SARS-Cov-2)の侵入受容体として認識されている。ACE2遺伝子の構造や配列の変異は、異なる組織におけるACE2の発現に影響を与え、SARS-Cov-2感染に対する反応やCOVID-19関連の表現型の違いを決定する可能性がある。
本研究では、イタリアの一般集団を代表する268人のコホートを対象に、ACE2の遺伝的変動性を一塩基変異(SNV)、コピー数変動(CNV)、および発現量的座位(eQTL)の観点から調査した。
解析の結果、イタリア人コホートでは5つのSNV(rs35803318、rs41303171、rs774469453、rs773676270、rs2285666)が同定された。
これらのうち、rs35803318とrs2285666は、イタリアの集団において、全世界の集団と比較して有意に異なる頻度分布を示した。
ACE2を標的としたeQTLs解析の結果、異なる脳組織に高い分布を示し、COVID-19患者におけるACE2の遺伝的変動と神経学的合併症との間に関連がある可能性が示唆された。
COVID-19患者におけるACE2発現と神経学的合併症への感受性との間に考えられる関係を明らかにするためには、さらなる研究が必要である。実際、神経学的合併症のリスクが高い患者では、重度の永久的な脳損傷を予防するために、異なるモニタリングと治療戦略が必要となる可能性がある。
キーワード
ACE2遺伝子; SARS-Cov-2; COVID-19; eQTLs; バイオインフォマティクス解析; 神経症状
1. 序論
アンジオテンシン変換酵素2(ACE2)は、新規病原性重症急性呼吸器症候群コロナウイルス2(SARS-Cov-2)の侵入受容体として認識されたことから、近年、科学界の注目を集めている[1]。ACE2は、染色体X(Xp2.22)上にマップされた相同遺伝子(ACE2)にコードされるタンパク質であり、18個のエクソンから構成されている。
ACE2は細胞外触媒ドメインを持つエクト酵素に分類され、循環ペプチドを切断することができる[2]。ACE2は、気道上皮、小腸、心臓、腎臓、肺、精巣、脳などの組織で発現している[2,3]。
ACE2の機能については、Ang IをAng-(1-9)ペプチドに、Ang IIをAng-(1-7)ペプチドに変換することで、レニンアンジオテンシン系(RAS)に関与している。Ang-(1-9)ペプチドの機能は未だ不明であるが、Ang-(1-7)ペプチドは血管拡張剤として作用する。
また、ACE2はアペリン、キニン、モルヒンスなどの他のペプチドを切断することができる[2]。ACE2は、アンジオテンシンIIの切断とその後の不活性化により、血圧、血管機能、代謝、動脈硬化、心臓、腎臓、脳、肺の傷害に対する保護に不可欠な決定因子として認識されている[2,3]。
しかし、ACE2は、2003年の重症急性呼吸器症候群(SARS)パンデミックと現在のコロナウイルス感染症(COVID-19)パンデミックの原因となったSARS-Cov-1および新規SARS-Cov-2ウイルスの侵入受容体としての病態生理学的機能も有していると考えられている[1]。
SARS-Cov-2は、ウイルススパイク(S)タンパク質とACE2受容体との高い結合親和性により、ヒトの細胞内に侵入し、自己複製や他の細胞への侵入のための細胞機構を乗っ取っている[4]。
SARS-Cov-2はACE2を受容体として利用しているが、Sタンパク質を発現させるためには、気管支、咽頭粘膜、肺などの気道組織に高発現する膜貫通型セリンプロテアーゼ2(TMPRSS2)という付属タンパク質が必要であり、感染した宿主におけるウイルスの拡散や病原性に重要であることが知られている[4,5,6]。
肺はSARS-Cov-2感染によって最も影響を受ける臓器であり、感染した肺胞細胞に重篤な細胞病理学的効果をもたらし、急性免疫炎症反応を誘発し、最終的には肺損傷をもたらすことが示されている[7]。
ACE2の発現は通常、肺損傷から保護され、SARS-Cov-1感染時にダウンレギュレーションされることが判明していることに注意することが重要である[4]。ACE2のダウンレギュレーションは、ウイルスの宿主細胞への侵入を阻害する自然免疫防御機構と考えられている[8]。
一方、ACE2のダウンレギュレーションは、ウイルスが宿主肺組織の傷害を誘発して細胞間の拡散を促進するメカニズムであることも示されている[8]。この点、SARS-Cov-2がACE2の発現を阻害するかどうかは、興味深い研究課題ではあるが、まだ明らかにされていない。
COVID-19の症状をもたらすSARS-Cov-2感染は、乾いた咳、発熱、筋肉痛または疲労、呼吸困難、および肺炎を含む様々な症状で特徴づけられる[1,9]。最も重篤な症例では、いくつかの臨床合併症(急性呼吸窮迫症候群、敗血症、急性心損傷、急性腎損傷、および二次感染)が記載されており、感染に対するより全身的な反応と関連しており、その結果は致命的なものとなり得る[9,10]。
全身性および呼吸器症状に加えて、COVID-19の重症患者の14~36%は、めまい、頭痛、味覚・嗅覚障害、意識障害、脳炎、発作、運動失調、および脳卒中を含む神経学的徴候を示す[11,12]。
この所見は、COVID-19患者の脳脊髄液中のSARS-Cov-2の証拠と合わせて、SARS-Cov-2の神経栄養作用がCOVID-19による罹患率および死亡率に寄与している可能性を示唆している[3]。
ACE2の複数の役割と異なる組織におけるその発現パターンを考えると、その発現レベルの変化はCOVID-19の感受性、症状、および転帰に影響を与えている可能性がある。特に、ACE2遺伝子の構造的および配列的変異の存在は、異なる組織におけるACE2遺伝子の発現に影響を与え、SARS-Cov-2感染に対する差動反応を決定する可能性がある。
このような観点から、本研究では、イタリア人268人のコホートにおけるACE2の遺伝的変動性を、一塩基変異(SNV)、コピー数変動(CNV)、発現量的遺伝子座(eQTL)の観点から調査することを目的とした。
2. 材料と方法
本研究は、イタリアの一般集団を代表する268のDNAサンプルを利用して行われた。これらのサンプルは、一部がサンタルチア財団病院のゲノム医学研究所で入手可能で、一部が国際的なデータベースから得られたものである。
イタリアのコホートは、構造的ゲノム変異の存在を評価するために比較ゲノムハイブリダイゼーション(aCGH)アレイを用いて分析した100サンプルと、ゲノムのコーディング領域またはスプライスサイト領域に位置する共通および稀な変異を同定するために利用した168サンプルから構成されている。
これらのサンプルに参照された遺伝データは、IRCCS Santa Lucia Foundation HospitalのGenomic Medicine Laboratoryで入手可能な全エクソームシークエンシング(WES)によって部分的に抽出され、Ensemblデータベース[13,14,15]によって部分的に抽出されたものである。
イタリア人患者の平均年齢は46±15歳、男女比は45:55であった。
研究はローマのサンタルチア財団倫理委員会(CE/PROG.650、2018年3月1日承認)の承認を受け、ヘルシンキ宣言に従って実施された。参加者は署名入りのインフォームドコンセントを提供した。
CNV解析は、Cytoscan750k_Array Single Sample解析「NA33_hg19」を参照ファイルとし、平均分解能100Kbで、Chromosome Analysis Suite (ChAS) 3.1 (Affymetrix, Santa Clara, CA, USA)を用いて行った。
SNVについては、タンパク質の機能に最も影響を与える可能性が高いと考えられる、コード化部位とスプライス部位のDNA領域に位置するSNV(SNPとインデル)を解析することにした。そこで、1000 GenomesデータベースとGnomADデータベース[15,16,17,18]から、ACE2のエキソン部位とスプライス部位に局在する変異体を抽出し、関心のあるSNVを選択した。
関心のある遺伝子変異体を選択するための頻度カットオフは、マイナー対立遺伝子頻度(MAF)>0.0001に設定した。このアプローチにより、ACE2配列内に位置する34の潜在的変異体を選択することができた(表S1)。
また、イタリアのコホートとアフリカ、アメリカ、アジア、ヨーロッパの集団で観察された頻度を比較するために、Ensemblデータベース[15]を使用して、世界中の集団における関心のある34のSNVの対立遺伝子頻度データをした。
イタリアのサンプルにおける34のSNVの存在は、WESおよびEnsemblデータベースから得られた出力ファイルを解析することによって評価された。
WESではACE2配列の解析に20倍のカバレッジを考慮した。WES解析で得られたバリアントコーラーファイル(VCF)は、まずvcfR[19]でスキャンした後、「GARFIELD-NGSにおける深層学習モデルによるゲノムバリアントフィルタリング」(GARFIELD-NGS)[20]による解析を行った。特に vcfR は、VCF データの可視化、操作、品質管理を可能にするパッケージである[19]。
GARFIELD-NGSは、ディープラーニングモデルに依存して、エクソームシーケンシング実験における偽変種と真変種を解剖するインフォマティクスツールである[20]。
検出されたSNVの対立遺伝子頻度分布、およびイタリアおよび世界的な集団間での有意差の有無を統計ツールを用いて計算した。すべての統計解析はR環境で行った [21]。イタリアのコホートにおける検出されたSNVの他の集団と比較して異なる対立遺伝子分布を評価するために、両側フィッシャーの厳密検定とp値(p)を計算した。有意性の閾値はp < 0.05とした。さらに、q値(q)[22]を計算し、有意下限をq < 0.05に設定することにより、多重検定補正(偽発見率)を行った。
また、ACE2がX染色体にマップすることを考慮し、性に関連した影響を評価するために、コホートを性別で層別化して統計解析(両側フィッシャーの厳密検定)を行った。
さらに、イタリアの集団で検出された SNV は、ACE2 タンパク質の機能およびスプライシング機構への潜在的な影響を評価するために、バイオインフォマティクス予測解析を行った。この目的のために、VarSite [23]、Human Splicing Finder (HSF) [24]、Uniprotデータベース[25]を用いて解析を行った。
VarSiteは、アミノ酸の変化がタンパク質の構造に与える影響を解析・予測する。HSFはバリアントがスプライシング機構に及ぼす影響を評価する。また、タンパク質のトポロジカルドメインと機能ドメインの構造を検索するために、Uniprotアノテーションデータベースを利用した。
また、eQTL解析については、Genotype-Tissue Expression (GTex)データベース[26]を用いて、異なる組織におけるACE2発現に有意な影響を与えるeQTLを検索し、Biomartツール[27]を用いて、影響を受けた組織に分布する有意なeQTLを抽出した。
GTexデータベースは、組織特異的な遺伝子発現・制御や遺伝的変異との関係を研究することができる公開リソースである[26]。eQTL解析の有意基準値はp < 0.05とした。
Biomartはウェブベースのツールであり、データを統一的に抽出し、異なるクエリに対してフィルタリングすることが可能である[27]。本研究では、脳組織に有意に分布するeQTLの抽出とフィルタリングにBiomartを利用した。本研究の全体的な解析ワークフローを図1に示す。
また、統計解析および計算解析に使用されたすべての生データは、以下のリンクから入手可能です: github.com/Andreater/Data-and-RMD-for-ACE2-article。
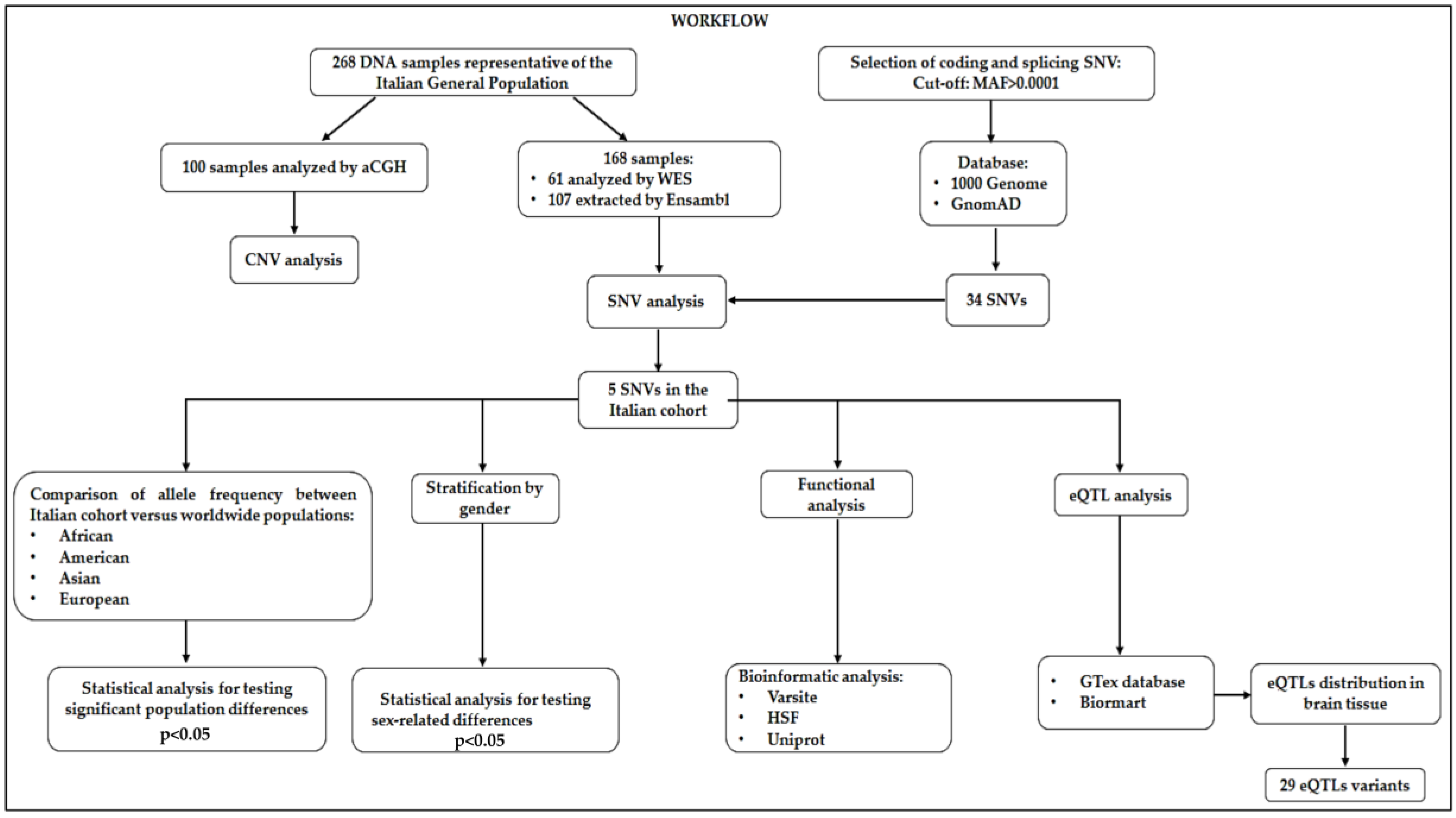
図1. 本研究で実施された解析ステップのワークフロー。
CNV: copy number variation、SNV: single nucleotide variants、MAF: minor allele frequency、HSF: human splicing finder、eQTL: expression quantitative locus。
3. 結果と考察
本研究の最終目標は、ACE2の発現と機能に影響を与える可能性のある変異体の研究であり、これは世界的な集団間でのSARS-Cov-2の拡散に寄与する可能性があり、COVID-19患者の臨床的変動と転帰に関して臨床的に重要な意味を持つ可能性がある。
ACE2のCNVの解析では、我々の研究コホートでは有意な変動は報告されておらず、頻繁なコピー数の変動がACE2の発現に影響を与えている可能性は否定できなかった。
しかし、SNVに関しては、以前に選択した34のSNVのスクリーニングを168のイタリアのサンプルで行ったところ、rs35803318(C/T)、rs41303171(T/C)、rs774469453(A/-)、rs773676270(T/C)、およびrs2285666(C/T)の5つのバリアントが存在することが明らかになった。
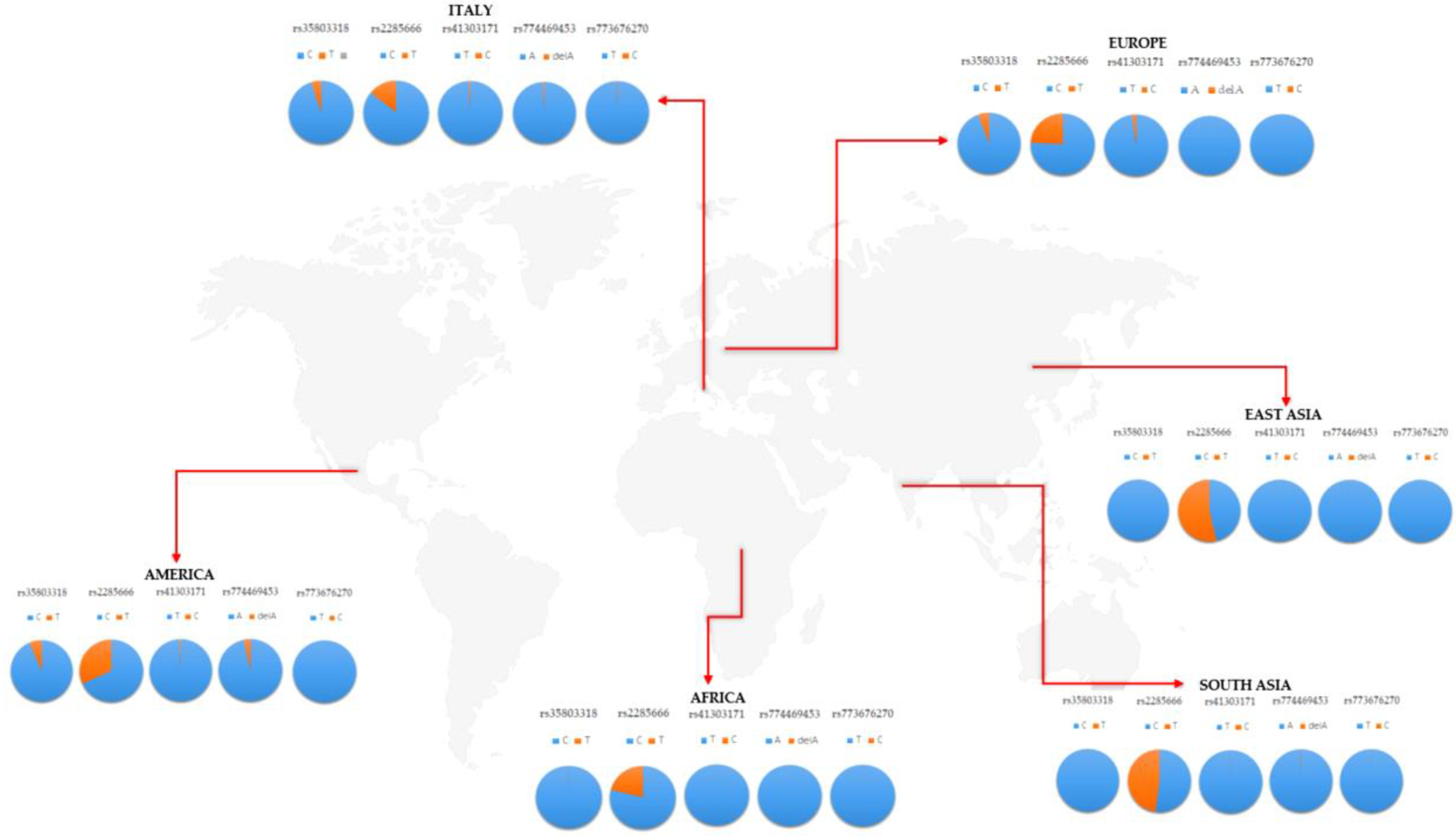
これらの変異体は、イタリアのコホートにおける頻度分布において、世界的な集団と比較して、いくつかの違いを示した(表1および図2)。遺伝子 11 00741 g002 550
図2. イタリアのコホートにおける5つの一塩基変異体(SNV)の全世界の集団に対する頻度分布。
表1 イタリア集団と全世界の集団におけるACE2対立遺伝子変異の比較
原文参照
予想通り、イタリアのコホートでは、ヨーロッパの集団と重複する頻度分布を示したが、アフリカ、アメリカ、アジアの集団では有意差が認められた(表2)また、これらのコホートでは、多重検定(q値)を補正した後に統計的有意性が確認された(表2)。
表2. イタリア集団における5つのSNVについて、全世界の集団と比較した(対)統計的結果。
イタリアのコホートで検出された5つのACE2変異体の頻度分布の、他の集団で観察された頻度との統計的に有意な差を示す両側フィッシャー厳密検定のp値(p)。q値(q)は、多重検定補正後の修正pを示す。有意なデータは太字で強調されている。
ITA:イタリア人;AFR:アフリカ人;AMR:アメリカ人;EUR:ヨーロッパ人;EAS:東アジア人;SAS:南アジア人;ns:有意ではない。
特に、rs35803318(C/T)は同義変異体であり、その対立遺伝子の頻度は、アフリカおよびアジア集団で観察された頻度とは有意に異なっていたが、ヨーロッパおよびアメリカ集団で記録された頻度と重なっていた(表1および表2)。
原文参照
実際、rs35803318は、アフリカとアジアの集団で観察された頻度が非常に低いのに比べて、イタリア、ヨーロッパ、アメリカの集団では、頻度が高いようであった(図2)。
rs41303171については、イタリア人集団では、アメリカ人、ヨーロッパ人、アジア人集団との重複頻度が見られたが、アフリカ人集団ではほとんど見られなかった(図2)。イタリア人集団におけるrs774469453の頻度は、わずかに高い頻度を報告したアメリカ人集団を除いて、調査したすべての集団と重複していた(図2)。
rs773676270は、イタリア人集団と他の世界的集団との間で、野生型および変異型対立遺伝子の頻度分布に有意な差を示さなかった(表2)。
変異型対立遺伝子は、すべての集団の中で極めて稀であり、イタリアのコホートで観察された頻度のわずかな増加が見られた(表1、図2)。
しかしながら、これらの変異体(rs41303171、rs774469453、およびrs773676270)のいずれも、多重検定で補正した後、集団間で有意に異なる分布を報告しなかった(表2)。
rs2285666に関しては、これは、以前に議論された他のバリアントと比較して、より高い頻度を示した唯一のバリアントであり、調査された集団の間では非常にまれであるように見えた(図2)。イタリア人集団における rs2285666 の頻度については、アフリカ人、アメリカ人、アジア人、さらにはヨーロッパ人集団と比較しても有意に異なることがわかった(表2)。
多重検定を行った結果、アメリカ人集団とアジア人集団では有意性が維持された(表2)。特に、rs2285666のバリアント対立遺伝子は、イタリア人コホートにおいて、他の集団と比較して最も低い頻度を示した(表1、図2)。
5つのSNVの頻度は、各集団の男性患者と女性患者、および異なる集団間で同様に分布しており、ACE2バリアントの頻度分布の根底には性別の影響がないことが示された。
以上のことから、イタリアの集団におけるACE2コード化変異の頻度分布を世界の集団と比較して解析したところ、イタリアの集団ではACE2遺伝子のコード化変異の割合が低いことが示され、SARS-Cov-2感染の感受性はACE2以外の他の遺伝子変異、あるいは他の遺伝子変異に依存している可能性が示唆された。
この点については、ACE2の調節領域(プロモーターやエンハンサーなど)に位置するノンコーディングバリアントが、SARS-Cov-2感染症のリスクにどのように寄与しているのかを調べることは興味深いことである。さらに、イタリア人および世界の集団におけるSARS-Cov-2感染症への感受性の変化を説明するために、集団特異的な影響の可能性を評価するために、さらなる研究を行うべきである。
我々の知見と一致するように、中国の集団を対象とした同様の研究では、彼らの集団における ACE2 の遺伝的変異を調査し、他の集団と比較して ACE2 変異体の頻度分布が異なることが明らかになった [28]。
さらに、eQTL変異体の対立遺伝子頻度が高く、これは組織内でのACE2の発現量の増加と関連しており、同じような条件の他の集団と比較して、SARS-Cov-2感染に対する感受性や反応が異なることを示唆している[28]。
しかし、これらのデータは、集団間でのACE2遺伝子変異とSARS-Cov-2感染に対する感受性の違いとの間の関係を示す直接的な証拠を示すには十分ではない。実際、イタリアおよび中国の集団で得られたデータは、それらの遺伝子変異とSARS-Cov-2感染症への感受性との潜在的な関連を評価するために、より大規模なコホート研究や症例/対照研究で再現されるべきである。さらに、これらの関連性を明らかにし、説明するために、さらなる機能研究を行うべきである。
イタリアのコホートで同定された5つのSNVバリアントの機能解析については、ほとんどの結果は、そのようなバリアントのタンパク質に対する機能的な影響を予測するには決定的ではないか、あるいは有意ではなかった。
rs35803318は同義変異体であるため、アミノ酸の変化をもたらさず、タンパク質の機能に影響を与える可能性は低いと考えられる。さらに、それはタンパク質の膜貫通部分をコードする領域に位置しており、通常はSARS-Cov-2 Sタンパク質とは相互作用しない。
rs41303171は、中性側鎖を有するアスパラギン(Asn)から負に帯電した側鎖を有するアスパラギン酸へのアミノ酸変化をもたらすミスセンスバリアントであり、したがって、より親水性である。しかし、Varsiteのインターログでは、AsnからAspへの変化は大きなものではなく、タンパク質の機能に変化をもたらす可能性があることを示している。
そのため、rs41303171のタンパク質機能への影響の予測解析は結論が出ず、現時点ではこのバリアントの機能的な影響を予測することはできないであった。しかし、rs41303171がACE2の細胞外部分をコードする領域に局在しており、通常はSARS-Cov-2 Sタンパク質と相互作用していることは興味深い。
したがって、将来的には機能実験によってこの変異の影響を評価することは興味深いことである。
rs774469453バリアントは、1塩基欠失であり、スプライシングイントロニック領域に位置している。そのため、このバリアントがスプライシングに変化をもたらす可能性があるかどうかを調べるために、HSF解析を行った。
HSFインターロゲーションの結果、rs774469453のバリアント対立遺伝子は、エキソニックスプライシングサイレンサー(ESS)部位を形成する可能性があるが、有意ではなく、したがって、おそらくスプライシングには影響を与えないことが示された。
rs773676270は、SARS-Cov-2のSタンパク質と相互作用するタンパク質の細胞外部分をコードする領域に局在する同義バリアントである。興味深いことに、HSFの解析により、この変異体がエキソニックスプライシングに影響を与え、エキソニックスプライシングエンハンサー(ESE)サイトを変化させたり、エキソニックスクリプティックアクセプターサイトを活性化させたりする可能性があることが報告された。
これらの知見から、rs773676270は、ACE2の機能により大きな影響を与える他のバリアントとともに、さらに調査されるべきであることが示唆された。
rs2285666バリアントは、ACE2のスプライスサイト領域に位置するバリアントであった。しかし、HSFによる予測解析では、有意なスプライシング変化は認められなかった。
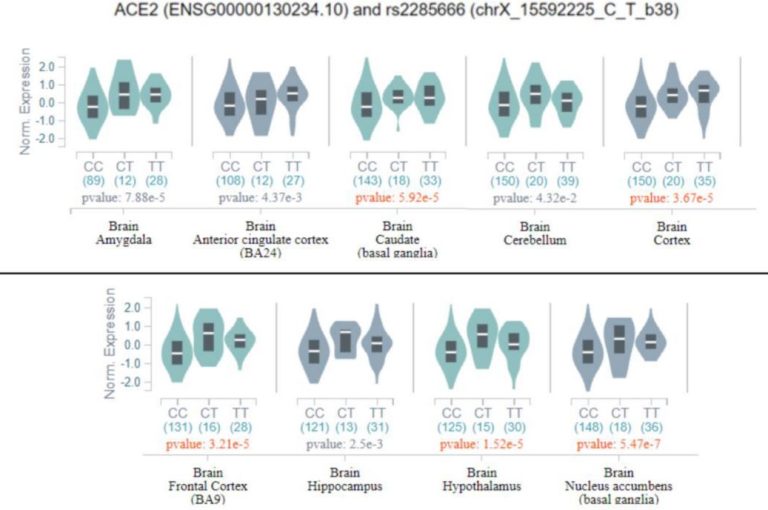
その後、先に述べたすべての変異体をGTExデータベースの潜在的eQTLとして評価したところ、rs2285666のみが扁桃体、前帯状皮質、大脳基底核、大脳皮質、小脳、海馬、視床下部といういくつかの脳組織において有意なeQTLとして分類された(図3)。

バイオリンプロットは、異なる脳組織におけるRS2285666遺伝子型とACE2 mRNA発現との間の相関関係を示す。
x軸上のレポートは遺伝子型であり、対応するカウントは括弧内にある。
y軸はACE2の正規化発現を報告している。
また、変異の有意性のp値が報告されている。
図は、Genotype-Tissue Expression (GTex) [26]から取得したものである。
図3に示すように、このバリアント対立遺伝子のホモ接合遺伝子型は、複数の脳組織においてACE2の発現を増加させ、その結果、脳内のACE2機能に影響を及ぼす可能性がある。この知見は、ACE2の遺伝的変異が、SARS-Cov-2感染の感受性よりもむしろ、COVID-19関連症状やSARS-Cov-2組織のトロピズムに大きな影響を与えている可能性を示唆している。
この問題に関して、TMPRSSの遺伝的変異の証拠および肺におけるeQTLの大きな存在は、TMPRSSの遺伝的変異が集団間でのSARS-Cov-2感染に対する異なる感受性を決定する役割を持っている可能性を示唆しているかもしれない。
しかし、これらは予備的な観察であり、さらなる調査によって確認されなければならない。複数の脳組織における rs2285666 のより広範な影響を考慮して、我々は、ACE2 を標的とする eQTL 変異体の脳組織における分布を調べることにした。
興味深いことに、文献研究では、血圧、心肥大、ストレス反応、不安、認知、脳損傷に対する顕著な調節効果を含む、脳生理学および病態生理学における ACE2 の重要な役割が強調されている [2,29,30]。
GTexポータルとBiomartでのeQTL解析により、脳内のACE2発現に異なるレベルで影響を与えると予測されている29の有意なeQTLを同定することができた(表S2)。そのほとんど(23個のeQTL)が複数の脳組織に有意な影響を与えており、ACE2関連の脳機能全体に影響を与えている可能性が示唆された。代わりに6つのeQTLはより組織特異的な効果を示し、脳の限られた領域で制御される脳機能の変化に関与している可能性を示唆している。
興味深いことに、ACE2関連のeQTLが有意に濃縮された組織は、大脳基底核、大脳皮質、視床下部、黒質であったが、扁桃体と小脳ではあまり影響を受けていなかった。これらの所見は、COVID-19患者で観察された神経症状(発作、脳卒中、脳炎、めまい、頭痛、錯乱、体温変化、無感覚、運動失調など)にACE2発現の変化が関与している可能性を示唆している。
興味深いことに、ACE2を標的としたACE2 eQTLバリアントは肺組織では報告されておらず、代わりにTMPRSS関連のeQTLバリアントに特に富むようであった。これらの知見は、COVID-19患者の感受性と臨床転帰、特に神経症状に関するACE2遺伝子変異の役割について、さらなる調査が必要であることを示唆している。
実際、これらの研究は、致命的な転帰または重度の永久的な脳損傷を防ぐために、異なるモニタリングと治療戦略を必要とする可能性のある神経学的合併症のリスクが高い患者を特定するために有用であろう。
COVID-19患者におけるACE遺伝子多型と重症肺障害
ACE gene polymorphism and severe lung injury in patients with COVID-19
COVID-19の臨床症状は著しく多様であり、大多数の患者は無症状または軽度の症状を呈している。しかし、SARS-CoV-2による重症急性呼吸器疾患は一般的であり、入院を必要とする患者の死亡率と関連している。
重症肺障害になりやすい病因については不明な点が多い。アンジオテンシンIからアンジオテンシン変換酵素(ACE)によって変換され,アンジオテンシン変換酵素2(ACE2)によって代謝されるアンジオテンシンIIは、肺障害の発症に重要な役割を果たしている。
ACE2は、SARS-COV-2が細胞内に侵入するための必須の受容体として同定されている。ACE2とSARS-COV-2の結合は、ACE2の枯渇とACE2のダウンレギュレーションをもたらす。ACEとACE2の間の相互作用とアンバランスは、アンジオテンシンIIの非抑制をもたらす。
ACE挿入/欠失(I/D)遺伝子多型は、一般集団におけるACEレベルの変動に寄与しており、DDキャリアの平均ACEレベルはIIキャリアの約2倍であることから、COVID-19患者における重度肺障害の遺伝的素因の仮説を提案する。ACE阻害薬やACE受容体拮抗薬(ARB)は,特に高ACE値を示すACE遺伝子型を有する患者において,SARS-COV-2感染後の急性肺障害を予防・治療する可能性があると考えられる。