COVID-19: A Mitochondrial Perspective
pubmed.ncbi.nlm.nih.gov/33872068/
掲載時期:2021年4月19日
概要
新型コロナウイルス019(COVID-19)は、今世紀最悪の公衆衛生上の危機である。COVID-19の病態解明には大きな進展があったが、まだ多くのことが解明されていない。COVID-19の病態にはミトコンドリアが重要な役割を果たしていると考えられているが、その理由は自然抗ウイルス免疫や炎症に関与しているからである。本稿では、COVID-19の病態をミトコンドリアの観点から検討し、肥満、メタボリックシンドローム、2型糖尿病のある人の予後がなぜ悪いのかなど、不可解な疑問に答えようとしている。有効なワクチンや抗ウイルス剤がこの危機に対する最終的な解決策となるであろうが、病気のメカニズムをより深く理解することで、治療や予防のための新たな道が開けるであろう。
はじめに
私たちの世界を荒廃させ続けている新型コロナウイルス019年疾患(COVID-19)の到来から 1年以上が経過した。ワクチンのニュースは多くの希望をもたらしたが、まだ終わったわけではない。現在承認されているワクチンは高い有効性と防御力を備えているとはいえ、防御力の持続期間や、最も弱い立場にある人を守る能力は、現時点では不明である。ウイルスの亜種の出現は、さらなる脅威となっている。国民も科学界も、今のうちから油断してはいけない。私たちには長い道のりが待っているようである。
COVID-19は 2002年の重症急性呼吸器症候群(SARS)や2012年の中東呼吸器症候群といったコロナウイルスによる過去の疫病と比較して、いくつかの特殊性があり、はるかに危険である。例えば、感染者の大半は無症状または軽度の症状であるが、他の人に感染させることができる。症状が出ている人は、症状が出る前に伝染してしまう。したがって、これらの健康な人や軽症の人が感染のリザーバーとなる。一方、65歳以上の高齢者や、心臓病、腎不全、悪性腫瘍などの病気を併発している人など、最も感染しやすい人たちにとって、感染は致命的である(Wolff et al 2021)。また、高血圧、肥満、2型糖尿病の方は、重症化して死亡率が高くなるリスクがある。超高齢者や、腎不全や心疾患などの併存疾患がある人の予後が悪いことは、重症の呼吸器疾患では予想外のことであるが、致死率の大部分は、肥満、糖尿病、高血圧を有する比較的若い患者さんである。これらの疾患はメタボリックシンドロームとして併発する傾向があり、世界の成人人口の約4分の1が罹患していると言われている(O’Neill and O’Driscoll, 2015)。
COVID-19の発症メカニズムの解明は、世界中の科学者の努力により、かつてないほどの進展を見せているが、まだまだ多くのことが解明されなければならない。COVID-19におけるミトコンドリア機能障害は、新たな興味深いトピックである(Burtscher et al 2020,Gibellini et al 2020,Moreno Fernández-Ayala et al 2020,Nunn et al 2020,Shenoy et al 2020,Singh et al 2020)。COVID-19におけるミトコンドリアの役割をより深く理解することで、重要な不可解な問題に対する答えが得られるかもしれない。
COVID-19の病因。ミトコンドリアの観点から
ミトコンドリアは、エネルギー生産に不可欠な細胞小器官である。細胞内のエネルギー通貨(ATP)のほとんどはミトコンドリアで生産される。ミトコンドリアは、エネルギー生産における役割以外にも、自然免疫、活性酸素種(ROS)の生成、アポトーシスなど、いくつかの生理的プロセスに重要な役割を果たしており、これらはすべてCOVID-19の発症に重要である(Mirzaei et al 2020;Li et al 2020a)。ミトコンドリアの機能不全は、酸化ストレスや細胞機能・生命力の喪失を素因とする。さらに、ミトコンドリアの損傷は、細胞質および細胞外空間における損傷関連分子パターン(DAMPs)の放出を引き起こし、不適切で持続的な炎症を引き起こす(Dela Cruz and Kang, 2018; Grazioli and Pugin, 2018)。
SARS新型コロナウイルス(SARS-CoV-2)(COVID-19の原因物質)は、細胞表面のアンジオテンシン変換酵素2(ACE2)受容体に付着して細胞内に侵入する。これらの受容体は、肺胞上皮細胞や血管内皮細胞など多くの種類の細胞に豊富に存在する(Bourgonje er al)。 感染後、ACE2受容体の内在化とダウンレギュレーションが起こる(Banu er al 2020)。血管内皮では、ACE2は、アンジオテンシンIIからアンジオテンシン(1-7)への変換を行う。したがって、SARS-CoV-2感染後にACE2活性が低下すると、レニン・アンジオテンシン系のバランスが崩れ、相対的にアンジオテンシンIIが過剰になる。アンジオテンシンIIはタイプ1受容体に結合して炎症促進作用、血管収縮作用、血栓促進作用を発揮し、アンジオテンシン(1-7)はアンジオテンシンタイプ2受容体とMAS受容体を介して相反する作用を発揮する(Verdecchia er al)。 さらに、アンジオテンシンIIは、酸化ストレスにつながる細胞質およびミトコンドリアの活性酸素生成を増加させる(de Cavanagh et al 2007; Doughan et al 2008)。酸化ストレスの増加は、内皮機能障害を引き起こし、全身および局所の炎症を悪化させるため、COVID-19の重症化に見られる急性肺損傷、サイトカインストーム、および血栓症の一因となる可能性がある(図1)(de Cavanagh et al 2007,Doughan et al 2008,Benigni et al 2010,Ahmed et al 2020,Sardu et al 2020)。
図1 COVID-19の病因におけるACE2の役割の模式図
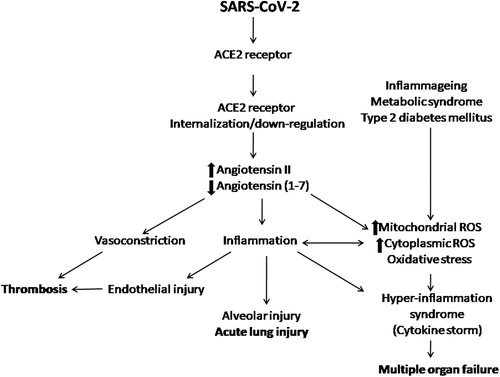
ACE2の内在化とダウンレギュレーションにより、アンジオテンシンIIが相対的に過剰となり、炎症や血栓症の促進状態となる。また、ミトコンドリアや細胞質での活性酸素の発生が促進され、酸化ストレスを引き起こし、炎症や傷害を悪化させる。全身の炎症や酸化ストレスを伴う病態(炎症性疾患、メタボリックシンドローム、2型糖尿病など)は、重症化したCOVID-19に特徴的な炎症亢進症候群を引き起こしやすいと言われている。ACE2,アンジオテンシン変換酵素2,COVID-19,コロナウイルス感染症2019,ROS、活性酸素種。
SARS-CoV-2は、細胞に侵入後、細胞の機械を乗っ取って自己複製を行う。さらに、細胞の抗ウイルス反応を抑制する。SARS-CoV-2は、小胞体の膜が変化してできた特殊な二重膜小胞(DMV)の中で複製を行う(Wolff et al 2020)。DMVには、ウイルスの複製と非構造タンパク質(nsp)の合成に不可欠なウイルス複製転写複合体(RTC)が含まれている(Yan er al 2020)。nspであるnsp4は、SARS-CoV感染(SARSの原因物質)においてRTCの組み立てに必須であり、SARS-CoV-2でも同様の機能を持つことが予測されている(Sakai er al 2017)。マウスコロナウイルスのnsp4の変異により、DMVの数が大幅に減少し、nsp3とnsp4が同時にミトコンドリアに局在することが明らかになった(Clementz er al)。 最近のアルゴリズムでは、SARS-CoV-2のゲノムおよび構造RNAの大部分がミトコンドリアマトリックスを標的としていることが示された(Wu et al 2020)。このように、SARS-CoV-2は、DMVの生合成を含む自身の利益のために、ミトコンドリアの機械をハイジャックしていると思われる(Singh er al)。 ウイルスによるミトコンドリアの操作は、ミトコンドリアの機能障害と酸化ストレスの増加を引き起こし、最終的にミトコンドリアの完全性の喪失と細胞死につながる可能性がある(Chen et al 2018,Han et al 2018)。ヒト免疫不全ウイルス(HIV)に感染した細胞では、ウイルスRNAがミトコンドリアに不均衡に集中していることが示された。さらに、ミトコンドリアのウイルスRNA負荷の増加は、ミトコンドリアの機能および生存率の低下と相関していた(Somasundaran et al 1994)。上述のように、酸化したミトコンドリアDNA、カルジオリピン、シトクロムcなどのDAMPsは、損傷したミトコンドリアから細胞質に放出され、局所的および全身的な炎症を永続させる可能性がある(Dela Cruz and Kang, 2018; Grazioli and Pugin, 2018; Han er al)。
自然免疫は、ウイルスに対する最初の防御ラインである。SARS-CoV-2などのRNAウイルスは、細胞質内のパターン認識受容体(PRR)によって認識される(Yan and Chen, 2012)。その結果、シグナルカスケードが活性化され、I/III型インターフェロンやその他の炎症性サイトカインが分泌される。インターフェロンには強力な抗ウイルス作用がある。インターフェロンは、感染した細胞とその周辺の細胞でいくつかの遺伝子の発現を誘発し、ウイルスの複製を抑制する(Yan and Chen, 2012; Vabret et al 2020)。複製中に形成されたSARS-CoV-2の二本鎖RNA中間体は、細胞質のPRR(RIG-IおよびMDA5)によって認識される。これらのPRRは、ミトコンドリア抗ウイルスシグナル(MAVS)タンパク質と相互作用し、ミトコンドリア外膜でMAVSの凝集と活性化を引き起こす。MAVSの活性化により、シグナルカスケードが活性化され、I/III型インターフェロンが分泌される(Banerjee et al 2020,Refolo et al 2020,Vabret et al 2020)。SARS-CoV-2は、生得的な抗ウイルス反応を回避するためのいくつかのメカニズムを開発した(Banerjee et al 2020,Vabret et al 2020)。例えば、DMVは二本鎖のウイルスRNAをPRRから遮蔽する。さらに、いくつかの構造的、非構造的、および付属的なタンパク質が、インターフェロン分泌経路またはインターフェロン分泌後の下流におけるシグナル伝達を阻害する(Amor et al 2020,Lei et al 2020,Vabret et al 2020)。SARS-CoV-2感染の細胞および動物モデルは、I/III型インターフェロン応答の欠損を示した(Blanco-Melo et al 2020)。さらに、インターフェロン抑制の程度は、COVID-19における病気の重症度やウイルス量と正の相関を示した(Hadjadj et al 2020,Zhang et al 2020)。
MAVSはインターフェロン応答に重要な役割を果たしている。SARS-CoVは、その付属タンパク質であるORF9bを介してMAVSのシグナルソームを阻害することで、インターフェロン応答を抑制する(Shi er al)。 ORF9bはSARS-CoV-2でも産生され、SARS-CoVのORF9bと約85%の類似性を持つ(Gordon et al 2020)。SARS-CoV-2の病因におけるその役割は、詳細には研究されていない。プロテオミクス研究により、SARS-CoV-2はミトコンドリア外膜タンパク質のトランスロカーゼであるTOMM70を標的としていることが明らかになった(Gordon et al 2020)。TOMM70はMAVSの活性化に重要な役割を果たしている(Liu et al 2010)。したがって、ORF9bは間接的にMAVSの活性を抑制し、その結果、SARS-CoV-2感染におけるインターフェロン応答を抑制すると考えられる。
ミトコンドリアは管状の構造体で、その品質を維持するために分裂と融合を繰り返している。ミトコンドリアの融合は、効果的な抗ウイルス反応に不可欠な管状の細長い構造を可能にする。RNAウイルス感染後にRIG-1が活性化されると、ミトコンドリアの融合が促進され、効率的なインターフェロン応答が可能になる(Pourcelot and Arnoult, 2014)。ウイルス感染は、ミトコンドリアのストレスと損傷を誘導する。ミトコンドリアの分裂は、マイトファジー(オートファジーの特殊な形態)によって除去されるミトコンドリアの損傷部分の除去を可能にする。メタボローム研究は、SARS-CoV-2がマイトファジーを阻害することを示唆している(Gassen et al 2020)。したがって、損傷を受けた機能不全のミトコンドリアが蓄積される。これは、MAVS応答の障害につながるだけでなく、炎症や細胞死を悪化させる(Kim et al 2018,Gassen et al 2020,Ma et al 2020,Seabright et al 2020)(図2)。
図2 ミトコンドリアの観点から提案されたCOVID-19の病因
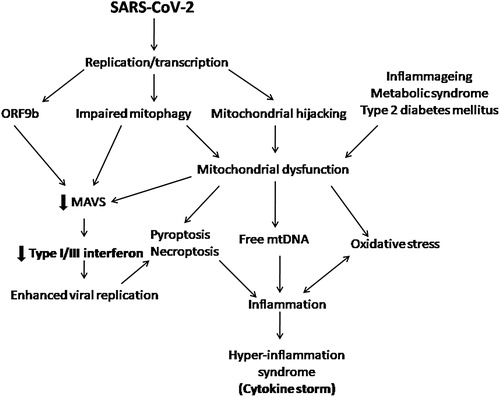
ウイルスRNAは細胞質内のPRRによって認識され、本文で説明したようにMAVSの活性化とI/III型反応を引き起こす。SARS-CoV-2は、この自然免疫反応を回避するためにいくつかのメカニズムを開発した。その一つがMAVSの阻害である。MAVSの阻害には、SARS-CoV-2が産生するアクセサリータンパク質であるORF9bによる間接的な阻害と、それに続くマイトファジーの障害によるものがある。また、マイトファジーが阻害されると、機能不全に陥ったミトコンドリアが蓄積され、炎症が悪化して細胞死が引き起こされる。また、SARS-CoV-2は、自身の複製のためにミトコンドリアの機械をハイジャックしており、これもミトコンドリアの機能障害の一因となっている可能性がある。ミトコンドリアの損傷、遊離mtDNA、抑制されていないウイルスの複製は、インフラマソームの活性化を促進し、その結果、ネクロープトーシス/ピロプトーシスを引き起こす。その結果、重度のCOVID-19に特徴的な炎症の亢進と多臓器不全が生じる。予後不良の原因として、ミトコンドリア機能障害、酸化ストレス、慢性的な全身性炎症などが挙げられる。MAVS, mitochondrial antiviral signaling, mtDNA, mitochondrial DNA, PRRs, pattern recognition receptors, SARS-CoV-2, severe acute respiratory syndrome coronavirus 2.
COVID-19の予後 ミトコンドリアの観点から
高年齢(65歳以上)2型糖尿病、肥満(体格指数[BMI]>30)高血圧、併存疾患(慢性腎疾患、肝疾患、がん、免疫抑制、心疾患)は、一貫して予後不良と関連することが示されている(Wolff et al 2021)。驚くことではないが、これらの疾患のほとんどはミトコンドリア機能障害と関連している。加齢および加齢関連疾患は、「inflammaging」とも呼ばれる慢性的な無菌性全身性炎症と関連している(Ferrucci and Fabbri, 2018)。これは、血中の炎症促進マーカーの増加を特徴とする。慢性炎症は、腸管伝染性の亢進、慢性感染症、細胞老化など、さまざまな刺激によって持続する(Ferrucci and Fabbri, 2018; Franceschi er al)。 加齢に伴うミトコンドリア機能の低下と、その結果としての酸化ストレスの増加は、炎症を引き起こす重要な要因となる(Conte er al 2020)。同様に、肥満、脂肪肝疾患、および2型糖尿病(特に、メタボリックシンドロームの構成要素として一緒になっている場合)は、ミトコンドリア機能障害、酸化ストレス、および全身性炎症と関連している(Galvan et al 2017,Lahera et al 2017,de Mello et al 2018,Silzer and Phillips 2018,Simões et al 2018,Yaribeygi et al 2019,Prasun 2020)。さらに、これらの状態は、ミトコンドリアダイナミクスの変化と、断片化した機能不全ミトコンドリアにつながる誇張されたミトコンドリア分裂によって特徴付けられる(Liu er al 2020)。このような比較的不健康なミトコンドリアは、上述の病態の項で説明したように、効果的なインターフェロン応答を生み出すことができないと考えられる。さらに、SARS-CoV-2によるハイジャックは、ミトコンドリアの完全性をさらに損ない、ミトコンドリアの機能を悪化させ、酸化ストレスを増大させる可能性がある。活性酸素の発生が増加し、酸化されたミトコンドリアDNAが細胞質に放出され、これがインフラマソームを活性化することで炎症を悪化させる(Sorbara and Girardin, 2011; Liu et al, 2018)。インフラマソームの活性化は、炎症性サイトカイン(インターロイキン1βおよび12)の産生をもたらし、パイロトーシスの素因となる(Kesavardhana and Kanneganti, 2017)。パイロトーシスは、炎症を発生させる細胞死の形態である。パイロトーシス後に放出される無細胞のミトコンドリアDNAは、局所的および全身的な炎症をさらに悪化させる(Riley and Tait, 2020)。このように、既存の炎症性亢進状態は、ミトコンドリア機能不全によって悪化し、感染の過程でその状態が悪化する。このようなハイリスク状態でのSARS-CoV-2感染は、火に油を注ぐようなものである(図2)。
上記の危険因子とは別に、重症のCOVID-19では男性の性別が独立して予後不良と関連している(Jin er al 2020)。女性の性ホルモンであるエストロゲンはミトコンドリアの生合成を促進するが(Lejri er al)。 このことが、予後の男女差を説明しているのかもしれない。
あるケースシリーズでは、COVID-19のすべての致死例で高乳酸が観察された(Li er al)。 肺病変による低酸素状態に加えて、ミトコンドリア機能障害と酸化的リン酸化の低下は、解糖と乳酸の蓄積を促進する。乳酸の蓄積はMAVSの機能にとって有害であり、インターフェロン応答をさらに低下させる可能性がある(Zhang et al 2019)。このように、ミトコンドリア機能不全は、ウイルスの複製を有利にし、同時に炎症を悪化させる(Burtscher et al 2020)。
COVID-19の治療と予防。ミトコンドリアの視点
COVID-19の病因においてミトコンドリアが重要な役割を果たす可能性があることを考えると、ミトコンドリアの健康状態を最適化することは、予防と治療において効果的な戦略となり得る。ミトコンドリアの健康は、運動、カロリー制限、および最適なBMIの達成によって改善することができる(Hoeks and Schrauwen, 2012; Pattanakuhar er al)。 また、ミトコンドリアの機能を高めるために、さまざまなミトコンドリアサプリメントが販売されている(表1)。これらのライフスタイルの変化は、長期的にはSARS-CoV-2への抵抗力を高めると考えられる。短期的には、MAVSの機能を高めることが効果的な戦略となる。最近の研究では、MAVSのO-GlcNacylationがその活性化とインターフェロン応答に重要であることが示された(Song er al)。 この研究では、マウスにD-グルコサミンを補給すると、致死的なRNAウイルス感染から保護された。グルコサミンは、軟骨の健康を改善するために広く使用されている栄養補助食品である。COVID-19の予防にも簡単に再利用できる。インターフェロン治療は、SARS-CoV-2に対する防御を強化することもできる。COVID-19ではインターフェロンの反応が乏しい、または遅れること、および試験管内試験でコロナウイルスに対する有効性が実証されていることから、COVID-19に対するいくつかの治療戦略には1型インターフェロンが含まれていた(Jamilloux et al 2020)。しかし、COVID-19患者におけるその有効性については結論が出ていない。さらに、すでに炎症が亢進している状態で、炎症を悪化させることが懸念されている。インターフェロンを効果的に使用するには、曝露後できるだけ早い段階で、理想的には予防として使用する必要がある。I/III型インターフェロンの経鼻製剤や吸入製剤が利用できるようになった今、グループホームや医療従事者などの高リスクグループにおける曝露前予防としての使用を強く検討すべきである。
表1 一般的なミトコンドリア関連のサプリメント
| 補足 | 用量(成人) | 備考 |
|---|---|---|
| コエンザイムQ10(ユビキノールと呼ばれる還元型と酸化型ユビキノンがある。還元型は生物学的利用能が高く、好ましいです) | ユビキノール 60〜600 mgを2回に分けて1日 ユビキノン 300〜2400 mgを2〜3回に分けて |
Co Q10は、ミトコンドリアの電子伝達系の不可欠な部分である。CoQ10サプリメントは、電子伝達系の効率を高めると考えられている。 |
| リボフラビン(ビタミンB 2) | 2〜3回に分けて1日50〜400 mg | リボフラビンは、複合体IおよびIIの構成要素の1つであるフラボタンパク質の前駆体である。 |
| アルファリポ酸 | 300〜600mg /日 | アルファリポ酸は、ミトコンドリア機能障害で過剰に形成された有毒なROSを除去する抗酸化剤として機能する。 |
| ビタミンE | 1日あたり100〜200 IU | ミトコンドリア機能障害で過剰に形成された有毒なROSを除去する抗酸化剤として機能する。 |
| ビタミンC | 1日50〜200 mg | ミトコンドリア機能障害で過剰に形成された有毒なROSを除去する抗酸化剤として機能する。 |
| L-カルニチン | 2〜3回に分けて1日あたり1000〜3000mg | L-カルニチンは、酸化のためにミトコンドリアへの長鎖脂肪酸の侵入を促進し、有毒なアシル化合物を除去する。 |
| L-クレアチン | 1日2〜10gを3回に分けて | クレアチンリン酸はATPの細胞内バッファーとして機能する。 |
ミトコンドリアの機能を高めることはCOVID-19の有効な予防策となるが、ミトコンドリアの機能不全がもたらす酸化ストレスを改善することは、重症患者の炎症亢進を治療するための有効なアジュバント戦略となる可能性がある。N-acetylcysteine(NAC)は、細胞内の重要な抗酸化物質であるグルタチオンの前駆体である。NACの静脈内投与はCOVID-19の炎症を改善するために使用することができる。同様に、他の多くのミトコンドリア抗酸化物質もCOVID-19に再利用することができる(Oyewole and Birch-Machin, 2015; Webb er al 2019)。
結論
SARS-CoV-2が自然免疫応答をうまく回避し、より速く増殖する能力は、症状を持たない、あるいは症状を発症しないかもしれない宿主の伝染性をもたらす。一方、感染を封じ込めようとする宿主の旺盛な炎症反応は、最も脆弱な集団においては自殺行為となる。このような病原体と宿主の特性の組み合わせにより、このウイルスは急速に進行し、壊滅的な被害をもたらしている。ウイルスによるミトコンドリアの操作は、免疫回避に重要であると考えられるが、一方で、ミトコンドリアの機能不全は、最も脆弱な人々の炎症の火種となる。現在承認されているワクチンは、このパンデミックに立ち向かうための大きな財産であるが、ミトコンドリアの観点からこの病気をさらに理解することは、武器を増やすことになるであろう」と述べている。
