Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC7890339/
アンドリュー・マカドナ(Andrew McCaddona,⁎)とビョルン・レグランドブ(Björn Reglandb)
要旨
COVID-19の社会経済的な影響は壊滅的である。かなりの罹患率が「Long-COVID」-感染症の合併症として認識されるようになってきている-に起因している。その多様な症状は、メチル化状態が損なわれた状態であるビタミンB12欠乏症を彷彿とさせる。
我々は、SARS-CoV-2感染がメチル基要求量の増加や一炭素代謝の他の障害を引き起こす理由を示唆している。このことが、Long-COVIDの様々な症状を説明する可能性を示唆している。我々が提案するメカニズムは、筋痛性脳脊髄炎/慢性疲労症候群などの類似した状態にも当てはまるかもしれない。
この仮説は、血清ギ酸塩、ホモシステインおよびメチルマロン酸を含むビタミンB12および葉酸の状態の詳細な決定、およびウイルスおよび宿主RNAのメチル化および症状との相関によって評価可能である。もし確認されれば、このような患者にはメチルグループのサポートが有益であることが証明されるはずである。
キーワード
コロナウイルス、COVID-19,ビタミンB12,葉酸、N6-メチルアデノシン(m6A)セリン、ギ酸塩
背景
2019年に武漢でコロナウイルスの新型「重症急性呼吸器症候群新型コロナウイルス」(SARS-CoV-2)が報告された[1]。SARS-CoV-2によるCOVID-19アウトブレイクは 2020年3月にパンデミック宣言された。
Long-COVID
“Long Covid “は、COVID-19の合併症として認識されているが原因不明のものである[2]。症状は多様であり、初期感染が解消された後も数ヶ月間続くことがある [3]。症状には、疲労、「ブレインフォグ」、筋肉痛、頭痛、めまい、息切れ、動悸、無呼吸、および胃腸障害が含まれる [3], [4], [5]。
悪性貧血(PA)患者、特に提示から診断までの間に著しい遅延を経験した患者が記載した症状と顕著な重複がある [6] (表1参照)。悪性貧血は、胃内因子の合成不足とそれに続くビタミンB12の吸収不良によって引き起こされる自己免疫疾患である。さらに、筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)もB12応答性症候群である[7]。感染によって発症することが多く、何らかの段階で自己免疫を誘発すると考えられている[8]。これらの症候群の臨床経験から、ビタミンB12の状態とSARS-CoV-2感染とその余波である「Long-COVID」との間に「共通分母」が存在するかどうかを検討することになった。
表1 PA患者(n = 889)[6]とCOVID 19(n = 165)の入院6カ月後に報告された症状の比較頻度[5]。
| 神経学的症状 | 悪性貧血 | 「ロングCOVID」 |
|---|---|---|
| 倦怠感 | 87% | 34% |
| 記憶の苦情 | 78% | 31% |
| 睡眠障害 | 87% | 26% |
| しびれ/うずき | 66% | 18% |
| 筋肉痛 | 文書化されていません | 30% |
| 錯乱 | 62% | 13% |
| めまい | 59% | 12% |
| 頭痛 | 52% | 10% |
| うつ病。 | 45% | 26% |
| 歩行障害 | 34% | 11% |
| 嗅覚障害 | 26% | 16% |
| 尿路機能障害/ UTI | 21% | 14% |
炭素一個分の代謝
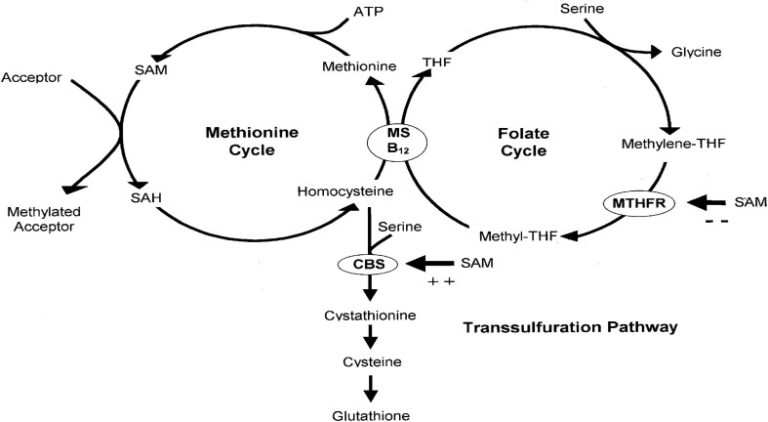
我々の仮説は、SARS-CoV-2による宿主の一炭素代謝とメチル基の利用可能性の変化に関するものである。特に重要なのは、B12依存性メチオニン合成酵素(MS)反応である(図1参照)。
図1 炭素数1の代謝
簡単に説明すると、メチオニンアデノシルトランスフェラーゼという酵素によってメチオニンがアデノシル化されると、S-アデノシルメチオニン(SAM)が生成され、これは多くの細胞内プロセスにメチル基を供給する普遍的なメチル供与体である[9]。SAMは、SAM依存性メチルトランスフェラーゼによるメチル基の移動に続いて、S-アデノシルホモシステイン(SAH)に変換され、それからSAHヒドロラーゼによってホモシステインに変換される。メチオニンサイクル」は、ホモシステインがMSによってメチオニンに変換されることで完了する(図1)。
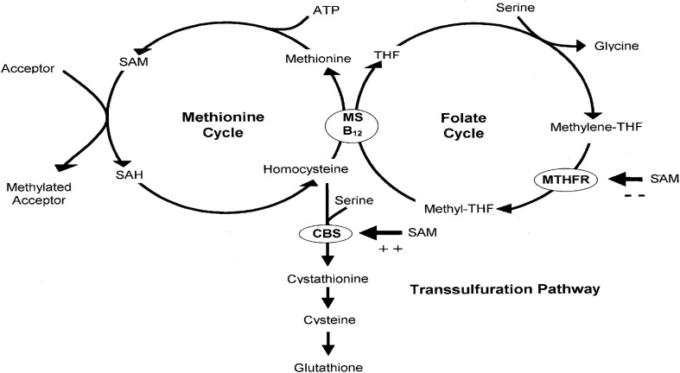
図2はMS反応を拡大したものである。MSに結合したメチル-B12は、そのメチル基をホモシステインに移動し、メチオニンと一過性の遊離cob(I)アラミン中間体を生成する。MS 結合メチル-B12 は、cob(I)alamin がメチル-テトラヒドロ葉酸 (メチル-THF) からのメチル基を受け入れるときに再生され、その過程で遊離テトラヒドロ葉酸 (THF) を生成する。
図2
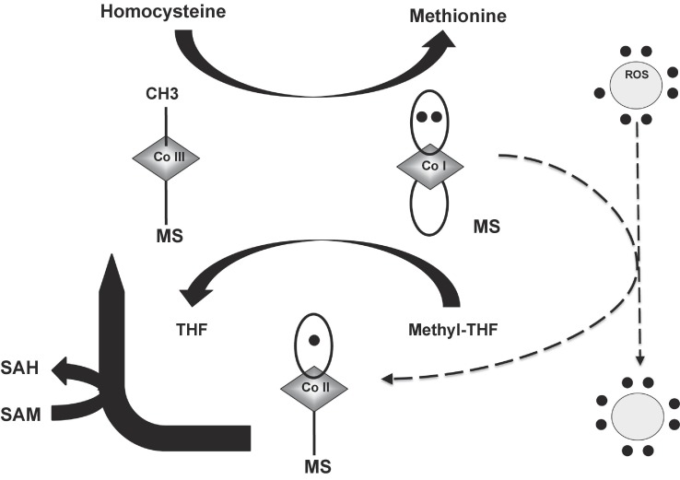
MS反応の一次ターンオーバーサイクルでは、ホモシステインはMS結合メチルコバラミンのメチル(CH3)基と反応してメチオニンとビタミンB12の不安定な中間体であるcob(I)アラミンを生成する(上の太字矢印)。この非常に反応性の高い種は、その後、遊離THFを生成し、MS結合メチルコバラミン(下の太字矢印)を再生するためにメチルテトラヒドロフォレート(メチル-THF)と反応する。したがって、コバラミンは、メチルコバラミンとコブ(I)アラミンの状態の間をシャトルする。コブ(I)アラミンは、時折、活性酸素種(ROS)によって不活性化され、コブ(II)アラミンに酸化される(破線の矢印)。コブ(II)アラミンの一次ターンオーバーサイクルへの復帰には、SAMがメチル基を提供する再活性化ステップが必要です(横の太い矢印)。脱活性化と再活性化は通常数千サイクルごとに起こる。このプロセスはSARS-CoV-2感染時に著しく増強されることが示唆されている。
N6-メチルアデノシン(m6A)
アデノシン(N6-メチルアデノシン)のN6位ではmRNAのメチル化が広く行われており、m6Aと略されている。このようなアデノシンの転写後メチル化は1970年代に初めて記述され、現在では自然なエピジェネティック現象と考えられている[10], [11]。このメチル化は、転写、翻訳、mRNAの崩壊を含む様々な生理的・病理学的プロセスに重要である[12], [13]。これは、おそらくすべてのRNAウイルス感染症、さらにはいくつかのDNAウイルスにも当てはまると思われる[14], [15]。
m6Aの有病率と分布を決定するのは、3種類のタンパク質である。メチル基はメチルトランスフェラーゼ(ライター)によって付加されるが、デメチラーゼ(消しゴム)によって除去される。mRNAのm6A修飾は、m6A結合タンパク質(リーダー)との相互作用によってその機能を発揮する。無数のm6Aリーダーが存在し、m6Aが遺伝子発現の広範な制御を可能にするように進化してきたことを示唆している。
哺乳類細胞では、m6A関連のメチルトランスフェラーゼは、主にメチルトランスフェラーゼ様タンパク質3(METTL3)と14(METTL14)の複合体で構成されている[16], [17]。主な脱メチル化酵素は、脂肪質量および肥満関連タンパク質(FTO)である[18]。重要なことに、FTOは、N6-ヒドロキシメチルアデノシンとN6-ホルミラデノシンの中間体を介してm6Aをアデノシンに順次酸化し、1-炭素単位をホルムアルデヒドとギ酸塩として放出する[19]。細胞質では、ホルムアルデヒドはヒドロキシメチル-GSH とフォルミル-GSH を介してグルタチオン(GSH)に依存した過程でギ酸塩に代謝される(図 3)。
図3 ホルムアルデヒドのGSH依存性代謝、およびギ酸塩の細胞内運命
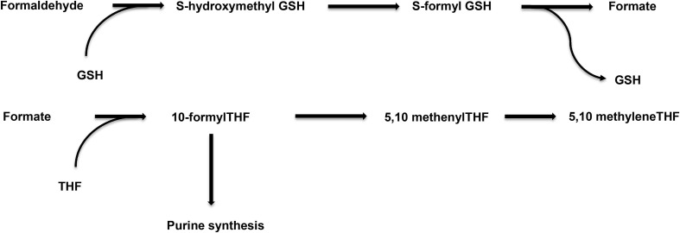
ギ酸塩にはいくつかの細胞内運命がある。CO2やギ酸塩自体としての直接輸出、プリン合成のための基質供給、メチオニンとSAMの合成を介したメチル基の再生などである。細胞内リサイクルは、遊離THFに依存し、SAM合成の場合はさらにB12に依存する(図1,図3)。
デメチラーゼによるmRNAのメチル化の可逆性は、mRNAの一次配列や二次構造だけで決定されるものではなく、動的なプロセスであることを示唆している[20]。
m6Aが最も一般的なmRNAのメチル修飾であるが、メチル基は、5-メチルシチジン、N4-アセチルシチジン、および4つのすべてのリボヌクレオシドのリボース部位の2′O-メチル化にも必要である[11]。
SARS-CoV-2ゲノム
SARS-CoV-2 のゲノムは約 30kB である。SARS-CoV-2のゲノムは、構造タンパク質、すなわちスパイク、エンベロープ、膜、ヌクレオカプシドをコードする遺伝子を持っている[21]。ゲノムの5′末端にはORF1ABとして知られる遺伝子があり、この遺伝子はすべての非構造タンパク質(NSP)を含むポリタンパク質をコードしている[22]。orf1abから生じるポリタンパク質は、タンパク質分解処理を受けて、16個のタンパク質、すなわちnspの1から 16までのタンパク質を生じさせることができる[23]。例えば、nsp12タンパク質はゲノムの複製を担うRNA依存性RNAポリメラーゼ(RdRp)を収容し、nsp14タンパク質にはN7-メチルトランスフェラーゼ活性があり、nsp16タンパク質にはSAM依存性O-メチルトランスフェラーゼ活性がある[22]。
仮説
我々は、SARS-CoV-2感染は、SAMの供給と需要の両方に関連して、いくつかの意味があることを示唆している。
1.COVID-19は「サイトカインストーム」と有意な酸化ストレスと関連している[24]。これは、MS反応に重要な意味を持つ。
コブ(I)アラミンはフリーラジカルによる酸化に対して脆弱である。MSの不活性化は、フリーラジカルがコブ(I)アラミンを酸化してコブ(II)アラミン種にするときに起こる。再活性化は、SAMによるメチル基の供与を必要とする[25](図2)。その正味の効果は、酸化ストレスの結果としてのSAMの枯渇(およびホモシステインレベルの上昇)である[26]。脱活性化と再活性化は通常、数千サイクルごとに起こる。このプロセスはSARS-CoV-2感染によって増強されることを示唆している。実際、このプロセスは、インフルエンザのようなサイトカインストームに関連した他の条件にも適用可能であろう。
2.ウイルスの複製は、メチル基、および一般的には1-炭素の利用可能性に大きな要求を与える。
SARS-CoV-2 nspの14および16は、メチルトランスフェラーゼ機能を有し、m7Gキャップおよび2′-O-メチル化修飾(下記参照)において重要な役割を果たす。しかしながら、細胞質で複製するほとんどのRNAウイルスは、m6Aメチルトランスフェラーゼ活性を有する酵素をコードしておらず、したがって、RNAを修飾するために宿主のm6A機械をハイジャックする。
SARS-CoV-2感染Vero-E6細胞(サル腎臓由来)を用いた最近の研究では、宿主m6A機械がウイルスのキータンパク質と相互作用してSARS-CoV-2の複製を促進することが結論づけられている。第一に、ハイジャックされたMETTL3はメチルトランスフェラーゼとして機能し、ウイルスRNAにm6A修飾を付加する。第二に、METTL3はウイルスRdRpと相互作用し、これによりMETTL3の発現が増強される(未知のメカニズムを介して)。要約すると、宿主のm6A修飾複合体は、ウイルスタンパク質と相互作用してSARS-CoV-2複製を調節する[27]。
一般に、宿主mRNAのm6A修飾は、ウイルス感染を増強するか、または宿主抵抗性を促進することができる。例えば、m6A修飾は、コロナウイルスファミリーの別のメンバーである豚伝染性下痢症ウイルス(PEDV)で記録されている[13]。PEDVの感染はホストRNA中のm6A比の増加を誘発し、ホストがm6A修飾によってウイルスの複製を制限しようとしている可能性を示唆している[13]。我々は、この防御的反応が、病前のメチル備蓄量が低い個体では損なわれ、その結果、Long-COVID患者ではm6A/A比が低下する可能性があることを示唆している。
SAMはまた、ウイルスRNAのキャッピングのためのメチル基にも必要である[28]。コロナウイルスは細胞質で複製し、宿主の核内キャッピング装置にはアクセスできない。SARS-CoV-2の場合、SAMはm7Gキャップ形成に必要な2つのメチル基を提供する[30]。
「背景情報」で述べたように、ウイルスのnsp12タンパク質は、ウイルスゲノムの複製を担当するRdRp活性を収容している。したがって、nsp12タンパク質は、RdRp活性を阻害してウイルス力価を低下させ、疾患の重症度を制限することができる分子を見つけるためのターゲットである。SARS-CoV-2のnsp12の計算モデルを用いて、そのような潜在的な阻害剤を同定するためのin silicoスクリーニングを行った[31]。興味深いことに、メチルコバラミンが最良のマッチング分子であることが証明された。すなわち、nsp12の天然基質の結合部位とメチルコバラミンの結合部位の間に最良のオーバーラップが見出された。したがって、メチルコバラミン(メチル化ビタミンB12)は、nsp12の阻害剤となり、ウイルスゲノム複製に必要なRNA合成を阻害する可能性がある。これはもちろん、我々の仮説を支持するものであるが、生体内試験での確認が必要である。
3.SARS-Cov-2は、SAMを介してリメチル化とトランススルファージョ化の調整を阻害する。
SAMは5,10-メチレンTHF還元酵素(MTHFR)の阻害剤であるが、シスタチオニンβ合成酵素(CBS)の活性化剤でもある(図1)。これにより、再メチル化と経硫化が協調的に行われるメカニズムが明らかになった(図1)。しかし、SARS-CoV-2によって引き起こされたメチル化要求の増加によってその調整が阻害されると、細胞内SAM濃度が低下し、CBS活性が低下し、ホモシステインが細胞内の重要な抗酸化物質である還元型GSHの合成から遠ざかることになる。したがって、SARS-Cov-2複製のシナリオでは、MTHFR活性と葉酸/B12およびMSを介したメチル化は、トランススルファージョ化およびGSH合成よりも優先されるであろう。
要約すると、SARS-CoV-2は宿主の一炭素代謝に大きなストレスを与えることが示唆される。それは同時に需要を増加させるが、メチル基の供給を損なう。
臨床的重要性の生化学的含意
我々の仮説の宿主に対する生化学的な意味合いはいくつかある。これらにはセリンの枯渇、ホモシステインの上昇、GSHの枯渇が含まれる。それぞれがLong-COVIDの様々な症状に明確な貢献をしている可能性がある。個人の「ベースライン」代謝状態および食事状態は、特定の症状への影響を予測する可能性がある。このことを念頭に置いて、予測されたそれぞれの生化学的帰結、およびそれに関連する臨床的後遺症を以下に個別に検討する。
セリン
SARS-CoV-2感染後に増加したシンジ炭素単位の需要は、5-メチルTHFの1-炭素単位の最終供給者であるセリンレベルの低下に反映されるはずである(図1)。
腎臓はセリン代謝において重要な役割を果たしている。腎臓は、循環からグリシンを除去してセリンに変換し、それを腎静脈に放出する。腎臓は1日あたり約4gのセリンを産生するが、これは典型的な欧米の食事とほぼ同等である[34]。慢性腎疾患の患者では腎のセリン産生量が低下し、血漿中のセリン濃度の低下に反映される[35]。腎臓に問題を抱えている患者や腎移植患者はCOVID-19を発症しやすく、このウイルス感染には腎機能が関与している[36]。
ミエリン合成におけるL-セリンの役割を考えると、末梢神経障害患者の中には軽度のセリン欠乏症があることが示唆されている [37], [38]。セリン欠乏は、Long-COVIDを持つ患者によってしばしば記述される「ピンや針でチクチクする感覚」(paraesthesia/知覚異常)に寄与するかもしれない。これはまた、PAの一般的な、まだ原因不明の症状である。
セリンに対する追加の代謝要求は、SARS-CoV-2誘発性T細胞反応の結果としても起こる。食事介入による血清セリンおよびグリシンレベルの低下は、病原体主導のT細胞の増殖を劇的に減少させ、この反応におけるこれらのアミノ酸の重要な要件を示している[39]。
ホモシステイン
我々の仮説では、Long-COVID患者ではホモシステイン濃度が上昇していることが示唆されている。「ウイルス性後疲労症候群」としての long-COVIDは、様々なウイルス感染の結果と して疑われるME/CFSにも似ている [8], [40]。ME/CFSは、研究室での決定的な特徴はないが、数十年に わたって診断が進化したことで、重篤な障害としての認識が 高まっている。ME/CFSのメタボローム研究は、メタボリックシンドロームであることを示唆している [41]。血中ホモシステイン値は一貫して上昇していないが、 ME/CFS患者では、脳脊髄液(脳脊髄液)中のホモシステインが非常に 著しく上昇しており、対照群と比較しても重複はない [42]。さらに、脳脊髄液ホモシステイン値は、客観的な「疲労」の評価と有意 に相関している[42]。
血中ホモシステインの上昇は、アルツハイマー病(AD)[43]を含む認知障害や認知症の患者では一般的である;この関連性は因果関係を示唆するBradford-Hillの基準を満たしている[44]。高用量ビタミンB群とホモシステインを下げることは、効果的に認知機能の低下や脳の萎縮を遅らせる[45]と、そのような治療は、現在、AD予防[46]のための最も有望な介入である。我々は、ホモシステインの上昇が、Long-COVID患者によって説明される「脳の曇り」に寄与していることを示唆している。また、対照群と比較してCOVID-19後の患者では認知障害が認められるという証拠もある[47]。
血栓塞栓症はSARS-CoV-2感染の病態形成の重要な一部である[48]。Long-COVID自体とは関係ないが、高凝固性および血栓塞栓症の増加傾向は、我々の仮説である血清ホモシステインの上昇によって予測される [49]。
グルタチオン
前述したように、GSHは細胞質ホルムアルデヒド代謝に必要である(図3)。また、GSHはB12の細胞内処理にも必要である[50]。しかし、SAMレベルの低下がCBS活性に及ぼす影響により、トランススルファリング経路を介した代謝フラックスが減少すると、Long-COVID患者ではGSHの低下(およびGSH/GSSG比の変化)が予測される。
効率的な抗酸化物質であることに加えて、GSHおよび/またはその前駆体であるN-アセチルシステインは、インフルエンザ、デング熱、単純ヘルペス、ロタウイルス、およびPEDVなどの広範囲のウイルスに対して有用な抗ウイルス活性を有する[51]。
最近のロシアの症例報告では、COVID-19が確認された4人の女性が報告されており、そのうち2人は軽症でGSH/GSSG比が正常であった。他の女性は、より重症のCOVID-19で、GSH/GSSG比が低く、「明らかにGSH欠乏と酸化ストレスを示している」。1人は出版時に重症のままであり、GSH治療は利用できないと報告されている [52]。米国の症例報告では、COVID-19肺炎による息切れを起こした2人の患者にGSHを投与したところ、数時間以内に劇的で迅速な反応を示した[53]。
研究への示唆
Long-COVID患者における予測される代謝効果を決定すべきである。これには血清セリンの測定や、GSH/GSSG比を含む「酸化ストレス」のマーカーの評価が含まれる。我々の仮説は、ビタミンB12と葉酸の状態の指標の変化も予測する。B12に関しては、その信頼性の高い評価は議論の対象となっているが、その重要な指標は、総血清B12,ホロ-トランスコバラミン(ホロTC)および2つの代謝マーカーであるメチルマロン酸とホモシステインの決定である[54]。後者は葉酸欠乏症でも上昇する;血漿ギ酸塩の測定はこの2つを区別するのに役立つかもしれない [55], [56]。
これらの患者では、内因性の不活性酸化生成物を表す不活性B12「類似体」の証拠もあるかもしれない[57], [58]。
可能であれば、これらの患者では明らかに変化しているはずのSAM/SAH比の決定を検討することも可能である[59]。
治療への影響
確認された場合、治療は、個人の特定の要件に合わせて合理的に調整されたメチル基の供給の回復に取り組むべきである。ビタミンB12と葉酸をグルタチオンまたは前駆体、そしておそらくセリンと組み合わせて置き換えることは、おそらく治療の主力を形成するであろう。興味深いことに、欧州10カ国を対象とした最近の研究では、最適でないB12の消費はCOVID-19の発症率および死亡率の増加と相関することが示されている[60]。
毎日のメチオニン摂取量を含む一般的な食事にも注意を払うべきである。他の栄養不足の回避および効果的な栄養政策は、COVID-19自体に対する集団の回復力を強化するのに役立つかもしれない [61], [62]。例えば、COVID-19で入院した17人の患者で、毎日ビタミンD(1,000IU)マグネシウム(150mg)およびビタミンB12(500mcg)を投与された患者は、非投与患者26人と比較して臨床経過が有意に改善した[63]。
このアプローチには前例がある。ある研究では、ME/CFS は低メタボリックシンドローム であることが示唆されており、「理論的には、葉酸、B12,グリシン、セリン プール、および B6 代謝に向けた介入によってサポートされる」 [41] 。
また、Long-COVID患者の慢性的な「酸化ストレス」に対処することも必要である。N-アセチルシステインはグルタチオンの前駆体であり、ホモシステインレベルを低下させるという付加的な利点がある[64]。
結論
我々は、SARS-CoV-2がウイルス誘発性酸化ストレスによりメチル基の供給を阻害すると同時に、メチル基の需要を増加させることを示唆している。
我々の仮説の生化学的な意味合いは、Long-COVID患者が経験する多様な症状を説明する可能性があり、もし確認されれば、治療へのアプローチの可能性を示唆している。
COVID-19の社会経済的な荒廃は、ウイルスの大パンデミックで世界的な研究を強化することによって、ME/CFSなどの他の疾患への貴重な洞察につながるだけでなく、記憶障害やアルツハイマー病を含む認知症の病因解明へのさらなる手がかりを提供することになるとすれば、皮肉なことである。