Costs and Resource Use Associated with Community-Dwelling Patients with Alzheimer’s Disease in Japan: Baseline Results from the Prospective Observational GERAS-J Study
概要
背景
日本の高齢化が進む中、アルツハイマー病認知症の人の介護が社会経済的な大きな課題となっている。
目的
アルツハイマー病 認知症に関連する社会全体のコストに対する患者と介護者のコストの寄与度を明らかにする。
方法
ベースラインデータは、縦断的な観察的研究であるGERAS-J研究のものを使用した。ミニ精神状態検査(Mini-Mental State Examination: MMSE)スコアを用いて、日常的にメモリークリニックを訪れている患者を、アルツハイマー病の重症度に基づいて3つのグループに分類した。医療資源の利用状況はResource Utilization in Dementia questionnaireを用いて記録した。また、日本独自のサービスや製品の単位費用(患者の直接医療利用、患者のソーシャルケア利用、インフォーマル介護時間)を用いて、月々の総社会的コストを推計した。平均コストの不確実性はブートストラップ法を用いて推定した。
結果
全体では、地域居住者のアルツハイマー病dementia患者553人(軽度[MMSE21-26]28.3%、中等度[MMSE15-20]37.8%、中等度/重度[MMSE14未満]34.0%)とその介護者が登録された。
患者の特徴は,平均年齢80.3歳,女性72.7%,一人暮らし13.6%であった。
介護者の特徴は、平均年齢62.1歳、女性70.7%、同居78.8%、患者の子供49.0%、単独介護者39.2%であった。
アルツハイマー病型認知症の社会的費用の総額(日本円)は月額15万8,454(軽度),中等度21万1,301人(中等度) 29万4,224(中等度・重度)であった。インフォーマルな介護費用が全体の50%以上を占めていた。
結論
GERAS-Jのベースライン結果では、アルツハイマー病認知症に関連した月々の社会的コストは重症度に応じて増加していることが示された。介護者関連の費用が最大のコスト要素であった。インフォーマルコストを減少させ、介護者の負担を軽減するための介入が必要である。
キーワード
アルツハイマー病、費用・コスト分析、日本、観察研究
はじめに
世界的に、人々は長生きしている[1]。現在のペースでは、世界の60歳以上の人口は2015年の9億人から 2050年には20億人に増加すると予想されている。同様に、2050年には世界で4億3,400万人以上の高齢者がいると予想されている。高齢化に伴い、アルツハイマー病やその他の認知症の発症率も増加している[2,3]。2050年には世界で1億3,150万人が認知症になると推定されている[4]。認知症の世界的なコストは 2015年には8,180億米ドル(USD)と推定されている。このうち40.4%(3,308億米ドル)が非公式(無報酬)の患者介護に起因している。インフォーマル介護のコストには、介護時間の価値、介護者の逸失利益、フォーマル介護の購入に関連するコスト(雇われヘルパー、在宅医療など)インフォーマル介護の提供に関連する介護者の医療費が含まれる[5]。
このように、インフォーマルケアは家族の介護者にかなりの負担を強いている。日本は、人口減少と65歳以上の人口増加を示す人口動態を考えると、認知症有病率の上昇の影響が他国に比べて大きく、インフォーマルケアの負担が大きくなる可能性がある[6,7]。
日本は世界で最も平均寿命が長い国である[8]。これと同時に出生率の低下が相まって、2030年までに65歳以上の高齢者が約33%、75歳以上の高齢者が約20%になると予測される「超高齢化社会」が形成されている[9]。日本では、全原因性認知症とアルツハイマー病認知症の発症率が増加しており[10-12]、これらの疾患が大きな健康問題となっている。2010年には、日本の成人250万人が認知症に罹患していると推定され、日本は認知症患者数の多い9カ国の中で第1位となっている[13]。日本の65歳以上を対象とした全国調査では、アルツハイマー病認知症の有病率は15.8%であった[14]。アルツハイマー病認知症は医学的な側面だけでなく、進行したアルツハイマー病認知症の患者は自分で介護ができないため、家族や社会に影響を与える社会経済的な問題でもある。
年齢人口動態の変化に対応して、日本では40歳以上の人に社会的介護保険(LTCI)の加入を義務付ける独自の保険制度を実施した[15]。このプログラムは、高齢者の総合的な評価と、家族介護者のための国保給付を通じた経済的支援を提供するものである。その後、高齢者のニーズが相対的に低いうちに他人に依存してしまうことを防ぎ、制度化のための経済的インセンティブを減らすための改革が導入された[16]。これにより、介護は地域や家族にシフトした。
認知症が社会に与えるコストは相当なものである。日本政府の統計を用いて、佐渡らは2014年の認知症に関連するコストを14.5兆円と推計しているが、そのうち6.16兆円がインフォーマルケアに関連している[17]。この研究では、1 週間のインフォーマルケアに費やされた時間は、介護者に配布されたアンケート調査に基づいている。この研究では、日常生活動作(日常生活動作)型ケアと器質的日常生活動作型ケアの提供に費やされた時間に、それぞれ代替コストアプローチと機会コストアプローチを適用した。同様に、日本の統計を用いて、花岡らは2014年の認知症関連の総コストを3.78~5.51兆円と推計し、インフォーマルケアが1.42~3.15兆円であるとしている[18]。この研究では、費用の算出には包括的疾病費法が用いられた。インフォーマルコストは、3つのケースモデルに基づいて介護時間と介護者の時間コストを算出した。
日本では、日本政府の統計を除いて、アルツハイマー病 認知症の社会経済的負担に関する実社会的な観察データはほとんどない。介護の取り決めや資源の利用パターンは時間の経過とともに変化し、文化や医療制度、社会規範に依存しているため、他国のデータを日本に外挿すことはできない。さらに、日本の意思決定者にとっては、現地のコストデータの方が有益である。GERAS-Japan (GERAS-J)調査は、日本の医療制度における国内のコストデータを提供することを目的としている。GERAS-J試験は、欧州連合諸国で実施されたGERAS-I(英国、フランス、ドイツ)[20]やGERAS-II(イタリア、スペイン)[22]と同様の18ヶ月間のプロスペクティブ観察研究[19]である。GERAS研究は、研究開始時のアルツハイマー病の重症度(軽度、中等度、中等度/重症)で層別化し、アルツハイマー病認知症とその介護者への影響に関連したリソースの使用量と総コストを明らかにすることを目的としている。アジアにおける資源の使用量とコストに関するデータは限られている。したがって、今回の研究は、その後の経済的評価へのインプットとして非常に価値のあるものである。本研究の目的は、GERAS-Jのベースラインデータを用いて、アルツハイマー病認知症に関連する社会全体のコストに対する患者と介護者のコストの寄与を明らかにすることであった。
方法
スタディデザイン
GERAS-Jは、日本において、地域に住むアルツハイマー病認知症患者の日常ケアを反映した縦断的プロスペクティブ多施設観察コホート研究であり、資源の利用状況を18ヶ月間追跡調査した。2016年11月から 2017年12月までに、日本の30の研究施設(大学病院13施設、病院12施設、診療所5施設を含むメモリークリニック)において、49名の研究者により患者とその主治医が登録された。
登録された患者
対象としたのは55歳以上の男女の外来患者で、アルツハイマー病認知症の診断とフォローアップのために日常的に受診している病院・診療所の外来患者として治療を受けており、治療の決定は治療担当医師の判断のみで行われている場合であった。患者は、National Institute on Aging and Alzheimer’s Association Alzheimer’s criteria [23]に基づくアルツハイマー病の可能性が高いとされる基準を満たし、Mini-Mental State Examination (MMSE) [24]のスコアが26以下であった。アルツハイマー病発症前または発症開始時に脳卒中、一過性虚血発作、パーキンソン病の既往歴、臨床徴候、画像診断による証拠、またはレビー小体型認知症の可能性がある患者は除外した。さらに、主介護者のいない患者や介入試験に同時参加している患者は除外した。
患者は、GERAS-Iおよび英国国立医療技術研究所(NICE)ガイドラインに準拠したMMSE基準[24]を用いて、ベースライン時のアルツハイマー病の重症度に基づいて3つのグループ(軽度、中等度、中等度/重度)に分類された:軽度、MMSE 21~26点、中等度、MMSE 15~20点、中等度/重度、MMSE≤14点[20, 25]。
この研究は、ヘルシンキ宣言に由来する倫理原則に従って実施され、日本の「医薬品疫学の適正実施規範」および適用される法令と一致していた。プロトコルは中央倫理審査委員会(ERB)によって審査された。一部の施設では、各施設の規則に従い、施設ごとのERBの承認を必要とした。患者(およびその代理人)と介護者の双方の書面による同意が必要であった。
評価およびアウトカム測定
各研究施設の担当者がベースラインデータを収集し、評価を実施した。収集したデータには、患者と介護者のベースラインの人口統計学、併存疾患、薬物使用、アルツハイマー病診断、生活状況、患者のアルツハイマー病治療が含まれている。患者と介護者の臨床転帰、医療資源の利用、健康関連のQOL、経済的援助、医療費の支出、アルツハイマー病認知症の負担もベースラインで収集した。
患者の臨床転帰は、MMSE [24]、Alzheimer’s Disease Cooperative Study Activities of Daily Living Inventory (ADCS-日常生活動作) [26]、Neuropsychiatric Inventory (NPI) [27]、Alzheimer’s Disease Assessment Scale-Cognitive Subscale (ADAS-Cog) [28, 29]を用いた面接ベースの方法で研究者によって評価された。MMSEとADAS-Cogは患者の認知を測定する [24, 29]。ADAS-CogはMMSEが14点を超える患者にのみ適用された。NPIは患者の行動を評価し、ADCS-日常生活動作は患者の機能を測定する [26,27];両方の情報は、研究者が実施した面接で介護者から得た。ADCS-日常生活動作については、基本的日常生活動作と手段的日常生活動作の別々のスコアが報告された。
健康転帰および医療資源利用は、EuroQol-5 Dimensions 5 Levels(EQ-5D-5 L Visual Analog Scale [VAS]およびHealth Index)[30,31]、Zarit Burden Interview(ZBI)[32]、およびResource Utilization in Dementia(RUD)質問票[33]を用いて評価した。EQ-5D-5 LとZBI質問票は、研究者の監修のもと、自己記入で実施した。RUD質問票は、研究者が面接ベースの方法で実施した。介護者は患者に代わってEQ-5D-5 Lの代理版に回答し、また自分自身も質問票に回答した。介護者はZBIとRUD質問票の情報を提供した。介護者は、トイレの使用、食事、着替え、グルーミング、歩行、入浴など患者の基本的な日常生活動作の援助に費やした時間、買い物、調理、家事、洗濯、移動、服薬、金銭管理など患者の道具的日常生活動作の援助に費やした時間、監督に費やした時間についての情報を提供した。
学習サイズ
サンプルサイズは指数関数的なコスト分布を仮定し、軽度、中等度、中等度/重度のアルツハイマー病患者の23.1%、30.5%、45.7%がそれぞれ18ヵ月後にフォローアップを受けることができなくなるか、あるいはコストを見積もるのに十分なフォローアップを受けることができなくなると仮定して推定された。予想される脱落率はGERAS-I [20]から導き出された。平均費用の±9.0%の95%信頼区間(CI)を得るために、最低550人(精度18%)の患者を登録する必要があった。これは、3つのアルツハイマー病サブグループ(軽度、中等度、中等度/重度)について同数の患者を想定した。観察されたサンプルサイズは、軽度、中等度、中等度/重度の3つのグループについて、それぞれ16%、14%、14%のおおよその精度を与えた。
コスト推定
ベースライン訪問から過去30日間のサービスや製品の日本独自の単価(2016年値)を、記録された資源利用(RUD質問票、薬物療法や神経心理学的評価などの治療に関する追加データ収集)に適用することで、アルツハイマー病認知症に関連する月々の社会的コストを患者と介護者の双方で推計した。補足表1)。
費用は以下の3つの構成要素に分けられている。1)患者の医療費(患者の投薬費、入院日数(入院)救急室の受診、外来受診を含む)2)患者のソーシャルケア費(地域ケアサービス、患者の居住施設への構造的適応、消耗品を含む)3)介護者のインフォーマルケア費(介護者の時間と介護者の欠勤の費用を含む)。介護者の時間は、基本的生活活動と道具的生活活動のための積極的な介護時間を含む RUD から算出した。監督時間は除外した。インフォーマルケアコストは、介護者の時間または介護者の欠勤のどちらか高い方のコストを用いて算出した(両方の項目に同じ単位コストが適用された) [17]。働いている介護者については、介護者時間の単位コストは生産時間の損失額とし、全国平均賃金を基にしたコストとした(補足表 1 参照)。非労働者の場合は、介護時間の単位コストは余暇時間の損失額であり、これは先行研究と同様に国の人口 1 人当たりの全国平均賃金の 35%とした [20, 34]。
統計的手法
研究参加基準を満たしたすべての患者が解析に含まれた。アルツハイマー病重症度群間の患者と介護者の特徴および報告された評価(すなわち、MMSE、ADCS-日常生活動作、ADAS、NPI、EQ-5D-5 L、ZBI、RUD)の差を、連続変数については分散分析(ANOVA)またはBrown-Mood中央値検定(モンテカルロ推定値からの正確なp値)で検定し、カテゴリカル変数についてはFisher’s Exact検定またはモンテカルロ推定値を使用した。有意性の検定は5%レベルで行った。
コストデータの分布は、全群および各群(軽度、中等度、中等度、重度/重度)について別々に評価した。平均コストは、ブートストラップ法を用いて計算された95%CIで報告されており、下限CIは2.5セント、上限CIは97.5セントである。元のデータのブートストラップ・リサンプリングは、10,000回実行された。置換した10,000サンプルのそれぞれについて、中央値と平均値を計算した。
総社会的コストに関連する因子は、総社会的コストを従属変数とした対数リンク関数を持つガンマ分布を用いた一般化線形モデルを用いて分析され、独立変数は後方選択法(p > 0.05)によって選択され、患者の年齢、患者の性別、およびMMSE重症度群はすべてモデルに残すことを余儀なくされた。予測変数については、連続共変量が欠落している場合は、母集団中央値が入力された。カテゴリー共変量が欠落している場合は、母集団のモードが入力された。ベースラインの欠落コスト情報はなかった。後方選択に使用された患者変数は以下の通りであった。アルツハイマー病重症度群、年齢、性別、LTCI認定(Yes/No)教育レベル、アルツハイマー病診断後の時間、居住地(都市部、農村部)居住形態(一人暮らし、一人暮らしではない+結婚している、一人暮らしではない+結婚していない)併存疾患数、過去3ヵ月間に転倒を経験した患者の数、ベースラインのADCS-日常生活動作合計スコア、ベースラインのNPIスコアであった。後方選択アプローチに使用した介護者変数は、患者を介護している介護者の数、年齢、性別、患者との関係、併存疾患の数、就労中の介護者、ベースラインのZBIスコアであった。モデルの仮定は残差診断を用いて評価し、モデルの適合性はデビアンスを用いて決定した。
分析にはSAS 9.4(SAS Institute, Cary, NC, USA)を使用した。
結果
全体では560名の患者が日本の30施設で49名の研究者によってスクリーニングされた。そのうち、7名が脱退した(5名は除外基準を満たさなかった、1名は除外基準を満たした[レビー小体型認知症]、1名は質問票記入前に脱退した)。GERAS-Jには合計553人のアルツハイマー病認知症患者とその介護者が登録された(表1)。患者の多くは女性(72.7%)であり、平均年齢は80.3歳であった。全患者のうち、軽度、中等度、中等度/重度のアルツハイマー病はそれぞれ28.3%、37.8%、34.0%であった。中等度/重度アルツハイマー病群では、アルツハイマー病診断からの期間が長く、自宅での一人暮らしの患者が少なかった。全体では、軽度アルツハイマー病患者の53.8%、中等度アルツハイマー病患者の67.9%、中等度・重度アルツハイマー病患者の88.3%が、日本固有の介護支援制度であるLTCIの要介護認定を受けていた。
表 1 ベースライン時の患者の特徴
| 全体(N = 553) | 軽度のAD(N = 156) | 中程度のAD(N = 209) | 中程度に重度/重度のAD(N = 188) | p | |
| 年齢、平均(SD)、中央値[最小-最大](年) | 80.3(7.3)、81.0、[57-100] | 79.6(6.7)、80.5、[60-96] | 81.0(6.9)、82.0、[61-100] | 80.1(8.2)、81.0、[57-97] | 0.333 1 |
| 女性、n(%) | 402(72.7%) | 108(69.2%) | 156(74.6%) | 138(73.4%) | 0.502 2 |
| AD診断からの時間、平均(SD)、中央値(年) | 2.8(2.5)、2.2 | 1.8(2.1)、1.2 | 2.5(2.1)、2.2 | 3.9(2.6)、3.5 | <0.001 1 |
| 婚姻状況:既婚/同棲、n(%) | 321(58.0%) | 93(59.6%) | 117(56.0%) | 111(59.0%) | 0.207 3 |
| 患者は自宅で一人暮らし、n(%) | 75(13.6%) | 36(23.1%) | 34(16.3%) | 5(2.7%) | <0.001 2 |
| 患者は自分の家に住んでいます、n(%) | 546(98.7%) | 153(98.1%) | 207(99.0%) | 186(98.9%) | 0.931 2 |
| 教育、n(%) | 0.628 2 | ||||
| ≤12年4 | 466(84.3%) | 126(80.8%) | 178(85.2%) | 162(86.2%) | |
| > 12年5 | 87(15.7%) | 30(19.2%) | 31(14.8%) | 26(13.8%) | |
| AD治療の適応となる薬を服用している患者、n(%) | 523(94.6%) | 142(91.0%) | 202(96.7%) | 179(95.2%) | 0.066 2 |
| LTCI認定、n(%) | 392(70.9%) | 84(53.8%) | 142(67.9%) | 166(88.3%) | <0.001 2 |
パーセンテージはベースライン時の全体の母集団に基づく(すなわち、欠損データがない)。1p-値はBrown-Moodの中央値検定による。2p-値はフィッシャーの厳密検定による。3p-値は、平均の一対比較(ボンフェローニ補正を適用)による。4Primary/Junior/High School. 5職業/短大/高等専門学校/大学/大学院。アルツハイマー病、アルツハイマー病;LTCI、介護保険;Max、最大;Min、最小;N、母集団規模;n、群内数;SD、標準偏差。
表2に介護者のベースライン特性を示す。介護者の多くは女性(70.7%)であり、平均年齢は62.1歳であった。介護者は子ども(49.0%)が最も多く、次いで配偶者(37.1%)であった。同居している介護者の割合は、アルツハイマー病の重症度が高いほど増加した(67.9%[軽度]から94.1%[中等度/重度])。全体では、介護者の39.2%が単独介護者であった。介護者の約半数(47.7%)は介護以外に有給の仕事をしていた。
表 2 ベースライン時の介護者の特性
| 全体(N = 553) | 軽度のAD(N = 156) | 中程度のAD(N = 209) | 中程度に重度/重度のAD(N = 188) | p | |
| 年齢、平均(SD)、中央値、[最小-最大](年) | 62.1(12.5)、60.0 [28-93] | 61.9(13.4)、60.0 [28-90] | 62.4(12.5)、60.0 [32-93] | 62.0(11.8)、60.5 [30-89] | 0.936 1 |
| 女性、n(%) | 391(70.7%) | 113(72.4%) | 150(71.8%) | 128(68.1%) | 0.637 2 |
| 介護者と患者との関係、n(%) | 0.624 3 | ||||
| 配偶者 | 205(37.1%) | 62(39.7%) | 71(34.0%) | 72(38.3%) | |
| 兄弟 | 8(1.4%) | 4(2.6%) | 2(1.0%) | 2(1.1%) | |
| 子 | 271(49.0%) | 74(47.4%) | 105(50.2%) | 92(48.9%) | |
| その他 | 69(12.5%) | 16(10.3%) | 31(14.8%) | 22(11.7%) | |
| 患者と同居、n(%) | 436(78.8%) | 106(67.9%) | 153(73.2%) | 177(94.1%) | <0.001 2 |
| 唯一の介護者、n(%) | 217(39.2%) | 64(41.0%) | 83(39.7%) | 70(37.2%) | 0.684 3 |
| 介護者は仕事を支払った、n(%) | 264(47.7%) | 77(49.4%) | 106(50.7%) | 81(43.1%) | 0.288 2 |
割合はベースライン時の全体の母集団に基づく(すなわち、欠損データがない)。1p-値は分散分析からのものである。2p-値はフィッシャーの厳密検定による。3p-値はフィッシャーの厳密検定(モンテカルロ推定値)から。アルツハイマー病, アルツハイマー病; Max, 最大値; Min, 最小値; N, 母集団の大きさ; n, グループ内の数; SD, 標準偏差。
予想通り、患者の臨床的特徴はすべてアルツハイマー病重症度が高くなるにつれて悪化した(表3)。介護者の苦痛と負担は、軽度のアルツハイマー病患者よりも中等度/重度のアルツハイマー病患者を介護する場合の方が大きかった。生活の質(EQ-5D VASと健康指数)は、中等度/重度のアルツハイマー病患者の方が軽度/中等度のアルツハイマー病患者よりも悪化していたが、介護者には有意差はなかった。
表3 患者と介護者が報告した評価
| 全体(N = 553) | 軽度のAD(N = 156) | 中程度のAD(N = 209) | 中程度に重度/重度のAD(N = 188) | p | |
| 患者の評価 | |||||
| MMSE | |||||
| 平均(SD)中央値 | 16.4(6.1)17.0 | 22.9(1.6)22.0 | 17.8(1.7)18.0 | 9.5(4.5)11.0 | <0.001 1 |
| ADAS-Cog11平均(SD) | 22.3(6.6) | 18.3(5.8) | 25.1(5.5) | – | <0.001 2 |
| ADCS-ADL基本 | |||||
| 平均(SD)中央値 | 18.0(5.3)20.0 | 20.6(2.8)22.0 | 19.4(3.4)20.0 | 14.2(6.4)16.0 | <0.0011 |
| ADCS-ADLインストルメンタル | |||||
| 平均(SD) | 28.6(14.2) | 38.7(11.2) | 30.6(12.1) | 17.9(11.1) | <0.001 2 |
| ADCS-ADL合計 | |||||
| 平均(SD)中央値 | 46.5(18.5)49.0 | 59.4(13.1)62.0 | 50.0(14.5)52.0 | 32.0(16.5)32.0 | <0.001 1 |
| NPI-12合計 | |||||
| 平均(SD)中央値 | 12.4(12.5)8.0 | 8.8(10.9)6.0 | 11.6(13.8)7.0 | 16.2(11.3)16.0 | <0.001 1 |
| EQ-5Dインデックス(プロキシ) | |||||
| 平均(SD)中央値 | 0.73(0.19)0.77 | 0.81(0.16)0.83 | 0.78(0.16)0.80 | 0.62(0.20)0.62 | <0.001 1 |
| EQ-5D VAS(プロキシ) | |||||
| 平均(SD)中央値 | 69.6(19.1)70.0 | 74.7(15.3)80.0 | 71.2(18.2)75.0 | 63.5(21.3)60.0 | <0.001 1 |
| 介護者の評価 | |||||
| NPI-12介護者の苦痛 | |||||
| 平均(SD)中央値 | 5.6(6.6)3.0 | 4.5(6.1)2.0 | 5.3(7.3)3.0 | 6.8(6.0)5.0 | 0.001 1 |
| ZBI合計スコア | |||||
| 平均(SD) | 29.4(15.6) | 27.2(16.1) | 27.2(15.3) | 33.6(14.8) | <0.001 2 |
| EQ-5Dインデックス | |||||
| 平均(SD) | 0.90(0.12) | 0.90(0.13) | 0.90(0.13) | 0.90(0.13) | 0.921 2 |
| EQ-5D VAS | |||||
| 平均(SD) | 80.5(15.1) | 80.5(15.2) | 80.6(16.1) | 80.3(13.8) | 0.984 2 |
1 p-値はBrown-Mood中央値検定から。2 p値は分散分析によるもの。NPI-12およびEQ-5Dでは0.2%~0.7%の患者、ADAS-Cog11では11.8%の患者でデータが欠落していた。MMSE、ADCS-日常生活動作、ZBIについてはデータの欠落はなかった。アルツハイマー病、アルツハイマー病、ADCS-日常生活動作、Alzheimer’s Disease Cooperative Study Activities of Daily Living Inventory、ADAS-Cog 11,Alzheimer’s Disease Assessment Scale-Cognitive Subscale 11,EQ-5D、EuroQol-5 Dimension、MMSE、Mini-Mental State Examination、N、母集団サイズ、NPI-12,Neuropsychiatric Inventory-12,SD、標準偏差、VAS、visual analog scale、ZBI、Zarit Burden Interview。
アルツハイマー病患者の半数以上がソーシャルケアサービスを受けていた(表4)。デイケアは最も一般的に利用されているコミュニティサービスで、デイケアを利用している患者の割合はアルツハイマー病の重症度に応じて増加していた:軽度35.9%、中等度47.4%、中等度/重度62.8%(p < 0.001)。
表 4 ベースラインの前月における患者によるソーシャルサービスの利用1
| 全体(N = 553) | 軽度のAD(N = 156) | 中程度のAD(N = 209) | 中程度に重度/重度のAD(N = 188) | p 2 | |
| 患者はコミュニティサービスを受けました、n(%) | 320(57.9%) | 71(45.5%) | 115(55.0%) | 134(71.3%) | <0.001 |
| 地区看護師訪問 | 10(1.8%) | 4(2.6%) | 3(1.4%) | 3(1.6%) | 0.723 |
| ホームエイド/整然とした | 38(6.9%) | 13(8.3%) | 13(6.2%) | 12(6.4%) | 0.705 |
| 食品の配達 | 13(2.4%) | 3(1.9%) | 6(2.9%) | 4(2.1%) | 0.828 |
| デイケア | 273(49.4%) | 56(35.9%) | 99(47.4%) | 118(62.8%) | <0.001 |
| 交通 | 61(11.0%) | 15(9.6%) | 24(11.5%) | 22(11.7%) | 0.808 |
| その他3 | 22(4.0%) | 5(3.2%) | 7(3.3%) | 10(5.3%) | 0.561 |
1データはRUD(Resource Utilization in Dementia Questionnaire)質問票のデータ。割合はベースライン時の母集団全体に基づいている(すなわち、欠損データがない)。2p値はフィッシャーの厳密検定によるもの。3その他にはリハビリテーション、ボランティア・ヘルパーなどを含む。アルツハイマー病、Alzheimer’s disease、N、母集団規模、n、群内数。
介護者の総介護時間は、アルツハイマー病重症度に応じて増加し、介護時間の小分類(基本的・器材的日常生活動作、監督)も増加した(図1)。補足表2に患者と介護者の医療資源利用状況を示す。
図1 ベースライン時の日常生活動作のための介護者の時間(時間/月)
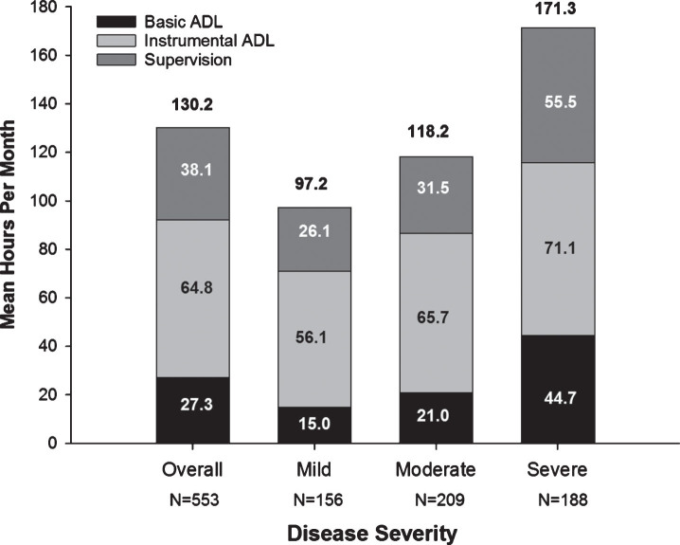
すべての値は、ベースライン訪問前の直近30日間に提供されたデータに基づいている。N値は、過去30日間に監督に時間を費やした回答者の数である。グラフの上の数値は、介護者の総時間(1カ月あたりの平均時間)である。日常生活動作、日常生活動作;重度、中等度/重度。
アルツハイマー病認知症に関連した月々の総社会的コストは、アルツハイマー病重症度に応じて増加した(図2,補足表3)。中等度/重度のアルツハイマー病患者は、軽度/中等度のアルツハイマー病患者に比べて総費用が有意に高かった、つまり、中等度/重度のアルツハイマー病のCIは軽度/中等度のアルツハイマー病のCIと重ならなかった。同様に、患者のソーシャルケア費用(患者の直接的な非医療費)と介護者のインフォーマルケア費用(介護者の間接的な非医療費)の両方がアルツハイマー病重症度に応じて増加した(補足表3)。介護者のインフォーマルケアコストは最大のコスト構成要素であり、社会的コスト全体の半分以上を占めていた(図2,補足表3)。
図2 ベースライン時のアルツハイマー病治療に伴う月々の総社会的コスト(重症度別)。
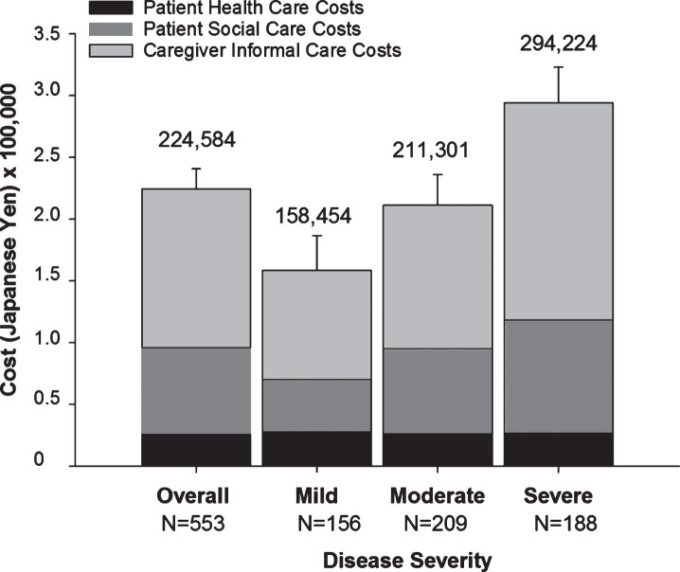
1 ヶ月あたりの平均コストを円で示している。また、グラフ上の数字は総社会的コストであり、エラーバーは総社会的コストの平均値の上限CIを示している。平均値の95%信頼区間の計算にはブートストラップ法を用いた。JPYからUSDへの換算に用いた為替レートは0.0093572(出典:https://www.bloomberg.com/quote/USDJPY:CUR; date 06-APR-2018)である。米ドルで見ると、平均的な総社会的コストは 全体では 2,101,軽度では 1,483,中等度では 1,977,重度では 2,753 であった。CI、信頼区間、JPY、日本円、N、人口規模、Severe、中等度/重度、USD、米国ドル。
GERAS-Jでは、日常生活動作トータルスコアが高い(患者の機能が向上している)患者の年齢が高い、介護者の数が多い、既婚/同居で一人暮らしではない、ということが、社会的総コストの低下と関連する独立因子となっていた。アルツハイマー病診断からの時間の増加、LTCI認定、ZBIスコアの増加(介護者の負担の増加)は、より高いコストと関連していた(表5)。
表5 ベースライン時の月別総社会的コストに関連する要因
| 因子 | 見積もり(95%CL) | 総社会的費用LS平均(95%CI) | p |
| 患者の要因 | |||
| MMSEの重症度 | 0.1222 | ||
| 軽度 | –0.0717(–0.2717; 0.1284) | 172,750(150,014; 198,933) | 0.4826 |
| 中程度 | 0.0903(–0.0762; 0.2568) | 203,124(179,564; 229,775) | 0.2878 |
| 中程度に重度/重度* | 185,583(159,325; 216,168) | ||
| 年齢 | –0.0129(–0.0223; –0.0036) | 0.0066 | |
| 性別 | 0.6070 | ||
| 女性 | –0.0386(–0.1855; 0.1084) | 183,175(167,465; 200,358) | |
| 男性* | 190,376(164,783; 219,945) | ||
| ADCS-ADL合計スコア | –0.0129(–0.0178; –0.0079) | <0.0001 | |
| 生活の手配 | <0.0001 | ||
| 一人暮らし | 0.1104(–0.1027; 0.3234) | 222,628(182,819; 271,106) | 0.3100 |
| 一人暮らしではなく結婚 | –0.3066(–0.4618; –0.1515) | 146,718(134,252; 160,341) | 0.0001 |
| 一人暮らしではなく、結婚していない* | 199,368(174,044; 228,376) | ||
| AD診断からの時間 | 0.0307(0.0023; 0.0591) | 0.0341 | |
| LTCI認定 | <0.0001 | ||
| 番号 | –0.5607(–0.7212; –0.4003) | 141,084(121,725; 163,522) | |
| はい* | 247,173(224,594; 272,021) | ||
| 介護者の要因 | |||
| 関与した他の介護者の数 | –0.1324(–0.1971; –0.0678) | <0.0001 | |
| ZBI合計スコア | 0.0150(0.0103; 0.0196) | <0.0001 |
ガンマ分布と対数リンク関数を用いて一般化線形モデルを使用した。除外基準:共変量に対するWard Statisticのp値>0.05。母集団の患者数=553人。使用した患者数=553人。太字のP値は有意である。連続共変量が欠落している場合は,母集団の中央値が入力された。カテゴリー共変量が欠落している場合は,母集団のモードが推定された。MMSE、患者年齢、および患者の性別はすべて最終モデルに強制的に組み込まれた。モデル統計量。R2DEVは0.359であった。*推定値の参照カテゴリ。アルツハイマー病、アルツハイマー病、ADCS-日常生活動作、Alzheimer’s Disease Co-operative Study activities of daily living、CI、信頼区間、CL、信頼限界、LS、最小二乗、LTCI、長期介護保険、MMSE、Mini-Mental State Examination、ZBI、Zarit Burden Interview。
考察
ここでは、日本の地域住民のアルツハイマー病認知症患者のケアに関連するベースラインの人口統計学と実費を報告する。本報告は、日本におけるアルツハイマー病認知症の認知症患者とその介護者の社会経済的負担を評価した初のプロスペクティブな観察報告である。社会経済的負担は、重症度が高くなるにつれて、月額158,454円(1,483米ドル)から294,224円(2,753米ドル)に増加した。インフォーマルな介護者の費用は、社会全体の費用の半分以上を占める最大の費用構成要素であった。
ここで示された主要な結果は、GERAS-I(英国、フランス、ドイツ)[20]およびGERAS-II(スペイン)[22]のベースライン結果と一致している。GERAS-Jにおけるアルツハイマー病に関連する総社会的コストはアルツハイマー病の重症度が上がるにつれて上昇し、軽度のアルツハイマー病患者よりも中等度/重症の患者の方が約1.9倍高かった。この傾向は、アルツハイマー病重症度の定義に用いられた方法や研究が実施された国に関係なく、アルツハイマー病重症度とコストを調査した過去の報告と一致している[35-39]。GERAS-Jでは、患者の直接医療費はアルツハイマー病重症度群に関わらず比較的一定であり、GERAS-I [20]やGERAS-II(スペイン)[22]と一致している。
多変量解析の結果、日本とEU諸国では、社会全体のコストに関連する独立因子のパターンが共通していることが示された。患者の機能向上(日常生活動作スコアの高さ)はGERAS-Iと同様にコストの低下と関連する重要な独立因子の一つであった[40]。また、患者の生活環境や介護者の負担もGERAS-J、GERAS-Iともに総コストに関連する独立因子であることが示された[40]。日本特有の独立した要因としては、患者の日常生活動作の悪化と介護の必要性を反映したLTCI認定が挙げられる。認知機能障害と機能障害の間には強い関連性があり[41]、日常生活動作は社会的コストと有意な関係があった。
診断からの時間もまた、総費用と有意に関連する日本固有の因子として同定された。この変数はEU/ドイツ/フランス[40]やスウェーデン[37]の先行研究で社会的コストとの関連性を評価したが、いずれの研究でも有意な因子として同定されなかった。日本では、認知症ケアパスウェイに複数のアクセスポイントがあることや、診断からの時間が長い患者の介護者の方が医療や社会的ケアを求めた経験が多いことから、診断からの時間という変数が有意であったのかもしれない[42]。長期間の介護は負担が大きく、インフォーマルな介護者は外部の社会的支援を求める傾向が強い。
GERAS-J、GERAS-I、GERAS-IIでは、インフォーマルな介護費用(介護者の時間、介護者が仕事を休むことに関連した費用)が社会全体の費用の最大の要因であった[20-22]。GERAS-Jでは、軽度、中等度、中等度/重度のアルツハイマー病患者において、介護者のインフォーマルケア費用はそれぞれ56%、55%、60%を占めていた。これは、国によってはインフォーマルコストが社会全体の約50%~60%を占めていたGERAS-Iの結果と一致している[20]。インフォーマルケアの費用の要因は、支払者、コミュニティの資源、社会的・家族的支援システムに依存しており、国ごとに異なる可能性がある。例えば、GERAS-Jでは、軽度、中等度、中等度/重度のアルツハイマー病患者の53.8%、67.9%、88.3%がLTCIの認定を受けていた。LTCI認定の増加はアルツハイマー病の重症度と関連しており、疾患の進行に応じた適切なソーシャルケア支援の必要性が高まることを示唆しており、家族の負担を軽減し、患者が地域での生活を維持することができた。介護者に経済的・社会的な救済を与えるためには、国ごとにこれらの要因を理解することが重要である[20]。
GERAS-Jでは、介護者の総時間(基本的日常生活動作、器材的日常生活動作、危険な出来事を防ぐための監督)は、月当たり97.2時間(軽度アルツハイマー病)から171.3時間(中等度/重度アルツハイマー病)であり、器材的日常生活動作が最大の構成要素であった。器質的日常生活動作は文化特異的である可能性があるため [43]、国間比較を行うことは困難である。しかし、軽度のアルツハイマー病患者の介護に費やされた平均総時間は週24.3時間であったのに対し、中等度/重度のアルツハイマー病患者の介護に費やされた時間は週43時間であり、それぞれパートタイムとフルタイムの有給雇用に相当し、介護者は無給であることに注意することが重要である。介護者の多くが配偶者(65.9%)であったGERAS-I [20]とは対照的に、GERAS-Jでは介護者の多くが成人の子供であり、次いで配偶者(子供49.0%、配偶者37.1%)であった。これは、GERAS-I(72%)に比べてGERAS-Jでは既婚者または同居者(59%)が少なかったためと考えられる。さらに、GERAS-Jのアルツハイマー病患者の38%は寡婦であり、未婚は0.9%であった。配偶者がいないために、成人した子供がひとり親の介護のために家庭に入ってくる必要があるのかもしれない。GERAS-Iの分析では、配偶者以外の介護者と同居している未婚の患者の方が、一人暮らしや既婚で配偶者/非配偶者の介護者と同居している患者よりも費用が高かった[40]。
GERAS-Jでは、インフォーマルな介護者が患者の配偶者である頻度はGERAS-Iに比べて低かったが、インフォーマルケア費用の割合は両研究間でほぼ同じであった。GERAS-JとGERAS-Iのインフォーマルケア費用の分析は、基本的な日常生活動作と手段的日常生活動作のアクティブな介護時間から計算された。患者と同居している介護者の割合はGERAS-J(78.8%)とGERAS-I(76.0%)で同程度であり、日常生活動作タイプのケアを提供する平均時間に差はなかった。このため、インフォーマルケアにかかる費用は両研究間で同程度であった。介護者の平均年齢はGERAS-Jの62.1±12.5歳(範囲28-93歳)がGERAS-Iの67.3±12.03歳よりも低く[20]、GERAS-Jの介護者の多くはまだ現役世代であることが示唆された。実際、GERAS-Jの介護者の47.7%が少なくとも何らかの有給の仕事をしていたのに対し、GERAS-Iの介護者では23.8%しか有給の仕事をしていなかった[20]。
患者と同居している成人の子供の介護者が働くことができないことがコストの原因になっている可能性がある。このように、日本では成人した子供の介護により生産性の低下を引き起こす可能性がある。
GERAS-Jではデイケアが最も人気のあるソーシャルサービスであったのに対し、GERAS-Iではホームエイド/オーダリーが最も多く利用されていた[20]。日本ではほぼ50%の患者がデイケアを利用していた。デイケアの利用は介護に費やす時間を減らし、介護者が有給の仕事や余暇に従事できるようにしたのではないかと考えられる。しかし、デイケアなどのコミュニティ資源が利用できるにもかかわらず、介護者のストレスと負担はGERAS-Jではアルツハイマー病の重症度に応じて増加した。このように、現在の日本のコミュニティリソースでは、介護者の負担の原因に完全に対処することはできない。
GERAS-Jでは、94.6%の患者さんがアルツハイマー病治療薬を服用していた。現在、アルツハイマー病治療薬の有効性は認知と日常生活機能で評価されている[44, 45]。軽度のアルツハイマー病患者の地域居住者の衰えを遅らせる新しい薬剤の開発は、介護者の時間を短縮することでコスト削減につながる可能性がある[46]。進行したアルツハイマー病患者は介護施設での長期ケアを必要とすることがあるため、病気の進行を遅らせることで、患者がより長く自宅で生活できるようになるなど、他の経済的な利点があるかもしれない。進行の遅延と社会経済的負担の観点からの新しいアルツハイマー病治療法の評価は、これらの治療法が支払者に受け入れられるために重要になる可能性が高く[20]、本研究で収集したデータは、新しい治療法の長期的な影響を推定するのに役立つ可能性がある。
この研究にはいくつかの制限がある。この研究はメモリークリニックを利用している地域住民のコホートであり、非公式で献身的な一次介護者がいるため、GERAS-Jの集団は地域住民でプライマリケア医を訪問するアルツハイマー病患者を完全に代表するものではないかもしれない。MMSEは重症度別に費用を層別化するために用いられたが、他の研究ではアルツハイマー病重症度別のカットオフ値が用いられている[36]。本研究では、GERAS-IおよびNICEのカテゴリーが使用された。したがって、これらのMMSEグループ化を用いた研究を、異なるMMSEカットオフを用いた研究に外挿することは難しいかもしれない。この研究では、入所型介護施設から家族介護者へのケアの移行が社会経済的に与える影響については検討していない。最後に、費用と時間の情報は回答者の記憶に基づいたものであり、正確ではないかもしれない。
GERAS-Jの強みは、アルツハイマー病認知症の全領域の患者を対象としていることであり、アルツハイマー病認知症の後期段階での更なる悪化とその後の入所介護の必要性との関連性についての仮定を提供することになる。GERAS-Jは、アルツハイマー病患者のケアにかかる費用と負担を理解するための既存のエビデンスに加え、地域に住むアルツハイマー病患者の社会経済的課題に関する政策決定に必要な重要な情報を提供している。GERAS-Jのデータは、日本におけるアルツハイマー病認知症が患者や介護者の負担や社会的コストに与える影響についての理解を深めるものである。ベースライン解析で得られた横断的なデータは、疾患の重症度ステージ間の違いや潜在的なケアの必要性を理解する上で重要である。
結論として、ベースラインでは、アルツハイマー病の重症度に応じて社会的コストが増加していた。インフォーマルケア費用は社会的コストの最大の構成要素であった。
