Contents
Coronavirus Disease 2019 in Children
www.ncbi.nlm.nih.gov/pmc/articles/PMC8193095/
オンラインでは2021年5月28日に公開
概要
2019年12月中旬に武漢で出現して以来、急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)コロナウイルス19(COVID-19)が世界中で劇的に広がっている。すぐに明らかになったのは、小児のCOVID-19の発生率は成人のものよりもはるかに低いということである。小児の罹患率は、臨床症状や経過が多様であることが特徴である。
症状は他の急性呼吸器ウイルス感染症と似ており、上気道が下気道よりも影響を受けやすいのが特徴である。これまでのところ、ウイルスに陽性反応を示した子どもの90%以上が、軽度または中等度の症状・徴候を示している。
ほとんどの子どもたちは無症状で、成人とは異なり重症化するケースはわずかであった。死亡例はまれで、主に基礎疾患のある子供たちに発生している。小児のCOVID-19に対する相対的な抵抗性には、アンジオテンシン変換酵素受容体の発現低下、インターフェロン関連の自然免疫反応の活性化の増加、および訓練された免疫などの要因が関与していると考えられているが、根本的な病因および作用機序はまだ確立されていない。
パンデミック発生時には、小児では軽度の呼吸器症状が最も多く報告されていたが、その後の報告では、COVID-19の臨床経過は当初考えられていたよりも複雑であることが示唆されている。成人で得られた経験のおかげで、小児のSARS-CoV-2感染症の診断は時間とともに向上している。
小児の治療に関するデータは少ないが、いくつかの抗ウイルス試験が進行中である。このナラティブ・レビューの目的は,小児のSARS-CoV-2感染症に関する現在の理解をまとめ,医療従事者により正確な情報を提供し,患者のケアを向上させることである。
キーワード
COVID-19, 新型コロナウイルス, SARS-CoV-2, 小児, 青年, 胸部画像, 薬剤, 療法
はじめに
急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)は、21世紀最初の世界的なパンデミックであると言われている。子どもは大人に比べてはるかに感染頻度が低く、症状も重くないことがすぐに明らかになった(1-3)。しかし、後になって、小児や青年でも重篤な臨床症状を呈し、好ましくない転帰を辿ることもあることが判明した(1)。実際、感染が拡大している米国では、多くの子どもたちが急性期または重症の病院治療を必要としている(4)。このナラティブ・レビューでは,小児の19型コロナウイルス感染症(COVID-19)の疫学,臨床症状,転帰,検査および胸部画像の特徴を明らかにしている。また、一般的に小児のコロナウイルス感染症の発症リスクが成人に比べてはるかに低い理由も明らかにしている。最後に、COVID-19を持つ小児の治療について、急速に増加しているデータをレビューする。
疫学
本稿執筆時点で入手可能なWHOのデータによると、COVID-19の累積症例報告数は1億件弱であり、パンデミックの開始以来、世界全体で200万人以上が死亡している(5)。アメリカ大陸、ヨーロッパ、東南アジアなどの一部の地域では、この病気の有病率は依然として非常に高く、アフリカ、西太平洋、オーストラリア、ニュージーランドではかなり低くなっている(5)。
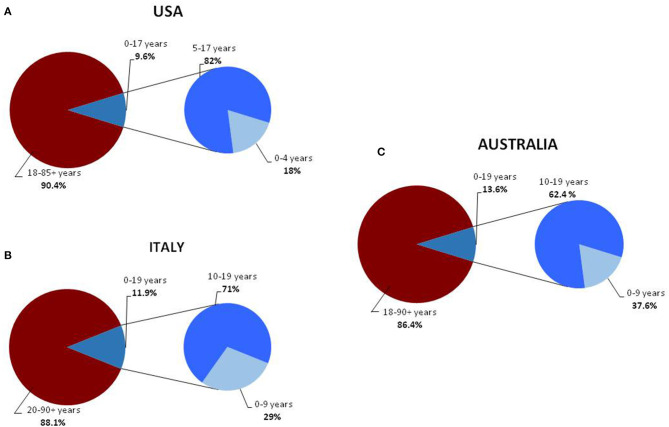
COVID-19の小児症例は、今回のパンデミックの初期に発生した。最初の小児症例は 2020年1月20日に報告されたもので、家族で武漢市を訪れていた中国・深圳の10歳の少年であった(6)。その直後に 2020年1月7日から 15日の間に発生した呼吸器症状のために入院した小児におけるSARS-CoV-2感染症の主な臨床症状をまとめたレトロスペクティブ研究が行われた(7)。2020年1月から 11月にかけて、世界各地で新たな小児の症例が記録された(8~17)(表1)。当初、小児の感染率は成人に比べて低かった。感染の連鎖を断ち切るには、検疫や感染対策などの持続的な社会的介入が有効である(18,19)。実際、厳格な強制検疫と感染対策により 2020年3月には小児のCOVID-19感染者の増加に歯止めがかかった(1)。注目すべきは、制限措置が実施されていない国や、短期間しか採用されていない国では、感染の拡大が抑えられていないことである。米国や欧州では 2020年9月から 10月にかけて症例報告率が急速に上昇し、小児症例の数がパンデミック開始時よりも多くなった(20,21)(表1)。小児症例の割合が高くなったのは、COVID-19の小児における有病率が当初は過小評価されていたためと考えられる。実際、大パンデミックの初期段階では、小児は症状がないか、入院を必要としない軽度の症状しかないため、ウイルス検査を受けることはほとんどなかった。検査の実施率が高いオーストラリアでは、確認された総症例数が少ない中で小児の症例が占める割合は、米国やヨーロッパの割合と同様である(20)。米国、イタリア、オーストラリアでは、小児や青年の症例が大幅に増加しているにもかかわらず、小児の症例の割合は成人の症例の割合を大きく下回っている(14,20,21)(図1)。世界各地のデータによると、COVID-19の小児症例の年齢中央値は5~7歳であるが、米国の感染年齢中央値は11歳であり、10~19歳の症例が0~9歳の症例よりも多く、男性が軽度に優勢であることが示されている(1,2,21)。
表1 2020年1月から 11月までの世界における小児COVID-19の有病率
| 1月 | 2月 | 行進 | 4月 | 11月 | |
|---|---|---|---|---|---|
| 中国 | 報告された最初の小児症例(6) | – | – | – | |
| 0.6%(8) | 2.4%(9)-3.4%(10) | ||||
| ヨーロッパ | – | 報告された小児症例は3例のみ(11) | – | 3.6%(12) イタリアでは1.9%(15) |
– イタリアでは11.7%(16) |
| アメリカ合衆国 | – | – | First pediatric case reported (2) | 1.7%(2) | 9.6%(14) |
| オーストラリア | – | – | – | 4%(13) | 13.6%(17) |
図1 米国(A)(14)、イタリア(B)(16)、オーストラリア(C)の一般人口および小児人口を年齢層別に分けたCOVID-19症例の分布(17)。

子供や青年の感染源としては、親や兄弟が最も多く、次いで家族以外の人や未知の対象との接触が挙げられる(25)。COVID-19を発症した40名の小児を対象とした研究では、症状が発症したのは成人の家庭内接触者が感染した後、あるいはそれと同時に発症しており、小児が感染源ではない可能性が示唆されている(26)。さらに、子供、特に学童期の子供は、大人に比べて感染しにくく(27)、SARS-CoV-2の感染源となる頻度も低いという証拠が増えてきている(28)。SARS-CoV-2は、まれではあるが、感染した母親からその乳児に垂直感染することがある(29)。SARS-CoV-2に感染した母親から生まれた新生児91人中3人(約3%)のみが、出生時の血清中のウイルスに対するIgMの上昇を示した(29)。
SARS-CoV-2は胎盤を介して感染するため、羊水、母乳、臍帯血、新生児の咽頭拭い液から、定量的なリアルタイムの逆転写ポリメラーゼ連鎖反応(RT-PCR)で検出することができる(30,31)。新生児は出生直後にSARS-CoV-2が陽性となることがあるが(32)、鼻咽頭ぬぐい液は数日で陰性となる(33)。したがって、上気道からウイルスRNAを分離しても、垂直感染のケースを特定するには、気道に直接感染したケースを特定するよりも信頼性が低い可能性が考えられる。感染初日に便検体を連続して検査することで、全体の診断収率が向上する可能性がある。したがって、妊娠中の女性はCOVID-19のスクリーニングを受け、厳格な感染管理を行うべきである。感染した母親は隔離され、COVIDのリスクがある新生児は注意深くモニタリングされるべきである(34)。
小児におけるSARS-CoV-2感染の病因と考えられる防御機構
歴史的には、SARS-CoVと中東呼吸器症候群(MERS)ウイルスが、それぞれ2003年と2012年の大パンデミックを引き起こした(35)。SARS-CoVとSARS-CoV-2はともに、レニン・アンジオテンシン系(RAS)の一部であるアンジオテンシン変換酵素2(ACE2)に結合する(36)。RASの活性化は、腎糸球体装置でレニンが産生されることから始まる。レニンはアンジオテンシノーゲンをアンジオテンシン1に変換し、アンジオテンシン変換酵素(ACE)によって活性型のアンジオテンシンIIに変換される(37, 38)。
ACE2は、いくつかの血管作動性抗炎症ペプチドの放出を促進する(39)。SARS-CoVおよびSARS-CoV-2が、ウイルスのスパイク(S)タンパク質を介して、心臓、腸、腎臓、内皮細胞およびII型肺胞宿主細胞に侵入する際に使用する機能的受容体である(40)。Sタンパク質が細胞膜に結合して宿主細胞に侵入するためには、プロテアーゼによる切断が必要である。SARS-CoV-2のSタンパク質を切断できる宿主プロテアーゼには、膜貫通型プロテアーゼであるセリンプロテアーゼ-2(TMPRSS2)やカテプシンLプロテアーゼなどがある。TMPRSS2は、SARS-CoV-2に感染した宿主へのウイルスの侵入と拡散に不可欠である(41)。その後、ACE2受容体に結合したSARS-CoV-2ウイルスがエンドサイトーシスすると、細胞表面に発現しているACE2分子が減少する(39)。したがって、SARS-CoV-2は、ACE2を介した代謝経路の活性を制限し、その結果、肺や心筋における炎症の発生を促進する(42, 43)。SARS-CoVおよびSARS-CoV-2感染によって誘発される急性呼吸窮迫症候群(ARDS)の動物モデルでは、ACE2のダウンレギュレーションによってACE/ACE2活性のバランスが崩れ、その結果、アンジオテンシンIIが蓄積され、炎症反応が亢進することが示された(44)。
COVID-19の罹患率や死亡率は、主に成人の人口に影響を及す。小児は成人に比べて症状が軽いのであるが、なぜそうなのかはまだわかっていない。妥当な説としては、ACE2が炎症を抑えるため、肺のACE2活性の低下が肺の炎症につながるのではないか(42)、また、ACE2とTMPRSS2の肺での発現が年齢とともに徐々に増加するため(45)、SARS-CoV-2が子供の気道細胞に入り込んで複製するのが難しくなるのではないか、というものがある。注目すべきは 2003年のSARSパンデミックでは、感染した成人の致死率は高かったが、12歳以下の小児の致死率は低かったことであり、このことの最も妥当な説明は、小児や青年がSARS-CoVに対して相対的な抵抗力を持っているということである(46)。さらに、SARS-CoVとSARS-CoV-2がおそらく同じメカニズムで宿主細胞に侵入するという事実は、小児のCOVID-19が成人型よりも重症度が低い理由を説明できるかもしれない。MERSウイルスはSARS-CoVやSARS-CoV-2とは別の方法で宿主細胞に侵入することが実証されているが、MERSに罹患したほとんどの小児は無症状か、風邪のような症状しかなかった(47, 48)。しかし、動物モデルとは対照的に、ARDSを発症した新生児、小児、成人のBALにおけるACEおよびACE2の発現には有意な差が認められず、このことは、ヒトの肺RASの変化に年齢が関係していないことを示している(49)。最後に、最近、ウイルス侵入関連遺伝子(ACE2やTMPRSS2を含む)の発現レベルが、小児集団における症状の軽さに寄与している可能性が否定された(50)。この結果は、ACEとTMPRSS2の発現が小児のCOVID-19に役割を果たしているという概念に疑問を投げかけている(51)。
小児の症状が軽いのは、成人と小児の免疫系の違いを反映している可能性もある。実際、小児は、”訓練された免疫 “と呼ばれる非常に効果的な感染防御機構を発達させる。訓練された免疫とは,義務的な予防接種やBCG(Bacillus Calmette-Guérin)ワクチンの接種,あるいは頻繁なウイルス性呼吸器感染によって自然免疫細胞が長期的にエピジェネティックに再プログラムされることであり,これがSARS-CoV-2に対する子どもの防御に役立つ可能性がある(52)。しかし、訓練された免疫が、最も一般的な病原体から保護するとはいえ、永久的な免疫記憶をもたらすかどうかは不明である(53)。出生時のBCGによる訓練された免疫が、子供のCOVID-19の経過が大人よりも軽い理由を説明できるとは思えない。なぜなら、多くの国では国のスケジュールにこのワクチンが含まれておらず、新生児のCOVID-19は世界的に見ても軽いからである。
小児のウイルス感染に対する初期免疫反応は、成人に比べてインターフェロン(IFN)関連の自然免疫反応の活性化率が高く、Th1細胞やナチュラルキラー細胞のレベルが高いという特徴がある(54)。実際、SARS-CoV-2は、高齢者ではすでに低下しているIFNシグナルのタイプに拮抗するため、成人のウイルス感染初期にはウイルスの急速な複製が進行する(55)。SARS-CoV-2感染時には、I型IFNシグナルのダウンレギュレーションにより、Th1反応が低下するとともに、Th2および適応免疫反応が亢進する可能性があり、これらはすべて、成人COVID-19の後期合併症の発症に中心的な役割を果たしている(56)。重症のCOVID-19の成人では、「サイトカイン・ストーム」を構成する炎症性のインターロイキン(IL)-2,IL-6,IL-7,IL-10,腫瘍壊死因子-αのレベルが上昇している(55)。実際、免疫抑制療法を受けている肝移植児は、炎症性サイトカインの産生が少なく、適応免疫の活性化が抑えられており、SARS-CoV-2に感染しているにもかかわらず、重篤な肺疾患のリスクは高まっていない(57)。また、Th2好酸球とそれに伴うIL-13,IL-5,IL-4の分泌過多は、SARS-CoV-2の感染を防御する。ACE2とTMPRSS2の発現を制御する遺伝的・生物学的な調節機構を調べたところ、IL-3を介してTh2炎症がTMPRSS2を含むネットワークをアップレギュレートし、気道におけるACE2の発現を低下させる一方で、呼吸器ウイルスに対する1型IFN反応がACE2の発現を増加させることがわかった(58)。アトピー性喘息の子どもや青年、あるいは単にアトピーの人に非常によく見られる症状である好酸球増加症を持っていることは、SARS-CoV-2の予後不良のリスクを高めるものではないようだ。しかし、現在のデータは限られており、疑問は残っている。
また、子どもへの義務的な予防接種は、SARS-CoV-2を含む他の呼吸器系病原体に対する免疫反応を高めることで、相互保護をもたらしていると推測される。実際 2007年に行われた様々なワクチンを接種したマウスの研究では、SARS-CoV-2に対する交差反応は見られず(59)、SARS-CoV-2についても同様の可能性があるが、これについてはまだ確立されていない。ヒトコロナウイルスに感染した子どものほとんどは、幼少期に同じようによく見られる他の呼吸器ウイルスに対して防御的な免疫反応を起こしている(60)。一般的なコロナウイルスとSARS-CoV-2は、例えばウイルスのSタンパク質を共有するなど、構造的な類似性があり、その結果、コロナウイルスに対する適応免疫反応がSARS-CoV-2に対する防御となるのではないかと推測されている(61)。したがって、小児の気道感染症の再発率の高さと、強制的な予防接種の非特異的な効果とが相まって、SARS-CoV-2に対しても防御することができるかもしれない(62)。これに関連して、最近の研究では、SARS-CoV-2に対する既存のT細胞介在性交差反応は、ヒトコロナウイルスへの過去の暴露だけでは説明できないことが示唆されており、交差反応が感染感受性の低下に役立ち、その結果、小児の感染症が成人よりも重症化しにくくなるという概念に疑問を投げかけている(63)。他に考えられる防御機構としては、凝固系のタンパク質濃度の加齢による変化による内皮障害の違いが挙げられる。さらに、年齢に応じて止血系に量的、ほぼ確実に質的な違いが生じ、これらの違いはおそらく小児の血栓塞栓症の疫学に大きな影響を与えていると思われる(64)。これらの違いは、SARS-CoV-2に感染した新生児や小児における血栓塞栓症や出血性イベントのリスクを減少させるのに役立つかもしれない。最後に、子ども、特に幼児は、高齢者に比べて気道が健康であると考えられている。これは、子どもは屋外で過ごす時間が短く、通常、海外旅行に出かけることも少なく、大人ほどタバコの煙や汚染にさらされておらず、基礎疾患も少ないためであるが、これらはすべて、重度のCOVID-19のリスクを低減するのに役立つと考えられる(65)。
結論として、小児の重症度の低いCOVID-19の病態には複数の要因が関与している(図2)。有力な仮説を確認することは難しく、死後の病理組織学的変化のみが、小児のCOVID-19の病因についての洞察を与えるかもしれない(56)。
図2 SARS-CoV-2感染に対する小児集団の考えられる防御機構

小児COVID-19の臨床的特徴
当初、小児COVID-19に関するデータは、ほとんどの小児が軽症か無症状で、成人に比べて重症患者や死亡者が少なかったことから、安心できるものであった(1,66,67)。最近のデータでは、非常に大規模なサンプルから収集され、COVID-19と診断された小児の予後は良好であることが確認されたが、この所見を検証し、最終的にはなぜ一部の患者が重度の炎症や多臓器不全を発症するのかを説明するためには、縦断的な研究が必要である(68-70)。図3は、小児におけるCOVID-19の臨床症状をまとめたものである。
図3 SARS-CoV-2感染の小児集団における主な症状と臓器・器官の関与

平均3日から7日(範囲は1日から 14日)の潜伏期間を経て、小児は症状を発症することもあれば、発症しないこともある(21)。子どもに臨床症状が現れない割合は、4.4%(1)から 14~19.3%(69,70)さらには39%(22)とさまざまな割合で報告されている。これらの違いは、研究集団の登録基準の違いを反映していると考えられる。中国からの最初の報告では、主に臨床症状の存在のみでCOVID-19と診断された子供たちが対象となっていた(1)。イタリアの最近のデータでは、小児や青年の間では、無症状の症例の割合が高い(2~6歳の年齢層では75%程度)とされている(15)。この割合は 2020年9月、10月、11月にイタリアで行われたスクリーニングや接触者追跡のための検査を受けた被験者の数が多かったことで説明できるかもしれない。
症状が出ると、通常39℃以下の発熱(53~59%)と咳(48~56%)が臨床シナリオの大半を占める(69~71)。その他、頻度は低いが、上気道症状や下気道症状が見られることもある(69-74)(表2)。呼吸困難は、特に急性呼吸窮迫症候群(ARDS)など、本疾患の最も重篤な症状の発現と密接に関連している(72)。症例の25%までは、消化器症状、すなわち、吐き気、嘔吐、下痢を発症し、その結果、水分や固形物の摂取量が減少することがある(69,70)。その他の症状としては、疲労感や筋肉痛、頭痛やめまい、基礎となる発作性疾患がない場合の発作、皮疹などがある(69,70,73,74)。COVID-19の子どもたちでは、症状や兆候が単独で現れることはほとんどない(21,75,76)。実際、発熱は咳や下痢、上気道感染症(URTI)と関連していることが多いである(73)(表2)。
表2 SARS-CoV-2 に感染した小児の臨床的特徴
| 兆候と症状 | ケースのパーセンテージ(%) |
|---|---|
| 熱 | 53から59パーセント(69、70) |
| 咳 | 48から56パーセント(69、70) |
| 倦怠感、筋肉痛 | 7.6%(71)-18.7%(70) |
| 胸痛 | 2.4%(74) |
| 上気道 | |
| 喉の痛み | 18.2%(70) |
| 鼻づまりと鼻水 | 10〜20%(70) |
| 咽頭紅斑 | 3.3%(70) |
| 下気道 | |
| 呼吸困難; 呼吸困難 | 9.5%(74)-11.7%(70) |
| 胃腸系 | |
| 吐き気 | 5.4%(70) |
| 嘔吐 | 5.4%(70、74)-6.4%(71) |
| 下痢 | 6.5%(70)-13.1%(74) |
| 腹痛 | 6.5%(70) |
| 経口摂取量の減少 | 1.7%(70) |
| 中枢神経系 | |
| 頭痛; めまい | 4.3%(70) |
| 発作 | |
| 非熱性 | 1.8%(74) |
| 発熱 | 1.2%(74) |
| 肌 | |
| 発疹 | 0.25%(70) |
| プレゼンテーション時の同時症状/徴候 | |
| 発熱と咳 | 8%(73) |
| 発熱と下痢 | 6.4%(73) |
| 発熱、咳、嘔吐 | 2.4%(73) |
| 発熱と鼻の症状 | 2.4%(73) |
| 発熱、鼻の症状、咳 | 2.4%(73) |
| 発熱、咽頭炎、咳 | 1.6%(73) |
| 発熱、咽頭炎、および下痢 | 1.6%(73) |
SARS-CoV-2 に軽度に感染し、通常は発熱、咳、および/または尿路感染による疲労を呈する小児において、肺炎は報告されていない(22, 77)。COVID-19 の中等度および重度の症例では、肺炎は複数の関連症状、すなわち、発熱、咳、筋肉痛、呼吸困難の兆候、チアノーゼ、神経学的な兆候や症状、摂食障害、脱水や低酸素血症の兆候などを伴うことがある(77)。また、発症時に下気道感染の兆候や症状が見られたのは、25%の子どもたちであった(21)。COVID-19肺炎の診断には、臨床所見や検査所見に加えて、画像による特徴を評価することが重要だ。呼吸不全を伴う重篤な疾患の基準を満たす、重度で持続性のある症状や徴候を持つ小児に対しては、集中治療を考慮する必要がある(78)。COVID-19に罹患した小児にARDSが発生することはほとんどない(5~8%)(21, 74)。小児ARDSは、重度の低酸素血症の症状と、既知の臨床的傷害から数日以内に発生するX線写真の変化を特徴とする急性呼吸不全である(79)。その他の急性重症・重篤な疾患像としては、ショック、脳症、心筋梗塞、心不全に加え、凝固機能障害、急性腎障害などがある(22, 72)。臓器の機能障害は、生命を脅かす重大な問題となる(1)。
COVID-19の子どもたちのほとんどは、何の問題もなく経過する。しかし、急性SARS-CoV-2感染後2-6週間以内に、川崎病(KD)や毒素性ショック症候群に似た炎症シナリオが確認されており、現在ではCOVID-19関連小児多系統炎症症候群(MIS-C)と呼ばれている(80)。MIS-CはCOVID-19感染後のまれな合併症である(発生率0.14%)(70)。症状・徴候としては、止まらない高熱、腹痛、嘔吐、下痢、発疹、結膜炎、粘膜皮膚疾患、低血圧などがあり、集中治療室(ICU)への入院を必要とするケースはごくわずかである。当初は非典型的なKDと考えられてたが(81-83)、古典的なKDではほとんど見られないショック、消化器症状、凝固障害がこのユニークな症候群の顕著な特徴であり、フェリチン、D-ダイマー、トロポニン、プロカルシトニン(PCT)、C反応性タンパク(CRP)の上昇と頻繁に関連していることが後に明らかになった(84, 85)。さらに、冠動脈の異常と心室機能障害が心臓画像で明らかになった(86)。MIS-Cに関する今後の研究では、生命を脅かす可能性のあるこの疾患を発症するための有用な予測因子を明らかにするために、COVID-19の主要な徴候や症状とMIS-Cの発症率や症状との相関関係を調べる必要がある。
入院や集中治療を必要とする重症・重篤な小児はめったにいません(1, 55, 67)。実際、ほとんどの小児科の研究では、入院やICUでの観察または治療の発生率は低いと報告されている(70,73)。イタリアでは、COVID-19に感染した小児患者3,836人のうち、入院したのは511人(入院率13%)で、そのうち18人(3.5%)がICUに入院した(22)。他の研究では、より高い入院率(最大68%)とICU入室率(8~19.5%)が報告されている(21,69,70,76,87)。これは、コロナウイルス検査の対象者の違いを反映しているのではないかと推測される。実際、多くの国では、入院中の小児、COVID-19の症状や兆候がある小児、重症または合併症のリスクが高いと考えられる小児に優先的に検査を実施している。この方法では、入院やICUでの治療が必要な子どもの割合が過大評価されている可能性がある。その他の理由としては、医師の間でCOVID-19の子供が重症である可能性に対する認識が高まり、観察的予防手段として入院を利用するようになったことが挙げられる。重要なことは、思春期、新生児、乳幼児、就学前児童では、病気の重症化のリスクが高いことが報告されていることである。このことは、COVID-19の重症度の年齢分布を説明するのが難しいことを示唆している(1,21,22,72,74)。
小児集団において、より重症または重篤な状態を示すICU入室に関連する要因は、男性(約60%)既往症(36~50%)であり、そのうち免疫抑制、呼吸器、心血管 免疫抑制、呼吸器系、心血管系、腫瘍系の疾患が大部分(65%)を占め、発症時に下気道感染の兆候や症状があった場合(73%)ウイルス感染があった場合(15%)肺炎やARDSを示唆する放射線的変化があった場合(24~30%)がある(21,22,70,72~74,88)。ニューヨークのある青少年コホートでは、ICUに入院した患者の30%にARDSが発生し、そのうち85.6%という高い割合で侵襲的人工呼吸が必要とされた(72)。実際、幼い子供であっても、ARDSの場合には侵襲的な人工呼吸が必須となる(89)。幸いなことに、ARDSの死亡率は非常に低い(0.09%)(70)。
新生児COVID-19の症例はこれまでにほとんど報告されておらず、感染した新生児のほとんどは軽度の症状か、症状が出ていなかった(90)。肺炎などの重篤な合併症の症例は散発的であり(COVID-19の母親を持つ新生児33人中3人)SARS-CoV-2の感染ではなく、未熟児や窒息、敗血症の結果である可能性がある(33)。現在、WHOはCOVID-19が疑われる、あるいは確認された母親に対して、母乳育児の開始または継続を推奨している(91)。実際、COVID-19が母乳を介して感染した例は報告されていない。さらに、COVID-19の感染リスクは乳児では低く、感染は一般的に軽度または無症状であるのに対し、母乳育児を行わず母と子を引き離すことで生じる影響は重大である。COVID-19が疑われる、あるいは確認された母親とその乳児・幼児との間の接触感染を防ぐためには、感染予防・管理策を厳格に遵守することが不可欠である(92)。一般的には、新生児と密接に接触するすべての人は、手指衛生を含む予防措置を取らなければならない。
小児COVID-19の臨床検査および画像診断の特徴
これまでに、COVID-19の小児における検査所見を評価した小規模な観察研究はわずかしかなく、ほとんどのデータは症例報告やケースシリーズから得られたものである。COVID-19の小児における最も頻繁に報告される検査所見は、白血球数と血小板数、赤血球沈降速度(ERS)C反応性タンパク質(CRP)尿素、クレアチニン、アラニンアミノトランスフェラーゼ、アスパラギン酸アミノトランスフェラーゼである(73)。白血球数は正常値の範囲内(平均7.1×103/μl、正常範囲4~12)であり(70)COVID-19の小児で白血球数の増加が見られたのはわずか10.4%であった(73)。好中球は軽度に減少し(44%、正常範囲54~62%)リンパ球はわずかに増加した(40%、正常範囲25~33%)(70)。血小板数はほとんどの研究で正常であった(平均272.7×103/μl、正常範囲150~450)(70)。また、まれではあるが、血小板増加症および血小板減少症も報告されている(73)。肝機能検査および腎機能検査はほとんどの報告で正常であったが、炎症性マーカー(CRP、D-ダイマー、PCT、ERS、クレアチンキナーゼ、乳酸脱水素酵素、IL-6)の血清レベルは平均値を超えてた(70,73)。
Yoon氏らは、COVID-19の症状のある子供と無症状の子供の検査特性のシステマティックレビューを行った(93)。CRP値が高かったのは、症状のある症例では約23%、無症状の症例ではわずか5.7%であった。症状のある小児、特に10歳未満の小児は、無症候性の小児に比べてリンパ球数が有意に多く(症状のある患者の14%対無症候性の患者の0%)PCT値も高い(症状のある患者の54.5%対無症候性の患者の12.5%)が、後者は有意な差はなかった(93)。
検査所見は、症状および/または徴候が中程度の患者と重度の症状を持つ患者とで異なっていた。さらに、重度のCOVID-19を持つ子供の所見は、成人患者で報告された所見と重なることが多かった(94)。軽度のCOVID-19の子供たちは、臨床検査値の異常が比較的少なく、最も多かったのは好中球数の減少であった。注目すべきは、CRP、PCT、LDHの値は、軽度のCOVID-19症例では、予想されるほど頻繁には上昇しなかったことである(94)。1歳未満の軽症COVID-19患者では、白血球数の増加、LDHおよび肝酵素レベルの上昇が見られた(94)。後者の所見は、乳児は年長児に比べて重症化するリスクが高いことが報告されていることから、この年齢層におけるウイルス負荷の高さを反映している可能性がある(94)。しかし、血清炎症マーカーに関しては、健常者とCOVID-19感染者の間に有意な差は認められなかった。
白血球レベルの上昇は、重症のCOVID-19患児では予想よりも頻度が低かった。実際、白血球数が上昇したのはわずか数人(25%)であった(95)。リンパ球の増加と減少は同程度の頻度(18.7%)で観察され、急性期反応(CRP、PCT、LDH)は一般的に上昇していた。2つの研究では、9人の小児において、IL-10,IL-6,インターフェロンガンマ(IFN-γ)が高値を示したが、その他のサイトカインは正常であったと報告されている(95)。また、CK-MB、D-ダイマー、プロトロンビン時間の上昇傾向も認められた(94)。血小板数は、COVID-19に関連したARDSを発症した小児では、ARDSに関連していない小児に比べて有意に低かった(169×103/mL対216×103/mL)。ARDS患者ではCRP、PCT、LDH、プロB型ナトリウム利尿ペプチド、IL-6の血清レベルが率直に上昇していたが、IL-6のレベルだけはARDSを発症していない小児のレベルと有意に異なっていた(78.7 pg/mL vs. 16.4 pg/mL)(72)。
リンパ球減少は、COVID-19関連のMIS-Cを発症した小児では、MIS-Cを発症していない小児よりも重度であった(11% vs. 42%)(70)。MIS-C患者では血清LDHとD-ダイマーの値が上昇していたが、血小板数や肝機能マーカーには差が見られなかった。MIS-C患者では、循環CD16+ CD56+ ナチュラルキラー細胞のレベルが低かった(70)。また、後者の患者では、著しい心機能障害があり、トロポニンが高値を示した。したがって、COVID-19を持つ入院中の小児において、定期的に心筋トロポニンをモニターすることで、進行中または差し迫った心筋障害を特定できる可能性がある。
胸部X線(CXR)肺超音波(LUS)コンピュータ断層撮影(CT)一般的には高解像度CTを用いた胸部画像診断は、肺疾患の診断や小児・青年期のCOVID-19の管理に重要な手段である。小児の肺炎の診断には、ほとんどの場合、CXRが好まれるが、COVID-19の小児におけるCXRの使用に関する研究はほとんど発表されておらず、さらに、所見はしばしば非標準的な用語を用いて報告されている(96, 97)。典型的なCXRの特徴は、中心部の気管支周囲のマーキングの増加(気管支周囲の壁の肥厚とも呼ばれる)と空域のコンソリデーションである(96)。CXRでは一般的に片側の密度の増加が検出され、左右の肺で大きな変化はなく、下部ゾーンが主に侵されている(97)。間質性パターンはあまり見られず、胸水、気胸、無気肺はまれである(96, 97)。
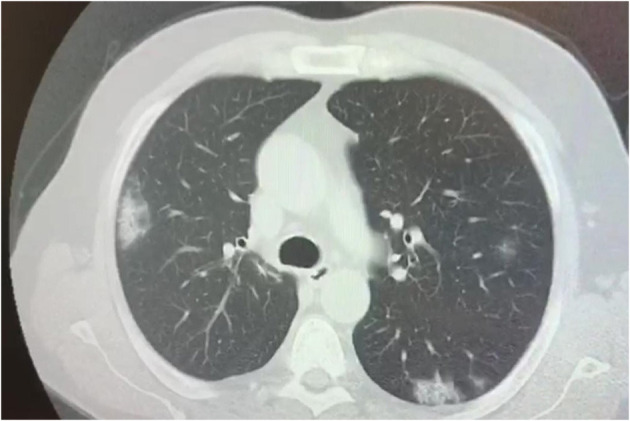
いくつかの研究では、小児のCOVID-19患者の胸部CT所見について述べられているが、ほとんどの異常は非特異的なものである(98-100)。COVID-19患者で胸部CT検査を受けた子供の割合と数は、少なくとも中国からのいくつかの初期報告では非常に高く、ほとんどすべての患者が、初期の病気であっても、胸部の病変を除外するためにCTを指示されていた(101)。小児は成人と同様のCT変化を示したが、重度ではなかった。これはおそらく、SARS-CoV-2によって引き起こされる炎症反応がより軽度であることを示していると思われる(図4)。さらに、多くの小児ではCTスキャンが正常であることが報告されている(最大77%)(100)。小児COVID-19のCT肺変化で最も頻繁に観察されるのは、GGO(Ground-Glass opacity)とコンソリデーションである。これらは孤立していることもあれば、複合していることもあり、主に末梢や後方、胸膜下に発生する(102)。小児COVID-19では、成人患者と比較して、GGOは片側に分布していることが多く、範囲はより限局しており、強調度は低く、小葉病変は少ないようである(103, 104)。通常、COVID-19肺炎の小児患者では、CT所見は疾患活動性や重症度と相関しているが、画像上の重症度と臨床症状との関連性は明確には確立されていない(100)。両側のコンソリデーションを含む、より拡散したCTの変化は、共同感染を持つ子供たち(105)、3歳以下の子供たち(106)、集中治療を必要とする子供たち(66)で観察されている。また、フォローアップCTは、肺の異常からの回復、GGOへのコンソリデーションの進行、残存する肺の線維化の有無などを評価するために用いられている(101)。結論として、COVID-19の小児におけるCT所見は、通常、軽度で非特異的であり、フォローアップ時には、ほとんどの小児が画像の改善または正常であることから、胸部CT画像は小児患者のさらなる管理にほとんど貢献しないことがわかり、その有用性が疑問視されている(107,108)。
図4 SARS-CoV-2に罹患した17歳の少年の両側性コンソリデーションを示す胸部CTスキャン
この10年間で、LUSは成人と子供のすべての年齢層において、肺炎を中心としたいくつかの肺疾患の診断に使用されるようになってきた(109, 110)。LUSは非侵襲的なベッドサイド技術として有望であり、COVID-19感染症のフォローアップにも推奨できる。小児のCOVID-19患者に対してLUSを用いた臨床研究はほとんど行われていない(111, 112)。この方法では、典型的な両側性パターンのびまん性間質性肺病変、胸膜下のコンソリデーション、そして頻度は低いが胸水が見られる(109, 113, 114)。興味深いことに、LUSはSARS-CoV-2に関連した肺炎の臨床的な疑いを裏付けるために、また感染した子供の長期的な追跡調査のために使用されている(111)。
小児COVID-19関連肺疾患の管理において、いつ、どの胸部画像診断ツールを使用すべきかは、重要かつ広く議論されている問題である。画像診断が必要な場合は、CXRを画像診断の手段として選択すべきである。しかし、他のウイルス性肺感染症の場合と同様に、免疫力のある小児で症状が軽い場合(115)、たとえ入院時に少量の酸素を必要とする場合でも(116)、初期のCXRは適応とならない。むしろ、中等度から重度の急性呼吸器症状を呈するCOVID-19が疑われる小児ではCXRを考慮すべきであり(115)、臨床経過が予想される進行に従わない場合や、入院3日目に状態が悪化して酸素を投与しなければならない場合には、最後に低酸素血症が悪化したり、非侵襲的な換気が必要な小児には酸素を投与すべきである(116)。注目すべきは、CXRが陰性であっても、実験室でCOVID-19が確認された小児の肺病変を除外することはできないし、RT-PCRで確認されていないCOVID-19感染が疑われる症例でCOVID-19感染がないことを示すこともできない(115)。このように、CXRはCOVID-19を持つ小児の胸部病変の評価において、感度と特異性が低い。COVID-19の胸部CT所見は小児では病的ではないことから、この集団での使用には疑問が持たれている。American College of Radiologyは現在、COVID-19を診断するための第一選択のスクリーニング検査としてCTを使用することを推奨しておらず、胸部CTは症状のある入院中の成人や特定の臨床的適応のある小児に限って使用すべきであると述べている(117)。International Expert Consensus Statement on Chest Imaging in Pediatric COVID-19 Patient Management(小児COVID-19患者管理における胸部画像診断に関する国際専門家合意声明)」では、疾患が疑われる小児の初期診断検査としてCTを使用することを推奨していない(115)。しかし、例えば、D-ダイマー値が上昇している小児の肺塞栓症を除外するなど、急性期における特定の臨床的疑問に対処するために、CTを考慮することがある(115)。さらに、胸部CTは、臨床経過が悪化したり、支持療法に適切な反応を示さない小児に極めて有用である(115)。過剰な放射線被曝や病室・検査機器の汚染を避けるため、胸部CTは臨床的に悪化している 不安定な症例や、手術を延期できない症例に限って行うべきである。本疾患が胸膜下領域に好発することを考えると、放射線を使わない胸部調査ツールとしてのLUSの使用は興味深い(118)。LUSはベッドサイドでポータブル機器を用いて行うことができ、ウイルス感染を最小限に抑えることができ、安価で、繰り返し行うことができる。しかし、専門家がいるかどうか、また、標準化された解釈基準がないため、その適用には限界がある(119)。表3は、COVID-19を発症した小児における胸部画像および検査データの異常をまとめたものである。
表3 COVID-19 を持つ小児における胸部画像および検査データの異常についての最新文献からの要約
| 調査 | 異常所見 | |
|---|---|---|
| 胸部画像 | 一般 | 珍しい |
| 従来の胸部X線 | 増加ペリ気管支血管マーキング(96) ユニ/両側統合(96、97) |
間質性パターン、胸水、気胸及び無気肺(96、97) |
| 胸部コンピュータ断層撮影 | すりガラス状陰影、(ハロ符号なし/付き)統合、小さな結節、クレイジー・舗装記号(102、104) | |
| 肺の超音波 | 予備領域のあるBライン、不規則な胸膜ライン、胸膜下圧密 | 胸水(109、113、114) |
| 臨床検査 | ||
| 白血球 | 正常 | 増加した(70、73) |
| 好中球 | 軽度に減少(70) | – |
| リンパ球 | やや増加(70) | – |
| 血小板 | 正常 | 減少または増加した(70、73) |
| ヘモグロビン | 正常 | 減少した(70、94) |
| C反応性タンパク質; プロカルシトニン; 赤血球沈降速度 | 正常 | 増加した(70、73、94) |
| 炎症性サイトカイン | 重度の疾患におけるIL10の増加 | 重度の疾患におけるIL-6およびIFN-γの増加 |
| Tリンパ球サブセット | 増加したCD4 +、CD3 +、CD4 + / CD8 +及びCD16低下+ CD56 +の重篤な疾患(内70、94) | CD8減少+の深刻な病気で(70、94) |
| アラニン/アスパラギン酸トランスアミナーゼ | ノーマル(70、94) | – |
| クレアチニン | 正常 | 減少または増加(70、94) |
| クレアチンキナーゼ | 増加した(70、94) | – |
| Lactate dehydrogenase | 正常 | 増加した(70、73、94) |
| D-ダイマー | 正常; (唯一の重篤な形態で増加70、73、94) | – |
診断
SARS-CoV-2 診断のゴールドスタンダードは、鼻咽頭ぬぐい液、気管吸引液、BAL 検体からのウイルス RNA の増幅を伴う RT-PCR である(120, 121)。COVID-19の診断法として気管支鏡を使用することは、患者と医療スタッフの両方を汚染のリスクにさらすことになるため推奨されておらず、したがって、上気道検体が陰性の場合は挿管患者に限定すべきである(122)。RT-PCR検査の特異性は約100%と思われるが、特に無症状の患者ではスワブの汚染により偽陽性の結果が得られることがある(123)。感度については明確に確立されていないが、~66~80%程度であろう(123)。無症状の患者から採取した上気道検体からは、高レベルの SARS-CoV-2 RNA が検出された(124)。SARS-CoV-2のRNAが気道にどのくらい持続するかはまだ明らかになっていないが、SARS-CoVやMERS-CoVに感染した患者では、曝露から数週間後にウイルスのRNAが検出されている(125)。しかし、ウイルスのリボ核酸が存在していても、それが伝達可能な生きたウイルスであるとは限らないため、ウイルスが検出されている期間中、患者が感染しているとは限らない。実際、La Scolaらは、症状が出てから8日後に採取したサンプルからは、ウイルスが分離できないことを発見した(126)。残念なが et al 1回の検査で陰性になったからといって、SARS-CoV-2感染を除外することはできず、検査を繰り返すか、ウイルスに高度に、あるいは繰り返しさらされていることがわかっている患者では、BALなどのより深い呼吸器系のサンプルを採取することが望ましいかもしれない(122)。
SARS-CoV-2の診断に使用できるもう一つの検査法は、迅速抗原検査(RAT)で、イムノクロマトグラフィーと酵素免疫測定法を組み合わせて、ウイルスのヌクレオカプシド(N)タンパク質を検出する(127)。RATは、鼻腔(または鼻咽頭)スワブを用いて実施され、1時間以内に結果が得られる。RATの特異性は100%、感度は~66.7%なので、通常、陽性の結果は信頼できるが、感度が低いことから、偽陰性の結果が出ることもある。ウイルス量が多いほど抗原検出率は高くなるが、RATだけではCOVID-19診断の第一線の検査としては推奨できない(127,128)。
感染症は、血清学的手法を用いて診断することもできる。この場合、SAR-CoV-2に反応して産生され、ウイルスのタンパク質に対して特異的に作用する抗体を、免疫蛍光抗体法を用いて血中で確認する(129)。また、指先で血液を採取して、イムノクロマト法で抗体を検出することもできる。結果は、1つ目の方法では数日以内に、2つ目の方法では20分以内に得られる。この2つの方法は重ね合わせ可能ではないことを明確にすることが重要だ。迅速なCOVID-19抗体検査は、実験室での検査よりも感度が低い(~60%)。IgG抗体とIgM抗体の感度は同じであるため、診断アルゴリズムにおいて両者を区別して使用することはできず、感染の経過中にレベルが並行して上昇する(130)。特異性は89.2〜100.0%である(130)。重要なことは、血清学的検査の結果をSARS-CoV-2感染の診断に用いることはできないということである。なぜなら、急性感染者の場合、症状が出てから7~10日後まではIgMが検出されない可能性があるからである。簡単に言うと、IgM抗体は症状が出た初日から5~10日後に現れ、その後にIgG抗体が続く。IgGおよびIgM抗体は第2週に増加し、第3週にピークを迎える。セロコンバージョンまでの平均期間は、全抗体が発症後9~11日、IgMが10~12日、IgGが12~14日である。IgMのレベルは5週目以降に低下し、7週目にはほとんど検出されなくなる(130, 131)。しかし、この検査は、過去にウイルスにさらされたことがあるかどうかの情報を提供するだけでなく、大規模に使用された場合には、集団における病気の有病率を知ることができる(131)。
SARS-CoV-2を検出するための生物学的サンプルとして唾液を使用することには、いくつかの利点がある。実際、唾液は鼻咽頭スワブの不快感を回避し、医療従事者をウイルスへの曝露から守り、鼻咽頭スワブの不足という問題を克服している。ラテラルフローアッセイに基づいてウイルスSpikeタンパク質を特定する迅速唾液抗原検査(132)のほか、唾液RT-PCR検査(133, 134)がある。唾液中のRT-PCRによるSARS-CoV-2の検出は、鼻咽頭ぬぐい液での分析と比較して92.5%の陽性率の一致を示し、唾液はSARS-CoV-2の検出に一般的に信頼できる検体であり、特に子供を検査する際に有利であることが強調された(134)。唾液のRT-PCR検査は、集団スクリーニング戦略において、特に再開期間中のパンデミックを抑制するために、変動モニタリングを行うために、そして子供の定期検査のために、貴重なツールとなり得る。
治療戦略
パンデミック発生時には、特異的な抗SARS-Cov-2薬はなかった。成人のCOVID-19患者に対しては、主に他のウイルスパンデミックで使用されているいくつかの治療戦略が検討された。COVID-19患者の治療には、IFNやロピナビル/リトナビルなどの抗ウイルス剤、ヒドロキシクロロキンなどの抗炎症剤とアジスロマイシンの併用や非併用、さらに免疫調整剤のトシリズマブなどが提案された。しかし、これらの薬剤の臨床的影響は意味のあるものではなく、また、いくつかの薬剤のリスクは利益を上回っていることがわかった。実際、これらの薬剤はCOVID-19の治療には推奨されていない。小児の治療は経験に基づいており、成人で得られた経験をモデルにしている(135-140)。現在、子供を対象としたCOVID-19治療の臨床試験がいくつか進行中である(141)(表4)。
表4 小児における抗 SARS-CoV-2 治療戦略の概要
| 薬の結果 | |
|---|---|
| 抗ウイルス剤 | |
| レムデシビル | 推奨/小児RCTなし(1つの非盲検小児研究)(135) |
| ロピナビル/リトナビル | 推奨されない/小児RCTなし |
| インターフェロン | 推奨されない/小児RCTなし |
| 抗炎症薬 | |
| ヒドロキシクロロキン | 推奨されない/小児RCTなし |
| 免疫調節剤 | |
| 全身ステロイド | 小児における推奨/ RCT(136) |
| アナキンラ | 考慮(137)/小児RCTなし |
| トシリズマブ | 考慮(137)/小児RCTなし |
| 静脈内Ig | 考慮(137)/小児RCTなし |
| JAK | 非推奨/小児RCTなし |
| 回復期の血漿 | 推奨されない/小児RCTなし |
| 抗生物質 | |
| 経験的抗生物質治療 | もし細菌同時感染の証拠(138、139) |
| アジスロマイシン | 推奨されない/小児RCTなし |
| 抗凝固剤 | |
| 低分子量ヘパリン | 考慮(140)/小児RCTなし |
COVID-19のほとんどの小児は無症状または軽度の症状であるため、一般的には支持療法で十分であり、入院の必要はない。発熱を呈する軽度および中等度の症例では、解熱剤の投与のみが適応となる。パラセタモールまたはイブプロフェンを、小児の発熱治療のガイドラインに従って使用することができる(142)。理論的仮定やいくつかの報告(143)に基づく当初の懸念にもかかわらず、イブプロフェンや非ステロイド性抗炎症薬がCOVID-19患者の臨床転帰を悪化させるリスクを増加させるという証拠はなく(144)、逆に有益である可能性がある(145)。最後に、重症・重篤なCOVID-19の小児には、薬物療法が適応となる(146, 147)(表5)。
表5 臨床的重症度に応じた小児COVID-19の治療法の概要(146, 147)
| 薬 | 病気の臨床的重症度 | ||||
|---|---|---|---|---|---|
| 症状の欠如 | 軽度 | 中程度 | 重度 | クリティカル | |
| 解熱剤 | |||||
| パラセタモール | 番号 | はい、温度が38°Cを超える場合。用量:4〜6時間ごとに10〜15 mg / kg | |||
| Ibuprofen | 番号 | はい、温度が38°Cを超える場合。用量:6〜8時間ごとに5〜10 mg / kg | |||
| 抗ウイルス剤 | |||||
| レムデシビル | 番号 | 番号 | 番号 | はい*、負荷量:5 mg / kg IV、その後2.5mg / kg /日で他の9日間。 | はい*、負荷量:5 mg / kg IV、その後2.5mg / kg /日で他の9日間。 |
| 免疫調節剤 | |||||
| メチルプレドニゾロン** | |||||
| デキサメタゾン§ | |||||
| プレドニゾン° | |||||
| アナキンラ† | 番号 | 番号 | 番号 | はい | はい |
| IV免疫グロブリン♦ | |||||
| 抗生物質 | |||||
| 番号 | はいΔ、細菌の重複感染が疑われるか確認された場合 | はいΔ、細菌の重複感染が疑われるか確認された場合 | YesΔ, if suspected or confirmed bacterial co-infection | はいΔ、細菌の重複感染が疑われるか確認された場合 | |
| 抗凝固剤 | |||||
| 低分子量ヘパリン | 番号 | 番号 | 番号 | はい 用量:100〜200 U / kg /日 |
はい 用量:100〜200 U / kg /日 |
抗ウイルス剤
抗ウイルス剤は、疾患の重症度、併存疾患、副作用に応じてケースバイケースで検討し、できれば臨床試験でその薬剤の有効性と安全性が確認されていればよい(146, 148)。レムデシビルは、現在COVID-19患者の治療に承認されている唯一の抗ウイルス剤である。レムデシビルは、ウイルスのRNA依存性RNAポリメラーゼに結合して、RNA鎖を早期に終結させるヌクレオチドアナログである。この薬剤は、エボラ出血熱の患者にも良好な忍容性を示した(149)。
COVID-19の入院患者1,059名を対象にレムデシビルを使用した無作為化比較試験であるAdaptive COVID-19 Treatment Trial(ACTT-1)では、レムデシビルを投与した患者とプラセボを投与した患者とでは、回復時間の中央値が早くなり、死亡率が低下したことが報告された(150)。2020年4月、レムデシビルは、米国小児感染症学会が承認したガイダンスにおいて、入院中の小児における重症・重篤なSARS-CoV-2感染症の治療に適応された(148)。2020年5月、米国食品医薬品局(FDA)は、レムデシビルとクロロキンまたはヒドロキシクロロキンを併用すると、レムデシビルの抗ウイルス活性が低下する可能性があるという警告が出されていたにもかかわらず、重症の成人およびCOVID-19が原因で入院している小児へのレムデシビルの投与を認める緊急使用許可を出した(151)。レムデシビルの安全性、忍容性、薬物動態を評価するために、新生児と18歳までの患者を対象とした第II/III相オープンラベル試験が2020年6月に開始された(135)。2020年11月、FDAはCOVID-19による入院中の小児の治療にレムデシビルを承認した。12歳以上で体重が40kg以上の小児に使用できる。また、FDA緊急使用許可により、低年齢(12歳未満)および体重40kg未満の小児にも使用可能である。小児におけるレムデシビルの薬物動態を評価する臨床試験が進行中である(152)。
抗生物質による治療
COVID-19の小児または青年への抗生物質の使用を支持するエビデンスはない(138)。ほとんどがグラム陰性桿菌による二次的な細菌感染は、死亡率の重要なリスク要因であるため、細菌感染を併発しているCOVID-19患者は抗生物質で治療すべきである(138)。
免疫調整剤による治療
ステロイド、アナキンラ、トシリズマブ、IVIG、回復期血漿、ヤヌスキナーゼ、IFNなどが、小児COVIDの免疫調節治療で考慮される薬剤である。これらの薬剤のすべてが現在、小児COVID-19の治療に使用されているわけではない。COVID-19のステロイド治療は議論の的となっている。当初、SARS や MERS の経験に基づいて、COVID-19 感染症の治療に全身性ステロイドは、ウイルスクリアランスの遅延、臨床状態の悪化、有害事象のリスクがあるため推奨されなかった(153, 154)。しかし、RECOVERY試験の中間解析では、COVID-19の人工呼吸器を装着した患者および酸素のみを投与された患者において、デキサメタゾンが死亡を有意に減少させたことが示された(136)。現在、IDSAの臨床実践ガイドラインでは、重症COVID-19患者(すなわち、人工呼吸を行っている患者)の治療に、レムデシビルを併用するか否かにかかわらず、デキサメタゾンを使用することを推奨しており、重症COVID-19患者、すなわち、酸素飽和度が94%未満で補助酸素を必要とする患者には、レムデシビルを併用するか否かにかかわらず、デキサメタゾンを投与することを推奨している(147)。小児のCOVID-19治療におけるステロイドの安全性と有効性に関するデータは乏しい。RECOVERY試験は、登録された子供の数が少なく、評価された結果が適切ではなかったため、COVID-19の子供のステロイド治療について結論を出すには不十分であった(136)。とはいえ、デキサメタゾンは重篤な疾患を持つ子供たちには有効かもしれない。COVID-19 に伴う炎症亢進状態を考慮すると、ステロイドやアナキンラ(またはトシリズマブ)などの免疫調節アプローチは、ARDS および症状発現から 7 日以上経過して呼吸機能が徐々に悪化している小児、MIS-C および/または IL-6 および/または D-ダイマーおよび/またはフェリチンおよび/または CRP の血清レベルが著しく上昇しているか、または上昇傾向にある小児に対して検討する必要がある(155, 156)。
アナキンラは、炎症性サイトカインであるIL-1αおよびIL-1βを阻害する遺伝子組換えヒトIL-1受容体拮抗薬で、関節リウマチおよびクリオピリン関連周期性症候群の治療薬としてFDAに承認されているが、IVIGおよびグルココルチコイドに抵抗性のMIS-C、MIS-Cおよびマクロファージ活性化症候群の患者、および長期のグルココルチコイド治療が禁忌の患者の治療に使用されている(137)。2つのケースシリーズでは、アナキンラにより、重度のCOVID-19を有する成人の侵襲的人工呼吸の必要性と死亡率が減少したことが報告されている(155,157)。COVID-19 小児患者へのアナキンラの使用に関する臨床試験は行われていない。しかし、2つの小児のケースシリーズでは、重症の小児においてアナキンラが安全で有益であることが示された(158,159)。しかし、米国国立衛生研究所(NIH)のガイドラインによると、COVID-19 の成人または小児へのアナキンラの使用を推奨するにはデータが不十分である。
回復期血漿とは、感染症の回復期にある患者から採取した血漿を用いて受動免疫を行うものである。SARS-CoV-2感染者に回復期血漿を投与する目的は、ウイルスがACE2受容体に結合する原因となるスパイクタンパクの部分に対する抗体を中和することである(160)。いくつかの症例報告やシリーズでは、中等度または重篤な疾患に罹患したCOVID-19成人において、回復期血漿が臨床症状を安定化または改善したことが報告されている(161)。しかし、最近のRCTでは、COVID-19に罹患した成人において、回復期血漿はプラセボと比較して、臨床状態および死亡率の点で有意な改善は見られなかった(162)。現在、小児における回復期血漿療法の安全性と有効性についてはほとんど知られていない(163)。小児における回復期血漿の使用に関するいくつかの臨床試験が進行中である(164)。
免疫調整剤は、MIS-Cの治療に最も広く使用されている薬剤である。662 名の MIS-C 患者を対象としたレビューでは、IVIG が最も頻繁に使用されており(症例の 76.4%)次いで血管作動薬(52.3%)ステロイド(52.3%)となっている(165)。IDSAの臨床診療ガイドラインでは、MIS-C患者の経験的治療として、高用量のIVIG、ステロイド、サリチル酸塩などの免疫調整剤、まれにアナキンラなどのより標的を絞った抗炎症剤を使用することが推奨されている(147)。逆に、米国国立衛生研究所のガイドラインによると、MIS-Cの管理に現在利用可能な治療戦略のいずれかを推奨する十分なデータはない(146)。SARS-CoV-2を特異的に標的とする抗ウイルス薬の役割は、現時点では不明である。American College of RheumatologyのClinical Guidance for Pediatric Patientsでは、MIS-Cの免疫調節療法を段階的に行うことを推奨しており、IVIGやステロイドを第一選択薬として投与している(166)。アナキンラは、IVIG および/またはステロイドに抵抗性のある MIS-C 患者に推奨される。しかし、MIS-C患者の少なくとも1つのサブグループでは、支持療法のみで回復していることから、免疫調整剤は必ずしも必要ではないかもしれない(158)。川崎病(KD)に特徴的な血小板の活性化、血小板増加、異常冠動脈における血流動態の変化、および内皮障害を考慮すると、KDの特徴を有するMIS-C患者には低用量のサリチル酸が推奨される(166)。
COVID-19の治療のための抗SARS-CoV-2モノクローナル抗体
SARS-CoV-2 に対するモノクローナル中和抗体は、SARS-CoV-2 のスパイクタンパクを標的とし、ウイルスの細胞への侵入を阻止する。NIHガイドラインでは、抗SARS-CoV-2モノクローナル抗体の緊急使用許可(EUA)の高リスク基準に基づき、病気の進行リスクが高い軽度から中等度のCOVID-19を持つ非入院の成人および小児(12歳以上、40kg以上)に対して、バムラニビマブ+エテセビマブまたはカシリビマブ+イムデビマブの併用を推奨している(167,168)。現時点では、小児や青年に対する本治療法の安全性と有効性に関する決定的な証拠はない(169)。
抗凝固剤治療
COVID-19感染症は、入院中の小児および成人において、播種性血管内凝固症候群および静脈血栓塞栓症のリスクと関連している。SARS-CoV-2感染症の小児に抗凝固剤治療を定期的に行うことは推奨されない。入院中の小児では、検査所見(D-ダイマーが正常値上限の5倍以上)に基づいて、血栓症の危険因子が確認された場合には、薬理学的予防と抗凝固剤による治療をケースバイケースで検討すべきである(170)。入院前に抗凝固剤の投与を受けていた小児や、現在体外式臓器補助を受けている小児、静脈アクセス器具の血栓症が再発している小児には、抗凝固剤の投与が推奨される(140)。
小児COVID-19の呼吸器支持療法については、さらに検討すべき点がある。SARS-CoV-2感染は小気道ではなく肺胞や間質に主に関与しているため、ウイルスによる気管支炎で推奨されているものとは異なり、吸入気管支拡張剤は必要ないだろう。気管支拡張剤やトピックステロイドが必要な場合は、飛沫の拡散を最小限に抑えるために、ネブライザーではなくスペーサー付きの定量吸入器を使用することが望ましい。喘息患者は、SARS-CoV-2感染時に吸入または経口ステロイドを中止しないことが推奨される(171)。最後に、病棟の子供に酸素が処方されている場合、空気感染隔離室が利用できない限り、飛沫の拡散を抑えるために、高流量ではなく低流量の鼻カニューレが好まれるべきである(172)。
SARS-CoV-2と他の呼吸器系ウイルスの比較
過去数十年の間に、子供や大人の急性下気道感染症に関連する古いウイルスや新しいウイルスの数は増加している。HIV、H1N1インフルエンザ、コロナウイルスによるSARS-CoVやMERSなど、肺に影響を及ぼすウイルスがパンデミックのきっかけとなっている。2003年と2012年に発生したコロナウイルスのパンデミックでは、小児の臨床症状は成人に比べて軽度であった(173)。全体として、ヒトの呼吸器ウイルスは、軽度の上気道感染から生命を脅かすARDSまで、さまざまな臨床症状を引き起こす。気道感染症の中でも、気管支炎は小児に最も多い疾患であり、その原因となるウイルスは、呼吸器合胞体ウイルス(RSV)インフルエンザウイルス、ライノウイルス、ヒトメタニューモウイルス、エンテロウイルス、コロナウイルス、ヒトパラインフルエンザウイルス、アデノウイルス、ボカウイルスなどである。アデノウイルス感染症は、一般的には、軽度の呼吸器感染症の臨床症状または徴候を持つすべての小児、特に幼児の4~10%が罹患する自己限定的な疾患である(174)。とはいえ、ごく一部の症例では、気管支炎や肺炎を発症し、閉塞性気管支炎や気管支拡張症を併発したり、急性呼吸不全に進行して死亡することもある。2001年と2005年には、メタニューモウイルスとボカウイルスという2つの新しいウイルスが気道で検出された(175)。重要なことは、メタニューモウイルスは乳幼児期の重症細気管支炎の第2の原因であり、ウイルス量が多く、他のウイルスとの共感染は重症化の危険因子であるということである(176)。また、ボカウイルスは、寒冷地と温暖地の両方に住む小児の肺炎や気管支炎の病因として認識されている。RSVと他のウイルス(主にライノウイルスやボカウイルス)との共感染が、気管支炎を発症した小児に認められることがある。
最近では、SARS-CoV-2も幼児の気管支炎の原因となることが報告されている(177)。したがって、SARS-CoV-2の分子検査が陰性であっても、気管支炎の他の原因が特定できない場合は、COVID-19を強く疑う必要がある。子供のCOVID-19下気道感染症の症状と重症度は、他のウイルス感染症の子供の症状と比べて重くないようである(178)。にもかかわらず、SARS-CoV-2陽性の子供には、他のウイルス性病原体、すなわちA型インフルエンザウイルスやメタニューモウイルスの有無を確認することが推奨されている。実際、COVID-19パンデミック時の公衆衛生対策は、RSVやインフルエンザなど他の呼吸器系ウイルスの感染に影響を与える可能性があり、COVID-19規制の実施後、呼吸器系ウイルスの検出数や関連する入院数が減少したことが示されている。
考察
SARS-CoV-2の驚異的な拡大は、世界的な緊急事態を引き起こした。COVID-19に関する基礎的、臨床的なデータが数多く得られるようになったにもかかわらず、特に小児科領域では様々な疑問が残されている。ここでは,小児のCOVID-19の疫学,病態,臨床症状,検査,胸部画像の特徴をまとめ,すでにわかっていることと,今後検討すべきことを明らかにした。このレビューの限界は、日々の知識の増加が非常に速いため、迅速に更新する必要があることだと認識している。小児COVID-19の病因に関する知識はまだ完全ではない。この病気の大きな負担を考えると、研究を最良の実践に移すことは緊急の優先事項である。小児感染症の専門家と小児呼吸器の専門家が分野を超えて協力することで、この分野の進歩が加速すると思われる。
今後の小児科研究は以下に焦点を当てるべきである。
(i) SARS-CoV-2の感染拡大の防止。SARS-CoV-2の感染を食い止めるためには、社会的距離を置くことや衛生対策などの効果的な感染制御介入が不可欠であり、また医療システムの過負荷を防ぐためにも重要であることを示す証拠が増えてきている。子どもたちは、大人よりも感染しにくく、病気の重症度も低いにもかかわらず、頻繁な手洗いやアルコール系手指消毒剤を使った消毒、咳の衛生、接触を避ける行動などを守ることを学ばなければならない(27)。COVID-19に対する防御策としての学校の閉鎖は、現在も議論されている(180)。無症候性の子どもや軽症の子どもは、他の子どもや大人にウイルスを拡散させるという点では脅威にならないかもしれない。実際、最近の研究では、無症候性のCOVID-19の患者は感染力があるが、症候性の患者よりも感染力が弱い可能性があることが示されている(181)。したがって、無症候性の子どもや軽度のCOVID-19の人は、学校における感染の媒介者として自覚がない可能性がある。さらに、SARS-CoV-2の感染拡大は、高校よりも小学校の方が限定的であるという証拠があり、これは幼い子供の感染感受性が年長の子供や青年よりも低いという証拠と一致する(27)。これとは異なり、SARS-CoV-2は、効果的な封じ込め対策が講じられていない場合、特に中学・高校で拡大する可能性がある。例えば、学校での広範な検査の実施、学校内で患者が発生した後の24~48時間の学校閉鎖、検出された患者の接触者の隔離、作業グループの規模の半減、マスクの着用などである(27)。これらの対策が実施できない地理的地域では、学校閉鎖を検討することも可能である。しかし、学校の閉鎖や遠隔教育などの介入は、子どもたちの長期的な教育成果に悪影響を及ぼす可能性がある。障害のある子どもや弱い環境にいる子どもは、そのニーズを満たさない学校閉鎖や遠隔教育によって、特に不利益を被る(180)。子どもや青少年が安全に学校に通えるような対策が実施されるべきである。隔離は、社会的な接触が減るため不快なものであるが、健康であるか慢性肺疾患に罹患しているかに関わらず、子どもや青年が感染症にさらされる機会を減らすのに非常に効果的である(182)。
医療機関は病気の主な発生源であり、医療従事者や入院患者へのSARS-CoV-2の院内感染は具体的な可能性としてある(183)。したがって、小児科医は、特にSARS-CoV-2感染が確認された病児を支援する際には、ウイルス感染を減らすための厳格な対策を取らなければならない。COVID19を持つ子供や青年を管理するために、一部の医療機関では遠隔医療が導入されており、ウイルスの拡散を抑えることができると期待されている(184)。出産時にウイルスが感染する可能性は低いであるが、すべての新生児、特に免疫系が未熟な早産児には、予防と対策が推奨される(185)。
免疫療法は、感染症の予防に有効な方法である。ワクチン接種は、小水疱瘡の根絶やポリオ、破傷風、ジフテリア、麻疹などの感染症の減少につながり、世界的に感染症の負担を大きく軽減している。現在販売されているCOVID-19ワクチンは、被接種者にSタンパク質中和抗体の産生を誘発する。しかし、小児、妊婦、免疫不全患者という特殊なグループに対する安全性試験はまだ実施されていない。
ii)小児COVID-19表現型の定義 COVID-19は、無症状から重度の臨床症状の悪化、さらには死に至るまで、幅広い臨床症状を示する。成人と小児のCOVID-19の表現型がなぜ異なるのかは不明である。単純に考えれば、小児の免疫系のウイルス量が成人に比べて少ないことが原因かもしれない。一般的には、小児のCOVID-19は成人のそれとは全く異なる新規の疾患ではないかと考えられている(186)。また、1つ以上の基礎疾患(先天性心疾患、嚢胞性線維症、肥満、煙やウイルスに関連した気道疾患、栄養不良)を持つ小児は、長期入院や集中治療が必要となり、転帰が悪くなるのではないかという一般的な懸念もある(186)。この点を解明するためには、小児のCOVID-19表現型に関するさらなる研究が緊急に必要である。
COVID-19の急性感染が克服された後、寛解した成人患者のサブグループでは、持続的な疲労、びまん性筋肉痛、炎症症候群、皮膚発疹、抑うつ症状、非回復性睡眠などの長期的な副作用が見られた。このようなCOVID-19の長期的影響は、一般的にlong COVIDと呼ばれている。小児のlong COVIDに関するデータは少ない。Ludvigssonは、SARS-CoV 2に急性感染した後、6~8ヶ月間症状が持続した5人の子供について報告している。主な症状は、疲労、呼吸困難、関節痛、胸痛であった(187)。Children Long COVIDは非常に衰弱しており、学校を長期にわたって欠席することになる(187)。COVID-19 を発症した子供たちは、長期的な後遺症、発症に関わるメカニズム、適切な管理を知るために、慎重なフォローアップが必要であると考えている。
(iii) 胸部画像診断法の研究。成人の場合、胸部画像診断は放射線被曝の観点から十分に確立されているが、小児の場合、標準化された解釈基準を持つ、侵襲性の低い胸部画像診断法(例えば、LUS)を特定するための研究が緊急に必要である。同様に、ウイルス感染後に残存する肺線維症が発生する可能性があるため(101, 188)、COVID-19を発症した小児においても、画像診断技術の縦断的な追跡調査は非常に価値があるだろう。胸部画像所見は、成人および小児のCOVID-19における初期の治療法や新規治療法の有効性を測る指標としても使用できるかもしれない。年長児では、退院時や経過観察時に肺機能検査を検討することができる(189)。しかし、この検査では咳や飛沫が発生する可能性があり、ウイルス感染のリスクが高いと考えられるため、厳密な感染対策を行う必要がある(190)。
(iv)治療。COVID-19の発生により、当初は、実験群と、介入を行わないかプラセボを服用している対照群とを比較する治療臨床試験を行う可能性が低くなった。さらに、COVID-19に罹患した小児は、その軽度の臨床症状から治療を必要としないことが多い。しかし、一部の小児患者は重症または重篤な急性COVID19に進行し、その場合は、抗ウイルス剤のレムデシビルや、回復期の血漿や免疫調整剤が有効となることがある。抗生物質は、その投与の容易さ、低コスト、安全性などから、自己判断で、あるいは不必要に処方されることがある。実際、COVID-19と呼吸器の細菌・真菌の重複感染は稀であるが、コロナウイルス関連の呼吸器感染症患者の多くは、広域スペクトルの経験的な抗生物質で治療されている(139)。SARS-CoV-2に感染した子供たちに無差別に抗生物質を使用した場合、抗生物質耐性の増加という劇的な結果をもたらす可能性があり、これを見過ごしてはならない。抗生物質耐性の脅威と戦うことは、特に呼吸器感染率の高い小児において、SARS-CoV-2の感染拡大を抑えることと同様に重要な公衆衛生上の優先事項である。
結論として、小児用COVID-19についてはいくつかの点を明らかにする必要がある。まず第一に、無症状の子どもがいる一方で、重度の炎症や多臓器不全まで発症する子どもがいるのはなぜか。それは、すべての小児にCOVID-19ワクチンプログラムを提供することと、小児COVID-19の重症型に対する安全で効果的な治療法を提供することである。実際、小児や青年を対象とした大規模かつ多施設の臨床試験が緊急に必要とされており、その目的は、彼らの全体的な幸福を確保するために有望な結果を得ることにある。