Comprehensive investigations revealed consistent pathophysiological alterations after vaccination with COVID-19 vaccines
www.nature.com/articles/s41421-021-00329-3
掲載日: 2021年10月26日
Jiping Liu, Junbang Wang, […]Zhongmin Liu
Cell Discovery volume 7, Article number: 99 (2021) Cite this article
概要
現在、COVID-19のパンデミックに対応するため、多くの国で大規模なCOVID-19ワクチン接種が行われている。今回,不活化SARS-CoV-2ワクチンを健康なボランティアに接種したところ,中和抗体の生成に加えて,ヘモグロビンA1c,血清ナトリウム・カリウム値,凝固プロファイル,腎機能に一貫した変化が見られたことが報告された。同様の変化はCOVID-19患者でも報告されており、ワクチン接種が感染を模倣していることが示唆された。初回接種の前と28日後に末梢血単核細胞(PBMC)のシングルセルmRNAシーケンシング(scRNA-seq)を行ったところ、多くの異なる免疫細胞タイプの遺伝子発現に一貫した変化が見られた。CD8+T細胞の減少と古典的な単球の増加が例示された。さらに、scRNA-seqでは、NF-κBシグナルの増加とI型インターフェロン反応の低下が確認された。これらは、生物学的検査で確認されており、SARS-CoV-2感染後に症状が悪化した場合に起こることも報告されている。以上のことから、糖尿病、電解質異常、腎機能障害、凝固障害などの持病を持つ人がワクチンを接種する際には、十分な注意が必要であると考えられる。
はじめに
COVID-19のパンデミックは、人類に大きな影響を与えている。様々な形態のCOVID-19ワクチンの開発が、これまでにないほど加速して進められている。潜在的な影響に関する不確実性にもかかわらず、多くの国で大規模なワクチン接種が行われている。不活化ウイルス粒子、mRNAワクチン、アデノウイルスベースのワクチンなど、さまざまなCOVID-19ワクチンが開発されてきた1,2,3,4,5。これまでのワクチン研究では、ワクチンを接種することでウイルス感染を防御するための中和抗体を生成できるかどうかに焦点が当てられており、新しく開発された様々なワクチンがヒトの病態生理やその他のヒト免疫系の観点に与える短期的・長期的な影響については十分に検討されなかった。
大規模なシングルセルmRNAシーケンシング(scRNA-seq)技術の開発により、主に末梢血単核細胞(PBMC)のscRNA-seqを用いて、人々の免疫システムの機能を精密に系統的に調べることが可能になった。COVID-19パンデミックの際には、PBMCのscRNA-seqを用いた多くの研究により、さまざまな種類のT細胞、B細胞、NK細胞、単球、樹状細胞など、さまざまな免疫細胞サブタイプにおける感染時および感染後の遺伝子発現の詳細な変化が明らかにされ、その結果、SARS-CoV-2感染時にCD4+およびCD8+ T細胞数が大幅に減少し、T細胞が疲弊することが示されたという。また、末梢の粘膜関連不変性T(MAIT)細胞数の減少や、肺への出入りも観察された。COVID-19患者では、インターフェロン-γ(IFN-γ)インターロイキン-6(IL-6)NF-κB反応など、非常に活性化された炎症性免疫反応が報告されている6,7,8,9,10,11,12。多くの研究では、COVID-19の感染後、強いI型インターフェロン(IFN-α/β)反応が有益であり、IFN-α/β反応の減弱は重篤な症状の発現と関連するという、症状が重い人と軽い人の間の免疫状態の違いが明らかにされていた13。一方、NF-κBの炎症反応が強くなると、症状が重くなることがわかった14。また、γδT細胞の増加や好中球の減少は、症状の軽度化と関連することが報告されている15。
SARS-CoV-2に感染すると、多くの人が様々な程度の呼吸器系の症状を発症し、中には消化器系の症状を呈する人もった。COVID-1916,17では、血液凝固障害、血管系の問題、電解質の不均衡、腎障害、代謝障害などが主な臨床合併症として報告されている。ワクチン接種がどのように感染症を模倣するのか、十分に評価されていない。本研究では、不活化SARS-CoV-2ワクチン(Vero Cell)3を接種する予定の健康なボランティアを登録し、抗体および中和抗体の検査に加えて、ワクチン接種前と接種後の異なる時期に詳細な臨床検査を実施した(スケジュールが若干異なる2回の投与法を適用)。驚いたことに、これらの人々はSARS-CoV-2に感染したかのように、電解質量、凝固プロファイル、腎機能、コレステロールやグルコースの代謝関連の特徴に関して、非常に一貫した病態生理学的変化を観察した。さらに、PBMCsのscRNA-seqの結果から、CD8+T細胞の減少と単球の増加、NF-κBの炎症シグナルの増加が一貫して示され、これも感染後の反応を模倣していた。驚くべきことに、SARS-CoV-2感染後のダメージの軽減と症状の軽快に関連していたI型インターフェロン反応は、ワクチン接種後、少なくとも1回目の接種から28日後までに減少していたようである。このことは、ワクチン接種後の短期(1カ月)では、人の免疫系は非特権的な状態にあり、より多くの保護が必要であることを示唆しているのかもしれない。
調査結果
不活化SARS-CoV-2ワクチン接種後の抗SARS-CoV-2抗体および中和抗体産生量の経時的な追跡調査
本研究では、24-47歳、BMI 21.5-30.0 kg/m²の健康な成人ボランティア男女計11名を登録した(図1a、補足表S1およびS2)。不活化したSARS-CoV-2ワクチン(Vero Cell)(Beijing Institute of Biological Products Co.Ltd)を三角筋に筋肉内投与した。ボランティアを2つのコホートに分け,5人(コホートA)は1日目と14日目に不活化したSARS-CoV-2ワクチン(Vero Cell)を全量(4μg)接種し,6人(コホートB)は1日目と28日目に全量を接種した(図1a)。Bグループのボランティアの1人は、ワクチン接種の直前に抗SARS-CoV-2 IgMおよびIgGに陽性反応を示し、過去に感染した可能性が示唆された。しかし、COVID-19の核酸(NA)診断では、過去に陽性となった記録はなかった(図1aの緑のマーク)。その後のすべての検査において、この患者のデータは緑色で表示され、潜在的な先行感染の影響を追跡した。
図1: ワクチン接種後のSARS-CoV-2抗体/中和抗体の検出とワークフローの模式図
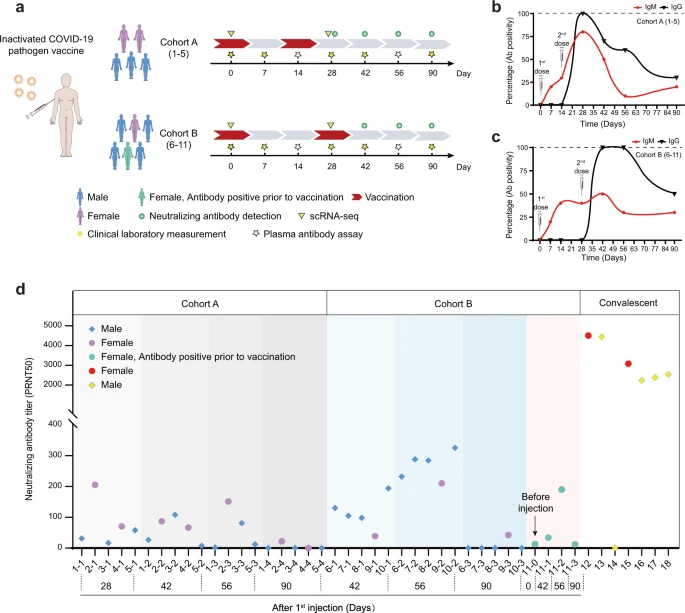
a ワクチンの接種方法、血液サンプルの採取、測定の概略。 b, c コホートAとBにおける抗体陽性率の経時的変化(陽性率/合計)。コホートAは1日目と14日目、コホートBは1日目と28日目に接種した。赤線はIgM、黒線はIgGの変化を示す。 d ワクチン接種後のコホートAおよびBのボランティアの血漿中の中和抗体価の変化、および回復期の人の血漿中の中和抗体価の変化を示す。
有害事象は,接種後7日間は毎日モニターし,その後数週間は参加者が日記カードに自己記録した。有害事象は全体的に軽度(グレード1または2)で一過性であった(補足表S3)。血液サンプルは0日目,7日目,14日目,28日目,42日目,56日目,90日目に採取し,尿サンプルは0日目,14日目,28日目,42日目,90日目に採取した。血漿サンプルは、複数の診断キットを用いて抗SARS-CoV-2 IgM/IgG検査を行い、最も感度の高いキットの結果を用いて定量した(図1b、c)。コホートAの検査結果では、2回目の接種前には0%の参加者が抗SARS-CoV-2 IgGを発現していたが、2回目の接種から2週間後の28日目には100%の参加者が陽性となった(図1b)。全体的に、IgMはIgGよりも早く発現したが、これは予想通りであった。コホートAでは、IgGとIgMの陽性率は42日目には減少し、90日目には比較的低いレベルにとどまった。コホートBでは、2回目の接種後までIgGを発症した者はいなかった。しかし、42日目にはIgG陽性率が100%に達し(図1c)56日目まで持続したことから、コホートBのワクチン接種プロトコルはより効果的であったと考えられる。90日目にはIgG陽性率も50%に低下し、抗体産生が長期間持続しなかったことが示された。さらに、SARS-CoV-2中和抗体18の検査を行ったところ(図1d)28日間隔で2回接種した場合(コホートB)は、14日間隔で2回接種した場合(コホートA)に比べて防御抗体価が高いことが分かった。一方、抗SARS-CoV-2中和抗体価は、過去に報告されたCOVID-19回復者の抗体価よりも全体的に低かったようだ3(図1d)。90日後には、すべてのボランティアで中和抗体価が劇的に低下した(図1d)。興味深いことに、ワクチン接種前に抗体陽性であった人は、他の参加者に比べて中和抗体を産生する傾向がなかったことから、中和抗体産生の観点からは、以前の潜在的な感染は起こらなかったか、あるいは長期的な保護をもたらさなかった可能性が示唆された。
ワクチン接種後の臨床検査値の変化
ワクチンの安全性を明らかにするために,感染症関連指標,血液学的パラメータ,凝固機能,血糖値,血清脂質,心機能関連酵素,電解質,肝機能,腎機能関連バイオマーカーなどの臨床検査値を測定した(図2a,補足表S4,S5)。白血球数は、ワクチン接種後7日目に有意に、しかしわずかに増加した。その後の時点では差は見られなかった(図2b)。驚いたことに、コホートA、Bにかかわらず、健康なボランティアにおいてHbA1c値のかなり一貫した上昇が観察された。42日目と90日目には、中位のHbA1c値は元に戻ったように見えたが、それでもワクチン接種前よりも有意に高かった。これまでの研究で、血糖値がコントロールされていない糖尿病患者は、COVID-19の重症型を発症しやすいことが明らかになっている。また、血糖値が高いと、ミトコンドリアの活性酸素種の産生やHIF1A20の活性化を介して、ヒト単球におけるSARS-CoV-2の複製が促進されることが示されており、不利な条件となっている。
図2 ワクチン接種後の臨床検査値の時間的変化
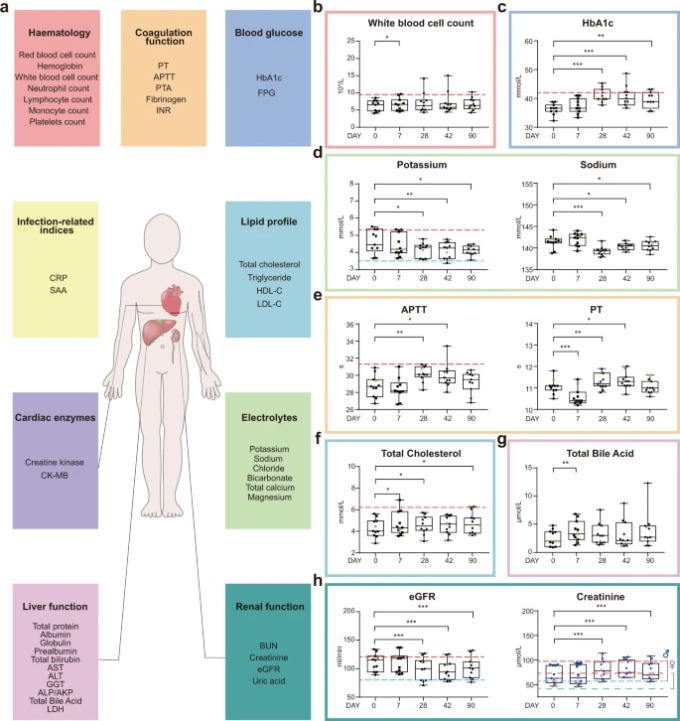
a 臨床検査のルーチン検査には、血液・凝固パラメータ、血糖値関連指標、感染症関連指標、脂質プロファイル、心筋酵素、電解質、肝機能・腎機能関連バイオマーカーが含まれる。詳細は、補足表S4およびS5に記載されている。白血球数(b)HbA1c(c)カリウム(d、左図)ナトリウム(d、右図)APTT(e、左図)PT(e、右図)総コレステロール(f)総胆汁酸(g)eGFR(h、左図)クレアチニン(h、右図)の各検査値。データポイントは各個人の値を示す。箱ひげ図は、25%、50%(中央値)75%を示した。水平方向の破線は,b,c,d(左パネル),e(左パネル),f,hの正常上限値(赤)と,d(左パネル)とhの正常下限値(青)を示した。P値は,Wilcoxon sign-rank検定により,各時点での検査値をベースラインの測定値と比較して算出した。*p ≤ 0.05, **p ≤ 0.01, ***p ≤ 0.001.
血清カリウム値は、1回目の接種後28日目、42日目、90日目までに有意に低下し、42日目には正常下限値を下回ったサンプルが1つあった(図2d、左パネル)。同様に、血清ナトリウム濃度もワクチン接種後に低下し(図2d、右パネル)ワクチンが電解質バランスに影響を与えていることを示している。ここでも電解質バランスの乱れがCOVID-19 21と関連している。凝固障害は、COVID-19によって引き起こされるもう一つの臨床症状である22。ワクチン接種後、凝固プロファイルが大きく変化することがわかった。1回目の接種後の短期(7日間)では、凝固プロファイルはプロトロンビン時間(PT)の短縮に傾いてたが、長期(28日および42日)では、活性化部分トロンボプラスチン時間(APTT)およびPTの延長に向かってた(図2e)。90日目にはワクチン接種前のプロファイルに戻った(図2e)。さらに、1回目の接種から7日目、28日目には血中コレステロール値の上昇が認められ、7日目には総胆汁酸値の上昇も検出された(図2f、g)。腎機能障害もCOVID-19に関連する臨床症状の一つで、1回目の接種後28日目、42日目、90日目には血清クレアチニン値が接種前に比べて有意に高くなり、その結果、eGFRが低下していた(図2h)。これらの臨床的特徴のほとんどは、COVID-19患者の重篤な症状の発現と関連することが報告されている(補足表S6)。全体的に見て、コホートAとBの間にはいくつかの指標を除いて統計的に有意な差がなかったため(補足表S7)2つのコホートのデータをプールして臨床データの提示とその後の解析を行った。
scRNA-seqにより、ワクチン接種後、ほぼすべての免疫細胞の遺伝子発現に劇的な変化が見られた
ワクチン接種後の健康なボランティアの免疫学的特徴を調べるために、ドロップレットベースのscRNA-seq(10×ゲノミクス)を用いて、コホートAまたはBに属するボランティアのワクチン接種前と接種28日後のPBMCのトランスクリプトームプロファイルを調べた(図3aおよび補足図S1a)。前処理と低品質細胞の除去(「材料と方法」参照)を行った結果、すべてのPBMCサンプルから188,886個の細胞が得られ、そのうち86,685個がコホートAから、102,201個がコホートBからの細胞であった。
図3:1回目の接種前と接種28日後における、末梢免疫細胞の種類とサブタイプの構成、および遺伝子発現の変化
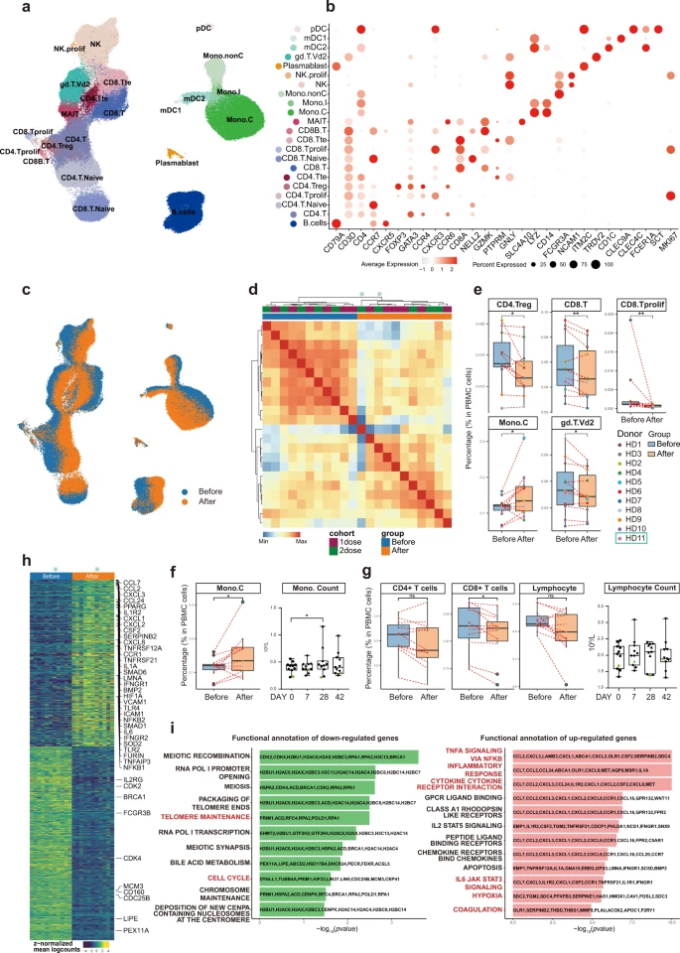
a 全ての統合されたサンプルのセルタイプUMAP表示。合計で22種類の細胞タイプが、細胞タイプ特有の遺伝子発現シグネチャーによって特定された。合計で188,886個の細胞が描かれている。 b 細胞タイプ特異的なシグネチャー遺伝子のドットプロット。c ワクチン接種前(青)とワクチン接種後(オレンジ)の細胞をUMAPで表したもの。 d 擬似バルクサンプル間の相関性を示すヒートマップ。 e ワクチン接種前後の各個人の全PBMCにおける特定の免疫細胞サブタイプの割合。箱ひげ図はサンプルの分布を示している。青色のBOXはワクチン接種前、オレンジ色のBOXはワクチン接種後のサンプルを表す。f scRNA-seqデータ(左パネル)と臨床検査値(右パネル)から得られた単球含有量のワクチン接種前後の変化を箱ひげ図で示した。g scRNA-seqデータ(左3パネル)と臨床検査値(右パネル)から、CD4+、CD8+ T細胞の含有量およびリンパ球(T + B + NK)の含有量のワクチン接種前後での変化を箱ひげ図で示した。 h ワクチン接種前後の疑似バルクサンプルで同定されたDEGs。 i ワクチン接種前後で異なる免疫学的特徴を示すMSigDBのHALLMARK遺伝子セットの過剰発現解析。
UMAP(Uniform manifold approximation and projection)23,SingleR(Single-cell Recognition of cell types)アルゴリズム24,および正準遺伝子マーカーに基づくマニュアルアノテーションを用いて、22種類の細胞タイプまたはサブタイプを同定し、すべての細胞タイプ間で発現量の差を解析した(図3bおよび補足表S8)。ワクチン接種前(青)と接種後(オレンジ)のサンプルの細胞(細胞トランスクリプトーム)は、両コホートのUMAP表現において明確に分離されていた。これは、検出されたほぼすべての免疫細胞タイプにおいて、免疫学的特徴がかなり大きく変化したことを意味し、すべてのボランティアにおいて一貫していた(図3c)。11組のPBMCサンプル(前後)のうち、10組は一緒にシークエンスを行い、1組は別のバッチで別々にシークエンスを行った。その結果、UMAPの分布は、異なるバッチにかかわらずほぼ同様であり、シーケンスのバッチ効果は最小限であることが示唆された(補足図S1b)。独立した2つのバッチでシークエンスを行ったところ、ワクチン接種の前後で同様の変化が見られたことから、この変化は本物であることが示唆された。一方、バッチ効果補正法(Harmony25)を用いると(補足図S1c-e)過剰なろ過が行われ、ワクチン接種によって引き起こされた本当の変化が排除されてしまう。さらに、トランスクリプトームのピアソン相関係数に基づいてサンプルをクラスタリングしたところ、ワクチン接種前後の2つのコホート(AとB)のサンプルは互いによく混ざり合っているのに対し、ワクチン接種による変化がはっきりと観察された(図3d)。そこで、統計処理能力を高めるために、2つのコホートを統合して解析を行った。
ワクチン接種前後での細胞タイプの違いを明らかにするため、各個人のPBMCにおけるすべての細胞タイプの相対的な割合をscRNA-seqデータに基づいて算出した(図3e)。ワクチン接種後には、CD4+制御性T細胞(CD4.Treg)CD8+T細胞(CD8.T)増殖性CD8+細胞(CD8.Tprolif)の割合が減少していることが確認された(図3e)。また、γδT細胞(gd.T.Vd2)の減少も顕著であった(図3e)。一方、CD14+古典的単球(Mono.C)は、ワクチン接種により増加し(図3e)臨床検査値と一致した(図3f)。CD4+T細胞、CD8+T細胞、B細胞、NK細胞を含むリンパ球全体の含有量は、ワクチン接種の前後で大きな変化はなく、これは臨床検査の測定結果でも確認された(図3g)。我々は、196人のCOVID-19感染者と対照者から得られた発表済みのデータセットを収集し7,我々のデータをそのデータセットと合わせて分析した。その結果、COVID-19感染者では、CD8+T細胞の増殖を除いて、5種類の異なる免疫細胞サブタイプの細胞含有量が、コントロールと比較して同じ方向に変化していることがわかった(補足図S2)。
ワクチン接種による遺伝子発現の変化を詳細に調べるために、個々のサンプルを疑似バルクサンプルに統合し、ペアサンプル検定を用いて、発現量の異なる遺伝子(DEG)を同定した(図3hおよび補足表S9)。その結果、COVID-19で報告されている「NF-κBを介したTNF-αシグナル」、「炎症反応」、「サイトカイン-サイトカイン受容体相互作用」、「IL-6-JAK STAT3シグナル」、「凝固」、「低酸素」に関わる遺伝子が有意に上昇する一方、細胞周期に関わる経路は低下していた(図3i)。これらの結果は、ワクチン接種が感染症を模倣しているという考えを支持するものであった6,7,8,9,10,11,12。
注目の免疫細胞サブタイプ特異的遺伝子発現の変化は、臨床検査の変化を反映していた
ワクチン接種前後のサンプル間の機能的異質性や細胞タイプ特異的な遺伝子発現の変化を解明するに先立ち、細胞を大きく11種類に分類した。(1)ナイーブ状態のCD4+T細胞、(2)ナイーブ状態のCD8+T細胞、(3)CD4+ヘルパーT細胞(CD4.T、CD4.Treg、CD4.Tprolifを含む)(4)CD8+細胞傷害性T細胞(CD8.T、CD8B.T、CD8.Tprolifを含む)(5)CD8+細胞傷害性T細胞(CD8.T、CD8B.T、CD8.Tprolifを含む)の11種類に分類した。 Tprolif)(5)MAIT、(6)γδT細胞、(7)NK細胞(NK、NK増殖性を含む)(8)B/プラズマブラスト細胞(B細胞、プラズマブラストを含む)(9)単球/樹状細胞(古典的なモノ、中間的なモノ、非古典的なモノを含む。9)単球・樹状細胞(古典的単球、中間的単球、非古典的単球、骨髄性DC1,骨髄性DC2,形質細胞性DCを含む)(10)CD4+末端エフェクターT細胞、(11)CD8+末端エフェクターT細胞。11種類の主要な細胞型に分類した後、各ドナーの主要な細胞型における遺伝子発現を集計してサンプルレベルの比較を行い、muscat26を用いて差次的発現解析を行った。その結果、すべての主要な細胞タイプにおいて、発現量の異なる遺伝子(DEG)を同定し(図4aおよび補足表S10)遺伝子機能解析を行った(図4b)。臨床検査の結果と同様に、「コレステロールの恒常性」「凝固」「炎症反応」に関連する遺伝子(CXCL8,CD14,IL-6,TNFRSF1B)「NF-κBを介したTNF-αシグナル」(NF-κB1,NF-κB2,NF-κBIE、TNFAIP3,TNFSF9)「低酸素」に関連する遺伝子(HIF1A)が上昇していた。また、「TGFβシグナル」、「IL-2-STAT5シグナル」(IFNGR1,MAPKAPK2,CASP3)「IL-6-JAK-STAT3シグナル」関連の遺伝子も上昇していた(図4c)。これらのシグネチャーがどのような細胞タイプに濃縮されているかを可視化するために、遺伝子モジュールスコアリングを行い、UMAP座標上にスコアを表示するとともに、グループ化したBOXプロットを表示した(図4cおよび補足表S11)。興味深いことに、「炎症反応」関連の遺伝子は単球に多く発現し、ワクチン接種後にはさらに増加した(図4c)。このことから、単球はワクチン接種後の炎症反応に関与する主要な細胞タイプの1つであると考えられる。一方、「解糖」、「胆汁酸代謝」、「I型インターフェロン(IFN-α/β)反応」に関連する遺伝子は発現が低下しており、我々の臨床データやCOVID-19,13の病態生理と一致していた(図4d)。
図4:ワクチン接種後に異なるタイプの免疫細胞間で共通する遺伝子発現の変化を示したサブタイプ特異的遺伝子発現差解析および遺伝子セット過剰発現解析
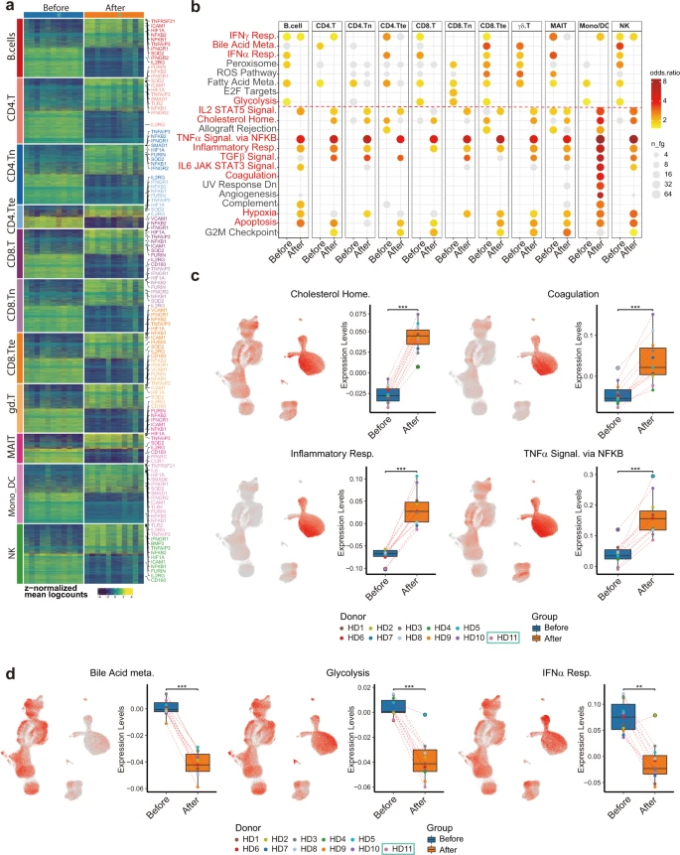
a ワクチン接種前後のサンプルを組み合わせて作成した疑似バルクデータから同定した11の主要な免疫細胞タイプ特異的DEG。b MSigDBに登録されているHALLMARK遺伝子セットを11種類の主要な細胞型でオーバープレッション解析したところ、ワクチン接種前後の免疫状態の変化を表す遺伝子セットに共通する変化が見られた。 c, d 差分濃縮経路に基づく平均発現スコア(レベル)で色分けしたUMAPの可視化。ワクチン接種前後の発現スコア分布を箱ひげ図で表したもの。
複数の免疫細胞サブタイプにおける最も一般的な変化は、NF-κBシグナルの増加とIFN-α/β応答の減少を明らかにした
このように、主要な細胞種の間で遺伝子群の発現が劇的に変化したことから、我々は、免疫学的変化をもたらすマスターレギュレーターとして機能する転写因子があるのではないかと考えた。このような大規模なデータに伴う計算上の課題を解決するために、我々はMetaCellアルゴリズム27を用いて、同種の細胞群をメタセルに集約し、最終的にscRNA-seqデータの全体構造を表す1857個のメタセル(ワクチン接種前893個、ワクチン接種後964個)を作成した(図5a)。これらのメタセルを「単一細胞制御ネットワークの推論とクラスタリング(SCENIC)」28,29 に適用して、遺伝子制御ネットワークを構築した。このワークフローでは、転写因子とその直接の標的を含む157の「レギュロン」のリストが作成された。レギュロンの活性をAUCellを用いて評価し、各メタセルにおける各レギュロンに属する全遺伝子の平均的な濃縮度と、ワクチン接種前の893個のメタセルとワクチン接種後の964個のメタセルにおけるレギュロン遺伝子の平均的な濃縮度を算出した。その結果、ワクチン接種後に発現量が増加した上位8個のレギュロンと発現量が減少した上位8個のレギュロンが特定された(図5b)。図5cに示すように、3+3の典型的なレギュロンを選択して、制御ネットワークを構築した(Supplementary Table S12)。このネットワークには、ワクチン接種後に発現が低下するIRF2,STAT1,STAT2からなるグループと、ワクチン接種後に発現が上昇するRELB、NF-κB2,HIF1Aからなるグループの2つの異なるグループが存在していた。上昇したネットワークのGOタームは、リンパ球の分化、活性化、「胚中心形成」に関連するものが多く、ワクチン接種後にT細胞やB細胞が活性化されていることが示唆された。また、NF-κBシグナルもワクチン接種後に上昇していた。ダウンレギュレートされたネットワークは、多くのインターフェロン関連パスウェイと「サイトカイン分泌」に集中していた(図5dおよび補足表S13)。このことから、ワクチン接種は、I型およびIII型インターフェロンシグナルを駆動するマスター転写因子と考えられているレギュロンSTAT1,STAT2,IRF2の活性を低下させることで、末梢免疫系におけるインターフェロン応答を抑制する可能性が示唆された30,31。
図5:ワクチン接種前後でのマスターレギュロンとその制御ネットワークの同定
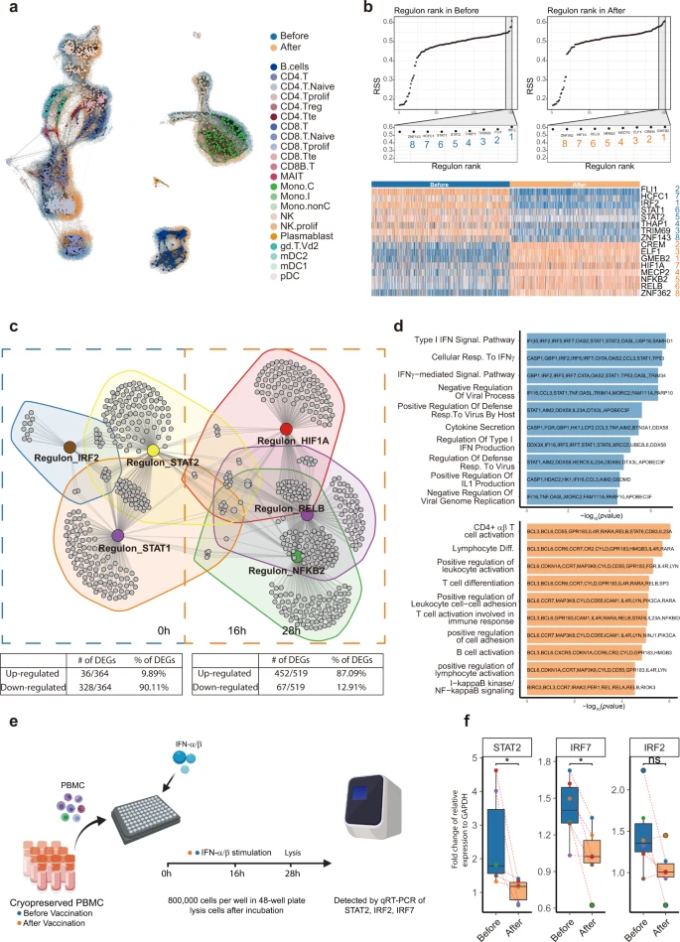
a オリジナルのscRNA-seqデータ上で、「類似構造を持つ」メタセルを視覚化したもの。メタセルは、その細胞タイプのアノテーションに従って色分けされている。b 上段:ワクチン接種前(左)とワクチン接種後(右)のサンプルに含まれるレギュロンの順位をRegulon Specificity Score(RSS)に基づいて表示。下段:ワクチン接種前(青)とワクチン接種後(オレンジ)の上位に位置するレギュロンの活性をAUCellスコアに基づいてヒートマップで示した。レギュロンの名前は色(青/オレンジ)と番号(1-8)で表している。 c レギュロンとその標的遺伝子のネットワーク。下の表は、ワクチン接種後に上昇または下降したレギュロン内の遺伝子の割合を示した。 d ワクチン接種前(青)とワクチン接種後(オレンジ)の遺伝子機能アノテーションと関連遺伝子。 e 実験の概略。 f IFN-α/βで処理した後、ワクチン接種後のボランティアのPBMCは、ワクチン接種前に比べてタイプIインターフェロン応答に関連する遺伝子の発現が減少した。ペアのWilcoxon検定を用いた。*P ≤ 0.05, n = 6.
scRNA-seqで明らかになったワクチン接種によるインターフェロン応答の阻害を確認するために、ワクチン接種前と接種28日後の被接種者のPBMCをIFN-α/βで刺激した。16時間の培養と12時間の刺激の後、RT-qPCRを用いて、マスターレギュレーターであるIRF2,IRF7,STAT2の相対的な発現量を測定した。STAT2とIRF7はワクチン接種後に有意に発現が低下したが、IRF2は低下の傾向を示した(図5e, f)。レギュロン解析の結果、ワクチン接種後の末梢免疫系の状態は、I型インターフェロン反応が低下しており、少なくとも初回接種から28日後には一般的な抗ウイルス能力が弱まっていることが示された。
ワクチン接種による単球の炎症反応
最近の報告では、呼吸器系ウイルス感染症に対する宿主の免疫応答シグネチャーとして、SARS-CoV-2感染症でも保存されているメタウイルスシグネチャー(MVS)が報告されている32,33。MVSのスコアが高いほど、感染症との関連性が高い32,33。今回のデータセットでは,MVS測定のために選択された396個の遺伝子(161個が正,235個が負)のうち,380個(158個が正,222個が負)がMVSスコアに寄与していることがわかった。不活化SARS-CoV-2ワクチン接種後の宿主の免疫反応を調べるために、正と負の遺伝子セットを分離し、MVSスコアを算出した(図6a)。MVSスコアはワクチン接種後に大幅に上昇し(図6b、c)ワクチン接種が感染を模倣していることが示唆された。興味深いことに、正のMVS遺伝子セットは単球に、負の遺伝子セットはリンパ球に主に発現しており、ワクチン接種後に異なる細胞型特異的な免疫反応が起こることを示している(補足図S3a, b)。
図6:単球が高いMVSスコアを示し、MVSスコアに関連するパスウェイを示した
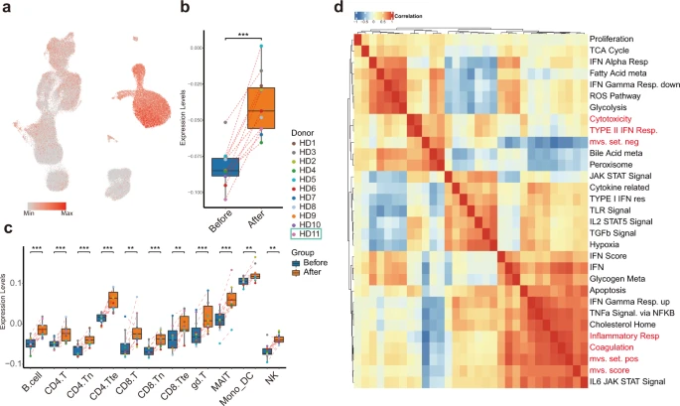
a UMAPをMVSスコアで色分けして可視化したもの。 b すべての細胞タイプを組み合わせた擬似バルクサンプルのMVSスコアは、ワクチン接種後に上昇を示した。 c ワクチン接種前後の11種類の主要な免疫細胞タイプのスコア分布を箱ひげ図で表したもの。 d ワクチン接種前後のMVSスコアと発現量の異なる遺伝子が濃縮されたパスウェイとの相関をヒートマップで表したもの。
MVS陽性遺伝子セットとMVS陰性遺伝子セットにどのようなパスウェイが関連しているかを調べるために、我々のscRNA-seqデータを用いて、MVS遺伝子セットのスコアと以前に同定された差次的に濃縮されたパスウェイとの間のスピアマン相関を計算した(図6d)。MVSスコアとMVS陽性セットとの相関が最も高かったのは「炎症反応シグナル」で、CD14,FPR1,C5AR1,NAMPT、NLRP3,CDKN1A、IFNGR2などとともに、ワクチン接種後の単球で顕著に上昇していた。一方、MVS陰性セットは、NKG7,CCL4,CST7,PRF1,GZMA、GZMB、IFNG、CCL3の発現に代表される「細胞毒性シグネチャー」とよく相関しており、ワクチン接種後に多くのT細胞サブタイプで有意に減少したが、NK細胞では減少しなかった(補足図S3c)。
考察
本研究は、COVID-19ワクチン接種後の人々の詳細な免疫学的変化を含む病態生理学的変化を包括的に調査したものである。ワクチン接種は、中和抗体の産生を促進するだけでなく、糖尿病、腎機能障害、コレステロール代謝、凝固障害、電解質異常などの様々な健康指標に、あたかも感染症を経験したかのような影響を与えることが示された。ワクチン接種前後のボランティアのPBMCのscRNA-seqでは、免疫細胞の遺伝子発現に劇的な変化が見られた。これは、臨床検査値の一部と一致するだけでなく、NF-κB関連の炎症反応の増加を示唆するもので、主に古典的単球で起こっていることが判明した。ワクチン接種により、古典的単球の含有量も増加した。さらに、MVSスコアに正に寄与する遺伝子セット(重篤な症状の発現に関連することも知られている)が単球で高発現していた。また、COVID-19に対して有効であるとされるタイプIインターフェロン(IFN-α/β)反応は、ワクチン接種後に低下した。また、ネガティブMVS遺伝子は、リンパ球(T細胞、B細胞、NK細胞)で高発現していたが、ワクチン接種後には発現が低下した。これらのデータを総合すると、ワクチン接種後、少なくとも28日目までは、中和抗体の生成以外にも、リンパ球や単球を含む人々の免疫システムが、おそらくより脆弱な状態にあることが示唆された。
興味深いことに、我々の予備データでは、SARS-CoV-2のRBDとPBMC(ワクチン接種前後のボランティアから採取)をプレインキュベートした後、IFN-α/βで処理すると、ワクチン接種後のPBMCでI型インターフェロン応答が実際に増強されたことが示された。一方、ワクチン接種前のPBMCと比較すると、SARS-CoV-2 S-RBDの前処理はI型インターフェロン応答を減少させるようで(P < 0.05, IRF2, IRF7, STAT2)(補足図S4b)ウイルスペプチドの1回目の暴露がPBMCにおけるI型インターフェロン応答の減少を実際に引き起こすことを示唆している。これらの試験管内試験データは、scRNA-seqの結果を見事に裏付けている。
なお、コホートAの中で抗生物質を服用していた1名は、I型インターフェロン反応に関連する遺伝子の発現が減少しておらず、また、この個体はコホート内で最も高い中和抗体価を有していたことが特筆される。さらに、中和抗体価と、TNF-κBを介したTNF-αシグナル伝達やインターフェロン-α(I型インターフェロン)反応に関連する遺伝子の平均的な発現量で測定した炎症反応との間のPearson’s Correlation Coefficient(相関係数)を算出した。その結果、それぞれ0.32,0.39でP>0.05となり(補足図S4c)免疫応答の変化とワクチンの適応免疫防御は高い相関性を持たないと考えられた。抗生物質がワクチンの有効性に影響を与えるかどうかは、今後の課題である。また、コホートAとBでは、抗SARS-CoV-2抗体の産生プロファイルが異なる一方で、PBMCsのscRNA-seqの結果は、B細胞のscRNA-seqデータを含めて劇的に類似していた点も興味深い(補足図S5a-c)。ワクチン接種後、反応するB細胞、特にメモリーB細胞を含む成熟した抗COVID-19抗体(IgG)を産生するB細胞の大部分は、主にリンパ節や脾臓などの末梢リンパ組織に存在するはずであり、循環系には少数の成熟B細胞しか存在しないことに留意すべきである。したがって、PBMCsのB細胞集団は、体液性免疫の全スペクトルを反映していない可能性がある。
本研究で発表された解析、特にPBMCsのscRNA-seqは、これまでのワクチン評価では実施されていなかったため、免疫系機能関連遺伝子の変化がCOVID-19に特異的なものであるか、他のワクチンや他の種類のCOVID-19ワクチンに一般的に適用できるかどうかは、まだ確定していない。しかし、このような詳細な解析は、ワクチンの開発や応用に総合的に役立つはずである。今回の研究では、ワクチン接種が特定の病状34や一般的な人間の健康に及ぼす長期的な影響の可能性を考慮することが必須であることを示唆している。
材料と方法
参加者,臨床データの収集,および手順
健康な成人ボランティアがプログラムに参加した。すべての被験者は,訓練を受けた医師による身体検査と質問票の記入を受けた。18~60歳の健康な成人で,腋窩温が37.0℃以下,SARS-CoV-2核酸検査が陰性で,予定されているすべての研究プロセスを完了する意思のある人を研究に登録した。てんかん、脳・精神疾患、アレルギーの既往、コントロールされていない主要慢性疾患、生化学・血液学的検査で臨床的に有意な異常所見のある人は除外した。また、妊娠中または授乳中の女性も除外した。本研究は,ヘルシンキ宣言(No.2020(096))の原則に基づき,上海東病院の倫理委員会の承認を得た。登録前にすべての参加者から書面によるインフォームドコンセントを得た。
合計11名の参加者が登録され,臨床的安全性と免疫系の動的変化を評価するためにワクチンを接種した。このうち,5名の参加者(コホートA)には,1日目と14日目に不活化SARS-CoV-2ワクチン(Vero Cell)を4μg投与し,6名の参加者(コホートB)には,1日目と28日目に同ワクチンを4μg投与した。不活性化SARS-CoV-2ワクチン(Vero Cell)(China Biotechnology Group Corporation)は三角筋に筋肉内投与された。すべてのワクチンは,中国国家食品薬品管理研究所の承認を得た。
実験室での安全性検査として,感染症関連指標(C反応性タンパク質,血清アミロイドAタンパク質),血液学的指標(白血球数,好中球数,リンパ球数,単球数,赤血球数,ヘモグロビン,血小板数),凝固機能関連指標(プロトロンビン時間,活性化部分トロンボプラスチン時間/APTT,フィブリノゲン.プロトロンビン活性/PT、国際標準化比/INR)血糖値関連指標(空腹時血糖値、HbA1c)血清脂質(総コレステロール、トリグリセリド、HDL-C、LDL-C)心機能関連酵素(クレアチニンキナーゼ、CK-MB)電解質(カリウム、ナトリウム、塩化物、重炭酸塩、総カルシウム、マグネシウム)肝機能関連バイオマーカー(例:血糖値、血中濃度、血中濃度、血中濃度、血中濃度、血中濃度、血中濃度、血中濃度、血中濃度)など。 g., 肝機能関連バイオマーカー(アルブミン、アラニンアミノトランスフェラーゼ/ALT、アスパラギン酸アミノトランスフェラーゼ/AST、総ビリルビンなど)腎機能関連マーカー(クレアチニン、尿酸、血中尿素窒素/BUN、推定糸球体濾過率/eGFR)を測定した。
COVID-19抗体(IgG/IgM)検査
Innovita (S protein specific)」、「GenBody (N protein specific)」、「Livzon (S + N proteins)」、「AbKhan (S + N proteins)」を含む多数の市販のCOVID-19抗体(IgG/IgM)迅速検査キットを用いて、ワクチン接種前およびワクチン接種後の異なる時期のボランティアの血漿の抗COVID-19(IgM/IgG)陽性を検査した。AbKhan」キットが最も感度が高く、本研究ではそのデータを使用した。
PRNTによる中和抗体検査
血清サンプルはそれぞれ、BSL-3実験室でSARS-CoV-2(2019-nCoV-WIV04)のプラークリダクション中和試験(PRNT)アッセイを用いて検査した。簡単に言うと、血清を56℃で30分間熱不活性化し、1:50に希釈した後、3倍の連続希釈を行った(1:50,1:150,1:450,1:1350,1:4050,1:12,150)。その後、血清を100PFUのウイルスと混合し、37℃で1時間インキュベートした。ウイルス-血清希釈混合物およびウイルスコントロールを、24ウェルプレートのVero E6細胞単層に1時間接種した後、1.5%メチルセルロースを含むオーバーレイ培地を37℃で4-5日間添加し、プラークを形成させた。その後、プレートを固定し、30%メタノールに溶解した2%クリスタルバイオレットで30分間、室温で染色し、プラークを手動でカウントして計測した。PRNT力価は、プラーク数の50%減少に基づいて算出した(PRNT50)。
単細胞懸濁液の調製、単細胞RNAライブラリーの調製、および配列決定
Ficoll-PaqueTM PLUS Media (GE Healthcare Inc.)を用いて、健康なボランティアのヘパリンを含む静脈血から、メーカーが提供する標準的な密度勾配遠心法に従ってPBMCを分離した。PBMCは、凍結用培地(70% RPMI-1640, 20% FBS, 10% DMSO)で凍結し、使用するまで液体窒素で保存した。シングルセルのキャプチャーとライブラリの構築は、Chromium Single Cell 5′ Library & Gel Bead kit (10× Genomics)を用いて、メーカーの指示に従って行った。ライブラリーはNovaseq 6000プラットフォーム(Illumina)を用いて配列決定した。
scRNA-seqデータの解析と統計
10×ゲノミクス社の公式ウェブサイトからしたGRCh38ヒトリファレンスゲノムに対して、kallisto/bustools(KB, v0.25.0)35を用いてシングルセルシーケンスデータのアラインメントと定量化を行った。予備的なカウントは、その後の分析に使用された。データを処理するためのパイプラインを作成した。対数で正規化したカウントと、上位3000個の高変動遺伝子(HVGs)の選択をScanpy36で行った。
ミトコンドリア遺伝子、免疫グロブリン遺伝子、サポートが不十分な転写モデルに関連する遺伝子(接頭辞「Rp-」でアノテーションされている)など、特定の遺伝子をHVGから除外した。その後、HVGを用いて主成分分析(PCA)を行い、ハーモニーアルゴリズムを用いてバッチ効果を除去した25。PARC法を用いてクラスターを同定し37 、cytograph2アルゴリズムの “FeatureSelectionByEnrichment “機能を用いて特徴を選択し38 、その後、PCA、Harmony、PARCを再度行った。続いて,KNN グラフの K 近傍を計算し,Pegasuspy39 で UMAP(uniform manifold approximation and projection)を行い,PARC でクラスターを同定した。さらに、潜在的なダブレットを同定するためにScrublet40を適用した。
品質管理は、パイプラインの第1ラウンドの出力に基づいて、クラスターに適用された。
- ダブレットスコアが0.4以上の細胞が20%以上存在するクラスターをダブレットクラスターと定義した。
- ミトコンドリア遺伝子にマップされた転写産物の割合が20%以上の細胞が20%以上あるクラスターを低品質クラスターと定義した。
- ミトコンドリア遺伝子にマップされた転写産物の割合が0.05%未満の細胞が20%以上のクラスタを核と定義した。
- PPBP, PF4, HBB, HBA2の発現量の中央値>0で、赤血球と血小板を示す。
- 50個以下の細胞。
- 検出された遺伝子数が1000未満。
- UMI総数の平均値と検出された遺伝子の平均値の比率<2
- Scrubletで識別されたダブレット。
- DBSCAN41を用いて外れ値を除去。
低品質の細胞を除去した後、Monaco免疫データセット42 を参考に、Single-cell recognition of cell types (SingleR) アルゴリズムで細胞のアノテーションを行った。
質の高い細胞は、下流の解析にかけた。同様に、T細胞(CD3D, CD3E, CD3G, CD40LG, CD8A, CD8B)B細胞(MS4A1, CD79A, CD79B)NK細胞(GNLY, NKG7, TYROBP, NCAM1)単球(CST3, LYZ)を含む主要な細胞タイプを同定するために、パイプラインを再実行した。さらに、各タイプの細胞にそれぞれパイプラインを実行し、SingleRで同定された細胞タイプとよく特徴づけられたマーカーに基づいて、さらにサブタイプを同定した(図3b)。
免疫細胞の割合の比較
PBMCのサンプルについて、主要な細胞タイプとその下のサブタイプごとに、免疫細胞の割合を計算した。各サンプルについて、細胞タイプの比率は、特定の細胞タイプの細胞数を細胞の総数で割って算出した。異なるグループのサンプル間での細胞比率の変化を確認するために、異なるグループ間の各主要な細胞タイプおよび細胞のサブタイプの比率についてウィルコクソン検定を行った(補足図S2)。割合に統計的に有意な差(P < 0.05)があった細胞タイプのみを図3eに示した。 発現差解析、遺伝子セット過剰発現解析、スコアシグネチャーモジュール 免疫学的特徴の変化を調べるために、デフォルトのパラメータでmuscatアルゴリズム26を用いてDEGsを同定した。簡単に説明すると、まず、各健康なドナーの細胞間のUMIを合計してデータを総崩れさせ、各サンプルのバルクRNA-seqスタイルのUMIsプロファイルを作成した。その後、集計されたカウントをpbDS関数にロードしてDEGを同定し、pbHeatmap関数でヒートマップをプロットした。DEGsの遺伝子セット過剰発現解析(logFC > 0.5および調整P < 0.05)は、MSigDBから得られた “HALLMARK”、”KEGG”、および “REACTOME “遺伝子セットを用いて、片側フィッシャーの正確検定(”gsfisher “Rパッケージに実装)を用いて行った。P < 0.05の遺伝子セットは有意であると判断した。シグネチャーモジュールのスコアは、Seuratのデフォルト設定である “AddModuleScore “関数を用いて算出した。各細胞について、シグネチャー遺伝子リストの平均発現量から対応するコントロール遺伝子リストの平均発現量を差し引いたものをスコアと定義した43。解析に使用した遺伝子リストを補足表S11に示す。 メタセル解析 Rパッケージ「MetaCell」27を用いてデータを解析した。特定のミトコンドリア遺伝子、免疫グロブリン遺伝子、サポートされていない転写モデルに関連する遺伝子(接頭辞「Rp-」でアノテーションされている)を除去した。さらに、UMIが500個以下の細胞をフィルタリングした。遺伝子の特徴は、パラメータTvm=0.08と最小のトータルUMIカウント>100を用いて選択した。続いて、これらの遺伝子間の相関行列の階層的なクラスタリングを行い(カバレッジの低い遺伝子をフィルタリングし、ダウンサンプルされたUMI行列を用いて相関を計算)アンカー遺伝子を含む遺伝子クラスタを選択した。K = 100,500回のブートストラップ反復を行い、それ以外は標準的なパラメータを使用した。メタセルは、各メタセルを構成する最も豊富な細胞タイプによってアノテーションした。
遺伝子制御ネットワーク解析
レギュロン活性の同定とスコアリングのために、対数正規化したメタセルデータにpySCENIC28,29のワークフローを適用し、共発現遺伝子のセットを決定した。また、RcisTargetデータベース(v1.2.1)を用いて、直接の標的を対応する転写因子にリンクさせ、転写開始点から10kbまたは500bpの位置に濃縮されたDNAモチーフを持つ下流の推定遺伝子を保持した(正規化濃縮スコア>3)。最後に、AUCell関数を用いて、データセット中の細胞全体における各レギュロンの活性をスコア化した。これは、レギュロンごとに発現した遺伝子の合計として計算され、AUCスコアの分布を検査した後に手動で調整したカットオフに基づいて、二値の活性マトリックスを作成した。レギュロン特異性スコア(RSS)は、 pySCENICアルゴリズムの “regulon_specificity_scores “関数を用いて、デフォルトのパラメータで計算した。
PBMCsのIFN-α/β反応の解析
ヘパリン処理した血液から、Ficoll-Hypaqueを400×gで30分かけてPBMCを分離した。そして、ワクチン接種前後のドナーのPBMC(1×106ml-1)を、5%ノックアウト血清交換と0.032%ヘパリンを含むRPMI-1640を用いて48ウェル培養プレートに播種した。翌日、培地を交換し、細胞を100 ng/ml IFN-αおよび10 ng/ml IFN-βで12時間処理した。一部の細胞は250 ng/ml RBDで16時間前処理した後、IFN-α/βで12時間処理した。洗浄後、total RNAを抽出した後、リアルタイム定量PCRを行い、I型インターフェロン応答関連遺伝子の発現を検出した。GAPDHに対するフォールドチェンジを2-ΔΔCtで算出し,平均値±SEMで表した。グループ間の差は,ペアのStudent’s t-testを用いて評価し,P < 0.05で有意とした。
統計解析
臨床データは,必要に応じて平均値(標準偏差),中央値(Q1,Q3),または数(%)を用いてまとめた。検査特性の経時的なペア中央値の比較には,Wilcoxon signed-rank検定を用いた。有害事象の評価は、中国国家医療製品監督管理局(https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20191231111901460.html)が発行した尺度に基づいて行い、臨床検査結果の判定は、地域住民の基準値範囲に基づいて行った。統計学的検定はすべて両側検定とした。統計的有意性はP≦0.05とした。統計解析は,SAS v9.4(SAS Institute Inc.,Cary,NC,USA)を用いて行った。
データの入手
本論文で使用したシーケンス生データおよび処理済みデータのアクセッション番号は,Genome Sequence Archive in BIG Data Center (GSA, Beijing Institute of Genomics, Chinese Academy of Sciences): HRA001150.
