Contents
Complications and Pathophysiology of COVID-19 in the Nervous System
オンラインで公開2020年12月4日
www.ncbi.nlm.nih.gov/pmc/articles/PMC7746805/
要旨
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によるコロナウイルス感染症(COVID-19)のパンデミックが世界的な公衆衛生上の脅威となっている。COVID-19の患者の大多数は発熱、咳、倦怠感を呈している。重症患者は呼吸困難や急性呼吸窮迫症候群を発症することがある。また、呼吸器症状に加えて、患者によっては神経障害も生じる。しかし、SARS-CoV-2が神経系に侵入するメカニズムは未だ解明されていない。本レビューでは、最適な治療戦略を設計するための参考となるよう、COVID-19の神経系における合併症や潜在的な機序について考察した。
キーワード:コロナウイルス、COVID-19,SARS-CoV-2,神経系、合併症、病態生理
序論
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によるコロナウイルス症(COVID-19)が世界的にパンデミックしている(1)。ウイルスの急速な蔓延と確定症例数の急増により、世界保健機関(WHO)は2020年3月11日にパンデミックと宣言した。
これまでに7種類のヒトコロナウイルスがヒトに感染することが知られており、そのうち3種類がパンデミックに至っている(2,3)。まず、SARSコロナウイルス(SARS-CoV)による重症急性呼吸器症候群(SARS)は、アジアを皮切りに 2002年から 2003年にかけて世界的にパンデミックした(4)。その後 2012年にはMERSコロナウイルス(MERS-CoV)による中東呼吸器症候群(MERS)が発生し、高い死亡率を記録している(5)。現在のCOVID-19パンデミックは3回目であり、現在も世界的に注目されている。
SARS-CoV-2は、SARS-CoVやMERS-CoVも含むβコロナウイルス(β-CoVs)ファミリーの一員と考えられている(6)。CoVファミリーは、エンベロープされたポジティブセンス一本鎖RNAウイルスで構成されている。CoVファミリーは、表面に大きな糖タンパク質スパイクを持つ球形または楕円形で、電子顕微鏡で観察すると陰性染色で典型的な王冠のような形をしている。CoVファミリーは、遺伝子型的にも血清学的にもα-CoV、β-CoV、γ-CoV、δ-CoVの4つの亜ファミリーに分けられる。これらのうち、α、β-CoVはヒト感染症を引き起こす可能性がある(7)。一般に、ヒトのCoVはすべて人獣共通感染症であり、コウモリがCoVの自然宿主である可能性が高い(8)。さらに、CoVがヒトに感染する前には、CoVの中間的な動物宿主が必要であり、それはそれぞれSARS-CoVの場合にはネコネコ、MERS-CoVの場合にはラクダである(9, 10)。パンゴリンCoVの発見とSARS-CoV-2との類似性は、パンゴリンがSARS-CoV-2の中間宿主の可能性を示唆している(11)。
現在、COVID-19の患者が主な感染源となっている。しかし、無症候性キャリアもウイルスを排泄することが証明されており、潜在的な感染源である可能性がある(12)。呼吸器飛沫および密接な接触が主な感染経路と考えられている。SARS-CoV-2 は糞便や尿から分離される可能性があることが報告されている。そのため、感染者の糞便や尿による環境汚染によるエアロゾル感染や接触感染に注意が必要である(13)。集団は一般的にSARS-CoV-2に感染しやすいため、COVID-19は世界的に急速に広がっている。いくつかのレトロスペクティブコホート研究では、年齢が高く、高血圧、乳酸脱水素酵素値が高い、続発性臓器不全評価スコアが高い、d-ダイマーが1μg/mLを超える、がん患者は、予後不良の悪化を示し、重症化する可能性が高いことが示唆されている(14,15)。さらに、男性の性、重症度、喀痰、筋肉痛、アルブミン低下がCOVID-19患者の臨床経過に影響を与える独立した危険因子であることが明らかになった。さらに、心臓損傷、高血糖症、高用量コルチコステロイド使用の重症男性は、死亡リスクが高い可能性がある(16,17)。喫煙も感染症の高リスク因子である可能性がある(18)。
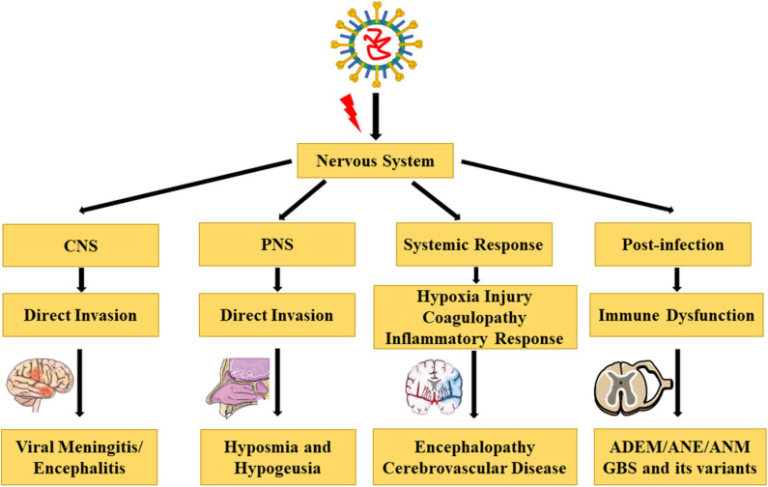
COVID-19は主に発熱、乾性咳嗽、倦怠感を呈する。鼻づまりや鼻水、頭痛、筋肉痛、下痢などの症状を示す患者はほとんどいない。重症患者の多くは発症1週間後に呼吸困難や低酸素症を呈する。急速に進行すると、急性呼吸窮迫症候群(ARDS)敗血症性ショック、代謝性アシドーシスを発症することがある(19)。限られた剖検や生検の病理所見によると、SARS-CoV-2は肺以外にも脾臓、肝臓、心臓、腎臓、脳など複数の組織や臓器に浸潤する可能性がある(20,21)。剖検の結果、胎児症例の36.4%で脳組織からSARS-CoV-2 RNAが検出されたことが明らかになり、SARS-CoV-2の脳内侵入の可能性と神経栄養学的な可能性が示唆されている(22)。最近、Zhangらは、SARS-CoV-2が誘導多能性幹細胞由来のヒト神経前駆細胞に直接感染することを初めて証明し、SARS-CoV-2に感染した神経球や脳内オルガノイドから広範なウイルス複製とウイルス粒子が検出された。さらに、SARS-CoV-2がヒトの脳に生産的に感染することを示した(23)。レトロスペクティブな症例シリーズでは、中枢神経系(CNS)症状や疾患(頭痛、めまい、意識障害、運動失調、急性脳血管障害、てんかん)末梢神経系(PNS)症状(低汗症、低呼吸、低酸素症、神経痛)骨格筋症状などの神経学的症状が報告されている(24)。今回のレビューでは、神経系におけるCOVID-19関連の主要な合併症および病態生理について考察した(表1,図1)。
表1 COVID-19に関連する神経系の合併症の臨床症状と補助検査所見
| 合併症 | 臨床症状 | 補助試験 | 参考文献 |
|---|---|---|---|
| COVID-19-神経系の関連する合併症 | |||
| ウイルス性髄膜炎/脳炎 | 頭痛 精神状態の変化、髄膜刺激の兆候 |
CSF:SARS-CoV-2の陽性PCRアッセイ リンパ球とタンパク質の増加 MRI:FLAIR高信号 EEG:減速 |
(25 – 30) |
| 急性散在性脳脊髄炎(ADEM) | 多焦点赤字 | MRI:FLAIR高信号、多発性脱髄病変 剖検:皮質下白質におけるADEMのような外観 |
(31 – 33) |
| 脳症 | 頭痛、 精神状態の変化 |
CSF:SARS-CoV-2 EEGのネガティブPCRアッセイ:びまん性減速 |
(34 – 36) |
| 急性壊死性脳症(ANE) | 意識レベルの変化 | CT:低減衰 MRI:内出血を伴うT2FLAIR高信号 |
(37) |
| 脳血管障害 | 感覚または運動機能障害 | CT / MRI:虚血性または出血性の変化 | (38 – 40) |
| てんかん | 発作 | CSF:SARS-CoV-2 EEGのネガティブPCRアッセイ:半リズミカルで不規則な高振幅のデルタ波 |
(41 – 43) |
| 急性脊髄炎 | 弛緩性麻痺、感覚鈍麻 尿および腸の機能障害 |
MRI:T2高信号 | (31、44、45) |
| 嗅覚減退症と味覚減退症 | 嗅覚と味覚の喪失 | アンケートベースの調査 横断研究 |
(46 – 49) |
| ギランバレー症候群(GBS) | 弛緩性麻痺 | CSF:SARS-CoV-2 MRIのネガティブPCRアッセイ:影響を受けた神経根の増強 EMG:動員の減少 |
(50 – 53) |
| ミラーフィッシャー症候群(MSF) | 眼筋麻痺、運動失調、および反射低下 | MRI:相対的な拡大、T2の高信号、および影響を受けたCN 抗GD1b抗体陽性の増強 |
(54、55) |
COVID-19,コロナウイルス病、SARS-CoV-2,重症急性呼吸器症候群コロナウイルス2,脳脊髄液、脳脊髄液、CT、コンピュータ断層撮影、MRI、磁気共鳴画像法、PCR、ポリメラーゼ連鎖反応、脳波、脳波造影、筋電図
図1 COVID-19の神経系における合併症と病態生理
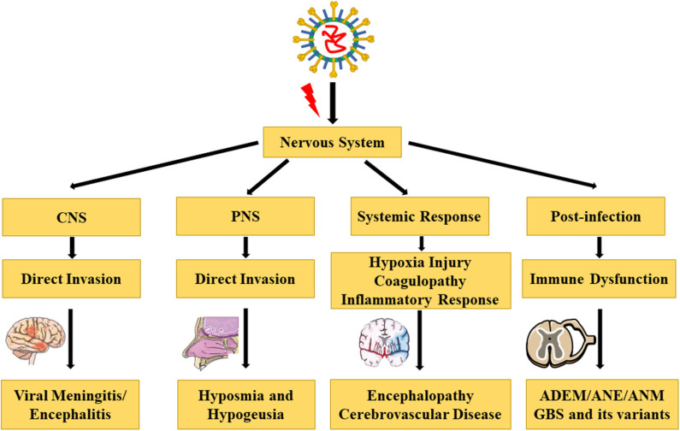
[イラストはServier Medical Art (smart.servier.com/)がクリエイティブ・コモンズ 表示 3.0 Unported Licenseの下でライセンスして提供している]。
神経系におけるCOVID-19関連の合併症
COVID-19-中枢神経系の合併症
ウイルス性髄膜炎・脳炎
ウイルス感染は髄膜炎と脳炎の両方を引き起こす可能性があり、それぞれ髄膜と脳実質の炎症である(56)。COVID-19を発症した男性では、髄膜の刺激性徴候(ヌクシャル硬直、Kernig sign、Brudzinski sign)を示し、伸展性足底反応が陽性であった。中枢神経系の細菌感染や結核感染を除外したところ,SARS-CoV-2脳炎と診断された。しかし,脳脊髄液検体中のSARS-CoV-2は陰性であり,これは脳脊髄液中のウイルス力価が極めて低いためか,あるいは脳脊髄液中のSARS-CoV-2検出のための標準化された検査がないためであると考えられた(25).日本では、意識不明を伴う痙攣で救急外来を受診し、その後、脳脊髄液からSARS-CoV-2 RNAが検出されて無菌性脳炎と診断された最初の患者の症例報告がある(26)。同様に、ロサンゼルスでは、COVID-19の若い女性が呼吸不全を伴わない髄膜脳炎の症状を示し、逆転写ポリメラーゼ連鎖反応(PCR)によりSARS-CoV-2が脳脊髄液中に陽性であることが判明した(27,28)。また、スイスではSARS-CoV-2感染に伴う急性髄膜脳炎の2例が報告されており、英国では急性COVID-19感染のまれな合併症として菱形脳炎の1例が報告されている(29,30)。
急性播種性脳脊髄炎
急性播種性脳脊髄炎(ADEM)は特発性の中枢神経系脱髄疾患であり,どの年齢でも発症する可能性があるが、ポストウイルス性であることが多く、小児に多い。COVID-19関連のADEMの最初の症例は40歳の女性で報告され、磁気共鳴画像法(MRI)では、皮質下および深部白質における流体減衰性逆転回復(FLAIR)高輝度が明らかになった(31)。51歳の女性はSARS-CoV-2感染後数週間で昏睡と片側眼頭反応障害を発症した。MRIでは急性多焦点性の脱髄病変が認められ、臨床検査と脳脊髄液分析では急性脱髄イベントと一致した(32)。さらに、COVID-19と診断された71歳の患者の剖検では、マクロファージの散在性クラスター、軸索損傷、皮質下白質に血管周囲ADEM様の外観が認められた(33)。
脳症
死亡したCOVID-19患者113例を対象としたレトロスペクティブな研究では、Chenらは、症例の20%が低酸素性脳症を示したと報告しており、これは回復した患者と比較して高い割合である(34)。慢性疾患を持つ高齢者はCOVID-19の影響を受けやすく、神経学的疾患や急性呼吸器症状の既往のある患者は脳症のリスクが高い。74歳の男性が頭痛や精神状態の変化を含む脳症の症状を呈し,COVID-19と診断された。髄液検査は正常であったため、神経学的症状は髄膜炎や脳炎によるものではなかった(35)。同様に、72歳の男性もCOVID-19感染と脳症を呈した。その後の脳脊髄液検査では、中枢神経系感染の証拠は示されなかった。しかし、脳波検査(EEG)では、脳症と一致するびまん性の鈍化が認められた(36)。
急性壊死性脳症
特筆すべきは、Poyiadjiらが急性出血性壊死性脳症を伴うSARS-CoV-2感染症の初症例を報告したことである。急性壊死性脳症(ANE)は、インフルエンザや他のウイルス感染に関連したまれな脳症であり、直接的なウイルス侵入や麻痺性脱髄を伴わず、血液脳関門(BBB)の破壊をもたらす。画像所見は、視床下部の多焦点対称性病変が特徴である。ただし、脳幹、大脳白質、小脳も侵されることがある(37)。
脳血管障害
脳血管疾患は、COVID-19患者における疾患重症度の上昇と関連しており(38)、COVID-19の重要な合併症としても浮上している。Maoらは、重症化した感染症患者は、疾患の経過の後半に神経学的症状、特に急性脳血管障害および意識障害を発症する可能性が高いことを報告した(24)。しかし、Avulaらは、PCRで確認されたSARS-CoV-2感染者で急性虚血性脳梗塞を呈した4例を報告しており、4例とも比較的早期の発病で脳血管事故を呈していた(39)。さらに、Al Saieghらによって2例の脳出血が報告されている(40)。
てんかん
イタリアでは、VollonoらがCOVID-19の患者を報告しており、その主な症状は、素因はあるが良好にコントロールされた脳後てんかんで、焦点性状態のてんかんであった。この患者は発熱や呼吸器症状を示さなかったが、発作性神経症状の悪化や再発からSARS-CoV-2感染症の診断仮説を立てることができた。したがって、SARS-CoV-2が神経栄養学的な病原性メカニズムを介して発作を誘発するという仮説を立てることは可能である(41)。しかし、てんかんの既往歴のない男性は、SARS-CoV-2に感染した後、複数の発作エピソードを発症した(42)。さらに、COVID-19とライノウイルスの両方に感染した乳児も発作を呈したが、脳波に変化は認められなかった(43)。
脊髄損傷
SARS-CoV-2 は脳への浸潤のほかに,脊髄への損傷もある.COVID-19を発症した66歳の男性が入院した際、両側下肢の急性弛緩性麻痺と尿失禁・腸失禁を呈した。感染後急性骨髄炎と診断された(31).また、多巣性横紋性骨髄炎の1例も報告されている。60歳の男性はCOVID-19で回復後、進行性の下肢脱力と膀胱機能障害を発症した。2日後にはTh9以下の感覚低下と中等度の痙性麻痺を呈した。脊椎のMRIではTh9レベルでの胸部脊髄のT2信号の過緊張が認められ、急性横筋炎を示唆していた(44)。さらに、69歳の女性は、臨床症状とMRIの所見から急性壊死性骨髄炎(ANM)と診断された(45)。
COVID-19に関連した神経系の合併症
嗅覚減退症と味覚減退症
多くの国でCOVID-19患者は嗅覚と味覚の喪失を報告している。韓国では、軽度のCOVID-19患者では低嗅覚が非常に多く、低嗅覚を有する患者のほとんどに低味覚などの付随症状が現れた(46)。イタリアでは、横断的な調査により、SARS-CoV-2感染の初期段階で嗅覚・味覚障害が存在することが証明された(47)。さらに、フランスの研究者は、COVID-19発生初期に低オスミアと低味覚が報告されていることに注目し、COVID-19の早期診断のためにこれらの症状の有用性を調査した(48)。したがって、症状が軽度で目立たない患者や発病初期の患者に対しては、病気の伝播を防ぐために社会的遠距離を強く実施すべきである(49)。
ギランバレー症候群とその変異体
ギラン・バレー症候群(GBS)は、主に末梢神経とその脊索根を標的とする自己免疫誘発性神経障害である。通常、異常な自己免疫応答を誘導する感染または免疫刺激によって引き起こされる(57)。COVID-19を有する患者においてGBSのいくつかの症例が報告されている(50-53)。しかし、GBSとCOVID-19との因果関係を支持するためには、さらなる疫学的データが必要である。
ミラー・フィッシャー症候群(MSF)は、GBSの亜種であり、眼瞼下垂、運動失調、および運動失調の3つの症状を示す急性末梢神経障害である。SARS-CoV-2に感染した36歳の男性が頭蓋神経(CN)IIIの麻痺による複視を呈した。MRIでは、患部CN IIIの相対的な拡大、T2の過緊張、および亢進が認められた(54)。同様に、50歳の男性がMSFのトリアドを呈し、ガングリオシドに対する抗体(GD1b抗体)の1つに陽性であった(55)。
COVID-19-神経系における関連病態生理
直接侵略
CoVは、直接的な血行性伝播および神経伝播を介して中枢神経系に侵入することができる(58)。血行性伝播の場合、気道内のCoVは上皮バリアを通過して血液またはリンパ循環に到達し、その後中枢神経系に向かって伝播することができる。BBBは内皮細胞で構成されており、神経血管ユニット内のペリサイト、アストロサイト、ミクログリア、ニューロンと相互作用し、BBBの透過性を調節し、結果として中枢神経系の完全性を維持している(59)。SARS-CoV-2の直径は60〜140 nmであり、BBBをバイパスして中枢神経系への侵入を得るためにウイルスが容易になる(60)。
CoVによる中枢神経系への侵入の他の経路は、神経細胞の分極による神経拡散である。この輸送は逆行性または反行性であり、ダイニンおよびキネシンによって促進される(61)。COVID-19患者における嗅覚低下は、「導電性」喪失または「神経性」喪失に起因する可能性がある(62)。患者における正常な嗅覚の急速な回復は、嗅裂症候群と呼ばれる「導電性」損失を示唆しており、嗅裂の粘膜閉塞と関連している(63)。Fodoulianらは、マウスとヒトの両方において、アンジオテンシン変換酵素2(ACE2)と膜貫通型セリンプロテアーゼ2が、嗅上皮と嗅球の非神経細胞に優勢に発現していることを示した(64)。最近、ニューロピリン-1(NRP1)が嗅上皮に発現していることが明らかになった。このことから、嗅神経から中枢神経系へのSARS-CoV-2の感染には、ACE2とNRP1の両方が関与している可能性があると考えられている(65)。また、Wangらは、ハムスターにおいて、SARS-CoV-2が成熟および未成熟の嗅神経細胞とそれを支えるustentacular細胞に感染することを報告しており、これがCOVID-19の特異的な嗅機能障害に寄与している可能性があると考えられている(66)。嗅球は初期のウイルス学的コントロールにおいて重要であるが、いくつかの研究では、嗅覚経路がウイルスの中枢神経系への侵入に重要な経路であることが証明されている(67)。
アンジオテンシン変換酵素2
SARS-CoVと同様に、SARS-CoV-2は、そのスパイクタンパク質を介してACE2を標的とすることでヒトに感染することができる。SARS-CoV-2はACE2を認識する際により特異性を示し、受容体結合ドメインの存在によりACE2との結合親和性が高い(68)。ACE2は、細胞増殖、血圧調節、炎症反応など、複数の生理的役割を持っている。ACE2は肺、腎臓、内臓、循環器系、さらには中枢神経系でも広く発現しており、SARS-CoV-2が複数の臓器やシステムに影響を与えている可能性があることを示している(69)。脳では、ACE2は神経細胞、アストログリア細胞、ミクログリア細胞、内皮細胞で発現している(70)。ACE2は、脳内に存在するすべての構成要素であるレニン-アンジオテンシン系のネガティブな調節因子である(71)。ACE2の枯渇はアンジオテンシンIIの発現を増加させ、血管収縮、ナトリウムおよび水の滞留、血圧上昇、炎症促進、および凝固促進作用をもたらす(72)。SARS-CoV-2はACE2に結合するため、一部の患者では異常に血圧が高くなり、急性脳血管疾患のリスクが高まる可能性がある。SARS-CoV-2が受容体としてACE2を標的としていることを考えると、SARS-CoV-2とACE2の結合を防止することは、多臓器への損傷を防止するための潜在的な治療戦略である可能性がある(73)。
低酸素障害
COVID-19を有する重症患者は、重篤な息切れおよび低酸素血症を特徴とするARDSを発症する可能性がある(19)。SARS-CoV2の神経侵襲性は、COVID-19患者に見られる呼吸不全に役割を果たしている可能性がある(74)。低酸素血症は、複数の臓器で一連の病理学的変化を引き起こす可能性がある。ARDSに関連するCOVID-19の病理学的所見は、ヒアリン膜形成を伴う肺水腫を示し、これは中枢神経系におけるガス交換障害および低酸素をもたらす可能性がある(21)。低酸素はミトコンドリアにおける嫌気性代謝物の過剰蓄積と脳内の酸性代謝物の過剰蓄積を誘導し、脳細胞の浮腫と脳血流の閉塞を引き起こす(75)。COVID-19の診断と治療に関するガイドライン(中国語での試験版8)(1)では、剖検時の脳のうっ血、浮腫、神経細胞の一部の変性からなる病理学的変化はSARS感染時に見られるものと類似していると記載されている(76)。このように、重度の低酸素は低酸素脳症や虚血性脳卒中の高リスク因子となり、神経系に深刻な障害を引き起こす可能性がある。
凝固障害
Zhangらは、COVID-19患者3人に凝固障害と抗リン脂質抗体が認められたことを報告している(77)。さらに、レトロスペクティブ解析の結果、d-ダイマーやフィブリン分解産物レベルの著しい上昇、プロトロンビン時間の延長、活性化部分トロンボプラスチン時間の延長などの異常な凝固結果が予後不良と関連していることが明らかになった。さらに、播種性血管内凝固は、COVID-19の死亡とより一般的に関連している(78)。COVID-19患者に見られる高凝固性は、脳卒中の素因となる可能性がある(79)。その結果、抗凝固薬治療は、重度のCOVID-19患者の凝固障害の死亡率を減少させる可能性がある(80)。
炎症反応
ARDSはCOVID-19患者の主要な死亡原因である(19)。ARDSの主なメカニズムの一つは、サイトカインストームであり、インターロイキン2(IL-2)IL-6,IL-7,IL-10,およびIL-1β、ならびにインターフェロンγ、腫瘍壊死因子α(TNF-α)G脳脊髄液、IP10,MCP1,およびMIP1Aを含む免疫エフェクター細胞による大量のプロ炎症性サイトカインおよびケモカインの放出によって特徴づけられる、致命的な全身性炎症反応である(19,81)。サイトカインストームは、体内の免疫攻撃を誘発し、多臓器不全およびARDSを引き起こす可能性がある(82)。さらに、以前の研究では、コロナウイルスは、アストロサイトおよびミクログリア細胞からのプロ炎症性サイトカインシグナルを誘導し、IL-6,IL-12,IL-15,IL-1β、およびTNF-αなどの炎症性因子を大量に放出することが示されている。これはまた、炎症性因子によって引き起こされる中枢神経系の損傷の原因となる病態生理学的プロセスの一つでもある(83)。炎症性サイトカインが大幅に増加していることから、炎症反応を改善するために、血漿交換やIL-6受容体標的化モノクローナル抗体などの治療法が使用されている(84,85)。さらに、漢方薬である連華青文は、試験管内試験でSARS-CoV-2に対して抗炎症活性を発揮することが証明されている(86)。
免疫機能障害
COVID-19の重症患者では、末梢性CD4+ TおよびCD8+ T細胞数は、過剰活性化状態にあるものの、有意に減少している。さらに、CD4+ T細胞には高濃度のプロ炎症性CCR6+ Th17が、CD8+ T細胞には細胞傷害性顆粒が存在し、T細胞の過剰活性化が重症患者の免疫傷害と関連していることが示唆されている(21)。さらに、リンパ球の有意で漸進的な減少は重症度の徴候と考えられている(87)。
療養血漿中の中和抗体は、COVID-19およびARDSを有する5人の重症患者の治療に使用され、臨床状態が改善された(88)。しかし、Wangらは、重症患者では免疫グロブリンG(IgG)反応が増加し、IgG、特に抗スパイクIgG(抗S-IgG)中和抗体のレベルが高いことを発見した(89)。これは、複数のウイルス感染症で観察されてきたものと同様に、抗体依存性増強(ADE)がSARS-CoV-2感染症に存在することを示唆している(90)。ADEは、Fc受容体または他の受容体と相互作用することにより、ウイルス-抗体複合体(ウイルス-抗S-IgG)の細胞内取り込みを促進し、ウイルスの侵入の増強を導くことができる(91)。そのため、ウイルス感染によって免疫系が活性化し、脳内の免疫細胞が活性化することで慢性炎症や神経障害を引き起こす可能性がある(92)。さらに、SARS-CoV-2感染後の免疫機能障害は、ADEM、ANE、ANM、GBSおよびその変種などの一連の感染後疾患を引き起こす可能性がある。
考察
COVID-19のパンデミックは世界的な関心事となっており、呼吸器系だけがこの疾患に関与しているわけではない。本レビューでは、COVID-19の主な神経学的合併症と潜在的な機序について考察した。低オスミアおよび低ゲオジアを含む神経学的症状は、COVID-19の最初の症状である可能性があり、早期発見、診断、隔離、および治療に役立つ可能性がある。
疾患の進行に伴い、脳炎、脳症、および急性脳血管疾患などの重症患者において、より重篤な神経学的症状が現れることがある。それにもかかわらず、COVID-19患者における神経学的症状の完全な臨床スペクトルは、まだ特徴づけられていない。
神経内科医は、これらの神経学的症状に注意を払い、可能性のある神経学的後遺症についてフォローアップする必要がある。COVID-19を治療する有効な薬剤はまだ存在しない(93)が、COVID-19に対するいくつかのワクチンが臨床試験中である(NCT04398147; NCT04456595; NCT04466085; NCT04368728)のを見ることは刺激的である。したがって、世界中の人々がCOVID-19のパンデミックに立ち向かうためには、まだまだ大きな努力が必要である。