Contents
Complex Disposition of Methylthioninium Redox Forms Determines Efficacy in Tau Aggregation Inhibitor Therapy for Alzheimer’s Disease
2014年8月19日受領,2014年10月14日受理
概要
メチルチオニニウム(MT)は、アルツハイマー病(AD)の治療薬として期待されているタウ凝集阻害剤である。MTは、還元型(ロイコメチルチオニニウム(LMT))と酸化型(MT1)の平衡状態で存在しており、塩化物塩(メチルチオニニウムクロライド(MTC)「メチレンブルー」)として、MT1型で安定化している。MTCは、軽度および中等度のアルツハイマー病患者321人を対象とした第2相試験の結果、認知機能および画像診断における最小有効量はMT138mg/日であることが確認されたが、MT228mg/日で予想外の効果が得られなかったため、MTの臨床開発は延期されていた。我々は、用量反応の失敗は、228mgの投与に使用された100mgのMTCカプセルの胃液および腸液への溶解度がその時点で判明していたことと、腸内の異なるレベルでのMTの酸化還元処理の違いを反映しているのではないかと考えた。新規化学物質であるLMTX(LMTを安定した無水結晶にしたもの)の合成により、前臨床試験および臨床試験におけるMTCとLMTXの薬物動態特性を系統的に比較することが可能となった。60分以内に水または胃液中に放出されるMTの量は、臨床効果の重要な決定要因であることが後に判明した。さらに、MTCのようにMT1の形で投与された場合、食物の存在下でMTを吸収する能力が用量依存的に制限されることも要因となった。MTの吸収の複雑さを説明するモデルが提示され、これは他の類似した酸化還元分子にも関連する可能性がある。
はじめに
アルツハイマー病(AD)は、アルツハイマー(1907)によって発見された神経原線維のもつれを特徴とする不可逆的な神経変性脳疾患である。この神経原線維変化は、主に微小管関連タンパク質であるタウの100アミノ酸の切断された断片からなる病的な対のらせん状のフィラメントで構成されている(Wischik et al 1988; Novak et al 1993)。数多くの研究により、タウの病理と、臨床的な認知症の程度および機能的分子イメージングの障害との間に相関関係があることが示されている(Wilcock et al 1982年、Arriagada et al 1992年、Bancher et al 1993,1996年、Duyckaerts et al 1997年、Grober et al 1999年、Mukaetova-Ladinska et al 2000,Chien et al 2013,Maruyama et al 2013,Okamura et al 2014)。ADの治療にタウベースのアプローチを開発する可能性への関心が高まっている。メチルチオニニウム(MT)は、正常なタウ-チューブリン相互作用を阻害することなく、試験管内試験でタウ凝集阻害剤(TAI)としての活性を有する一群のジアミノフェノチアジンの一つである(Wischik et al 1996)。
MTは酸化還元分子であり、環境条件(pH、酸素、還元剤など)に応じて、還元型(ロイコメチルチオニニウム(LMT))と酸化型(MT1)の間で平衡を保って存在する。メチルチオニニウム塩化物(MTC)は、塩化物塩(通称「メチレンブルー」)として、酸素雰囲気下では完全に酸化型(MT1)で存在する。我々は最近、321人の被験者を対象とした第2相臨床試験を報告した。この試験では、Gelucireに懸濁したハードゼラチンカプセルの形で1日3回食事とともにMTを投与し、3つの用量(69,138,228mg MT/日)の潜在的な有効性を検証した(C. Wischikら、提出原稿)。その結果、認知機能および機能的分子イメージングの評価項目において、138mgMT/日の投与が最小有効量であることが確認された。これらの結果は心強いものであったが、MTの228mg/日の用量では同じエンドポイントで有効性がない、または限定的であるという予想外の結果が出たため、MTのさらなる臨床開発は延期された。
228mgMT/日の投与に使用された100mgMTCゼラチンカプセルは、試験開始時点では、水および模擬胃液に対して用量依存的な溶出制限があることが知られていた。しかし、模擬腸液(SIF)での溶出は達成され、カプセルの18か月の保存期間中、受け入れ仕様を満たしていた。この研究では、腸内での溶解部位の違いが有効性に重大な影響を与えないと仮定して進められた。今回、第2相試験の有効性データについて、初期の溶出データとその後の摂食・嚥下試験の両方を考慮した事後解析を行ったので報告する。その結果、60分以内に水溶液として放出され、かつ食事の有無にかかわらず吸収される用量を算出することで、臨床および画像診断の結果を予測できることがわかった。逆に、60分後に吸収可能で、SIFで放出可能な残りの用量は、MTCの血液学的効果の予測因子となる。これらのデータは、中枢神経系(CNS)と末梢におけるMTの効果には機能的な差異があり、MTが腸内のどこで吸収されるかに依存していることを示唆している。
赤血球をモデル系として用いて、酸化型のMT1を細胞に吸収させるには、チアジン色素還元酵素活性を介して還元型のLMTに変換する必要があることが示されていることから(May er al)。 我々は最近、LMTが酸素雰囲気下で安定なジヒドロメシル酸塩またはジヒドロブロミドとして無水結晶の形で入手可能な新規化学物質(LMTX)の合成を報告した(図1; C. Harrington er al)。 これにより、MTCとLMTXの薬物動態特性を、前臨床試験および臨床試験において、これらの分子のネイティブバージョンと14C標識バージョンの両方を用いて系統的に比較することが可能になった。これらの研究結果を要約し、MTの吸収の複雑さを説明できる一般的なモデルをどのように支持しているか、また他の類似した酸化還元分子にも関連性があるかもしれないことを示す。
材料と方法
フェーズ2試験
AD治療薬としてのMTCの探索的な第2相試験のデザインと結果については、別の文献で報告されている(C. Wischik er al)提出原稿)。本試験では、英国の16施設およびシンガポールの1施設において、321名の被験者を対象に実施された。本試験では、MTを69mg/日、138mg/日、228mg/日の3種類の用量で、それぞれ30mg、60mg、100mgのMTCをGelucireに懸濁したハードゼラチンカプセルの形で、1日3回、食事と一緒に投与し、有効性を検証した。有効性の主要評価項目は、24週間後のADAS-cog(Alzheimer’s Disease Assessment Scale-cognitive subscale)の変化であった。また、135名の被験者を対象としたネステッドサブスタディでは、ヘキサメチルプロピルアミンオキシムを用いた単一光子放射型コンピュータ断層撮影法(SPECT)により、局所脳血流(rCBF)の変化を測定した。試験の第1段階が終了した後、被験者は、盲検化された延長段階に最大2年間登録するように再審査された。最初の6カ月間の延長期間(24~50週目)では、プラセボに無作為に割り付けられた被験者に、MT152mg/日をMTC100mgカプセルで1日2回投与し、さらにプラセボカプセルを追加して盲検化を維持した。有効量に無作為に割り付けられた被験者は、元の無作為化された投与量を継続した。
MTCカプセルの溶解性
カプセルは、Encap Drug Delivery社(Livingston, UK)が製造した25%のMTC懸濁液と75%のGelucire 44/14を混合したものを使用した。カプセルの強度は、55℃でゼラチンカプセルに注入された最終的な懸濁液の充填重量によって制御され、カプセルのキャッピング後に冷却すると硬くなった。ここで報告されている実験は 2004/2005年にEncap Drug Delivery社で行われた。溶解は PhEur 回転パドル法(パドル速度 75rpm、金属製シンカー)を用いて 37℃ 6 0.5℃で測定した。各カプセル剤(30 および 100 mg)の経時的な MTC 投与量の溶解量を分光光度法で調べた。水中の60mgカプセルの値は補間により算出した。カプセルを1000mlの脱イオン水またはSIF(1%パンクレアチンミックスUSPをオルトリン酸二水素カリウムを含む水に溶解し,0.2N水酸化ナトリウムまたは0.2N塩酸でpH6.8 6 0.1に調整したもの)に回転させながら入れ,15,30,45,60分後に5mlの分注液を採取して測定した。サンプルアリコートとMTC標準リファレンスの吸光度を665nmで測定し、標準曲線を用いて各時点の溶液中のMT1量を算出した。25°C 6 2°C/60% 6 5%の相対湿度で0, 1, 3, 6, 9ヵ月間保存した後、60分までの各時点で6つの複製を作成し、水およびSIFへの溶解性を測定した。模擬胃液についても,0 及び 1 ヶ月後に同様のデータが得られた。
赤血球 体外でのMT吸収
実験はQuotient Bioresearch社(Rushden, UK)で行った。[14C]MTCまたは[14C]LMTX(7mM;1988ng/ml)をミニピッグまたはヒト全血に添加した。サンプル(n 5 2)を37℃で0,5,15,30,60分間、ロータリーミキサーでインキュベートした。培養後、血液のアリコートを液体シンチレーション計数で放射能を分析し、ヘマトクリットを測定した。残りの血液サンプルを遠心分離して血漿を生成した。血漿のアリコートを放射能分析し,血液/血漿比を測定した。赤血球(RBC)に関連する放射能(%)は以下のように計算した。
放射能ð%Þ 5 100 2 分裂係数。
ここで,分配係数5 (Cp ([1 2 H])/Cb) 100; Cp 5 血漿中放射能濃度; Cb 5 血液中放射能濃度; H 5 ヘマトクリット (パックセルボリューム).
赤血球 In VivoでのMTの吸収
Covance Laboratories(Harrogate, UK)において、ゲッティンゲンの雌のミニブタに、外科的に挿入された中央カテーテルを介して、[14C]MTC(5 mg MT/kg; 0.634 MBq/mg; n 5 2)または[14C]LMTX(5 mg MT/kg; 0.0191 MBq/mg; n 5 2)を静脈内に投与した。5分、15分、30分、120分後に血液を採取し、液体シンチレーション計数により全血放射能濃度を測定し、ヘマトクリットを測定した。残りの血液サンプルから4℃で10分間遠心分離して血漿を調製し、放射能濃度を測定した。残った赤血球を0.9%NaClで2回洗浄し、放射能濃度を測定した。この洗浄による赤血球の溶出は認められなかった。実験分析はCovance Laboratories社で行った。
ゲッティンゲンのミニブタは,確立されたガイドラインに従って扱われ,すべての実験は機関内の倫理委員会によって承認された。
血漿:生体内でのMTの吸収
投与および実験分析は,Covance Laboratories社で行った。ゲッティンゲン大学の雌のミニピッグに,3日間のウォッシュアウト期間をおいて,2回に分けて[14C]MTCまたは[14C]LMTX(30 mg MT/kg;n 5 2/群)を単回経口投与した。最初の経口投与(それぞれ0.567 MBq/mgおよび0.115 MBq/mg)の後、血漿サンプルを時間ごとにプールし、液体シンチラントに直接添加した。2回目の経口投与(それぞれ1.36 MBq/mgと0.116 MBq/mg)の後、2時間後にのみ血液サンプルを採取した。血漿をプールし、アセトニトリルで抽出し、ハイブリッド型高性能液体クロマトグラフ・イオントラップ・飛行時間型質量分析計を用いた放射性液体クロマトグラフ・イオントラップ質量分析法(LCMSn)により、親薬物(MT)と代謝物の両方を分析した。
脳内濃度 In Vivo
マウス投与および実験分析は,TauRx Therapeutics Ltd. (Aberdeen, UK) で行われた。(Aberdeen, UK)で行われた。) 8~9か月齢のLine 66の雌マウスにMTCまたはLMTXを1日1回、19日間経口投与した。投与量は、3.7,11,33mg MT/kg(n 5 12~13/群)であった。Line 66マウスは、NMRIを背景にしたヒトタウのトランスジェニックマウスである(V. Melisら、提出原稿)。動物は19日目に投与後1時間で安楽死させ、脳を取り出して直ちに凍結した。脳サンプルをホモジナイズした後、塩酸(1M)を加えた。その後,ヘキサンスルホン酸ナトリウムとジクロロエタンを加え,15分間攪拌した。遠心分離後、ジクロロエタン層を回収し、窒素下で蒸発させた。得られたサンプルを移動相に溶解し、660nmでダイオードアレイ検出を行う高速液体クロマトグラフィーで全MT濃度を分析した。酸処理(Peter et al 2000)の結果,この方法は総MT濃度を測定するものであり,親MTと酸に不安定な共役代謝物(複数可)を区別するものではない。
実験は,欧州共同体理事会指令(63/2010/EU)に基づき,現地での倫理的承認,および英国科学手続き法(1986)に基づくプロジェクトライセンスを得て実施された。
ヒトを対象とした Cetero Research社(ニュージャージー州ファーゴ)において,健康なコーカサス系の男女12名(年齢55歳)を対象に,69mgのMTを1日3回(約8時間ごと),1日の総投与量207mgのMTを14日間連続で投与した後,15日目の朝に69mgのMTを最終投与する,非盲検の単回および複数回投与MTC試験を実施した。1日目と15日目には、10時間の絶食後、投与前と投与後0.5,1,1.5,2,2.5,3,4,5,6,8時間目に血液を採取した。また,3日目,7日目,10日目,12日目,13日目,14日目の投与前に血液を採取し,血漿中のトラフレベルを測定した。実験分析は,Covance Laboratories(Madison, WI)で行った。血漿中の総MT濃度(親MTと共役代謝物の組み合わせ)は,CaCl2とアセトニトリル中の1%トリフルオロ酢酸を用いたタンパク質沈殿抽出法を用いて測定した(Burhenneら,2008)。堅牢な分析を行うため、サンプルを70℃で40分間加熱した後、遠心分離して沈殿したタンパク質を除去し、上清に2.5%のギ酸を加えた後、液体クロマトグラフィーとタンデム式質量分析装置を用いて分析した。
食品効果試験
MTCの食品効果試験はShandon Clinical Trials社(アイルランド、コーク)で12人の健康なボランティア(18~30歳)を対象に、LMTXの食品効果試験はQuotient Bioresearch社(英国、ラディントン)で24人の健康な高齢者ボランティア(55~73歳)を対象に実施された。MTCまたはLMTXの単回投与を行った。絶食コホートでは、MTC試験では10時間以上、LMTX試験では8時間以上の絶食を行いました。MTC試験の摂食フェーズでは、投与30分前に標準的な朝食(タンパク質10%、脂質10%、炭水化物55%、約382kcal)を摂取した。LMTX試験の摂食フェーズでは、投与30分前に高脂肪(500-600kcal)、高カロリー(1000kcal)の朝食を摂取した。両試験とも、投与前および投与後0.5、1、1.5、2、2.5、3、4、5、6、8、10、12、24、36、48、72時間後に血液を採取した。血漿を調製し MTC試験では-20℃で,LMTX試験では分析するまで-70℃で保存した。実験分析はBioClin Labora-tories社(Athlone, Ireland)で行った。MTの総量は、加熱工程を除き、MTCの複数回投与試験に準じて測定した。この方法では、酸処理(Burhenneら、2008年)を行うため、親MTと酸に不安定な共役代謝物の区別がつかない。
いずれの試験も、現地の法律、欧州臨床試験指令(2001/20/EC)ICH Good Clinical Practiceガイドライン(CPMP/ICH/135/95, January 17, 1997)および現行のヘルシンキ宣言に準拠して実施された。
薬剤
[14C]MTCおよび[14C]LMTXはAlmac社(Craigavon, UK)で合成した。MTCおよびLMTXはTauRx Therapeutics社から供給された。マウスへの薬剤投与はすべてp.o.で行い、5ml/kgの容量で投与した。投与量はすべてフリーベースで投与した。
結果
MTの赤血球への取り込みはMTCよりもLMTXの方が高い In Vitro and In Vivo. まず、酸化還元状態がMTの赤血球への取り込みに影響するかどうかを、モデルシステムとして、ゲッティンゲンのミニブタまたはヒトの全血に[14C]LMTXまたは[14C]MTCを37℃で15分間添加したものを用いて確認した。MTの赤血球への取り込みは、MTCよりもLMTXの方が大きく(ミニブタおよびヒトでそれぞれ平均6S.E.M.、81% 6 2.2%および95.3% 6 0.4%)、その差は公称0時間の時点ですでに明らかであった。
ゲッティンゲンのミニブタに[14C]MTCと[14C]LMTXを静脈内投与したところ、生体内ではより顕著な酸化還元形態の違いが見られた。14C]MTCと[14C]LMTXを投与した動物では、赤血球中のMT関連部位の取り込みが、測定開始から2時間で[14C]MTCに比べて6〜21倍高く、30分後には最大の相対的な差が見られた(21.4倍、7.7倍の差;図2)。最初の30分では、赤血球から抽出された放射性物質の主な形態は親MTであった。投与後2時間後には、MTは体内の他の部位に分布し、代謝物の生成量が増加した。
ミニブタの生体内血漿中の親MT濃度は、LMTXの経口投与の方がMTCよりも3倍高かった。
14C]MTCおよび[14C]LMTXをゴッティンゲンのミニブタに経口投与したところ、血漿中の全放射能濃度は、投与したレドックス体にかかわらず同程度であった(図3A)。しかし、血漿を抽出してradio-LCMSnでプロファイリングしたところ、親MTの形であったこの放射能の量は、2時間後に[14C]LMTX(18.1%)の方が[14C]MTC(5.5%)よりも3倍多かった(図3B)。重要なことは、抽出されてプロファイリングされた放射能の割合は、[14C]MTC群と[14C]LMTX群でほぼ同じであったことである(約92~93%)。残りのMT以外の放射性物質は、MTの代謝物で構成されていた。これらの結果から、MTCを経口投与した場合、LMTXを経口投与した場合に比べて、MTがより広範に代謝されることが示唆された。
In Vivoにおけるマウスの全MTの脳内濃度は、LMTXの経口投与の方がMTCの低用量投与よりも4倍高い。
マウス脳内の全MT濃度は、LMTX経口投与時の方がMTCを3.7 mg MT/日または11 mg MT/日で投与した場合よりも3.9倍高かったが(図3C)脳内濃度が0.4 mMとなる最高用量(33 mg MT/日)では、脳内濃度は同等となった。なお、マウス脳から全MTを抽出する方法では、酸に不安定なMT代謝物を別途測定することはできなかった。
In VivoでMTCを経口投与したところ、ミニピッグのMTの脳内濃度は、試験管内試験でのタウ凝集を抑制するのに十分なレベルに達した。
ゲッティンゲンミニブタに[14C]MTC(30 mg/kg)を経口投与した2時間後に得られた脳ホモジネート中の平均総放射能は0.595 mg Eq/gであり、これは同時刻にプールした赤血球中の放射能(0.618 mg Eq/g)と同程度のレベルであった。しかし、サンプルを抽出してLCMSnでプロファイリングし、MTとその代謝物を同定したところ、脳組織では赤血球に比べて2倍の量の放射能が抽出可能な形で存在していた。平均0.214 mg Eq/gがMTと同定され、さらに0.073 mg Eq/gがMTのデスメチル誘導体と同定された。後者はメチル基を1つまたは2つ失っているが、MTと同様にTAIの薬理活性を保持している(Taniguchi er al 2005)。今回の試験における投与量(21.4mg/kg)は、体表面積を調整した上で、現在進行中の試験におけるヒトの最大投与量(MT250mg/日、4.2mg/kg)の約5倍に相当する。
ミニブタとヒトにおけるMTの薬物動態が類似していることから(T. Baddeleyら、準備中の原稿)ミニブタのデータに基づいて、第2相試験の公称用量である138mg MT/日のヒトにおける定常状態でのMTおよびそのデスメチル誘導体の予想脳内濃度を推定することができる。この用量は、60mgのMTCカプセルを1日3回投与するもので、蓄積係数は1.65であった(1日目と15日目のMT総血漿中濃度のピーク値(Cmax)の比較に基づく;図4A)。この用量では、ヒトの脳内における親MTおよびその活性代謝物の定常トラフ濃度は,0.051mg Eq/g(0.18mM)と推定される。
臨床試験において、MTCとして投与されたMTの吸収を、LMTXではなく、食物によって用量依存的に低下させることがわかった。
MTCおよびLMTXの速放性錠剤を用いて、健康な成人ボランティアを対象に、老化したゼラチンカプセルによる溶出遅延を解消するための食物効果試験を実施した。その結果、MTC 100mg(MT75mg)の錠剤の吸収を阻害したが(n 5 6,空腹時の48%に減少)MTC 60mg(MT46mg)の錠剤の吸収は阻害しなかった(n 5 6)。健康な高齢者を対象としたMT100mgをLMTXとして投与した場合(n 5 24)吸収に対する食物の影響は認められなかった(図4B)。したがって、MTCとして投与した場合には、MTの吸収は用量依存的に食物の影響を受けるが、LMTXとして投与した場合には影響を受けない。
同じ食餌影響試験において、空腹時の血漿中MT総量ピーク(Tmax)までの時間(中央値)は、いずれの塩形態においても迅速(1.5-1.75時間)であった。LMTX錠剤の場合、食物と一緒に投与した場合、Tmaxの中央値は1.5時間遅れた(表1)。MTC錠では、食事によるTmaxへの影響は少なく,0.5~0.75時間程度の遅延であった。
MTCの24週および50週における臨床効果を、溶出障害および食物の影響と比較した。
第2相試験開始時に実施したカプセル安定性試験では、水およびSIFに対する薬物の溶出を測定した(図5)。水のデータは 1 ヶ月までは模擬胃液のデータと同様であったが、1 ヶ月以降は模擬胃液の分析を中止した。水に対する溶出障害は用量依存的に認められ,保存期間の経過とともに悪化した。これは、拡散反射赤外フーリエ変換分光法(データ未提示)により示されたゼラチンカプセルシェルの架橋が原因の一つであり、MTCハードGelucire懸濁液中の微量濃度のフリーラジカルがゼラチンシェルと接触し、Gelucire懸濁液の不溶性が増加することが原因であることが判明した(Damian et al 2002)。9ヵ月後のSIFでの溶出は、すべてのカプセル強度で許容された(図5A)。
公称用量である138 mg MT/dayのADAS-cogスケールにおいて、中等度の被験者では24週目、軽度および中等度の被験者では50週目に有意な治療効果が認められたが、228 mg MT/dayを投与された被験者の効果は、同じ時点で138 mg MT/dayを投与された場合よりも小さかった。また、軽度の被験者における投与20週後のrCBFの低下の抑制についても同様のプロファイルが見られた。したがって、これらの結果はいずれも公称用量に対する用量反応は見られなかった(相関係数0.117,0.714,0.253;図6A-C)。
吸収可能な用量は、60分以内に水に溶けるか、60分後に溶けるかに基づいて算出した。これだけでは治療効果を予測するのに十分ではなかった。しかし、食事による吸収阻害の影響(MTC 100mg単位の投与でMTの吸収が空腹時の48%に低下したこと、前述)も考慮すると、第2相試験で見られた有効性データをよく説明する一連の用量反応関係が見られた。60分以内に吸収可能で、食事の存在下でも吸収可能なMTの平均投与量(図5B)は、24週後および50週後のADAS-cogに対する治療効果の平均値(r 5 0.835;図6D)および治療開始20週後のSPECTスキャンによるrCBFの低下防止効果の平均値(r 5 0.947;図6E)を予測することがわかった。公称用量である228mgMT/日の有効量は,3つの結果すべてにおいて69mgMT/日の有効量とほぼ同等であった。
24週目および50週目のベースラインからの赤血球数の減少(図7のAおよびB)と公称用量との間に強い相関関係が見られたが、これは60分後に吸収可能な残りの用量がSIFのカプセルから放出されたことであるべて説明できた(24週目および50週目にそれぞれr 5 0.955および0.896;図7のCおよびD)。
考察
MTCとして酸化型MT1を投与したMTは、138mg MT/dayでは中枢神経系に有益な効果をもたらすことが、臨床転帰尺度および機能的分子イメージングで観察されたが、228mg MT/dayでは認められなかった。最高用量の異常な挙動は、いくつかの血液学的パラメータに単調な用量反応効果が見られたことから、単純な吸収不良では説明できなかった。同様に、試験管内試験(C. Harringtonら、提出原稿)およびトランスジェニックマウスのタウオパシーモデルにおける前臨床試験(V. Melisら、提出原稿)でも、逆U字型の用量反応は認められなかった。
試験開始時に実施された安定性試験に基づき、水または胃液中で60分以内にカプセルから放出されるMTの量が、臨床効果の重要な決定要因であることが後になって判明した。その後の定期的な摂食/断食試験で明らかになったさらなる要因は、MTCとして酸化されたMT1の形で提供された場合、食物の存在下でMTを吸収する能力が用量に依存して制限されることであった。この限界は、10分以内に0.80%溶解するように製剤化されたMTC錠剤で観察されたように、製剤の問題とは無関係である。この2つの要因を考慮すると、中枢神経系活性の単純な用量反応プロファイルが明らかになり、100mgカプセルで投与される有効量は30mgカプセルで投与される有効量とほぼ同等であることがわかる。この同等性は、吸収可能な量の計算値と、それに対応する中枢神経系効果の両方に当てはまる。これらの関係は、独立した集団(すなわち、軽度および中等度のADサブグループ)で実証され、異なる観察方法(すなわち、SPECTスキャンおよび臨床尺度)で見られたという事実は、MTによる中枢神経系における実際の効果を反映していることを意味する。
早期放出への依存性は、胃での吸収に対する影響か、胃で発生する必要のある化学的処理段階のいずれかによるものと考えられる。摂食/絶食試験では、MTCとLMTXの両方について、食物が血漿Cmaxまでの時間を遅らせることが示されており、MTの吸収部位として最も可能性が高いのは小腸であることが示唆されている。また、MTCとして提供された場合にのみ食物がMTの吸収を阻害し、LMTXとして提供された場合には阻害しないという事実は、胃の中で行われる処理が酸化還元反応に関係していることを示唆している。
MT1として提供されたMTの吸収には、赤血球表面でLMT型に変換される必要があり、これはエネルギー依存性のチアジン色素還元酵素活性によって媒介される(May er al 2004)。LMTに変換された後は、受動的な拡散によって吸収される。このモデルは、今回のデータによっていくつかの点で確認された。単離された赤血球においても、特に静脈内投与後においても、MTの赤血球への取り込みは、LMTの形態で提供された方がサブスタンティヴに大きかった。また、経口投与の場合、MTCではなくLMTXで投与した方が、低用量でもMTの脳への到達率が高くなることがわかった。我々は、MTの吸収および分布における重要なステップは、MT1からLMTフォームへの変換であり、この変換が胃の中で再度必要とされるのは、pHの影響である可能性が高いと結論づけた。MTCのサイクリックボルタンメトリー研究から、酸化還元電位がpHによって変化することが知られている(Murthy and Reddy, 1984)。我々のデータは、LMTの生成に必要な還元酵素の活性は、胃の低いpHで有利に働くことを示唆している。逆に、溶解が遅れると、小腸からMT1型が吸収されやすくなる。これはおそらく、還元酵素のメカニズムとは異なる、容量制限のある活性輸送システムを介したものと思われる。このようにしてMT1として吸収されたMTは、ヘモグロビンを酸化する傾向が強いと考えられる。
これらのデータを統合した一般的なモデル(図8)によると、MTの代謝と分布において赤血球が重要な役割を果たしていることが示唆される。MTはファーストパス代謝を受け、TAI活性を持たない難溶性の抱合体に変換されるが(T. Baddeleyら、準備中の原稿)赤血球に早期に取り込まれることで保護効果が得られる。赤血球に含まれるMTの主な形態は、親MTとそのデスメチル誘導体であり、易動性の抱合体代謝物は含まれていない。したがって、赤血球内に蓄積されるMTの量は抱合の程度に反比例し、赤血球内のMTの量は、総放射能で示される脳内のMTの量を反映する。このため、LMTXを経口投与した場合、血漿中の親MTの量はMTCに比べて多く、脳内の親MTの量も多くなる。したがって、MTの深部への分布については、赤血球が主要な薬物動態学的リザーバーであると考えられるという意外な結論に達した。我々の知る限り、血漿ではなく赤血球がこの機能を果たす初めての薬剤であり、MTのユニークな酸化還元特性によるものと思われる。
MTを脳に送達する手段としてのMTCの限界にもかかわらず、138mg/日のMTを投与した場合のMTおよびその薬理活性デスメチル誘導体の脳内濃度は、TAI活性に必要なレベルに非常に近いことを示している。タウ凝集の細胞モデルにおいて、ADの脳組織から単離した対のらせん状フィラメントをMTで溶解する際のIC50は0.16mM、タウ凝集を阻害する際の細胞内Kiは0.12mMであった(C. Harringtonら、投稿論文論文)。タウオパシーの2つのトランスジェニックマウスモデルでは、行動に対するMTの効果とタウ病理との関係は、脳内のMTの10倍の濃度範囲(0.13-1.38mM)で単調に上昇した。我々は、1日3回の投与におけるMTおよびその薬理活性を有するデスメチル代謝物の定常的な脳内トラフ濃度は0.18mmと推定している。我々は最近、文献で提案されているMTの代替的な作用機序をレビューした(Wischik er al 2014)。これらのほとんどは、ヒトへの経口投与後に脳内でもっともらしく達成されるMTの濃度と矛盾している。
今回、MTCが最小有効量で治療効果を発揮する可能性を示したが、MTCにはLMTXと比較して大きな限界があり、今後の臨床開発の候補としては劣っていることは明らかである。MTCは、食事をしていない状態では忍容性が低く、食物を摂取すると用量依存的に吸収が阻害される。MTCカプセルの不用意な遅延放出特性を排除しても、食物による干渉を防ぐことはできなかった。したがって、第2相試験で明らかになったように、MTCを使用して、より高用量のMTの潜在的な有益性を探ることはできない。しかしながら、MTCカプセルの遅延放出特性により、MT部分の認知的効果と血液学的効果を部分的に分離することが可能であるという驚くべき発見がなされた。LMTXを使用することで、望ましくない血液学的作用が回避または軽減されるかどうかは、まだ決定されていない。現在、長期の第3相試験が実施されており、軽度および中等度のADにおいて、MTなどのTAIを用いた治療が、LMTXとして150~250mg/日の用量で投与された場合に有益であるかどうかが確認されている。
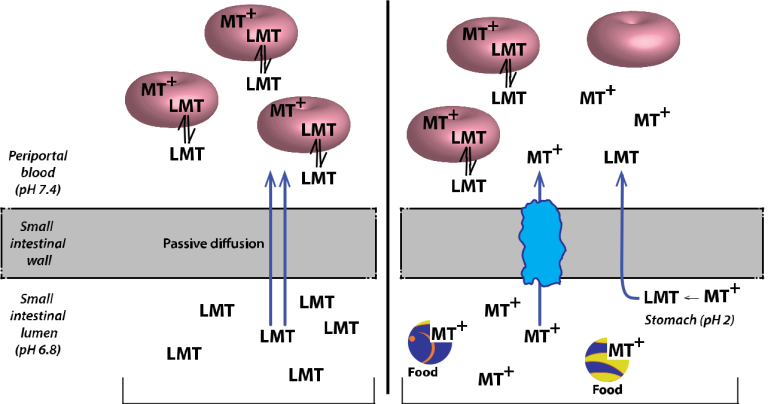
図8. LMTXとMTCの吸収・輸送経路の推定値
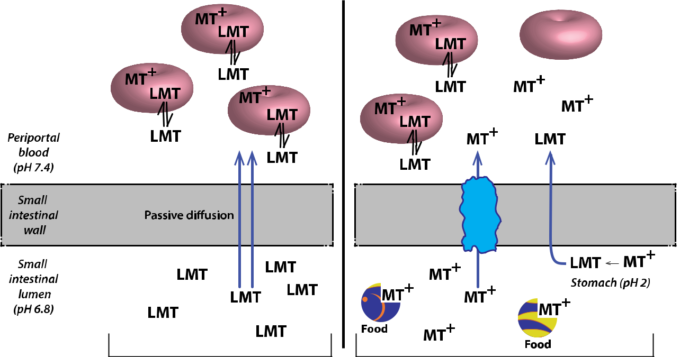
今回報告された結果は、LMTXとMTCの体内動態の違いをもたらすMTの複雑な吸収特性を説明する一つの全体モデルとしてまとめることができる。LMT(LMTXとして投与)は、腸内pH6.8ではイオン化されず、食物の影響を受けずに濃度勾配に沿って小腸壁を通過して受動的に拡散する。小腸から排出される脾臓循環では、LMTの一部(全てではない)が速やかに赤血球に取り込まれ、第一段階の肝代謝を免れる。赤血球内では、LMTは活性平衡に達するまでMT+に酸化される。MT+は細胞内に捕捉されるが、LMTは濃度勾配に沿って外に拡散し、脳や他の組織に分布することができる。したがって、赤血球は親MTを全身に輸送するための主要な貯蔵庫として機能している。一方、MTCのようにMTをMT+の形で投与した場合、吸収される量は少なく、代謝される量が多くなるため、赤血球や血漿中に存在するMTの量は少なくなり、脳内に分布する量はLMTXに比べて少なくなる。MTCのpKaが低いため、MT+は胃と腸の両方で大部分がイオン化されたままであるが、推定される活性チアジン色素還元酵素のメカニズムによってLMTに変換される割合は別である(Mayら、2003年)。この変換はpHに依存し、したがって製剤の放出時間にも依存すると推測される。MT+が小腸に到達した場合(放出が60分以上遅れた場合は顕著)、還元酵素が利用できないか不活性であり、MT+種の吸収には容量制限のある代替の活性キャリア媒介プロセスが必要であると推測される。MT+の吸収における用量依存性の食物干渉は、いずれかのステップ(胃での還元酵素ステップ、小腸での活性輸送ステップ、腸内腔での食物/脂肪との結合)が原因であると考えられる。