Community transmission and viral load kinetics of the SARS-CoV-2 delta (B.1.617.2) variant in vaccinated and unvaccinated individuals in the UK: a prospective, longitudinal, cohort study
www.thelancet.com/journals/laninf/article/PIIS1473-3099(21)00648-4/fulltext
Anika Singanayagam, PhD(アニカ・シンガナヤガム、博士
セラン・ハッキ博士
ジェイク・ダニング(博士) *
Kieran J Madon, MSc
Michael A Crone, MBBCh
Aleksandra Koycheva, BSc
概要
背景
SARS-CoV-2デルタ型(B.1.617.2)は感染力が強く、ワクチン接種率の高い地域を含めて世界的に広がっている。我々は、ワクチンを接種した人としていない人を対象に、地域社会におけるデルタ変異株の軽度感染者の感染とウイルス量の動態を調査することを目的とした。
調査方法
2020年9月13日から 2021年9月15日の間に、471人の英国COVID-19指標症例のコミュニティ接触者602人(英国のコントラクトトレーシングシステムで特定)を、Assessment of Transmission and Contagiousness of COVID-19 in Contactsコホート研究にリクルートし、最大20日間の毎日のサンプリングで8145個の上気道サンプルを提供した。5歳以上の家庭内接触者および非家庭内接触者は、インフォームド・コンセントを提供し、上気道の自己スワッブに同意できる場合に募集に参加した。疫学的につながりのあるデルタ変異株感染の指標となる162例の接触者231人を対象に、ワクチン接種の有無による感染リスクを分析した。完全にワクチンを接種したデルタ感染者(n=29)と、ワクチンを接種していないデルタ感染者(n=16)アルファ感染者(B.1.1.7;n=39)アルファ感染前の感染者(n=49)のウイルス量の推移を比較した。疫学解析の主要な結果は、接触者のワクチン接種状況と指標症例のワクチン接種状況で層別された家庭内接触者の二次攻撃率(SAR)を評価することであった。ウイルス負荷動態解析では,SARS-CoV-2の変異型とワクチン接種状況に応じて,参加者間のピークウイルス負荷,ウイルス増殖率,ウイルス減少率の違いを検出することを目的とした。
調査結果
デルタウイルスに感染した家庭内接触者の SAR は、完全にワクチンを接種した人では 25%(95% CI 18~33)であったのに対し、ワクチンを接種していない人では 38%(24~53)であった。完全にワクチンを接種した家庭内接触者の2回目のワクチン接種から研究参加までの期間(中央値)は、感染者(中央値101日[IQR 74-120])の方が非感染者(64日[32-97]、p=0-001)よりも長かった。完全にワクチンを接種した指標症例に接した家庭内接触者のSARは,ワクチンを接種していない指標症例に接した家庭内接触者と同程度であった(ワクチン接種者では25%[95%CI 15~35],ワクチン未接種者では23%[15~31]).完全にワクチンを接種した家庭内接触者31人のうち12人(39%)は、疫学的にリンクした完全にワクチンを接種したインデックスケースからの感染であり、さらにインデックスケースと接触者の3組のゲノムおよびウイルス学的解析により確認された。ピーク時のウイルス量は,ワクチン接種の有無や変異型によって差はなかったが,年齢とともにわずかに増加した(10歳から50歳までの間で,1mL当たりのピーク時log10ウイルス量の差は0-39[95%信頼区間-0-03~0-79]).完全にワクチンを接種したデルタ変異株感染者は,ワクチンを接種していないプレアルファ(0-69),アルファ(0-82),デルタ(0-79)変異株感染者に比べて,ウイルス量の平均減少速度(1日あたり1mLあたり0-95 log10コピー)が速かった(事後確率>0-84).また、個人内では、ウイルス量の増加が速いほど、ピーク時のウイルス量が多く(相関0-42[95%信頼区間0-13~0-65])減少が遅い(-0-44[-0-67~-0-18])という相関関係が認められた。
解釈の仕方
ワクチン接種は、デルタ変異株の感染リスクを低減し、ウイルスのクリアランスを促進する。それにもかかわらず、完全にワクチンを接種した感染者は、ワクチンを接種していない場合と同様のウイルス量のピーク値を示し、完全にワクチンを接種した接触者を含めて、家庭内で効率的に感染を伝播することができる。感染初期の宿主とウイルスの相互作用が、ウイルスの全軌跡を形成すると考えられる。
資金提供
国立保健医療科学院(National Institute for Health Research)。
はじめに
ワクチン接種の主な目的は、重症のCOVID-19感染症とその影響から個人を守ることであるが、SARS-CoV-2の伝播をどれだけ抑えられるかが、パンデミックを抑制する鍵となる。この結果は、ワクチンの感染防御能力と、ワクチン接種によってブレイクスルー感染症の感染力をどの程度低減できるかにかかっている。
研究の背景
本研究以前のエビデンス
SARS-CoV-2デルタ型は、ワクチン接種率の高い地域を含め、世界的に広がっている。ワクチン接種は、病気の重症度を弱め、死亡を防ぐという点では依然として高い効果があるが、デルタ型では感染に対するワクチンの効果が低下している。ワクチンを接種したデルタ感染者から、ワクチンを接種した人への感染の程度を明らかにすることは、公衆衛生上の優先事項である。デルタ感染の上気道(URT)ウイルス負荷動態を他の変異型のものと比較することで,デルタの感染性増加の潜在的なメカニズムを知ることができる.データベース開設から 2021年9月20日までに発表された論文を,”SARS-CoV-2, デルタ variant, viral load, and transmission “という検索語を用いてPubMedとmedRxivで検索した。ワクチン接種を受けた人と受けていないデルタ変異株感染者のURTを縦断的にサンプリングし、ウイルス負荷の動態を比較した研究が2件ある。シンガポールの入院患者コホートを対象としたレトロスペクティブ研究では、ワクチン接種を受けた人の方が、ワクチンを受けていない症例よりも、より急速なウイルス量の減少が認められた。しかし、この研究では、ワクチン未接種者は中等度から重度の感染症であり、これは長期にわたる排出と関連することが知られている。2つ目の研究は、米国のプロスポーツ選手を対象とした縦断的な研究である。この研究でも、ワクチンを接種した症例のデルタウイルスRNAのクリアランスは、ワクチンを接種していない症例よりも早かったのであるが、ワクチンを接種していない症例のうちデルタ変異株感染をしていたのは8%のみで、解釈が複雑になっている。最後に、ベトナムの医療従事者で発生したデルタ亜系の単一感染源による院内感染の報告では、ウイルス量の動態をプロットし(ワクチン未接種のデルタ感染とは比較していない)院内で完全にワクチンを接種した医療従事者の間で感染が発生したことを示している。したがって、本研究で得られた知見は、特定の環境や調査した異なるウイルス亜系統を超えて一般化できない可能性がある。
本研究の付加価値
SARS-CoV-2の感染の大部分は家庭内で発生しているが、このような環境下での完全にワクチンを接種した人同士の感染はこれまで示されていない。二次感染を高感度で確認するために、SARS-CoV-2のデルタ変異株に曝露された後、早期に地域社会にいるインデックスケースとその接触者(症状の有無は問わない)を縦断的に追跡し、14~20日間、URTサンプルに毎日定量的RT-PCRを実施した。その結果、完全にワクチンを接種した家庭内接触者の二次攻撃率は25%と高かったが、この値はワクチンを接種していない接触者のそれ(38%)よりも低かった。感染リスクは、ワクチンの2回目の接種から2~3カ月の間、時間の経過とともに上昇した。感染した接触者の割合は、指標となる症例のワクチン接種の有無にかかわらず同様であった。ワクチンを完全に接種した指標症例とその接触者の間で,デルタ変異株の伝播が数世帯で認められ,全ゲノム配列解析で確認された。ピーク時のウイルス量は,ワクチン接種の有無や変異型の種類によって差はなかったが,年齢とともにわずかに増加した。ワクチンを接種したデルタ型の症例は、ワクチンを接種していないアルファ型やデルタ型の症例よりもウイルス量の減少が早かった。このことは、感染初期の宿主とウイルスの相互作用が、ウイルスの軌跡全体を形成していることを示唆している。今回の結果は、現実の生活環境における地域の家庭内接触者から得られたものであるため、おそらく一般の人々にも一般化できるものと思われる。
入手可能なすべての証拠の意味するところ
COVID-19による重症化や死亡を防ぐためには、ワクチンは依然として非常に有効であるが、今回得られた知見は、長期にわたる曝露が行われる家庭環境では、ワクチン接種だけではデルタ変異株の感染を防ぐのに十分ではないことを示唆している。今回の結果は、高度にワクチン接種された集団における新しいSARS-CoV-2変異株の疫学的表現型を明らかにするための地域研究の重要性を強調するものである。ワクチン接種を受けた人であっても、デルタ型の感染を抑制するための公衆衛生上および社会的な対策を継続することが重要である。
ワクチン接種は,α型(B.1.1.7)の家庭内感染を40~50%減少させる効果があり1,ワクチン接種者の感染者は,ワクチン未接種者の感染者に比べて上気道(URT)のウイルス量が少なく,感染力が低下していることがわかっている2。インドで大パンデミックした後、英国はデルタ型の感染が急増していることを最初に報告した国の一つである。現在のワクチンは、デルタ型の感染による入院や死亡を防ぐのに高い効果を発揮している7。しかし、デルタ型の感染に対するワクチンの効果は、アルファ型に比べて低下しており8,9,ワクチン接種率が高い国でもデルタ型の感染は依然として高い負担となっている。ワクチンを接種した軽度の感染者からデルタ型が市中に伝播するリスクについてのデータは少ない。
この研究では、COVID-19感染が確認された患者の外来患者である近親者が、毎日、縦断的なURTサンプリングを受け、関連する臨床データおよび疫学データを収集した。本研究では、デルタ変異株の家庭内感染を定量化し、ワクチン接種の有無が接触者の感染リスクおよび指標となる症例の感染力に及ぼす影響を評価することを目的とし、(1)ワクチン未接種の接触者と指標となる症例がいる家庭、(2)完全にワクチンを接種した接触者と完全にワクチンを接種した指標となる症例がいる家庭を対象とした。また,非重症のデルタ,アルファ,プレアルファ SARS-CoV-2 感染者から順次採取した URT ウイルス RNA トラジェクトリーを比較し,SARS-CoV-2 の変異型の状態,およびデルタ感染の場合はワクチン接種の状態が感染可能性に及ぼす影響を推測した。
方法
研究デザインおよび参加者
ATACCCは、SARS-CoV-2感染者の地域住民との接触者を対象とした観察的縦断的コホート研究である。英国の接触者追跡システム(National Health Service Test and Trace)に通知されたPCRで確認された有症状の指標症例の接触者に、Public Health Englandから本研究への参加についての連絡を受ける意思があるかどうかを尋ねた。指標となる症例の症状が出てから5日以内に通知されたすべての接触者を、我々の募集定員内で連絡を取るように選択した。5歳以上の家庭および非家庭の接触者は、書面によるインフォームド・コンセントを提供し、URTの自己スワビングに同意することができれば、募集の対象となった。URTのサンプリングに関する詳細は、付録(p13)に記載されている。
ATACCC研究は、ATACCC1とATACCC2の2つの研究群に分かれており、SARS-CoV-2パンデミックの異なる波を捉えるように設計されている。ATACCC1では、グレーター・ロンドンにおけるアルファ・変異株およびプレアルファ症例を調査し 2020年9月13日から 2021年3月13日の間に接触者のみを募集した。ATACCC1では、プレアルファ波(2020年9月~11月)とアルファ波(2020年12月~2021年3月)が実施された。ATACCC2では、グレーターロンドンとボルトンにおけるデルタ変異株症例を調査するために特別に研究を再開し、インデックス症例とコンタクトの両方を2021年5月25日から9月15日の間にリクルートした。早期に西ロンドンとボルトンに焦点を当てたのは、これらの地域でデルタ・変異株の英国での発生率が最も高かったからである10。国と地域のサーベイランスデータに基づくと、今回の募集期間のほとんどにおいて、地域社会での感染は中程度から高程度であった。
この研究は,保健研究局の承認を得て実施された。登録前にすべての参加者から書面によるインフォームド・コンセントを得た。子どもについては、両親と介護者が同意した。
データ収集
登録時に研究チームが人口統計情報を収集した。世帯主以外の接触者の暴露日はPublic Health Englandから入手した。COVID-19の予防接種歴は、英国のNational Immunisation Management System、一般開業医の記録、および研究参加者の自己申告から決定した。参加者は、登録日の少なくとも7日前にCOVID-19ワクチンを1回も接種していない場合は未接種、登録日の少なくとも7日前にワクチンを1回接種している場合は一部接種、登録日の少なくとも7日前にCOVID-19ワクチンを2回接種している場合は完全接種と定義した。ワクチン接種の状態を定義するための7日間の閾値は、過去の文献を参考にして決定した。ワクチン接種から試験参加までの期間を算出した。WHO基準14 を用いて,試験参加日までの症状を定義した。インシデント症例(登録時にPCR陰性で、その後陽性となった参加者)の症状は、最初のPCR陽性結果が出た日から定義した。
検査手順
SARS-CoV-2の定量的RT-PCR、ORF1abとエンベロープ(E-gene)のサイクル閾値のウイルスゲノムコピーへの換算、全ゲノム配列の決定、および系統の割り当てについては、付録(p13-14)に記載した。
成果
疫学解析の主要項目は、接触者のワクチン接種状況と指標症例のワクチン接種状況で層別した家庭内接触者の二次感染率(SAR)の評価であった。ウイルス負荷動態解析では,α前型とα型とδ型に感染した参加者,ワクチンを接種していないδ型感染者とワクチンを接種したδ型感染者の間で,ピーク時のウイルス負荷,ウイルス増殖率,ウイルス減少率の違いを検出することを目的とした。
また,探索的解析として,ワクチンの有効性と,2回目のワクチン接種からの経過時間で層別したSARS-CoV-2の感染しやすさを評価した。
統計解析
ウイルスの動態をモデル化するために,疾患発症時のウイルス力15の単純な現象論的モデルを用いた。ウイルスの動態パラメータは,ベイジアン階層モデルを用いて参加者ごとに推定し,このモデルを全参加者について測定された逐次周期の閾値の全データセットに適合させた。指標となる症例の家庭内接触者ではなく、曝露日が特定されている19名の参加者については、曝露日の疑似無症候性データポイント(すなわち、ウイルスが検出されなかった)によってサイクル閾値データを補完した。検査の精度とモデルの不完全性については,(正規)誤差分布から観察結果が得られる確率をp,真の分布から得られる確率を1-pと仮定し,混合モデルを用いてモデル化した。
階層構造は、感染した変異株とワクチン接種状況に基づいて参加者をグループ分けすることで表現した。このモデルでは、ウイルスの動力学的パラメータは個人によって異なり、変異株やワクチン接種の有無によっては変化しないことを暗黙的に仮定している。また、グループ1,2,3,4がそれぞれpre-alpha、alpha、未接種のデルタ、完全接種のデルタを表す4グループモデルを検討した。参加者固有の動態パラメータ間の相関行列を当てはめ、ピークウイルス力価、ウイルス増殖率、ウイルス減少率にグループ内の相関があるかどうかを調べた。最初のモデル選択では,リーブワンアウト・クロスバリデーション法を用いて,ピークウイルス量を決定する個人レベルのパラメータと,ウイルス量の増加率および減少率との間の相関係数が適合する4群の階層モデルを選択した(付録P5).しかし、探索的分析の結果、参加者固有のピークウイルス量の推定値(増加率と減少率ではない)は、年齢と顕著かつ有意な相関を示したため、平均ピークウイルス量が年齢に応じて変化するモデルを検討することになった。最も予測性の高いモデルは、平均ウイルス量の増加率と減少率を4群間で変化させ、平均ピークウイルス量は全群共通で、年齢の対数に対して線形に変化すると仮定した(付録P5)。基準年齢である50歳のピークウイルス量を、95%信頼区間(95%CrI)とともに示した。基準年齢として50歳を選んだのは、全データセットの症例の年齢に典型的なものであり、基準年齢の選択によってモデルの適合性や群間の差の判定に違いはなかった。
グループレベルの母集団の平均値と,log peak viral titre,viral growth rate,viral decline rateのグループ内の平均値を計算した。これらの変数の事後推定値はグループ間で相関しているため,あるグループの推定値と別のグループの推定値の信頼区間が重なっても,必ずしもこれらのグループ間に有意差がないことを示すものではない.そこで我々は,これらの変数があるグループで他のグループよりも大きいという事後確率ppを計算した。我々のモデルでは、ベイズ係数はpp/(1-pp)として計算される。我々は,差の少なくとも中程度の証拠を示すものとして,0-75より大きい(ベイズ係数3以上に対応する)集団(群レベル)事後確率のみを報告する.
ワクチンの効果については,症状の有無にかかわらず,感染を予防する効果の推定値を定義し,家庭でのデルタを1-SAR(完全接種)/SAR(非接種)とした。
資金提供者の役割
本研究の資金提供者は,研究デザイン,データ収集,データ分析,データ解釈,および報告書の作成に関与していない.
試験結果
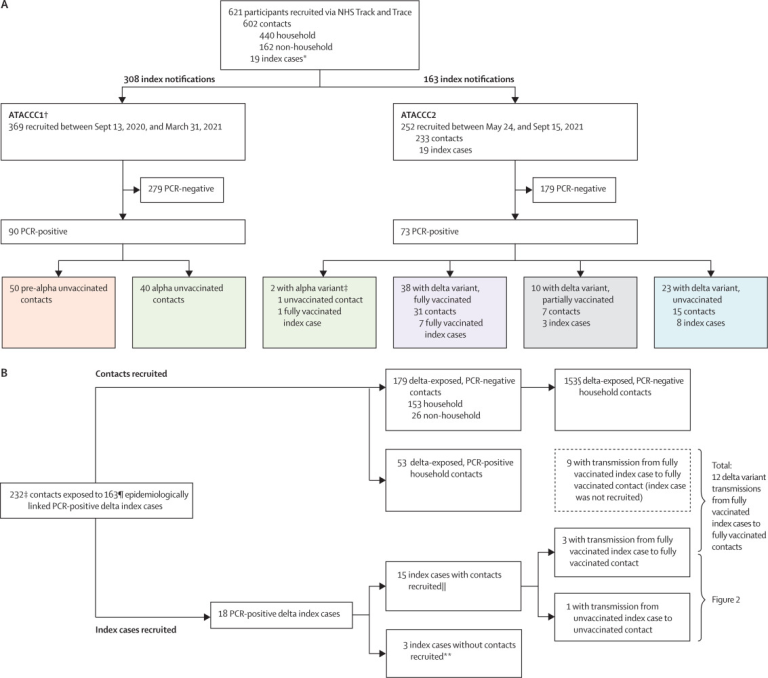
2020年9月13日から 2021年9月15日の間に、471件のインデックス通知を受けたコミュニティベースの参加者621人(接触者602人、インデックス症例19人)が、ATACCC1およびATACCC2研究に前向きに登録され、8145個のURTサンプルを提供した。このうち、ATACCC1では369人の接触者(308件のインデックス通知から生じた)ATACCC2では233人の接触者(163件のインデックス通知から生じた)と19人のインデックス症例が登録された。621名のうち163名(26%)からSARS-CoV-2のRNAが検出された。PCR陽性の症例の全ゲノム配列を解析した結果、71人がデルタ変異株に感染しており(インデックスケース18人、接触者53人)42人がアルファ変異株に感染しており(インデックスケース1人、接触者41人)50人がアルファ変異株以前に感染していることが確認された(すべての接触者、図1A)。
図1ATACCC研究参加者のリクルート、SARS-CoV-2感染、変異株状態、およびワクチン接種歴
PCR陽性者163名のうち、89名(55%)が女性、133名(82%)が白人であった。年齢の中央値は36歳(IQR 26-50)であった。性別、年齢、民族、BMI(body-mass index)分布、併存疾患の頻度は、年齢と性別を除き、デルタ、アルファ、アルファ以前の感染者、ワクチン接種者と未接種のデルタ感染者で同様であった(付録pp2-3)。ワクチン未接種の女性は男性よりも少なく(p=0-04)英国でのワクチン展開の年齢優先から予想されるように、デルタ型に感染したワクチン未接種者は有意に若かった(p<0-001;付録p3)。指標となる症例に感染してから研究に参加するまでの期間の中央値は4日(IQR 4~5)であった。参加者は全員、重度ではない外来患者か、無症候性であった。無症状の症例の割合は、完全にワクチンを接種した群、部分的にワクチンを接種した群、ワクチンを接種していないデルタ群で差はなかった(付録P3)。
試験登録前にCOVID-19ワクチンを接種していたプレアルファ感染者はおらず、アルファ感染者は1名のみであった。71名のデルタ感染者(うち18名がインデックスケース)のうち、23名(32%)がワクチン未接種、10名(14%)が部分接種、38名(54%)が完全接種であった(図1A;付録P3)。完全にワクチンを接種したデルタ感染者38名のうち、14名がBNT162b2 mRNAワクチン(Pfizer-BioNTech社)23名がChAdOx1 nCoV-19アデノウイルスベクターワクチン(Oxford-AstraZeneca社)1名がCロナバック不活化全ウイルスワクチン(Sinovac社)を接種していた。
233人のATACCC2接触者のうち、1人を除いて全員がデルタ型に曝露された可能性が高い。なぜなら、彼らはデルタ型の地域有病率が少なくとも90%、ほとんどが95~99%の時に募集されたからである(図1B)10。年齢、民族、BMI、喫煙状況、併存疾患の分布は、PCR陽性の接触者とPCR陰性の接触者の間で類似していた(付録P4)。完全にワクチンを接種したデルタ変異株感染者の2回目のワクチン接種から試験参加までの期間の中央値は74日(IQR 35-105,範囲16-201)で、PCR陽性の接触者はPCR陰性の接触者に比べて有意に長かった(それぞれ101日[IQR 74-120]対64日[32-97]、p=0-001,付録p4)。PCR陽性の接触者53人全員が家庭環境で曝露されており、デルタ変異株に曝露された家庭環境の接触者全員のSARは26%(95%CI 20~32)であった。ワクチン未接種者(38%,95%CI 24~53)は,ワクチン接種済みの家庭内接触者(25%,18~33)に比べてSARは有意に高くなかった(表1).家庭内でのデルタの感染(症状に関わらず)を予防するワクチンの効果は34%と推定された(ブートストラップ95%CI -15~60)。2回目のワクチン接種から試験参加までの期間を14日とし,完全接種とみなして感度分析を行ったが,ワクチンの有効性やSARの推定値に大きな影響はなかった(データは示されていない).サンプル数が少ないため精度には限界があるが,この推定値は,より大規模なデータセットに基づくデルタ変異株感染に対するワクチン効果の推定値とほぼ一致している9, 16, 17.
表1ATACCC2研究に募集されたデルタ感染指標症例の接触者におけるSAR
| 合計 | PCR陽性 | PCR陰性 | SAR(95%CI) | p値 | |
|---|---|---|---|---|---|
| 連絡先 | |||||
| 全て | 231 | 53 | 178 | 23(18–29) | NA |
| 完全ワクチン接種 | 140 | 31 | 109 | 22(16–30) | 0・16 |
| ワクチン未接種 | 44 | 15 | 29 | 34(22–49) | .. |
| 部分的にワクチン接種 | 47 | 7 | 40 | 15(7–28) | NA |
| 世帯の連絡先 | |||||
| 全て | 205 | 53 | 152 | 26(20–32) | NA |
| 完全ワクチン接種 | 126 | 31 | 95 | 25(18–33) | 0・17 |
| ワクチン未接種 | 40 | 15 | 25 | 38(24–53) | .. |
| 部分的にワクチン接種 | 39 | 7 | 32 | 18(9–33) | NA |
完全にワクチンを接種した症例とワクチンを接種していない症例とのSARの差のp値を算出するためにχ2検定を行った。ワクチン接種状況の情報を持たずに調査を辞退したPCR陰性の接触者1名を除外した。NA=該当なし。SAR=二次攻撃率。
デルタ変異株に曝露された家庭内接触者204人のうち、疫学的にリンクした138人のインデックスケースのワクチン接種状況がわかった(図1B、表2)。完全にワクチンを接種した指標症例に接した家庭内接触者のSARは25%(95%CI 15-35;69人中17人)であり、ワクチンを接種していない指標症例に接した家庭内接触者のSAR(23%[15-31];100人中23人;表2)と同様であった。PCR陽性の53人の接触者は、PCR陽性の39人の指標症例に家庭内で接触したことが原因であった。二次感染の原因となったこれらの指標症例のうち、完全にワクチンを接種していた人の割合(39人中15人[38%])は、ワクチンを接種していなかった人の割合(39人中16人[41%])とほぼ同じであった。指標症例が2回目のワクチンを接種してから、それぞれの接触者の募集日までの日数の中央値は73日(IQR 38~116)であった。接触者に感染させたインデックスケースとそうでないインデックスケースでは、時間間隔に差はなかった(それぞれ94日[IQR 62-112]、63日[35-117]、p=0-43)。
表2デルタ変異株に感染した家庭内接触者204人のうち、PCR陽性のインデックスケース138人のワクチン接種状況を比較した結果
| すべての世帯の連絡先(n = 204) | 完全にワクチン接種された連絡先(n = 125) | 部分的にワクチン接種された連絡先(n = 39) | ワクチン未接種の連絡先(n = 40) | ||||
|---|---|---|---|---|---|---|---|
| PCR陽性(n = 31) | PCR陰性(n = 94) | PCR陽性(n = 7) | PCR陰性(n = 32) | PCR陽性(n = 15) | PCR陰性(n = 25) | ||
| 完全にワクチン接種された発端者(n = 50) | 69 | 12 | 31 | 1 | 8 | 4 | 13 |
| 部分的にワクチン接種された発端者(n = 25) | 35 | 7 | 12 | 3 | 10 | 3 | 0 |
| ワクチン未接種の発端者(n = 63) | 100 | 12 | 51 | 3 | 14 | 8 | 12 |
家庭内被爆者以外の接触者(n=24,すべてPCR陰性)は除外した。PCR陰性の家庭内接触者のうち、ワクチン接種状況の情報なしに調査を辞退した1名を除外した。PCR陰性の家庭内接触者のうち、指標となる症例との関連付けができなかった1名も除外された。
* 以下の行は、各カテゴリーのインデックスケースにさらされた接触者の数を示している。
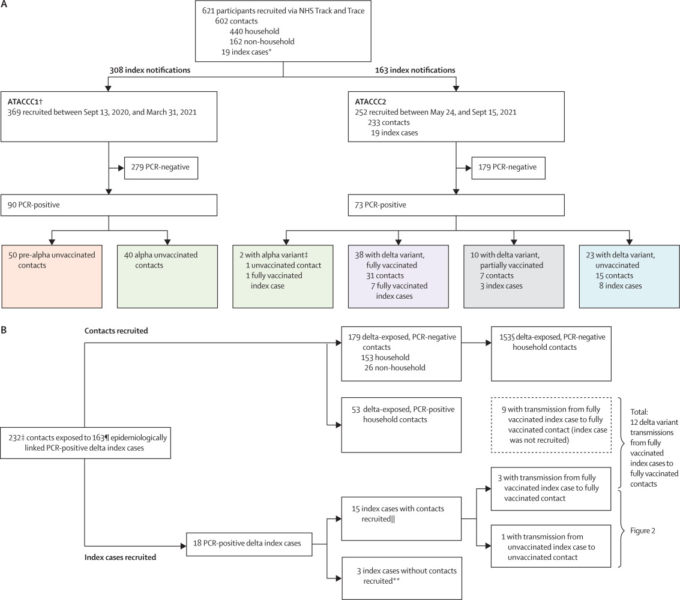
接触者登録につながった163人のデルタ変異株感染者のうち18人は、自らATACCC2にリクルートされ、連続URTサンプルが採取されたため、より詳細なウイルス学的・ゲノム学的解析が可能となった。このうち15人については、その連絡先も募集した(家庭内連絡先13人、家庭外連絡先2人)。これら15人の指標症例のうち4人について、対応するPCR陽性の家庭内接触者が同定された(図1B)。ゲノム解析の結果、これらの事例では、1つの例外を除き、指標となる接触者のペアは同じデルタ変異株のサブ系統に感染していた(図2A)。1世帯(番号4)では、ワクチンを接種していない指標症例が、ワクチンを接種していない接触者にデルタ変異株を感染させたが、部分的にワクチンを接種した別の接触者は、異なるデルタ亜系統に感染していた(これはおそらく世帯外で感染したものと思われる)。他の3世帯(番号1~3)では、完全にワクチンを接種した指標症例が、完全にワクチンを接種した家庭の接触者にデルタ亜系を感染させており、すべての症例でウイルス量が高く、ウイルス量の動態の時間的関係は指標症例からそれぞれの接触者への感染と一致していた(図2B)。
図2B SARS-CoV-2デルタ変異株(B.1.617.2)の家庭内感染を示すウイルス学的、疫学的、ゲノム学的証拠
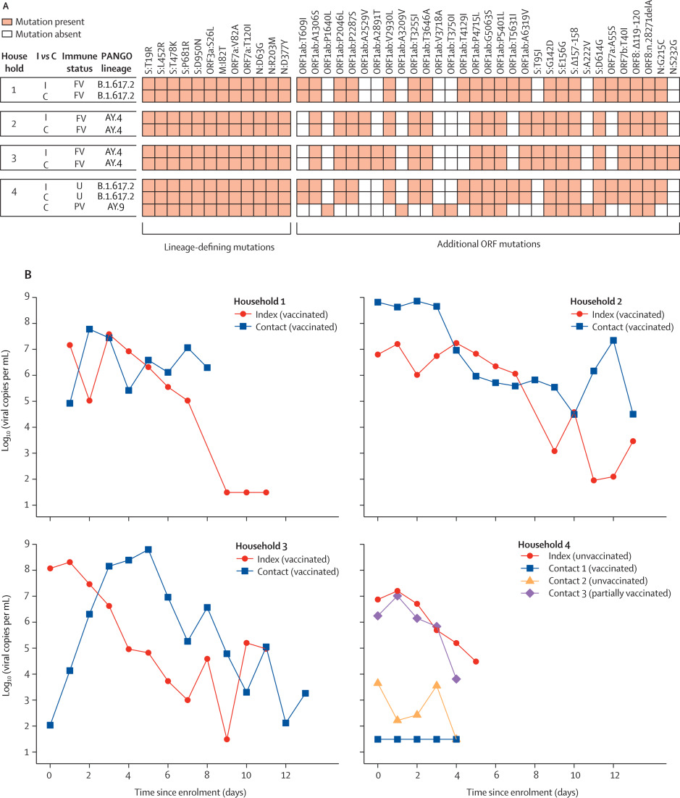
モデリング分析の対象基準は、PCR陽性の参加者163名のウイルス負荷RNA軌跡を選択した(プレアルファ変異株49名、アルファ39名、デルタ45名;付録P14)。デルタ45例のうち、29例は完全にワクチンを接種しており、16例はワクチンを接種しておらず、部分的にワクチンを接種した例は除外した。対象となった133例のうち、29例(22%)が偶発症例(すなわち、登録時にPCR陰性であったが、その後PCR陽性となった症例)104例(78%)が有病症例(すなわち、登録時にすでにPCR陽性であった症例)であった。有病者のうち15名は、明らかに解決可能なピークウイルス量を有していた。図3は、モデル化されたウイルスRNA(ORF1ab)の軌跡と、個々の参加者について測定されたウイルスRNAコピー数を示している。また、E-geneに相当するものを付録(p2)に示した。E-geneのサイクル閾値データ(付録p5,7,9,11)から得られた推定値は、ORF1abの推定値と同様であった。
図3プレアルファまたはアルファ変異株(ワクチン未接種)またはデルタ変異株(ワクチン接種およびワクチン未接種)の変異株に感染した133名の参加者における、ピーク前14日目からピーク後28日目までのORF1abのウイルス量の軌跡
図3α前またはα変種(ワクチン未接種)あるいはデルタ変種(ワクチン接種済みおよび未接種)に感染した133人の参加者におけるピーク前14日目からピーク後28日目までのORF1abウイルス量の軌跡
ウイルスの動態は、4つのグループのすべての症例で視覚的には類似しているように見えるが、推定されたウイルスの増殖率と減少率には定量的な違いがあることがわかった(表3,表4)。ORF1abサイクルの閾値データに基づく平均ウイルス量減少率の母集団(グループレベル)の推定値は、1mLあたり0-69-0-95 log10 units/daxes 4; appendix p 10)の範囲で変化しており、ウイルス量がピークから検出されなくなるまでには、典型的な10日間の期間が必要であることを示している。α群(pp=0-93)未接種のδ群(pp=0-79)完全接種のδ群(pp=0-99)では、α以前の群に比べて早い減少が見られた。また、完全接種のデルタ群の平均ウイルス量減少率は、α群(pp=0-84)および未接種のデルタ群(pp=0-85)よりも速かった。これらの減少率の違いは、ワクチン接種前のα群とワクチン接種後のδ群の減少期の平均期間に約3日の差をもたらした。
表3ORF1abサイクル閾値データから算出したα前、α、δ(未接種および完全接種)のVL成長率の推定値
VL成長率はサンプル内事後平均推定値で示した。残りの列は、その行の推定値が他のグループの推定値よりも小さくなる母集団(グループレベル)の事後確率を示す。事後確率は20,000個の事後サンプルから得られ、サンプリング誤差は0-01未満である。VL=viral load。CrI=信頼できる区間。
表4ORF1abサイクル閾値データから得られたプレアルファ、アルファ、デルタ(未接種および完全接種)症例のVL減少率の推定値
VL減少率はサンプル内事後平均推定値で示した。残りの列は、その行の推定値が他のグループの推定値よりも小さくなる母集団(グループレベル)の事後確率を示す。事後確率は20,000個の事後サンプルから得られ、サンプリング誤差は0-01未満である。VL=viral load。CrI=信頼できる区間。
ウイルス量の増加率は減少率よりも大幅に速く、グループ間で1日あたり2-69-3-24 log10 units/mLの範囲で変化し、ウイルス量が未検出からピークに達するまでには典型的な3日間が必要であることが示された。グループ間の増殖率の違いを推論する力は,ウイルス減少の場合よりも制限されていたが,ワクチン接種を受けたデルタグループの増殖率がpre-alphaグループよりも低いことを示す中程度の証拠(pp=0-79)があった。
50 歳の成人の平均ピークウイルス量は,1 mL あたり 8~14(95% CrI 7~95~8~32) log10 コピーと推定されたが,ピークウイルス量には変異やワクチン接種の有無による差はなかった。しかし、ピークウイルス量は年齢とともに増加すると推定され(log[年齢]に対するピークウイルス量の傾きが0以上であることをpp=0-96とした)log[年齢]の単位変化あたり0-24(95% CrI -0-02~0-49) log10 copies per mLの傾きがあると推定された。この推定値は、10歳と50歳の間のピーク時の平均log10コピー/mLの差が0-39(-0-03~0-79)であることに相当する。
グループ内の各被験者のウイルス量増加率の推定値は、ピーク時のウイルス量と正の相関があり、相関係数の推定値は0-42(95%CrI 0-13~0-65,付録P8)であった。したがって、ウイルス量の増加速度が速い人は、ピーク時のウイルス量が高い傾向にある。また、ウイルス量の減少率は、ウイルス量の増加率と負の相関があり、相関係数は-0-44(95% CrI -0-67〜-0-18)と推定され、ウイルス量の増加が早い人ほど、ウイルス量の減少が遅い傾向にあることが示された。
考察
19 デルタウイルスに感染した家庭内接触者のコホートでは、ワクチン未接種者のSARは38%、ワクチン接種済み者は25%であった。この所見は,COVID-19ワクチン接種による感染防御効果が知られていることと一致している8, 9.しかしながら,これらの所見は,ワクチン接種にもかかわらず家庭内接触者の感染リスクが継続していることを示している.ワクチン接種から研究参加までの期間は、PCR陽性の接触者がPCR陰性の接触者よりも有意に長かったことから、ワクチン接種後2~3カ月で感染しやすくなることが示唆され、これは防御免疫の減退と一致する。この重要な観察結果は,最近の大規模データと一致しており,さらなる調査が必要である17. デルタ感染の世帯SARは,ワクチン接種の有無にかかわらず26%(95%CI 20-32)であり,英国の全国サーベイランスデータの推定値(10-8%[10-7-10-9])よりも高かった10.しかし,本研究では,症状にかかわらず毎日接触者をサンプリングし,高感度で積極的に感染を確認した。対照的に,症状に基づく単一のタイムポイントでのサーベイランス検査は,おそらく真のSARを過小評価し,感染に対するワクチンの効果も過大評価する可能性がある.
完全にワクチンを接種したインデックスケースの家庭内接触者のSAR(25%)は、ワクチンを接種していないインデックスケースの家庭内接触者のSAR(23%)と同程度であった。この結果は、完全にワクチンを接種した人のブレイクスルー感染が、家庭内で効率的に感染を伝播することを示している。完全にワクチンを接種した指標症例と接触者の間で12件の家庭内感染が確認されたが、このうち3件については、指標症例と接触者が同じデルタ変異株亜系統に感染していたことがゲノムシークエンスによって確認されたため、疫学データやウイルス量動態の時間的関係を裏付けることができ、二次感染の決定的な証拠となった。我々の知る限り、完全にワクチンを接種した人の間でデルタ型ウイルスが伝播したことを報告した研究は他に1件あり、これはベトナムで特定のデルタ型ウイルス亜系統に感染した1人の医療従事者による点源的院内発生であった22。
曝露後早期(中央値4日)から最大20日間にわたって症例を毎日縦断的にサンプリングすることで、感染過程におけるURTウイルス量の高解像度の軌跡を得ることができた。現在までに、地域社会で軽度のSARS-CoV-2感染者を連続的に抽出した研究は2件あるが、これらは無症状のスクリーニングプログラムによって特定された非常に特殊な集団から得られたものである(例:大学職員および学生23,プロスポーツ選手24)。
ウイルス負荷動態の最も予測的なモデルでは,50 歳の成人の 1 mL あたりの平均ピーク log10 ウイルス負荷は 8~14(95% CrI 7~95~8~32)と推定されたが,これは日常的なサーベイランスデータを用いた 2021 年の研究による推定値と非常によく似ている25。ウイルス負荷のピーク値に,変異やワクチン接種の有無による違いを示す証拠は得られなかったが,年齢とともにピークウイルス負荷がわずかながら有意に増加する(pp=0~95)という証拠がいくつか報告されている。これまでに行われた小児と成人のウイルス量に関する研究4, 25, 26では、このような密度の高い連続したウイルス量のサンプリングは行われていないため、年齢に関連した差を明らかにする力は制限されていた。そのような研究の中で最も規模の大きい25件の研究では、小児と成人の間に今回推定した差と同様の差が報告されている。ウイルス量の減少速度は、ワクチンを接種したデルタ感染者が他のすべてのグループよりも速く、アルファ感染者とワクチンを接種していないデルタグループの人はアルファ感染前の人よりも速いことがわかった。
すべてのワクチン接種群において、ウイルス負荷動態パラメータの推定値の参加者間のばらつきは、グループ間で推定された平均パラメータのばらつきよりもかなり大きかった。完全にワクチンを接種した人とワクチンを接種していないデルタ感染者との間のウイルス動態の違いがそれほど大きくないことが、今回の研究でワクチンを接種したデルタインデックスケースからの感染率が比較的高いことの説明になるかもしれない。完全にワクチンを接種したデルタのインデックスケースのSARが、ワクチンを接種していないケースのSARよりも低いという証拠は見つからなかった。しかし、指標となる症例が日常的な症候性サーベイランスによって同定されたことを考えると、典型的な症候性を持たないワクチンブレークスルーの指標症例を同定することに選択バイアスがかかっていた可能性がある。
プレアルファ、アルファ、デルタの各変異株グループ間で見られたウイルス動態の違いは、SARS-CoV-2の進化に伴うウイルス動態の変化が、より迅速なウイルス除去に向けて少しずつ、しかし潜在的には適応的に変化していることを示唆している。本研究では、各変異型やワクチン接種群において、ウイルス増殖速度はピークウイルス量と正の相関があるが、ウイルス減少速度とは負の相関があるという初めての証拠を得た。この結果は、ウイルスの複製が最初に最も速い個人感染では、ピークウイルス量が最も高く、ウイルスのクリアランスが最も遅いことを示唆している。これらのデータは、SARS-CoV-2の初期増殖速度を決定する宿主およびウイルスの要因が、感染全体の軌道に基本的な影響を与えていることを示唆している。増殖速度が速いと、免疫反応による制御が(ウイルス量のピークとその後のウイルス量の減少の両方の観点から)困難になる。感染時に連続して採取された免疫マーカーを分析することで、感染動態の初期の違いの免疫的な相関関係を知ることができるかもしれない。また、ウイルス量の増加が最も速く、ピークが最も高い人は、地域社会の感染に不相応に貢献している可能性があり、この仮説は今後の研究で検証されるべきである。
日常的に入手可能なデータを用いたいくつかの集団レベルの単一時点のサンプリング研究では、デルタ変異株感染者のワクチン接種者と非接種者の間でサイクル閾値に大きな差がないことが判明している10, 27, 28。シンガポールの入院患者を対象としたレトロスペクティブコホート29でも、デルタ変異株のワクチン接種者と未接種者では、ウイルスの減少速度が速いことが報告されており、減少速度の差は今回の推定値よりもやや大きいと報告されている。しかし、この差は、シンガポールの研究では、ワクチン未接種者の重症度が我々の研究よりも高かった(約3分の2が肺炎、3分の1がCOVID-19による治療を必要とし、5分の1が酸素吸入を必要としていた)ことで説明できるかもしれないし、重症度の高い患者ではウイルス排出量が長くなることが報告されている30。また、この研究では、ワクチン接種者と非接種者の軌跡を比較し、増殖期とピークサイクルの閾値は類似しているが、ワクチン接種者の方がウイルスのクリアランスが早いことを報告している。しかし、米国で行われたこの研究では、ワクチン接種の有無とウイルスの種類を合同ではなく別々に層別化している。つまり、デルタ型に感染しているワクチン接種者は、主にアルファ型やアルファ型に感染しているワクチン未接種者と比較されているのである。さらに、サンプリングはプロスポーツ選手の職業健康診断プログラムの一環として行われたため、今回の結果は必ずしも典型的な地域感染を代表するものではない。
今回の研究には限界がある。第一に、本研究の募集は、日常的な接触者追跡通知に基づいて行われているため、症状のある指標症例の接触者のみを募集した。第2に、指標症例はPCR陽性の綿棒を持った最初の世帯員と定義したが、別の世帯員がすでに感染していて指標症例に感染している可能性も否定できない。第三に、ウイルス負荷の軌跡の記録は左打ち切りの対象となり、有病者との接触者(登録時にすでにPCR陽性)の成長期が一部の参加者で見逃されていた。しかし、今回の調査では、29例の感染者と15例の追加感染者がウイルス量の増加傾向にあったため、一部の参加者のウイルス量の増加率とピーク時のウイルス量に関する貴重な情報を得ることができた。第4に、英国のワクチン接種プログラムでは年齢が層別されているため、ワクチン未接種のデルタ変異株感染者の年齢は、ワクチン接種者の年齢よりも低かった。そのため、年齢が結果の交絡因子となっている可能性があり、考察したように、ピーク時のウイルス量は年齢と関連していた。しかし,ワクチン接種を受けていない接触者で観察された高いSARが,ワクチン接種を受けていないことよりも年齢の低さによって引き起こされたとは考えにくく,我々の知る限りでは,年齢の低下に伴ってSARS-CoV-2感染の感受性が高まることを示す証拠は公表されていない31。最後に、今回はウイルスの培養を行っていないが、これはRT-PCRよりも感染力の指標として優れている。他の2つの研究27, 32では、デルタ型に感染したワクチン接種者の約3分の2から培養可能なウイルスが検出されており、ワクチン接種者は、特に感染後早期にウイルス量が多くなり、ほとんどの感染が発生すると考えられる場合には、他の人に感染する可能性が残っているという我々の結論と一致している30。
今回の結果は、ワクチン接種率の高い地域でデルタ型が効果的に感染している理由を説明するのに役立つ。現行のワクチンはCOVID-19による重症化や死亡を防ぐのに有効であるが、今回の知見は、家庭内での感染が密接かつ長期にわたる場合、ワクチン接種だけではデルタ変異株の感染を完全に防ぐことはできないことを示唆している。ブースタープログラムや10代の子供へのワクチン接種により集団免疫を高めることで、現在は限られているワクチン接種による感染防止効果を高めることができるが、今回の分析では、重篤な結果を招くリスクのある個人をワクチン接種や非薬理学的介入により直接保護することが、デルタ型による疾病の負担を抑制するための中心的な役割を果たすことが示唆された。
このオンライン出版物は修正された。訂正版は2021年11月2日にthelancet.com/infectionに掲載された。
貢献者
AS、JD、MZ、NMF、WB、ALalが本研究のコンセプトを提案した。AS、SH、JD、KJM、AK、JLB、MGW、ND-F、RV、RK、JF、CT、AVK、JC、VQ、EC、JSN、SH、EM、TP、HH、CL、JS、SB、JP、CA、SA、NMFがデータの収集と調査を担当した。AS, SH, KJM, JLB, AC, NMF, ALalが正式なデータ解析を行った。MAC, AB, DJ, SM, JE, PSF, SD, ALacが実験を担当した。RV, RK, JF, CT, AVK, JC, VQ, EC, JSN, SH, EM, SEがプロジェクトを監督した。AS, SH, JD, KJM, JLB, NMF, ALalはデータにアクセスして検証した。JD、MZ、ALalが資金を獲得した。NMFはソフトウェアの開発と管理を担当した。ASとALalは原稿の初稿を書いた。AS, JD, GPT, MZ, NMF, SH, ALalが原稿のレビューと編集を行った。共著者は,本研究のすべてのデータにアクセスでき,出版物への投稿を決定する最終的な責任を負っている。
ATACCC研究の調査員
Anjna Badhan, Simon Dustan, Chitra Tejpal, Anjeli V Ketkar, Janakan Sam Narean, Sarah Hammett, Eimear McDermott, Timesh Pillay, Hamish Houston, Constanta Luca, Jada Samuel, Samuel Bremang, Samuel Evetts, John Poh, Charlotte Anderson, David Jackson, Shahjahan Miah, Joanna Ellis, Angie Lackenby.
データの共有
すべての結果を再現できるように、匿名化、非識別化されたデータセットをご要望に応じて提供する。モデリングコードは、GitHubリポジトリで公開される。
利益の宣言
NMFは、UK Medical Research Council、UK National Institute of Health Research、UK Research and Innovation、Community Jameel、Janssen Pharmaceuticals、Bill & Melinda Gates Foundation、Gavi(the Vaccine Alliance)からの助成金、世界銀行からのコンサルティング料、Wellcome Trustからの支払いまたは謝礼、WHOからの旅費、武田薬品のアドバイザリーボードへの参加、eLife誌のシニアエディターであることを報告している。その他の著者は、競合する利害関係がないことを表明している。
謝辞
本研究は,米国国立衛生研究所(NIHR200927),米国保健社会福祉省COVID-19 Fighting Fund award,NIHR Health Protection Research Units (HPRU) in Respiratory Infections and in Modelling and Health Economicsの支援を受けている。NMFはMRC Centre for Global Infectious Disease AnalysisおよびJameel Instituteからの資金提供を受けている。PSFとMACは,UK Dementia Research Instituteの支援を受けている。JDはNIHR HPRU in Emerging and Zoonotic Infectionsの支援を受けている。MGWはNIHR HPRU in Healthcare Associated Infections and Antimicrobial Resistanceの支援を受けている。GPTはImperial NIHR Biomedical Research Centreの支援を受けている。本研究に参加したすべての参加者、研究への参加を促してくれたPublic Health Englandのスタッフ、PCRおよびシーケンシングアッセイを実施してくれたVirus Reference Departmentのスタッフ、ワクチン接種データの分析に協力してくれたImmunisations Departmentに感謝する。また,ロジスティクス,データ入力,品質管理に携わっていただいたKristel Timcang,Mohammed Essoussi,Holly Grey,Guilia Miserocchi,Harriet Catchpole,Charlotte Williams,Niamh Nichols,Jessica Russell,Sean Nevin,Lulu Wang,Berenice Di Biase,Alice Panes,Esther Barrow,Lauren Edmundsに感謝する。インペリアル・カレッジ・ロンドンのMolecular Diagnostics Unit、特にLucy Mosscrop、Carolina Rosadas de Oliveira、Patricia Watberには、RNA抽出、定量的RT-PCR、およびシーケンス用サンプルの準備を行ってもらった。