Contents
Combating Neurodegenerative Diseases with the Plant Alkaloid Berberine: Molecular Mechanisms and Therapeutic Potential
www.ncbi.nlm.nih.gov/pmc/articles/PMC6712296/
要旨
神経変性疾患は、世界中の何百万人もの人々に影響を与える最も深刻な健康問題の一つである。このような疾患は、中枢神経系の神経細胞の変性や死滅が進行することによって特徴づけられる。現在のところ、神経変性疾患を治療したり、進行を食い止める治療法はない。
過去20年の間に、高い有効性と低い毒性を持つ天然物から単離された化合物の神経保護活性と抗神経変性活性に注目が集まっている。漢方薬草から単離されたイソキノリンアルカロイドであるベルベリンは、最も重要な病原性酵素の活性を阻害し、細胞内酸化ストレスを改善し、神経炎症を抑制し、オートファジーを誘発し、アポトーシス細胞死から神経細胞を保護することで、有望な抗神経変性剤として作用する可能性があることを示す証拠が蓄積されている。
本レビューでは、アルツハイマー病、パーキンソン病、ハンチントン病などの神経変性疾患に対するベルベリンの治療効果について、その分子機構に焦点を当てて、現在の知見をまとめてみたい。
キーワード
神経変性疾患、ベルベリン、神経保護、酸化ストレス、神経炎症、オートファジー
1. はじめに
ベルベリンは天然のイソキノリン系アルカロイドであり、ベルベリス(Berberisコプティス・チネンシス(Coptis chinensisペロデンドロン・アムレンセ(Phellodendron amurenseハイドラスティス・カナデンシス(Hydrastis Canadensis)などの各種薬草の根、根茎、茎、樹皮などに広く含まれている(図1 1 1)[1-5]。これらの植物は、2,000年以上も前から中国伝統医学(TCM)で様々な病気の治療に用いられてきた[6]。しかし、ベルベリンが単離され、これらのハーブの主要な薬理活性化合物として同定されたのは最近のことである[6]。ベルベリンは、抗微生物、抗炎症、抗酸化、低血糖、低脂血症、肝保護特性を含む幅広い薬理活性を有することが示されている[7,8]。下痢、潰瘍性大腸炎、胃炎、メタボリックシンドローム、2型糖尿病、多嚢胞性卵巣症候群、高コレステロール血症、高脂血症、非アルコール性脂肪肝疾患、心臓病などの治療に臨床試験が行われている[6-8]。
図1 ベルベリンの分子構造

動物を用いたベルベリンの薬物動態試験では,ベルベリンは腸壁に吸収されにくく,血中濃度が非常に低いことが示されているが,経口投与後のベルベリン及びその生理活性代謝物の濃度は,血中濃度よりも組織内濃度の方が高いことが明らかになっている[9-11]。Tanらは最近の研究で、ラットへの経口投与(200mg/kg)後のベルベリン及びその生理活性代謝物の組織分布を系統的に解析し、量の多い順に肝臓、腎臓、筋肉、肺、脳、心臓、膵臓、脂肪に速やかに分布していることを明らかにした[11]。肝臓でのベルベリン濃度は血漿中の10倍以上であり、経口投与後8時間後にピーク(68.19 ng/g)が観察された[11]。さらに,ベルベリンの主要な生理活性代謝物はベルベリン,タリフェンジン,ジャトロリジンであり,肝臓での代謝物のAUC(0-t)(濃度-時間曲線下面積)は血漿中の30倍であった[11]。ベルベリンとその代謝物の組織分布プロファイルは、ベルベリンのバイオアベイラビリティーの低さと薬理作用の不一致を少なくとも部分的に説明している。
最近では、ベルベリンは神経変性疾患に対する治療効果のために広範囲に研究されている[12-17]。蓄積されたエビデンスは、ベルベリンが正常な生理学的条件下で血液脳関門に浸透し、アルツハイマー病、パーキンソン病、ハンチントン病の細胞モデルと動物モデルの両方で神経保護効果を発揮することを示している[12-21]。ベルベリンの神経薬理学に関する最近の研究では、ベルベリンの神経保護特性は、最も重要な病原性酵素の活性を阻害し、細胞内酸化ストレスを減少させ、炎症反応を減衰させる能力によるものであると考えられている[22-30]。さらに、最近の研究では、ベルベリンがオートファジーを誘導することで、神経細胞内の有害な誤った折り畳みや凝集したタンパク質のクリアランスを促進することで、神経変性疾患にも対抗できることが示されている[31, 32]。本レビューでは、アルツハイマー病、パーキンソン病、ハンチントン病におけるベルベリンの効果の根底にある分子機構に焦点を当て、神経変性疾患に対するベルベリンの治療可能性に関する現在の知見をまとめようとしている。
2. ベルベリンとアルツハイマー病
アルツハイマー病は不可逆的な進行性の神経変性疾患であり、記憶力、認知能力、最終的には単純な日常業務を遂行する能力を徐々に蝕んでいく [33, 34]。認知症の最も一般的な原因であり、高齢者の認知症の60~80%を占めている[35]。国際アルツハイマー病協会(アルツハイマー病I)によると、現在、世界中で約4,400万人がアルツハイマー病または関連する認知症に悩まされており、世界的な高齢化の加速により、今後50年間でアルツハイマー病の影響を受ける人の数は4倍になると予測されている[35]。
過去30年間で、アルツハイマー病の病態生理学の理解に著しい進歩が見られたが、この病気の病因はまだほとんどわかっていない[36, 37]。これまでに、アルツハイマー病の病態に関して3つの主要な仮説(コリン作動性仮説、アミロイド仮説、タウ仮説)が提案されており、これらの仮説は、脳内神経伝達物質であるアセチルコリンの欠損、βアミロイド(アミロイドβ)の細胞外沈着、およびタウタンパク質の細胞内凝集が本疾患の病態生理に重要な役割を果たしていると仮定している[38-41]。これらの主要な仮説とは別に、神経炎症、酸化ストレス、高レベルの血清コレステロールもアルツハイマー病の病因に関与していることを示唆する証拠が増えている[42-46]。
この疾患には複数の病因因子が関与しているため、単一の神経毒性因子や経路のみを標的とした現在のアルツハイマー病治療戦略は不十分であることが証明されている[47]。したがって、アルツハイマー病の発症に関与する複数の因子を標的とした治療薬の開発を検討することは非常に価値のあることである[48-52]。最近、いくつかの証拠から、ベルベリンはアセチルコリンエステラーゼ(AChE)およびブチリルコリンエステラーゼ(BChE)阻害活性を含む複数の活性を有することから、アルツハイマー病と闘うための有望な多能性薬剤として作用する可能性が示唆されている。βサイトアミロイド前駆体タンパク質切断酵素1(BACE1)阻害活性、グリコーゲン合成酵素キナーゼ3(GSK-3)阻害活性、抗炎症活性、抗酸化活性、コレステロール低下活性[1,12-14,22-29]。
2.1. ベルベリンはコリン作動性障害を緩和し、神経伝達を改善する。
アセチルコリンは、これまでに同定された最初の神経伝達物質であり、コリンアセチルトランスフェラーゼという酵素によってシナプス前神経細胞でコリンとアセチルコエンザイムAから合成される [53, 54]。一旦放出されると、アセチルコリンはAChEおよびBChEによって急速に分解される [55,56]。30年以上前から、アルツハイマー病の病因は脳のアセチルコリン欠乏にリンクされている[38]。AChEおよびBChEの阻害は、コリン性欠損を緩和し、神経伝達を改善することにより、アルツハイマー病の効果的な管理のための重要なターゲットとして最近文書化されている[57-61]。その結果、3種類のコリンエステラーゼ阻害薬(ドネペジル、ガランタミン、リバスチグミン)が食品医薬品局(FDA)によって承認され、アルツハイマー病の対症療法のための最初の薬のグループを構成した[62-64]。最近では、ベルベリンが0.37~0.58mMのIC50値を示し、ガランタミン(0.59~0.62mM)に匹敵する有意なAChE阻害効果を示すことが多くの研究で示されている[14, 22, 23, 65, 66]。さらに、Jiらは計算薬理学的解析を行い、ベルベリンはFDA承認のアルツハイマー病治療薬Donepezilよりもはるかに高いDockスコアと高いAChE阻害活性を有していることを明らかにした[23]。これまでの研究では、ベルベリンのBChEに対する阻害作用は弱いとされていたが、最近の研究では、ベルベリンのBChEに対する強力な阻害作用が認められ、そのIC50値は3.44 mMであった[67]。AChEとBChEの強力なデュアル阻害剤として機能することに加えて、ベルベリンはまた、アルツハイマー病におけるアミロイドβとタウ病理の発症を予防または遅延させるためのアミロイドβとタウベースの治療薬の有望な候補として同定されている[22,26-28,32]。
2.2. ベルベリンはアミロイドβの生成と老人斑形成を抑制する
アミロイドβペプチドは、β-セクレターゼ(BACE1としても知られている)とγ-セクレターゼによるアミロイドβ前駆体タンパク質(APP)の逐次切断に由来するタンパク質分解産物であり、α-セクレターゼは、アミロイドβ配列内のAPPの代替切断を介してその生成を妨げる[68-70]。細胞外空間におけるアミロイドβの漸進的な蓄積と凝集は、アルツハイマー病の特徴的な病変の一つである老人性プラークの形成を導く[71-73]。したがって、アミロイドβの生成および/または凝集を阻害することは、アルツハイマー病の合理的な治療戦略であるべきである[74, 75]。蓄積されたエビデンスは、ベルベリンがAPP処理を調節することによりAβペプチドの産生を減少させ、Aβ凝集を阻害することによりアミロイド線維形成を防止できることを示唆している[26, 28, 32, 76, 77]。浅井らは、スウェーデン型APPを安定的に発現するヒト神経膠腫H4細胞におけるアミロイドβのレベルを、ベルベリン投与により効果的に低下させ、そのIC50は約5μMであったと報告している[76]。さらに、この減少は、β-セクレターゼ(BACE1)活性のダウンレギュレーションとα-セクレターゼ活性のアップレギュレーションの両方を介してベルベリンによって調節され、APPの処理がアミロイド原性経路から非アミロイド原性経路へとシフトすることを示した[76]。スウェーデンのAPPを発現するHEK293細胞を用いて、Zhuらは、ERK1/2経路の活性化を介してBACE1の発現を阻害することで、ベルベリンがアミロイドβの産生を減少させることを示した[78]。MEK1/2アンタゴニストであるU0126を用いてERK1/2を阻害すると、アミロイドβとBACE1の両方に対するベルベリンの効果を廃止することができた[78]。Zhangらによる最近の研究では、AMP活性化プロテインキナーゼ(AMPK)経路もベルベリンによって調節されたアミロイドβの代謝に関与していることが明らかになった。AMPKの活性化を介して、ベルベリンはBACE1の発現をダウンレギュレートし、神経芽腫細胞や初代培養ニューロンにおけるアミロイドβの生成を抑制した[79]。最近、ベルベリンのAPP処理およびアミロイドβ誘導神経毒性の調節に対する有効性が、いくつかの生体内試験モデルでさらに検証された [26, 28, 80]。Al-マルトール誘発性アルツハイマー病ウサギモデルを用いて、Panahiらは、ベルベリン治療がBACE1の活性を有意に低下させ、海馬を変性から保護し、化学的に誘発されたアルツハイマー病様の行動異常を回復させることを示した[28]。同様に、Haghaniらは、前頭前野にアミロイドβを両側から注射してアルツハイマー病のラットモデルを作成し、アミロイドβ誘発性認知障害と神経毒性に対するベルベリンの効果を調査した[80]。その結果、ベルベリンの投与は、海馬錐体ニューロンの電気生理学的特性だけでなく、学習、記憶、および電気生理学的特性へのアミロイドβの影響を抑制することで、アミロイドβによって誘発される神経毒性を改善する可能性が示唆された[80]。さらに、最近の研究では、Durairajanらは、ベルベリンの慢性投与がアミロイドβの沈着を減少させるだけでなく、よく特徴付けられたアルツハイマー病のトランスジェニックマウスモデル(TgCRND8マウス)でタウの高リン酸化、グリア症、認知障害を改善したことを実証した[26]。また、これらの効果は主にPI3K/Akt/GSK3シグナル伝達経路を介したAPP処理の調節によって達成されたことを発見した[26]。ベルベリンを投与すると、PI3K/Aktが活性化され、その後、グリコーゲン合成酵素キナーゼ3(GSK3)がリン酸化状態の調節を介して不活性化され、その結果、p-APPとアミロイドβのレベルが低下することがわかった[26]。
2.3. ベルベリンはタウの高リン酸化と神経原線維のもつれ形成を抑制する。
ベルベリンの阻害標的として、GSK3はAPPの処理を調節し、アミロイドβの産生に影響を与える重要な役割を果たしているだけでなく、タウの高リン酸化にも寄与しており、正常なタウタンパク質のペアらせん状フィラメントや神経原線維のもつれへの変換をもたらし、これはアルツハイマー病のもう一つの特徴的な病変である[81-83]。タウのリン酸化状態は、プロテインキナーゼとプロテインホスファターゼのバランスのとれた作用の結果であるため、グリコーゲン合成酵素キナーゼ3β(GSK-3β)の過剰活性化および/またはプロテインホスファターゼ2A(PP2A)の阻害がタウの高リン酸化を誘導することが頻繁に報告されていることは驚くに値しない[84-88]。最近の研究では、Yuらはタウを発現するHEK293細胞をPP2AおよびPP1の強力な阻害剤であるカルキュリンAで処理し、タウ過リン酸化におけるベルベリンの役割を調べるためにタウ症の細胞モデルを作成した[89]。彼らは、カルキュリンA治療はPP2Aを阻害するだけでなく、GSK3βをTyr216上でリン酸化し、Ser9上で脱リン酸化することでGSK3βを活性化し、その後、複数の部位でのタウの過リン酸化を引き起こしたことを示した[89]。ベルベリンは、PP2A活性の回復とGSK3β活性化の反転を介して、カルキュリンAによるタウの高リン酸化と細胞毒性を有意に減衰させた[89]。これらの知見と一致するように、Liuらは、ベルベリンがTyr307上のPP2Aのリン酸化を逆転させることでPP2A活性の低下を回復させ、その結果、カルキュリンAによって誘導されたタウの高リン酸化と軸索輸送障害を緩和したと報告している[16]。
3. ベルベリンおよびパーキンソン病
パーキンソン病(PD)は、世界で約700万人が罹患している第2位の有病率を誇る神経変性疾患である [90-92]。パーキンソン病の4つの主要な運動症状があり、頭字語TRAPの下にグループ化される。安静時の震え、硬直、アキネジア(またはブラジキネジアおよび姿勢不安定 [93,94]。さらに、パーキンソン病はまた、運動機能低下、認知障害、自律神経障害および睡眠障害を含むいくつかの非運動機能障害を引き起こす可能性がある [95,96]。パーキンソン病の主な症状は、黒質のドーパミン作動性ニューロンが選択的に消失し、α-シヌクレイン蛋白質の異常な蓄積により、残りのニューロンの多くにレビー小体が形成されることに起因することが示唆されている[97-105]。パーキンソン病の病態生理については比較的多くの知見が得られているが、この疾患の病因はいまだに不明である [106-108]。その病態の理解が不十分なため、パーキンソン病の進行を止めたり、逆行させたりする治療法は存在しない[106-108]。
現在行われている治療法のほとんどは、脳内のドーパミンレベルを回復させることによって、パーキンソン病の症状を緩和することに限られており、この点ではレボドパ、ドーパミンアゴニスト、モノアミン酸化酵素B(MAO-B)阻害薬が第一選択薬として用いられている[109-113]。レボドパはドーパミンの代謝前駆体であり、血液脳関門を通過することができるが、ドーパミン自体は通過できない[114]。中枢神経系に入ると、レボドパはドーパミン作動性ニューロンに取り込まれ、3,4-ジヒドロキシフェニルアラニン(DOPA)デカルボキシラーゼによってドーパミンに変換される[114]。レボドパの投与は、線条体のドパミン作動性神経伝達を一時的に回復させ、パーキンソン病の症状を緩和させる [115]。この緩和は、シナプス後線条体ドーパミン受容体を直接活性化する化合物であるドーパミンアゴニストによっても達成され、ドーパミン産生の必要性をなくすことができる[116]。モノアミン酸化酵素(MAO)は、ミトコンドリア酵素の一族であり、ドーパミンやセロトニンなどのモノアミン神経伝達物質の酸化的脱アミノ化を触媒する [117-120]。MAOは2つの異なるサブタイプ、MAO-AおよびMAO-Bから構成され、これらは2つの異なる遺伝子によってコードされ、異なる基質および阻害剤特異性を有する [118, 119]。線条体では、MAOの優勢な形態はMAO-Bであり、ヒトの脳における全MAO活性の約80%を構成している[118, 119]。MAO-Bはドーパミンを分解するので、それを阻害するとドーパミンの作用が延長され、パーキンソン病の症状が改善する [120-122]。実際、セレギリンやラサガリンなどのMAO-B阻害薬は、運動症状の治療に有効であり、初期のパーキンソン病においてレボドパの必要性を遅らせることが示されている[123-128]。しかし、化学的に合成された薬剤の望ましくない副作用のため、天然物ベースのMAO-B阻害剤を探索することは、パーキンソン病の安全な治療のために大きな価値があるだろう[129]。
3.1. ベルベリンはドーパミンの分解を減少させ、神経毒誘発性ドーパミン神経細胞死を防ぐ
MAO-Aの阻害は抗うつ活性と関連しているが、MAO-Bの阻害はパーキンソン病の発症を遅らせたり、症状を緩和したりすることが証明されている[130]。最近の研究では、ベルベリンがMAO-AとMAO-Bの両方に対して阻害活性を示すことが明らかになっている[23, 131-133]。Leeらは、ベルベリンのMAO-Bに対する阻害効果を評価し、IC50値が98.2μMに達した[131]。同様の結果は、従来のベンジルアミン(基質)法と代替の LED 蛍光(基質なし)法を用いた Castillo らによって得られ、それぞれ 98.4 μM と 90 μM の IC50 値を報告している[132]。さらに、ベルベリンのMAO-Bに対する阻害作用の分子基盤を明らかにするため、Jiらはドッキングシミュレーションを用いてベルベリンとMAO-Bの結合様式を調べた[23]。その結果、ベルベリンのMAO-Bに対する理論的な結合定数は66μMと推定され、実験値に非常に近い値が得られた[23]。さらに、ベルベリンのMAO-Bへの結合は、静電相互作用ではなく、疎水性相互作用によって主に駆動されることが示された[23]。これらの知見は、ベルベリンがMAO-Bに対する抑制効果を介して、ドーパミンの分解を抑制し、パーキンソン病の症状を緩和する可能性が少なくとも部分的にあることを示している。
いくつかの試験管内試験および生体内試験の研究により、パーキンソン病に対する治療薬としてのベルベリンの可能性と限界を概観することができる[15, 134]。Baeらは、パーキンソン病の試験管内試験モデルを用いて、パーキンソン病を誘発する神経毒である6-ヒドロキシドパミン(6-OHDA)によって誘導される細胞死から、ベルベリンがドーパミン作動性ニューロンを保護することを実証している[134]。さらに、Kimらは、1-メチル-4-フェニル-1,2,3,6-トレラヒドロピリジン(MPTP)マウスモデルを用いて、ベルベリンの生体内試験神経保護効果を研究した。彼らの研究では、ベルベリンがMPTPによって誘発された黒質のドーパミン作動性ニューロンの死や線条体の繊維の喪失を防ぐことで、運動バランスや協調性を改善することが示唆されている[15]。また、ベルベリンは海馬のアポトーシスを抑制することで、MPTP誘発性の短期記憶障害を緩和することも実証されている[15]。これらの研究は、ベルベリンをパーキンソン病に対する治療薬として利用する可能性に光を当てている[15, 134]。ベルベリンは一般的にヒトへの使用は安全と考えられているが、韓国のShinらの研究では、パーキンソン病のラットモデルにおける慢性的なL-DOPA-ベルベリン併用療法の副作用について懸念が提起されていることは言及に値する[135]。以前の研究では、ベルベリンがPC12細胞における6-OHDA誘発細胞毒性を悪化させ、6-OHDA損傷ラットの黒質部におけるドーパミン作動性神経細胞の変性につながったと主張している[136]。ベルベリンは6-OHDAまたはMPTP誘発性のドーパミン作動性ニューロン喪失を保護し、海馬のアポトーシスを抑制することが示唆されている他の研究[15, 134]とは一致しないが、パーキンソン病の治療にベルベリンを単独または併用した場合の潜在的な副作用や限界を評価するためには、さらなる研究が必要である。
4. ベルベリンとハンティングトン病
ハンチントン病(HD)は遺伝性の神経変性疾患であり、不随意運動、認知障害、精神障害を特徴とする [137,138]。HDの世界的な有病率は10万人あたり5~10例と推定されているが、民族や地理的な場所によって大きく異なり、発生率が最も高いのは西ヨーロッパで、最も低いのはアジアである[139]。この病気の原因はかなり最近まで明らかにされなかった[140-142]。現在では、HDは主にハンチンチン(HTT)と呼ばれる遺伝子の2つのコピーのいずれかの常染色体優性突然変異によって引き起こされることが明らかになってきている[143-146]。HTTは、エクソン1に異なる数のCAGトリヌクレオチドリピートを持つ多くの多型を持っているため、その構造は可変的である[147]。CAGトリヌクレオチドはアミノ酸グルタミンのコドンであるので、CAGのストリングはポリグルタミン(ポリQ)トラクトの産生をもたらす[147]。健常者におけるグルタミンリピートの長さは6~35である[148]。ポリQトラクトが36回以上のグルタミンリピートに拡大すると、HTTタンパク質のフォールディングミス、凝集、神経細胞死を引き起こし、ハンチントン病を引き起こす[149]。さらに、HDの発症年齢はpolyQトラクトの長さと反比例することが明らかにされている[150, 151]。病原性閾値を超えると、polyQ管の長さとHD発症年齢との間に強い負の相関があることがわかった[150, 151]。
最近の研究では、HDの進行とオートファジー-リソソソーム経路の欠陥との間に直接的な相関関係があることが示唆されていることは注目に値する[152-154]。マクロオートファジー(一般にオートファジーと呼ばれる)は、ユビキチン-プロテアソームシステム(UPS)が処理できない小器官やタンパク質凝集体などのより大きな構造物を分解するための必須の恒常性プロセスである[155-156]。このプロセスの間、標的とする細胞質の構成要素は、オートファゴソームと呼ばれる二重膜構造に封じ込められ、エンドソームやリソソームと融合し、それらの内容物が分解されリサイクルされることを可能にする[155-156]。オートファジーは、アルツハイマー病(変異タウ)やPD(変異a-シヌクレイン)に関連する細胞内凝集体を形成しやすいタンパク質を除去するための主要なクリアランス経路であることが実証されている[157-165]。さらに、最近の研究では、オートファジー-リソソソーム経路もまた、凝集体を起こしやすい変異型ハンチンチン(polyQ-HTT)のクリアランスにおいて重要な役割を果たしていることが示唆されている[152-154]。複数の独立した証拠から、HDの進行中にオートファジーが障害されることが示されている [152-154]。オートファジーの誘導は、ショウジョウバエやマウスのHDモデルにおいて、polyQ-HTT凝集体のクリアランスを促進し、変異型ハンチンチン媒介の毒性を緩和する [166-168]。これらの知見は、HDや関連するタンパク質のミスフォールディング障害を治療したり、進行を遅らせたりするための新しい戦略として、オートファジーモジュレーターを開発するための強力な根拠を提供している[169]。興味深いことに、ベルベリンは有望なオートファジー活性化剤であることが判明した。Jiangらは、トランスジェニックHDマウスモデルを用いて、ベルベリンがオートファジーを有意にトリガーしてポリQ-HTT凝集体を除去し、その結果、HDマウスの神経学的表現型を著しく改善することを示した[31]。
5. ベルベリンの一般的な神経保護作用
5.1. ベルベリンはオートファジーを誘発し、有害凝集タンパク質のクリアランスを促進する
近年、ベルベリンは、肝臓、腎臓、乳房、心筋、マクロファージ、肺、ニューロン細胞を含む幅広い細胞型において、オートファジーの強力な引き金となることが明らかになっている[31, 32, 170-189]。ベルベリンはオートファジーを促進する効果があり、ラットの心肥大モデルにおいて左室リモデリング、心機能障害、心筋細胞のアポトーシスを減衰させることができる[175, 176]。オートファジーのレベルをアップレギュレートすることで、ベルベリンはまた、マクロファージにおける酸化低密度リポタンパク質(ox-LDL)誘発性炎症を抑制し、アテローム性動脈硬化症の治療における治療の可能性を提供することができる[177-180]。また、ベルベリンは、PI3K/Akt-mTORシグナル伝達カスケードを阻害することでオートファジーを刺激し、動物モデルにおいて肺線維化の程度を有意に減少させることが報告されている[181]。さらに、ベルベリンには抗腫瘍作用があり、アポトーシスだけでなく、オートファジーの誘導を介して、がん細胞に対する特定の化学療法剤や放射線治療の効果を高めることが示唆されている[182-189]。
最新の研究では、Jiangらは、細胞およびHDの動物モデルにおける毒性ポリQ-HTTの蓄積に対するベルベリンの効果を調べた[31]。その結果、エクソン1に120個のCAGリピートを含む変異型HTTをトランスフェクトしたHEK293細胞と、ポリQトラクトに82個のグルタミンリピートを含む変異型HTTを発現させたトランスジェニックHDマウスの両方において、ベルベリンはオートファジーを有意にアップレギュレートしてポリQ-HTTを除去できることが示された[31]。オートファジーによる polyQ-HTT 凝集体のクリアランスは、HD マウスの神経学的表現型を有意に改善し、回転運動性能、筋力、運動協調性、寿命が大幅に改善された [31]。
さらに、APP/tau/PS1トリプルトランスジェニックマウスを用いたADモデルでは、Huangらは、ベルベリンはまた、オートファジーを誘発し、ADマウスの海馬におけるアミロイドβクリアランスを促進することを示した。彼らはさらに、ベルベリンは、おそらくクラスIII PI3K/ベクリン-1経路[32]の誘導を介してトリプルトランスジェニックADマウスの脳内のオートファジーを高めることを示した。興味深いことに、多くの研究がオートファジーがAMPK/mTOR経路の活性化によって引き起こされることが示されているが、Zhangらは最近、ベルベリンがBACE1の発現を減少させ、mTORシグナル伝達[79]には影響を与えず、ちょうどAMPKを活性化することを介して、アミロイドβの生成を阻害することを実証した。
これらの知見は、ミスフォールドタンパク質が原因である他の神経変性疾患におけるベルベリンの治療的役割の解明を目的とした更なる研究を促進するものである[32, 174, 178]。
5.2. ベルベリンの神経炎症抑制作用
神経炎症は神経組織の炎症である。神経炎症は、外傷性脳損傷、微生物感染、毒性代謝物、自己免疫、および加齢など、さまざまな要因によって開始される可能性がある [190-192]。引き金となる事象が異なるにもかかわらず、神経炎症の共通の特徴は、ミクログリアおよびアストロサイトの慢性的な活性化である [193,194]。疾患のある中枢神経系(中枢神経系)では、ミクログリアとアストロサイトが劇的に活性化され、様々な炎症促進性メディエーターや神経毒性サイトカインを分泌し、神経細胞にさらなるダメージを与えることで、神経細胞のダメージと神経炎症の悪循環を自己増殖させ、神経変性疾患の慢性的な進行に寄与している[195-197]。神経炎症を抑制することで神経細胞の損失が減少するという仮説が立てられており、この仮説は非ステロイド性抗炎症薬(NSAIDs)の長期使用が神経変性疾患の発症率を有意に低下させるという観察結果によって支持されている[198-200]。
最近では、ベルベリンが神経炎症を抑制することが実証され、炎症性関連中枢神経疾患の薬物候補として考えられるようになった[201-205]。Namらは、ベルベリンがラット脳ミクログリアの炎症性活性化を抑制するために、プロ炎症性サイトカイン、一酸化窒素(NO)核内因子κB(NF-κB)活性を抑制する効果があることを明らかにしている[201]。さらに、ベルベリンは、AMPKシグナル伝達経路の活性化を介して、BV-2ミクログリア細胞において、誘導性一酸化窒素合成酵素(iNOSシクロオキシゲナーゼ2(COX-2腫瘍壊死因子-a(TNF-aインターロイキン(IL)-1β、IL-6などの炎症性メディエーターやサイトカインの産生を、LPSやインターフェロン-gによって誘導される産生に対しても有意な抑制効果を示すことが示されている[202, 203]。これらの知見と一致するように、Jiaらは、ベルベリン投与により、マイトジェン活性化プロテインキナーゼ(MAPK)およびNF-κBシグナル伝達経路を阻害することにより、マウス初代ミクログリア細胞およびBV2ミクログリア細胞株において、アミロイドβ誘導性炎症反応が抑制されることを発見している[204]。最近の研究では、Chenらは、ベルベリンが白血球の浸潤、ミクログリアの活性化、炎症性メディエーターの産生を阻害することで、外傷性脳損傷(外傷性脳損傷)誘発の神経細胞障害を軽減することを示している[205]。
5.3. ベルベリンは酸化ストレスを改善する
蓄積されたデータは、酸化ストレスが神経変性の発症と進行に重要な役割を果たしていることを示している[206-208]。酸化ストレスの状況下では、過剰な量の活性酸素種(ROS)および/または活性窒素種(RNS)が脂質の過酸化、タンパク質の酸化、タンパク質の硝酸化、および糖酸化を引き起こし、その結果、神経組織における細胞膜の損傷、細胞骨格の破壊、および核酸の突然変異を引き起こす[209, 210]。近年、神経変性疾患に対抗するための抗酸化化合物の利用が注目されている[211-214]。
ベルベリンは強力で多様な抗酸化活性を有することが報告されている[215-226]。ベルベリンは、NADPHオキシダーゼの触媒サブユニットであるgp91phoxの発現を阻害することで、リポ多糖類(LPS)刺激ヒト単球由来マクロファージの細胞内スーパーオキサイドレベルを効果的に低下させることができる[227]。また、ベルベリンは、iNOSの発現をダウンレギュレーションすることにより、LPS処理したマウスマクロファージにおけるNO産生を減少させることも示されている[228]。さらに、ベルベリンはまた、スーパーオキシドジスムターゼ(SOD)カタラーゼ、グルタチオンSトランスフェラーゼ(GST)およびグルタチオンペルオキシダーゼ(GSH-Px)を含むいくつかの抗酸化酵素の活性を試験管内試験および生体内試験の両方で回復させることができることが明らかになった[229, 230]。
Hsuらは、運動ニューロン様細胞株NSC34を用いて、ベルベリンの試験管内試験神経保護効果を調べた。彼らは、ベルベリンが過酸化水素による細胞毒性からNSC34細胞を保護することを発見した。それは、活性酸素産生を抑制し、GSHとSOD活性を回復させるだけでなく、抗酸化タンパク質である核エリスロイド2関連因子2(Nrf2)とヘムオキシゲナーゼ1(HO-1)を活性化させることによっても行われた[231]。さらに、ベルベリンの高グルコース誘発性酸化ストレスやSH-SY5Y細胞の神経細胞損傷に対する保護機構を検討した。ベルベリンは、PI3K/Akt/NRF2/HO-1依存性の細胞保護・抗酸化経路を活性化することで、高グルコース誘発性の活性酸素産生、核凝縮、神経細胞死を少なくとも部分的に効果的に改善することが明らかになった[232]。以上の研究により、ベルベリンは強力な抗酸化分子であることが確認されており、神経変性疾患の治療効果が期待されている。
5.4. ベルベリンはアポトーシスから神経細胞を保護する
多くの研究で、ベルベリンが様々な癌細胞においてアポトーシスを誘導することが報告されているが[233, 234]、様々な種類の正常細胞[235-243]、特に神経細胞[244-256]において、ベルベリンが酸化ストレス、高グルコースストレス、虚血・再灌流誘発性アポトーシスの抑制に重要な役割を果たしていることを示すエビデンスが蓄積されている。
Kimらは、パーキンソン病のMPTPマウスモデルを用いて、ベルベリンが抗アポトーシスタンパク質Bcl-2をアップレギュレートし、プロアポトーシスタンパク質Baxをダウンレギュレートすることを実証した[246]。その結果、パーキンソン病を持つマウスの黒質細胞におけるドーパミン作動性神経細胞の死を防ぐことで運動バランスや協調性を高め、海馬における神経細胞の損傷やアポトーシスを抑制することで短期記憶障害を改善した[246]。また、ベルベリンは、CA1領域の錐体ニューロンのアポトーシスを減衰させ、ストレプトゾトシン(STZ)糖尿病ラットの学習および記憶障害を改善することが示されている[247]。
さらに、ベルベリンは試験管内試験および生体内試験モデルにおいて、神経細胞のアポトーシスを抑制することで、虚血性脳損傷に対する神経保護効果を示している[248-255]。ベルベリンは、細胞内活性酸素の発生を抑制したり、PI3K/Akt/GSK3βやJNKのシグナル伝達経路を調節することで、神経学的転帰を改善し、虚血/再灌流(I/R)誘発の神経細胞死を抑制することが報告されている[248-255]。低酸素誘導因子1α(HIF-1αカスパーゼ9,カスパーゼ3の活性を低下させ、Bcl-2/Bax比を増加させ、その結果、カスパーゼ依存性および非依存性のアポトーシス経路を抑制することが示唆されている[248-255]。さらに、Zhangらによる最近の研究では、ベルベリンが低酸素/虚血誘発性の脳損傷を改善するための前処理刺激としても作用することが示唆されている[256]。これらの知見は、神経変性疾患と闘うためのベルベリンの新たな視点を提供するものである。
結論と今後の展望
神経変性疾患は、世界中の何百万人もの人々に影響を及ぼす最も深刻な健康問題の一つである [257]。このような疾患は、中枢神経系のニューロンの進行性の変性および/または死によって特徴づけられる [258]。現在のところ、神経変性疾患を治療する、あるいは進行を食い止める治療法はない[259]。過去20年の間に、高い有効性と低い毒性を有する天然物から単離された化合物の神経保護活性と抗神経変性活性に注目が集まっている[260-263]。蓄積されたエビデンスは、漢方薬草から単離されたイソキノリンアルカロイドであるベルベリンが、有望な抗神経変性剤として作用する可能性を示唆している。
ここでは、ベルベリンのアルツハイマー病、パーキンソン病、ハンチントン病への作用を支える分子機構に焦点を当て、神経変性疾患に対するベルベリンの治療可能性に関する現在の知見をレビューした。これまでの研究をまとめると、ベルベリンは、主にいくつかの重要な病原性酵素(AChE、BChE、BACE1,GSK-3,MAO-Bなど)の活性を阻害し、細胞内酸化ストレスを改善し、神経炎症を抑制し、アポトーシス細胞死を抑制することで、神経保護効果を発揮することが明らかになっている。また、ベルベリンは、オートファジーを誘導することで、神経細胞内の有害なミスフォールディングや凝集したタンパク質のクリアランスを促進することで、神経変性疾患と闘うことができる(図2 2)。また、ベルベリンは、下痢、代謝障害、心血管疾患、2型糖尿病、多嚢胞性卵巣症候群、高コレステロール血症、高脂血症、非アルコール性脂肪肝疾患などの治療薬として長年にわたり臨床試験が行われており、一般的に臨床現場で使用される用量では、細胞毒性、遺伝毒性、変異原性は検出されておらず、有効性・安全性が高いと考えられている[264-275]。さらに、ベルベリンは経口投与が可能であり、血液脳関門を容易に通過することができる[276]。
図2 アルツハイマー病、PD、HDに対抗するベルベリンの能力の根底にある共通かつ明確な分子機構
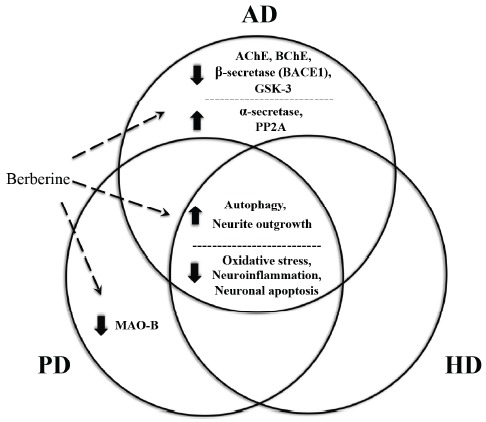
過度の酸化ストレス、神経炎症、アポトーシス、不十分なオートファジーは、神経変性疾患によって共有されている共通の病理学的特徴であり、共通してベルベリンによって標的とすることができる。さらに、ベルベリンは、AChE、BChE、BACE1,BACE1,GSK-3およびMAO-Bを含む、AD、PDおよびHDにおけるいくつかの重要だが異なる病原性酵素の活性を阻害することができる。
ベルベリンの臨床試験は、下痢、メタボリックシンドローム、糖尿病、うっ血性心不全、放射線誘発性急性腸症状を含むいくつかの疾患で実施され、死亡率はゼロであり、消化器系への副作用はない、または軽微であるという安全性のプロファイルが強調されているが、中枢神経系疾患に対するベルベリンの臨床試験はまだ行われていない[277-281]。本レビューにまとめられた広範な前臨床データは,近い将来,神経変性疾患に対するベルベリンの臨床試験を実施するための説得力のある根拠となるはずである。一方、ベルベリンの臨床応用は、経口投与後の消化管吸収性やバイオアベイラビリティーの低さから大きく制限されており、これらの障壁を克服できる新規な剤形のベルベリンが必要とされている。最近、ベルベリンのナノテクノロジーによる薬物送達アプローチは、薬物の薬物動態性能と目的とする結果を改善することが示されている[282-286]。今後の研究では、臨床現場でのベルベリンおよび/またはその誘導体のバイオアベイラビリティ、薬理活性、有効性および選択性を向上させるために、ベルベリンの異なるタイプのナノ粒子およびナノフォーミュレーションの試験にも焦点を当てるべきである。
