Contents
- 要旨
- 背景
- 脳血管疾患(心血管疾患)は重度のCOVID-19に多い
- SARS-CoV-2はヒトの脳に感染する
- COVID-19で見られる脳虚血障害の種類は、認知機能の低下や認知症の主な原因となっている。
- アンジオテンシン変換酵素2介在性SARS-CoV-2のヒト細胞への侵入および古典的レニン-アンジオテンシン系の活性化
- COVID-19における古典的レニン-アンジオテンシン系活性化の増加の潜在的な神経学的帰結
- アルツハイマー病および血管機能障害の確立された危険因子であるAPOE ε4はCOVID-19の危険因子でもあるのか?
- COVID-19におけるADAM-17の潜在的なアップレギュレーション
- COVID-19患者における治療的介入のための臨床管理、臨床試験および将来の可能性のあるターゲット
- 結論
Cognitive impact of COVID-19: looking beyond the short term
www.ncbi.nlm.nih.gov/pmc/articles/PMC7772800/
オンラインで公開2020年12月30日
スコット・マイナーズ、共著者パトリック・G・ケーホー、セス・ラブ共著者
要旨
COVID-19は主に呼吸器疾患であるが、入院患者の3分の2までが中枢神経系(CNS)の損傷を示している。虚血性障害のうち、どの程度が中枢神経系血管系に対するウイルスの直接的または炎症性の影響によって媒介され、どの程度が頭蓋外心肺疾患の二次的なものであるかは明らかではない。
限られたデータでは、原因となるSARS-CoV-2ウイルスは鼻粘膜や嗅覚線維を介して、あるいは血行性の伝播によって中枢神経系に侵入し、内皮細胞、周皮細胞、おそらくはニューロンに感染する可能性があることが示唆されている。頭蓋外では、SARS-CoV-2は内皮細胞およびペリサイトを標的とし、内皮細胞の機能不全、血管漏出および免疫活性化を引き起こし、時には播種性の血管内凝固を引き起こす。脳血管系の内皮細胞およびペリサイトが同様に標的とされるかどうかは確認されていない。
COVID-19のいくつかの側面が認知に影響を及ぼす可能性がある。COVID-19では、脳白質は特に虚血性障害を受けやすく、認知機能にも決定的に重要である。脳低灌流がアミロイドβ(アミロイドβ)蓄積を促進し、タウおよびTDP-43病理と関連しているという証拠が蓄積されており、また、セリン129でのα-シヌクレインのリン酸化を誘導することで、虚血はレビー小体型疾患の発症リスクを高める可能性もある。
COVID-19に対する現在の治療法は、呼吸機能のサポート、血栓症の予防、および免疫活性化の低減に焦点を当てているのは理解できる。
アンジオテンシン変換酵素(ACE)-2はSARS-CoV-2の受容体であり、ACE阻害薬およびアンジオテンシン受容体拮抗薬はACE-2の発現を増加させることが予測されているため、それらの使用がCOVID-19を悪化させるのではないかと当初危惧されていた。しかし、最近のメタアナリシスでは、これらの薬剤は防御的であることが示唆されている。これはおそらく、SARS-CoV-2の侵入がACE-2を枯渇させ、アンジオテンシンII-ACE-1を介した古典的なRAS活性化のバランスを崩し、血流低下を悪化させ、炎症を促進させるからであろう。
COVID-19のリスクが高いと思われるAPOE ε4個体もまた、ACE-2活性が最も低いことが関係しているかもしれない。COVID-19は、かなりの数の生存者に長期的な神経学的合併症という予期せぬ遺産を残す可能性がある。COVID-19患者の認知的フォローアップは、特に急性期に脳血管障害や神経学的合併症を発症した患者において重要であると考えられる。
キーワード
COVID-19,SARS-CoV-2,脳卒中、白質虚血、アンジオテンシン変換酵素2,アンジオテンシン変換酵素阻害薬、アンジオテンシン受容体拮抗薬、認知障害、認知症
背景
重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)によるCOVID-19は、主に呼吸器疾患であるが、脳を含む他の臓器を損傷する能力を持っている。重症急性呼吸器症候群(SARS)および中東呼吸器症候群(MER)ウイルス[1-3]と同様に、SARS-CoV-2は脳を標的としており(レビュー[4])増加する症例報告およびコホート研究は、COVID-19患者における重大な神経学的障害を示している(レビュー[5])。非特異的脳症(頭痛、錯乱、見当識障害)を含む中枢神経系(CNS)の病変は、中国の武漢で53/214人(25%)の入院患者で初めて報告された[6]。ヨーロッパでの最近の研究では、中枢神経系の関与率が高いことが報告されている。フランスの研究では58人の入院患者の69%、英国の最近の調査では精神病や神経認知の変化を含む精神状態が変化した125人の患者の31%であった[8]。最近の報告では、退院した43人の患者の33%に「不注意、見当識障害、または命令に応じた不十分な組織化された動きからなる性機能不全症候群」がみられたと報告されている[7]。さらに、回復したCOVID-19患者の3ヵ月後の追跡調査では、神経放射線学的に脳の微細構造の損傷と機能的完全性の破壊の証拠が示されている[9]が、重症化したCOVID-19患者の長期的な神経学的影響の可能性を示唆している(レビュー[10] )。急性脳血管疾患(心血管疾患)は、典型的には虚血性脳卒中を呈するが、時として脳内出血(ICH)を呈することもあり、COVID-19の重要な臨床的特徴として浮上してきている([5]で検討)。また、脳幹病変を伴う脳炎の症例報告も複数ある([5]のレビューを参照)。神経学的症状を伴う中枢神経系の病変は、高齢で重症のCOVID-19患者ではより頻繁にみられる [6]。SARSおよびMERSにおける神経学的合併症の最小有病率に基づいて、Ellulら[5]は、当時報告された480万人のCOVID-19症例のうち、1805~9671人が中枢神経系合併症を発症したと推定している。
ヒトコロナウイルスは中枢神経系を標的とし、直接的な神経毒性または宿主免疫応答の活性化によって損傷を引き起こすことが知られている[1]。SARS-CoV-2の脳血管障害を引き起こす傾向は、多巣性脳虚血または出血の累積的な破壊的効果だけでなく、脳内皮および血液脳関門(BBB)機能障害や脳内のプロ炎症性サイトカインのアップレギュレーションなど、心血管疾患の慢性的な感染後合併症を介して、慢性的な脳障害のリスクを大幅に増加させる[11]。海馬の萎縮を伴う長期的な認知機能の低下と神経変性 [12] は、重症敗血症に伴う全身性炎症を合併することが以前に報告されている [13, 14]。COVID-19患者によくみられる臨床症状である急性呼吸窮迫症候群(ARDS)は、認知機能の低下と神経変性とも関連している[15, 16]。COVID-19患者の長期追跡調査は、COVID-19による長期的な神経学的および精神医学的影響の程度と有病率を明らかにするために、詳細な認知評価を含むCOVID-19患者の長期追跡調査が重要である[17]。
このレビューでは、COVID-19と認知症に共通する病態生理学的プロセスと危険因子について、特に脳血管疾患の役割とレニン・アンジオテンシン系(RAS)の関与に焦点を当てて議論する(表1)。我々は、SARS-CoV-2感染が、特に脳血管疾患を基礎疾患とし、糖尿病や高血圧などの高リスクの併存疾患を有する人において、後に認知症を発症するリスクを増加させる可能性があるかどうかを検討している。
表1 COVID-19患者における認知症を含む慢性神経疾患のリスク増加に寄与する病態生理学的プロセス
| 参考文献 | |
|---|---|
| 1.心肺疾患に続発する低酸素症および脳低灌流 | [ 25、26 ] |
| -低酸素性虚血性脳損傷、びまん性白質損傷 | |
| 2.脳血管の血栓性閉塞を伴う凝固障害 | [ 22 ] |
| -脳動脈血栓症、播種性血管内凝固症候群 | |
| 3.脳の微小血管の損傷と機能障害 | [ 23、24 ] |
| -内皮炎、周皮細胞の損傷、BBBの漏出、神経血管の機能障害、自己調節の障害、血管/傍血管のドレナージの障害 | |
| 4.レニン-アンギオテンシン系の調節不全 | [ 125 – 127、160、161 ] |
| -規制RASの喪失と古典的なRASシグナル伝達の過活動 | |
| 5. SARS-CoV-2脳炎/感染後脳炎(まれ) | [ 27、28、38 ]、[レビュー5] |
| -嗅神経線維または血管系/ 中枢神経系への感染後の免疫損傷を介した中枢神経系ウイルスの神経浸潤 |
脳血管疾患(心血管疾患)は重度のCOVID-19に多い
SARSやMERSとは異なり、COVID-19患者は急性心血管疾患の発症リスクが高い。これまでの研究では、COVID-19で入院した患者の2~6%が心血管疾患に罹患していることが示されている([5]を参照)。スペインのコホートでは、1683人の患者のうち23人(1.4%)が心血管疾患を発症し、脳虚血が74%、ICHが23%を占めている[18]。神経学的合併症を有するCOVID-19患者の中でも、報告されている心血管疾患の発症率ははるかに高い。イタリアの神経内科病棟に入院した56人の患者の77%で急性心血管疾患と診断された[19]。COVID-19の神経学的および/または精神医学的障害を有する153例のCOVID-19患者を対象とした最近の英国全体を対象とした調査では、完全な臨床データセットが利用可能なほとんどの患者(125例中62%)が脳血管障害を有していたのに対し、脳症では31%であった;心血管疾患を有する患者のうち、74%が虚血性脳卒中、12%がICH、1%が中枢神経系血管炎を呈していた [8]。これらの研究のほとんどに共通しているのは、高齢の患者では、より重篤な疾患を伴う心血管疾患が多く、高血圧、糖尿病、基礎疾患である脳血管疾患などの併存疾患を持つ患者では心血管疾患が多いということである[20]。しかし、COVID-19を有する若年成人でも大血管脳卒中が報告されている[21]。
COVID-19における心血管疾患の病態生理はまだ完全には解明されていない(図1)。炎症誘発性播種性血管内凝固(DIC)は、多くの場合、肺塞栓症を合併しており、神経血管合併症を有する患者の高い割合で報告されており、COVID-19,特に若年健康成人において、ほとんどの急性心血管疾患イベントの主な原因となっている可能性が高い[22]。最近のレビュー[23]では、COVID-19患者のARDSにおけるDIC形成に寄与する、局所的な内皮細胞機能不全、血管漏出、および制御されていない免疫活性化を含む多くの経路が強調されている。カリクレイン-ブラジキニン系の活性化は、血流の減少、白血球の勧誘を媒介する接着分子のアップレギュレーション、血小板および好中球の活性化、炎症および免疫モニタリングの増加につながり、すべてCOVID-19患者の血管障害(および肺損傷)に寄与する可能性がある。SARS-CoV-2はまた、複数の組織の血管床の内皮細胞を標的にして感染することが示されている[24]が、脳血管系の内皮細胞も同様に標的にされるかどうかは確認されていない。
図1 COVID-19の脳血管障害の機序
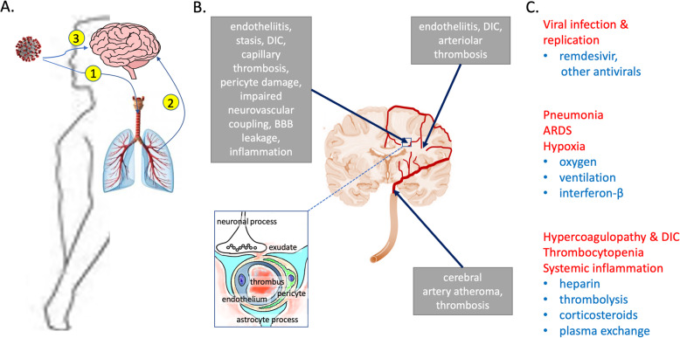
a ウイルスは吸入(1)および肺感染後の血行性伝播(2)または鼻粘膜および嗅神経線維を介して中枢神経系に到達する(3)。呼吸器および心血管機能の低下による低酸素虚血性脳障害に加えて、ウイルスは大血管脳卒中、多発性小梗塞および出血の病巣、びまん性虚血性白質障害および浮腫を引き起こす可能性がある。c すでに、COVID-19の脳血管障害を予防または改善するためのかなりの進歩がなされている。アプローチのいくつかを以下に列挙する。
これまでのほとんどの研究では、COVID-19に関連する主要な神経学的合併症に血管機能障害と虚血障害が関与していることが示唆されている。18例のCOVID-19患者の死後の神経病理学的検査では、すべて大脳と小脳に影響を及ぼす急性低酸素性虚血性脳障害を呈しており、2例の脳ではまれに血管周囲炎症の病巣が認められたが、中枢神経系内でのウイルスの説得力のある証拠は認められなかった[25]。死亡したCOVID-19患者の死後24時間以内の剖検脳のMRイメージングにより、2例では出血の病巣を含む白質の変化が、別の1例では後可逆性脳症症候群の証拠が明らかになった [26]。COVID-19患者では、神経細胞およびアストロサイト傷害の血漿中マーカー(ニューロフィラメント軽鎖タンパク質およびグリア線維性酸性タンパク質)が上昇し、疾患の重症度と関連していた [27]。著者らは、脳損傷と虚血および炎症過程との関係を評価するためにはさらなる研究が必要であると結論づけた。未回答の主な問題は、中枢神経系実質または血管系に対するウイルスの直接的な影響(ウイルスが中枢神経系から除去された後も持続すると予想される損傷)によってどの程度の損傷が媒介されているか、免疫活性化によって媒介される間接的な中枢神経系血管損傷がどの程度であるか、そして呼吸器系および心血管系に対するウイルスの頭蓋外作用による二次的な低酸素虚血損傷がどの程度であるかということである。
SARS-CoV-2はヒトの脳に感染する
SARS-CoV-2抗原とRNAの両方がヒトの死後の研究で脳組織内に検出されており、抗原は主に髄質および頭蓋下部神経内で検出されている[28]。SARS-CoV-2は、ウイルス性脳炎患者の脳脊髄液から検出され[29]、剖検ではCOVID-19脳組織の神経内皮細胞および毛細血管内皮細胞で観察された[30]。これらの観察結果は、特にウイルスRNAのPCR検出に使用されるCt値が高いことと、ウイルス様粒子の電子顕微鏡的解釈が困難であることを考えると、さらなる研究で確認する必要がある。嗅球を介した逆行性の軸索輸送は、無神経症に伴う神経侵入の可能性があるが、ウイルスの中枢神経系への侵入には大脳血管系がより重要な役割を果たしていると考えられる。SARS-CoV-2の主要な受容体であるACE-2は、全身の内皮細胞 [31] および周皮細胞 [32] で高度に発現しており、公開されているデータベースの解析により、ACE-2は脳でも発現していることが示されている [33]。
脳内のACE-2 mRNAのレベルは明らかに低いにもかかわらず[34-37]、SARS-Cov-2は、誘導多能性幹細胞由来のヒト神経幹細胞および前駆細胞、神経球、脳内オルガノイドを持つ皮質ニューロン(これらはすべてACE-2を発現している)に感染する[38-41]。これらのデータは、mRNAレベルが脳内のACE-2タンパク質や酵素活性を反映している必要はないことを示唆しているが、情報の一部(例えば[38-41])はプレプリントサーバーでのみ公開されていることを指摘しておきたい。我々や他の人は、ヒトの死後脳の脳血管系内でACE-2を免疫組織化学的に検出している[38, 42]とBetsholtz研究室による事前発表された研究は、ACE-2が脳周皮細胞にも濃縮されていることを示している[43]。ACE-2に加えて、SARS-CoV-2の他のドッキング受容体として、Basigin(BSG、CD147)(preprint [44])およびニューロピリン(NRP1)(preprint [45])が同定されており、これらは内皮細胞およびペリサイトで高度に発現している[46]。これらの受容体は、ACE-2と並んで、あるいはACE-2とは別個に、ウイルスの侵入や疾患の発症に重要な役割を果たしている可能性がある(レビュー[46])。
アルツハイマー病を含む様々な疾患状態における脳内皮の活性化は、BBBを越えた免疫細胞の接着、結合および通過を担当しているインテグリンおよびセレクチンの発現の増加と関連している。これは、好中球、単球、リンパ球を含む免疫細胞による脳組織への浸潤をもたらし、疾患の病因に寄与する(レビュー[47])。COVID-19の肺および他の組織における内皮の活性化および炎症性細胞の浸潤を考慮すると、脳内皮の活性化および免疫細胞による浸潤もまた、多くの患者における神経学的障害に寄与していると考えられるが、これもまだ確定されていない。
ペリサイトは微小血管の基底膜内に位置する粘膜細胞であり[48]、BBB [49]の完全性を維持するために内皮細胞とコミュニケーションをとり、血流[50]と神経血管の結合、内皮細胞のトランスサイトーシス[51]、および血管新生[52]といった本質的な血管機能を調節している。マウス心臓 [32, 53] および脳 [54-56] のトランスクリプトーム解析は、周皮細胞が高レベルの ACE-2 を発現していることを示しており、したがって SARS-CoV-2 の標的となる可能性が高いことを示している。入院した4人のCOVID-19患者の肺生検では、毛細血管壁の肥厚に加えて、肺胞毛細血管の周皮細胞の被覆率が劇的に低下していることが明らかになった[57]。周皮細胞の変性とその結果としての内皮シグナルとホメオスタシスの破綻は、COVID-19の血管不安定性に重要な寄与をしていると考えられる [32]。周皮細胞欠損マウス(Pdgfrbret/ret)では、血小板凝集と凝固を促進するvon Willebrand factorのレベルが上昇しており、COVID-19患者では周皮細胞の欠損が血管新生反応に寄与していることが示唆されている[43]。これらの研究は、COVID-19における病態生理のメディエーターとしての周皮細胞機能不全を暗示している。神経学的症状を呈するCOVID-19患者において、脳内のペリサイトが退化するか、機能不全になるかはまだ知られていない。
最近の研究では、SARS-CoV-2の神経侵襲性のさらなる証拠が得られている[38]。著者らは、ヒトの脳内オルガノイド内の神経細胞へのACE-2依存性感染、および隣接する感染していない細胞での低酸素様代謝変化と損傷を実証した。SARS-CoV-2に感染したマウスの脳内でヒト化ACE-2を実験的に発現させると、大脳皮質全体に血管リモデリングが生じ、死亡率が大幅に上昇した。著者らは3人のCOVID-19患者の脳組織を調べたところ、SARS-CoV-2スパイクタンパクが微小梗塞に隣接する小血管の皮質壁内で免疫組織化学的に検出されたことを報告した。また、一部の皮質神経細胞でスパイク蛋白の免疫染色陽性が認められたことも報告されている。しかし、これらの所見を確認する必要がある。
COVID-19で見られる脳虚血障害の種類は、認知機能の低下や認知症の主な原因となっている。
認知症の既往はCOVID-19で最も重要な危険因子(併存疾患)の1つである。英国のOpenSAFELYプラットフォームにおける英国の医療記録のレトロスペクティブ評価では、既存の認知症/脳卒中との関連でハザード比2.16(完全調整モデル)が示された [58]。英国のバイオバンクのコミュニティ研究では、オッズ比3.07が認知症と関連していた [59]。認知症の既往がある患者のリスクと死亡率の増加の理由はよく検討されている[60]。おそらく広く知られていないのは、COVID-19で見られる脳損傷のタイプ自体が認知機能低下や認知症の主な原因となっているということである。
虚血性脳損傷は血管性痴呆(血管性認知症)の病理学的プロセスの定義であり、脳卒中は痴呆の主要な危険因子である[61, 62]。DICの主な合併症である脳血管の血栓塞栓性閉塞は、認知障害や認知症を含む広範な神経学的障害を引き起こす可能性がある。大脳動脈に影響を及ぼす血栓塞栓症の結果としての単発または多発性梗塞は、脳卒中に関連する認知症症例の約20%を占めると推定されている[63]。COVID-19の重症患者では、高凝固を伴う急性大脳血管閉塞が認知症のリスクをある程度高める可能性がある。
小血管疾患(脳小血管病)は脳卒中全体の約20%を占め[64]、脳卒中関連認知症症例の約80%を占め[63]、血管性認知障害の最も一般的な原因である。脳小血管病に関連した白質の神経画像異常と脳微小血管の動脈硬化は、認知症患者の約50%で認められる [65, 66]。脳小血管病の併存疾患には高血圧および糖尿病が含まれる[67](両者とも重度のCOVID-19の危険因子でもある)。重度のCOVID-19患者の多くに影響を及ぼす高凝固性および播種性血管内凝固は、より大きな脳内血管よりも小さな脳内血管を介した灌流を低下させる可能性が高い。SARS-COV-2は内皮機能障害を誘導し[23]、複数の組織の血管床に感染する[24]。脳白質は、びまん性小血管機能障害との関連で予想され、COVID-19で報告されているように、脳血流の変化に対して特に脆弱である[68-70]。皮質下白質の完全性は認知機能の維持に極めて重要であり[71, 72]、COVID-19における白質損傷の結果の一つは認知障害である可能性が高い。このことは、回復したCOVID-19患者の3ヵ月後の追跡調査で、海馬などの脳領域における白質の損傷と機能的完全性の破壊が記憶喪失と関連していることが神経放射線学的に証明されたことによって強調された[9]。
脳小血管病の病態生理は未だに不完全に解明されていないが、内皮細胞およびペリサイトの損傷、およびBBBの漏出は脳小血管病に関連した脳損傷の一因であり(レビュー[66, 73])重度のCOVID-19患者では悪化する可能性が高い。内皮機能障害およびペリサイトの喪失は、脳への流入およびフィブリノーゲンなどの血漿中の有害成分の蓄積と関連しており、オリゴデンドロサイトの損傷およびミエリンの喪失につながる[74]。フィブリノーゲンを介した骨形態形成タンパク質シグナル伝達経路の活性化は、オリゴデンドロサイト前駆細胞の成熟を妨げ、オリゴデンドロサイトの成熟と再髄化を制限する [75]。損傷したBBBを横切る免疫細胞の浸潤もまた、認知症における白質損傷および認知機能低下に寄与する可能性があり、おそらくCOVID-19(レビュー[47])。さらに、内皮機能障害および周皮細胞の喪失は、過剰に存在すると毒性を示すアミロイドβペプチドを含む脳代謝物のクリアランスを損なう可能性がある。アミロイドβを含む代謝物の排出障害は、脳アミロイド血管症およびアルツハイマー病[76,77]の発症に関与しており、溶質の効果的でない排出は、おそらく脳小血管病患者における血管周囲空間の拡大の原因となっている(レビュー[78,79]および脳アミロイド血管症([80-82]))。
他にもいくつかの因子が全身感染時の脳灌流に影響を与える可能性がある。血液粘度の上昇は毛細血管通過を遅らせ、酸素送達を制限する傾向がある。グリコカリックス(毛細血管の内腔側にある炭水化物富化マトリックス)の損傷は、灌流に障害を与え、虚血を悪化させる可能性がある[83, 84]。全身感染における小血管への劇症的変化の多くは、加齢、高血圧、糖尿病、肥満など、重度のCOVID-19を素因とする同じ危険因子によって悪化する。
死後および神経画像研究は、脳白質への虚血性損傷がアルツハイマー病患者の3分の2までに存在することを示している[85-87]。脳アミロイド血管症が損傷に寄与する可能性があるが、ほとんどの場合、虚血に関連した損傷は、おそらく動脈硬化性脳小血管病と非構造的な血管機能不全の組み合わせに起因するものである(レビュー[88])。最近の一連の神経画像学的研究では、虚血性白質障害はアルツハイマー病の非常に初期の段階で発生し、疾患の進行を加速させ、認知機能の低下に寄与することが示されている[89-93]。これらの臨床観察は、脳虚血がアミロイドβ前駆体タンパク質(APP)の処理障害とアミロイドβクリアランス障害の組み合わせによって、アミロイドβ蓄積を促進し(レビュー[87])その結果、アミロイドβペプチドが周皮細胞[94]と血管平滑筋細胞[95]の収縮を誘導することによって、血管収縮を媒介することを示す実験的研究によって支持されている。微小血管内皮細胞単分子膜[96,97]、ヒトAPPトランスジェニックマウスモデル[98]、ヒト死後脳組織[99]の研究では、アミロイドβペプチドもまた、タイトジャンクションタンパク質の発現を低下させることによって、一部ではBBB機能を損なうことが示されている。アルツハイマー病におけるペリサイト変性はBBB破壊と関連している[100-102]。ペリサイトの喪失はアミロイドβ病理を加速し、ヒトAPPマウスではタウ病理と認知機能の低下を誘導する[103]。アルツハイマー病患者からのヒト脳組織では、周皮細胞マーカーである血小板由来成長因子-β(PDGFRβ)のレベルの低下は、アミロイドβレベルの上昇と脳灌流の低下と関連していた[104]。アミロイドβペプチドは培養中のヒト脳周皮細胞に毒性があり[105]、脳脊髄液の分析では、周皮細胞傷害およびBBB漏出性のマーカーである可溶性PDGFRβのレベルが、認知能力の最も早い検出可能な変化と関連して高齢者で上昇していることが示されている[89,90]。
脳低灌流もタウ病理と関連しているという証拠が増えてきている。臨床的に正常な成人で脳アミロイドβ蓄積のポジトロン断層撮影(PET)の証拠がある場合、心血管疾患リスクスコアが上昇している人は、同様にタウ蓄積の証拠を示す可能性が有意に高かった [106]。軽度の認知障害を有する患者では、脳血管障害の増加は、アミロイドβ-PETとは無関係に、PET-Tauシグナルの上昇と認知パフォーマンスの悪化と関連していた[107]。いくつかの実験研究では、脳低灌流のモデル化がタウのリン酸化を増加させることが示されている:成人Wistarラット[108]、アミロイドβおよびタウ蓄積を有するトランスジェニックマウス[109]、酸素およびグル経過欠乏に曝露したラットおよびヒトの脳スライス[110]。最近の剖検研究では、可溶性タウおよび不溶性ホスホ-タウのレベルの上昇は、アルツハイマー病における内皮タイトジャンクションタンパク質、クラウディン-5およびオクルーディンのレベルの低下と関連していた[111]。タウ過剰発現マウスは血管の形態異常と血管密度の増加を示すことが示された[112]。最近の研究では、突然変異タウを発現した若年(2-3ヵ月)マウスでは、神経変性に先立って神経血管結合が障害されていることが明らかになった[113]。したがって、脳血管機能障害と病理学的タウとの間に双方向の関係があることを示唆する臨床的および実験的データが存在する。同様に、TDP-43病理学が、周皮細胞喪失や小血管疾患を含む脳血管機能障害と関連しているという証拠が最近の研究から得られている[114, 115]。最後に、脳虚血は、α-シヌクレインのセリン129位でのリン酸化を誘導する;これは、パーキンソン病やレビー小体型認知症におけるレビー小体型および神経突起におけるα-シヌクレインの疾患関連修飾であり、また、これらのレビー小体型疾患に伴うアルツハイマー病の病態と有意に関連している[116]。
脳虚血と全身性炎症の両方が内皮活性化を誘導し、インテグリンとセレクチンの発現が増加することで、脳実質への白血球の接着と経内皮移動を導く。白血球のリクルートを伴う内皮活性化は、アルツハイマー病でも示されている[47, 117]。白血球は大脳実質内の毛細血管後静脈を介して脳内に入り、より少ない範囲では、レプトメニンと脈絡叢の血管を通る。脳血管と大脳実質における活性化好中球は、ヒトのAPPマウスにおいてグリア症と認知障害に関与していることが明らかになった[118]。APP/PS1マウスでは、呼吸器感染によりインターフェロンγ産生T細胞やインターロイキン17産生T細胞、ナチュラルキラーT細胞による脳への浸潤が増加し、グリア症やアミロイドβの沈着が亢進した[119]。単球は、アルツハイマー病においてBBBを介して脳内に移動する末梢免疫細胞の最も一般的なタイプである。単球上に発現するCCR2の主要リガンドであるCCL2は、アルツハイマー病の微小血管でアップレギュレートされ、アミロイドβクリアランスに役割を果たしている(レビュー[47])。内皮活性化がCOVID-19における急性期だけでなく、より長期の神経学的合併症(認知症を含む)を予測するかどうかは、まだ決定されていない。
アンジオテンシン変換酵素2介在性SARS-CoV-2のヒト細胞への侵入および古典的レニン-アンジオテンシン系の活性化
SARS-CoV-2細胞の付着および侵入は、アンジオテンシン変換酵素2(ACE-2)へのウイルスの結合によって開始される[120]。したがって、細胞表面でのACE-2の発現は、COVID-19におけるウイルスのトロピズムおよび病原性の重要な決定因子である可能性が高い。ACE-2は幹細胞由来のニューロン[121]や脳内の神経細胞やグリア細胞[33, 42]で発現しており、嗅神経[33]に沿った逆行性の軸索輸送によって、あるいは肺から迷走神経節や結節神経節[4]を経由して脳幹に至る感覚線維からのウイルスの侵入や伝播を可能にする可能性がある。ACE-2はまた、認知と記憶に関与し、アルツハイマー病 [122]で影響を受けている側頭葉と海馬-脳領域で発現している。脳内での神経細胞の取り込みおよび拡散は、SARS-CoV-1 [123]およびSARS-CoV-2 [124]に感染したヒトACE-2トランスジェニックマウスで実証された。しかし、上述したように、ACE-2は内皮細胞および周皮細胞にも高度に発現しており、内皮への取り込みまたは感染した末梢免疫細胞の流入に続く血行性の広がりが、脳内へのウイルスの侵入経路としてさらに考えられる。
SARS-Cov-1感染時には、ACE-2はウイルス侵入時にADAM-17 [126]によって細胞表面から切断される [125] [127]。その可能性は高いが、SARS-CoV-2が同様に細胞膜関連ACE-2の喪失をもたらすかどうかは、まだ明らかにされていない。通常、ACE-2は、古典的なRASの作用に対抗する調節性RASの重要なエフェクターであり、心血管疾患(レビュー[128, 129])脳卒中[130-132]、および認知症[133]のリスクを低下させる(図2)。ACE-2はアルツハイマー病[42]で減少し、ACE-2ノックアウトマウスでは認知機能の低下が顕著である[134]。SARS-CoV-2の侵入が(SARSのように)ACE-2の損失をもたらすならば、アンジオテンシンII媒介の古典的RAS活性化は、COVID-19患者の脳血管障害および神経学的障害のリスクを増加させるであろう。このメカニズムはまた、COVID-19の他の血管および肺の症状を説明するために提案されている[135, 136]。アンジオテンシンIIによるアンジオテンシン受容体1型(AT1R)の活性化の結果としてのACE2の内在化は、損傷をさらに悪化させる可能性がある[137]。ACE-2の利用可能なリザーバーは、COVID-19における臨床転帰の重要な決定因子である可能性がある。げっ歯類を用いた研究では、ACE-2発現は加齢とともに低下し、男性では低いことが示されている[138-141]。対照的に、エストロゲンはACE-2をアップレギュレートし、これはCOVID-19の重篤な合併症から閉経前の女性を保護するのに役立つ可能性がある[142, 143]。高血圧、肥満、糖尿病を含むCOVID-19の合併症のリスクを増加させるほとんどの併存疾患は、古典的なRASの過活動に関連していることは関連しているかもしれない。実際、民族性と遺伝的変異はベースラインのACE-2レベルにも影響を与え[144]、ある民族グループがなぜCOVID-19のリスクが高いのかという生物学的説明を提供することができる[145]。この仮説は、アンジオテンシン受容体拮抗薬(ARB)およびアンジオテンシン変換酵素-1阻害薬(ACE-Is)が、それぞれアンジオテンシンII(Ang-II)シグナルまたはAng-II合成を阻害することで古典的なRASをダウンレギュレートし、ACE-2をアップレギュレートすることで、COVID-19患者の死亡率を減少させる理由を説明するであろう [146, 147]。
図2 COVID-19におけるレニン-アンジオテンシン系(RAS)の古典的な部分と調節的な部分の間のバランスの変化
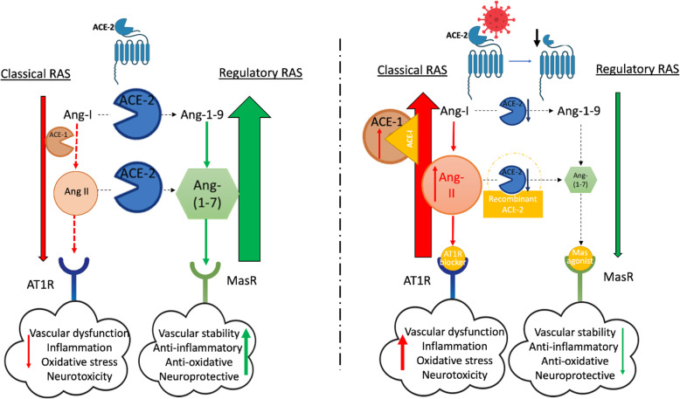
血管内のAT1RへのAng-IIの結合は、血管収縮を誘導するだけでなく、血管伝染性および神経血管結合に影響を与え、中枢神経系内の神経炎症および酸化ストレスを促進する。通常の状況下では、これらの作用はACE-2活性によって打ち消され、それはAng-1-9とAng-(1-7)の産生とMasRの活性化をもたらす。 b SARS-CoV-2ウイルスの結合および細胞侵入後の膜結合ACE-2の内在化または開裂は、調節性RASのダウンレギュレーションと古典的RASの過剰作用をもたらし、COVID-19における血管機能障害、炎症、酸化ストレスおよび中枢神経系の損傷を促進する。
RASの不均衡は急性ARDSに寄与しており(レビュー[148])ウイルス性肺炎を発症するCOVID-19患者の高い割合で発症する[149, 150]。ARDS患者は、古典的なRASの過活動性[151]とACE-2の減少[152,153]を示す。炎症を促進するAng-II介在性AT1Rシグナル伝達の亢進[154]は、重度のCOVID-19における炎症ストームに寄与している可能性が高い。ARDSにおける肺組織損傷は、ARBsおよびACEIs [155]および組換えACE-2 [152, 156]の投与により減少させることができる。ACE-2は、Mas受容体に結合するAng-(1-7)の形成を触媒する;ACE-2の活性化[157]とMas受容体のAng-(1-7)活性化の両方が、ARDSにおける肺損傷を減衰させる[158]。Ang-(1-7)はERK1/2シグナルを活性化し、インターロイキン(IL)-10の発現を調節し、肺の損傷から保護する(レビュー[159])。
組換え可溶性ACE-2(rsACE-2)は、重度のCOVID-19感染症において治療上の有望性を示している;投与は、ウイルス力価および血清Ang-IIを低下させ、血清Ang-(1-7)レベルを上昇させ、プロ炎症性サイトカインを著しく低下させることが報告されている[160]。ウイルスの結合を防ぐことに加えて、rsACE-2が介在するAng-IIの減少は、AT1Rが介在する膜結合ACE-2のADAM-17開裂を防ぎ、RASのバランスを回復させる可能性がある[161]。
COVID-19における古典的レニン-アンジオテンシン系活性化の増加の潜在的な神経学的帰結
RASは脳内で独立して発現し、機能している。ACE-1とAng-IIの上昇を伴う古典的なRASの過剰活性化は、アルツハイマー病の死後ヒト脳組織で実証されている[162-164]。成体WistarラットへのAng-IIの脳室注入は、アミロイドβ産生とタウ病理学を促進し[165,166]、ARBとACEIは、アルツハイマー病のトランスジェニックAPPマウスモデルにおける認知機能の低下と疾患病理学から保護する(レビュー[167])。我々は以前に、アルツハイマー病における脳組織におけるACE-2の減少が、実質的なアミロイドβおよびタウレベルと強く相関し、ACE-1活性の増加と相関していることを報告した[42]。我々や他の研究者はそれ以来、ACE-2の誘導、またはAng-(1-7)またはペプチド類似体の投与が、神経炎症と酸化ストレスの減少に関連したマウスのアミロイドβ関連認知機能低下から保護することを示している[133, 168, 169]。
RASは血管機能の重要な調節因子である。Ang-IIは血管平滑筋細胞のAT1Rに結合して脳動脈の収縮を誘導し[170, 171]、周皮細胞に結合して微小血管の収縮を引き起こす[173, 174]。Ang-IIはBBB伝染性も調節する。AT1RシグナルはBBBの内皮細胞培養モデルにおいてBBBの漏れを誘導し[175]、Ang-IIの注入はマウスにおいてBBBの漏れを引き起こし、スーパーオキシドスカベンジャーを添加することで逆にすることができ、酸化ストレスの役割を示唆している[176]。血管内皮成長因子、マトリックスメタロプロテアーゼ(MMP)-2およびMMP-9を含むBBBリーキーネスのいくつかのメディエーターは、Ang-IIによって誘導される[177-179]。マウスでは、Ang-IIは体性感覚野における神経血管結合(すなわち、神経活動の増加に対する血流応答)を障害し[180]、脳の自己調節を妨害することが示された[181, 182]。脳動脈周囲の細胞外マトリックスにおけるACE-1の蓄積(特に脳アミロイド血管症を有するアルツハイマー病患者における)は、局所的に産生された(同様に循環系)Ang-IIが古典的なRASの過剰活性化によって媒介される脳血管機能不全に参加していることを示唆している[163]。
古典的RASの過剰活性化もまた、アミロイドβのクリアランスを減少させる可能性がある。皮内動脈周囲ドレナージ(IPAD)と超血管性グリンファチャネルは脳からのアミロイドβの除去に関与している[183-185]。これらのドレナージ経路の機能は、アストロサイトエンドフィートにおけるアクアポリン-4の偏光発現に依存しており[186]、これは周皮細胞によって制御されている[187]。ぺリサイトが局所的に存在しない場合、アクアポリン-4は細胞ソーマに再分配される [51]。RASはアストロサイトにおけるアクアポリン-4の発現を調節し[188]、Ang-IIはAT1Rを介して作用してアストロサイト培養物におけるACE-2の発現を減少させることが示された[189]。周皮細胞およびアストロサイトの機能におけるこれらの変化は、アミロイドβのクリアランスを損なう可能性がある。これがCOVID-19で起こるかどうかは、まだ決定されていない。
神経炎症はアルツハイマー病の発症に強く関与している。ゲノムワイド関連研究により、いくつかの炎症性経路遺伝子がアルツハイマー病の危険因子として同定されている[190, 191]。補体系[192]および炎症性酵素の活性化[193,194]は、脳血管機能障害、神経毒性、およびアルツハイマー病におけるアミロイドβおよびタウの蓄積に寄与している可能性が高い。Ang-IIは補体系[195, 196]とNLRP3インフラマソーム[197]を活性化し、補体[198]とインフラマソーム活性化[11]の両方がCOVID-19患者の神経疾患に寄与することが提案されている。最近のin silico研究では、COVID-19患者の炎症反応の主な原因として、SARS-CoV-2によるToll様受容体4(TLR4)の活性化が示唆されている[199]。Ang-IIはTLR4をアップレギュレートする[200]が、Ang-II媒介の血管リモデリングの重要な決定因子である[201]。TLR4シグナルの遮断はラットにおけるAng-II介在性高血圧の発症を遅延させ、ACE-2の劇的な増加と関連していた[202]。ペリサイトは、遊離長鎖脂肪酸によって活性化されたTL4Rを高レベルで発現する[203]。SARS-CoV-2のスパイクタンパク質はリノール酸と結合し、タンパク質のコンフォメーションに影響を与え、おそらくウイルスのACE-2への結合に影響を与えることが示されている(発表前の研究[204])。したがって、リノール酸がCOVID-19 [205]およびアルツハイマー病 [206]の両方で減少し、潜在的に両方の疾患の進行に影響を及ぼすことと関連しているかもしれない。Ang-IIはまた、ミクログリアの表現型を調節する分子スイッチとして作用し、M1(炎症促進性)とM2(免疫調節性)保護貪食表現型の間で切り替わる。COVID-19の神経学的症状におけるミクログリアの役割はまだ完全に探索されていない。
Ang-IIを介した内皮活性化はBBBを横切る白血球の結合とダイアペシスを促進する;これらの効果はAng-1-7によって緩和される[209]。周皮細胞もまた免疫調節特性を有し([210]で検討)脳血管系内での局在化は、免疫細胞の浸潤を調節する「ゲートキーパー」の役割を果たす可能性があることを示唆している。周皮細胞はACE-2を発現するが、それらがSARS-CoV-2によって標的とされるかどうかはまだ確立されていない。脳血管機能(およびおそらく免疫細胞の浸潤)の調節におけるペリサイトの極めて重要な役割のために、ウイルス誘発性のペリサイトの損傷は、脳灌流、BBBの完全性、および免疫調節を損なう可能性が高い。血管効果に加えて、Ang-IVおよびAng-(1-7)を含むAng-II由来のアンジオテンシンペプチドは、神経調節性[211](レビュー[212])および神経保護特性を有する(レビュー[213])。Mas(調節性RAS)受容体のAng-(1-7)活性化、およびc-Metおよびインスリン調節アミノペプチダーゼ受容体のAng-IV活性化(レビュー[214])は、脳卒中モデルにおける組織損傷を制限する(レビュー[215, 216])。同様に、ACE-2の活性化および/またはAng-(1-7)注入は、血圧の変化とは無関係に、アミロイドβ蓄積の動物モデルにおいて認知機能の低下および疾患病理を予防する[133,169,217,218]。したがって、調節性RASシグナリングの減少がCOVID-19における脳損傷を悪化させる可能性のある幅広いメカニズムが存在する。
アルツハイマー病および血管機能障害の確立された危険因子であるAPOE ε4はCOVID-19の危険因子でもあるのか?
APOE多型はアルツハイマー病発症のリスクに大きく影響する:リスクはAPOE ε4で増加し、APOE ε2で減少する[219, 220]。コード化されたアポリポ蛋白質(アポリポ蛋白E、ApoE)の生理学的役割はまだ完全に定義されていない。最近の研究では、APOE ε4の保有が、BBB漏出性および周皮細胞変性を含む脳血管機能障害と関連していることが示されており[221]、毛細血管病変を伴う脳アミロイド血管症と関連していることが示されている[222]。最近の英国の研究では、APOE ε4のキャリアである人においてCOVID-19の有病率が高いことが報告された[223]。我々は以前に、APOE ε4保有者もまたACE-2活性が最も低いことを示した[42]。APOE ε4 のペリサイト発現は、基底膜形成不全により BBB 漏出性を促進することが報告されている[224]。さらに、APOE ε4 の保有は、脳血流の低下や皮質下虚血性白質障害の増加[225, 226]、および アルツハイマー病 における神経炎症と関連している(レビュー[227])。今後の研究では、APOE ε4,COVID-19,および脳血管機能障害とアルツハイマー病との関係を明らかにすることを目指すべきである。
COVID-19におけるADAM-17の潜在的なアップレギュレーション
ACE-2は、SARS-Cov-1が細胞に侵入するとADAM-17によって切断される [125-127]。データはまだ得られていないが、これはSARS-Cov-2の細胞侵入時にも起こる可能性が高いと思われる。Ang-IIを介したADAM-17の活性化とACE-2の脱落は、Ang-IIレベルの上昇がACE-2の喪失と関連しているという正のフィードバックループを示唆している[228]。しかし、ADAM-17は、ApoE受容体、アミロイドβの経内皮クリアランスに関与する低密度リポ蛋白質受容体関連蛋白質1(LRP-1)(ApoEによって促進される)および周皮細胞の維持に必要なPDGFRβを含む、血管系の適切な機能に必要な多くの細胞関連蛋白質を切断することに注目すべきである。したがって、ADAM-17のアップレギュレーションは、潜在的にCOVID-19の血管機能障害を悪化させる可能性がある。ADAM-17はまた、α-セクレターゼの一つとして作用し、APPを切断し、アミロイドβの生成を防ぐ(レビュー[229])。アルツハイマー病および潜在的にCOVID-19におけるADAM-17の複雑で分岐した役割は、さらなる調査を必要とする。
COVID-19患者における治療的介入のための臨床管理、臨床試験および将来の可能性のあるターゲット
重症のCOVID-19では、患者は肺炎を呈し、最も重症の患者は敗血症性ショックおよび多臓器不全を特徴とするARDSを発症し、酸素治療および/または機械的換気を必要とする。静脈血栓塞栓症(VTE)DICおよび血栓塞栓性微小血管障害を伴う血栓性微小血管症を含む、凝固障害および血栓症に関連した感染症誘発性の炎症性および血管変化は、重症COVID-19の一般的な合併症であり、入院患者の25~27%にVTEが認められたとの報告からも明らかである[230, 231]。国際血栓止血学会(ISTH)は、COVID-19入院患者のd-ダイマー、プロトロンビン時間、部分トロンボプラスチン時間、血小板数の測定を推奨している[232]。パンデミックが始まった当初に中国の武漢で行われたレトロスペクティブ研究では、低分子ヘパリンを投与された患者の方が死亡率が低かったことが明らかになっている [233]。重症COVID-19患者の臨床管理には、出血のリスクが高くならない限り、低用量の皮下ヘパリン [233] および/または血栓予防 [234] が日常的に用いられている。
調節性T細胞およびB細胞、ナチュラルキラー細胞の著しい消失、単球、好酸球および好塩基球の減少、好中球の増加を伴うリンパ球減少症は、重症のCOVID-19では典型的なものである(レビュー[235])。プロ炎症性サイトカインのレベルの上昇もあり、時に顕著である(いわゆるサイトカインストーム)。完治血漿 [236] および血漿交換 [237, 238] は重症患者の生存率を改善し、IL-6受容体に対するモノクローナル抗体であるトシリズマブ [239] やIL-6受容体拮抗薬であるサリルズマブ [240] などの免疫調節療法は、保護を提供する可能性があり、現在臨床試験が行われている。他の炎症性サイトカイン(IL-1,IL-17)を標的とした中和抗体もまた、補体系活性化阻害剤の可能性がある場合と同様に、保護を提供する可能性がある。間葉系幹細胞の静脈内移植は、中国北京のCOVID-19患者7人のCOVID-19肺炎患者の転帰を改善することが示されている[241]。間葉系幹細胞には免疫調節や抗炎症作用があり、脳虚血後のBBB損傷や神経炎症を減衰させる能力があることから、間葉系幹細胞が重症COVID-19患者の脳損傷を改善する可能性があると考えられる [242-244]。
COVID-19患者における全身性コルチコステロイドまたは吸入コルチコステロイドの役割については、引き続き議論がなされている。以前の研究では、コルチコステロイドの有用性の欠如が示されていたが [245]、英国オックスフォードのRECOVERY共同グループが報告したランダム化臨床試験では、重症化したCOVID-19患者において、全身性のデキサメタゾンが死亡率を減少させることが明らかになった [246]。吸入されたステロイドは、ARDSにおける炎症と組織傷害を減少させることが以前に示されている[247](レビュー[248])。本来の抗炎症特性に加えて、ステロイドは抗ウイルス特性を有する可能性がある[249]。吸入型コルチコステロイドであるシクレソニドは、試験管内試験でMERS-CoV、SARS-CoV、SARS-CoV-2の複製を抑制することが示された[250]。
抗ウイルス性および抗炎症性を有する内因性タンパク質であるインターフェロン-β(IFN-β)の発現および活性は、COVID-19で障害される[251]。インターフェロンは試験管内試験でSARS-CoV-2複製を阻害する[252]。第II相臨床試験では、IFN-βと抗ウイルス薬の併用により、ウイルスの脱落期間と入院期間が短縮された[253]。英国の製薬会社であるSynairgen社は、IFN-βの吸入型であるSNG001の第II相臨床試験において、人工呼吸を必要とするリスクが低下し、死亡率が約79%減少したと報告している(これらのデータは現在未発表である)。
ACE-2はSARS-CoV-2の受容体であり、ACEIおよびARBはACE-2発現を増加させることが予測されているため、これらの薬剤の使用はCOVID-19を悪化させる可能性があると当初恐れられていた[254]。代わりに最近のメタアナリシスでは、RAS標的薬はCOVID-19の保護効果があることが示唆されている [146, 147, 255]。これは、上記で概説したように、古典的なRASの活性化を低下させたり、過剰活性化を防止し、その結果として生じるAng-II介在性の虚血および炎症性障害を最小限に抑えるというACE-2の保護的役割によるものであると考えられる。
COVID-19患者を対象としたロサルタンなどのARBの臨床試験が米国国立衛生研究所(NIH(アメリカ国立衛生研究所)(アメリカ国立衛生研究所))に登録されている。NCT04335123,NCT04312009,NCT04311177である。また、ACE-Isの中止がCOVID-19に与える影響を検討している2つの試験もある(EudraCT番号2020-001544-26および2020-001206-35)。RASの調節機能を高めることは、ACE-2とAng-(1-7)の保護効果によりCOVID-19を改善する可能性がある;組換えヒトACE2(rhACE2)とAng-(1-7)を用いた介入試験も登録されているが(それぞれNCT04287686とNCT04332666)rhACE2試験は中国で18~80歳の患者を募集していたが、その後取り下げられている。さらなるrhACE2試験(2020-001172-15)がEUの臨床試験登録に登録されている。その他の戦略としては、TMPRSS2の阻害を目的としたいくつかの試験が検討されている。TL4RブロッカーやADAM-17阻害剤を含む研究も、今後の研究に値するかもしれない。COVID-19における潜在的な介入および治療法として現在研究されている薬理学的標的の包括的なレビューについては、読者は最近のレビュー[256-258]を参照されるべきである。
結論
重度のCOVID-19の主要な合併症として脳血管疾患が浮上している。これは、持続的な脳障害を引き起こし、脳卒中や血管性認知障害のリスクを高める可能性が高い。COVID-19患者に影響を及ぼす代謝異常のいくつかも、アルツハイマー病発症のリスクを高める可能性がある。認知症とCOVID-19は、年齢、性別、高血圧、糖尿病、肥満、APOEε4の保有など、多くの併存疾患や危険因子を共有しており、そのほとんどが過活動性RAS、脳血管機能障害、神経炎症と関連している。これらの共通の併存疾患や類似のメカニズムはまた、認知症患者の高い罹患率と死亡率の増加を説明する可能性がある[59, 259, 260]。COVID-19の神経障害の病態をよりよく理解するための研究が急務であり、そのいくつかはおそらく隠蔽されており、その有病率はかなり過小評価されているかもしれない。この理解は、この疾患による長期的な影響(場合によっては認知症リスクの増加の可能性を含む)を確立し、脳障害を予防または改善するための手段を特定するために不可欠である。
略語
アミロイドβアミロイド-β
ACE アンジオテンシン変換酵素
ACE-I アンジオテンシン変換酵素1阻害剤
アルツハイマー病 アルツハイマー病
ApoE アポリポタンパクE
APP アミロイドβ前駆体タンパク質
アンジオテンシンII
ARB アンジオテンシン受容体拮抗薬
ARDS 急性呼吸窮迫症候群
AT1R アンジオテンシン1型受容体
BBB 血液脳関門
BSGベースジン
中枢神経系 中枢神経系
心血管疾患 脳血管障害
DIC 播種性血管内凝固症
IFN-β インターフェロン-β
ICH 脳内出血
IL インターロイキン
LRP-1 低密度リポ蛋白質受容体関連タンパク質1
MMP マトリックスメタロプロテアーゼ
MER中東呼吸器症候群
NRP1 ニューロピリン
PDGFRβ 血小板由来成長因子-β
PET 陽電子放射断層撮影
RAS レニン-アンジオテンシン系
SARS 重症急性呼吸器症候群
SARS-CoV-2 重症急性呼吸器症候群コロナウイルス-2
脳小血管病 小血管疾患
TLR4 Toll様受容体4

