Contents
Coffee intake and decreased amyloid pathology in human brain

要旨
いくつかの疫学的および前臨床研究は、アルツハイマー病のコーヒーの保護効果をサポートしている。しかし、コーヒーの摂取がヒトの脳内アルツハイマー病病態の軽減に特異的に関連しているかどうかはまだ不明である。そこで本研究では、コーヒー摂取と脳βアミロイド(アミロイドβ)沈着、アルツハイマー病サイン領域の神経変性、脳白質肥大(白質肥大)などの生体内試験 アルツハイマー病病態との関連を検討することを目的とした。
合計411人の非認知症高齢者が対象となった。参加者は包括的な臨床評価を受け、[11C]ピッツバーグ複合Bポジトロン断層撮影(PET)[18F]フルオロデオキシグルコースPET、および磁気共鳴画像スキャンを含むマルチモーダル神経画像検査を受けた。生涯および現在のコーヒー摂取量を、コーヒーなしまたは2杯/日未満(基準カテゴリー)と、2杯/日以上(コーヒー摂取量が多い)に分類した。
生涯のコーヒー摂取量が2カップ/日以上の場合、2カップ/日未満の場合と比較して、潜在的な交絡因子をコントロールした後でも、アミロイドβ陽性率の低下と有意に関連していた。対照的に、生涯のコーヒー摂取量も現在のコーヒー摂取量も、代謝低下、アルツハイマー病シグネチャー領域の萎縮、白質肥大量とは関連していなかった。
以上の結果から,生涯のコーヒー摂取量の増加は,病的な脳アミロイド沈着を減少させることで、アルツハイマー病や関連する認知機能低下のリスクを低下させることに寄与する可能性が示唆された。
序論
コーヒーは世界で最も一般的に消費されている飲料の一つであり、成人の高い割合で毎日飲んでいる1。コーヒーには、カフェイン、クロロゲン酸、ポリフェノール、少量のミネラルやビタミンなどの生理活性化合物の数百が含まれており、そのうちのいくつかは、健康にプラスの効果を持っていることが知られている2。多くの疫学研究では、コーヒーは、脳卒中3,心不全4,癌5,糖尿病6,自殺7,パーキンソン病8,死亡率9を含む様々な病状に有益な効果を持っていることを示唆している。
いくつかの疫学研究もアルツハイマー病 (アルツハイマー病)10-12 と認知機能の低下13-15 のコーヒーの保護効果をサポートしている。それにもかかわらず、人間のアルツハイマー病と関連する認知機能の低下にコーヒーの保護効果をサポートする神経病理学的な証拠で利用可能な情報は限られている。高齢化トランスジェニックADマウスの前臨床研究では、コーヒーの主要成分であるカフェインが脳のβアミロイド(アミロイドβ)レベルを低下させることが報告されている16-18が、コーヒーがヒトのアミロイドβ沈着や局所神経変性を含む脳のアルツハイマー病病態の低下と特異的に関連しているかどうかはまだ不明である。
そこで我々は、コーヒー摂取量と、マルチモーダル脳イメージング上の生体内試験 アルツハイマー病バイオマーカーとの関係を調査し、脳アミロイドβ沈着、アルツハイマー病サイン領域の脳内グルコース代謝(アルツハイマー病-CM)アルツハイマー病サイン領域の皮質厚(アルツハイマー病-CT)および非衰弱高齢者の脳白質高次脳機能(白質肥大)を含む。
研究方法
参加者
本研究は 201419年に開始された進行中の前向きコホート研究であるKorean Brain Aging Study for Early Diagnosis and Prediction of Alzheimer’s Disease(KBASE)の一部である。2017年2月時点で、55歳から90歳までの411人[認知的に正常(CN)成人282人、軽度認知障害(MCI)成人129人]が本研究に登録されている。
CN群は、Clinical Dementia Rating(CDR)20のスコアが0で、MCIまたは認知症の診断を受けていない者で構成されていた。MCIの参加者は全員、以下のような無感覚MCIの現在のコンセンサス基準を満たしていた。(1)情報提供者によって確認された記憶の訴え、(2)客観的な記憶障害、(3)全体的な認知機能の温存、(4)機能的活動の自立、(5)認知症のないこと。基準2については、4つのエピソード記憶テストのうち少なくとも1つについて、年齢、教育、性別調整したzスコアが1.0未満であった。これらのテストは、韓国版CERアルツハイマー病-K(Consortium to Establish a Registry for Alzheimer’s Disease (CERアルツハイマー病-K) neuropsychological battery21に収録されている)に含まれている。すべてのMCI患者はCDRスコアが0.5であった。除外基準は以下の通りであった。(1)主要な精神疾患の存在、(2)精神機能に影響を及ぼす可能性のある重大な神経学的または医学的状態または併存疾患、(3)磁気共鳴画像法(MRI)スキャンの禁忌(例:ペースメーカーまたは閉所恐怖症)(4)精神疾患の存在、(5)精神疾患の存在。ペースメーカーや閉所恐怖症など)(4) 文盲、(5) 臨床検査や脳スキャンを困難にするような著しい視覚/聴覚障害や重度のコミュニケーションや行動障害の存在、(6) 妊娠中または授乳中、(7) 治験薬の使用、(8) お茶の抽出物を定期的に飲んでいること。本研究は、韓国のソウル大学病院とSMG-SNUボラマエ医療センターの施設審査委員会が承認し、すべての被験者が参加前に書面によるインフォームドコンセントを提供した。KBASEコホートの募集に関するより詳細な情報は、以前の報告書に記載されている19。
臨床および神経心理学的評価
すべての被験者に、CERアルツハイマー病-K22を組み込んだCERアルツハイマー病-K臨床評価19を組み込んだKBASE臨床評価プロトコルに基づいて、訓練を受けた理事会認定の精神科医による標準化された臨床評価を実施した。また、すべての被験者には、CERアルツハイマー病-K神経心理学的電池21を組み込んだ標準化されたプロトコルに従って、臨床神経心理学者または訓練を受けた心理測定士によって投与された包括的な神経心理学的評価の電池が与えられた。包括的な評価項目の詳細については、以前に述べた19。
コーヒー摂取量の評価
参加者全員を対象に、訓練を受けた看護師がコーヒー摂取量を系統的に評価した。具体的には、各参加者のコーヒー摂取量(カップ/日)を過去 1 年間(つまり現在)と全生涯のコーヒー摂取量を評価した。コーヒー摂取量の影響に関するこれまでの疫学研究10,12,23では、「1日2杯未満(飲まない、または飲まない人)」と「1日2杯以上(飲まない人)」の間で、全生涯またはアルツハイマー病認知症のリスクに明確な差があることが示されていた。この結果をもとに、参加者を2群に分類し、2群間でアルツハイマー病の病態に差があるという仮説の検証を試みた。
潜在的交絡因子の評価
コーヒーの摂取量は、他の様々な条件によって影響を受ける可能性がある。そのため、すべての参加者を対象に、生涯認知活動(LCA)職業の複雑さ、年収、血管リスク、うつ病、喫煙、アルコール摂取などの潜在的な交絡因子について系統的に評価した。
認知活動参加頻度は、39項目の構造化質問票24,25により測定した。認知活動の測定の詳細は前回の報告26に記載されている。項目のスコアを平均化し、各年齢層ごとに別々の値を算出した。次に、その後の分析で使用する LCA の複合スコアを計算したが、これはすべての 4 エポック平均の平均であった。職業の複雑さについては、最も長く保持している職業のみを考慮し、国際標準職業分類(http://www.ilo.org/public/english/bureau/stat/isco/)に記載されているスキルレベルに基づいて 4 つのレベルに分類した。職業は一般的に、技能レベル1では単純で日常的な物理的または手作業の作業、技能レベル2では機械・電子機器の操作、自動車の運転、電気・機械設備の保守・修理、情報の操作・発注・保存などの作業の遂行、技能レベル3では専門分野の複雑な問題解決・推論・意思決定を必要とする複雑な技術的・実務的作業の遂行、技能レベル4では専門分野の広範な理論・事実知識に基づく複雑な問題解決・意思決定・創造性を必要とする作業の遂行が含まれるとされている。職業に関する情報は、参加者の自己申告により入手し、信頼できる情報提供者により確認した。年収は評価され、3つのグループに分類された(最低生活費(MCL)以下、MCL以上だが2倍以下、MCLの2倍以上(http://www.law.go.kr))。MCLは 2012年11月に韓国保健福祉部が発表した行政規則に基づいて決定された。MCLは単身世帯で57万2,168韓国ウォン(KRW)とし、同居人が1人増えるごとに286,840韓国ウォンを加算した。血管リスク因子の併存率は、参加者とその信頼できる情報提供者へのインタビューによって評価した;血管リスクスコア(VRS)は、血管リスク因子の数に基づいて計算され、パーセンテージとして報告された27。正確な情報を得るために、信頼できる情報提供者に面接を行い、医療記録を確認した。抑うつ症状の重症度を測定するために老年期うつ病尺度(GDS)28を使用した。喫煙状況(喫煙者/既往者/喫煙者)およびアルコール摂取状況(未経験/既往者/飲酒者)は、看護師の面接により評価された。採血も静脈穿刺で行い、全血からゲノムDNAを抽出し、アポリポ蛋白E(APOE)遺伝子型決定を既述のように行った29。APOEε4(APOE4)陽性は、少なくとも1つのε4対立遺伝子の存在として定義された。
脳アミロイドβ沈着の測定
すべての参加者は、メーカーのガイドラインに従って、3.0 T Biograph mMR(PET-MR)スキャナ(Siemens; Washington DC, WC, USA)を使用して、3次元[11C]ピッツバーグ化合物B(PiB)-陽電子放射断層撮影(PET)およびT1強調MRIスキャンを同時に受けた。PiB-PETおよび前処理の詳細は、以前の報告書30に記載されている。AALアルゴリズムと領域結合法31を適用して、前頭部、外側頭頂部、後帯状突起前庭、側頭側頭部のPiB保持レベルの特徴付けのための関心領域(ROI)を決定した。各ROIの標準化された取り込み値比(SUVR)値は、各ROI内の全ボクセルの平均値を同じ画像上の小脳取り込み値の平均値で割ることによって計算された。SUVR値が4つのROI31,32の少なくとも1つで> 1.4であった場合、各参加者は、アミロイドβ陽性(アミロイドβ+)として分類された。私たちのPiBデータの二峰性分布を考慮して、唯一のアミロイドβ陽性は、アウトカム変数33,34として使用された。
アルツハイマー病-CMの測定
すべての被験者は、上記のPET-MR装置を使用して[18F]フルオロデオキシグルコース(FDG)-PETイメージングを行った。FDG-PETと前処理の詳細は、我々の前の報告30に記載されていた。そのような角回、後帯状皮質、下側頭回32などのアルツハイマー病に関連する変化に敏感であるアルツハイマー病-signature FDG ROIを決定した。アルツハイマー病-CMは、アルツハイマー病-signature FDG ROIから抽出したボクセル加重平均SUVRとして定義された。
アルツハイマー病-CTの測定
すべてのT1強調画像は、前述の3.0 T PET-MR装置を使用して矢状体方向に取得された。MR画像と前処理は、我々の前の報告30に記載されている。アルツハイマー病-CTは、以前に記載されているように、内耳鼻、下側頭、中側頭、および房状回を含むアルツハイマー病シグナチャー領域から得られた平均皮質厚さの値として定義された32。
白質肥大の測定
すべての参加者は、以前に報告されている有効な自動手順で、上記の3.0 T PET-MRIスキャナーを使用して流体減衰反転回復を伴うMRIスキャンを受けた35。脳白質肥大の体積測定の詳細は以前に報告されている36。
統計解析
まず、コーヒー摂取量とアルツハイマー病バイオマーカーとの関係について、人口統計学的変数、その他の潜在的交絡因子[APOE4,臨床診断(CN vs MCI)LCAスコア、職業複雑度、年収状況、VRS、GDSスコア、喫煙状況、アルコール摂取状況]、およびアルツハイマー病イメージングバイオマーカーを、生涯のコーヒー摂取量のカテゴリー(1日2杯未満と1日2杯以上)間で、t検定またはχ2検定を用いて、適宜比較した。生涯のコーヒー摂取量と潜在的交絡因子との関係を探るために、スピアマン相関分析を行った。生涯(または現在)のコーヒー摂取量のカテゴリーと神経画像パラメータとの関係を調べるために、多変量ロジスティックまたは線形回帰分析を適宜実施した。これらの分析では、「1 日 2 杯未満」を基準とした。共変量を段階的にコントロールするために、3つのモデルが試験された。第1のモデルは年齢、性別、学歴、APOE4,臨床診断を共変量として、第2のモデルは第1のモデルの共変量にLCAスコア、職業複雑度、年収状況、VRS、GDSスコア、喫煙状況、アルコール摂取状況を加えたものであり、第3のモデルは第2のモデルの共変量にコーヒー摂取期間と最初のコーヒー摂取時の年齢を加えたものであった。多重検定による偽陽性誤差を減らすために、ボンフェローニ補正を適用した。実際には、4 つのバイオマーカーと 2 つの期間を考慮した各解析において、p < 0.00625 (=0.05/8)を統計的有意性の閾値とした。
上記の解析でコーヒー摂取量と有意な関連を示したアルツハイマー病神経画像バイオマーカーについては、追加の探索的解析を行った。第一に、生涯のコーヒー摂取量とバイオマーカーとの関係について脳の領域特異性があるかどうかを調べるために、4 つの ROI(前頭部、外側頭頂部、後帯状突起前庭、外側側頭頂部)のそれぞれについて同様の解析を行った。第二に、コーヒー摂取量とバイオマーカーとの関係における潜在的交絡因子(年齢、性別、教育、APOE4,臨床診断、LCAスコア、職業的複雑性、年収状況、VRS、GDSスコア、喫煙状況、アルコール摂取状況)の変調効果を調べるために、コーヒー摂取量と交絡因子のいずれかとの間の二元的相互作用項、およびコーヒー摂取量自体を独立変数として含む同様の分析を行った。さらに、コーヒー摂取量とバイオマーカーとの関係について、生涯のコーヒー摂取量と年齢、学歴、性別、APOE4 のいずれか2つとの3元相互作用を調べた。第三に、コーヒー摂取量全体とバイオマーカーとの用量効果関係を調べるために、コーヒー摂取区分(低・高)ではなく、生涯のコーヒー摂取量(=コーヒー摂取期間×コーヒー摂取カップ数/日)を独立変数として、同様の分析を行った。同様の目的で、χ2検定を用いて、二分法カテゴリの代わりに、4つのコーヒー摂取カテゴリ(すなわち,0または<1杯/日、1≤および<2杯/日、2≤および<3杯/日、および3≤杯/日)の間でアルツハイマー病バイオマーカーを比較した。これらの探索的分析では、p < 0.05を統計的閾値とした。すべての統計分析は、IBM SPSS Statistics 24 ソフトウェア(IBM Corp.
結果
参加者の特徴
参加者の人口統計学的および臨床的特徴を、生涯のコーヒー摂取量のカテゴリー別に表1.1に示した。411 人の参加者のうち、269 人はコーヒーを飲まないか、または飲まない人(1 日 2 杯未満)142 人はコーヒーを多く飲む人(1 日 2 杯以上)であった。生涯コーヒー摂取群と生涯コーヒー摂取群の間には、性別、学歴、コーヒー摂取期間、初回コーヒー摂取年齢、LCAスコア、職業の複雑さ、喫煙状況、飲酒状況、アミロイドβ陽性率に有意な差があった。また、コーヒー摂取量とアルツハイマー病バイオマーカーとの関係について、生涯のコーヒー摂取量と潜在的交絡因子との相関関係を補足表1に示した。
表 1 参加者の特徴
加者の特性A
| 特性 | コーヒーの摂取量、生涯 | Tまたはχ 2 | p値 | ||
|---|---|---|---|---|---|
| <2カップ/日 | ≥2カップ/日 | 合計 | |||
| n | 269 | 142 | 411 | ||
| 年齢、y | 71.06(7.73) | 69.67(8.43) | 70.58(8.00) | 1.675 | 0.095 |
| 女性、いや。(%) | 175(65.06) | 57(40.04) | 232(56.45) | 23.467 | <0.001 |
| 教育、y | 10.56(4.90) | 12.27(4.49) | 11.15(4.82) | −3.574 | <0.001 |
| MMSE | 25.26(3.41) | 25.96(3.34) | 25.50(3.40) | −2.007 | 0.045 |
| APOE4陽性、いいえ。(%) | 61(22.76) | 35(24.65) | 96(23.41) | 0.184 | 0.668 |
| 臨床診断、CN、いいえ。(%) | 183(68.03) | 99(69.72) | 282(68.61) | 0.123 | 0.726 |
| コーヒー摂取時間、y | 27.61(19.06) | 34.12(15.06) | 25.93(18.73) | −6.784 | <0.001 |
| 最初のコーヒー摂取年齢、y | 41.17(17.94) | 34.03(14.54) | 38.31(17.01) | 3.940 | <0.001 |
| 認知活動 | |||||
| 小児期のスコア | 2.00(0.64) | 2.06(0.58) | 2.02(0.62) | −0.892 | 0.373 |
| 成人期スコア | 2.29(0.90) | 2.46(0.84) | 2.35(0.86) | -1.800 | 0.073 |
| 中年スコア | 2.24(0.84) | 2.44(0.79) | 2.31(0.83) | −2.338 | 0.020 |
| 現在のスコア | 2.37(0.69) | 2.52(0.71) | 2.42(0.70) | -1.934 | 0.054 |
| 生涯複合スコア | 2.23(0.67) | 2.37(0.59) | 2.27(0.64) | −2.113 | 0.035 |
| 職業の複雑さ、いいえ。(%) | 11.571 | 0.021 | |||
| 無し | 59(22.01) | 16(11.27) | 75(18.29) | ||
| スキルレベル1 | 20(7.46) | 9(6.34) | 29(7.07) | ||
| スキルレベル2 | 88(32.84) | 44(30.99) | 132(30.19) | ||
| スキルレベル3 | 28(10.45) | 26(18.31) | 54(13.17) | ||
| スキルレベル4 | 73(27.24) | 47(33.10) | 120(29.27) | ||
| 年収、いいえ。(%) | 2.530 | 0.282 | |||
| <MCL | 19(7.06) | 16(11.27) | 35(8.52) | ||
| ≥MCL、<2×MCL | 124(46.10) | 58(40.85) | 182(44.28) | ||
| ≥2×MCL | 126(46.84) | 68(47.89) | 194(47.20) | ||
| VRS | 18.77(15.76) | 16.31(17.47) | 17.92(16.39) | 0.148 | 0.148 |
| GDSスコア | 6.65(5.95) | 6.47(6.76) | 6.59(6.24) | 0.270 | 0.787 |
| 喫煙状況、いいえ。(%) | 27.087 | <0.001 | |||
| 決して | 206(76.58) | 73(51.41) | 279(67.88) | ||
| 前者 | 54(20.07) | 58(40.85) | 112(27.25) | ||
| 喫煙者 | 9(3.35) | 11(7.75) | 20(4.87) | ||
| アルコール飲料のステータス、いいえ。(%) | 12.651 | 0.002 | |||
| 決して | 161(59.85) | 63(44.37) | 224(54.50) | ||
| 前者 | 25(9.29) | 28(19.72) | 53(12.90) | ||
| 酒飲み | 83(30.86) | 51(35.92) | 134(32.60) | ||
| 脳のAβ沈着 | |||||
| Aβ陽性、いいえ。(%) | 73(27.14) | 25(17.61) | 98(23.84) | 4.650 | 0.031 |
| 神経変性 | |||||
| AD-CM、SUVR | 1.40(0.13) | 1.39(0.12) | 1.39(0.13) | 0.462 | 0.645 |
| AD-CT、mm | 2.81(0.22) | 2.80(0.23) | 2.81(0.22) | 0.262 | 0.794 |
| WMHボリューム、cm 3 | 5.89(5.56) | 6.02(5.03) | 5.94(5.37) | −0.217 | 0.828 |
APOE4アポリポ蛋白ε4,CN認知正常、MCL最小生活費、VRS血管リスクスコア、GDS老人性うつ病スケール、アミロイドββアミロイド、アルツハイマー病アルツハイマー病、アルツハイマー病-CMアルツハイマー病シグネチャー脳内グルコース代謝、アルツハイマー病-CTアルツハイマー病シグネチャー皮質厚さ、SUVR標準化された取り込み値比、白質肥大白質過敏症
a特記しない限り、データは平均値(標準偏差)で表示している。
コーヒー摂取量が多い場合と少ない場合のアミロイドβ陽性率の違い
コーヒー摂取量とアミロイドβ陽性との関連性を表22および図で示した。図1.1.1. 生涯のコーヒー摂取量が2杯/日以上の人は、2杯/日未満の人と比較して、モデルにかかわらず有意にアミロイドβ陽性率が低いことが示された。生涯のコーヒー摂取量とアミロイドβ陽性率の関係に脳の領域特異性があるかどうかを調べるために、4つのROI(前頭前野、側頭頂後部、後帯状突起前庭、側頭側野)のそれぞれについて、生涯のコーヒー摂取量が多い場合と少ない場合のアミロイドβ陽性率の違いを調べた。生涯のコーヒー摂取量が2杯/日以上の場合、4つの領域すべてでアミロイドβ陽性率が低下した(表3).3)。生涯のコーヒー摂取量とは対照的に、現在のコーヒー摂取量は共変量にかかわらずアミロイドβ陽性とは関連していなかった。
表2 層別化されたコーヒー摂取量とアミロイドβ陽性との関係を評価するための多重ロジスティック回帰分析の結果
| コーヒーの摂取量 | Aβ陽性 | |
|---|---|---|
| または(95%CI) | p値 | |
| モデル1 A | ||
| 一生 | ||
| <2カップ/日 | 参照 | |
| ≥2カップ/日 | 0.401(0.208〜0.772) | 0.006 * |
| 電流 | ||
| <2カップ/日 | 参照 | |
| ≥2カップ/日 | 0.453(0.236〜0.869) | 0.017 |
| モデル 2b | ||
| 一生 | ||
| <2カップ/日 | 参照 | |
| ≥2カップ/日 | 0.386(0.197〜0.757) | 0.006 * |
| 電流 | ||
| <2カップ/日 | 参照 | |
| ≥2カップ/日 | 0.443(0.227〜0.862) | 0.017 |
| モデル 3c | ||
| 一生 | ||
| <2カップ/日 | 参照 | |
| ≥2カップ/日 | 0.334(0.162〜0.689) | 0.003 * |
| 電流 | ||
| <2カップ/日 | 参照 | |
| ≥2カップ/日 | 0.402(0.197〜0.822) | 0.013 |
アミロイドββアミロイド、ORオッズ比、CI信頼区間、APOE4アポリポ蛋白ε4,LCA生涯認知活動、VRS血管リスクスコア、GDS老年期うつ病尺度、アミロイドββアミロイド、ORオッズ比、CI信頼区間、APOE4アポリポ蛋白ε4,LCA生涯認知活動、VRS血管リスクスコア、GDS老年期うつ病尺度
a 年齢,性別,教育,アポリポ蛋白ε4,臨床診断で調整済み
b モデル1プラス、LCAスコア、職業複雑度、年収状況、VRS、GDSスコア、喫煙状況、アルコール状況の共変量で調整済み
c モデル 2 の共変量に加えて、コーヒー摂取期間、最初のコーヒー摂取時の年齢で調整した。
*統計学的に有意(p < 0.00625)
図1
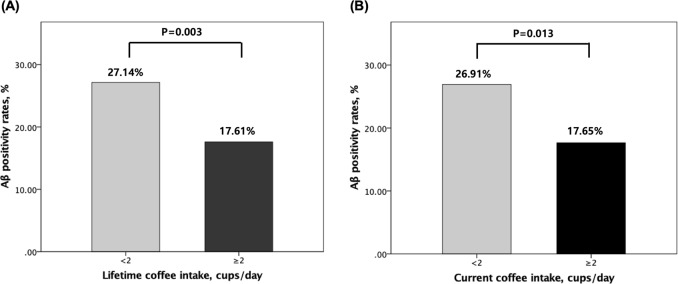
(a)生涯または(b)現在のコーヒー摂取量のカテゴリー別のアミロイドβ陽性率:非認知症高齢者における0~2杯/日と2杯/日以上のアミロイドβ陽性率の比較。年齢、性別、教育、アポリポ蛋白ε4,臨床診断、LCAスコア、職業的複雑性、年収状況、VRS、GDSスコア、喫煙状況、アルコール摂取状況、コーヒー摂取期間、最初のコーヒー摂取年齢をコントロールした後、多変量ロジスティック回帰分析を行った。アミロイドββアミロイド、LCA生涯認知活動、VRS血管リスクスコア、GDS老人性うつ病スケール。本書に記載されている英語は、少なくとも2名の専門の編集者(いずれも英語を母国語とする者)によってチェックされている。証明書については、http://www.textcheck.com/certificate/1uduau を参照してほしい。
表3 層別化された生涯のコーヒー摂取量とアミロイドβ陽性との関係を評価するための多重ロジスティック回帰分析の結果
| 生涯のコーヒー摂取量 | 前頭葉 | PC-PRC地域 | 頭頂葉中部 | 側頭葉 | ||||
|---|---|---|---|---|---|---|---|---|
| または(95%CI) | p | または(95%CI) | p | または(95%CI) | p | または(95%CI) | p | |
| モデル1 A | ||||||||
| <2カップ/日 | 参照 | 参照 | 参照 | 参照 | ||||
| ≥2カップ/日 | 0.400(0.197〜0.813) | 0.011 | 0.417(0.218〜0.798) | 0.008 | 0.393(0.197〜0.783) | 0.008 | 0.500(0.252〜0.993) | 0.048 |
| モデル 2b | ||||||||
| <2カップ/日 | 参照 | 参照 | 参照 | 参照 | ||||
| ≥2カップ/日 | 0.381(0.183〜0.793) | 0.010 | 0.402(0.206〜0.783) | 0.007 | 0.370(0.181〜0.757) | 0.007 | 0.475(0.234〜0.966) | 0.040 |
| モデル 3c | ||||||||
| <2カップ/日 | 参照 | 参照 | 参照 | 参照 | ||||
| ≥2カップ/日 | 0.324(0.149〜0.707) | 0.005 | 0.349(0.170〜0.713) | 0.004 | 0.285(0.132〜0.617) | 0.001 | 0.400(0.188〜0.851) | 0.017 |
アミロイドββアミロイド、PC-PRC後帯状突起前庭、ORオッズ比、CI信頼区間、APOE4アポリポ蛋白ε4,LCA生涯認知活動量、VRS血管リスクスコア、GDS老年期うつ病スケール
a年齢,性別,教育,アポリポ蛋白ε4,臨床診断で調整済み
bモデル1の共変量、LCAスコア、職業の複雑さ、年収状況、VRS、GDSスコア、喫煙状況、およびアルコール状況で調整した。
cモデル2の共変量、コーヒー摂取期間、最初のコーヒー摂取時の年齢で調整した。
生涯のコーヒー摂取量とアミロイドβ陽性率との関係における潜在的交絡因子の中程度の効果
生涯のコーヒー摂取量と年齢、性別、性別、APOE4,臨床診断、LCAスコア、職業の複雑さ、年収状況、VRS、GDSスコア、喫煙状況、アルコール摂取状況との間の二元的交互作用はいずれも有意ではなく、潜在的交絡因子が生涯のコーヒー摂取量とアミロイドβ陽性の関係を緩和しないことが示された(補足表2)。さらに、生涯のコーヒー摂取量とアミロイドβ陽性率の関係について、生涯のコーヒー摂取量と年齢、性別、学歴、APOE4のいずれか2つとの三者間相互作用を検討したが、有意な知見は得られなかった。
生涯のコーヒー摂取量と アミロイドβ陽性率の用量効果関係
さらに、生涯のコーヒー摂取量とアミロイドβ陽性率の用量効果を調べるために、χ2検定を用いて、生涯のコーヒー摂取量を0~1杯/日、1≤~2杯/日、2≤~3杯/日、3≤~3杯/日の4つの層に分けて、アミロイドβ陽性率を比較した。補足図1に示すように、生涯のコーヒー摂取層とアミロイドβ陽性率との間には有意な関連傾向が見られた(p=0.048)。また、重回帰分析では、生涯のコーヒー摂取量の総量(=コーヒー摂取期間×コーヒー摂取カップ数/日)とアミロイドβ陽性率との間の用量効果関連にも有意な傾向が見られた[OR(95%CI)=0.991(0.982-1.001)p=0.067]。量が増えるにつれて、アミロイドβ陽性率は低下した(補足表3)。
コーヒー摂取量と脳タウ沈着、アルツハイマー病-CM、アルツハイマー病-CT、白質肥大との関連性
アミロイドβ陽性の結果とは対照的に、アルツハイマー病-CM、アルツハイマー病-CT、白質肥大のいずれにも、生涯のコーヒー摂取量も現在のコーヒー摂取量も関連していなかった(表44)。
表4 層別化されたコーヒー摂取量と非自閉症者のアルツハイマー病-CM、アルツハイマー病-CT、または白質肥大量との関係を評価するための多重線形モデル解析の結果
| コーヒーの摂取量 | AD-CM | AD-CT | WMH | |||
|---|---|---|---|---|---|---|
| B(95%CI) | p値 | B(95%CI) | p値 | B(95%CI) | p値 | |
| モデル1 A | ||||||
| 一生 | ||||||
| <2カップ/日 | 参照 | 参照 | 参照 | |||
| ≥2カップ/日 | -0.007(-0.034〜0.021) | 0.633 | 0.002(-0.037〜0.042) | 0.910 | 0.237(-0.990〜1.464) | 0.704 |
| 電流 | ||||||
| <2カップ/日 | 参照 | 参照 | 参照 | |||
| ≥2カップ/日 | -0.009(-0.037〜0.019) | 0.540 | −0.001(−0.041〜0.040) | 0.980 | 0.620(-0.626〜1.867) | 0.328 |
| モデル 2b | ||||||
| 一生 | ||||||
| <2カップ/日 | 参照 | 参照 | 参照 | |||
| ≥2カップ/日 | −0.008(−0.035〜0.020) | 0.580 | 0.003(-0.037〜0.042) | 0.888 | 0.282(-0.961〜1.526) | 0.655 |
| 電流 | ||||||
| <2カップ/日 | 参照 | 参照 | 参照 | |||
| ≥2カップ/日 | -0.013(-0.040〜0.015) | 0.369 | -0.002(-0.041〜0.038) | 0.935 | 0.674(-0.591〜1.939) | 0.295 |
| モデル 3c | ||||||
| 一生 | ||||||
| <2カップ/日 | 参照 | 参照 | 参照 | |||
| ≥2カップ/日 | 0.006(-0.022〜0.033) | 0.678 | 0.008(-0.033〜0.048) | 0.707 | 0.181(-1.124から1.486) | 0.785 |
| 電流 | ||||||
| <2カップ/日 | 参照 | 参照 | 参照 | |||
| ≥2カップ/日 | 0.001(-0.027〜0.029) | 0.951 | 0.004(-0.038〜0.045) | 0.864 | 0.612(-0.714〜1.938) | 0.365 |
アミロイドββアミロイド、アルツハイマー病-CMアルツハイマー病シグネチャー脳内グルコース代謝、アルツハイマー病-CTアルツハイマー病シグネチャー皮質厚、白質肥大白質異常、CI信頼区間、LCA生涯認知活動、GDS老年期うつ病尺度、APOE4アポリポ蛋白ε4
a年齢、性別、学歴、APOE4,臨床診断で調整済み
bモデル1の共変量に加えて、LCAスコア、職業の複雑さ、年収状況、血管リスクスコア、GDSスコア、喫煙状況、およびアルコール状況で調整した。
cモデル2の共変量、コーヒー摂取期間、最初のコーヒー摂取時の年齢で調整した。
議論
本研究では,生涯のコーヒー摂取量が2杯/日以上(コーヒー摂取量が多い)の場合,2杯/日未満のコーヒー摂取量と比較して,非認知症高齢者の脳アミロイドβ陽性率が低いことと関連していることを明らかにした。コーヒー摂取量と地域神経変性や白質肥大との関連は認められなかった。本研究は、コーヒー摂取量の増加とヒトの生体内試験 アルツハイマー病病態との関連を調査した初めての研究である。
コーヒーの高摂取量と病理学的なアミロイドβ沈着率の低下との関係は、コーヒーの主要成分の一つであるカフェインの高摂取量が分子的なアミロイドβ関連メカニズムを介して保護効果を発揮することを示した動物モデルを用いた先行研究の結果と一致している16-18,37,38。例えば、Arendashら18は、カフェインがADマウスを認知障害から保護し、アミロイドβタンパク質前駆体のγ-からβ-セクレターゼ切断からのポジティブフィードバックループを不活性化することで、脳のアミロイドβ産生を減少させることを示唆した。また、同じグループは、高カフェイン摂取は、脳のアミロイドβ濃度が低下した高齢ADマウスの認知能力を向上させるが、高齢野生型マウスの認知能力を向上させないことを報告し、ADマウスにおけるカフェインの認知増強効果がアミロイドβ濃度の低下によって媒介されていることを示唆している16。さらに、Caoらは、カフェインがADマウスの血漿と脳のアミロイドβ濃度を抑制することを報告し17,カフェインとコーヒーに含まれる他の成分が相乗的にADマウスの認知機能低下を防ぐ可能性を示唆した38。さらに、Liら37は、カフェインがアデノシンA3受容体を介してアミロイドβタンパク質前駆体の内部化とアミロイドβ生成を抑制することを示している。今回の発見は、いくつかの臨床研究や疫学研究10-12で観察されたコーヒー摂取量の増加とアルツハイマー病認知症リスクの減少との関係を神経病理学的に説明するものである。これらの研究では、コーヒー摂取量が多い人は アルツハイマー病 認知症リスクが 31~65%減少したと報告されており、これはコーヒー摂取量が多い人(27.14%)では アミロイドβ陽性率が低い人(17.61%)に比べて約 65%減少したことに匹敵するものである。さらに、コーヒー摂取量が多い人とアミロイドβ陽性率の低下の関係は、現在のコーヒー摂取量よりも生涯のコーヒー摂取量の方が顕著であった。このことから、コーヒー摂取量が多いことによるアミロイドβ病態に対する保護効果は、急性・短期的な効果ではなく、長期暴露に伴う慢性的な効果が関与していることが示唆された。
本研究では、コーヒー摂取量と地域神経変性および白質肥大との関連は認められなかった。コーヒーの摂取量と脳代謝との関連を調べた先行研究はなかったが、ホノルル・アジア高齢化研究では、コーヒーの摂取量と全般的な脳萎縮や微小血管虚血病変39との関連はないことが示されている。また、Health Professional Follow-up Studyでは、慢性的なコーヒーやカフェインの摂取は、脳血管疾患や心血管疾患のリスクとは関連していないことが示されている40。コーヒーの摂取量と脳血管疾患リスクとの関連性を示す報告はあるが、それらの報告ではコーヒー摂取の急性効果は調べられているが、長期的なコーヒー摂取の慢性的な効果は調べられていない41,42。このようにコーヒー摂取量と アルツハイマー病 関連の神経変性や血管変化との間には無関係な関係があることから、慢性的なコーヒー摂取量は アミロイドβに依存しない機序で神経変性や脳血管変化に直接的な影響を与えないことが示唆された。コーヒー摂取量の増加とアミロイドβ陽性率の低下との間に有意な関連性があることを考えると、アルツハイマー病に関連した地域神経変性の陰性所見は、病的なアミロイドβ蓄積とアミロイドβ依存性の神経変性との間に長い時間の遅れがあることに関連していると考えられる43,44。
本研究には、考慮すべきいくつかの限界があった。第一に、本研究は横断的な研究であるため、所見から因果関係を推測することは困難である。しかし、生涯のコーヒー摂取量とアミロイド病理との間に有意な関係があることは、因果関係の可能性を裏付けるものである。第二に、コーヒー摂取量の過小評価やレトロスペクティブなリコールバイアスが、高齢者における生涯コーヒー摂取量の結果に影響を与えた可能性がある。しかし、コーヒー摂取量は長期的な習慣的行動であるため、誤報の可能性は低い。コーヒー摂取量の評価は、最も高い妥当性と再現性をもって行われることが知られている45。また、今回のコーヒー摂取量とアミロイドとの間の所見は、臨床診断の認知状態への影響をコントロールした後でも有意であり、報告されたコーヒー摂取頻度はMCIの割合とは関連していなかった(表(表1)1.1)。最後に、コーヒーに含まれるどの成分がアミロイドβの病態に作用するのかは不明である。カフェインはコーヒーに含まれる数百種類の生理活性化合物の中でも46,アミロイドβ病理に対して最も広く研究されている成分である16-18。他にもクロロゲン酸、ポリフェノール、少量のミネラル、ビタミンB3などの生理活性化合物も研究されている47-49。しかし、コーヒーに含まれる単一の成分がアミロイドβ病理に効果があるのか、それとも複数の成分の組み合わせが効果的なのかについては、未だに議論の余地がある。したがって、コーヒーに含まれるどの成分がアミロイドβ病変の軽減に重要であるかを明らかにするためには、さらなる研究が必要である。また、カフェインを含むコーヒーと含まないコーヒーを比較することで、カフェインの具体的な効果を知る手がかりが得られるかもしれない。
結論として、今回の研究結果は、生涯のコーヒー摂取量を増やすことで、病理学的な脳アミロイド沈着を減少させることで、アルツハイマー病や関連する認知機能低下のリスクを下げることに寄与する可能性があることを示唆している。
