Contents
CNS repurposing – Potential new uses for old drugs: Examples of screens for Alzheimer’s disease, Parkinson’s disease and spasticity
pubmed.ncbi.nlm.nih.gov/30165077/
受入日:2018年8月23日
クリス・G・パーソンズ
要旨
近年、製薬会社のみならず、政府機関においても、増加するアンメットメディカルニーズに対応するための新薬を費用対効果の高い方法で迅速に創出しようとする医薬品のリパーポージングが注目を集めている。既知の医薬品の新規適応症を特定するためには、いくつかのアプローチがある。多くのアプローチは合理的な選択に基づくものであり、例えば、既知の薬や新しい薬の作用機序などが挙げられる。このレビューでは、作用機序に関係なく化合物の有効性を予測できると考えられているモデルにおける化合物の表現型または高含量スクリーニングに焦点を当てる。アルツハイマー病、パーキンソン病、痙縮症の3つの短いケーススタディを例として紹介する。
薬物の再利用の定義
薬物のリパーポージング(または私のような英国人の場合はリポジショニング)は、 “既知の薬のための新しい適応症の同定 “として定義することができ、それによって “既知の薬 “は、いずれかの市場または臨床開発段階≥ Iにある/あった化合物/医薬品有効成分(API)である。この分野における最近の関心の高さを示すために、クエリフレーズ “drug (repositioning OR repurposing) “でPubMedを検索すると、レビュー記事が604件ヒットしたが、明らかな理由からここに引用されている最近のより関連性の高い例はわずか数件しかない(Baker er al 2018; Ciallella er al 2017; Delavan er al 2017; Jones er al 2017; Lee er al 2016; Pritchard er al 2017)。商業的、すなわち製薬会社の観点からは、そのような化合物の開発が、それらの主要な適応症(複数可)における有効性の欠如またはより商業的/戦略的な理由のいずれかのために、臨床開発の後期段階で他の者によって中止されている場合が最善であろう。しかし、その化合物は通常、ヒトにおいて安全であることが明確に証明されている必要がある(ハンセン病治療薬のサリドマイドのように、すべての規則に例外はある(Baek er al)。 純粋に学術的・ヘルスケアの観点からは、通常、安全性と有効性が最優先されるが、商業的な観点や他の適応症での有効性はあまり問題にならないはずである。
なぜ医薬品を再利用するのか?
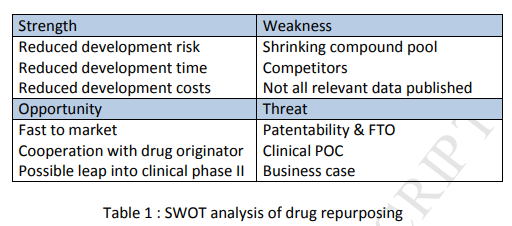
新薬の発見と開発は、非常に時間と費用のかかるプロセスである。中枢神経系の適応症では、血液脳関門の克服(Alavijeh er al 2010)や動物モデルからヒトへの挙動の翻訳(Millan er al 2015)などの余計なハードルがあるため、これが特に問題であることが証明されている。薬物候補の開発中には、多くの潜在的な殺傷物質が存在する。再利用のアプローチをとることで、これらのいくつかの問題を大部分回避できる可能性がある。これらには、1)標的選択性 2)薬物代謝と薬物動態(DMPK) 3)毒性、4)副作用が含まれる。これらの側面は通常、動物種とヒトの両方で試験を行うことで対処し、潜在的なハードルを克服しなければならない。これらの領域のいずれかで陰性の所見が認められた場合、正常な発生経路の初期段階に沿った化合物の数が減少する主な原因となる(Waring et al 2015)。しかし、これらは、ほとんどの場合、再利用された薬剤にとっては、もはや現実の問題ではない、例えば、効果的で安全であれば、選択的である必要さえない。実際には、汚れた薬剤の方がより良い治療薬になることがよくある-例えば(Bastos er al)。 もちろん、他の潜在的なハードルにも対処しなければならないが、その中でも最も重要なのは、新しい適応症での自然な有効性である(通常、ヒトだけでなく動物実験種でも)。商業的な観点からは、ビジネスケース、特許の問題、事業の自由度などがリパーポージングアプローチの主要な問題として残っているが、純粋に学術的/ヘルスケアの観点からは、有効性と安全性が2つの主要な目的である場合には、このような問題はそれほど重要ではない。もちろん、化合物のプールが縮小していることや、が過去に公表されていない可能性があることなど、リパーポージングに特有の弱点は他にもある。これらは(表1
)に示す SWOT 分析にまとめられている。
2004年からのレビューでは、de novo創薬と開発は通常10~17年のプロセスであり、全体的な成功確率は10%未満であると結論づけられている(Ashburn er al 2018年の現状はさらに悪化する可能性が高い;特に中枢神経系の適応症については(Cummings er al)。 同じレビューでは、医薬品の再利用は3-12年のプロセスで安全性と薬物動態の不確実性が減少すると主張している(Ashburn er al 2004)が、これらの数字は更新/増加しなければならないかもしれない。
そのためMerzは、「ビッグファーマ」が注目していない、アンメットメディカルニーズの高い中枢神経系の適応症を扱うことにした。中枢神経系の適応症におけるリパーポージングに関する他の最近のレビューについては、(Alexandrov er al 2015; Bastos er al 2014; Mei er al 2016)を参照されたい。最も賞賛に値する例は、おそらく治療法の選択肢がない重篤な疾患(Ekins er al 2011; Sardana er al 2011; Young er al 2017)であるが、小規模なビジネスの可能性のある、他の製薬会社からはまだほとんど注目されていない、いわゆるオーファン適応症であろう。実際、このような再利用薬の最も興味をそそられる例の一つは、ハンセン病のサリドマイドかもしれない(Baek er al 2015; Millrine er al 2017)。この化合物は、催奇形性が非常に高いという理由で使用が中止されたが、子供を産まない成人に最も多くみられるハンセン病への使用にはもはや関連性がないと判断されたのである。
どのようにして薬剤を再利用することができるのか?
薬物の再利用には2つの古典的なアプローチがある。
合理的作用機序(MoA)に基づくもの
合理的アプローチは、既知または予測された作用機序(MoA)に基づいている。これは基本的に、ほとんどの古典的な医薬品研究開発(R&D)プログラムと同様のアプローチをとる。すなわち、化合物の選択は、
- 1)関心のある適応症に対する古典的/既知の作用機序(またはその組み合わせ(Sahoo et al 2017))の以前の「検証」に基づく
- 2)選択する新規化合物に対するこの作用機序の予測および/または検証
- 3)疾患の動物モデルで化合物を試験し、
- 4)この疾患における第II相臨床試験で化合物を試験する。
また、新たな適応症に対して異なる投与経路、高用量、またはより長い投与期間が必要な場合には、追加の第I相臨床試験を実施する必要があるかもしれない。
このアプローチの潜在的な欠点としては、この合理性が、同じまたは類似のMoAを有するこの疾患に対する有効で実績のある薬剤に基づいている場合、アンメットメディカルニーズが少なくなる可能性があることが挙げられる。
表現型/高含有量スクリーニング
ここでは、化合物の主要なMoAは、少なくとも当初は大きな関心事ではない。重要なのは、むしろ、関心のある適応症における予測される有効性に焦点を当てることである。明らかに、臨床開発段階やジェネリック医薬品の競合など、他の、ほとんどが商業的に適切な選択基準を適用したとしても、最初に試験しなければならない可能性のある化合物の数は膨大な数になる可能性がある(おそらく、数千になるであろう)。このように、一つの課題は、迅速で信頼性の高い前臨床スクリーニングのカスケードを通じて、臨床第二相開発へのファストトラックアプローチを特定することである。したがって、最初のステップは、
- 疾患における有益な効果を予測できると考えられ、
- 最大数千の化合物をスクリーニングするのに十分な能力を有する試験管内試験高含量スクリーニング(HCS)を確立し、検証することである
関連するいくつかの例としては、(Cooper er al 2017; Kinser er al 2017; Rinaldi er al 2017; Zock 2009)。
遺伝子/タンパク質発現フィンガープリントの変化
より古典的なアプローチ/定義では、通常、薬物による遺伝子またはタンパク質の発現プロファイルの変化(フィンガープリント)が使用され、最も多くの場合、関心のある適応症に関連する試験管内試験組織/培養物が使用される。基本的には2つのバリエーションがある。
1つ目は、薬剤による変化の比較に基づくものである。新薬が、この疾患に有効であることがすでに証明されている薬と同様のプロファイルやフィンガープリントの変化をもたらす場合、同じ疾患でも同じか、あるいはそれ以上の効果が得られる可能性がある。このことは、疾患組織だけでなく、対照組織の両方で対処するのが最善であろう。2つの薬剤の効果がなぜ似ているのかは、最初はそれほど重要ではないが、後になって、新しい特許や再利用された薬剤のMoAの理解などのために重要になる可能性がある。このアプローチの欠点は、この疾患に有効で実績のある薬剤がすでに存在する場合、アンメットメディカルニーズは、ほとんど私の定義では、より少ないということである。
2つ目は、その新薬が、その病気そのものとは反対のプロファイル/フィンガープリントを生成するかどうかをテストすることである。もしそうであれば、この薬を使って病気の症状や進行を抑えることができるのではないかという仮説が立てられる。繰り返しになるが、どのようにしてこれが起こるかは最初はそれほど重要ではないが、最初の変異体と同様の理由で後に重要になる可能性がある。
高含有量スクリーニング(HCS)
高含量スクリーニング(HCS)という用語を用いて、私は、遺伝子またはタンパク質発現プロファイル以外の疾患関連パラメータにおける薬剤誘発性変化、例えば(Cooper er al 2017; Kinser er al 2017; Rinaldi er al 2017; Zock 2009)を参照している。しかしながら、いくつかの定義に従うと、表現型スクリーニングは、厳密にはHCSの仮名に過ぎないと理解され得る。薬物誘発性変化は、多種多様な追加のパラメータで評価することができ、そのうちのいくつかの例を以下に示す。
単純な生体内モデル
HCS疾患モデルは、まだ非常に複雑であるが、高い処理能力を有する単純な生物に基づいている可能性がある。ゼブラフィッシュは、最近、例えば筋萎縮性側索硬化症(ALS)の研究において広範囲に使用されている(Wittmann et al 2015)一例である。この場合、例えば、mSOD1,mTDP-43およびmFUSゼブラフィッシュ幼虫は、96ウェルプレート内のHCSでスクリーニングすることができる運動障害を表示する(Vaccaro et al 2012)。HCS技術をしばしば使用する他の単純な生体内試験モデルシステムには、酵母、一般的な線虫Caenorhabditis elegans(Harrington er al 2011; Kinser er al 2017; Lakso er al 2003; Ziehm er al 2017)および果実蠅Drosophila melanogaster(Dilly er al 2017; Hirth 2010; Yadav er al 2016; Ziehm er al 2017)をベースとしたものが含まれる。ハイスループット解析システムもまた、複雑な生体内試験モデル、例えばげっ歯類の行動の解析や多重化技術の使用のために開発されていたが、これらはむしろ現在のレビュアーの専門外です-例えば(Alexandrov et al 2015; Saporito et al 2011)
器官型文化モデル
関連する組織およびHCSの器官型培養もまた、関連するパラメータの変化を評価するために使用することができる(Daviaud er al 2013)。その一例として、脊髄組織の器官型培養における正常および痙攣薬誘発活性の多電極アレイ(MEA)記録がある(Heidemann et al 2014;Magloire et al 2009)。同様のアプローチは、例えば、抗てんかん薬のために皮質組織や海馬組織を用いても可能である(Perez-Alcazar er al)。 ほとんどのアッセイは、マルチウェルプレートでも行うことができる。
タンパク質/タンパク質相互作用
プロテインオパチーは、特に中枢神経系の疾患において、最近の科学的関心の高い比較的新しい分野である(Ugalde er al 2016)。生理学的に重要なタンパク質の偽凝集・オリゴマー化を伴うプロテインオパチーの例としては、アルツハイマー病では ß-アミロイド、パーキンソン病では a-シヌクレイン、多系統萎縮(Prabhudesai er al 2012; Yates 2012)アルツハイマー病、進行性核上麻痺(PSP)および皮質馬場変性症のタウ(Karakaya er al 2012)ハンチントン病のハンチンチン(Bano er al 2011)筋萎縮性側索硬化症(ALS)の様々な凝集タンパク質包接体(Chen er al)。 ウシ海綿状脳症(BSE)におけるプリオンタンパク質との類似性を描くことができる(Ugalde et al 2016)。
このようなターゲティングを、古典的なMoAベースのアプローチとみなす人もいるかもしれない。しかし、この目標が潜在的に達成され得る可能性のあるMoAが多数存在するので、ここでのHCSの読み出しは、凝集したタンパク質そのもの、あるいはより好ましくは、そのような試験管内試験での潜在的な毒性効果であり得る。
毒性のある ß-アミロイドオリゴマー(Parsons et al 2017を参照)は、私の意見では、我々は、例えば単純な結合アッセイで膨大な数の化合物で最初にスクリーニングすることができる単純で簡単に単離され、同定されたMoAを扱っていないことを示す良い例である。他のアプローチの中でも、ßアミロイドオリゴマーの毒性は、アミロイド前駆体タンパク質(APP)の発現を減少させること、またはAPPからのAßの生成を減少させること(例えば、a-、ß-またはg-セクレターゼに対処すること)抗体、Aß凝集を阻害すること(少なくとも5つの受け入れられた「MoA」が存在する)または最終的にはそれらの毒性効果を単に防止することによって、潜在的に対処することができる。
例えば、N – メチル-D-アスパラギン酸(NMDA)受容体には多数の認識/結合部位があり、その全てが何らかの段階で最も関連性の高いターゲットであると主張されていた(競合型、非競合型チャネル、グリシンB、NR2Bサブタイプ選択型など、主要なものだけを挙げると(Parsons er al)。 1998))。
スクリーニングカスケード
どのような初期スクリーニングを選択したとしても、さらなる開発のためのリスクを減らすためには、より疾患に関連する哺乳類の生体内試験モデルに続いて、別のリードアウトを使用した確認的なスクリーニングが確かに望ましいであろう。以下では、一般的な表現型スクリーニングに基づく再利用のこの概念にどのようにアプローチすることができるかの例として提案した3つの選択されたアプローチのスクリーニングシナリオを紹介する。
1) アルツハイマー病とその関連疾患における ß-アミロイドの凝集、2) パーキンソン病とその関連疾患における a-シヌクレインの凝集である。これらの両方のケースにおいて、私たちは最初のスクリーニングアッセイで凝集そのものをターゲットにすることを最終的に選択したが、私たちが選択した二次スクリーニングは、それ自体の毒性の読み出しに対応しており、他の人が化合物の還元/フィルタリングされたサブセットをスクリーニングするために使用することもできる。3つ目の痙性は、たとえ一次スクリーニングレベルであっても、いかなるMoAからも独立したHCS/表現型スクリーニングの一例と考えることができる。
もちろん、他にも多くのアプローチ/シナリオがあるが、それぞれの詳細は私の短いレビューの範囲外であり、実際には私の専門知識を超えている。
化合物の選択
Merzのバーチャル医薬品データベースには20,000以上の項目が含まれており、そのうち2,610項目が社内で物理的に利用可能でした。選択された一次試験管内試験/高スループットスクリーニングのデータポイントあたりのスループットとコストに応じて、スクリーニングをより費用対効果が高く、より速くするための事前選択基準を実装することができる。
- アッセイで活性があると予想される/予測される化合物(先行技術)-アッセイの検証のための追加的なアッセイのためのものであり、必ずしも最終的な再利用のためのものではない。
- 開発が終了したことが知られているフェーズⅡ~Ⅲの化合物は、商業的な観点から最も有望なリポージング候補となるはずである。
- フェーズI、上市され、すべての明らかに先行技術の化合物 – 商業的観点から魅力的である可能性がより高いリスクまたはより少ない可能性が高い
- データベースに含まれる薬物類似性を有しない化合物 – 少数の割合で、ほとんどがアッセイバリデーションのために存在している。
ß-アミロイドオリゴマー / アルツハイマー病における会合
少なくともアルツハイマー病の初期段階の引き金となる βアミロイドオリゴマーの凝集体の役割については、今では広く受け入れられて いるレビューが豊富にあるので、この紹介文は非常に短くしておく(例えば、私自身の最近のレビュー Parsons er al)。 私は、このトピックに関する私自身の以前に発表された論文を盗用することを望んでいないが、それらは多かれ少なかれ私の散文/スタイルに最適化されていると感じており、それゆえに私がそれ以上修正することは困難である。タウは、明らかにアルツハイマー病の病因に非常に重要である別のタンパク質である。長年にわたり、アルツハイマー病の病気の進行の分野では、2つの「陣営」があった – βアミロイドだけが本当に重要であると確信している人と、タウについても同じことを信じている人である。ありがたいことに、彼らは今、両方のタンパク質がこの病気の病因に重要であり、アミロイドの欠損はおそらくタウの欠損に先行しているというコンセンサスを発見した(Bloom 2014; Polanco er al)。
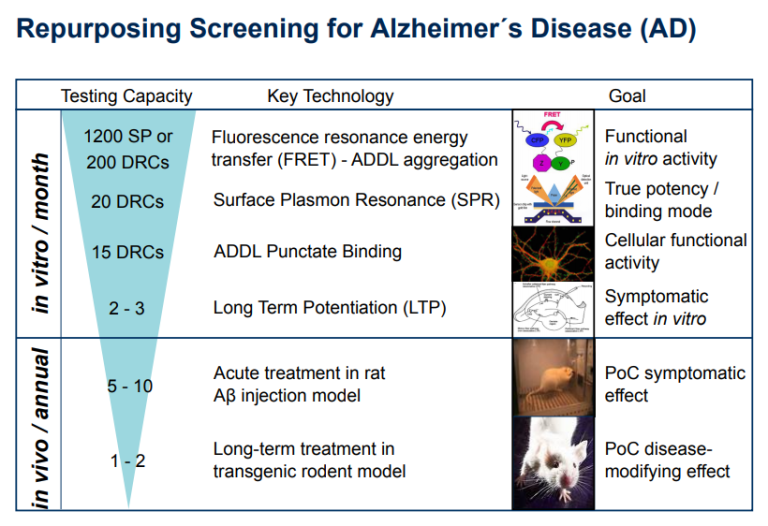
我々のスクリーニングカスケードは、アルツハイマー病の病因の開始における ß-アミロイドオリゴマーの重要性についての我々の非常に強い信念に基づいていた – 図1 この場合、我々は実際に、個々の ß-アミロイドモノマー間の最も早い凝集ステップ/相互作用に対処することを選択し、潜在的な新規化合物を検出するためにTR-FRETアッセイを設定した(Guo et al 2017; Marcellin et al 2012)。しかし、上で強調したように、このアプローチによって検出されなかったであろう ß-アミロイド凝集を防止することができる他のMoAが存在する。これは、異なるMoAを介して ß-アミロイドオリゴマーの形成を回避するように作用し、実際には我々の一次スクリーニングTR-FRETアッセイには現れなかった(Parsons er al 2015)。
しかし、二次アッセイは、シナプスへのこれらの毒性オリゴマーのパンクテート結合であったであろう。この方法は、特定の抗体、専用の共焦点顕微鏡HCS装置(オペレッタ、パーキンエルマー)を使用する真のHCS /表現型アッセイで構成されており、非常に複雑な分析アルゴリズムの開発を必要とする。このアッセイは、一度確立されると、それによって、そのシナプス毒性ターゲット、すなわちシナプスへの ß-アミロイドオリゴマーの特異的な結合の局在化を可能にする。Acumen社の大切な同僚たちがこの技術を開発し、大成功を収めた(Klein er al)。 シナプト毒性の可能性に対処する関連の「二次的」アッセイは、Cross BetaおよびCognition therapeuticsによって開発されている(Parsons et al 2017)。このように、より古典的な表現型スクリーニングのカスケードでは、実際には、異なる基準に基づいて事前に選択された化合物の数を少なくして、出発点としてこのようなアッセイを使用する可能性が高くなる。
第三の試験管内試験アッセイは、その後、アルツハイマー病における認知障害のための特定の関連性を持っている海馬スライスにおける長期増強(LTP)の誘導における ßアミロイドオリゴマー誘発性障害であったであろう(Rammes et al 2015)。このスクリーニングカスケードの最初の全動物のステップは、その後、i.c.v.アミロイドオリゴマー誘導生体内試験での誘導LTPの障害の反転であったであろう(Rammes et al 2015)。最後に、我々は、そのようなモリス迷路や新規オブジェクト認識における空間記憶などの齧歯類における真の学習タスクにおける認知障害に対する有効性を証明する必要があるだろう、好ましくはアルツハイマー病のトランスジェニックモデルで、すなわち外因性のオリゴマー化されたßアミロイドの投与によって課されていない(Rammes et al 2015)。
ßアミロイドオリゴマーはまた、加齢黄斑変性(AMD)(Liu er al 2013; Wang er al 2012)および緑内障(Nucci er al 2010; Orwig er al 2012)などの網膜疾患の病因に関与している。このように、我々はまた、関連する組織培養物である網膜神経節細胞(RGC)と網膜色素上皮(RPE)細胞の安静時膜電位の変化を評価する電気生理学的パッチクランプスクリーンを実装し、検証した。
a-シヌクレインオリゴマー/パーキンソン病(PD)における会合
パーキンソン病(PD)は、通常、ゆっくりと進行する黒質パーコンパクトのドーパミン神経ニューロンの神経変性によって特徴づけられる(Chaudhuri et al 2017)。これは最終的に線条体におけるドーパミン含量の検出可能な重度の減少をもたらす(Schapira et al 2011)。因果関係はほとんど不明であるが、遺伝的感受性や、例えばロテノンなどの殺虫剤による環境障害と関連している(Bove er al)。 また、毒性(例:物質乱用、例:ストリートドラッグ汚染物質MPTP(Kopin 1987))または異因性の原因の報告もまれにある(Albers er al)。
主に重度の運動症状(安静時振戦、硬直、徐行性振戦、歩行障害)が特徴である。その他、精神症状(認知障害、無気力、抑うつ、不安、精神病・幻覚)自律神経症状(性機能障害、膀胱機能障害、便秘、よだれが出る。
便秘、姿勢性低血圧);疼痛;レム睡眠障害および疲労(Schapira er al)。
パーキンソン病には、先駆的な「プロドラッグ」であるL-DOPA、ドパミン作動薬、MAOB阻害薬、COMT阻害薬、抗コリン剤、アマンタジン、手術、脳刺激(運動症状)非定型神経遮断薬、非ベンゾジアゼピン系抗不安薬、抗うつ薬(精神症状)覚せい剤(疲労)など、数多くの対症療法がある。
既存の治療法には多くの副作用があり、次のようなものがある:幻覚および/または精神病、起立性低血圧、吐き気、嘔吐、衝動制御障害、日中の過剰な眠気、肝毒性(一部のCOMT阻害薬)顆粒球症(一部の抗精神病薬)。主な副作用としては、ドーパミン作動性治療薬による長期治療後に重度のジスキネジアが発現することが挙げられ、おそらく運動反応の変動と関連していると考えられる。
さらに、これらの薬剤はいずれも疾患の進行に直接対処するものではない。このように、パーキンソン病の治療のための新しい神経保護薬に対する大きなアンメットメディカルニーズがまだ存在している。
a-シヌクレインもまた、生理学的に重要なタンパク質である(Bartels et al 2011;Bisaglia et al 2009)。その偽凝集/オリゴマー化はまた、豊富な文献(Fountaine et al 2008; Goedert et al 2017; Venda et al 2010)において、パーキンソン病の病因に関与していることが示唆されている。
したがって、我々のスクリーニングカスケードは、パーキンソン病の病因の開始における凝集したa-シヌクレインの重要性についての我々の非常に強い信念に基づいていた-図2を参照のこと。そのため、私たちはまず、上述した ß-アミロイドについての TR-FRET アッセイと同様のアッセイを設定したいと考えてた。しかし、これには同様の注意点がある。そこで、我々は、凝集したa-シヌクレインの潜在的な毒性の影響をより直接的に扱う、それによって真のHCS/表現型スクリーニングアッセイを代表する二次的なアッセイを提案した。
この場合、異なる原始動物種からの少なくとも2つの一般的に使用されているモデル系があり、それは、全生物におけるより多くのHCSレベルでこれに対処することができる – すなわち、酵母およびC. elegans。例えば、酵母において発現し得る既知のA53T-α-シヌクレイン変異が存在し(Anandhan er al 2015; Brandis er al 2006; Sharma er al 2006)α-シヌクレインの凝集をもたらす。α-シヌクレインは、C. elegansにおいて運動欠損を引き起こし、寿命を減少させることも知られている(Lakso er al 2003)(Harrington er al 2011; Ziehm er al 2017)。
この場合、生体内試験でのPoPは、齧歯類、例えばAAV-A53T-a-synラット(Rocha et al 2015)およびThy1-a-synマウス(Chesselet et al 2012)における「検証された」生体内試験モデルに依存するであろう。
提案されたMoAの明確化のためのその後のアプローチの例として、様々なアッセイが、必要に応じて、その後使用され得る。例えば、ロテノンは、試験管内試験で「レビー小体」を含むa-シヌクレインの産生を引き起こし得る(Diaz-Corrales et al 2005;Javed et al 2016)。表面プラズモン共鳴(SPR)などの技術もまた、a-シヌクレインへの化合物の結合の効力を確認するために使用され得る(Heller et al 2017)。同様の側面は、上記で議論した ß-アミロイドオリゴマーのアプローチにも適用されるであろう。
痙性
痙縮には多くの原因があるが、そのほとんどは、出生前/遺伝性(脳性麻痺、痙性麻痺、ALS、多発性硬化症(MS))または成人になってからの急性/準急性障害(脳卒中、外傷性脳損傷、脊髄病変など)に起因している(Satkunam 2003)。最も明らかな障害症状としては、異常な姿勢(痙性ジストニア)協調性の喪失、疲労などが挙げられる。
基礎となる病態メカニズムは、下行抑制の欠損と前部運動ニューロンからの負のフィードバックの減少によって特徴づけられる。脊髄レベルでの拮抗筋の異常な活性化がしばしば見られ、麻痺した痙性四肢ではストレッチに対する受動的な抵抗が見られる。
対症療法としては、バクロフェン、ダントロレン、チザニジン、ベンゾジアゼピン、トルペリゾン、ガバペンチン、ティアガビンおよびクロニジンが挙げられる(Otero-Romero er al)。 ここでも、疾患予防に対処するこれらの症候性MoAのいずれも、この場合には、新規な再利用薬を評価するための示唆されたスクリーンもまた、直接的に一次病理に対処する可能性は低いであろうが。
それにもかかわらず、現在最も一般的に使用されている治療薬(バクロフェン、ダントロレン、チザニジン)には、鎮静、脱力感、疲労感、めまいなどの多くの共通の副作用がある。また、それぞれが独自の付加的な副作用のプロファイルを持っている。
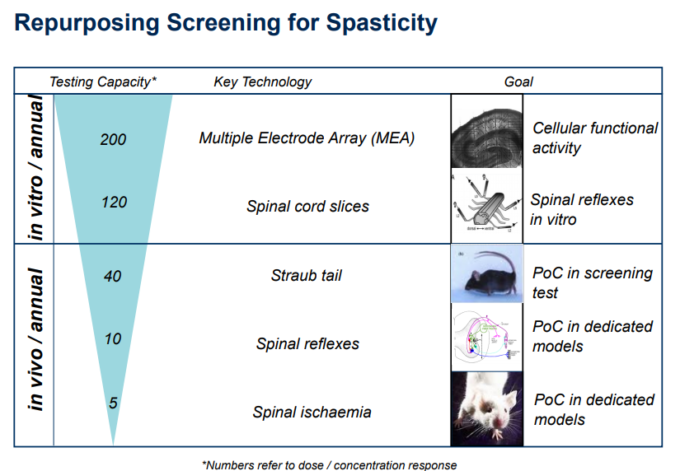
上記で述べたように、痙縮(および潜在的にはてんかん)について、我々は、マルチウェルプレート(Heidemann er al 2014; Magloire er al 2009)で行うことができる脊髄組織の有機型培養物における正常および痙攣薬誘発異常活性のマルチ電極アレイ(MEA)記録を使用することを選択した-図3 第二の確認のための試験管内試験スクリーンは、その後、脊髄縦断スライスにおける脊髄反射になるであろう。
次に、第一の生体内試験スクリーニングの次のステップは、例えばモルヒネなどのアヘンに対する反射反応である痙性のStraub tailモデルであろう(Belozertseva et al 2016)。このモデルは確立が容易で、高速で高い処理能力を持ち、比較的費用対効果が高く、許容可能な予測妥当性(偽陰性なし)が実証されている。
より具体的なリスク低下モデルとしては、1)Hoffmanと多シナプス反射の測定(Kathe et al 2016)2)脊髄虚血誘発性痙縮(Fuchigami et al 2011)3)MSに関連する痙縮のより具体的なモデル(Gaby 2013)などが考えられる。
結論
薬物の再利用は「パンデミックしている」ようである。アンメット・メディカル・ニーズの高い治療のために、効果的でありながら費用対効果が高く安全な新薬を見つけるための非常に有望なアプローチであると言えるであろう。実際に様々な製薬会社によって取り上げられているが、NHS(英国保健医療局)やNIHのような資金提供/健康機関の側からはさらに関心があるかもしれない。このレビューは、本号のNeuropharmacologyに掲載されている、より具体的な側面やアプローチに関する論文の紹介や前置きとして意図されている。意図した、より具体的になる可能性のある焦点は、合理的なMoAベースのアプローチではなく、表現型スクリーニングに基づいた再利用にある。
キーワード
薬物の再利用、再配置、表現型、高含有量スクリーニング、アルツハイマー病、パーキンソン病、痙性、 ßアミロイド、a-シヌクレイン
図と表
図1 – アルツハイマー病治療のための新規再利用化合物を同定するために提案された表現型スクリーニングカスケードの模式図
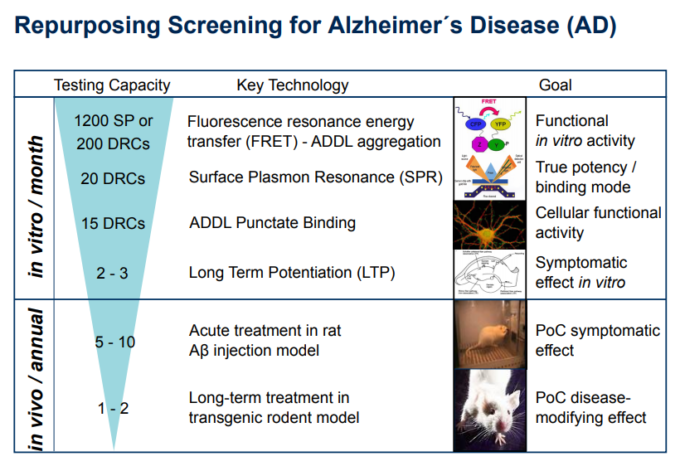
図1 – パーキンソン病治療のための新規再利用化合物を同定するために提案された表現型スクリーニングカスケードの模式図
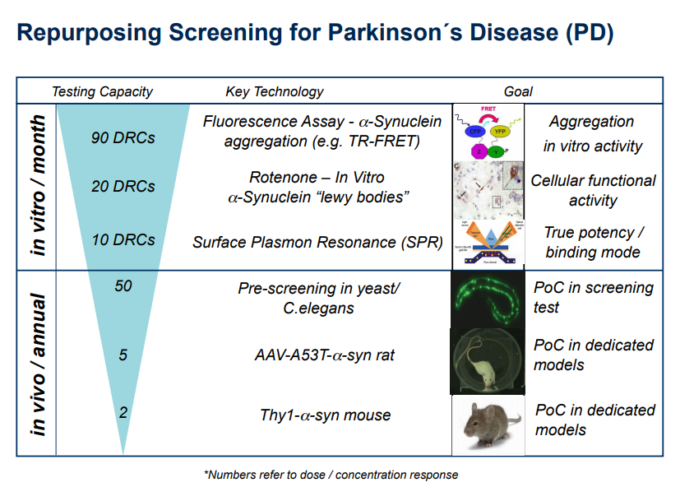
図1 – 痙縮性疾患の治療のための新規リパーパス化合物を同定するために提案された表現型スクリーニングのカスケードの模式図
ハイライト
薬物の再利用は「パンデミック」しているようである。アンメット・メディカル・ニーズの高い治療のために、効果的でありながら費用対効果が高く安全な新薬を見つけるための非常に有望なアプローチであると言えるであろう。実際に様々な製薬会社によって取り上げられているが、NHS(英国保健医療局)やNIHのような資金提供/健康機関の側からはさらに関心があるかもしれない。このレビューは、本号のNeuropharmacologyに掲載されている、より具体的な側面やアプローチに関する論文の紹介や前置きとして意図されている。意図された、潜在的により具体的な焦点は、合理的なMoAベースのアプローチではなく、表現型スクリーニングに基づいた再利用にある。