Contents
CNS implications of COVID-19: a comprehensive review
pubmed.ncbi.nlm.nih.gov/33550782/
2020年12月7日
要旨
COVID-19は2019年12月に中国の武漢市で初めて報告されて以来、世界的に感染が拡大し、人命や経済に大きな打撃を与えている。COVID-19感染症は、咳、発熱、息切れなどの症状を伴うことが一般的であるほか、筋肉痛、無気力症、低汗症、味覚障害などの報告が明らかになってきている。
最近の報告では、SARS-CoV-2の中枢神経系への病原性の侵入が示唆されており、それによって壊滅的な長期合併症を引き起こす可能性がある。これらの証拠は、ウイルスがアンジオテンシン変換酵素2(ACE-2)受容体、神経細胞輸送、血液経路、鼻腔経路を介して嗅球、篩板(しばん)を経由して中枢神経系に侵入し、シナプスを介して伝播し、神経線維に沿って逆行性に中枢神経系に移動することを示唆している。
COVID-19は、ACE-2受容体損傷、サイトカイン関連傷害、サイトカインストーム症候群、二次性低酸素症、脱髄、血液脳関門障害、神経変性、神経炎症などの多様なメカニズムを介して、中枢神経系の炎症や神経変性障害を誘導する。中枢神経系へのウイルス侵入は、パーキンソン病、アルツハイマー病、髄膜炎、脳症、無神経症、低神経症、不安症、うつ病、精神症状、発作、脳卒中などの合併症との関連を示すことが報告されている。
本レビューでは、COVID-19の中枢神経系の病態について詳細な考察がなされている。著者らは、COVID-19は単に肺や末梢系の障害とは考えられず、むしろ中枢神経系の関与が大きいと結論づけている。したがって,COVID-19から回復した後も,長期的な中枢神経系の合併症を防ぐためには,COVID-19の中枢神経系の病態を注意深く観察する必要があると結論した。
序論
新型コロナウイルス感染症(COVID-19)または重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)は 2019年12月に中国の武漢市で初めて報告され、それ以来、世界中で制御不能に爆発的に増加し、生命と経済に大きな損害を与えている(Kong er al 2020; Li er al 2020b)。当初は、原因不明の未治療肺炎の潜在的な原因として認識されていたが、後にCOVID-19として同定された(Sohrabi er al 2020)。新規ヒトコロナウイルスであるSARS-CoV-2は、主に呼吸器系に侵入し、口腔咽頭および鼻咽頭スワブ検査によって診断される(Thoms er al 2020)。潜伏期間は1日から 12.5日であるが、症状が現れるまでに14日まで延長されることもある(Liao er al)。 より大きな脅威は、無症状のCOVID-19患者の急増であり、これは世界中の国々が現在実施している予防対策を著しく脅かしている。臨床的には、COVID-19は咳、発熱、息切れを伴い、最終的には呼吸器系を悪化させる(Repici et al 2020)。2020年9月14日現在、COVID-19は世界で2,890万人以上の症例と9.25ラック以上の死亡をもたらしている WHO (2020) (Reutured on 14th September 2020)。
下気道COVID-19感染症の発生率が高いのは、新生児、高齢者、原発性疾患を持つ人で目撃されている(Guo er al 2020)。過去数ヶ月間の新たな証拠は、COVID-19が中枢神経系を含む様々な身体系を攻撃しうることを示唆している(Moriguchi er al 2020)。COVID-19患者の約36.4%が何らかの神経学的合併症を発症するという報告がある(Wu er al 2020)。2020年3月4日、北京大丹病院において、ウイルス性脳炎の最初の症例は、SARS-CoV-2が中枢神経系に侵入する可能性を示した(Xiang er al 2020; Zhou er al 2020b)。SARS-CoV-2が、肺の上皮細胞だけでなく、血液脳関門(BBB)の内皮細胞にも広く分布しているヒトアンジオテンシン変換酵素2(ACE-2)と相互作用することが明らかになった。これらの観察およびSARSウイルスに関する先行研究は、SARSウイルスが脳にも壊滅的な影響を与えうることを示唆している(Briguglio er al 2020;Kuba er al 2005;Ji-Young er al)。) さらに、死亡した患者の剖検報告において、脳組織浮腫および部分的な神経細胞変性が観察された(Wu er al 2020)。さらに、COVID-19感染に苦しんでいる患者の多くは、中枢神経系の機能として定着している味覚および嗅覚の喪失の症状を経験しており、ウイルスが中枢神経系の嗅覚機能に直接影響を与えうることを示している(Izquierdo-Dominguez et al 2020)。また、様々な研究では、SARS-CoV-2が神経系組織に非特異的に関与していることが示されており、気づかないうちに中枢神経系に深刻なダメージを与える可能性がある(Ahmed er al 2020)。
現在、このウイルスに対して利用可能なワクチンまたは治療法はない。提案されたレビューは、特に中枢神経系に重点を置いたCOVID-19の研究における最近の進歩、およびCOVID-19に関連する合併症の管理のための可能性のある治療戦略を強調する。
コロナウイルス(CoV)
コロナウイルス(CoV)は、多形または球形であり、直径80〜120nmの糖タンパク質のクマのクラブ状の突起が特徴である(Yang er al)。 すべてのRNAウイルスの中で、CoVの一本鎖RNAゲノムは、26.2から31.7kbの範囲の最も一般的な形態の一つである(Chen er al 2020a, b)。CoVゲノム中のオープンリーディングフレーム(ORF)の数は6から 10の範囲である(Belouzard er al)。 CoVの遺伝物質は、一般的な組換えプロセスに対して脆弱であり、これによって病原性が変化した新しい株が生じる可能性がある(Thomas and Nielsen 2005)。ヒトのCoVには、229E、NL63,OC43,HKU1,中東呼吸器症候群(MERS)CoV、および新型SARS-CoV-2の7つの株があり、肺炎、気管支炎、咽頭炎、感冒、副鼻腔炎などの呼吸器合併症を引き起こす原因となっている(Chang et al 2016; Paules et al 2020)。
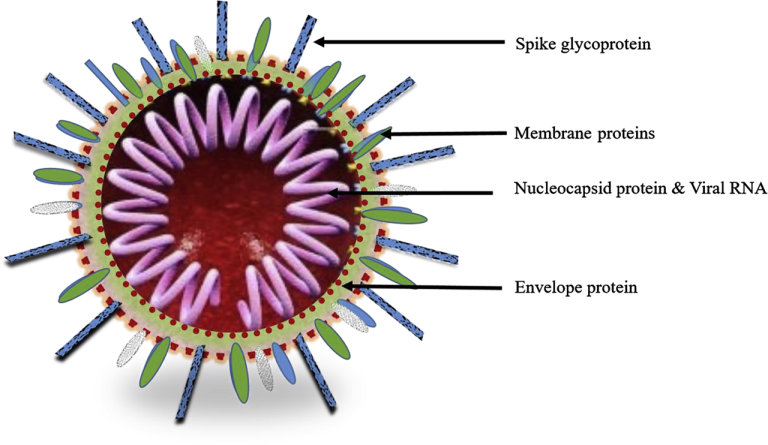
構造的には、CoVはスパイク蛋白質、膜蛋白質、エンベロープ蛋白質、ヌクレオカプシド蛋白質などの蛋白質で構成されている(図1)(Gu and Korteweg 2007; Guo er al 2008)。CoV株のいくつかの株は、1つの追加のエンベロープ関連タンパク質、ヘマグルチニンエスターゼ(HE)タンパク質を発現する(Li 2016)。CoV RNAゲノムは、ヌクレオカプシドタンパク質に詰め込まれ、さらにエンベロープで覆われている(Guo er al 2008)。CoVエンベロープは、糖タンパク質、およびヌクレオタンパク質と関連して存在する一本鎖RNAを囲むコアを取り囲む膜タンパク質で点在している。スパイクタンパク質は、ACE-2と相互作用することにより、CoVの宿主細胞への付着および侵入に関与している(Hilgenfeld 2014)。RNAゲノムは、5′〜3,方向に7つの遺伝子(ORF1A、ORF1B、OEF3,E、M、S、N)を有する(McBride et al 2014)。ゲノムの3分の2を占めるORF1AおよびORF1B遺伝子は、2つのウイルスレプリカーゼポリプロテイン(pp1aおよびpp1ab)を産生する。これらのレプリカーゼポリタンパク質は、その後、16種類の非構造タンパク質の産生に関与する(Li 2016)。残りの3分の1のゲノムは、構造タンパク質(スパイク、エンベロープ、膜、ヌクレオカプシド)およびその他の付属タンパク質をコードしている(McBride er al)。
図1:SARS-CoV-2の構造の模式図
ヒトでは、SARS-CoV、MERS-CoV、およびSARS-CoV-2の3つの株が、まれではあるが極めて病原性が高いことが知られている(Al-Osail & Al-Wazzah 2017; Saif 2004)。2つのよく知られたウイルスアウトブレイクは、中国広東省でのSARS-CoVアウトブレイク(2003)およびサウジアラビアでのMERS-CoVアウトブレイク(2012)である(Al-Osail & Al-Wazzah 2017; Saif 2004)。
構造的には、SARS-CoV-2は、主に4つの主要なタンパク質と、いくつかの他のアセッサータンパク質とから構成されており、これがこのウイルスの構造を構成している。これら4つの主要なタンパク質には、小エンベロープ(E)糖タンパク質、ヌクレオカプシド(N)タンパク質、スパイク(S)糖タンパク質、および膜(M)糖タンパク質が含まれる(Jiang er al 2020)。これらのタンパク質のうち、S-糖タンパク質は150kDaの膜貫通型タンパク質であり、構造的にはSARS-CoV-2の外側に位置している。このSARS-CoV-2のS-糖タンパク質は、宿主細胞のACE2受容体に強い親和性を持ち、ACE2受容体を発現する宿主細胞へのウイルスの結合を促進する。宿主細胞中に存在するフーリン様プロテアーゼは、S-糖タンパク質をS1およびS2に切断し、そのうちS1は主に受容体結合ドメインとして機能し、S2はSARS-CoV-2の宿主細胞への融合を促進する(Fehr er al 2015; Guo er al 2020; Walls er al 2020)。さらに、M-タンパク質は、ウイルスエンベロープの構造的完全性および形状を決定する役割を担っている。M-タンパク質は、これらのタンパク質の安定化に役立つ他の構造タンパク質と結合する可能性を有している。例えば、M-タンパク質はヌクレオカプシドやNタンパク質を安定化させ、それによってNタンパク質とRNAの複合体を安定化させることで、ウイルスの内部ウイルス集合体を容易にする。Eタンパク質またはエンベロープタンパク質は、SRAS-CoV-2の最小構造タンパク質であり、SARS-CoV-2の産生および成熟に不可欠である(Schoeman and Fielding 2019)。
宿主細胞におけるウイルスのライフサイクル
ヒトおよび牛、猫、コウモリおよびラクダを含むいくつかの動物は、CoVsの宿主として機能する可能性がある(Cui er al 2019)。ヒトでは、SARSとMERSの2つが最も病原性が高く、主に呼吸器飛沫感染(咳やくしゃみ)感染者との密接な接触、汚染された物体を介して伝播する;さらに、最近ではエアロゾル感染の証拠が重要視されている(Adhikari er al)。 また、汗、便、尿を介して伝播することもある(Ding er al)。 SARS-CoVの主な標的は肺の上皮細胞である。CoVの他の主な標的細胞は、腸細胞、肺細胞、免疫細胞、神経細胞、腎尿細管上皮細胞である(Guo er al)。
CoVは、SARS-CoVではスパイクタンパク-宿主細胞ACE-2相互作用の助けを借りて標的細胞に侵入し(Zhang et al 2020b)MERS-CoVではジペプチジルペプチダーゼ-4(DPP-4)の助けを借りて標的細胞に侵入する(Mubarak et al 2019)。その上、ウイルスはまた、ウイルスの宿主細胞への侵入を活性化する補因子膜貫通型セリンプロテアーゼ2(TMRSS2)を必要とし、これは、感染および複製に続く(Antalis er al)。 ウイルスゲノムは宿主細胞内に放出され、そのウイルス複製酵素ポリプロテイン(ORF1AおよびORF1B遺伝子によってコードされるpp1aおよびpp1ab)は、それ自身の翻訳プロセスのために宿主リボソームに指令を与えるのを助ける(Prajapat et al 2020)。
ウイルスが呼吸器または他の経路を介して体内に侵入すると、ウイルススパイクは標的細胞のACE2受容体に結合する(Desforges er al 2014)。新規のCoVスパイクタンパク質は、SARSのCoVスパイクタンパク質よりも何倍も高い宿主細胞膜への結合親和性をウイルスに与えることがわかっており(Vabret er al 2020)したがって、新規のCoV 19は従来のSARSのCoV図2よりも高い病原性を持っている。
図2:COVID-19の感染メカニズムと中枢神経系侵襲および関連する中枢神経系合併症の経路.COVID-19は、破壊されたBBBを介して、神経経路および嗅覚経路を介して中枢神経系に侵襲することができる。COVID-19は神経細胞や嗅覚経路を介して侵入し、サイトカインストーム症候群を引き起こし、神経細胞を損傷するだけでなく、BBBの生理機能をも破壊することで中枢神経系に侵入する。また、COVID-19ウイルス(SARS-CoV-2)は、ACE-2受容体を利用して細胞に侵入・増殖し、肺を損傷して低酸素症を引き起こし、COVID-19を媒介とした合併症をさらに悪化させる。ACE-2:アンジオテンシン変換酵素-2;BBB. 血液脳関門;TNF:腫瘍壊死因子;SARS-CoV-2:重症急性呼吸器症候群コロナウイルス-2。
図2 COVID-19の感染機構と中枢神経系への浸潤および関連する中枢神経系合併症の経路
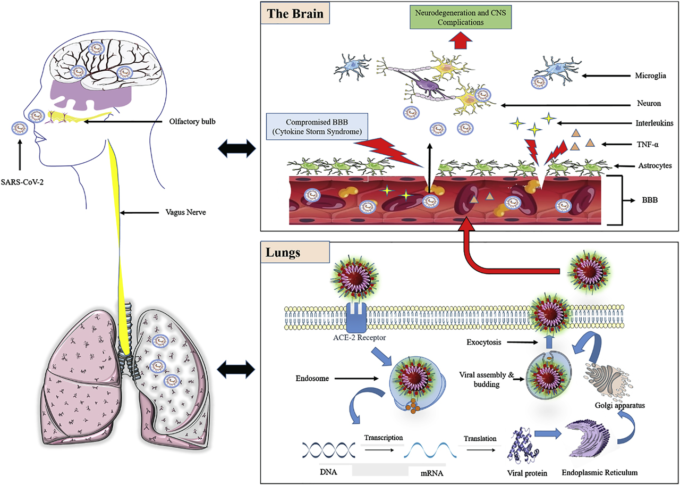
COVID-19は、破壊されたBBBを介して、神経細胞経路や嗅覚経路を介して中枢神経系に侵入することができる。その主なメカニズムは、サイトカインストーム症候群を引き起こすことにより、神経細胞の損傷だけでなく、BBBの生理機能をも破壊することである。また、COVID-19ウイルス(SARS-CoV-2)は、ACE-2受容体を利用して細胞に侵入・増殖し、肺を損傷して低酸素症を引き起こし、COVID-19を媒介とした合併症をさらに悪化させる。ACE-2:アンジオテンシン変換酵素-2;BBB. 血液脳関門;TNF:腫瘍壊死因子;SARS-CoV-2:重症急性呼吸器症候群コロナウイルス-2。
宿主免疫系は、CoVに反応して活性化し、全身循環の炎症性サイトカインを放出する(Ding er al 2004)。サイトカインの放出およびリンパ球および好中球などの他の免疫細胞は、さらに炎症、発熱、血液のpHの低下および胸膜流出を引き起こし、最終的には肺損傷を引き起こす(Guzik er al)。 また、サイトカイン放出症候群との整合性を示す、特にIL-6およびTNF-αが関与するプロ炎症性サイトカイン経路の調節障害が、重篤なCOVID-19患者の脳脊髄液(脳脊髄液)において報告された(Krett et al 2020)。さらに、炎症性メディエーターはBBBを損傷し、その伝染性を増加させ、中枢神経系を神経炎症、脳炎のような合併症に対して脆弱にする(Erickson er al 2012)。
宿主細胞に侵入した後、ウイルスは宿主免疫応答を誘発する。最初に、ウイルスは、自然免疫系の構成要素であるマクロファージやデンドリア細胞などの抗原提示細胞(APC)に遭遇する(Rabi er al 2020; Li er al 2020a)。RIG-I様受容体(RLR)NOD様受容体(NLR)トール様受容体(TLR)などのAPCのパターン認識受容体(PRRR)は、ウイルス上に存在する炭水化物部位、核酸、リポタンパク質、糖タンパク質、および他のタンパク質などの構造成分を認識するか、またはRNA、dsRNAなどのウイルスの中間生成物を認識して、免疫シグナル伝達カスケードを開始する。さらに、各PRRは、ウイルス成分の活性化および認識に基づいて異なる反応を誘発することができる(Li er al 2020a; Yi er al 2020)。さらに、MHCクラス1の助けを借りて、APCはCD4+ヘルパーT細胞にコロナウイルス抗原を提示する。これは、IL-12,IL-17,およびINF-αのようなプロ炎症性サイトカインの放出をもたらし、これは、MHCクラス1およびNK細胞の発現をさらに増強し、活性化する。これは、宿主細胞内でのウイルス複製に対抗し、感染した細胞を排除するために重要である。これはさらに、プロ炎症性サイトカインの活性化および放出を誘発するNF-kBシグナル伝達経路を活性化する。これらのサイトカインは、単球および好中球を感染部位に引き付け、そしてTNF-α、MCP-1,IL-1,IL-6,IL-8およびIL-21などのいくつかの他の抗炎症性サイトカインおよびケモカインの活性化を導く(Janeway et al 2008;Li et al 2020a;Rabi et al 2020;Zumla et al 2020)。
CD4細胞の活性化は、ウイルスに対する体液性応答を刺激し、そして主にIgMおよびIgGからなるコロナウイルスに対する抗体の生成を助ける(Janeway er al 2008; Li er al 2020b; Rabi er al 2020)。COVID-19は、一般に、12週間の持続期間を有する特異的なIgM抗体およびより長い持続期間を有するIgG抗体を生成する。さらに、コロナウイルスの曝露は、CD4 T細胞およびCD8メモリーの形成を誘導し、これは最大4年間持続する可能性がある(Fan er al 2009)。
コロナウイルスが利用する中枢神経系への侵入経路
中枢神経系に侵入するウイルスとしては、HIV、インフルエンザウイルス、フラビウイルス、マウスアデノウイルス1型、パラインフルエンザウイルス、リンパ球性絨毛膜炎ウイルス、アルボウイルス、サイトメガロウイルス、ラブドウイルスおたふくかぜウイルス、パルボウイルスB19,麻疹ウイルス、単純ヘルペスウイルス、ヒトT細胞白血病ウイルス、エンテロウイルス、モルビリウイルス、ブニャウイルス、CoVなど多くのウイルスが知られている(Michalicova et al.2017; 高橋・鈴木 2011)。) しかし、CoVの神経細胞浸潤の病態は十分に理解されていなかった。2020年3月4日に、中国において、ゲノムシークエンシング技術を用いて、脳脊髄液陽性COVID-19の最初の症例が報告された(Al Saiegh er al)。 また、COVID患者の剖検報告から中枢神経系障害が観察されており、脳内の神経変性および脳浮腫の重度を特定している(Briguglio et al 2020)。COVID-19の神経侵襲性の別の例は、74歳の患者の脳組織において観察された(Paniz-Mondolfi et al 2020)。また、神経細胞体においても、内皮細胞内に明瞭な茎状突起を有する球状のウイルス斑の発生が観察された(Paniz-Mondolfi er al 2020)。研究者らはまた、ヒトタンパク質ニューロピリン-1(NRP-1)がウイルスの侵入を可能にすることを確立した。CoVがNRP-1に結合することができ、このタンパク質に結合する抗体がヒト細胞内の感染をブロックすることができるという仮説が立てられた。マウスを用いた実験検証の結果、NRP1がウイルスサイズの粒子の中枢神経系への侵入をサポートしていることが明らかになった。この研究は、ウイルスと宿主NRP1との間の相互作用が、CoV感染に対抗するのに役立つ可能性を示唆している(Daly et al 2020)。
様々な研究は、COVID-19の神経系組織との相互作用の特異的または非特異的な経路を示しており、以下で議論されている。
神経細胞の輸送
SARS-CoV-2は、嗅覚、呼吸器、および腸管神経系の経路を介して中枢神経系に移行することができる(Esposito et al 2020; Wu et al 2020)。嗅覚ニューロンおよび嗅球が脳と近接しているため、ウイルスは、軸索ニューロンの感覚末端または運動末端を介して脳に移行する(Esposito er al)。 さらに、嗅毛細管細胞上のACE 2受容体の存在により、ウイルスは7日以内に脳脊髄液に到達することができる(Wu er al 2020)。Bohmwald et al 2018)によるマウスにおける研究では、嗅球が除去されたときにCoVの中枢神経系への制限された侵入が示唆され、それにより、CoVがこの経路を介して中枢神経系に侵入することができることが確認された(Bohmwald et al 2018)。
また、ウイルスは、呼吸器系に宿命を与え、調節するニューロンによって、延髄(呼吸中枢)に到達することができる(Baig 2020; Li er al 2020b; Li er al 2020c)。最初のCoV HEV 67Nは、末梢神経を介してブタの脳に侵入することが知られていた。神経細胞間のHEV67Nの伝達もまた、クラスリンコーティング媒介エンドサイトティック経路およびエキソサイトティック経路を用いた超微細構造研究によって認識されている(Li et al 2020b 2020c)。
腸管の腸細胞細胞におけるACE-2受容体の高可用性、および迷走神経を介した腸管神経系と脳との直接接続は、脳へのウイルスの侵入のための追加の経路を提供する(Gao er al)。 SARS CoV2は、サイトカインの過剰放出などの末梢免疫応答をさらに誘発する腸内細胞に直接感染し、複製することができる(Gao er al)。 このサイトカインストームは、二次的な全身感染およびウイルスの転座を引き起こす炎症による腸内炎症および脳内神経炎症、および腸管バリアの崩壊を促進する(Huang er al 2020)。
血行性ルート
中枢神経系の完全性はBBBと血液-脳脊髄液バリアの複合効率によって保護されており、中枢神経系への不要物質の侵入を制限している。我々の循環系は、SARS-CoV-2が中枢神経系への侵入に利用できるもう一つの潜在的な経路である。この経路では、感染した上皮細胞が基底側から循環系にウイルスを放出し、それが様々な臓器に広がる可能性がある。神経細胞はBBBによって保護されており、循環系とは直接接触していないため、ウイルスは、中間宿主細胞である内皮細胞や白血球を利用して循環から中枢神経系に拡散する(Koyuncu er al 2013)、E型肝炎ウイルス(Tian er al 2019)、HSV(He er al 2020)、脳炎性アラウイルス(Salimi er al 2020)のようないくつかのウイルスは、循環からBBBの上皮細胞に感染することができる。これは、BBBの正常な機能を混乱させ、BBBの伝染性を増加させる炎症性サイトカインの放出に続いて、中枢神経系感染につながる(He et al 2020;Salimi et al 2020;Tian et al 2019)。BBB上皮細胞上でのACE2受容体の高発現を考慮すると、BBB損傷および中枢神経系感染をもたらすCOVID-19の可能性を見過ごすことはできない。
HIV(Kaul er al 2001)およびZikaウイルス(Ayala-Nunez er al 2019)のような他のウイルスは、中枢神経系に侵入するために「トロイの木馬」メカニズムを利用しており、このメカニズムでは、白血球を使用してBBBを越えて輸送される(Gu er al 2005; McGavern and Kang 2011)。HIVのようなウイルスは、BBBを物理的に通過することができる単球に蓄積される(Collman er al 2003)。これらのウイルスは中枢神経系に侵入し、ミクログリアを活性化してケモカインを分泌させ、中枢神経系内での単球浸潤、BBB伝染性の亢進、炎症過程を引き起こす(Eugenin er al 2003; Persidsky er al 2000)。HCoV-229Eのようなコロナウイルスはまた、単球およびマクロファージへの蓄積につながる白血球に感染し(Collins 2002; Desforges et al 2007)樹状細胞に侵入し(Mesel-Lemoine et al 2012)ケモカイン分泌のプロセスを開始することが知られており(Spiegel et al 2006)コロナウイルスはまた、「トロイの木馬」メカニズムを利用して中枢神経系へのアクセスを獲得し、感染させることができることを示唆している。
アンジオテンシン変換酵素2 (ACE-2)
ACE-2は、呼吸器系、消化器系、脳など様々な組織に発現しているタンパク質である。ACE-2は、酸素と二酸化炭素の交換が行われる肺胞に存在する重要な細胞である2型肺細胞に多く存在する。ACE-2は血圧制御、正常な心機能に不可欠であり、レニンアンジオテンシン系(RAS)の重要な調節因子である。ACE-2受容体に対するCoVの攻撃はまた、RASの正常な機能に影響を与え得る(Vaduganathan et al 2020)。ニューロンにおけるACE-2受容体の存在により、ウイルスはニューロンへの侵入を獲得し、細胞機械を乗っ取る(Buja et al 2020;XuおよびLazartigus 2020)。ウイルス表面のスパイク様タンパク質は、ACE-2受容体に結合し、これは、アンジオテンシンIIを調節する正常な神経細胞の機能を阻害し、ACE-2産生組織を破壊する(Buja er al 2020)。これまでの研究では、SARS-CoV-2が、嗅覚経路を介して脳に侵入してマウスの神経細胞死を引き起こしたことが報告されている(Izquierdo-Dominguez et al 2020;Wu et al 2020)。SARS-CoV-2はまた、脳脊髄液中での存在を示す(Al Saiegh et al 2020; Wu et al 2020)。毛細血管内皮内膜に発現するACE-2とウイルススパイクタンパク質の潜在的な結合は、脳へのウイルスの侵入を促進し、次いで、ウイルス感染、複製、およびその後の神経細胞の炎症をもたらす(Al Saiegh er al 2020; Wu er al 2020)。最初に脳組織内出血を伴う脳毛細血管の内皮損傷があり、その後に神経細胞の損傷が生じることが報告されている(Al Saiegh et al 2020; Paniz-Mondolfi et al 2020; Wu et al 2020)。さらに、アンジオテンシンIIは、ヒト単球における核内因子-κB(NF-κB)の活性化を刺激し、炎症性シグナル伝達経路を開始する。さらに、ACE-2は内皮層を保護し、その欠乏は成体マウスの脳動脈の機能障害と関連していることが明らかになった(White er al)。
中枢神経系におけるサイトカインストーム症候群
神経炎症は、中枢神経系の様々な合併症を引き起こす主要な経路の一つである。近年、COVID-19はTNF-αやIL-6などの炎症性サイトカインを増加させることで、中枢神経系の構造的・代謝的障害を引き起こすことが示唆されている。この現象はサイトカインストーム症候群として知られている。COVID-19またはSARS-CoV-2によるサイトカインストーム症候群の発症は、脳内のアストロサイトおよびミクログリアなどのグリア細胞からIL-6サージを誘導する他の神経向性ウイルスに類似している(Wan er al)。 Bohmwald et al 2018)は、IL-6,TNF-α、IL-5,IL-2などのプロ炎症性サイトカインのレベルを高めることで、慢性炎症と脳障害を誘発するグリア細胞の関連性を、試験管内試験研究で実証している(Bohmwald et al 2018))。中枢神経系の内部では、SARS-CoV-2はIL-6を分泌するCD4+細胞を活性化し、マクロファージを活性化する。サイトカインストーム症候群は、COVID-19の間の死亡率および罹患率の主要な原因である多臓器の障害をもたらす可能性がある(Chen er al 2020a)。これらの所見は、IL-6ブロッカーであるトシリズマブで治療された後、COVID-19の重症患者において有意な改善を示したZhang et al 2020a)の所見によって適切に正当化されている。これらの知見は、生々しいものではあるが、中枢神経系におけるサイトカインストーム症候群が、SARS-CoV-2が脳に損傷を誘発する主要な分子経路の一つであることを明確に示すものである。
コロナウイルス媒介の中枢神経系合併症
文献からの蓄積された証拠は、SARS-CoV、MERS-CoV、およびHCoV-229EなどのCoVが、中枢神経系に侵入し、神経細胞感染を誘発する可能性を有することを示唆している(Huang er al 2020)。SARS-CoV-2とSARS-CoVとの顕著な構造的類似性のために、SARS-CoV-2が中枢神経系に侵入し、合併症を引き起こす可能性を無視することはできない(Andersen er al 2020)。臨床報告では、患者が味覚喪失(5.1%)嗅覚喪失(5.6%)脳卒中、発作などの神経症状を経験することから、ウイルスが神経向性である可能性があることが提案されている(Mao er al)。 最近、研究者らは、ヒトの中枢神経系に類似した試験管内試験3Dヒト脳オルガノイドモデルを用いて、SARS-CoV-2が強力な神経向性であることを発見した(Ramani er al 2020a)。その結果、ウイルスは皮質ニューロンを標的とし、タウの過リン酸化と細胞死を引き起こすことが明らかになった(Teixeira er al)。 さらに、COVID-19患者が頭痛、吐き気、食欲不振、筋痛、嘔吐などの神経学的症状を示すことが様々な研究で報告されており、COVID-19感染の中枢神経系への影響を示唆している(Montalvan er al 2020; Gupta er al 2020)。
神経変性疾患
COVID-19患者が神経変性疾患に罹患しているかどうかの決定的な証拠はないが、疑われている。パーキンソン病のBraak仮説では、ウイルスがα-シヌクレインを緩い結合体に変化させるsubstitania nigraなどの脳の主要部位に影響を与えると提唱されていた(Santos er al)。2019)。また、COVID-19関連サイトカインストーム症候群の結果としてのBBBの破壊は、神経変性障害の進行をもたらすのではないかと推測されている。プロ炎症性メディエーター(IL-6およびTNF-α)の存在は、パーキンソン病の故人患者の脳脊髄液および脳組織において見出されている(Swab et al 2020)。Aβの沈着をもたらすプロ炎症性メディエーターIL-1およびIL-6の存在は、サイトカインストームによる神経炎症がアルツハイマー病につながる可能性があるという仮説を支持する(Serrano-Castro er al 2020)。
蓄積されたエビデンスは、COVID-19が中枢神経系に侵入する可能性を確認しているが、分子レベルおよび機序レベルでのその影響は、推測や仮説に過ぎない。SARS-VoV-2はパーキンソン病時の神経変性に関与する脳領域の機能を損なう可能性があるとの報告もある。これらの知見は、パーキンソニズムの古典的な特徴でもあるCOVID-19の間の老年期および無気力症の症状(Lechien et al 2020)によって支持される(Rey et al 2018a; Schirinzi et al 2018)。興味深いことに、パーキンソニズムの病因の間に、レビー小体は嗅覚経路に蓄積され、そこから嗅覚系の接続に沿って脳の他の領域への伝播が起こり、神経細胞の変性を引き起こす(Rey er al 2018a; Schirinzi er al 2019)。COVID-19の患者の一部が嗅覚を完全に失う可能性があり、多くの患者が部分的に回復することを考慮すると、COVID-19とパーキンソン病との間のこの重なりは、シヌクレイノパシーのカスケードを開始し得るこの領域の潜在的な神経細胞傷害を示唆している(Lechien et al 2020a)ことを考慮すると、より重要になる(Rey et al 2018b)。これは、サイトカインストーム症候群を介して神経炎症をもたらすとともに、COVID-19は、パーキンソン病の発症および進行のリスクを高める可能性がある(Krashia et al 2019)。さらに、COVID-19患者の血中炎症性プロファイルは、IL-2R、IL-6,IL-8,IL-10,フェリチンおよびC反応性タンパク質の有意な増加を示唆している(Henry er al 2020)。炎症性プロファイルのこの増加は、C反応性タンパク質、IL-1β、IL-2,IL-6およびTNFの増強されたレベルが、パーキンソン病に罹患している患者の血液サンプルにおいても観察されているので、興味深いものである(Qin er al)。 炎症が重要な役割を果たす神経学的合併症、例えば多発性硬化症、ナルコレプシー、アルツハイマー病などは、COVID-19と高い関連性を示す可能性があると推測されている(Schirinzi er al 2020)。これまでに生成された証拠は、COVID-19の精神医学的併存性を無視することはできないことを示唆している。COVID-19患者は不安およびうつ病を発症することが観察されている;しかしながら、決定的な証拠が不足しているため、これはCOVID-19のみに起因するものではないと考えられる(Rogers et al 2020)。
頭蓋内感染症
COVID-19患者は、肺、代謝障害および脳症を引き起こす重度の低酸素に苦しむ(Wu er al 2020)。インフルエンザやウイルス感染症は、サイトカインストームや神経細胞の脱髄に関連している(Jang er al)。 最近、COVID-19を有する急性壊死性出血性脳症の最初の症例が報告された(Pryce-Roberts et al 2020)。COVID-19患者の髄膜炎症剖検報告では、増加したIFN、TNF、IL-2およびIL-22のレベルが、B細胞活性の増加を伴って観察された(Serrano-Castro er al 2020)。これらの報告はまた、中枢神経系関連疾患における神経炎症の役割を支持している(Machhi er al 2020)。臨床データがないため、炎症が神経細胞死の基礎となる単独因子なのか、それとも他の因子が関与しているのかは明らかではない。味覚および嗅覚の喪失は、現在、COVID-19感染の症状として観察されている(Lao er al 2020)。Lechienらは、357/417例の嗅覚機能障害と342/417例のCOVID-19患者の無嗅覚を報告している。これらの症状には、ウイルスによる迷走神経と嗅神経の浸潤が関与していることが示唆されている(Lechien et al 2020b)。
脳炎。急性脳炎としても知られる脳炎の主な原因はウイルス感染である。原因ウイルスは主に水痘帯状疱疹ウイルス、インフルエンザウイルス、単純ヘルペスウイルス(HSV)およびサイトメガロウイルスである(Kennedy 2004);しかしながら、SARS-CoV-2およびMERS-CoVの病因も脳炎中に同定されている(Saad er al 2014; Vandervorst er al 2020; Babar er al 2020)。SARS-CoV-2 RNAの存在は、臨床的髄膜脳炎という病状を有する患者において脳脊髄液中に検出されている(Moriguchi er al 2020)。同様に、COVID-19に感染した患者では、脳内脳炎の存在が疑われる精神状態の変化が診断されている(Poyiadji et al 2020)。この患者の脳炎は、SARS-CoV-2の脳への直接的な侵入の結果ではなく、むしろ、SARS-CoV-2媒介性サイトカインストーム症候群によるものであった。同様の研究は、サイトカインストーム症候群が、COVID-19に感染した患者で観察される様々な重篤な症状の原因である可能性を示唆している(Mehta et al 2020)。これらの報告は、IL-6およびIL-1R受容体阻害剤(トシリズマブおよびアナキンラ)を投与されたCOVID-19の患者がCOVID-19感染症において何らかの改善を示した臨床所見から、いくつかの支持を見いだす(Shakoory et al 2016,Zhang et al 2020a)。
ウイルス性髄膜炎。COVID-19関連髄膜炎は、意識の変化および発作エピソードを示した日本の若い患者で最初に報告された(Moriguchi er al)。 右側脳室炎とともに右中葉と海馬の脳炎と診断された。興味深いことに、この患者は脳脊髄液中のSARS-CoV-2 RNAが陽性であったが、鼻咽頭スワブ検査では診断されなかった。これらの所見は、SARS-CoV-2またはCOVID-19の神経侵襲性を示唆している(Moriguchi er al 2020)。
精神神経疾患
近年蓄積されたエビデンスは、COVID-19が精神症状と関連している可能性を示唆している。Hu et al 2020)は、統合失調症とCOVID-19の初回エピソードの発生率の増加を報告している(Hu et al 2020)。また、回復したCOVID-19患者の96%が心的外傷後ストレス症状を示すことも観察されている(Bo et al 2020))。58人のCOVID-19患者を対象としたレトロスペクティブ研究では、錯乱(65%)皮質脊髄路症状(67%)神経心理学的障害(33%)などの精神医学的および神経学的徴候が認められた(Helms et al 2020)。900人以上の患者を対象とした全身研究では、混乱や意識障害などの症状とCOVID-19との関連性が示されている(Rogers er al)。 さらに、144人の患者を対象とした研究では、不安(35%)および抑うつ(28%)とCOVID-19との関連が示唆されている(Rogers er al 2020)。Varatharaj et al 2020)が実施したイギリスのサーベイランス研究では、59%のCOVID-19患者で精神状態が変化していることが報告されており、その大部分は新たに診断された患者であった。さらに、精神状態が変化したと診断された患者のうち、43%が新規発症の精神病であり、26%の患者が神経認知または認知症様症状を示し、17%の患者が情動障害を有することが確認されたと報告している(Varatharaj et al 2020))。
アノスミア(嗅覚脱失)
アノスミア(嗅覚脱失)および嗅覚減退はCOVID-19と関連しており(Vaira et al 2020)他の症状に気づかれる前に患者に存在し得る(Eliezer et al 2020)。COVID-19の患者114人に対して実施されたレトロスペクティブ研究では、患者の47%にアノスミア(嗅覚脱失)が存在することが示された(Klopfenstein et al 2020)。さらに、この研究では、COVID-19の約4.4日後に無隔膜症が出現し、8.96日の全体的な持続時間を有することが示された。さらに、COVID-19の患者の98%が感染後28日以内に回復することが報告された(Klopfenstein et al 2020)。無視は、COVID-19またはSARS-CoV-2感染の最も一般的な中枢神経系の症状である。興味深いことに、無症状の患者および20代前半の年齢層の患者では、無感覚症が診断される(Lao et al 2020)。COVID-19患者は、感染の他の典型的な症状を伴わずに突然の無気力症の発症を示すことがあるが(Gane et al 2020)一部の患者は軽度の乾性咳嗽の症状を示すことがある(Eliezer et al 2020)。COVID-19患者における無汗症および低汗症の有病率を描いた複数の横断的研究がある。これらの研究では、COVID-19患者における有病率は33.9~68%と広範囲にわたっていると報告している(Bagheri et al 2020;Giacomelli et al 2020;Menni et al 2020;Spinato et al 2020;Yan et al 2020)。これらの研究はまた、これらの患者における味覚障害とアノスミア(嗅覚脱失)の関連性を強調した(Bagheri et al 2020;Giacomelli et al 2020;Menni et al 2020;Spinato et al 2020;Yan et al 2020)。興味深いことに、ほとんどの研究において、嗅覚障害の有病率は男性に比べて女性の方が高いことが観察された(Bagheri et al 2020; Giacomelli et al 2020; Menni et al 2020; Spinato et al 2020)。
血管イベント(CVA/AIS)
COVID-19に関連する急性虚血性脳卒中(AIS)の病因は完全には解明されていないが、重症のCOVID-19と虚血性脳卒中が関連している可能性を示唆する報告がある。中国およびヨーロッパで入院したCOVID-19患者を対象に実施されたレトロスペクティブ研究では、COVID-19患者の脳卒中発症率は2.5〜6%であることが示唆されている(Klok et al 2020;Lodigiani et al 2020;Mao et al 2020b)。興味深いことに、AISはSARSおよびMERSのパンデミックとの関連性も報告されており、COVID-19とAISの関連性を無視することはできないことを示唆している(Algahtani er al 2016; Umapathi er al 2004)。この関連性は、COVID-19の5人の患者が大血管虚血性脳卒中を発症し、炎症性マーカーの上昇および急性脳卒中症状およびリンパ球減少症のような症状を呈したニューヨークからの症例シリーズでも最近報告された(Oxley er al 2020)。
最近の報告では、COVID-19患者は血栓塞栓性有害事象を発症するリスクが高いことが示唆されている(Guan er al 2020; Klok er al 2020; Zhou er al 2020a)。重度のCOVID-19患者では、dダイマー濃度の上昇に関連した凝固活性の亢進が示されており(Guan et al 2020;Klok et al 2020)それが致死に至ることさえあった(Zhou et al 2020a)。さらに、COVID-19および脳血管疾患の両方を有する患者は、脳血管疾患のない患者よりも高いd-ダイマー濃度を有していたことも報告されており(Klok et al 2020)COVID-19とより高いd-ダイマー濃度および関連する合併症との関連を示唆している。さらに、内皮炎は、ACE-2受容体を介したウイルスの侵入およびそれに続く炎症反応の結果として生じる可能性があり、それによってCOVID-19の様々な臨床的病因に寄与している(Varga er al)。 内皮炎は、内皮機能障害および微小循環血管収縮を引き起こし、アポトーシスおよび虚血につながる可能性がある(Varga er al)。
Maoらは、COVID-19入院患者における脳卒中発症率が3%であることを報告した(Mao et al 2020a)。同様に、ストラスブール大学病院では、調査した23人のうち3人の患者で脳虚血性脳卒中の発症が認められた(23%)(Helms et al 2020)。中国では、221人のCOVID-19入院患者を対象とした単施設レトロスペクティブ研究が行われた。この研究では、1回の出血性脳卒中、1回の静脈洞血栓症、11回の虚血性脳卒中からなる13例の急性脳卒中が示された(Li er al 2020d)。COVID-19とAISを結びつける直接的な証拠はまだ確立されていないが、最近の報告ではCOVID-19がAISの高い発生率と関連している可能性が示唆されており、COVID-19患者の管理の際には注意深くモニタリングすべきである。
骨髄炎
Mao et al 2020a)は、COVID-19患者の36.4%(78/214)に神経学的症状を報告した最初の科学者の一人である。頭痛、めまい、意識障害、運動失調、急性脳血管疾患、およびてんかんがCOVID-19の神経学的症状の最も多くの報告例であった(Mao er al 2020a)。現在、いくつかの症例報告で、COVID-19と急性横筋炎(ATM)との関連が観察されている。SarmaおよびBilello(2020)Valiuddin et al 2020)およびZhao et al 2020a)は、SARS-CoV-2感染後の急性骨髄炎の最初の3例を報告した。パンデミックが世界的に進行するにつれて、この関連性を確認するより多くの研究が現れ始めている(Hazrati er al 2020; Munz er al 2020; Sotoca and Rodríguez-Álvarez 2020)。最近、症例報告は、両側性の重度の視神経炎および骨髄炎を有するSARS-CoV-2およびミエリンオリゴデンドロサイト糖タンパク質(MOG)IgG抗体陽性患者を示し、COVID-19と骨髄炎との潜在的な関連を示唆している(Zhou er al 2020c)。
SARS-CoV-1,MERS-CoVおよび他のコロナウイルスの広範な配列相同性および神経侵襲性に基づいて、SARS-CoV-2が経シナプス経路を介して中枢神経系にアクセスし、COVID-19の呼吸不全を引き起こす可能性があるという仮説が立てられている(Li et al 2020c)。さらに、脊髄ニューロンの膜にACE-2受容体が存在することは、SARS-CoV-2が脊髄に侵入し、したがってATMまたは他の神経学的効果を引き起こす可能性を示唆している(Valiuddin er al 2020)。これらの報告は、COVID-19がSARS-CoV-2感染後に複雑な神経学的効果をもたらす可能性があることを示しており、COVID-19患者を検査している間は心に留めておくべきである(Mao er al 2020a)。
脱髄/ADEM
世界中からのいくつかの症例報告は、ギラン・バレー症候群(GBS)のスペクトルとCOVID-19との間の関連を示唆している(Alberti et al 2020;Zhao et al 2020b)。GBSは、免疫介在性の急性発症脱髄性多発性神経障害(急性炎症性脱髄性多発性神経障害-AIDP)であり、典型的には、上行性脱力、深部腱反射の喪失、および感覚障害を呈する(Leonhard er al)。 Abu-Rumeileh Sらは、73人のSARS-CoV-2患者がGBSおよび他の関連形態の急性炎症性脱髄性多発神経障害に苦しんでいたことをレビューした(Abu-Rumeileh et al 2020)。シンガポールからの研究は、COVID-19患者が、急性播種性脳脊髄炎(ADEM)および脳炎との関連性の多様な確実性を示したことを示した(Koh er al)。 COVID-19に関連した中枢神経系の脱髄性合併症に関する症例報告は限られており、重度のCOVID-19患者における急性播種性脳脊髄炎(ADEM)および髄膜脳炎の報告はこれまでにほとんど発表されていない(Moriguchi er al 2020; Parsons er al 2020; Reichard er al 2020; Zanin er al 2020)。Palao Mらは、COVID-19感染後の視神経炎の形での脱髄性疾患の最初の提示を報告している(Palao et al 2020)。ウイルス感染は、脱髄性疾患の発症と関連していることが知られており(Donati 2020)これはSARS-CoV-2誘発脱髄の仮説を煽っている。遅延した中枢神経系の損傷は、免疫系によって媒介されているように見える(Klein er al)。 SARS-CoV-2感染後のサイトカインストーム(IL1,IL-6,およびTNF-α)は、グリア細胞の活性化およびそれに続く脱髄に関与している可能性がある(Mehta et al 2020)。これらの報告は、COVID-19患者における急性神経学的合併症が脱髄病変によって持続する可能性があることを示唆しており、したがって、中枢神経系の損傷を避けるために、早期の脳脊髄液分析および迅速な侵襲的治療が採用されるべきである。
低酸素
COVID-19患者の呼吸機能障害は、酸素レベルの低下をもたらし、低酸素症が続く(Cavezzi er al 2020)。正常な血中酸素濃度は約95%であり、この濃度が90%を下回ると脳に十分な酸素が供給されなくなる可能性がある(Berim 2020)。脳は酸素に対して最も敏感な臓器であるため、肺胞ガス交換の低下は脳の生理に直接影響を与え、不可逆的な一連の病理学的合併症を引き起こす可能性がある(Berim 2020)。また、脳細胞のミトコンドリアにおける嫌気性代謝の増加は、乳酸、脂質過酸化物、無酸素ラジカル、抗酸化システムの弱体化、および中枢神経系の合併症に寄与する可能性があるBBBの混乱のレベルを高めることにつながる可能性がある(Bhattacharyya et al 2014)。興味深いことに、乳酸のレベルの増加はpHの低下をもたらし、これはSARS-CoVの生存と成長に有利であると仮定されている(Li er al)。 低酸素はまた、頭蓋内血流の増加、脳毛細血管圧、頭蓋内血管の拡張、組織液の産生、脳のフリーラジカル、および膜脂質過酸化などの様々な合併症を引き起こし得る(Berim 2020; Cipolla 2009)。低酸素はさらに、脳血管痙攣と伝染性を急増させる代謝性アシドーシスを引き起こし、間質性脳浮腫、頭蓋内領域の高血圧、およびATP産生の減少につながる(Berim 2020; Cipolla 2009; Sekhon er al 2017)。これは、細胞内Ca2+過負荷、酸化ストレス、神経認知障害、脳損傷を開始する(Sekhon et al 2017)。COVID-19患者における拡張低酸素は、急性虚血性脳卒中、血液粘度の上昇、およびヘマトクリットレベルの上昇などのいくつかの脳血管イベントを誘発または減衰させる可能性がある(Desforges et al 2020)。
結論
COVID-19のアウトリーチと影響は呼吸器系に限定されておらず、このウイルスの干渉が正常な呼吸生理のみを阻害するという神話に自信を持って挑戦していた。COVID-19 は、BBB の伝染性を変更することによって、ニューロン輸送、血行性ルートを介して、ACE-2 受容体への接続を介して中枢神経系へのアクセスを獲得し、したがって、ニューロンのダイナミクスに影響を与える能力を持っている。COVID-19による神経細胞の損傷は、炎症性経路の誘発とサイトカインストーム症候群の誘発が関与していることを示唆する多くの証拠がある。サイトカインの関与は、神経変性疾患(アルツハイマー病、ハンチントン病、パーキンソン病)や神経精神医学的合併症(うつ病や不安症)などの大部分でよく文書化されているため、これらの合併症の確率はまた、COVID-19で倍増する。この不安は、これらの患者でパーキンソニズム、アルツハイマー病、てんかん、頭蓋内感染症、脳炎、髄膜炎、めまい、うつ病、不安、混乱、頭痛、不眠症、脳卒中、脊髄炎などのような合併症の出現を報告するCOVID-19患者の臨床所見を介して強さを取得する。これらの所見は、COVID-19を単に肺や末梢系の障害とは考えられないことを示唆しているが、むしろそれは複雑な関連する病理学の網目を持っている。しかし、これらの蓄積された証拠は、さらに適切な検証と確認を必要とする予備的な段階であるが、これらの知見は、患者がCOVID-19から回復した後も、長期的な合併症を防ぐために、COVID-19の中枢神経系の側面を非常に密接にモニタリングする必要があることを示唆している。