Contents
Chaperone-mediated autophagy (CMA)
関連記事
![]() オートファジー促進因子TFEB(転写因子EB)10の活性方法
オートファジー促進因子TFEB(転写因子EB)10の活性方法
概要
Chaperone-mediated autophagy (CMA)
シャペロン媒介オートファジー(CMA)とは、オートファジー経路のひとつであり、リソソーム依存性のタンパク質分解経路。
CMAによって分解される可能性のあるタンパク質にはさまざまな種類が存在するが、このプロセスにより、サイトゾルタンパク質の少なくとも30%が分解される。
加齢、高脂肪食、高炭水化物食などの不適切な栄養摂取による影響を受けることによって、脂質および炭水化物の代謝などの生理学的プロセス、神経変性疾患などの病理学的プロセスにそれぞれ関与する。
CMAのメカニズムについてはほとんど知られていないが、代謝障害や神経変性障害と関連付けられる調節因子と考えられている。
マクロオートファジーとの違い
- オートファゴソームやオートリソソームの形成を伴わない。
- 標的は細胞小器官ではなく細胞タンパク質(アミノ酸ではなくモチーフに結合)
- HSC70との相互作用によりリソソーム膜を横切って内腔へ直接送達される。
www.ncbi.nlm.nih.gov/pmc/articles/PMC3078170/
(下記図で左下の経路)

www.novusbio.com/antibody-news/antibodies/chaperone-mediated-autophagy-cma-does-it-all
マクロオーロファジーよりも選択的にタンパク質の品質管理を行う特にCMAは活性化される。
CMAの基質は解糖に関する酵素であり、活性化されるとエネルギーのグルコース利用が低下し脂肪燃焼プロセスが促進されケトンの利用率がより高まる。
CMAのメカニズム
分子メカニズム
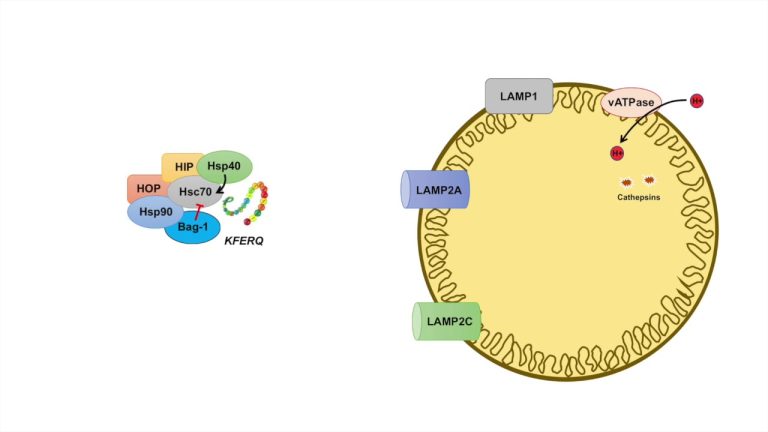
LAMP-2AとHSC70
CMAの2つの主要なタンパク質プレーヤーは、LAMP-2AとHSC70。
LAMP-2Aはリソソーム膜でタンパク質基質の受容体として機能するが、HSC70はタンパク質標的に特異的に結合し、CMA分解プロセスにおいてそれらをリソソーム内腔へ取り込む。
シャペロンHSC70は、特定のアミノ酸ではなく、モチーフ(KFERQ)を構成する残基の特性によって標的に結合できるかどうかが決まる。
LAMP-2AはCMA経路の律速成分。リソソーム膜でのLAMP-2Aレベルの変化によってCMAの分解速度が調節される。LAMP-2Aがアップレギュレーションされるすべての条件はわかっていないが、緩やかな酸化的ストレス、遺伝毒性損傷、低酸素症、T細胞活性時の転写因子(NFAT1)などによってでデノボ合成が誘導される。
www.ncbi.nlm.nih.gov/pmc/articles/PMC6399518/
CMAの作用
ミトコンドリア機能の保護
CMAはミトコンドリアタンパク質を効率的に分解することにより、ミトコンドリアの機能を維持するのに役立ち、細胞エネルギーに良い影響を与える可能性がある。
www.ncbi.nlm.nih.gov/pubmed/27171370/
脂質代謝の調節
マウスの研究ではCMAを経由して多くの解糖系代謝酵素が数倍の速さで劣化することがわかった。
www.ncbi.nlm.nih.gov/pubmed/7491910/
これは、飢餓時に肝臓の解糖系を遮断に寄与し末梢器官のエネルギー不足を防ぐ役割を果たす。
www.ncbi.nlm.nih.gov/pubmed/25043815/
免疫応答
CMAはT細胞を負に調節する2つの調節因子ITCHとRCAN1を低下させる。そのためCMAの機能不全による2つの因子の持続的な高レベルは、細胞増殖とサイトカイン分泌を減少させる原因となっており、CMAと免疫応答の間には重要な関連性があることが示されている。
疾患との関連
CMA活性の障害は、パーキンソン病、アルツハイマー病、前頭側頭葉変性症、ALSなどの神経変性障害の病因と関連する。CMAはいくつかの凝集するタンパク質の分解に寄与するため、CMA活性の低下は毒性凝集体の蓄積につながる。
タウとCMAの相互作用
タウタンパク質は、オートファジーリソソーム系によって分解され、さまざまなフラグメントが生成される。これらのフラグメントはHSC70に結合するCMA基質となる。
これらのフラグメントがリソソームに到達するとリソソーム膜に結合しリソソーム損傷を引き起こす。その結果病理学的なタウ凝集体の形成を引き起こし、CMA標的の分解を阻害する。
www.ncbi.nlm.nih.gov/pmc/articles/PMC2758146/
ハンチントン病の細胞モデルおよびマウスモデルでは、マクロオートファジー抑制の代償メカニズムとしてCMAが活性化された。(lys-HSC70、LAMP-2Aの増加)
αシヌクレイン
αシヌクレインはCMA基質であり、CMAの機能不全がパーキンソン病のαシヌクレイン蓄積に役割を果たす可能性があることを示唆する。
www.jbc.org/content/283/35/23542
CMAまたはLAMP2A発現のin vitro、in vivoでのアップレギュレーションは、αシヌクレインレベルを低下させ神経変性からの保護を示す。
www.ncbi.nlm.nih.gov/pubmed/23757764
初期段階でのパーキンソン病脳ではαシヌクレインが蓄積していないにも関わらずLAMP2Aレベルは低下しており、CMA機能不全がパーキンソン病の初期イベントであることを示唆する。
www.ncbi.nlm.nih.gov/pubmed/24477431
TDP-43
www.nature.com/articles/s41598-018-24463-3
加齢によるLAMP-2Aの減少
CMAの活性は加齢によって減少するが、リソソーム膜におけるLAMP-2Aに起因する。
www.ncbi.nlm.nih.gov/pubmed/17284523/
CMAの活性は、老化マウスのタンパク質損傷処理能力を向上させ、肝機能を改善する。
www.ncbi.nlm.nih.gov/pubmed/18690243/
CMAの活性と阻害
CMAの活性
- 栄養欠乏
- ケトン体
- 酸化ストレス
- 遺伝毒性損傷
- 放射線ストレス
- タンパク質凝集などの細胞ストレス
- αシヌクレイン
- 血清欠乏
- 低酸素症(HIF-1α)
- NRF2
- ERストレス
ケトン体
ケトン対はCMAを活性化し、CMAに由来するアミノ酸の加水分解により、α-ケト酸自体を生成し、CMAとエネルギー生産の間に正のフィードバックループが確立される。
ケトン体によるCMAの活性化はROSの生成を通じて起こる。これはT細胞の活性化によって生じるものと同様のメカニズムが働いていることを示唆する。
www.ncbi.nlm.nih.gov/pubmed/15883160/
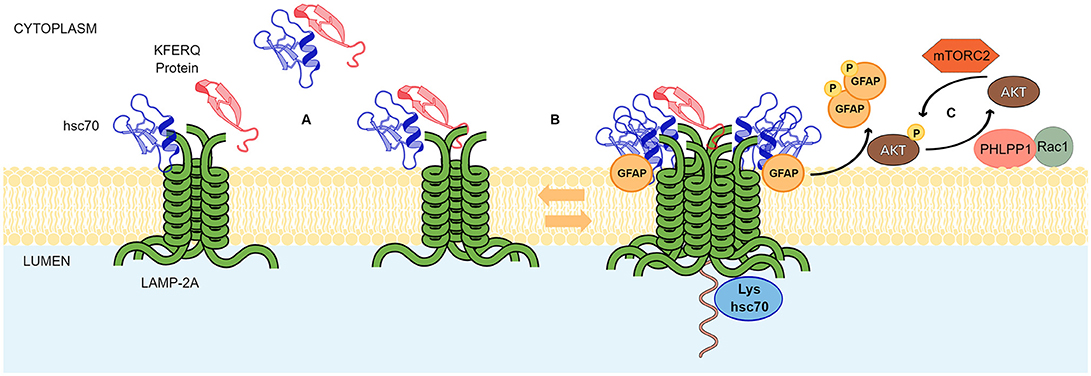
CMAの阻害
- mTORC2
- Akt
- RCAN1(アルツハイマー病)
www.frontiersin.org/articles/10.3389/fendo.2018.00778/full#h2
CMAの機能不全
リソソーム膜の脂質組性の変化は、CMAに影響を与える。高脂肪食はリソソーム膜リピドームを変化させ、LAMP2Aの安定性と多量体化能力の両方を損なう。
脂質膜の組性を変更することでCMAの活性を調節し、病理学的な介入を利用できる可能性がある。
www.ncbi.nlm.nih.gov/pubmed/22331875/