Contents
Clinical Trials in Alzheimer’s Disease: A Hurdle in the Path of Remedy
www.ncbi.nlm.nih.gov/pmc/articles/PMC7152954/
要旨
ヒト臨床試験は、臨床基準ではまだほとんど治療不可能な疾患の病状や症状の進行を改善することを目的としている。理想的な臨床試験は、「疾患修飾薬」、すなわち、疾患の病理学的特徴や分子基盤を特異的に修飾し、疾患の進行に大きな影響を与えるであろう治療薬を試験することである。
しかし、アルツハイマー病の場合、このアプローチは、臨床的に有用な治療法の開発の足かせになっているように思われる。過去25年間、アルツハイマー病を対象とした臨床試験は、βアミロイド(アミロイドβ)とアルツハイマー病の進行と病理に関するアミロイドβ仮説に焦点を当ててきた。この仮説によると、アルツハイマー病の進行はアミロイドβペプチドの蓄積に続いて始まり、最終的にはシナプスの喪失と神経細胞の死に至る:アルツハイマー病の真の根本的な病理学的特徴である。
アミロイドβ仮説に基づく臨床試験では、アミロイドβの形成を減少させたり、クリアランスを高めるために、この経路の原因となるステップを標的としており、この目的では薬剤は成功しているが、認知機能の回復や認知機能の低下を遅らせることにはまだ成功していない。そのため、アミロイドβ、その前駆体、またはその生成物を標的としたアルツハイマー病治療選択肢の開発における資源のさらなる活用が再評価されるべきである。
本レビューの目的は、米国でどのようにヒト臨床試験が行われているかを概観し、最近のアルツハイマー病を対象とした失敗した試験の結果を評価することであり、その大部分はアミロイドβ仮説に基づいていた。これらの現在の知見に基づいて、アミロイドβの低下は実証されていない戦略であり、タウの病理学的形態を含む本疾患の治療のための他のターゲットに再焦点を当てる時期に来ているのではないかと示唆されている。
1. 中枢神経系疾患治療の課題
アルツハイマー病に関する最近の臨床試験について議論する前に、中枢神経系疾患の治療に関連した課題のいくつかを強調することが重要である。中枢神経系に特有の課題は、少なくとも一部では、脳の科学的理解が他の生理学的システムほど進んでいないという事実に由来している。中枢神経系内の障害の大部分では、関心のある状態の病態生理についての理解が最小限にとどまっているか、あるいは場合によっては全くない。したがって、分子標的が十分に定義されていない治療法を設計することは、克服しなければならない明らかなハードルである。このような背景から、神経疾患や神経変性疾患の罹患率が高く、経済的負担も大きいにもかかわらず、多くの神経疾患や神経変性疾患に対する疾患修飾療法が存在しないという厳しい現実がある。また、神経疾患や精神疾患は、ヒトの脳が複雑であることもあり、他の全身疾患と比較して後期臨床試験の不成功率が高くなっている[1]。このため、他の治療領域と比較して開発プロセスが長くなり、特に臨床試験の初期段階では、ボランティアや患者の安全性リスクが高くなることが関係している可能性がある。もう一つの交絡する主観的要因はプラセボ効果であり、これは患者の治療上の有益性への期待が薬物投与に対する反応を妨げる可能性がある[2]。実際、プラセボ効果はすべての臨床試験、特に中枢神経系の試験に蔓延している [3]。例えば、疼痛、パーキンソン病、統合失調症などの最近の多くの神経系臨床試験の失敗は、高いプラセボ効果の直接的な結果である[3]。
中枢神経系の薬物試験のかなりの割合は主観的エンドポイントにも依存しており、データのばらつきの可能性を高めることができる。例えば、多くのアルツハイマー病試験は、主観的な記憶の改善や認知の変化を捉えるためのアルツハイマー病評価尺度(ADAS-cog)の使用などのエンドポイントに依存しており、有効性の主要な尺度となっている。臨床家や試験実施施設によって評価方法の経験が大きく異なるため、データの意図しないばらつきが生じている。さらに、認知機能障害、障害、生活の質、または全体的な疾患の重症度を測定するための尺度を用いた臨床評価は、治療法の対症療法的効果の影響を受け、短期的には、この効果を疾患修飾と区別することができない。これらの要因が組み合わさって、第II~III相試験で有効性を証明することはほぼ不可能となっている[4]。
これらの主観的エンドポイントに加えて、中枢神経系疾患の治療薬開発の成功を制限してきた障壁がある。固有の課題は、ヒトの脳の複雑さと、関連する組織環境で薬物候補を研究する可能性が限られていることに起因して、前臨床段階から始まる。さらに重要なことは、血液脳関門(BBB)の側面が薬物の浸透性に複数の問題を生み出していることである。薬物開発の初期段階で有望性を示した治療薬は、BBBを越えられないことが原因で、その後の臨床試験を成功裏にクリアできないことがよくある。低分子医薬品の98%以上、大分子医薬品のほぼ100%がBBBのために脳への薬物送達が妨げられていると推定されている[5]。
おそらく、中枢神経系疾患の治療において克服しなければならない最も驚くべき客観的なハードルの一つは、患者の募集である。患者募集は臨床試験の中で最も時間がかかり、最も費用がかかる側面であり、臨床研究の進展に対する大きな障壁となっている。患者募集の課題は、少なくとも部分的には、多くの中枢神経系疾患に関する一般の人々の意識が低いことに起因しており、その結果、診断が遅れる可能性がある。アルツハイマー病では、これは長年の問題となっている[6-8図1は、中枢神経系の障害や疾患の治療のための治療薬の開発に関連する課題をまとめたものである。
図1 中枢神経系疾患の治療への挑戦
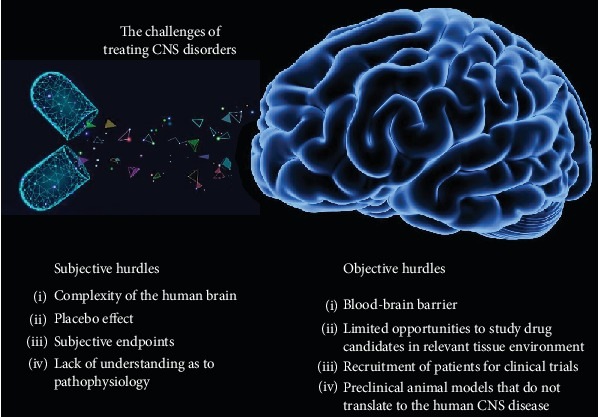
中枢神経系疾患の治療薬を開発する際には、主観的なハードルと客観的なハードルの両方を乗り越えなければならない。これらのハードルを乗り越えることは困難であり、少なくとも医薬品開発にかかる時間とコストの増大につながり、最悪の場合、全身疾患の場合には実現するであろう多くの薬の失敗につながることがわかっている。
2. FDA臨床試験の概要
米国では、臨床試験は食品医薬品局(FDA)によって規制されており、市場に出回る医薬品が、目的とする疾患や病気の治療に有効であり、目的とする患者集団にとって安全であることを保証している[11]。新薬のプロセスは2つのセクション(前臨床と臨床)に分かれており、一般的には12~15年の歳月をかけて26億ドル(2700億円)の費用がかかる[12, 13]。新薬5,000種類のうち約5種類の新薬が前臨床段階を完了し、ヒトでの臨床試験この5つのうち、通常1つの医薬品がFDAによって承認され、市場に出回ることになる[14]。
臨床試験は、I~IVと呼ばれる4つの異なるフェーズに加え、前臨床フェーズ、探索的試験である第0相試験から構成されている[13, 15](表1)。臨床試験のプロセス全体では、12~15年かかる可能性があり、臨床試験の80%が第I相または第II相で失敗しているため、成功の保証はない[13]。
表1 FDAによって規制されている臨床試験段階
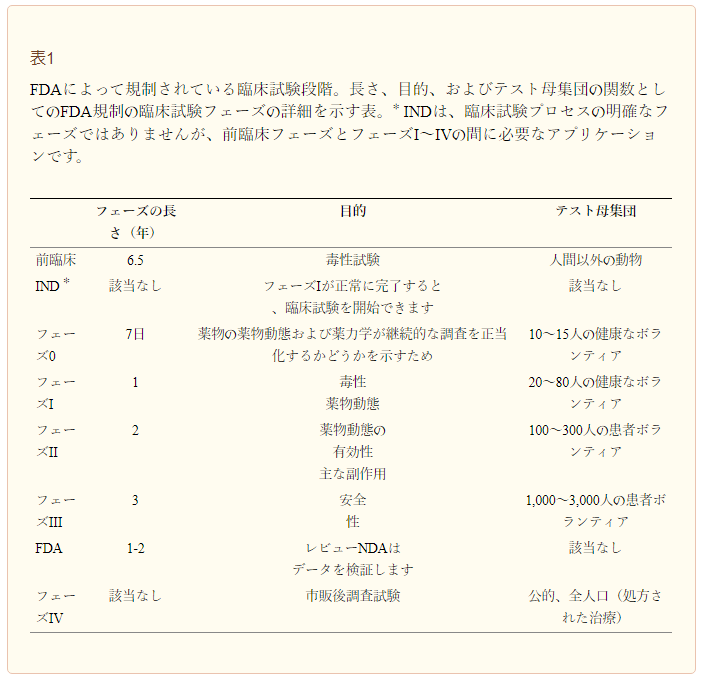
臨床試験プロセスの各段階で得られたデータの多くはNIH臨床試験データベース(clinicaltrials.gov)を通じて一般に公開されているが、これは2007年に施行されたものであり、まだ比較的新しい透明性のレベルである。10年以上が経過した現在、規制や適時報告の実施はいささか光沢を欠いたままであるため、すべての臨床試験情報が公開されているわけではないことに注意することが重要である。これは、2017年にNIHとFDAが協力して、このような報告の実施を明確にし、可能にすることを意味するいわゆる最終規則を提訴した後でさえも同様である[16]。
2.1. 前臨床フェーズ
臨床試験は、通常6.5年間続く前臨床試験から始まる。前臨床段階は、提案された薬剤の薬物動態、化学、製造計画、潜在的な品質管理に関する情報を収集することを目的としている[15]。前臨床段階では、試験管内試験および生体内試験モデルを用いた毒性試験を実施することでリスクが決定される。生体内試験試験では、少なくとも2種類の異なる哺乳動物種(一般的にはマウスとラット)が必要である[11]。前臨床試験におけるモデル系としてのマウスの使用は、これらの研究から得られた知見が必ずしもヒトの神経生理学に翻訳されるとは限らないため、アルツハイマー病試験の高い失敗率の一因となっている可能性がある[17]。
2.2. フェーズ0
IND申請のうち、臨床的に承認された医薬品は約10%しかないため[18] 、また、医薬品開発は時間がかかり、費用がかかり、リスクの高い命題であるため、場合によっては、早期に試験を実施して、期待される標的と薬剤が結合しているかどうかを評価し、その結果、ヒト被験者において期待される臨床効果が得られる可能性が高いかどうかを評価することがある[19]。第0相試験の主な目標は、比較的少人数の被験者を対象とした無毒性量の薬物を投与して、その後の大規模な第I-II相試験の設計と潜在的な成功に役立つ情報を得ることである(表1)。第0相試験のもう一つの潜在的な目標は、非臨床モデルで定義された作用機序がヒトで達成できるかどうかを判断することである[20]。第0相試験では、最も初歩的な要件さえ満たされていない薬剤を排除することができるため、時間と費用を節約することができる[21]。
2.3. フェーズI~IVとNDA
第0相臨床試験が実施されていない限り、第1相臨床試験は候補薬のヒトへの曝露が初めて行われることになるため、健康なボランティアの少数サンプルでの試験に力を入れなければならず、当分の間は疾病集団に特有の、あるいはより極端な副作用を避けなければならない[11]。第I相試験は主に安全性試験であり、治療に関連する毒性および薬物動態の要因をさらに解明することに関心がある。これらの試験は通常、少数の被験者を対象とする単盲検試験である(表1)[13]。
第II相試験は、特定の疾患に対する薬剤の有効性を評価し、薬剤の使用に最適な便益-リスクプロファイルを提供する有効量を決定する対照臨床試験である[13]。第II相試験では、その薬物が治療を目的とする疾患を持つ患者を対象に、より大規模(数十人から数百人)な試験が実施される。副作用の判定に加えて、第II相試験では有効性の評価が開始される [13]。平均的な期間は2年で、第II相試験の後、FDAと製薬スポンサーが協力して第III相試験のデザインを決定する[22]。試験されたすべての医薬品の80%が、第I相または第II相試験の後、過剰な毒性または有効性の欠如のためにスポンサーによって中止されることは注目に値する[23]。
第III相と第IV相は、その規模が大きく、安全性と有効性の最終確認であることから、これまでに議論した試験デザインとは異なる。第III相試験は、対象疾患集団の数千人を対象とした大規模な対照試験である。この試験では、有効性を評価し、副作用をモニターし、一般的に使用されている代替療法と薬剤を比較する [15]。これらの試験では、提案された治療法の安全性と有効性の評価が継続されるが、観察された結果が統計学的に有意なものであることを確認するのに十分な規模で行われる [11] [23]。第III相試験の重要な側面は、臨床効果が本当に存在する場合には、少なくとも80%の確率で臨床効果を見いだすことができるように、十分な数の患者を参加させなければならないということである。これはしばしば研究の力と呼ばれている[23]。
第III相試験が終了すると、新薬承認申請(NDA)がFDAに提出される[11]。この暫定期間はFDA承認フェーズと呼ばれることもあり、通常は1~2年続き、この間にすべての過去のデータがFDAによって検証される [11; 14]。NDAは、FDAに医薬品の安全性を評価し、米国での販売を承認するための正式な要請である[22]。Office of Federal Registerによると、臨床データを必要とするNDAの2019年の申請料は2,588,478ドル(約2億7000万円)である[24]。NDAの提出後、FDAは60日以内に審査のための申請書を提出しなければならない。それによると、FDAはNDAの少なくとも90%を標準薬では10ヶ月以内に、優先薬では6ヶ月以内に審査し、対応している[24]。
NDAが承認されれば、その薬は市場に出て、その薬が処方された一般の人々を対象に長期的な安全性と副作用を評価する第IV相試験を受ける可能性がある[23]。第IV相試験は、大規模な集団を対象に長期間にわたって実施されるため、長期的で特有の効果を特定して集計することができる。例えば、第IV相研究は母集団が大きく、併存疾患が存在するため、副作用を検出する可能性が高い[22,25]。FDA臨床試験の概要および各相の推定期間については、表1を参照のこと)。
3. アルツハイマー病の臨床症状
アルツハイマー病は、記憶喪失や他の認知症状が現れる何十年も前に、脳内で発生した病理学的な後遺症が始まる進行性の障害である。この段階は前臨床アルツハイマー病と呼ばれ、病理学的変化が脳内で、特に内側側頭葉記憶回路で行われているが、患者は通常、この段階では無症状である。海馬形成を含むこのネットワークは、アルツハイマー病脳ではかなりの萎縮を受ける。さらに、この回路は、アルツハイマー病患者のリコールタスク中に活動の低下を示している[26]。初期の疾患過程は、デフォルトモードネットワークの実行機能回路にも影響を与える。この回路は後帯状皮質(PCC)を含み、健康な参加者と比較して初期のアルツハイマー病患者では活動の低下を示す [27]。これらの領域に対するアルツハイマー病の重篤で早期の影響は、病気のプロセスを通じて多少免れているように見える小脳などの他の領域で見られる相対的な保護とは対照的である[28]。前臨床段階の診断とこの段階の薬理学的治療は、疾患の進行を遅らせるために不可欠である[28]。前臨床段階には、軽度、中等度、重度の3つの主要な症状の段階が続き、それぞれ認知障害の重症度が増すことを特徴とする。このように、軽度の初期段階では、記憶障害および集中力の問題がある。最も長い段階である中等度の段階では、出来事の記憶障害、問題解決のための思考や行動の困難、衝動的な行動、注意力の低下、言語障害、および潜在的な落ち着きのなさや焦燥感などの症状が現れる。重度の、後期段階では、患者はコミュニケーションを取ることができず、彼らのケアのために完全に他人に依存している。アルツハイマー病は不可避的に進行し、5〜10年以内に致命的である[]。最近、アルツハイマー病の新しい早期段階が提案され、アルツハイマー病の進行期と指定されている。アルツハイマー病のこの移行期は軽度認知障害(MCI)とも呼ばれ、症状には、エピソード性記憶喪失の証拠、想起遅延、実行能力の低下、および行動問題、特にうつ病、不安、睡眠障害が含まれている[31]。興味深いことに、うつ病に関しては、アルツハイマー病患者の20~25%が大うつ病エピソードに苦しみ、さらに20~30%の患者が軽度のうつ病の症状を経験することが研究で示されている[32]。
4. アルツハイマー病の病理学。神経原線維のもつれとアミロイドβプラーク
4.1. 神経原線維のもつれ
神経原線維性タングル(NFT)は、アルツハイマー病病理に特徴的な本質的な特徴を示す細胞内病変である[33, 34]。NFTは、顕著な細胞毒性を示し、この毒性を介して細胞全体のシグナル伝達機能障害と神経細胞死に寄与するタンパク質の集合体である[33-35]。タウ病理学の細胞骨格効果に加えて、翻訳後修飾されたタウとそれが形成する凝集体に関連した潜在的な毒性がある。高リン酸化されたタウが微小管から剥離すると、ペアらせん状フィラメント(PHF)と呼ばれる繊維状の構造になる。これらの繊維状で不溶性のPHFは、NFTの主成分であると考えられている[34, 37, 38]。リン酸化されたタウは、それが産生する凝集体と同様に、細胞のシグナル伝達や軸索輸送の障害に寄与している。
NFTsの毒性効果は、局所的な神経細胞死を引き起こすのに十分であるように見えるが、NFTsと高リン酸化タウの真の病原性は、脳全体のもつれ病理学の “プリオン様 “の広がりのためのプロパティーにある[40-42]。アルツハイマー病脳の死後の組織サンプルは、死亡前に報告された症状の進行や重症度とタングル病理の合流点や位置との間に直接的な相関関係を示している[40, 42]。この相関関係のため、NFTの広がりがアルツハイマー病で見られる症状の進行と特徴的なBraak病期分類の原因になっている可能性があると考えられている[40, 42]。さらに、死亡時にNFTを示さなかった脳領域における可溶性タウの所見は、特に患者が生きていれば直線的に進行するBraak病期分類と相関していたであろうことから、タウ(もつれ自体ではなく)が脳を介したNFT病理の広がりを可能にする移動性の特徴であることを示唆している[43]。最後に、培養中の初代ニューロンの免疫組織学的研究は、凝集したタウの存在がタウの更なるミスフォールディングを誘発するのに十分であることを示しており、したがって、アルツハイマー病脳を通してタウとNFTの拡散の “プリオン様 “な方法を支持している[42]。
4.2. アミロイドβの病理学
老人斑はアルツハイマー病に特徴的な細胞外病変である。これらのプラークは、その長寿、安定性、およびその結果として生じる毒性の大部分は、通常のミクログリアクリアランスプロセスでは分解が困難であることが証明されているβシート二次構造に起因するアミロイドβタンパク質凝集体で大部分が構成されている[44, 45]。アミロイドβタンパク質断片は、アミロイド前駆体タンパク質(APP)の酵素的セクレターゼ切断の産物である。前駆体タンパク質の切断を担当するタンパク質分解酵素には、α-、β-、およびγ-セクレターゼが含まれる。α-セクレターゼは、アミロイドβタンパク質断片自体が細胞外の切断部位で切断される「善玉経路」の責任者である[48, 49]。アミロイドβタンパク質フラグメント内でのこの切断は、後続のγ切断による無傷のアミロイドβペプチドの生成を防ぎ、その結果、神経毒性のある凝集を防ぐことができる[46, 47, 49]。アミロイド生成経路は、図2に示されているように、細胞質のカルボキシル末端から完全に解放された無傷のアミロイドβフラグメントを生成するために、βおよびγセクレターゼの両方の連続的な協力を必要とする[47, 50, 51]。βおよびγセクレターゼの両方による酵素的切断に続いて、脂質可溶性アミロイドβ1-40/42は、オリゴメラーまたはフィブリルの形態のいずれかで神経毒性効果を発揮する可能性がある[52]。アルツハイマー病脳では、アミロイドβ1-40とアミロイドβ1-42のバランスのとれた調節は、分泌されたアミロイドβの大部分がフィブリル化しやすい1-42フラグメントであるように乱れている[52, 53]。これは、アミロイドβがタンパク質の適度なクリアランスを可能にするのに十分に遅い速度でフィブリル形態を採用する高可溶性の1-40フラグメントであるのとは対照的である[52-54]。
図2 アミロイドβカスケードと最近ヒト臨床試験で失敗した潜在的な治療法
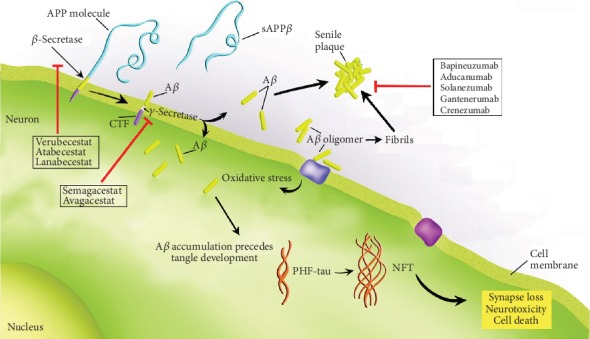
アルツハイマー病脳で起こると考えられているようにアミロイドβの生産と沈着に関与する主なステップを説明する高度に模式的な図面。産生は、β-またはγ-セクレターゼによるAPPの切断に続いて、最終的に細胞外プラークに沈着するオリゴマーおよびフィブリルの形成に始まる。大まかには、示されている治療薬は、ミクログリアによって媒介されるアミロイドβの形成またはクリアランスのいずれかを標的としている。さらに、アミロイドβと最終的なシナプスの損失および細胞死との関連は、もつれの発生を介してリンクされている。
5. アミロイドβを標的とした疾患修飾治療に関する臨床試験
5.1. アミロイドβ
25年以上前から、アミロイドβ仮説(またはアミロイドカスケード仮説)は、アミロイドβがアルツハイマー病の主な原因であり、タウのNFTへの凝集を促進し、最終的には神経細胞死を誘発するという仮説で、アルツハイマー病の分野の中心的な理論となっている[55]。この仮説は、アミロイドβが凝集(フィブリル化、より具体的にはオリゴマー化)すると、アルツハイマー病における記憶力や認知能力の低下につながる神経変性過程を誘発するというものである。この仮説の強力な支持は、若年性アルツハイマー病につながるすべての既知の変異がアミロイドβのレベルを増加させる全体的な効果を持っているという知識から来ている。アミロイドβ仮説、それはオリゴマーまたはプラークの形成または持続に関して、仮説に沿って任意の離散的なステップを目的とした薬剤介入は、アミロイドβ負荷と認知機能の低下の両方を抑制するために機能すべきであることを次のようになる。このフレームワークは、認知症に特徴的な認知症状とは対照的に、アルツハイマー病の発症機序を標的とした医薬品開発のための論理的なバックボーンとなる。これらの医薬品のアプローチには、β-およびγ-セクレターゼによるAPPの初期の病原性処理を標的としたものや、この酵素的切断の産物を対象としたものが含まれる(図2を参照)。
5.2. 方法
以下の臨床試験データのレビューは、包括的かつ包括的であることを目的としているが、アルツハイマー病に関与する過去の臨床試験のすべてを網羅的にリストアップしたものではない。アミロイドβ仮説とその論理的帰結である酵素療法や免疫療法の本質は、アミロイドβに影響を及ぼす可能性のあるあらゆる発見可能な個別の標的を調査することを可能にしている。そのため、この分野の深さは、関連するが技術的には異なる医薬品の大多数が同様の臨床上の失望をもたらし、ユニークな知見は慣用的なルールの例外となってしまうというような冗長性を生み出している。このような冗長性の傾向に対抗し、本レビュー全体の有効性を維持するために、引用された試験は、それぞれのグループ内で代表的な出版物として機能する能力を持つものを選択した。データベース検索では、出版の新しさは厳密なガイドラインとしては使用されなかったが、選ばれた引用の大部分は15年以内のものでした。これは、一般的な臨床試験のペース、特に神経学的に焦点を当てた臨床試験、またはアルツハイマー病臨床介入の全体的なスキームにおけるアミロイドβ仮説の相対的な新規性によるものかもしれない。
5.3. 臨床試験の結果
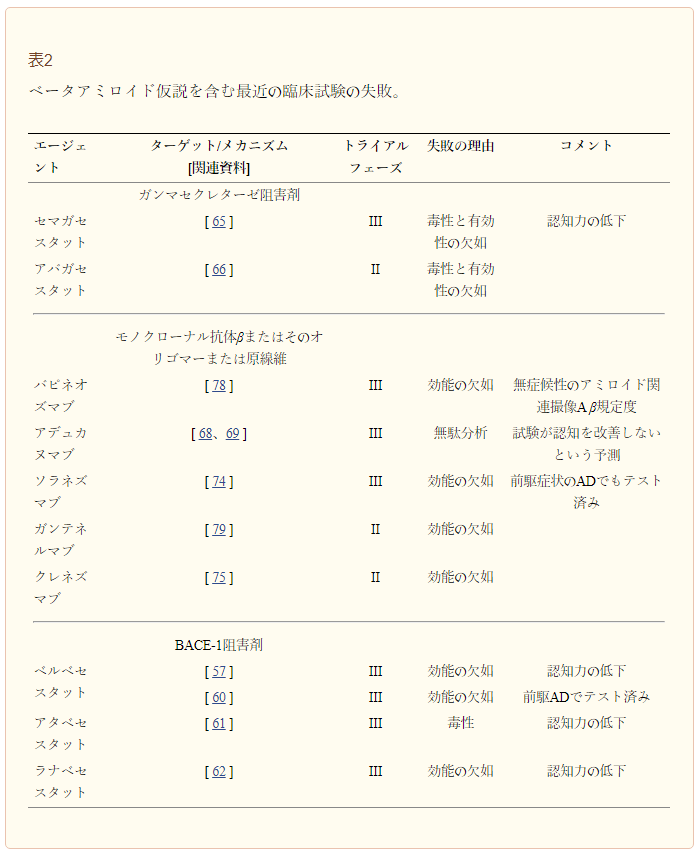
APPからアミロイドβへの酵素的切断は、βサイトAPP切断酵素1(BACE-1)とγセクレターゼによる前駆体タンパク質の逐次処理に依存している [49, 50]。APPからのアミロイドβタンパク質断片の放出は、βサイトとγサイトの両方での切断を必要とするため、いずれかの部位特異的酵素の阻害は、細胞外空間におけるアミロイドβの蓄積を防止するのに十分である[47, 48, 50]。このスキームで開発された薬剤候補には、BACE-1およびγ-セクレターゼの阻害剤が含まれる。BACE-1阻害剤の薬理学的関与に関する証拠は、アミロイド陽電子放出断層撮影法(アミロイドPET)または免疫測定法による分析で決定されるように、そのような阻害剤による治療後のアミロイドβ濃度の低下から推測されることが多い[57, 58]。Villarrealらが行った2017年の研究では、進行した年齢のマウスモデルを用いて、BACE-1阻害薬であるベルベセスタットを投与すると、血漿中のアミロイドβ1-40が98%、アミロイドβ1-42が90%減少することが示された。さらに、この研究では、脳脊髄液(脳脊髄液)中のアミロイドβ1-40およびアミロイドβ1-42のレベルが低下していることが示された(それぞれ62%および68%の低下)[59]。ヒトの研究では、BACE-1阻害薬アタベセスタットによる治療に対するアミロイドβレベルの低下に関して同様の結果が示されている。初期のアルツハイマー病患者を対象としたプラセボ対照第I相試験の結果では、アタベセスタットの投与により脳脊髄液中の毒性アミロイドβレベルが最大95%まで低下したことが示されている[58]。アミロイドβレベルの低下というこれらの有望な結果があれば、アミロイドβ仮説への厳しい追認は論理的に認知機能障害の平行した低下を結論づけるであろう。しかし、軽度・中等度アルツハイマー病を対象としたベルベセスタットの多施設共同第III相試験の結果は、低用量および高用量治療条件(12mg/日 vs. 40mg/日)において、アルツハイマー病評価尺度(ADAS-cog)およびアルツハイマー病協力研究活動日常生活インベントリ尺度(ADCS-日常生活動作)によって定義される認知機能の悪化(プラセボ条件で観察されたものと同様)を示している[57]。さらに、低用量投与群と高用量投与群の両方で、プラセボ群と比較して、肝酵素の上昇を含む重篤な副作用の統計学的に有意な発生率が示された [57]。さらに、進行性アルツハイマー病を対象としたベルベセスタットの研究では、高用量治療群(40mg/日)ではプラセボ群と比較して、Clinical Dementia Rating Scal-Sum of Boxes(CDR-SB)で定義される認知機能が悪化し、治療群では副作用の発現率が継続的に増加していることが示されている[60]。第II-III相アタベセスタット試験の予備的なアドホック統計解析では、同様の有害事象の発生率と、プラセボ群で観察された継続的な低下とは異なる認知機能の指標の低下が示されている[61]。さらに最近では、BACE-1阻害薬であるlanabecestatは、第III相臨床試験の独立評価で主要評価項目を満たす可能性が低いと示されたため、スポンサーによって中止された[62]。最後に、これらの失敗に加えて、ノバルティスが最近、2つの第II-III相臨床試験におけるBACE-1阻害薬umibecestatの試験を中止すると発表したことも、事前に計画された中間解析で認知機能のいくつかの指標が悪化したためである。スポンサーは、本試験の参加者にとっての潜在的な有益性はリスクを上回るものではないと結論付けた[63]。
APPの律速制限的なβセクレターゼ切断を阻害する臨床試験に加えて、γセクレターゼもまた、アミロイドβの減少と認知機能の回復の両方の潜在的なターゲットとして検討されている。BACE-1阻害試験と同様に、アミロイドβレベルの低下からターゲットの関与が推測される。2009年に行われたγセクレターゼ阻害薬セマガセスタットの研究では、240mgを経口投与すると用量依存的にアミロイドβ産生が最大84%減少することが明らかになった[64]。アミロイドβレベルの低下が期待できるにもかかわらず、2013年に実施された第III相試験では、プラセボと比較して高用量投与時にADAS-cogおよびADCS-日常生活動作で評価される認知機能が悪化したことが示された[65]。さらに、非黒色腫皮膚がんの発生率の増加、体重減少、失神などの重大な有害事象が治療に関連していることが明らかになった。高用量治療(140mg/日)に伴うこれらの有害事象は、プラセボと比較して治療中止率が高かった(30% vs. 11%)。さらに、140mgを投与された治療群では、プラセボ群と比較して致死率が高いことが明らかになった(14人対9人)[65]。追加のγセクレターゼ阻害剤であるアバガセスタットは、以前に議論された薬剤候補と比較して、アミロイドβ1-40およびアミロイドβ1-42レベルの有意な減少が少ない(それぞれ10-15%および5-9%)ことが判明した[66]。さらに、アバガセスタットはプラセボと比較して、体積磁気共鳴画像法(MRI)で測定される脳萎縮を有意に増加させることが示された[66]。アバガセスタットの第Ⅱ相試験では、他のγセクレターゼ阻害薬と同様に高用量(125mg/日)で重篤な有害事象が発生し、プラセボと比較して高用量治療(100mg/日および125mg/日)ではADAS-cogで測定される認知機能の変化が認められた[67]。しかしながら、第II相試験で観察された認知機能の低下が、観察された脳萎縮の増加と相関しているようには見えない[67]。
APPのアミロイド原性処理に関与する酵素の阻害に加えて、β-およびγ-セクレターゼ切断の生成物を直接標的とする医薬的試みが行われてきた。このクラスのアミロイドβ標的化薬剤は、典型的には、溶解性および凝集性の様々な状態のアミロイドβに対するモノクローナル抗体である[68]。このタイプのすべての薬剤において、標的の関与は、クリアランスの増加またはアミロイドβの沈着の減少のいずれかをもたらすと想定されており、したがって、アミロイドβ特異的PET分析およびイムノアッセイによって評価することができる。アミロイドβ仮説に従えば、アミロイドβ濃度の低下は認知機能の低下に反映されると予想される。
フィブリル化する前のアミロイドβに特異的な抗体には、ducanumab、solanezumab、およびcrenezumabがある。これらの抗体は、オリゴマー型、可溶性型、および原始フィブリル型のアミロイドβを標的とする。抗体aducanumabは、第I相試験の様々なサブステージで中等度の成功を示した[68]。この成功には、Mini-Mental State Examination(MMSE)による認知機能低下の統計的に有意な安定化が含まれていた[68]。この試験は当初、第III相試験が無益であったために終了したが、これは、認知に対する観察された効果がより大きな試験集団で統計学的に再現されなかったことを意味する [69]。これらの第III相所見の解釈は、Aducanumabの初期研究でアミロイドβプラークの沈着を減少させる抗体の能力を確認したこととは対照的である[68]。見かけの標的関与と臨床結果との間のこの不一致は、先に述べたように、アミロイドβが効果のない標的であることを示している可能性がある。しかし、2019年10月現在、バイオジェン社は、この無益性分析の再評価により、CDR-SBによって評価されたアデュカンマブ(10mg/kg)の高用量治療群では、プラセボと比較して認知機能の低下が23%減少したことを明らかにしたと発表している[70,71]。この再評価は、当初の無益性分析では使用されなかった追加データが得られたことを受けて行われたものであり、アウトカムの変化は高用量治療群でのみ認められ、他の用量では、または試験の他のサブグループで評価された場合には追加の有益性は認められなかった[70-72]。このようなサブグループ間の再解析の間の顕著な転帰の不一致は、Biogen社がaducanumabのFDA承認を求めてFDAに復帰した際に、この再評価された無益性解析の妥当性について、いくつかの疑念を呼び起こしている[73]。
可溶性アミロイドβペプチドを標的とする抗体であるソランズマブの第III相試験の結果は、プラセボと比較して、治療群のMMSEおよびADAS-cogで評価した場合、認知機能低下の有意な減少を示すことができなかった[74]。ビタミンD欠乏症や変形性脊椎関節症などの有害事象の発現率は、治療群とプラセボ群で有意差はなかった(84.5% vs. 83.4%)[74]。アミロイドβの可溶性形態と不溶性形態を別々に標的とすることに加え、クレネズマブの投与により、両者の間の移行を標的とすることが可能である。クレネズマブの第II相試験の結果では、低用量(300mg/日)または高用量(15mg/kg)のいずれにおいても、ADAS-cogまたはCDR-SBで評価される認知機能低下の有意な安定化または緩徐化は認められなかった[75]。有害事象の発生率は、低用量、高用量、およびプラセボ条件の間で同程度であることが明らかにされており、したがって、本薬の投与に関連しているとは考えにくい [75]。この明らかな効果の欠如にもかかわらず、高用量治療群では、脳脊髄液 アミロイドβ1-42のレベルが有意に増加していることが明らかになった。このアミロイドβの増加は、アミロイドβのクリアランスの減少(望ましくない効果)または沈着の減少(望ましい効果)に応答してアミロイドβの動員が増加したことのいずれかを示唆している可能性があるため、解釈が難しい。この第II相試験の事後統計解析では、ADAS-cogで評価されたクレネズマブの高用量投与による認知的効果の可能性が示唆されている(CDR-SBの再評価では認められなかった結果)。このことは、クレネズマブの早期・高用量治療によって有効性が高まることを示唆しているかもしれない [75]。
アミロイドβのフィブリル型を対象とした薬剤介入には、バピニューズマブとガンテルマブがある。バピニューズマブの第I相試験の結果は、高用量治療(5mg/kg)で血漿中アミロイドβ濃度の上昇を示している[76]。これは、アミロイドβのクリアランスの減少、または沈着量の減少による動員の増加によるものであろう。この不確実性にもかかわらず、第III相試験の結果では、バピニューズマブによる治療に対するフィブリラーアミロイドβの減少が確認されていることから、観察された一過性のアミロイドβ濃度上昇の機序的原因としてアミロイドβの動員が増加していることが示唆されている[77]。しかしながら、フィブリラーアミロイドβレベルの低下が確認されたにもかかわらず、第III相試験の結果では、ADAS-cogおよび認知症障害評価(Dアルツハイマー病)で評価された認知機能の低下について、プラセボ群と治療群の間に有意な差は認められなかった[78]。バピニューズマブに反応して記録された有意な有害事象には、無症候性アミロイド関連の画像異常の存在が含まれる[78]。最後に、フィブリルを標的としたガンテルマブの第III相試験は、脳萎縮(体積MRIで測定脳脊髄液 アミロイドβ濃度、認知機能低下(CDR-SB、MMSE、およびADAS-cogで測定および治療または疾患に関連した有害事象の発生率において、治療群(高用量:225mg、低用量:105mg)とプラセボ群の間に統計的有意差が認められなかったため、無駄であるとして早期に中止された[79]。表2は、βアミロイドカスケードを標的とした最近の臨床試験から得られた知見をまとめたものである。
表2 βアミロイド仮説に関わる最近の臨床試験の失敗
アミロイドβ仮説は、以前に議論した酵素療法や免疫療法にも当てはまるが、これらの戦略は、すべてのアミロイドβに焦点を当てた治療を説明するものではない。アルブミン置換によるアルツハイマー病の管理(AMBAR)試験は、現在進行中の多施設共同試験であり、現在は第II-III相試験が行われている。AMBAR試験では、アルブミン置換による血漿交換療法を行い、アミロイドβ動員を増加させることを目的としている。主要試験の転帰は、ADAS-cogおよびADCS-日常生活動作で評価される認知的変化である [80]。
アミロイドβ以外の標的にこれまで以上に焦点が当てられ始めているため、現在のタウを標的とした試験について簡単に議論することが必要である。アミロイドβを標的とした免疫療法戦略と同様に、多くの現在の臨床試験では、病理学的形態とネイティブ形態の両方のタウに対する受動的免疫化に焦点が当てられている[81, 82]。C2N 8E12は、タウを標的とする受動的免疫療法アプローチである。この抗体は、NFT病理学的に細胞外に存在する凝集型タウに特異的である。本試験の第I相試験では、アルツハイマー病ではなく核上麻痺に焦点を当て、2.5~50mg/kgの用量で安全性が確認された。この試験は現在第II相試験であり、投与量を無作為化して有効性を決定している[82]。RO7105705(セモリネマブ)は、細胞外タウに対する別の受動的免疫化であり、病的タウのリン酸化されたセリン残基を標的としている。この試験の第I相試験では、薬物投与に関連した重篤な有害事象は認められず、皮下投与時のバイオアベイラビリティは70%であった[83,84]。この試験は現在第II相試験中であり、ADAS-cogおよびADCS-日常生活動作を主要エンドポイントとして使用して治療期間中の認知変化を測定することを計画している[81,83,84]。
5.4. 試験の失敗の潜在的な原因
ほぼ一貫した試験の失敗は、アミロイドβ仮説の妥当性に大きな疑念を投げかけている。しかし、アルツハイマー病臨床試験で一般的に用いられている方法には問題があり、これらの試験の結果を適切に分析する試みを複雑にしている可能性がある。これらの問題は、仮説の妥当性に関する懸念の高まりから適度に切り離して検討され、対処されるべきである。例えば、試験デザインの潜在的な弱点は、INDに提示されたプロトコルによって特定された臨床的に意味のあるエンドポイントの指定から始まる。エンドポイントの達成は、試験の成功を意味し、大規模な消費者と患者の集団で再現可能な結果を想定している。アルツハイマー病試験では、最も臨床的に有意な(直接的な)エンドポイントは認知機能の改善と脳活動の回復である[85]。直接的なエンドポイントに加えて、バイオマーカーの変化などの間接的なエンドポイントを満たすことも、これらの評価の相対的な容易さとコストの削減のために、試験プロセスで使用されることがある。アルツハイマー病試験では、問題となるバイオマーカーは、アミロイドβ42,総タウ、およびリン酸化タウの脳脊髄液濃度である。これらのバイオマーカーの濃度を定量するために利用可能な自動免疫測定法(ELISAなど)は、非常に初期の段階であってもアルツハイマー病の診断に有用である[86-88]。しかし、診断ツールとして有用であるにもかかわらず、エンドポイントとしてこれらのバイオマーカー(および臨床試験期間中のバイオマーカー特性の変化)に依存することは十分ではない[85]。これは、先に議論したverubecestat、atabecestat、およびsemagacestatの試験で見られる[58, 61, 64]。これらの薬剤の試験では、認知の悪化または変化のないアミロイドβ濃度の低下という有望な知見が示されている。イムノアッセイに加えて、アミロイドβ特異的PETスキャンを実施して、このタンパク質の濃度変化を評価することができる。残念ながら、この方法は免疫測定と同じ問題を抱えている。すなわち、疾患過程における原因ペプチドであると推定される標的の減少は、有望ではあるが、認知機能の改善が反映されない場合にはほとんど意味がないということである。これらの主観的エンドポイントとは対照的に、PETスキャンは試験介入の結果として代謝活性の変化を示すために使用することができる [89,90]。具体的には、PETスキャンでは、健康な対照群と比較してアルツハイマー病脳の代謝が有意に低下している後帯状皮質と側頭頂部領域の活動の増加を探すことになる[89, 90]。さらに、標的関与の指標としてバイオマーカーの減少を用いることは、表面的には論理的であるが、抗体の交差反応の可能性があるため、アミロイドβ標的免疫療法に関しては特に不適切である(しかし、臨床的に有用なモノクローナル戦略においては、交差反応は他の抗体ベースの治療薬よりもはるかに低い可能性がある)[91, 92]。言い換えれば、モノクローナル抗体による治療に応答して毒性のあるアミロイドβが減少したからといって、そのような抗体がアミロイドβ自体や正しいエピトープに結合したことを意味するものではないということである[91-93]。実際には、抗体は二次的なメカニズムにより、アミロイドβの減少をもたらす意図しない標的に結合している可能性がある。しかし、意図しない結合は、試験結果を複雑にする付加的な副作用をもたらす可能性がある[91, 93]。
認知の救済または安定化はすべてのアルツハイマー病試験の究極の目的である。そのため、この包括的な目標に関連する薬物の有効性を評価するための直接的なエンドポイントとして、認知テストがしばしば使用される。しかし、これらのテストの管理は主観的であり、テスト者の間だけでなく、試験施設間でも大きく異なることがある。指摘すると、2008年のADAS-cogの研究では、試験者の手順のばらつきが有意に信頼性の低いスコアリングをもたらしたことが示されている[94]。認知の変化を測定するためのこの信頼性の欠如が正しいとすれば、このような方法でADAS-cogを使用する研究(先に議論したベルベセスタット、セマガセスタット、アバガセスタット、ソランズマブ、クレネズマブ、バピヌズマブの試験を含む)は、アルツハイマー病臨床介入の最も重要な目的である認知機能障害についての正確な結果を報告していない可能性がある。
アルツハイマー病の臨床試験が事前に設計されたエンドポイントに到達しない最後の理由は、特にサンプルサイズが不十分な場合のプラセボ対照群の解析である。例えば、プラセボ群で異常な改善が見られた場合、その薬剤が本当に有効であるかどうかを判断する能力が制限される。一方で、プラセボ群の急激な低下は、その治療法による利益が過度に強いことを示唆していると誤解を招く可能性がある。これは、スポンサーに、同様の頑健な効果を期待して後続の試験を過小評価するように誤って納得させてしまう可能性がある[96]。
6. 今後の方向性
アルツハイマー病の窮状が拡大し、決定的に効果的なアミロイドβをベースとした治療法では満たされていない規模とコストが増大しているため、新たなターゲットの発見と疾患進行の正確な仮説の策定がより重視されるようになっている。また、臨床試験の失敗は、方法や手順の妥当性についての内省を促している。前臨床研究における有効性や毒性を予測するために動物モデルを使用することから始めて、改善の余地があるかもしれない。動物モデルは研究において紛れもなく重要なデータを提供するが、これらの研究でヒトの毒性を正確に予測できるのは70%のケースに過ぎない [97, 98]。これらの動物毒性試験は試験プロセスの初期に行われるため、ヒトへの毒性を有する可能性のある薬剤のかなりの割合が、試験プロセスを不当に継続することになる可能性がある。例えば、BACE-1阻害薬の初期試験の結果を見てみると、試験終了の原動力となったにもかかわらず、予備的なマウスモデルでは肝毒性が認められなかったことがわかる。これは、臨床試験プロセスにおける動物実験の完全な削除が正当であるか、慎重であると言うことではなく、マウスモデルからヒト、特にアルツハイマー病研究における結果を外挿する際に注意が必要であるということだけである。動物モデルに依存することの影響を軽減するのに役立つかもしれない方法の一つは、アルツハイマー病患者のヒト由来の人工多能性幹細胞(iPSC)の使用である。これらの細胞を使用することで、ヒト細胞の組織や細胞特異的な毒性、さらに重要なことに、アルツハイマー病に見られる潜在的な未知の修飾を持つヒト細胞の研究が可能になるであろう [100]。さらに、iPSCの研究グレードの細胞株を生成し、検証するためのコストは10,000ドルから25,000ドルの範囲であり、医薬品製造のスキーム全体で名目上の価格上昇を提示している[101]。しかし、どの方法も欠点がないわけではなく、iPSCsの使用は、細胞培養[102,103]で発見された2次元構造とは対照的に、1000億以上のニューロンとシナプスの数兆個の脳で発見されているような複雑な3次元構造の医薬品の挙動を正確にフェノコピーする能力の潜在的な欠如にその欠陥を見つけることができる。
標的型アルツハイマー病治療の将来の試みは、標的の発現を変化させるためのアンチセンスオリゴヌクレオチド(ASO)の使用を含むかもしれない。これらの戦略はタウ病理に対して特に有用であろう。マウスモデルはすでにタウの過リン酸化とそれに続く機能不全に関与する主要なキナーゼの一つであるGSK-3βに対するASO治療に応答して、ショック回避タスクにおける学習と記憶の改善を示しているので、[104]。さらに、この同じ研究では、タウの病理学的影響を受けた組織で一般的に見られる酸化ストレスのマーカーが、RNA干渉を用いた治療に応答して減少したことが示されている[104]。しかしながら、これらの有望な結果にもかかわらず、神経変性疾患の臨床治療におけるASOの使用は、歴史的に高額であり、健康保険に加入している患者であっても利用できないほどであった [105, 106]。さらに、ASOは、BBBを横断し、適切な標的と相互作用する能力、またはその相対的な欠如に限界を見出している[107]。
アミロイドβ仮説主導の臨床的失敗に直面し、ducanumabの潜在的な成功を考慮しても、アルツハイマー病治療のための新しい生体分子標的の発見への関心が高まっている。プロテオミクスとトランスクリプトームの両方のアプローチは、新しい潜在的な標的を同定するためだけでなく、これらの標的に対する特定の治療の効果を調べるために使用される可能性がある[108,109]。
7. 結論
アルツハイマー病は、主に高齢者に影響を与える進行性で致死的な神経変性疾患であり、認知症の最も一般的な原因である[110]。現在、550万人のアメリカ人が罹患しており、その数は2050年までに3倍になると予想されている。現在までのところ、アルツハイマー病は心臓病、がんに次いで第3位の死因であり、70万人の65歳以上のアメリカ人が死亡時にアルツハイマー病に苦しむと推定されている[111]。さらに、病気のコストは、現在、病気を管理するために行く2590億ドルの医療費と実質的であり、世紀の半ばまでに、コストは完全に米国の医療制度を破産させる1.2兆ドル以上に高騰すると予測されている[]。
これらのデータから明らかなように、患者にとって効果的な疾患修飾薬が緊急に必要とされている。コリンエステラーゼ阻害薬やNMDAアゴニストを含む現在FDAに承認されている薬は、症状の緩和をもたらすものであり、効果は低い。実際、コリンエステラーゼ阻害薬とNMDAに関する最近の研究では、これらの薬物は認知機能に対する有益な効果が弱いと結論づけられている [113]。さらに、アミロイドβ仮説のさまざまな側面を対象とした臨床試験への多額の投資は、これまでのところ無駄であることが証明されている。
今日までに、製薬業界はアルツハイマー病の研究開発に過去4年間で35億ドル以上を費やしており、その失敗率は99.6%であった[]。人は成功よりも失敗から多くを学ぶとよく言われるが、もしそうであるならば、アミロイドβは認知症の原因ではなく、効果である可能性があることを受け入れるべきであろう。したがって、アルツハイマー病の分野では、アミロイドβ戦略の検討を継続すべきであるというのが我々の意見である(特に、Biogen社がFDAにducanumabの承認を先取りして提出したことを考慮して)が、タウの病理学的形態、アンチセンスオリゴヌクレオチド(ASOまたはCRISPRを含む他の遺伝学的アプローチを含むがこれらに限定されない他の潜在的な創薬標的にも焦点を当てるべきであろう。
さらに、臨床試験で早期に成功を収めている他の潜在的標的には、テロメラーゼ、MAOB、核内受容体、神経新生、およびp38a阻害剤が含まれる[ ]。臨床研究はまた、タウの病理学的形態についても倍増すべきであり、特にタウが将来の脳萎縮の場所を予測する上でアミロイドをはるかに凌駕していることを示唆する2つの最近の論文を考慮すると、タウの病理学的形態についても倍増すべきである。
最初の研究では、βアミロイドプラークは初期の引き金というよりは、むしろ後天的なものであると考えられ、プラーク負荷に統計的な差が見られなかったことから、βアミロイドが初期の疾患進行の引き金ではない可能性を示唆している[115]。2つ目の研究では、タウPETイメージング(現在FDAによってレビュー中)を使用して、著者らは、初期臨床段階のアルツハイマー病患者において、タウPET脳スキャンは1-2年後のMRIで測定された脳萎縮の位置を予測するが、アミロイドPETイメージングはタウの位置も将来の萎縮の位置も予測しないことを雄弁に示した[116]。
最後に、前臨床的に、これまでの結果は、アルツハイマー病動物モデルがヒトの有効性や毒性を予測しないことを示している;したがって、将来のアプローチは、適切な動物モデルの継続的な使用に加えて、アルツハイマー病患者のヒト由来の誘導多能性幹細胞の使用を含むように拡大されるべきである。これらの細胞を使用することで、ヒトの アルツハイマー病 疾患プロセスをより良く再現することが可能になることが予想され、薬剤の毒性や有効性の面でより有利な翻訳が可能になるかもしれない。米国および世界中で増加するアルツハイマー病の負担と戦うためには、病気を予防し、遅くし、または停止する新しい治療法が緊急に必要とされている。
