Clinical and Scientific Rationale for the “MATH+” Hospital Treatment Protocol for COVID-19
2020年12月15日
要旨
2019年12月、中国・武漢で新型コロナウイルスSARS-CoV-2(COVID-19)による重篤な呼吸器疾患が出現した。COVID-19が最も大きな影響を与えたのは集中治療室(ICU)であり、入院患者の約20%が急性呼吸不全(ARF)を発症し、ICUへの入院を余儀なくされたことを考えると、COVID-19が最も大きな影響を与えたのは集中治療室(ICU)であった。
COVID-19はウイルス性肺炎であり、抗コロナウイルス療法が存在しないという前提に基づいて、ほぼすべての国内および国際的な医療学会は、治療におけるコルチコステロイドの使用を特に禁止し、ランダム化比較試験以外の他の治療を避ける「支持療法のみ」を推奨していた。しかし、COVID-19に関連したARFの初期の研究では、そのような支持療法の専門家であっても、機械的人工呼吸(MV)の持続時間が頻繁に延長され、不可解に高い死亡率が報告された。
これらの報告を受けて、著者らは臨床専門家パネル「Front-Line COVID-19 Critical Care Alliance(最前線COVID-19クリティカルケアアライアンス)」(www.flccc.net)を結成した。このパネルでは、COVID-19の新たな臨床、X線写真、病理学的報告を共同で検討するとともに、中国、イタリア、ニューヨークの初期発生地域からの第一線の臨床ICU専門家の幅広い臨床ネットワークの中で何度も議論を開始した。
「何が効いていて何が効いていないのか」という初期の印象の共有、医学雑誌の出版物の増加、COVID-19患者の個人的な臨床経験の急速な蓄積に基づいて、メチルプレドニゾロン、アスコルビン酸、チアミン、ヘパリンおよび共同介入(MATH+)を中心とした入院患者のための治療プロトコルが作成された。
本論文では、ウイルス性症候群とCOVID-19を中心とした患者の治療におけるMATH+の使用を支持する研究に特に重点を置き、MATH+の背景にある科学的・臨床的根拠を、それぞれの薬剤を支持するために発表されたin-vitro、pre-clinical、臨床データに基づいてレビューしている。本レビューは、多国間で発表されている死亡率データとMATH+センターの結果との比較で締めくくられている。
キーワード
肺感染症、呼吸不全、トロンビン、息切れ
序論
2019年12月、中国の武漢で新型コロナウイルスSARS-CoV-2(COVID-19)に関連した肺炎を特徴とする疾患が出現した。2020年3月11日までに、世界保健機関(WHO)はこの新型コロナウイルスの発生をパンデミックと特徴づけ、213カ国で確認された症例を報告した。入院患者の約20%が急性呼吸不全(ARF)を発症し、ICUへの入院を必要としたことから、この病気が集中治療室(ICU)に与える影響が最も大きかったと考えられている1,2。
COVID-19は当初、原発性ウイルス性症候群と定義され、有効な抗コロナウイルス療法が存在しなかったため、ほぼすべての国内および国際的なヘルスケア学会は、無作為化比較試験以外の他の治療法を避け、コルチコステロイドの使用を避けることを具体的に推奨しながら、支持療法に主眼を置くことを提唱した。
コルチコステロイドがCOVID-19呼吸器疾患に有害であるという世界の医療学会の間での広まった信念は、いくつかの理由から驚くべきものであった。第一に、本稿で詳述するように、WHOやCDCの先行パンデミックデータの解釈に反して、著者の一人(G.U.M)を含むグループによる同じデータのレビューが 2020年4月初旬にSociety for Critical Care Medicineで発表・公表され、SARS、MERS、H1N1パンデミックからの最大かつ最もよく管理された研究では、コルチコステロイドで治療した場合、中等度から重症の患者の死亡率が有意に減少することが判明したと結論づけている6。第二に、イタリアとニューヨークの「最前線」の臨床医からの報告では、治療にコルチコステロイドが使用された場合、急速に観察可能なポジティブな影響が報告されている。さらに、米国の放射線科医の専門家パネルは 2020年3月に中国・武漢で撮影された初期のCTスキャンのレビューを発表しており、その中で「COVID-19の肺損傷の最も一般的なパターンは、組織化性肺炎(OP)である」と結論づけていたが、これはCTスキャンで正確に識別でき、第一選択治療はコルチコステロイドである。OPの存在は、著者の一人による最近のレビュー(PK)で証明されたように、初期のCOVID-19呼吸器疾患の一見不可解な臨床症状とコルチコステロイドの有効性の両方を説明しているようである7,8。
しかし、現在ではコルチコステロイドが広く使用されるようになる以前の時期に、COVID-19に関連したARFに関する複数の初期研究では、そのような支持療法戦略を専門とする施設であっても、機械的人工呼吸(MV)が頻繁に長期化し、不可解に高い死亡率が報告されていた9。これらの報告を受けて、本稿の著者を含む多くの医師は、広く推奨されている支持療法のみのアプローチに疑問を呈し、重度の低酸素血症、高炎症、および高凝固性というよく知られた症候群を打ち消す治療法の背後にあるエビデンスを見直すことになった。
著者らは、重症感染症および急性呼吸窮迫症候群(ARDS)の治療において、100年以上の臨床現場、ベッドサイドのICUでの経験を持つクリティカルケアの臨床研究者グループとして、臨床専門家パネル「Front-Line COVID-19 Critical Care Alliance(フロントラインCOVID-19クリティカルケアアライアンス)」(www.flccc.net)を結成した。このパネルでは、COVID-19の新たな臨床、X線写真、病理学的報告を共同で検討するとともに、中国、イタリア、ニューヨークの初期発生地域からの第一線の臨床ICU専門家の幅広い臨床ネットワークの中で、複数の議論を開始した。「何が効いていて何が効いていないのか」という初期の印象の共有、医学雑誌の出版物の増加、COVID-19患者の個人的な臨床経験の急速な蓄積に基づいて、著者の一人(P.E.M.)が自国の医療機関で作成したプロトコルを基に、入院患者のための治療プロトコルが作成された。そのプロトコルは、メチルプレドニゾロン、アスコルビン酸、チアミン、ヘパリンの4つの “コア “治療と多くの共同介入で構成されており、”MATH+”(表1)と呼ばれていた。主薬はすべて、治療メカニズムが知られており、安全性プロファイルが確立されており、ARDSのような類似の疾患モデルで有効性を示す複数の臨床試験が行われている、非常によく知られた低価格のFDA承認薬であった。追加の共同介入薬はまた、有望な初期臨床データ、強力な科学的根拠、および/またはCOVID-19と同様のクリティカルケア疾患に対する既存の臨床エビデンスベースのいずれかによっても支持されていた。パンデミックの初期にMATH+が開発されて以来、プロトコルの大部分の成分(コルチコステロイド、アスコルビン酸、ヘパリン、スタチン、ビタミンD、メラトニン)の治療効果は、その後のランダム化比較試験で検証されたか、大規模な観察データセットでより強力に支持されている11-16。
表1 COVID-19のMATH+病院治療プロトコル(www.flccc.net)
多くの施設が同様にCOVID-19の「治療ガイドライン」を作成しようとしたが、それらは主に支持的な呼吸ケア技術を強調していたが、多くの施設では「早期挿管」などの明らかに有害であるとすぐに撤回されたアプローチや、作用機序が理論的な抗SARS-CoV-2活性しか持たない治療薬や介入も含まれていた17-21。
COVID-19に対する提案されたMATH+プロトコルの有効性を研究するために、MATH+で治療された患者の転帰を測定し、比較するために患者登録簿の形成を介して行うことを決定した。
著者らは、「新規」疾患で使用される治療法はすべて「実験的」であり、したがって使用は無作為化比較試験(RCT)内のみに限定されるべきであると主張する主要な査読付き医学雑誌に掲載された論説に悩まされていた。 22 「実験的」治療法とは、臨床的根拠がないか、あるいは類似の疾患状態での使用について臨床的にほとんど知られていない治療法と定義され、特にパンデミックの初期の数週間には、ヒドロキシクロロキン、レムデシビル、ロピナビル/リトナビル、トシリズマブなどの薬剤が採用され、広く使用されていた。しかし、これらの薬剤は、類似の疾患や病態を持つ患者の治療に使用した場合に良好な結果が得られることを示す臨床的証拠が公表されており、著者らの間には広範な臨床経験と専門知識があったMATH+の中核的な治療法とは明らかに対照的であった。いくつかの例では、いくつかの治療法は、すでにその施設で重度の肺炎、ARDS、敗血症などの条件のための標準的なICU治療プロトコルに組み込まれてた。MATH+の各要素は重症患者を対象に広範囲に研究されており、その使用法や適応についてのメタアナリシスが発表されているほど、ほとんどすべての要素が十分に研究されている。
著者らは、このような新しい疾患症候群においては、十分に実施された観察試験や無作為化比較試験の必要性に大きな価値と重要性を置いているが、特にパンデミック時には、すべての機関がそのような試験を計画し、実施するために必要な経験、資源、インフラストラクチャを持っているわけではないことを認識しなければならない。さらに、無作為化プラセボ対照試験のデザインに反対することを決定したのは、このような試験では、治験責任医師が「臨床的平衡感覚」、すなわち、対照群と実験群のどちらの介入も「より良い」ものではないという治験責任医師の信念を持つことが必要であるからである。MATH+の個々の “中核 “となる治療法に関して、すべての著者は、その治療法がプラセボよりも優れているか、あるいは潜在的な利益と比較してリスクとコストが最小であるという証拠を持っているため、使用が有利であると感じている。
逆に言えば、著者らは、臨床経験があるところでこのような試験を実施することは、大規模な研究機関の計り知れない力と資源の範囲内にあると考えている。11 具体的には、RECOVERY試験の設計と実施には、重症コロナウイルス症候群の治療におけるコルチコステロイドの使用に関する臨床的な知識を持った研究者が必要であった。MATH+の著者は、上記のようにCOVID-19におけるコルチコステロイド療法の重要性についての集団的な信念を持っていたため、このような平衡感覚を持っていなかった6,8,23。
したがって、4000人以上の患者がプラセボ投与された対照群で過剰死亡したために、RECOVERY試験が早期に中止されたことは、著者にとって驚きではなかった。もしプラセボ群でコルチコステロイドを投与されていた場合に回避可能な死亡を保守的に推定すると、酸素を必要とする患者で109人、機械的換気を必要とする患者で84人の200人以上の命が救われたことになる。
11 MATH+治療プロトコルを支持する科学的・臨床的根拠については、以下のセクションで、各薬剤を支持するために発表されたin-vitro、pre-clinical、臨床データをレビューし、特にウイルス性症候群とCOVID-19の治療に関連した研究に重点を置いてレビューする。本レビューは、COVID-19患者の治療にMATH+プロトコルを採用した2つの病院からの予備的なアウトカムデータについての報告で締めくくられる。
メチルプレドニゾロンとCOVID-19
メチルプレドニゾロンは以下の基準に基づいて選択された。(i)コルチコステロイド反応性疾患の証拠、(ii)関連する臨床研究の結果、1万人以上の患者を含む過去のウイルス性パンデミックからの多くの結果、(iii)薬理学的特徴。
ARDSと同様に、重度のCOVID-19患者は気管支肺胞液ミエロイド細胞におけるグルココルチコイド受容体の発現が有意に減少しており、それは肺好中球性炎症、NETosis、および疾患の重症度に負の関係がある24,25。COVID-19で観察された炎症と凝固の調節障害(病態生理を参照)は、多因子性ARDSのそれと類似しており、長期にわたるコルチコステロイド治療(CST)が全身および肺の炎症-凝固-線維増殖の調節を低下させ、疾患の治癒を加速させる能力を示す十分な証拠がある。さらに、地上ガラスの不透明性のコンピュータ断層撮影所見と組織化肺炎、ヒアリン膜、炎症性滲出液、および急性線溶性および組織化肺炎の組織学的所見は、すべてCST応答性の炎症性肺疾患と互換性がある。
MATH+作成時の関連臨床試験には、成人の非ウイルス性ARDS患者を対象とした無作為化比較試験(RCT)SARS-CoV(n=7008)H1N1(n=2141)インフルエンザ患者を対象とした大規模観察試験、および複数のCOVID-19観察試験の初期の結果が含まれている。 -35 非ウイルス性ARDSでは、10のRCT(n=1093)の集計データから、CSTは28日目までにMVフリー日数(WMD 6.18日、95%CI 3.45日~8.90日)ICUフリー日数(WMD 8.12日、95%CI 3.87日~12.37日)病院死亡率の減少(RR 0.67,CI 0.52~0.870)の有意な増加と関連しており、メチルプレドニゾロン治療で最大の影響が観察されたことが示された6,32,36。6 一過性の高血糖症(ほとんどが初回ボーラス投与後36時間以内)を除き、CSTは神経筋力低下、消化管出血、院内感染のリスク増加とは関連していなかった(RR 0.83(95%CI 0.67~1.02))。
ウイルス性肺炎(SARS、H1N1)における有益性の証拠は、交絡因子の調整および転帰に関するCST変数(タイプ、時期、投与量、期間)の解析を含む大規模研究(n = 9149)に基づくものである31,32。これらの研究では、SCCM(Society of Critical Care Medicine)およびESICM(European Society of Intensive Care Medicine)の Corticosteroid Guideline Task Forceが推奨しているものと同様のCSTの投与量と投与期間で死亡率が有意に減少することが報告されている(図1)。 6,37 最大規模の SARS-CoV 試験では、交絡因子の可能性を調整した後、メチルプレドニゾロン 80mg/日の投与は安全であり、死亡リスクを 63%減少させた(HR 0.37,95% CI: 0.24-0.56)。FiO2 <300 mm Hg(535 vs. 462)の患者のサブグループ分析では、院内感染率が高いにもかかわらず、低用量から中用量のCST(メチルプレドニゾロン25~150 mg/日)は30日死亡率(aHR 0.49 [95% CI 0.32~0.77])と60日死亡率(aHR 0.51 [95% CI 0.33~0.78])の両方を有意に減少させた32。
図1 クリティカルケア医学学会(SCCM)および欧州集中治療医学学会(ESICM)のコルチコステロイドガイドラインタスクフォースで推奨されているコルチコステロイド長期投与のプロトコル
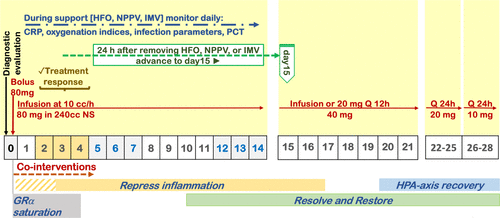
メチルプレドニゾロンは、肺組織への浸透性が高く、滞留時間が長く、転写因子κB(肺の炎症を引き起こす因子)の阻害活性が高いため、重症急性炎症性肺疾患の治療に最も頻繁に使用されている静脈内コルチコステロイド剤である38。 -40 理想体重の1日1mg/Kg(約80mg)の初期用量は、非ウイルス性ARDSのRCTやSARS-CoVおよびH1N1肺炎の大規模観察研究において、最も高い死亡率の減少との関連性が示されている6,31,32。ヒト肺組織組織およびA549肺細胞株におけるSARS-CoV2によって誘発された発現変化を、5,694種類のFDA承認薬によって誘発された発現変化と照合した最近の研究では、メチルプレドニゾロンがCOVID-19によって誘発された変化を元に戻す可能性が最も高い薬剤であることが判明したが、デキサメタゾンやプレドニゾンのような他の密接に関連したコルチコステロイドはそうではなかった41。
CSTによるウイルスクリアランスの低下のリスクは誇張されており、最も頻繁に引用されているArabiらの論文では、7日以上の投与を受けた患者で 7日以上のCSTを受けた患者では、90日死亡率が低下する傾向が強く、ウイルスクリアランスへの影響はなかった[aOR 0.94,95%信頼区間(CI)0.36-2.47,p = 0.90]。 42 COVID-19におけるCSTの使用を推奨する国内および国際的な学会の複数の勧告に不幸にも影響を与えた、ウイルスクリアランスの遅延に関する根拠のない恐れが広まっていることに反して、実際には、ウイルスクリアランスの遅延と重篤なCOVID-19患者の転帰の悪化を結びつける証拠はなく、さらに、それが宿主自身の「サイトカインストーム」よりも大きな負の影響を及ぼす可能性は低いと考えられている26。
MATH+プロトコルの導入後、プロスペクティブな観察研究に加えて、大規模なランダム化試験によってCSTのより決定的な支持が得られた。RECOVERY試験では、28日間の死亡率を主要アウトカムとした無作為化、対照、オープンラベル、適応性のあるプラットフォーム試験でデキサメタゾン(6mgを1日1回、最大10日間)が検討された11。CSTは死亡率の有意な減少(21.6% vs. 24.6%)と関連しており、年齢調整率比[RR] 0.83;95%信頼区間[CI] 0.74~0.92;P < 0.001)であった。デキサメタゾンは、侵襲的機械換気を受けている患者のサブグループで死亡を3分の1減少させた(29.0%対40.7%、RR 0.65 [95%信頼区間[CI] 0.51~0.82]; P < 0.001)。 001)侵襲的機械換気なしで酸素吸入を受けている患者では5分の1(21.5%対25.0%、RR 0.80 [95%CI 0.70~0.92]; p = 0.002)であったが、無作為化時に呼吸支援を受けていない患者では死亡率は減少しなかった(17.0%対13.2%、RR 1.22 [95%CI 0.51~0.82]; p < 0.002)。 .2%、RR 1.22 [95%CI 0.93~1.61]; p = 0.14)。) しかし,デキサメタゾンは副腎のより大きな抑制に関連するコルチコステロイドであることに留意すべきである。特筆すべきは、RECOVERY RCTでは少量のデキサメタゾンを使用し、リバウンド炎症を防ぐためのテーパリングは取り入れていないことである。
イタリアの多施設共同プロスペクティブ観察研究では、イタリアの呼吸器高依存性ユニットに入院した重症COVID-19肺炎患者(CST群83例対対照群90例)において、長期CST(事前に設計されたプロトコル:メチルプレドニゾロン80mgを9日間投与した後、事前に定義された臨床検査値の改善に基づいて漸減投与)への曝露と、ICUへの紹介、挿管、または28日以内の死亡の必要性(複合主要エンドポイント)との関連性が検討された43。複合主要エンドポイントは19例対40例で達成された[調整後ハザード比(HR)0.41;95%信頼区間(CI):0.24-0.72]。ICUへの転院と侵襲的MVの必要性があったのは、それぞれ15対27(p=0.07)14対26(p=0.10)であった。28日目までに、MP群では死亡が少なく(6対21,調整後HR=0.29;95%CI:0.12~0.73)侵襲的MVのオフ日数が多かった(24.0±9.0 vs. 17.5±12.8;p=0.001)。試験治療はPaO2の急速な改善と関連していた。FiO2およびCRPレベルは、リンパ球数に影響を与えることなく、急速に改善した。合併症率は2群間で同程度であった(p = 0.84)。病院に紹介されてから最初に鼻咽頭スワブが陰性となったまでの日数として決定されるウイルス脱落には差は認められなかった。
スペインの半無作為化試験では、COVID-19の低酸素血症患者85人(CST56人、対照29人)を対象にメチルプレドニゾロン(それぞれ3日間、80mgと40mg)が調査された;主要複合エンドポイントのリスクはイタリアの試験と同様であった44。
ヘンリーフォードCOVID-19管理タスクフォースは、ミシガン州の多施設医療システムにおいて、試験前の単一試験、試験後の単一試験の疑似実験を実施した。SOC群の患者の半数は最初の1週間にCSTを投与されたが、開始時期は遅めであった。主要複合転帰はイタリア試験と同様であり、CST群ではより少ない患者数で達成された(34.9%対54.3%、p=0.005)。入院期間中央値の有意な短縮も、早期コルチコステロイド投与群で観察された(8日 vs. 5日、p<0.001)。入院期間は3日短縮された(p<0.001)34。
RECOVERY試験の後、重度のCOVID-19患者におけるコルチコステロイド治療を調査した合計6件の追加RCTが発表された。WHOから要請された最新のメタ解析では、全身デキサメタゾン、ヒドロコルチゾン、またはメチルプレドニゾロンの投与群(678人)または通常のケアまたはプラセボ投与群(1025人)に無作為に割り付けられた患者が含まれていた45 。死亡率に関するデータでは、試験結果の間にほとんど矛盾が見られず(I2 = 15.6%)ランダム効果メタ解析に基づく要約ORは0.70(95%CI,0.48-1.01;P = 0.053)であった。また、コルチコステロイド群に無作為化された患者の死亡数は222例(32.7%)通常治療またはプラセボ群に無作為化された患者の死亡数は425例(42.5%)であったと報告されている(要約OR,0.66[95%CI,0.53-0.82];P<0.001)。これらの所見の結果、WHOは「COVID-19に対するコルチコステロイド」を更新した。これらの結果を受けて、WHOは「COVID-19に対するコルチコステロイド:生活指導」を更新し、「重症・重症のCOVID-19患者の治療には、コルチコステロイドを投与しないよりも全身性コルチコステロイドを投与することを推奨する(中程度の確実性のエビデンスに基づく強い推奨)」としている46。
アスコルビン酸(AA)とCOVID-19
COVID-19感染患者の約15%は呼吸器疾患に進行し、初期段階ではOPと一致しており、コルチコステロイドによる治療が行われなかったり、不十分であったりすると、より重度の肺炎に進行し、約5~10%は機械換気を必要とし、肺をさらに傷つけ、血管閉塞、高凝固、多臓器不全を特徴とするサイトカインストームと同時にARDSを引き起こすことが多い10,24,26。アスコルビン酸(AA)は、敗血症、ARDS、外傷、火傷などの炎症状態に関与する複数の分子や生物学的経路を標的とした多元的な作用モードを持つ哺乳類で最も強力で重要な抗酸化物質である。
敗血症性ショックや他の種類のストレス反応における前臨床および臨床の重要な証拠は、COVID-19感染時の免疫系の異常による生命を脅かす合併症の多くを、AAの静脈内投与が減衰させることを示している49,26,50。少数の患者では、プロ炎症性サイトカインと活性酸素種の圧倒的な産生を伴うサイトカインストームが起こり、進行性の臓器不全を引き起こす24,26,51-53。
自然免疫応答および適応応答は、抗ウイルス応答に不可欠な役割を果たし、マクロファージ、リンパ球、感染した免疫細胞によるI型インターフェロンα/βの放出によって媒介される。AA を合成できない H1N1 感染ノックアウトマウスを用いたいくつかの実験では、AA の投与によりインターフェロン産生が増加し、インターフェロン産生に必要な遺伝子の発現が回復し、炎症性サイトカインの放出が減少して炎症性遺伝子の発現が減少することが明らかになった54,55。
アスコルビン酸はまた、内因性カテコールアミンの産生とコルチコステロイド合成のための補因子でもある。 -ヒトは進化的突然変異により、AAを合成できないという点で、すべての哺乳類の中でほぼ特異的であることを考えると、ストレス状態の血漿AAレベルは、ストレス状態や感染状態では直ちに何グラムものAAを産生し始めるヤギのような他の哺乳類とは対照的に、急速かつ顕著に減少する。49,60 臨床研究では、ステロイドとの併用または非併用でAAを投与すると、血管圧迫剤の必要量が減少し、ショックが逆転するという結果が得られている。
動物モデルでは、静脈内のアスコルビン酸は、血管収縮剤への動脈反応性を改善し、微小血管透過性を減少させることが示された57,61 AAの血行力学的効果は、アスコルビン酸の投与が血管プレッサーとボリューム蘇生要件を減少させた敗血症性ショック、外傷、および火傷で実証されている47,49,62,63
Marikらは、敗血症患者を対象に、重症敗血症患者に単回静脈内投与の単回静脈内投与、ヒドロコルチゾン、チアミンを投与し、生存期間に有意な効果があることを示した。ARDSにおけるこの治療法がすぐに採用されなかった理由は、当初の主要アウトカム解析では、死亡した患者に重症度(SOFA)スコアが割り当てられていなかった対照群の初期の過剰死亡をすべて考慮に入れていなかったという事実だけで説明できるだろう。その後、著名な科学者グループによる編集者への書簡により、これらの早期死亡を考慮した解析が要求された。65 このように、CITRIS-ALIは、否定的な試験として不可解に描かれていたが、その代わりに、主要な転帰と重要な副次的転帰の両方の点で非常にポジティブな試験であった。
重症患者を対象とした2つの大規模なメタアナリシスでは、ビタミンCの静脈内投与は副作用を示さず、輸液と血管抑制剤の必要性を減らし、機械的人工呼吸器の使用時間を短縮したことが示されている50,66。
最も重要なことは、COVID-19呼吸不全における高用量の静脈内AAのプロスペクティブ、ランダム化、二重盲検、プラセボ対照試験が中国湖北の3つの病院で実施され、介入群に12時間ごとに12gの静脈内AAを7日間投与したことである15 。主要エンドポイントである侵襲的機械的換気なし日数は26.0対22.0(p=0.57)で有意ではなかったが、介入群では7日間で酸素化の有意な改善とIL-6の減少が認められ、その差は統計的に有意ではなかったが28日死亡率の減少が観察された(22.2%対37.9%、p=0.31)。SOFAスコアが3以上の患者のサブグループでは、ICUおよび病院での死亡率の差は統計的に有意であったが、28日死亡率は近づいたが統計的有意差には達しなかった。21.7% vs. 52.4%、p = 0.06)。
要約すると、AAの静脈内投与は、重要な生理機能に対する多元的効果、強力な抗酸化剤/ROS捕捉剤としての特性、グルココルチコイド受容体機能のROS誘発酸化ストレス障害の反転、COVID呼吸不全および非COVID ARDS、その他の高炎症性疾患の両方の治療成績への影響、非の打ちどころのない安全性プロファイルおよび低コストに基づいている。
チアミンとCOVID-19
チアミンは水溶性ビタミンで、小腸で受動的に吸収される。摂取後、遊離のチアミンはチアミン・ピロリン酸(TPP)に変換され、一般的にビタミンB1として知られている。体内のTPPの大部分は赤血球に存在し、体内の総貯蔵量の約80%を占めている67 。TPPは、ピルビン酸脱水素酵素の重要なコファクターであり、クレブスサイクルに入るためのゲートキーパーである。
チアミンの他の非補因子的役割は、免疫系、遺伝子制御、酸化ストレス応答、コリン作動、塩化物チャネル機能、神経伝達の中にも多数存在する。
ヒト成人は筋肉組織、肝臓、腎臓に約30mgのチアミンを貯蔵することができるが、これらの貯蔵量はチアミン摂取を停止してからわずか18日で枯渇する可能性がある67。重症患者では、チアミン欠乏症の有病率は入院時に10~20%、ICU滞在中に71%まで上昇することがあり、このビタミンの急速な枯渇を示唆している69,70。
ある研究では、肝機能障害を伴わない敗血症患者において、チアミンと乳酸値の間に有意な負の相関関係が報告されている69。敗血症性ショック患者(n = 88)を対象としたパイロットランダム化比較試験(RCT)では、チアミン(200mgを1日2回、7日間)の投与により、チアミン欠乏症の患者の事前に定義されたサブグループ(コホートの35%)において、乳酸値が低下し、死亡率が経時的に改善された。消化器外科手術を受けた患者を対象とした無作為化試験では、チアミン投与(200 mg/日、3 日間)は術後せん妄の有意な減少と関連していた。
TH17 細胞による IL-17 の分泌増加は COVID-19 に特徴的な炎症性サイトカインストームに寄与していることに留意すべきである。
これらの有望な結果と良好な安全性プロファイルを考慮して、MATH+プロトコルでは、重篤なCOVID-19患者における併用療法の一部としてチアミンの補充が含まれている。
抗凝固療法とCOVID-19
COVID-19患者をケアする初期の臨床経験から、過剰な凝固の医師の報告は中国とイタリアから出てきた。感染症は宿主防御の一部として炎症反応および凝固反応の活性化因子として認識されており、COVID-19では、従来の播種性血管内凝固DICで典型的に見られるようなDダイマーおよびフィブリン/フィブリノーゲン分解産物の顕著な上昇を呈するが、プロトロンビン時間(PT)部分トロンボプラスチン時間(PTT)および血小板数の異常は、初期にはほとんどないか、あるいは全く見られない。77 逆に、公表されているほぼすべての臨床報告では、CACは「高凝固性」の状態と表現されている。
トロンボエラストグラフィ(TEG)は、低剪断応力下で血栓を形成する際の全血の抗血栓性と低凝固性の両方の動態を評価できるため、CACの高凝固性の性質を最もよく理解している。著者の一人(PK)を含むグループは最近、COVID-19患者の最初の波で遭遇したTEG研究のケースシリーズを発表した。これらの初期の洞察は、以下にレビューする大量のその後の調査とともに、MATH+に組み込まれたより積極的な抗凝固レジメンの初期の基礎となった。
CACの調査で重度の高凝固性が発見されたことを考えると、発表されたデータの大部分は、血栓予防を受けているにもかかわらず、重症のCOVID-19患者において以前に報告されたよりも高い凝固の頻度を報告していることは驚くに値しない。フランスのHelmsら82は、COVID-19呼吸不全患者におけるVTE(主に肺塞栓症)の発生率が16.7%であったと報告している;この発生率は、1年前に治療を受けたCOVID ARDS患者以外のマッチした集団よりも6倍高い。同様に驚くべきことに、継続的な腎代替療法を受けている患者の96.6%が回路凝固を発症していた。オランダで行われた2つの研究では、ICU患者におけるVTEの発生率は7日目までに3分の1,14日目以降は50%以上であった。
2/3が全身性抗凝固療法(AC)を受けており、1/3が血栓予防を受けているICU集団を対象とした下肢超音波スクリーニング研究では、VTEは69%の患者で発見され、予防を受けている患者では100%、ACを受けている患者では56%の発生率であった。83 上記のCOVID-19患者のICU集団で報告されたVTEの発生率は、血栓予防を受けているCOVID-19以外のICU患者を対象とした先行研究で報告された約8%のVTEの発生率よりもはるかに高い。
COVID-19 ICU患者とは対照的に、COVID-19入院病棟患者のVTE発生率は低い。MiddeldorpはVTEの累積発生率9.2%を報告しており、COVID-19以前の非ICU患者の発生率と同様であったが、別の研究では累積発生率27%、動脈血栓症4%の複合発生率29%が報告されている。 85,86 しかし、病棟患者を対象としたすべての研究がこのような高い発生率を示しているわけではなく、例えばLodigianiら87は、この集団での発生率が6.6%であると報告しているのに対し、Cattaneoらは、388人のCOVID-19患者(うち64人は下肢超音波スクリーニングを受けた)でVTEを発症した患者はいなかったと報告している。
体外受精の発生率だけでは、COVID-19の体外受精の有病率に関する最近のシステマティックレビューでは、20,523人の患者を含む52の研究を分析し、プールされた有病率がICU以外の患者では9%、ICU患者では19%と著しく増加していることが報告されている89。
「大血管」血栓症の発生率が著しく上昇していることに加えて、剖検では広範な微小血管血栓症も明らかにされており、ある報告では、細胞内ウイルスの存在と細胞膜の破壊に伴う重度の内皮損傷と微小血管症を伴う広範な血栓症が認められている。別の報告では、COVID-19患者の肺胞毛細血管微小血栓症はインフルエンザ患者の9倍の有病率であった(p<0.001)91 。微小血管血栓症は多臓器においても顕著な特徴であり、完全な抗凝固療法を行っているにもかかわらず、また病状の経過の時期にかかわらず、いくつかのケースでは、病気を引き起こす初期の役割を果たしていることを示唆している。最近の剖検では、25例中17例で中程度の大きさの動脈または動脈孔内に血管内フィブリン血栓が認められ、25例中23例では中程度の動脈、動脈孔、毛細血管内に血小板凝集体および/または血栓が認められていることが明らかになった。臨床的梗塞を認めた症例のうち2例では、世界的な無酸素性脳障害が認められた。さらに、COVID-19患者における脳卒中の発生率を検討した最近のシステマティックレビューでは、COVID-19患者の脳卒中の割合(1.8%、95%CI 0.9-3.7%)は、インフルエンザ入院患者の報告(0.2%)の8倍であった。 94 さらに問題なのは、これらの推定値は、1)気管挿管されず死亡した患者の脳卒中診断を見逃したこと、2)検死が制限されているため検死が行われていないこと、3)COVID-19の時代に急性脳血管症状を持つ患者の数が減少していることが原因であることがほぼ確実に指摘されていることである。
COVID-19患者の多臓器における大血管および微小血管血栓症の発生率が高く、壊滅的であることを考えると、抗凝固療法がCOVID-19患者の転帰を改善できるかどうかが臨床上の大きな疑問である。Tangは、「重症」COVID-19患者449人を対象に最初に報告し、予防的に低分子ヘパリン(LMWH)を投与することで、敗血症誘発性凝固障害スコア≧4(40.0% vs 64.2%、P=0.5)を満たす患者のサブグループでは、大きな死亡率の改善と関連していることを明らかにした。 95 ニューヨーク市のMt. Sinaiによる2,777人の患者を対象とした大規模な研究では、AC治療を受けた患者の死亡率は29.1%であったのに対し、AC治療を受けなかった患者の死亡率は62.7%であったと報告されている。別の研究では、機械的換気を行った49人の患者のうち33%がPEと診断され、高強度血栓予防薬の使用は、標準的なレジメンよりもPEの発生率が低いこと(2/18;11%)と関連していた(11/22;50%-OR 0.13 [0.02-0.69]; p = 0.02)。
入院患者468人を対象としたレトロスペクティブ研究でも、高強度血栓予防薬の初回使用は、出血の有意な増加を伴わずに30日死亡率の改善と関連していることが明らかになった(調整後RR 0.26;95%CI,0.07-0.97;p = 0.04)。入院後48時間以内に抗凝固療法を開始した患者のサブグループ(n = 1860)では、治療的抗凝固療法の方が予防的抗凝固療法よりも院内死亡率が低かったが、その差は統計的には有意ではなかった(aHR 0.86;95%CI 0.73-1.02;p = 0.08)。興味深いことに、大出血の発生率は、予防的AC(33/1959,1.7%)およびACなし(29/1530,1.9%)の患者と比較して、治療的AC(27/900,3.0%)でも同様であった。Jonmarkerらは、COVID-19のICU患者の転帰を標準、中間、全用量の抗凝固療法で比較した。
最近発表された最初のRCTでは、機械換気を行っているCOVID-19 ICU患者における治療的ACと標準的血栓予防を比較したもの(HESACOVID)が発表され、小規模ではあるが、治療的ACを投与された患者における酸素化、機械換気からの解放(ハザード比:4.0 [95% CI 1.035-15.053]、p = 0.031)および無呼吸日数(15日 [IQR 6-16] vs 0日 [IQR 0-11]、p = 0.028)の統計学的に有意な改善が報告されている。
COVID-19 ICU患者に対する最初のMATH+プロトコルで推奨された治療量ACが生存率の改善と強く関連していることは心強いことであるが、心配なのは、AC治療にもかかわらずCOVID-19患者で重度の血栓性合併症が発生した「凝固不全」の複数の報告があることである。この現象を説明する可能性があるのは、Maierらによって提供されたもので、彼らは重症のCOVID-19 ICU患者15人(ほとんどすべてARDS患者)を対象にキャピラリー粘度計を使用し、すべての患者の血液粘度が正常値の95%を超えていることを発見した。104 COVID-19におけるTPEの役割を強く支持するエビデンスが増えていることは、以下の「救済療法」のセクションでレビューされている。
我々の知る限りでは、今日までのところ、国内または国際的な主要な医学会は、COVID-19患者のどのサブグループにおいても、標準的な治療的ACを投与することを推奨していない。その代わりに多くの学会は,COVID-19の入院患者すべてに標準的な血栓予防を推奨しているが,その一方で,高強度血栓予防の推奨も避けている。現在までに得られた最良の証拠に基づいて、現在よく知られている重度の高凝固障害の発生率とリスクは、治療に関連した生存期間の大きさと出血性合併症の有意な増加の報告の少なさに基づいて、わずかに積極的な抗凝固療法のリスクをはるかに上回るようであることを考えると、このような治療上の保守主義は不可解である。したがって、入院患者では積極的な血栓予防レジメンが必要であるが、重症患者では特に禁忌でない限り、治療用量のACを投与することが必要であると考えている。
我々が病棟患者に推奨する「中間」用量の血栓予防は、薬物動態学的および抗Xaレベルのモニタリング研究に基づいており,0.5mg/kgを1日2回、低分子ヘパリン(LMWH)を1日2回投与する体重ベースの予防法の使用を提案している105。
ICU患者には1mg/kg LMWHを1日2回投与することを推奨する。さらに、COVID-19ではヘパリン抵抗性が一般的であるとの報告があることから、抗Xa活性0.6~1.1 IU/mlを目標に抗Xa活性をモニタリングすることを推奨する。
メラトニンとCOVID-19
メラトニン(N-アセチル-5-メトキシトリプタミン)は、松果体と体内のほぼすべての細胞のミトコンドリアでトリプトファンから合成される108 。メラトニンは2つの受容体サブタイプに結合する。109 メラトニン受容体はGタンパク質共役受容体(GPCR)であり、細胞内シグナル伝達経路を活性化したり阻害したりする。
メラトニンの抗酸化作用は、抗酸化酵素(スーパーオキシドジスムターゼなど)のアップレギュレーション、プロ酸化酵素(一酸化窒素合成酵素など)のダウンレギュレーション、フリーラジカルと直接相互作用してフリーラジカル消去剤として機能することにより、メラトニンの抗炎症作用と協調している108,111。メラトニンは、酸化的傷害からミトコンドリアを保護する重要な役割を果たし、それによってエネルギー生産を維持するために重要な役割を果たしている。
メラトニンレベルは40歳を過ぎると劇的に低下する;このような患者はCOVID-19を発症し、この疾患で死亡するリスクが最も高い患者でもある。
SARS-CoV-2によって誘発された内皮機能障害は、JAK2およびSTAT3のリン酸化レベルの上昇によって開始され、活性酸素種の増加量を産生する118 。COVID-19におけるメラトニンの臨床的有用性は、SARS-CoV-2検査が陽性となる危険因子を特定するために作成された大規模なプロスペクティブ・レジストリで初めて実証された。
メラトニンのヒトへの経口投与は、頭痛や眠気などの軽微な副作用のみで、極めて安全性が高い。メラトニンの致死量50(LD50)は無限大と報告されており、動物を殺すのに十分な量のメラトニンを投与することは不可能である。116 さらに、「健康な人」と炎症性疾患を持つ人におけるメラトニンの最適投与量は不明である。COVID-19の患者には、6-12mgを夜間に服用することを提案している。
亜鉛とCOVID-19
亜鉛は、COVID-19の予防、初期症状期の治療、肺期の免疫異常とそれに伴うサイトカインストームの抑制に重要な役割を果たしている可能性が高い。亜鉛は体内に主要な貯蔵庫を持たないため、亜鉛欠乏症は容易かつ迅速に生じる。亜鉛の欠乏につながる同じ食生活の要因が、他の微量栄養素の欠乏につながることが多いことを認識しておく必要がある。亜鉛は宿主の抗ウイルス(および抗菌)免疫反応において重要な役割を果たしている。さらに、亜鉛には直接ウイルス性の作用がある。亜鉛はDNA結合タンパク質を含む1000以上の転写因子の構成要素であり、300以上の金属酵素に必要とされている。亜鉛は細胞の分化と増殖において中心的な役割を果 たしており、亜鉛が欠乏すると免疫応答の障害、 感染症への感受性の増加、創傷治癒の障害を引き起こす。120 亜鉛の状態はT-およびB-リンパ球の機能と抗体形成に強く影響する。120,121-123 亜鉛欠乏症は、重症患者、特に敗血症や急性呼吸不全の患者では、 亜鉛濃度が非常に低いことが報告されている124-126 亜鉛濃度の低さは、感染症の再発や病院での死亡率の増加と 関連していることが報告されている127 。
これまでの研究では、ウイルス性感染症、特に上気道感染症における亜鉛補給の有用性が実証されている。RCTSのメタアナリシスでは、症状発症から 24時間以内に75mg/日以上(亜鉛)の亜鉛ロゼンジを投与し、少なくとも5日間服用することで、風邪の症状の持続期間、欠席、抗生物質の使用を有意に減少させることが実証されている。しかし、ビタミンCと併用すると、低用量の亜鉛は風邪の症状の持続期間を短縮することが報告されている。123 1日あたり75mg以上の亜鉛を5カ月以上予防的に使用すると、風邪の発症リスクが低下した。介護施設の高齢者に亜鉛を補給すると、肺炎の発生率が低下することが報告されている。
Te Velthuis氏らは、亜鉛と亜鉛イオノフォアであるピリチオンを併用することで、SARS-Co-V依存性RNAポリメラーゼの活性が阻害され、ウイルスの複製が阻害されることを細胞培養で実証した。
ビタミンDとCOVID-19
ビタミンDは食事から摂取するか、UVB光によって皮膚で生成される。COVID-19の自然免疫系では、プロ炎症性サイトカインと抗炎症性サイトカインの両方を産生し、ビタミンDは腫瘍壊死因子αやインターフェロンγなどのプロ炎症性Th1サイトカインの産生を減少させ、マクロファージによる抗炎症性サイトカインの発現を増加させている137-139。
ビタミンDは免疫機能に重要な役割を果たしていることから、多くの人はビタミンDの欠乏が感染症への感受性を高め、ビタミンDの補給が特にCOVID-19において予後を改善する可能性があるという仮説を立ててきた140,141。Rhodes et al 144は、最初にCOVID-19の死亡率を国の緯度と比較することでこの関連性を明らかにし、年齢を調整した後でも、緯度28度以北では死亡率が4.4%増加していることを明らかにした。さらに、米国と英国の少数民族では、ビタミンD欠乏症の割合が高く、これらの集団の死亡率が高い理由を説明する可能性がある。最近、COVID-19におけるビタミンD補給の予防的役割を支持する強力な証拠は、50州すべての19万人以上の患者を含む国立研究所の非同定検査の大規模な観察分析から得られたものである。この研究では、過去12ヵ月間のどこかの時点でビタミンD値が測定された患者のSARS-CoV-2検査結果を分析した。3つのビタミンDの範囲内でのSARS-CoV-2陽性率は以下の通りであった。欠乏」(20ng/ml未満)の場合は12.5%、「十分」(30-34ng/ml)の場合は8.1%、55ng/ml以上の場合は5.9%であった145。
ビタミンD欠乏とウイルス感染症の発生率の高さとの強い関連性を考えると、複数の研究では、ビタミンDの補給がこのリスクを減少させることができるかどうかが検証されている。研究の知見は相反するものであるが 2018年に行われた最近のメタ分析では、ビタミンDの定期的な補給が急性呼吸器感染症のリスクを低下させ、重度のビタミンD欠乏症患者において最も深い効果があることが明らかになった146。
ビタミンD不足のリスクと入院前の補給の利点は、入院時にビタミンDレベルを測定した235人の患者を対象としたイランの研究で最も最近になって強調された147 。さらに、40歳以上の患者の死亡率は、十分なビタミンDの有無にかかわらず9.7%対20%であり、ビタミンDが免疫応答の調節に重要な役割を果たしていることが示唆された。
ICUでは、ビタミンD欠乏症は一般的であり、入院後にレベルが急速に低下する。148,149 さらに、欠乏症は転帰、すなわち死亡率の上昇と強い負の相関関係がある。しかし、最近になって、ビタミンD欠乏の重症患者におけるコレカルシフェロール補充の効果に関する大規模、前向き、多国籍、二重盲検、プラセボ対照試験(VIOLET)の結果が発表された154 。さらに、より重症の患者やより重症の欠乏症の患者であっても、個々のサブグループでは効果は見られなかった。
VIOLET試験の結果は、ビタミンDの補充のみでは重症患者への介入としての効果がないことを強く示唆しているが、ウイルス性症候群とCOVID-19の両方において、より強力な治療的役割を果たす可能性を示唆する証拠(VIOLET試験ではウイルス性症候群の患者はほとんど含まれていなかったと思われる)とは別に、COVID-19の治療にビタミンDを含めることは、ビタミンDとの併用投与により、コルチコステロイドとビタミンCの相乗効果に似たコルチコステロイドの効果が治療的に増強されることに主に基づくものである。 155 ビタミンDはグルココルチコイド受容体を上昇させ、T細胞のアポトーシスを増加させる一方で、末梢血細胞単球におけるサイトカイン産生を抑制するコルチコステロイド効果を増強することが実証されている。
最近、COVID-19入院患者を対象に、血清中の活性型ビタミンDの直接前駆体であるカルシフェジオールを用いたビタミンD治療のパイロットRCTが行われ、患者は入院当日に0.532mg(約68,000IUのビタミンD3とほぼ同等の力価)を経口投与され、3日目、7日目、その後週1回に半量を投与された。カルシフェジオールを投与された50人の患者のうち、1人がICUへの入院を必要としたのに対し(2%)未投与の26人の患者のうち13人がICUへの入院を必要としたのに対し(50%)p<0.001,OR 0.02 [0.002-0.17].14であった。著者らは、カルシフェジオールは疾患の重症度を軽減するように思われるが、より決定的な答えを出すためには、より大規模な試験が必要であると結論づけた。
このように、利用可能なデータは、高用量ビタミンDの補充が、ウイルス感染症の予防だけでなく、COVID-19や副腎皮質ステロイド療法の効果を改善する上でも有益であることを示唆している。
補給の影響は欠乏状態や重症度によって異なるが、ビタミンD補給は安全である;健康な患者を対象としたあるメタアナリシスでは有害事象は認められなかったが、重症患者では軽度の高カルシウム血症が最も一般的な有害事象であった146,159。
50nmol/L(20ng/mL)以上の血清レベルは、急性呼吸器感染症に対する保護には十分であると考えられている146 それは、北米ではビタミンD2(エルゴカルシフェロール)ヨーロッパではビタミンD3(コレカルシフェロール)であることに注意すべきであるが、投与量は同じである。ある報告では、「10,000IU/日までの投与は安全であるが、必要な量をはるかに超えている」とし、「骨と免疫に最適な効果を得るためには1,000~2,000IUしか必要ないかもしれない」としている160。このように、COVID-19のリスクを減らすために、ある専門家は、COVID-19のリスクがある人は、25(OH)D濃度を急速に上昇させるために数週間、10,000IU/日のビタミンD3の摂取を検討し、その後、5,000IU/日を摂取することを推奨している。目標は、25(OH)D濃度を40-60ng/mL(100-150nmol/L)以上に上昇させることである。
重症患者では、公表されているRCTで使用された用量は200,000-600,000 IUのビタミンD3で、一般的には1回の経腸投与量である152,161,162。ICUでは、上記のICUでの先行試験と同様に、48万IU(30ml)の単回大量投与を推奨する(表1)。その後、5日目にビタミンD値を再チェックし、20ng/ml未満であれば、96,000IU/日を5日間追加投与する必要がある。
スタチン療法とCOVID-19
スタチンは脂質レベルを低下させる薬であるが、複数の抗炎症作用も有する。163 その後、さまざまなスタチンと用量のランダム化比較試験が複数実施されたが、2628人の患者が参加した敗血症を対象としたRCTのメタアナリシスでは、群間の死亡率に差は認められなかった。しかし、STATInS試験とHARP-2試験の結果をレビューした論説では、わずか3つのイベントを変更するだけで、死亡率の転帰に基づいて統計学的に有意な結果が得られたであろうことが示されている166-168。この低い「脆弱性指数」は、サブグループの利益は存在するが、ARDSや敗血症などの重篤な疾患症候群のRCTにしばしば含まれる異質な集団では、利益が「失われる」ことを示唆している。この仮説は、著者らが患者をARDSの2つの表現型、「高炎症性」と「低炎症性」に分割したHARP-2試験の二次解析で検証されたようである。高炎症性表現型の患者にシンバスタチン80mgを投与したところ、死亡率が統計学的に有意に大きく減少した。さらに、COVID-19では、2件のレトロスペクティブ研究でスタチン使用と生存率との強い関連が示されている。中国の13,981人の患者を対象とした大規模研究では、1,219人がスタチンを投与されたが、スタチン投与群では全死亡率がほぼ半減した(HR = 0.58,(95%CI,0.43-0.80,p = 0.001))。 13 米国で行われたより小規模な研究では、あるグループが88人の患者群のうち55%が死亡したが、アトルバスタチンの使用は死亡への進行リスクを73%低下させることと関連していた(aHR 0.38(95%CI 0.18-0.77,p=0.008))。アトルバスタチンは薬物相互作用のプロファイルがより良好であるため、HARP-2試験と同様に80mgの高用量を使用すべきである。
ファモチジンとCOVID-19
ファモチジンはヒスタミン-2受容体拮抗薬(H2RA)であり、胃での酸産生を抑制するために一般的に使用されているが、HIVのようなウイルス複製を阻害するだけでなく、自然免疫系および適応免疫系のほぼすべての免疫細胞に刺激作用を発揮する試験管内試験特性を有することが知られている171 。
H2RAは過去に他のウイルスに対して有効であることが証明されている。シメチジン、それ程ではないがファモチジンは試験管内試験でHIVへのウイルス感染を減少させ、ヒト乳頭腫ウイルスによるイボのクリアランスを増加させ、慢性エプスタインバーウイルス感染に伴う症状の改善に効果的であると考えられている174-176 。実際、クエン酸ラニチジンビスマスはSARSコロナウイルスヘリカーゼのヌクレオシド三リン酸ヒドロラーゼとDNAアンワインド活性を効果的に阻害し、感染細胞内での複製レベルを劇的に減少させた177 。
抗ウイルス効果、特に抗SARS-CoV効果と免疫系への効果が先行して証明されていることを考えると、Freedbergらは、単一の医療センターでCOVID-19患者を対象に、傾向スコアマッチングを用いたレトロスペクティブコホート研究を行った。治療群はすべて入院後24時間以内にファモチジンを投与された。1620人の患者が含まれ、そのうち81人がファモチジンを投与されていた。その結果、ファモチジンの使用は、死亡または挿管のリスクの大幅な減少(調整後ハザード比(aHR)0.42,95%CI 0.21-0.85)と関連しており、また単独での死亡リスクの減少(aHR 0.30,95%CI 0.11-0.80)と関連していることが明らかになった。観察研究ではあるが、グループ間で傾向スコアのマッチングが行われ、挿管と死亡に大きな差が観察された。このような研究は、最適な妥当性を検証するためのRCTの必要性を考慮して、厳密には仮説を立てたものと考えるべきであるが、生物学的に妥当であること、他のウイルスに対する先行的な有効性、よく知られた安全性プロファイル、低コスト、高可用性、および関連する死亡率の大幅な減少を考慮すると、COVID-19の治療にファモチジンを使用することは妥当であると思われる。Freedberg試験で使用された用量は、17%に10mg、47%に20mg、35%に40mgで、使用期間の中央値は5.8日であった。
呼吸不全の管理
COVID-19呼吸不全における酸素化と換気の最適なサポートについての包括的なレビューは本稿の範囲を超えているが、いくつかの重要な生理学的洞察が認められるべきである。
初期の出版物では、COVID-19患者で観察された低酸素血症の程度と適度な呼吸機能との間の不可解な不一致がすぐに強調され、これを「サイレント低酸素血症」と表現し、そのような患者を「ハッピー低酸素血症」と表現していた。呼吸困難の欠如の理由は複数あるが、最大の要因は以下の通りである。1)初期のCOVID-19は、古典的なARDSのように肺が「乾いていて軽い」対「重くて流体で満たされた」肺を作るような肺胞液の蓄積/浮腫ではなく、肺胞と管路への細胞浸潤を表す「組織化肺炎」であり、したがって、膨張させるためのより少ないエネルギーの仕事をリードし、非再就職に対抗するために。2)典型的な低酸素性肺血管収縮の失敗を示唆し、不釣り合いな低酸素血症を引き起こしている組織性肺炎の病巣のまだ原因不明の逆説的な過灌流(図2)および3)ルーチンの画像検査では検出されなかった初期の広範な微小および/または大血管の凝固の可能性が高い。 8,181,182
図2 COVID-19患者の造影を伴うスペクトルCT画像。顕著に増加したヨウ素取り込みが見られ(画像の右のカラースケール)グランドガラスの不透明度への灌流が増加していることを示している
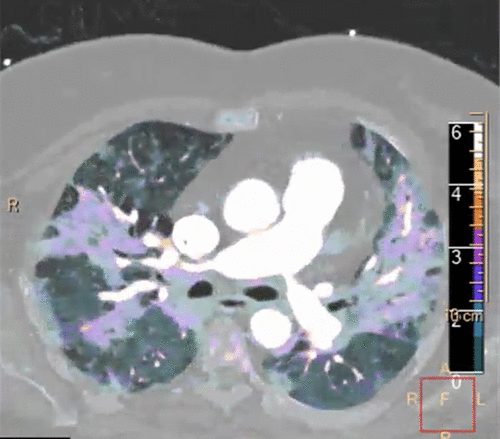
図3 COVID-19における低酸素血症と呼吸不全に対する治療的アプローチ

「伝統的なARDS」とのこれらの違いは、残念ながら、機械的によく耐えられる低酸素血症の根拠のない恐怖であったものを「早期挿管」のための頻繁な推奨によって証明されたように、広く最小限に抑えられ、見落とされていた。このようなアプローチは、最初に報告された許容できないほど高い死亡率だけでなく、初期のハードヒット地域のいくつかでは、人工呼吸器、ICUベッド、人工呼吸器、看護師、薬剤が広範囲に不足していたことにも貢献したと考えられる。このようなアプローチは不思議なことに、「早すぎず遅すぎず」という機械的人工呼吸を開始するという長年の治療原則から逸脱していた。非侵襲的な方法にもかかわらず、WOBが過剰であったり、持続不可能であると感じられた場合には、その時に限って侵襲的な機械的サポートの開始を追求すべきである。COVID-19 呼吸不全に対する我々の推奨戦略を図3に示す。同様のアプローチで、多くの施設では、非侵襲的な手段と方法(セルフプローニング)を用いた酸素供給のサポートに主眼を置くことで、人工呼吸器とICUベッドの必要性が減り、転帰が改善されることがすぐにわかった。
サルベージ療法
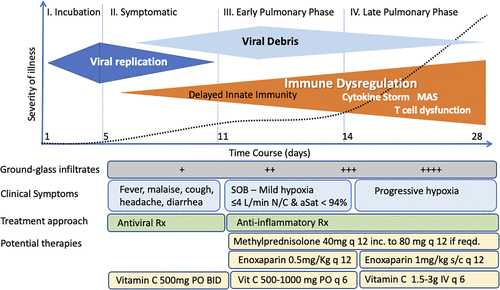
COVID-19の入院に至る病態生理学的メカニズムは段階的に発生し(図4)細胞病性ウイルス複製期よりもむしろ全身性の宿主応答期によって大きく駆動されることがますます認識されるようになってきている。宿主の反応は現在、炎症、内皮症、サイトカインストーム、および高凝固性の複雑な相互作用として理解されているため、治療的血漿交換はサイトカインの除去、内皮膜の安定化、および高凝固状態の逆転によってユニークな利点を提供できると主張する者もいる。
図4 COVID-19の病期
著者らの臨床経験の中には、MATH+プロトコルを構成する複合療法に生理的に反応しない患者に遭遇したことがあるが、これは主に提示時の進行した疾患や広範な併存疾患によるものと考えられる。このような最初の症例では、治療的血漿交換療法(TPE)が試みられ、一時的な生理的改善が観察され、気管切開と退院の両方につながった。著者らの経験のうち2例(PEM、PK)では、この記事を書いている時点で、高用量MATH+プロトコルで治療したにもかかわらず、生理的改善がほとんど見られず、TPEで経験的に治療された患者が合計16例いた。16人のうち13人は抜管して退院したが、3人は反応せず、その後死亡した。185-195 ほとんどすべての症例で、TPEの開始または完了に関連した時間的に同様の生理的および臨床的反応が得られたことが報告されている。さらに、プラスマフェレーシス治療を受けた74人の患者を含む3件のレトロスペクティブな観察的コホート研究では、気管切開と生存率に劇的な差があることが報告されている104,196,197。最大の研究であるパキスタンの研究では、プラスマフェレーシス治療を受けたCOVID-19患者45人を対象に、45人の割合を一致させた対照群と比較して、プラスマフェレーシス治療群の死亡率は8.9%対対照群の38.5%、HR 0.21,95%CI 0.09-0.53,対数順位 . 002.197 オマーンの Khamis らは、中等度から重度の呼吸不全を有する COVID-19 患者 31 例について発表しており、重症度の高い患者のうち 11 例が TPE を受けており、 TPE 群では対照群に比べてトシリズマブを受けている割合がわずかに高かった 104。抜管率(73%対20%、p = 0.018)と死亡率(0%対35%、p = 0.03)の両方で大きな改善がみられたことが報告されている。
これらの研究は、コルチコステロイドなどの現在の標準治療に反応しないCOVID-19患者の管理におけるTPEの役割を強く示唆しているが、TPEの適応、期間、および有効性をよりよく確立するために、前向きおよび/または無作為化試験の両方を行うべきである。
MATH+プロトコル病院死亡率とCOVID-19
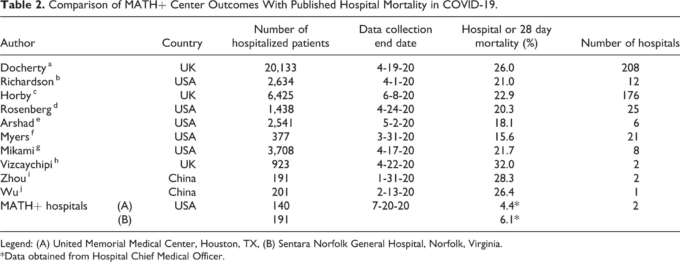
上記で検討したMATH+プロトコル(表1)は、米国の2つの病院でCOVID-19患者の治療に実施された:テキサス州ヒューストンのユナイテッドメモリアル病院(J.V.)とバージニア州ノーフォークのノーフォーク総合病院(P.E.M.)である。ユナイテッドメモリアル病院では入院時にMATH+が体系的に提供され、ノーフォークジェネラル病院ではICUへの入院時にプロトコルが投与された。2020年7月20日現在、これら、2つの病院で治療されたCOVID-19患者のための利用可能な病院転帰データは、米国および世界の複数のCOVID-19の出版物から発表された病院死亡率との比較を含めて、表2に提供される。
これら、2つの病院で治療を受けた300人以上の患者の平均病院死亡率は5.1%であり、COVID-19患者の公表されている平均病院死亡率22.9%と比較して、死亡率の絶対的リスクが75%以上減少していることを示している。この比較は病気の重症度と提供された治療法に関するデータが不足しているために限られたものであるが、2つの施設で報告された死亡率の低さは、かなりのサンプルサイズの患者であることから、MATH+治療プロトコルの生理学的根拠と有効性を裏付ける臨床的証拠を提供している。
この比較には限界があるが、この比較研究はすべてRECOVERY試験がコルチコステロイドの使用による死亡率の改善を確認する前に発表されたものであり、コルチコステロイドがより広く使用されるようになれば、他の施設から報告された死亡率は時間の経過とともに減少する可能性がある。しかし、RECOVERY試験では、酸素を使用している患者や機械換気が必要な患者など、コルチコステロイドの効果があった患者でも、28日間の死亡率はそれぞれ20%~30%であったのに対し、酸素を使用していない患者では、コルチコステロイドの使用の有無に応じて10%~20%の死亡率となり、いずれもMATH+プロトコルを使用している施設よりも高かったことに留意すべきである。
表2 COVlD-19におけるMATH+センターの成績と公表されている病院死亡率の比較
結論
結論として、COVID-19で確認された多様な病態生理学的メカニズムは、この異常な免疫反応の多様で有害な結果を打ち消すために、複数の治療薬が協調して作用することを必要とする可能性が高い。魔法の弾丸」が発見される可能性は非常に低い、あるいは病気の複数の段階で有効であろう薬さえも。Math+治療プロトコルでは、代わりに、強力な生理学的根拠に基づいたよく知られた安全性プロファイルを持つ安価な医薬品の組み合わせを提供し、増加する臨床的根拠に基づいて、COVID-19患者の管理に救命的なアプローチを提供する可能性がある。
