Contents
- Classification of the present pharmaceutical agents based on the possible effective mechanism on the COVID-19 infection
- 要旨
- 序論
- 方法
- COVID-19ライフサイクル
- 図1 宿主細胞接着
- 図2 エンドサイトーシス経路
- 図3 ウイルス複製
- 宿主細胞の付着
- スパイクプロテインブロッカー
- ACE2可逆性ブロッカー
- TMPRSS2阻害剤
- エンドサイトーシス経路
- クラスリン媒介エンドサイトーシス阻害剤
- リソゾモトロピー薬
- 直接的なエンドソーム/リソソームプロテアーゼ阻害剤
- ウイルスの複製
- プロテイナーゼ阻害剤
- 直接RdRp阻害剤
- ヌクレオシドアナログ
- ウイルス性タンパク質阻害剤
- 炎症性反応
- COVID-19における血栓塞栓症のメカニズム
- ウイルスの防御ブロッカー
- 直接的なインターロイキン拮抗薬
- プロ炎症抑制剤
- コルチコステロイド
- その他のプロ炎症抑制剤
- JAK-STATシグナル伝達阻害薬
- インターフェロン
- 酸化ストレス阻害剤
- 界面活性剤の置換
- 考察
- 結論
Classification of the present pharmaceutical agents based on the possible effective mechanism on the COVID-19 infection
link.springer.com/article/10.1007%2Fs40199-020-00359-4
要旨
目的
COVID-19の研究はいくつかの種類がある。パンデミックを克服するには、ウイルスの病態生理をマスターすることが必要であると思われる。膨大な量の情報を分類し、有用な解釈ができるようにした。
エビデンス取得
本研究では、COVID-19の病原性と病態生理に焦点を当てた様々なキーワードと検索戦略でデータベースを検索した。本レビューでは、感受性の高い病原性メカニズムと宿主細胞での病態生理イベントに基づいて、実装されたすべての薬剤を収集し、分類し、治療法を議論し、提案することを目的としている。
研究成果
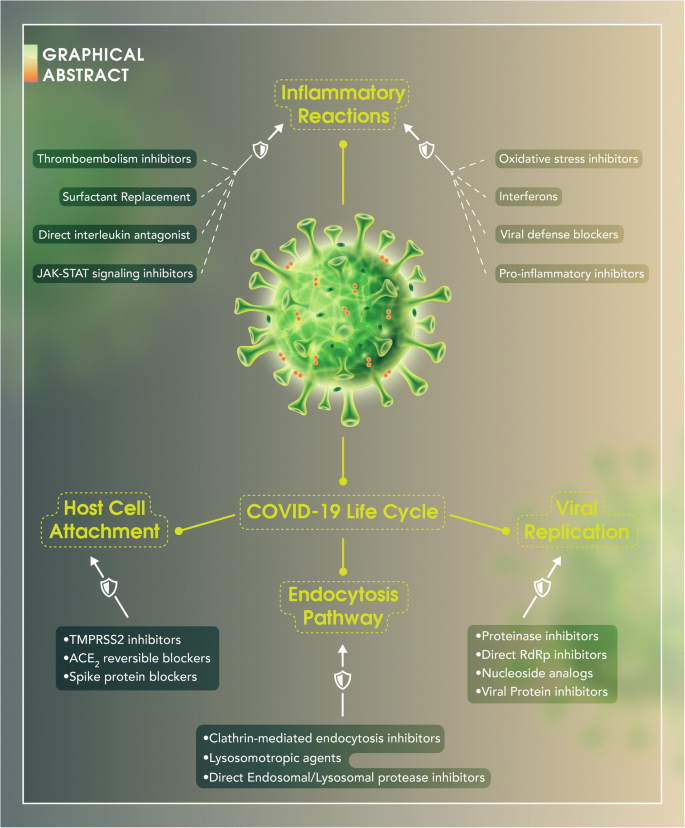
その結果、COVID-19のライフサイクルは以下のステップに分類された。主に宿主細胞からのACE2受容体やTMPRSS2とSpike(S)タンパク質を介して行われる「宿主細胞接着」、主にクラスリン媒介エンドサイトーシスによって行われる「エンドサイトーシス経路」、そしてRNAウイルスゲノムの翻訳・複製を含む「ウイルス複製」である。ウイルスの病原性は、主に中等度から重度のCOVID-19病を引き起こす「炎症反応」によって継続している。また、COVID-19の前臨床試験や臨床試験で1回以上の経験を持つ薬剤や、有効な治療薬のメカニズムが明確に定義された。
結論
治療プロトコルは、感染症のステージと患者の状況に基づいて時折行われる。COVID-19病のほぼすべての病期に影響を及ぼす可能性のある薬剤のカクテルは,重篤な症状のある患者には不可欠なものであるかもしれない.
グラフィカル・アブストラクト
COVID-19の病原性に基づく医薬品の考えられるメカニズムの分類
序論
CoVs(コロナウイルス)は、一本鎖RNA(30 kbゲノム)と大きな包絡粒子(60~140 nm)を持つウイルスであり、ヒトや動物の健康に影響を与える[1,2,3]。その中でも特に注目されている3つのウイルスは、呼吸器疾患や腸疾患を引き起こし、重篤な併存症や死亡率を伴う場合もある [2,4,5]。SARS(重症急性呼吸器症候群)はその筆頭であり,2002年11月から 2003年7月までに中国南部で発生し,29カ国で8098人の患者が発生し,そのうち774人が死亡した。
2番目のMERS(中東呼吸器症候群)はサウジアラビアで出現し、2019年7月までに2458人が感染し、27カ国で848人が死亡した[2]中国湖北省武漢市では、2019年12月に原因不明の肺炎が出現したとの報告があり[6]、その後、2019年12月には、中国の湖北省武漢市でも、原因不明の肺炎が出現したとの報告があった。
その後、2020年1月7日に新型CoV(SARS-CoV-2、通称COVID-19)が肺炎患者から分離され、3番目の緊急性、7番目の既知のものとして報告された[2、7]。COVID-19は2020年1月22日まで中国の25省で571人に感染していたが、2020年2月までの間に4万4,672人(総感染者数72,314人の62%)に急増し、中国疾病管理予防センターが報告した[8,9]注目すべき3つのCoVはいずれもコウモリからの人獣共通感染によって出現している[9]。
感染した患者の口や鼻から飛散する飛沫との接触は、人から人への感染の主な原因とされている[10]。世界保健機関(WHO)は2020年3月11日、COVID-19の発生は11万8000人以上の感染者を抱えたパンデミックと考えられ、114カ国で4292人の死者を出したと発表した[11]。
中国の病院での138人の患者の報告では、感染者の主な初期症状は発熱(98.6%)、疲労(69.6%)、乾いた咳(59.4%)、筋肉痛(34.8%)、呼吸困難(34.2%)であった[12]。一般的に、基礎疾患のない小児は軽症であるように思われた[13]。
専門家は、COVID-19の潜伏期間は初期症状が出る前の14日間であると宣言している[14]。胸部CTスキャンは、感受性の高い人の早期診断に有用なツールである[15]。患者の胸部CTの主な特徴は、時折圧密を伴った地被膜の不透明化である[16]。診断が確定した後、臨床医にとって治療が主な課題となった。最初の数日間は治療方針がなく、利用可能な薬剤に基づいて投薬治療が継続された。
2020年5月1日、米国食品医薬品局は、成人および小児のCOVID-19重症化が確認された疾患の治療にレムデシビル抗ウイルス薬の使用を許可した[17, 18]。しかし、これで終わりではなかった。レムデシビルは入院期間を短縮することができるが、一方でウイルスは異なる症状を示し、治療には様々な戦略を必要とする。
そこで、適切な治療プロトコルを見つけることがCOVID-19を克服するための根本的な解決策であることから、COVID-19の病原性や病態生理に着目し、異なるキーワードと検索戦略でデータベースを検索した。その結果、ウイルスの病原性、治療メカニズム、薬剤の選択肢について説明した。
表によると、COVID-19の前臨床試験またはヒト臨床試験として1回以上の経験がある薬剤を集めた。臨床で実施された薬剤については本文でレビューし,ヒト臨床試験を通過した薬剤については表に記載した。すべての薬剤のメカニズムが表に記載されているので、研究者が治療に適した組み合わせを選択する際のヒントになる。
方法
目的とした文献レビューは、COVID-19上の現在の医薬品の分類に達成された。2019年1月から 2020年4月までに英語で発表された原著論文を、WHOやClinicalTrials.gov、PubMed/MEDLINE、Google Scholar、Web of Scienceなどのオンラインデータベースや関連サイトから検索し、検索された論文のすべての参考文献を評価した。毒性、病態生理、COVID-19で実装されている薬剤に焦点を当てた異なるキーワードを使用した。
著者はまずタイトルと要旨を読むことで文献の関連性を評価した。次に、選択された論文の全文と関連文献を導き出し、熟読した。また、これまでにSARS-CoVやMERS-CoVに対して使用されていたいくつかの薬剤とCOVID-19のライフサイクルとの間には関係があるように思われる。そこで、COVID-19の治療法として考えられる選択肢を示唆するために、試験管内試験(in vitro)および生体内試験(in vivo)での活性と臨床経験を持つ論文を検索した。
検索した用語は、COVID-19 OR コロナウイルス OR SARS-CoV-2 OR SARS-CoV OR MERS-CoVであった。COVID-19のライフサイクルで選択された薬剤について、ClinicalTrials.govで検索した臨床試験(募集中のもの、未募集のもの、活動中のもの、完了したものを含む)が表に記載されている。
COVID-19ライフサイクル
宿主細胞からのACE2(アンジオテンシン変換酵素-2)受容体やTMPRSS2(膜貫通型プロテアーゼセリン-2)とウイルス粒子からのSpike(S)タンパク質を中心に行われる「宿主細胞付着」、主にクラスリンを介したエンドサイトーシスによって行われる「エンドサイトーシス経路」、RNAウイルスゲノムの翻訳・複製を含む「ウイルス複製」に分類される。
ウイルス粒子は脂質エンベロープ[19]を含み、構造タンパク質はエンベロープ(E)、膜(M)、スパイク(S)と呼ばれる表面糖タンパク質突起[20]、ヌクレオカプシド(N)と呼ばれるタンパク質を含む。COVID-19ウイルス粒子は、SARS-CoVと比較して高い親和性(10~20倍)を持つSタンパク質のホモ三量体であるSpikeタンパク質を介してヒト細胞上のACE2受容体に結合し[21, 22](図1)、主に「クラスリン媒介エンドサイトーシス」経路を介してエンドサイトーシスに誘導される[23, 24]。
ウイルス粒子のエンドソームは、DMV(二重膜小胞)とオートリソソームの生成を介して、「後期エンドソーム/リソソーム」の形成、または「オートファジー」のいずれかを経るが、オートファジーについては議論がある[25]。ライソソソーム機能は、ウイルスゲノムを宿主細胞に注入するために酸性のpHを必要とする(図2)。
非構造タンパク質には、宿主細胞でRNAゲノムを発現させた後に産生されるポリタンパク質、ヌクレオタンパク質、RNAポリメラーゼ、3CL(3-chymotrypsin-like)プロテアーゼ、PL(papain-like)プロテアーゼ、ヘリカーゼなどがあり、これらは新しいウイルス粒子を形成し、他の細胞に感染するために産生される[26](図3)。
図1 宿主細胞接着
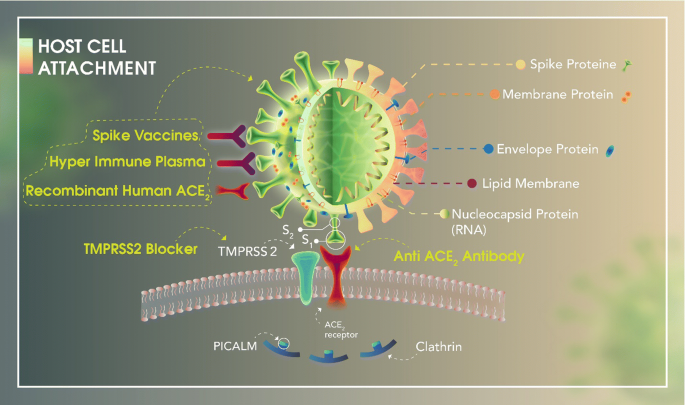
COVID-19構造タンパク質は、エンベロープ(E)、膜(M)、スパイク(S)、およびヌクレオカプシド(N)タンパク質を含む。Sタンパク質は、S1(サブユニット1)でACE2(アンジオテンシン変換酵素2)受容体に結合している。
TMPRSS2(膜貫通プロテアーゼセリン-2)のようなプロテアーゼの活性は、このステップにおいて重要な役割を果たす。クラスリンタンパク質であるPICALM(ホスファチジルイノシトール結合クラスリン集合タンパク質)およびS2(サブユニット2)は、ウイルスのライフサイクルの次の段階に参加するであろう。
COVID-19の宿主細胞膜への結合を阻害する可能性のある薬剤は、その作用機序と特異的な作用部位に基づいて黄色で表示されている。
図2 エンドサイトーシス経路
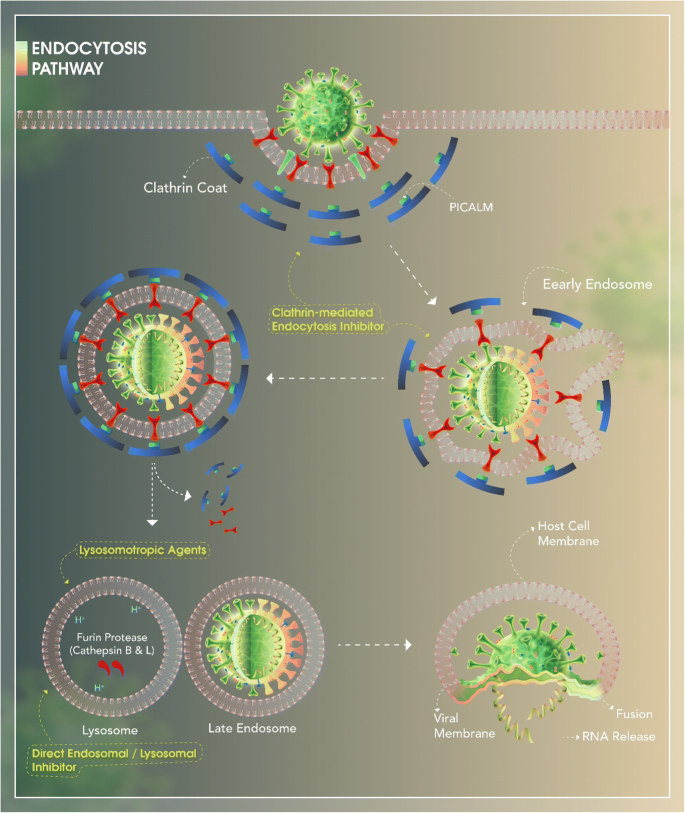
このステップは、ウイルス粒子のクラスリン依存性エンドサイトーシスによって開始される。ウイルス粒子は 「初期エンドソーム 」の貨物となる。PICALM(ホスファチジルイノシトール結合型クラスリン集合タンパク質)のようないくつかのタンパク質は、初期エンドソームの成熟、特にその湾曲およびクラスリン依存性エンドサイトーシス速度の調節に不可欠である。
ACE2(アンジオテンシン変換酵素2)などの膜受容体を初期エンドソームから排除することで「後期エンドソーム」が形成される。その後、リソソームを後期エンドソームに融合させ、pH依存性分解を開始させる。リソソームの機能は、ウイルスゲノムを宿主細胞に注入するために酸性のpHを必要とする。
カテプシンB&LなどのFURINプロテアーゼは、FURIN切断部位からSpikeをS1とS2のサブユニットに切断する役割を担っている。S2を切断してS1サブユニットを明らかにした後、ウイルス膜は後期エンドソーム膜と融合し、ヌクレオカプシドタンパク質を宿主細胞に放出することができる。COVID-19エンドサイトーシス経路を阻害することが可能な薬剤を、その作用機序と特異的な作用部位に基づいて黄色で表示している。
図3 ウイルス複製
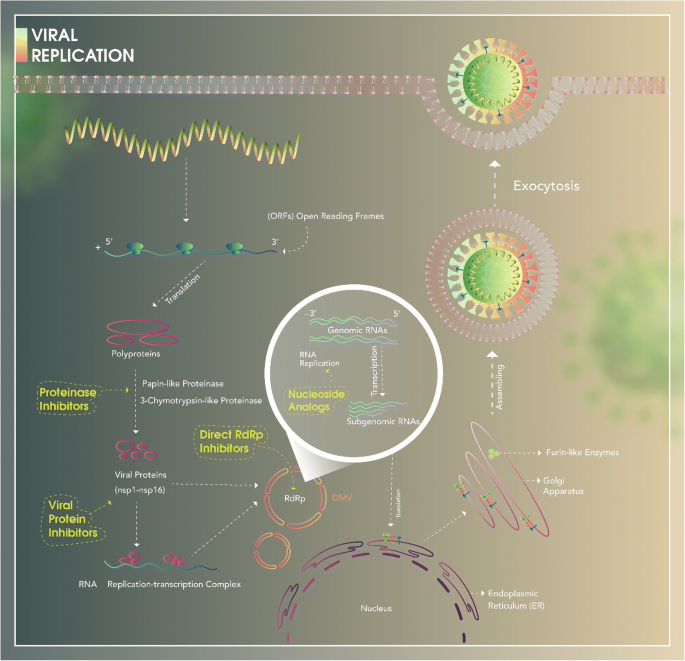
COVID-19は細胞内に入った後、RNAゲノムを放出するために分解する。5-メチル化されたキャップと3-ポリアデニル化されたテールを含むゲノムが5ʹの順に配列されている。オープンリーディングフレーム(ORF)は細胞質内でポリプロテインに翻訳される。生成されたポリタンパク質はパパイン様プロテイナーゼと3C様プロテイナーゼによって切断され、16個の非構造タンパク質(NSP1-NSP16)が生成され、RNA Replication-Trancription Complex(RNA複製転写複合体)を展開する。
ウイルスのRNA複製は、小胞体(ER)に由来する二重膜小胞(DMV)内のRNA依存性RNAポリメラーゼ(RdRp)と呼ばれるウイルス酵素によって行われる。その後、ゲノムRNAはサブゲノムRNAに転写され、翻訳される。
その結果、構造タンパク質が合成され、ER-ゴルジ配位で核カプシドやウイルスエンベロープに組み立てられる。ゴルジ体の組み立て段階では、FURIN様酵素がS1サブユニットとS2サブユニットの間の結合を形成する。
最後に、新しいウイルスはエキソサイトーシスによって細胞外コンパートメントに放出される。COVID-19の複製を阻害する可能性のある薬剤を、その作用機序と特異的な作用部位に基づいて黄色で表示している。+正鎖RNA, -: 負鎖RNA
宿主細胞の付着
簡単に説明すると、COVID-19ウイルス粒子は、Sタンパク質を介してヒト細胞上のACE2受容体を標的にしてエンドサイトーシスを行い、宿主細胞に感染する[21, 24]。
また、COVID-19は、膜融合のためのSタンパク質の活性化に重要な役割を果たしていることから、宿主細胞への侵入にはTMPRSS2などのプロテアーゼが必要であると考えられている[27, 28](図1)。
ACE2を発現する肺細胞はすべてTMPRSS2陽性であり[29]、承認された阻害剤はCOVID-19治療の一環となる可能性がある[28]。潜在的な治療法としての「宿主細胞付着」阻害剤を以下のグループに分類することができる。
スパイクプロテインブロッカー
Sタンパク質は病原性の開始に重要な役割を果たしているため、治癒したCOVID-19患者の血漿抗体(重症例では米国食品医薬品局により承認されている)[30, 31]、IVIG(静脈内免疫グロブリン受動免疫)[32]、組換えヒトACE2、またはSタンパク質を用いたワクチン接種(能動免疫)[33]により中和することができる。
重症COVID-19病と急性呼吸窮迫症候群(ARDS)を有する5名の患者に、回復期血漿から中和抗体を投与したところ、臨床状態が改善したとの非対照例が報告されている[34]。COVID-19のワクチンは、スパイクがウイルス-宿主細胞相互作用に関与しているため、スパイクの外観構成をシミュレートする必要がある[8]。
S1サブユニットタンパク質ベースのワクチンの開発は、ACE2がCOVID-19の受容体であるという事実に依存しているかもしれない。ACE2の存在下でウイルス複製を促進する細胞株は、大規模なワクチン生産において最も効率的であるかもしれない[33]。
ACE2可逆性ブロッカー
肺のAECII(肺胞上皮Ⅱ型細胞)、食道上部および層状上皮細胞、回腸および結腸の吸収性腸球、胆管細胞、心筋細胞、腎臓近位尿細管細胞、肝臓の内皮細胞、膀胱尿道細胞など、高レベルのACE2発現を有する細胞がいくつか存在し、COVID-19の潜在的な標的となる可能性がある[21, 35, 36]。
ACE2受容体は肺に比べて心臓、精巣、膀胱、腎臓、胆嚢、脂肪組織、腸で有意であるにもかかわらず[22]、肺はCOVID-19の影響を受けやすい標的である。L Baoらの研究では、COVID-19ウイルス粒子を吸入して感染させたヒト-ACE2トランスジェニックマウスの病理組織学は、肺胞間質に顕著な量の単球とリンパ球の移動と肺胞腔内のマクロファージの蓄積が間質性肺炎の原因となることを示した。
また、肝臓、心筋、胆嚢、腎臓、腸、精巣など他の臓器では目立った病理組織学的所見は見られないであった[37]。また、SARS-CoVに感染したマウスを用いた別の動物モデルでは、ACE2受容体のダウンレギュレーションに続いて、アンジオテンシンIIの蓄積、肺血管透過性、最後に肺水腫が起こることが示されている[38]。
このメカニズムは劇症型心筋炎の発生も示唆している[39]。以前から知られているように、ACE2受容体のダウンレギュレーションは、SARS-CoVに感染したマウスの重篤な肺損傷を示唆していた[33]。組換えヒトACE2はACE2のダウンレギュレーションを抑制することも可能である[33]。
ACE2受容体拮抗薬であるロサルタンは肺障害の軽減効果が期待されているが[38, 39]、COVID-19患者におけるACE阻害薬やARBを含むRAS拮抗薬の使用については議論がある[38]。
ロサルタン(NCT04312009)の有効性を証明するため、あるいは重症COVID-19患者におけるRAAS(レニン-アンジオテンシン-アルドステロン系)拮抗薬の使用の危険因子が疑われることを明らかにするための臨床試験が行われている(NCT04318418)(表1)。
表1 COVID-19宿主細胞接着破壊に有効と想定される分子の定義
原文参照
ACE2受容体のより高い慢性発現は、重度のCOVID-19のリスクが高い傾向にある患者に影響を及ぼす可能性があるこの論争を説明している。高血圧や糖尿病などの慢性疾患を併発している患者で、チアゾリジン系薬剤やイブプロフェンのようなACE2増加薬[40]を投与されている患者では、ACE2調節薬(ACE阻害薬またはARB)の有益な使用に関する報告があるが、最近の臨床研究では、アセトアミノフェンの全量投与後に軽減が見られない場合にはイブプロフェンの使用を推奨している[40]。
また、非ステロイド性抗炎症薬(NSAIDs)は予後に悪影響を及ぼすため、疾患の初期段階での使用を避けることを推奨している専門家もいる[41]。他のACE2活性化剤としてはキサンテノンがあり、高血圧ラットで研究されている[42]。
しかし、ACE阻害薬やARBの慢性的な使用はACE2受容体をアップレギュレートさせる可能性があり[40]、COVID-19の治療は感染ステージや患者の状況に応じて考慮する必要がある。動物観察によれば、ヒトではACE2受容体によるウイルスの病原性が肺障害の原因と考えられる[37]。
致死的な症例では、呼吸不全単独および劇症性心筋炎との併発が死亡原因の第一位であり、中国のある小規模な臨床評価では、それぞれ約53%、33%であったとの報告がある。また、7%が劇症性心筋炎のみで死亡していることも注目に値する[43]。
しかし、心筋炎による高度房室ブロックの発生率は、他の集団と比較してアジア系民族が突出している(8.1%対1%)[32]。他集団における劇症型心筋炎の死因としての有病率は不明である。幸いなことに、ECMO(体外膜酸素化)[32]やステロイドの前にIVIGを早期に使用することで、心筋炎による死亡を防ぐことができるとの報告もある[44]。
しかし、臨床的にはALT/ASTの異常上昇が多く、ビリルビン値の上昇はまれ(14.8%~53%程度)であり、重症例では血清アルブミンの上昇がみられることもある。しかし、肝障害とCOVID-19の因果関係は、ロピナビル単独または胆管細胞を損傷する可能性のあるリトナビルを併用していたため、不明な点が多かった[35, 45]。
ACE遺伝子多型が腎疾患などの関連疾患のリスク上昇に関与していることはいくつかの研究で報告されているが、糖尿病性腎症のような他の疾患との関係は不明である[46,47,48]。我々は、ヨーロッパの患者におけるCOVID-19感染におけるACE遺伝子多型の役割について文献を検討し、臨床症状に影響を与える可能性があることを明らかにした[49]。
このように、理論的には呼吸器障害がCOVID-19の最も重要な意味合いを持つと考えられ、死亡例では約86%の発症率を示している[43]。肺でのこれらの観察を支持するいくつかの理由がある。第一に、肺胞の表面積がかなり大きいため、肺胞は吸入されたウイルス粒子に対して脆弱な臓器である。
第二に、肺で最もACE2を発現している細胞(83%)はAECIIであり、これは有意なレベルのウイルスプロセス関連ゲノムを有するウイルス複製のためのリザーバーとして機能し得る[33]。したがって、専門家は、感染者への肺介入がカクテルレジメン治療において重要な役割を果たすことを推奨している[33]。表1は、COVID-19感染症におけるACE2の役割に関して有用な可能性を有するいくつかの薬剤を示す。
TMPRSS2阻害剤
TMPRSS2阻害活性を有する可能性のある薬剤として、日本では慢性膵炎に使用されているカモスタットメシル酸塩(セリンプロテアーゼ阻害剤)があり、SARS感染マウスの死傷者を予防している[25, 33]。また、日本ではカモスタットメシル酸塩と同様の薬剤であるナファモスタットメシル酸塩が宿主細胞、特に肺細胞へのCOVID-19の侵入を試験管内試験(in vitro)で阻害する効果を示しており、東京大学では2020年4月に臨床試験が予定されている[50, 51]。
TMPRSS2阻害に関しては、Cbz(カルボキシベンジル)-ホスホノ-Lys(OPh)2のように、TMPRSS2の活性を不可逆的に阻害する可能性があることが検討されている[52]。ロシアでインフルエンザに処方されている一部のセリンプロテアーゼ阻害剤(アプロチニン)の局所肺製剤であるが、COVID-19に対する有効性についてはまだエビデンスがない[53]。
エンドサイトーシス経路
前に簡単に説明したように、このステップは、ウイルス粒子のクラスリン依存性エンドサイトーシスによって開始される。ウイルス粒子は、現在、「初期エンドソーム 」内のカーゴである。PICALM(ホスファチジルイノシトール結合型クラスリン集合タンパク質)のようないくつかのタンパク質は、初期エンドソームの成熟、特にその湾曲およびクラスリン依存性エンドサイトーシス速度の調節に不可欠である[3, 55](図2)。
初期エンドソームからACE2などの膜受容体を排除することで「後期エンドソーム」が形成される。その後、ライソソソームは後期エンドソームに融合し、pH依存性分解を開始する[25, 56]。
FURINプロテアーゼは、リソソソームのシステインプロテアーゼ(カテプシンB&Lなど)の中で最も重要なものの一つであり、FURIN切断部位からSpikeをS1およびS2サブユニットに切断する役割を担っている[20, 57]。
この切断は、S2の融合ペプチドを明らかにし[59]、ウイルスとエンドソーム/リソソーム膜の取り込み、COVID-19ゲノムの宿主細胞質への放出、および感染に必要である[25, 58, 59](図2)。
他にも、エンドサイトーシスを介さずに、ウイルス粒子と細胞膜とのこの融合を介して直接感染が出現する可能性があるとする説もある[60]。しかし、これは第一のメカニズムではない。また、COVID-19のFURIN切断部位が他のCoVと比較して高い病原性とヒトへの感染率を引き起こす可能性があることもわかっている[23, 58]。
FURINプロテアーゼは肺細胞に豊富に存在するため、呼吸器系への感染性が高いと考えられている[61]。また、葉酸のFURINプロテアーゼ阻害作用のエビデンスもあり、これがCOVID-19の治療プロトコルに寄与している可能性がある[62](表2)。潜在的な治療法としてのエンドサイトーシス経路阻害剤を、以下の3つの有力なグループに分類することができる[25]。
表2 エンドサイトーシス経路の阻害に有効と想定される分子の定義
原文参照
クラスリン媒介エンドサイトーシス阻害剤
クロロキン(PICALMを減少させることにより)などのいくつかの薬剤のCOVID-19に対する有効性が研究で示されている[3]。ユミフェノビルは、ロピナビル/リトナビルとリバビリンを併用したヒトの研究において、クラスリンを介したエンドサイトーシスを阻害することにより、ウイルス細胞の侵入と融合を示した別の薬剤である[63, 64]。また、他の研究では、オアバインやブファリン(有酸素性ステロイド薬)、クロルプロマジンがMERS-CoVに対してこのような効果を示すことが示されており、COVID-19に対しても同様の効果を示す可能性があり、追加の研究が必要である[25]。クロロキン(クロロキン)は、クロルプロマジンよりもクラスリン媒介エンドサイトーシスの阻害に有効であることが研究で示されている[3]。ユミフェノビルとクロロキンは、中華人民共和国国家衛生委員会のCOVID-19治療ガイドラインに追加された[65]。
リソゾモトロピー薬
膜透過性を介して、弱塩基は酸性の小器官に漏出し、低pHでは親油性の関係でプロトン化する可能性がある。イオン化した後は、小器官に追いつく(イオントラッピング)[66]。後期エンドソーム/リソソソーム小胞に高濃度で集積する機能を持つ薬剤は、「リソモトロピズム」と呼ばれている[67]。
そのほとんどが、弱塩基として作用するアミン基を保持している[66]。そのため、エンドソーム/リソソーム小胞内に拡散してトラップされ、pHを変化させることでプロテアーゼ阻害を誘導し、転写のためのウイルスの放出を阻害する可能性がある[25, 68]。クロロキンやヒドロキシクロロキン( ヒドロキシクロロキン)[69]のような薬剤の中には、リソゾモトロピック剤として作用するものがあり、ウイルス受容体ACE2を液胞内にトラップし、ウイルスゲノムの転写を阻害し、ウイルスのライフサイクルを中断させる可能性がある。
非盲検非ランダム化臨床試験では、 ヒドロキシクロロキンはCOVID-19患者のウイルス負荷を有意に減少または消失させ、その効果はアジスロマイシンによって増強されることが明らかになった[70]。武漢大学人民病院のCOVID-19感染患者62人を対象とした別の臨床研究では、 ヒドロキシクロロキンは対照群(54.8%、31人中17人)と比較して肺炎を有意に改善できることが示された(80.6%、31人中25人)[71]。
また、塩化アンモニウム(NH4Cl)のような他の分子もライソ運動性物質として知られている[72](表2)。これらはゴルジ小胞などの酸性小器官にも侵入することができる。そのため、新しいウイルス粒子が宿主細胞外に放出される際に、ウイルスのライフサイクルを阻害する可能性がある[59](複製ステップ)。
COVID-19に対する ヒドロキシクロロキンおよびクロロキンの有効性は、試験管内試験(in vitro)および小規模でコントロールが不十分な、あるいはコントロールされていない臨床試験で実証されている[73]。また、試験管内試験(in vitro)では、 ヒドロキシクロロキンはクロロキンと比較してCOVID-19のより強力な阻害剤であることが研究で示されている[74]。
COVID-19の重症疾患におけるダパグリフロジンの有効性を示唆する報告もあるが、細胞質pHの低下を阻害し、その結果、ウイルス負荷を減少させることが示唆されている[75]。[75]. 正確なメカニズムに関する情報はないが、ウイルスのライフサイクルの現段階では考えられる。(NCT04350593)(NCT04393246)。
直接的なエンドソーム/リソソームプロテアーゼ阻害剤
抗生物質であるteicoplaninは後期エンドソームでカテプシンL阻害剤として作用し,Sタンパク質の切断と宿主細胞へのゲノム放出を阻害することでCOVID-19のライフサイクルを阻害する可能性がある[74, 76]。
Zhouらによると、テラバンシンとテイコプラニンはSARS-CoVとMERS-CoVでこのメカニズムを示している[77]。他にもいくつかの治験薬(E64d [25]やビタミン類(葉酸 [62]など)がFURIN様プロテアーゼに対して阻害活性を示している。別の研究では、E64dが間接的にCOVID-19 RNAレベルを低下させることを宣言した[78]。
ウイルスの複製
いくつかのオープンリーディングフレーム(ORF)[81]を持つウイルスゲノムは、リボソームフレームの変化によってポリタンパク質に翻訳される[58, 82]。最初に生成されたポリタンパク質は、パパイン様(PL)と3-キモトリプシン様(3CL)プロテイナーゼの形成につながる自己増殖過程を経る [58]。これらのウイルスプロテイナーゼは、16個の非構造性ウイルスタンパク質(NSP 1~16)の発現に重要な役割を果たしており、その結果、RNA複製-転写複合体においても重要な役割を果たしている[82]。
PLプロテイナーゼは、自然免疫応答を抑制し、NSP3活性化によるサイトカイン発現を誘導するという病態生理学的な役割を果たしている[58]。ウイルス誘発性DMVでは、複製-転写複合体の以下のステップが起こる[81]。3CLプロテイナーゼは、NSP4活性化によるDMV作成を促進する。一般に、NSP3、4、および6はDMV形成に寄与する[58]。
DMVはRNA複製の最初の場所である[83]。RNAウイルスは、NSP12に位置するRNA依存性RNAポリメラーゼ(RdRp)またはRNA-replicaseと呼ばれるウイルス酵素によって複製を行う(図3)(84, 85)。FURIN様酵素はゴルジ体の組み立て段階でS1サブユニットとS2サブユニットの間に結合を形成している[60, 86]。感染細胞による内部インターフェロン放出は、FURIN様酵素の阻害を示し、ウイルスの発現を阻止する[61]。
最後に、COVID-19ウイルスを含む小胞は、ゴルジ体系に集合した後、感染した宿主細胞外に排出される[87](図3)。エンベロープ(E)タンパク質と膜タンパク質(M)は宿主細胞の出芽コンパートメントで相互作用している。
Mタンパク質は細胞の免疫原性を支配する。ヌクレオタンパク質(ORF9a)は、ウイルスゲノムおよび膜タンパク質Mとの相互作用を介して、ウイルスのアセンブリ中に、正鎖ウイルスRNAゲノムをらせん状リボヌクレオカプシド(RNP)にパッケージ化する。
特に赤血球(RBC)上で議論されているメカニズムがある。エンベロープとORF8タンパク質が赤血球中のポルフィリンに付着する可能性がある[88]。それと同時に、他のいくつかのORF(ORF1ab, ORF3a, ORF10)がヘムから鉄を分離してポルフィリンを作ることができる。
そのため、ヘモグロビンの活性型が低下し、O2/CO2の移動に影響を与えることになる。結論から言うと、急性ポルフィリン症が発生することになる。また、COVID-19患者ではヘモグロビン値を低下させるエビデンスが存在しており[90]、COVID-19患者の治療の一環として遊離鉄キレート剤(デフェロキサミン、NCT04333550、NCT04361032、NCT04389801)を見ることができる。クロロキンはポルフィリン症の治療薬として承認されている[90]。
ウイルス複製に対する潜在的な治療法を以下のように主要なグループに分類することができる。
プロテイナーゼ阻害剤
以上、ウイルスプロテアーゼの重要な役割について説明した。COVID-19のライフサイクルにおける3CLプロテアーゼの重要性については、治療のターゲットはNSPsの産生を防ぐことであると仮定している[58]。COVID-19、HCV(C型肝炎ウイルス)、HIV(ヒト免疫不全ウイルス)のCLプロテアーゼは、構造的にも機能的にも同じであることを明らかにしていることに言及する価値がある。
臨床試験におけるダノプレビルとリトナビルの併用は、COVID-19に対して有効な治療法が示されている[90](表3)。しかし、COVID-19の治療において、利用可能なRNAウイルスプロテアーゼ阻害剤のみでは十分な効果が得られない可能性が示唆された多くのカクテル治療を目にすることから、これらについてはいくつかの論争がある(NCT04276688, NCT04254874, ChiCTR2000029308)。
ロピナビル/リトナビル単独では、COVID-19のほとんどすべての患者に効果がないという報告がある。抗プロテアーゼとしてのCOVID-19複製の阻害におけるネルフィナビルの有効性を示す試験管内試験(in vitro)研究がある[94]。
また、SARS-CoVでPLおよび3CLプロテアーゼ活性を示したジアリールヘプタノイド(天然物)およびシナセリン(セロトニン受容体拮抗薬)もCOVID-19の抗プロテアーゼとしての可能性を示唆している[95]。しかし、さらなる研究が必要である。
表3 COVID-19の複製破壊に有効と考えられる分子の定義
原文参照
直接RdRp阻害剤
これらの薬剤はRNA複製を中断することができるため、新しいウイルス粒子は他の宿主細胞に感染することができない。HCV RNAポリメラーゼ阻害薬としてベクラブビルとソフォスブビルが臨床試験中であり(表3)、治療薬として使用される可能性がある[96]。試験管内試験(in vitro)試験では、亜鉛および亜鉛ピリチオンがSARS-CoVのRdRp機能を阻害し、複製を阻害することが明らかになっている[95, 97]。表3に臨床試験の結果を示す。
ヌクレオシドアナログ
レムデシビル[93、98、99]、リバビリン[93]、クレブジンなど、RNA複製の早期終了を引き起こし、間接的にRdRp活性を阻害する可能性のある薬剤がある(表3)。しかし、COVID-19患者のARDS予防には、リバビリン単独と比較して、リバビリン+ロピナビル/リトナビルの併用がより効果的であることを示す知見もあった[93]。
レムデシビルがCOVID-19の治療に最適な薬剤である可能性が示唆されている[92]。試験管内試験(in vitro)試験では、ロピナビルはCOVID-19の複製を阻害するが、リトナビルは阻害しないことが示されている[100]。レムデシビルの有効性は、重症COVID-19患者の68%(53人中36人)を対象とした非対照コホート研究で報告されている[101]。
237名の患者を対象とした無作為化臨床試験(レムデシビル群158名,プラセボ群79名)では,臨床改善までの時間に群間差はなかった[102]。しかし、1059名の患者の紹介結果から、レムデシビル群(n=538)の回復期間中央値は、プラセボ群(n=521)の15日に対し、レムデシビル群(n=538)では11日であったことが示された[103]。
ウイルス性タンパク質阻害剤
ダクラタスビルはHCV非構造タンパク質阻害薬であり、NSP12ブロッカーとしてのビタミンB12(メチルコバラミン型)はウイルスのライフサイクルを阻害することでCOVID-19の治療を検討している可能性があり、ソフォスブビルとダクラタスビルの併用投与を受けた患者では入院期間が短縮された[84]。
COVID-19の赤血球に対する役割については、クロロキンがORF1ab、ORF3a、ORF10、ORF8、エンベロープタンパク質を阻害して赤血球に影響を与え、ARDSの症状を効果的に緩和することが研究で示されている[89]。ファビピラビルは、エンベロープとORF7aタンパク質がポルフィリンを付着するのをブロックし、宿主細胞への侵入を防ぎ、遊離ポルフィリンを捕らえることができた[89]。
また、mRNAの翻訳を阻害することでウイルスの負荷を軽減することも可能であった[104]。ORF-3aはSARS-CoV感染細胞内のイオン透過性チャネルのコードであり、ウイルスの放出に関係している可能性があると主張されている[105]。そのため、エモジンやカエンフェロール誘導体のジュグラニンは、イオンチャネルを阻害することで感染細胞からのウイルス放出を防ぐことができる可能性がある[106]。
また、イベルメクチンは、SARS-CoVのヌクレオカプシドタンパク質を阻害し、ウイルスゲノムの宿主細胞への放出を阻害する可能性がある[107]。また、イベルメクチンは、生体内の COVID-19 に対しても有効性を示している[108]。COVID-19の重症症例におけるARDSの軽減に関するエビデンスもある[108]。表3は、COVID-19に影響を及ぼす可能性のある薬剤をまとめたものである。
炎症性反応
COVID-19の病態生理におけるウイルスのライフサイクルの役割の他に、肺、肝、心臓、および腎不全を含む重篤な状態での併存率および死亡率の主な原因となる患者の炎症反応についての強い証拠がある[113]。サイトカインの一群であるインターフェロン(IFN)は、CoVのような病原体に対して免疫系に重要な影響を与えている[115]。
CoVsによる免疫系の抑制には様々なメカニズムがある[116]。第一に CoVsは、重篤な症状や死に関連している可能性のある内部I型IFN急速産生(IFNαやβなど)を阻害する可能性がある[115、116]。
第二に:JAK-STAT(Janus kinase/signal transducers and activators of transcription)成分としてのSTAT1は、CoVsによってブロックされ、これはI型IFNシグナリングの防止につながる[115、116]。免疫枯渇は、COVID-19の第三の防御機構であり、それによって形質細胞様樹状細胞(pDCs)によるIFN-1産生を誇張し、延長する[116]。
結論として、好中球、単球、「サイトカインストーム」、IFN-1誘導T細胞のアポトーシスを含む免疫細胞の亢進は、感染した臓器、特に肺において出現する[116]。さらに、活性化されたTヘルパー(Th)細胞から放出されるサイトカインは自己免疫疾患に寄与する[117]。Th1サイトカインには、IL-2、IFNγ、およびTNF-α(腫瘍壊死因子α)が含まれ、より細胞免疫に関与している[117]。他のグループ、IL-4、IL-5、IL-6、IL-10、IL-11、およびIL-13を含むTh2サイトカインは、B細胞媒介の体液性免疫に役割を持っている[117、118]。
ICUに入院した患者の血漿サンプルから得られたデータは、通常よりも高い様々なサイトカインレベルを示しており、これは「サイトカインストーム」の兆候である。これらのサイトカインには以下が含まれる。IFN-γ [113]、IL-1β、IL-2、IL-6、IL-7、IL-8、IL-9、IL-10、IL-17、G-脳脊髄液(顆粒球コロニー刺激因子)、GM-脳脊髄液(顆粒球-マクロファージ-脳脊髄液)。IP10(インターフェロン-γ誘導性タンパク質)、MCP1(単球化学吸引性タンパク質)、MIP1α(マクロファージ炎症性タンパク質1α)、MIP1β、およびTNF-α[114、119、120]。重症例または死亡例の別の一般的な症状は、リンパ球減少症である[121]。
いくつかの研究では、IL-6血漿レベルは患者の肺合併症を予測することができることが示唆されている[118]。他の特筆すべき特徴として、CD4(分化クラスター-4)とCD8 T細胞の数は減少しているが、免疫活性は高くなっている。
さらに、CD4のIL-17やCD8 T細胞の細胞傷害性顆粒を含む炎症性サイトカインの濃縮は、COVID-19患者のT細胞の病理学的炎症反応を示している。したがって、Th17細胞の増加とCD8細胞毒性が感染臓器の重篤な損傷に寄与することが実証されている[122]。Th17細胞は、IL-22、IL-6、TNF-α、そしてIL-17のみを放出するCD4陽性T細胞である[123]。彼らは、微生物に対する身体保護のための免疫系を強化するか、またはIL-10による免疫原性反応を調節するために、様々なタイプのTh細胞に容易に分化することができる。
しかし、研究では、Th17細胞が自己免疫疾患において重要な役割を果たしていることが示されている[123、124]。一般に、IL-6, IL-8, IL-17, TNF-αを減少させることで、炎症誘発性の損傷を防ぐことができると考えられている[125, 126]。
もう一つの注目に値するトピックは、CoVsの病原性における酸化ストレスの役割である。活性酸素種(ROS)は、ミトコンドリアの酸化的リン酸化の際に呼吸細胞内で生成される酸素分子(O2)に由来する一連の副産物である。さらに、活性酸素は、スモッキング、金属、薬物、異種生物学的物質、放射線、感染などの細胞外起源のものである可能性がある[127]。活性酸素はウイルス感染時に継続的に生成される。
それは、ウイルスを攻撃するために有効であると同時に、正常な細胞機能に有害である可能性がある。バランスが崩れると、余分な量の活性酸素が酸化的な状態になる可能性がある[128]。CoVsタンパク質は、ミトコンドリアの完全性、プロテアソーム機能に影響を与え、活性酸素の発生を引き起こす[129]。プロテアソームに影響を与えることで、ミトコンドリアの機能不全や宿主細胞とウイルスの両方のタンパク質の凝集を引き起こす可能性がある(細胞機能を阻害する)。
SARS-CoVおよびCOVID-19による患者の死亡率は、炎症性疾患と関連している。喫煙、糖尿病、癌、心血管疾患の患者はプロテアソーム活性が低下していることが多い。また、プロテアソーム活性はSARS-CoVタンパク質によって直接的に低下する可能性がある[129]。喫煙は肺上皮細胞のプロテアソーム阻害に関与している。
また、炎症性疾患や肥満は細胞ストレスを増加させる可能性がある。そのため、感染した細胞がタンパク質の凝集体を取り除くことができなくなる可能性がある。また、ウイルス性の活性酸素がSTAT/IL-6軸、サイトカイン形成、肺の免疫細胞の浸潤を誘発する可能性があるとの説もある[129]。
インフルエンザおよびコクサッキーウイルスのいくつかの動物モデルでは、酸化ストレスを受けた宿主細胞において、ウイルスゲノムの変化(正常または軽度の病原性変化から攻撃性変化への変化)が、あいまいな分子メカニズムで示されている[128]。
COVID-19における血栓塞栓症のメカニズム
COVID-19の病態生理のもう一つの所見は、気管支動脈における血栓塞栓症である[130]。これは炎症性機序によりプロコアグラントと抗凝固剤のバランスが崩れ、微小血栓症、播種性血管内凝固、臓器不全を引き起こすと定義されている。
この知見は、予後不良の重症COVID-19肺炎や死亡した患者ではd-ダイマーのレベルが高いことからも確認されている[131]。したがって、d-dimerの値が著しく高い入院患者では、静脈血栓塞栓症の予防や治療のために低分子ヘパリン(LMWH)の使用が推奨されている。また、LMWHの抗炎症作用はCOVID-19の管理において有益な役割を果たす可能性がある。
また、静脈血栓塞栓症の予防・治療に定評のある抗トロンビン剤や抗因子Xa直接経口抗凝固剤の投与も有用であると考えられる[131]。COVID-19はAECII上のACE2受容体と結合して肺サーファクタントの産生を抑制することが示唆された。COVID-19は重症化した場合のARDSの発現に関与している可能性がある。
したがって、肺サーファクタントまたはサーファクタント産生刺激剤の投与は、治療または予防のいずれかとして有用であろう[132]。抗炎症剤を使用すると、患者は二次感染を起こしやすくなる可能性がある[133]。
ほぼすべての抗炎症薬のモノグラフに基づき、自然免疫系の抑制剤でもあるため、併発感染についての注意が目立つ。COVID-19の治療プロトコルでの使用を考慮しなければならない。しかし、炎症反応に影響を与える可能性のある薬剤を以下のように分類することができる(表4)。
表4 炎症反応に影響を与えてCOVID-19の治療に効果があると想定される分子の定義
原文参照
ウイルスの防御ブロッカー
明確に定義されているように、COVID-19は宿主免疫系に対する3つの主要な防御機構を適用した。PD-1(プログラムされた細胞死-1)を持つCD8 T細胞の割合は、COVID-19 ICU患者では、非ICU患者や健康な人と比較して有意に増加していることが研究で示されている。
T細胞におけるPD-1の増加は、T細胞の枯渇を示唆している[134]。T細胞の枯渇は感染症のような疾患の延長後の免疫抑制を示唆しており[134, 135]、PD-1阻害薬(カムレリスズマブ、表4)[136]を使用することで克服できる可能性がある。
また、抗原虫薬の一つであるニタゾキサニド(nitazoxanide)は、試験管内試験(in vitro)では特にCOVID-19に対して潜在的な抗ウイルス活性を示している。有効性のメカニズムは内部IFNに対するCOVID-19の防御反応を遮断することであると考えられており[99],中等度のCOVID-19を有する入院患者を対象に研究が進められている(表4)。
直接的なインターロイキン拮抗薬
COVID-19患者におけるサイトカインストームのインターロイキン情報が重要な役割を果たしていることから、インターロイキンが免疫反応を緩和し、臓器障害を救う可能性があると考えている。
COVID-19では、トシリズマブとサリルズマブがIL-6ブロッカー、アナキンラがIL-1ブロッカー、デュピルマブがIL-4, IL-13アンタゴニストであり、現在臨床試験が行われている[137, 138]。この報告では、デュピルマブが高齢患者のサイトカインストームに有益である可能性が示されている[138]。
2020年6月11日のCDCの最新の更新では、トシリズマブの早期使用は死亡率を減少させ、酸素濃度を改善することが示されている。この報告では、アナキンラは呼吸困難を改善するが、合併症のため中止されたことが示されている。
プロ炎症抑制剤
クロロキン、 ヒドロキシクロロキン [59、69、139]、アジスロマイシン(試験管内試験(in vitro))[126]のようなマクロライド系抗生物質、およびメチルプレドニゾロン[140]のようなコルチコステロイドなど、サイトカインストームを防ぐのに寄与するであろうプロ炎症性サイトカインの産生を中断しうる薬剤がある。
イラン、テヘランのBaqiyatallah病院のCOVID-19成人患者60人を対象とした単一中心のレトロスペクティブな観察研究では、アジスロマイシン、ナプロキセンと併用した低用量プレドニゾロンの短期使用が有効であることが示された。
およびロピナビル/リトナビルは、メロペネム、レボフロキサシン、バンコマイシン、 ヒドロキシクロロキン、およびオセルタミビルと比較して、酸素飽和度、血清中CRP値、および平均入院期間の短縮に有益な効果がある[141]。しかし、QTc延長の懸念は、COVID-19治療のために ヒドロキシクロロキンとアジスロマイシンを投与されていた84人の患者を対象とした研究から来ている[142]。
コルチコステロイド
前述のようにサイトカインストームは、特に肺のようなACE2受容体を豊富に持つ臓器に深刻な組織障害を引き起こする。この損傷は、死の主な原因であるARDSを引き起こする。コルチコステロイドは、IL-1やIL-6のような炎症性サイトカインを減少させることで、この損傷を軽減することができる。
彼らはまた、抗炎症メディエーターであるIL-10の産生を増加させる。メチルプレドニゾロンの使用は、特にARDSの重症例において死亡率を減少させることができると主張されている[143]。
COVID-19の治療にデキサメタゾンのようなコルチコステロイドを使用することにはいくつかの論争があったが[144]、2020年6月25日の国立衛生研究所は、機械的換気または補助酸素を必要とする患者にのみデキサメタゾンを投与することを推奨している[145]。
その他のプロ炎症抑制剤
ARDS患者を対象に研究された組換えヒトACE2は、IL-6などの炎症性タンパク質の血漿中レベルの低下を示しており、同様に分類することができる[33]。また、S1P(スフィンゴシン1リン酸塩)アゴニスト分子1つでサイトカインストームを理論的に治療することが可能であると考えられている[146]。
フィンゴリモドは、S1Pとして、IL-6を阻害し、IFN応答を歪め、肺線維化を減少させる[147]。また、S1Pアナログ(FTY720)や全トランスレチノイン酸などの治験薬は、IL-17を阻害し、Th2分化を抑制する可能性がある[148]。
エタネルセプトは乾癬患者においてTNFブロッカーおよびIL-17/IL-22モジュレーターとしての作用が認められていることから[124]、サイトカインストームの抑制に役立つ可能性がある。また、コルヒチン、サリドマイド、エマパルマブ、アタザナビル、IVIGなどの一部の薬剤は、COVID-19の以前のプロ炎症抑制機序で臨床試験が行われている(表4)。
JAK-STATシグナル伝達阻害薬
JAK-STATシグナル伝達の障害は、様々な免疫関連疾患および癌につながる[149]。COVID-19患者は通常、血漿中に高レベルのサイトカインを示すので、JAK-STATシグナル伝達阻害剤が治療に有用であるかもしれない。
バリシチニブ、フェドラチニブ、およびルキソリチニブは、JAK阻害薬であり、支配的な抗炎症薬である[113]。バリシチニブは抗ウイルス治療の他にCOVID-19の臨床試験が行われており、ICU入室者数の減少を評価するために実施されている(表4)。トファシチニブはJAK阻害薬として、試験管内試験(in vitro)でインターフェロン-α産生を阻害することが示されている[133]。
インターフェロン
IFNの抗ウイルス活性および抗炎症活性のため、いくつかの研究が行われている。ある臨床研究では、吸入可能なIFNαとロピナビル/リトナビルの併用がCOVID-19の抗ウイルス療法として推奨されている(NCT04251871)[93]。他にもIFNα2bをロピナビル/リトナビルやリバビリンと併用して評価した研究もあるが(NCT04254874、2/5/20、ChiCTR2000029308、1/23/20)、これらに関する結果は発表されていない。
また、IFNα1bの治療効果は武漢の別の試験で評価されている(NCT04293887)。医療従事者のCOVID-19感染に対する経鼻IFNα(NCT04320238)とペグインターフェロンランバダ-1a(NCT04344600)の予防効果も実施されている。重症COVID-19患者20人を対象としたプロスペクティブな単群臨床試験の結果から、 ヒドロキシクロロキンおよびロピナビル/リトナビルと併用した皮下IFNβ1aの使用がCOVID-19の管理に有益であることが明らかになった[150]。
さらに、香港の病院で127人の患者を対象とした多施設共同、前向き、非盲検、無作為化、第2相試験では、IFNβ1a、ロピナビル/リトナビル、およびリバビリンによる抗ウイルス療法は、軽度から中等度のCOVID-19患者のウイルス脱落を短縮し、症状を緩和し、退院を促進する点で、ロピナビル/リトナビル単独よりも安全で優れていることが示唆された(NCT04276688)[151]。
症状発症から7日以内に投与された場合、ロピナビル-リトナビル単独と比較して、鼻咽頭スワブだけでなく、すべての臨床検体において、SARS-CoV-2の脱落を抑制するのに有効であった。研究者らは、控えめな抗ウイルス薬を3種類組み合わせて使用することで、高い初期ウイルス負荷を迅速に抑制し、臨床パラメーターを改善し、これらの治療を受けた患者からのウイルス排出の期間と量を減らすことで、医療従事者のリスクを低減できるのではないかと仮説を立てた[151]。
また、10人の患者のうち8人はリアルタイムRT-PCR陽性の直腸スワブを有しており、糞便ウイルス排泄の可能性を示唆しており、消化管からウイルスが排出され、糞便-口腔感染の可能性があることを示唆している[152]。すべての患者は、入院時から開始されたα-インターフェロン経口スプレーによる抗ウイルス療法を受けていた(8000 U、2回スプレー、1日3回)。ウイルスRNAの測定から、消化器系からのウイルス脱落は呼吸器系からの脱落よりも大きく、長く続く可能性があることが示唆されている[152]。
また、IFNβ1は肺細胞の保護やCoVの治療にも重要な効果があると推測されている。IFNβ1は内皮細胞にCD73を誘導して抗炎症剤の放出を促し、内皮細胞のバリア能力を維持している。したがって、IFNβ1aで治療されたARDS患者の血管漏出の減少は、定義されたメカニズムを説明することができるかもしれない。
しかし、ARDS患者における死亡率の低下は、臨床的にはまだ十分なエビデンスが得られていない。一般に,IFNβはIFNαと比較してCoVsの抑制効果が高いとされている[153]。IFNβ1aとIFNβ1bの比較は臨床試験(NCT04343768)で進行中である。
酸化ストレス阻害剤
ほとんどすべての栄養は酸化ストレスを防ぐために不可欠な役割を持っているので、COVID-19の治療に効果的であると思われる。ビタミンEは抗酸化物質であり、セレンは酵素群を助け、活性酸素の発生や細胞の損傷を防ぐことに貢献する可能性がある[95]。
また、セレン欠乏は宿主細胞を酸化ストレスに導く[128]。さらに、人工呼吸器誘発性肺障害患者で観察されるビタミンB3治療による肺細胞への好中球浸潤の抑制は、既知の抗炎症作用に加えて、その抗酸化作用に関連していると考えられている[95]。
また、ウイルス感染者はビタミンD(膜抗酸化物質)不足である可能性があることが研究で示されている[95]。鉄分不足は免疫系を抑制する可能性があるが、過剰になると酸化ストレスを誘発する可能性があった[95]。いくつかの研究では、抗炎症作用、抗酸化作用、免疫系調節作用を持つメラトニンの使用がCOVID-19患者に有用であることが示唆されている[154]。
特定の状況下で下気道感染症の発生率を低下させる可能性が以前に報告されていたので[95]、ビタミンCの適度な量がCOVID-19を予防しているように思われる[155]。栄養剤の中でも、ウイルス治療のための強力な抗酸化剤としてのビタミンCの静脈内投与効果は、COVID-19患者を対象とした臨床試験で評価されている(表4)。
界面活性剤の置換
議論されているように、いくつかの可能性のある薬剤がARDSを予防する可能性がある。アンブロキソールやブロムヘキシンは、AECIIに影響を与えて肺サーファクタントの産生を誘導する可能性がある。
また、ブロムヘキシンはTMPRSS2を阻害し、ウイルスの侵入を抑制するとされている[132]。また、COVID-19に起因するARDSの治療には、肺界面活性剤の使用が有効である可能性があり、現在進行中の臨床試験もある(表4)。
考察
COVID-19に関する研究はいくつかの種類がある。パンデミックを克服するには、ウイルスの病態生理をマスターしなければならないと思われる。そこで、膨大な情報を「ウイルスのライフサイクル」と「炎症性反応」の2つに分類し、解釈の参考にすることを試みました。
これらの情報によれば、新規薬剤の発見に加えて、現在の薬剤を用いて有効な薬剤をより早く発見することができると考えられる。今回のレビューの結論として、感染症のステージや患者の状況に応じて、治療プロトコルを適宜設定することを提案した。倫理的な問題もあるが,臨床現場での適応外薬の処方がCOVID-19治療の機会を提供する可能性があることは言及しておくべきであろう[158]。
結論
現在のところ、COVID-19に有効な薬剤はないため、COVID-19の罹患臓器や重症度に応じて、抗ウイルス剤と免疫調節剤を中心とした薬剤のカクテルが、COVID-19のほぼすべての病期に効果を発揮することが、患者にとって重要であると考えられる。

