Contents
サーカディアンリズム
はじめに
すべての生物は24時間リズムをもっている
現在、知られる限り地球上で24時間の概日リズムのメカニズムをもたない生物は存在しない。
60兆個の時計遺伝子
時計遺伝子とは概日リズムの発生に必要な遺伝子の一群をさし、概日リズムの下流での生成経路の活性因子として重要な役割を果たしている。
動物にでは大脳視床下部に位置する視交叉上核(SCN)が中心となって概日リズムの同期を制御することが知られている。(中枢時計)
さらに最近の研究で、ヒトでは生殖細胞をのぞく60兆個すべての細胞が概日リズムの仕組み(末梢時計)を備えているがわかってきた。
アミロイドβの概日リズム
ヒトの概日リズムを示す代表的なものには、睡眠、覚醒、コルチゾール(グルココルチコイド)、成長ホルモン、メラトニン、体温、血圧、免疫応答、さらにはアミロイドβ!まで非常に多く概日リズム因子が存在する。
健常者の通常の生活においてはこれらの周期(位相)に個人差はほとんどないが、概日リズム障害、うつ病、神経変性疾患、アルツハイマー病などの精神・神経障害において周期がずれていたり、変動幅が喪失していることが多くの研究によって報告されている。[R]
25時間の体内時計
体内に固有に備わる体内時計は実際には約25時間と24時間よりも少し長く、外因的な環境(特に光)が途絶えると環境の時間周期とずれていくことがわかっている。
そのため環境の外因的刺激(同調因子)によって、内因的リズムを微調整することで体内の概日リズムと環境が同調するようになる。
同調にもっとも重要な役割を果たす因子は光だが、それ以外に食事、運動、温度、湿度、騒音、振動、社会的事象(仕事、家庭、定時の作業、認知活動など)などによっても調節される。
健常者の概日周期
概日リズムを示す体内の因子は相互に影響を与えうるが、それぞれのピーク時間は異なる。
ヒトは昼行性であり、夜行性であるマウスやラットなどとはピークが真逆になる(12時間のズレ)ことがあるが、すべての位相が反対になるわけではない。
- 0時 グレリンの上昇
- 1時 コリン作動性の最下点(ラット)
- 2時 BMAL1のピーク、コリン作動性活性の最下点(ラット)、最も深い睡眠
- 2時30分 グレリンのピーク→成長ホルモン
- 3時 TRHの急上昇→TSH→T4,T3、メラトニン濃度のピーク
- 4時 体温の最下点
- 6時 コルチゾールのピーク、VIPの上昇、卵胞刺激ホルモン(FSH)、黄体形成ホルモン(LH)
- 6時45分 血圧の上昇の開始
- 7時 CRH、ACTHの上昇
- 9時 テストステロンのピーク
- 9時-12時 レプチンピーク
- 10時 コリン作動性活性のピーク(ラット)、最高の注意力、健常者の脳脊髄液アミロイドβ40,42のの最下点、Rev-erbα(Nr1d1)(ラット)
- 12時 エストロゲンのピーク、Nrf2の上昇の開始
- SCN ZT6 Per1,Per2,Dec1,Dec2ピーク(ラット)
- 14時 胆汁酸合成、TG合成
- 14時30分 最大の協調、マルチタスク能力
- 15時30分 有酸素運動能と筋力のピーク
- 17時-18時 男性BDNFのピーク(女性BDNFはより可変的) ラットでは脳内のBDNFは逆相を示す
- 18時 Nrf2のピーク、VIP最下点
- 18時30分 ANF、ADHの変化 血圧ピーク
- 19時 深部体温のピーク
- 21時 メラトニン分泌の開始
- 22時 健常者の脳脊髄液アミロイドβ40,42のピーク、オレキシン濃度のピーク
- 23時 プロゲステロンのピーク

en.getmoona.com/blogs/mission-sleep/how-your-circadian-rhythm-influences-your-sleep
概日リズムと関わる睡眠メカニズム
アルツハイマー病の不規則な睡眠
コルチゾールレベルの日内変動検査において早期アルツハイマー病患者の活動リズムは、健康な同年齢の被験者と同様の活動リズムをもっている。しかし中等度認知症被験者では、活動リズムの安定性が低下しており、睡眠の断片化と睡眠周期の喪失を示した。
しかし概日リズムの乱れの程度は、認知症の重症度とは相関していなかった。[R]
早期アルツハイマー病患者の睡眠障害
軽度から中等度アルツハイマー病患者の睡眠障害の有病率は24.5%[R]
アルツハイマー病患者の不規則な睡眠・覚醒リズム
高齢のアルツハイマー病患者の睡眠量は変化していないが、睡眠は分散しており、通常の睡眠覚醒が乱され睡眠効率が低下している。
これらは遺伝子、薬、うつ病、および環境要因などの多くの変数が影響となっている。[R][R]
夕暮れ症候群(日没症候群)
![]() 夕暮れ症候群(日没症候群) 25の原因と7つのアプローチ症候群
夕暮れ症候群(日没症候群) 25の原因と7つのアプローチ症候群
徐波睡眠(SWS)
ぐっすり睡眠
ノンレム睡眠で出現する脳波の低い周波数(2~4Hz)が中心となる睡眠を徐波睡眠と呼び、ヒトにおいてはステージ3とステージ4がそれに該当し、総睡眠時間の20%を占める。
このステージはヒトでは深い睡眠に該当し,健常者ではぐっすり眠れた感覚と関連すると考えられている。
アミロイドβはこの徐波睡眠を減少させることが示されており、認知症の発症前から徐波睡眠の減少は起こっていることも実証されている。
デフォルトモード・ネットワーク(DMN)
睡眠中に減少するDMN
前頭皮質のDMNは睡眠中に減少することがMRI研究で示されている。[R]
睡眠中のDMN増加はアミロイドβを放出する
![]() デフォルト・モード・ネットワーク(DMN)とアルツハイマー病 DMNを変調させる20の方法
デフォルト・モード・ネットワーク(DMN)とアルツハイマー病 DMNを変調させる20の方法
深部体温
深部体温の順応能力の低下
健常者と高い頻度で夜間活動を行うアルツハイマー病患者の深部体温の概日リズム変動に差はなかったが、アルツハイマー病患者では深部体温を順応させるタイミングが遅れていた。
このことはアルツハイマー病患者が体温を概日リズム周期と同期させる能力が低下している可能性があることを示唆している。[R]
概日リズムに影響を与える因子
アミロイドβ
睡眠・覚醒リズムによって調節されるアミロイドβ
アミロイドβ濃度はオレキシンと睡眠・覚醒サイクルによって調節されており、睡眠中に間質液のアミロイドβ量は睡眠遮断によって有意に増加する。[R]
加齢によって低下するアミロイドβの日内変動
アミロイドβレベルの日内変動は、アミロイド沈着の存在する高齢者ではアミロイド沈着のない健常者と比較して増加が観察されなかった。
アミロイドβの日内変動パターンの減少はアミロイドβ動態の正常な生理機能を崩壊させ、アルツハイマー病の発症に寄与し得る。[R]
オレキシン
アルツハイマー病患者の低いオレキシン濃度
www.ncbi.nlm.nih.gov/pubmed/21546124/
85%のオレキシン受容体を喪失したナルコレプシー患者では、アルツハイマー病と同様の神経病理学を有する。[R]
アルツハイマー病リスク遺伝子と関与するオレキシン
オレキシンシグナル伝達は、海馬の概日リズム周期およびアルツハイマー病リスク遺伝子であるBACE2、ApoEなどの概日周期を調節する。

www.ncbi.nlm.nih.gov/pubmed/27796320
BMAL1,CRY1,PER1周期性の喪失
前臨床および臨床アルツハイマー病患者の松果体では、BMAL1、CRY1、 PER1の周期的な発現が失われている。[R]
コルチゾール
健常者のコルチゾールは早朝に上昇し夜間に最低値を記録する。
この変動は、アルツハイマー病、または認知症が疑われる個人において観察される。[R][R][R]
メラトニン
アルツハイマー病に加えてパーキンソン病、ハンチントン病においてはこのコルチゾールの変動性が平坦化している。
夜間のメラトニン分泌の減少は、認知症症状の兆候を示す個人において観察されており、日中の眠気の強さと関連している。[R][R][R]
概日リズムに影響を与える遺伝子
BMAL1
Bmal1は代謝を調節する遺伝子であり、時計遺伝子を含むゲノムの150を超える部位を標的とする。[R]
概日リズム、高血圧、糖尿病、肥満に対する感受性に関与する遺伝子としても同定されている。
BMAL1を分解するアミロイドβ
アミロイドβはBMAL1、CBP1の両者を分解に関わり、下流のPER2の発現を乱すことを示唆している。これはアルツハイマー病において観察される概日リズム障害の重要な原因因子がアミロイドβであることを示唆する。
アルツハイマー病初期のBAML1変化
異常なDNAメチル化がアルツハイマー病の概日リズム変化と関連している。
このエピジェネティクパターン変化はアルツハイマー病初期の病理に起こっており、おそらく異常なBMAL1発現と概日リズム障害をもたらす。[R]
BMAL1の低下による神経変性
BMAL1発現の低下は睡眠・覚醒リズムが維持されているにも関わらずマウスの神経病理を引き起こした。
抗酸化反応の重要なメディエーターであるNQO1とALDH2の両方はBMAL1によって直接的に調節されており、BMAL1の低下が脳の酸化還元防御遺伝子の発現を損なうことで酸化ストレスを悪化させ、神経変性を促進する可能性がある。[R]
血液脳関門の完全性を破壊
体内時計は血液脳関門の維持に重要[R]
REV-ERBα(Nr1d1)
核内受容体REV-ERBα(Nr1d1)は肝臓代謝において強力な調節機能を示しメタボリックシンドロームと関連していると考えられている。
REV-ERBαは、Bmall1プロモーターに直接結合し、特定の時間帯にREV-ERBα発現レベルが上昇することでBMAL1発現の抑制に重要な役割を果たす。
またBMAL1 / CLOCKも核内受容体REV-ERBα(NR1D1)の発現を誘導する。
Rev-erbα、脂肪酸結合タンパク質7(Fabp7)は概日リズム周期を示し、活性することで海馬神経発生を調節する。[R]
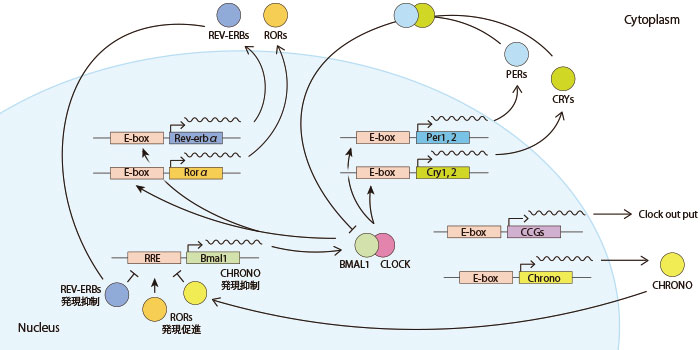
ruo.mbl.co.jp/bio/product/circadian/pickup/bmal1-clock-chrono.html
リチウム
GSK3β阻害剤であるリチウムがRev-erbalphaをリン酸化し安定化させる。[R]
IGF-1によるBmal-1活性
EGF、NGFではなくIGF-1のみがBmal1プロモーターの活性を増強する。
GSK3β阻害剤であるリチウムはBmal1プロモーターに対するIGF-1の効果を低下させた。[R]
GSK-3β

jcs.biologists.org/content/123/22/3837
L-カルニチン
PER1のタンパク質レベルの増加およびBmal1、Per1、Cry1およびDec1のmRNAレベルの増加は、L-カルニチン含有飼料によって明らかに下方制御される。[R]
Bmall1遺伝子
rs6832769
www.ncbi.nlm.nih.gov/pubmed/26782499
Clock
rs6832769
Per1(時計遺伝子Period1)
PER1はSCNで発現するCLOCK遺伝子ファミリーメンバー、哺乳類の末梢組織全体に発現しており、哺乳動物の脳の主要な概日リズムのペースメーカーでもある。
PER1は光の合図を借りなくとも概日発現を示すが、光によっても周期的に転写される。
SCNのリセット
網膜に入り神経節細胞で受容された光シグナルは、電気的シグナルに変換され網膜視床下部路を経由して視交叉上核(SCN)へ到達する。
SCNの神経終末からグルタミン酸が放出されSCNのNMDA受容体が活性化される。
NMDA受容体の活性化は、細胞内Ca2+濃度を上昇させカルモジュリンキナーゼのリン酸化を介してCREB(c-AMP応答配列結合タンパク)が活性化する。
CREBの活性化によりPer1遺伝子の転写が促進される。
このメカニズムによってSCNはリセットされる。[R]
Per1遺伝子とパーキンソン病
www.ncbi.nlm.nih.gov/pubmed/26507264/
Per2(時計遺伝子Period2)
ヒトPER2は睡眠障害と癌形成に関与する。
マウスPER2は強い光によって安定する。PER2の安定化は酸素利用の効率化による解糖能力を増強によって虚血からの心臓保護の役割を果たし心臓発作の危険性を減らす可能性があると推測されている。[R]
PER2の発現
www.ncbi.nlm.nih.gov/pubmed/22634208/
PER1とPER2の強固な協調作用と柔軟性の低さ
短周期のPER1タンパク質と長周期のPER2タンパク質は協調して、概日周期を約24時間に限定しているが、この機構は強固な反面、柔軟性が低い。
柔軟性の低い概日リズムが人工照明の多い現代社会では仇となり、せん妄を始めとする概日リズム障害の素因となっていることを示唆するものである。[R]
パーキンソン病とPER2
ドーパミンD2受容体の活性化はPER2の発現リズムを調節する。パーキンソン病による線条体ドーパミンの枯渇が概日リズムの異常に影響を与える可能性がある。[R][R]
CRY1
CRYはCLOCK-BMAL1による転写を抑制する、その結果Per遺伝子とCry遺伝子の発現を抑制する。[R][R]
アルツハイマー病患者のCRY1はおそらくSCNの機能的破壊による中断によって増加する。[R]
CRY2
DEC1
www.ncbi.nlm.nih.gov/pubmed/28730830
DBP
Chrono
GNAT2
VIP
血管作動性腸管ペプチドは、哺乳類神経細胞の概日リズムの同調性を媒介する。[R]
腸の時計遺伝子
腸管では時計遺伝子が発現しており、腸管上皮の増殖、腸管透過性など遺伝子発現の約30%が概日リズムを示すことが報告されている。
腸細胞の時計遺伝子はおそらく視交叉上核から分泌されるホルモン、ニューロンシグナルによって引き起こされる。
食物同調振動子
腸や肝臓などの末梢組織は、光→視交叉上核の経路によって引き起こされるメカニズムとはまたある程度独立に、食事などの摂取によって時計遺伝子の発現レベルが変化する。
肝臓の同調振動子は80%が食事依存性である。[R]
腸の活動の多くは時計遺伝子によって調節されており、これらの活動が混乱をきたすと胃腸の不快感を引き起こす可能性がある。[R]

www.ncbi.nlm.nih.gov/pmc/articles/PMC4381220/
腸管のタンパク質吸収
PEPT1
腸管内で加水分解されたタンパク質は、トリペプチドまたはジペプチドとなって腸細胞の表面(頂端膜)にあるペプチドトランスポーター1(PEPT1)を介して取り込まれる。
PPAR-αはPEPT1の発現レベルを低下させるが、概日リズムの調節には関与していない。
胆汁酸分泌は時計遺伝子の制御下にあり、胆汁酸の変動がPEPT-1の変動に関連している可能性がある。
アミノ酸とグルコースの組み合わせによるリセット
アミノ酸とグルコースを組み合わせることによって、ラット肝臓の時計遺伝子は概日リズムのリセットを引き起こすことができたが、片方だけではできなかった。[R]
タンパク質・システイン
www.seikatsusyukanbyo.com/calendar/2018/009548.php
www.ebiomedicine.com/article/S2352-3964(18)30015-X/fulltext
L-セリンの概日リズム調整作用
L-セリン投与は、この作用はGABA-A受容体を介してマウスの光誘発性の概日リズム位相シフトを増強した。
L-セリン単独(その他のアミノ酸も含む)ではこの増強作用を示されず、光暴露と組み合わせることによってその効果が示された。
またL-セリンは視交叉上核(SCN)の時計遺伝子(Per2、Bmal1)発現の長期的な変化を誘導する。
被験者へのL-セリン投与量3g[R]
九州大学(日本語)[R]
腸管の炭水化物吸収
SGLT1
グルコース、ガラクトースはナトリウム依存性グルコーストランスポーター1(SGLT1)によって腸細胞に取り込まれる。
末梢体内時計の位相にはSGLTが関与する。[R]
高血糖による肝臓時計の同調
血糖値を急速にあげる炭水化物(αスターチ)は、そうではないβスターチよりもマウスの肝臓概日時計の位相の遅れを誘発した。[R]
インスリン
絶食後のマウスへのインスリン注入は、PER2遺伝子およびREV-ERBα遺伝子発現の急激な増加をもたらし位相シフトを引き起こした。[R]
腸管の脂質吸収
血漿中のトリグリセリドは日内変動を示す。[R]
胆汁合成は概日リズムを示す。[R]
血漿中の脂肪酸の概日変動は食事や睡眠とは関係なく、内因性の概日リズム時計によって駆動されることが示唆される。[R][R]
コレステロールによるRORα活性
レチノイン酸受容体関連オーファン受容体(RORα)は概日リズムおよび、脂質代謝に関与するいくつかの遺伝子の発現を調節する。
RORαはコレステロールおよびその誘導体を含むステロール、いくつかのレチノイドによって活性化される。(候補としてメラトニン、ピオグリタゾン)[R]
オメガ3脂肪酸のリセット作用
DHA・EPAはGPR120アゴニストとして作用することでGLP-1を上昇→インスリン分泌上昇により体内時計のリセットを引き起こす。[R]
腸内脂質吸収の概日リズム
腸管細胞への脂質の吸収ステップ
胆汁による乳化 → リパーゼによる加水分解 → 輸送体による取り込み
↓
吸収後 脂肪酸結合タンパク質によって細胞内に輸送 → 小胞体にてトリアシルグリセロール、リン脂質、コレステロールエステルの合成に使用 → これらの脂質はカイロミクロンと呼ばれるリポタンパク質にパッケージされる。
いくつかの研究では、カイロミクロンを介した腸内脂質吸収が24時間にわたって有意に概日リズム変化することを示している。
カイロミクロン
カイロミクロンは、リン脂質とコレステロールも含む、非常に大きな球形のトリアシルグリセロールの豊富な粒子。
これらの粒子の表面は、リン脂質単層、遊離コレステロール、いくつかのアポリポタンパク質で覆われている。
カイロミクロンを作るには、アポリポタンパク質B(apoB)とミクロソームトリグリセリド転移タンパク質(MTP)の2種類のタンパク質が必要。
高脂肪食・PPARγ
高脂肪食は、正常な概日周期を乱すが、それに加えてPPARγなどの遺伝子発現の振動を誘発することにより概日リズム(トランスクリプトーム)の再プログラミングを引き起こす。[R]
PPARα
ベザフィブラートによるPPARαの活性化は、ラットの概日リズムによる摂食を促進する。[R]
PPARαに作用するベザフィブラートの投与はマウスの概日時計の位相を3時間早めた。PPARαはSCNとは無関係に概日時計の制御に関与しており概日リズム障害を治療するための潜在的な薬物治療標的であることを示唆する。[R]
PPARδ
核内受容体PPARδは暗期の摂食周期において脂質生成遺伝子の概日リズム発現を制御する。PPARδ発現は夜にピークに達する。[R]

