Contents
CHOLINESTERASES AND THE FINE LINE BETWEEN POISON AND REMEDY
www.ncbi.nlm.nih.gov/pmc/articles/PMC5959757/
要旨
アセチルコリンエステラーゼ(AChE、EC 3.1.1.1.7)とブチリルコリンエステラーゼ(BChE、EC 3.1.1.1.8)は、動物界全体で見られる関連酵素である。神経伝達におけるアセチルコリンエステラーゼの重要な役割は、ほぼ100年前から知られているが、ブチリルコリンエステラーゼの生理的役割は、最近になって現れていた。コリンエステラーゼは、治療と毒性の両方を意図的にターゲットにしており、コリンエステラーゼ阻害剤は様々な障害のために臨床で使用されており、逆に殺虫剤や化学兵器としての毒性の可能性があることが知られている。コリンエステラーゼ(ChEs)の非触媒機能は、神経発達と疾患の両方に関与している。これらの酵素の触媒活性や構造を操作することで、多くの生理学的プロセスにおいて、有益な効果と有害な効果のバランスを変えることができる可能性がある。
II. はじめに
16 世紀のスイスの医師であり哲学者でもあるパラケルススの言葉には、「用量は毒と治療薬を分ける」というものがある。基礎薬理学と毒性学の学生は、「治療指標」と呼ばれる、有効性と毒性の定量的な関係を早くから学び、パラケルススの勅語の直系の概念を学ぶ。薬理学と毒性学における用量反応関係の重要性を強調するのは難しい。アセチルコリンエステラーゼ(AChE、EC 3.1.1.1.7)およびブチリルコリンエステラーゼ(BChE、EC 3.1.18)は、動物界の多くの場所で発現している関連酵素である。AChE はコリン作動性シグナル伝達の制御において明確な役割を果たしているが、BChE の生理的影響は最近まで不明のままであった。ここでは、AChEの生物学について簡単に概観し、薬剤や毒物によるエステラーゼ活性の変化、あるいはタンパク質自体の変化が、どのように利益と害のバランスを変化させるのかを検討する。
III. 2つのコリンエステラーゼ
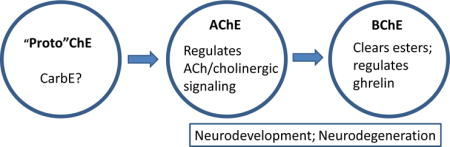
アセチルコリンエステラーゼ(AChE)とその「姉妹」酵素であるブチリルコリンエステラーゼ(BChE)は、動物界全体に広く発現している [1]。AChEとBChEは、約50%の配列相同性を共有しており、比較的類似した3次構造と4次構造を持っている。AChEとBChEは共に3次構造の「峡谷」の奥深くに位置する3つのアミノ酸(セリン、グルタミン酸、ヒスチジン)の触媒三位一体を持っている[2-4]。証拠は、これらの酵素がカルボキシルエステラーゼのスーパーファミリーから出現したことを示唆しており、「真の」AChEは最初に数億年前にPlatyhelminthes [5]に出現した。高等脊椎動物は1つのACHE遺伝子と1つのBCHE遺伝子を持っているが、いくつかの低級種は1つまたは両方の複数の遺伝子を発現している[1]。ウナギやハタを含む顎のない魚類であるサイクロストームは、AChEのみを発現しており、BChEは進化の後に遺伝子の重複とAChEからの分岐によって誕生したことが示唆されている[1, 2, 6]。
IV. アセチルコリンエステラーゼとコリン作動性シグナル
神経細胞と被支配細胞の間のシナプスと、それらの相互作用を媒介する受容体の概念は、Bernard、Ehrlich、Sherrington、Langleyなどによって開発された([7-9]を参照)。筋細胞への神経インパルスの伝達が電気信号によって行われるのか、化学信号によって行われるのかは、後に1936年にノーベル賞を受賞したOtto LoewiとHenry Daleの研究まで長い間議論されていた[10]。これらの初期の研究者や他の研究者による様々な生理学的プロセスの理解は、天然の毒素を使用することによって助けられた。実際、Loewi [11] は、薬理学の第一の目的を「化学物質に対する生物の反応によって生理機能を明らかにすること」と考えていた。この狭い説明は現代薬理学の多面的な側面を網羅するものではないが、異生物学の実験的使用は神経伝達とコリン作動性シグナル伝達の理解を得る上で重要な役割を果たしてきた。
100年以上前、Dale [12] は、キノコの毒素であるムスカリンと選択されたコリンエステルの効果を比較し、「ムスカリン様」と「ニコチン様」の作用を最初に記述した。隔離された器官系と無傷の動物におけるコリンエステルの相対的な効力は、その効果の「蒸発」はエステル分解酵素による急速な加水分解によるものである可能性があると彼に示唆させた。Loewiの古典的研究[13]では、生理学的溶液中の神経-心臓製剤中の迷走神経を刺激すると、迷走神経接続のない第二の心臓に流体媒体を移したときに神経刺激の効果を模倣した迷走神経物質(vagusstoff)と呼ばれる物質の放出が誘発された。重要なことに、Loewiはまた、迷走神経物質の効果が(アセチルコリンの効果と同様に)ChEsの阻害剤として知られているエセリンによって増強されることを示した[14,15]。その後まもなく、Dale and Dudley [16] は、組織(馬の脾臓)からアセチルコリンの単離を報告し、その内因性の存在を確認した。これらの研究やその他の研究は、シナプスシグナル伝達におけるアセチルコリンの役割とAChEによるその調節に関する膨大な量の研究の基礎を築いた。
現在では、AChEが脳、骨格筋、自律神経系を含む脊椎動物のコリン作動性経路において、神経伝達を制御する最重要または唯一の酵素であることが広く合意されている。AChEは、アセチルコリンがシナプス前コリン作動性ニューロンから放出された後、数秒から数ミリ秒以内にアセチルコリンを選択的に不活性化することで、すべての哺乳類でこの役割を果たしている。AChEは体内で最も効率的な酵素の一つであり、その触媒率は拡散限界に近づく[17,18]。AChEの機能は、脳と末梢においても同様に重要であると考えられている。この見解は、全身のコリン作動性シナプスにこの酵素が集中的に局在していること、および脳内または末梢コンパートメントのいずれかでAChEを阻害することによって誘発される効果の多様性によって支持されている。
V. BChEの生理的役割
コリン作動性シグナル伝達の制御における AChE の役割は、長年にわたって確立されてきた明確な役割とは対照的に、BChE の真の生理的機能は何十年にもわたって解明されなかった。BChEはAChEよりもはるかに広い基質特異性を示す。例えば、BChEはブチリコリンとアセチルコリンを加水分解するが、AChEは後者のみを加水分解する。また、多くの組織でBChEの発現がAChEを上回る一方で、脳、骨格筋、末梢神経でははるかに低い濃度で存在している[19]。外因性のブチリコリンはイヌの内在性心臓ニューロン活動を調節することが示されているが[20,21]、我々の知る限りでは、高等脊椎動物のシナプスでは神経伝達物質としてブチリコリンを使用していない。実際、そのようなシナプスは存在しないというのが長年のコンセンサスである。この見解を裏付ける証拠として、私たちの未発表の研究では、イソOMPA(テトライソプロピルピロホスホラミド)のような選択的阻害剤は、明らかな生理的障害を引き起こすことなく、BChE触媒作用を完全に阻害することができるということが挙げられている。驚くことではないが、BCHEを発現しないBCHEノックアウトマウスは完全に健康に見える [22]。特に、運動機能、自律神経機能、認知機能に明らかな変化は見られない。何気ない観察では、野生型マウスと区別がつかない。さらに、機能的なBCHE遺伝子を完全に欠いていることが確認されている孤立したヒト集団があるが、どう考えても、彼らは正常な表現型を示している。彼らの「野生型」との唯一の生理学的な違いは、食品中の生理活性エステルや、クリニックでのエステル型筋弛緩剤にさらされた場合のリスクが高いことである[23,24]。
このように、最近までBChEは、神経伝達に関してAChEの「バックアップ」としての役割と、食物中の生理活性エステルの適度な保護のためのバイオスカベンジャーとしての役割以外には、重要な機能を持たないと考えられていた。後者は、人間や他の種が植物から栄養素を得ることを可能にする機能と考えることができる。エステルを加水分解する酵素の能力は、筋弛緩剤のサクシニルコリンのようなエステル系医薬品を用いた外科手術にも利用されており、この酵素は急速に不活性化する。しかし、特定の患者では、サクシニルコリン治療後の回復に非常に長い時間を要することが早くから明らかになってた。すなわち、これらの患者では、活性部位の突然変異を持つ「非定型 BChE」が発現しており、本来の酵素よりもはるかに低い触媒効率を示していることが明らかになった。この BChE の変異のために、彼らはゆっくりとサクシニルコリンをクリアし、長時間の補助呼吸と臨床モニタリングを必要としていた。
さらに最近、BChEが神経ペプチドである腸内ホルモンのグレリンを加水分解することが発見された[25-28]。それにもかかわらず、酵素反応は非常に遅いため、この発見を最初に報告した人たちは当初、この現象に本当の生理学的役割があるとすることに消極的でした。しかし、集団飼育された雄性マウスにBChEを高レベルで遺伝子導入したことで、ストレスの減少、攻撃性の低下、血漿中のグレリン濃度の低下と偶然にも結びついたことから、我々の見解は一変した[29]。我々は現在、グレリンの調節がこの酵素の重要な生理学的役割を表していることを確信しており、その役割を考慮すると、多くの種類の情動障害におけるグレリンの影響を調節するために BChE を使用する可能性があると考えている。
グレリンは、オクタン酸によってアシル化されたセリン残基を持つ 28 アミノ酸ペプチドである。この特徴は、その主要標的であるGタンパク質共役型成長ホルモン分泌促進受容体(GSHR)に結合し、活性化するために不可欠である[30,31]。血漿グレリンの主な供給源は、一般的な循環に放出される胃の内分泌細胞に由来する。循環するグレリンはその後、胃にフィードバックして胃の筋肉を刺激し、”空腹時のパンジー “を引き起こす。それは、食物を求めることに関与する中枢神経系の領域を活性化するために、胃の求心性迷走神経細胞をトリガーする。同時に、血漿中のグレリンもまた、血中脳関門を通過してGHSRを刺激し、食物欲求を駆り立てる。さらに、脳下垂体や視床下部の脳ニューロンは、局所的にグレリンを産生・放出する。下垂体でGHSRを活性化すると成長ホルモンの分泌につながるが、他の場所での活性化は、グルコース恒常性および脂肪貯蔵を含む他の多くのプロセスで役割を果たしている [32,33]。BChEは血流と脳の両方に存在するため、その加水分解活性は、血漿および脳脊髄液中のペプチドの支配的な形態である脱サシル-グレリンを形成するためにアシル基を切断することにより、グレリンシグナルを調節する役割を果たしている[34]。したがって、血中BChE活性の変化、例えば、抗コリンエステラーゼ(抗CHE)に応答して、GHSRシグナル伝達のバランスを活性なアシル-グレリンに有利にシフトさせることができる。しかしながら、デサシル-グレリンもまた、GHSRに依存しない方法で複数の効果を有する。これらの関係は、酵素阻害剤でBCHE活性を低下させたり、BCHE遺伝子導入でBCHE活性を上昇させたりすることでグレリン代謝を変化させることの生理学的意味合いをさらに強調している [29, 35-37]。
グレリンは快楽的摂食のための刺激剤としての役割を果たし、食物摂取と脂肪貯蔵を促進する [38-40]。健康的な除脂肪体重の人は、グレリンのパルスに反応して食物を欲しがることを経験する [38]。循環中のグレリン濃度は食物摂取量に影響され、食前には高く、食後には低くなる [41]。BChEによるグレリンの調節の最も明白な役割は、摂食行動/食物摂取量を調節することである。通常の条件下では、循環するBChEは安定しており、時間ごと、日ごと、週ごとにほとんど変化しない。対照的に、胃や脳内で放出されるグレリンのレベルは、時間の経過とともに急激に変化する。BChEレベルが低すぎると、食べたいという欲求が高まる可能性がある。肥満のヒトおよびイヌの血漿中BChEは、除脂肪体重の多い人に比べて中程度に高く、血漿中グレリンは低いことが報告されている[42,43]。同様の知見は、肥満のマウスモデルで報告されている[44]。同様に、肥満のヒトやマウスが元の健康な体重に回復すると、血漿BCHEは低下し、血漿グレリンは上昇し、しばしば顕著になる。このように、これまでのエビデンスは、BCHE活性とグレリン活性のレベルが逆に結合していることを示唆している。このことは、血漿または組織のBCHEの変化がグレリン代謝に影響を与え、それによってアシルおよび脱アシル-グレリンのそれぞれのシグナル伝達経路に影響を与える可能性を示唆している[45]。これらの知見を踏まえると、BCHEレベルを操作して、グレリンが駆動する過食や肥満に影響を与えることが可能であると考えられる[46]。
VI. コリンエステラーゼと周辺部の阻害剤の薬理学的効果
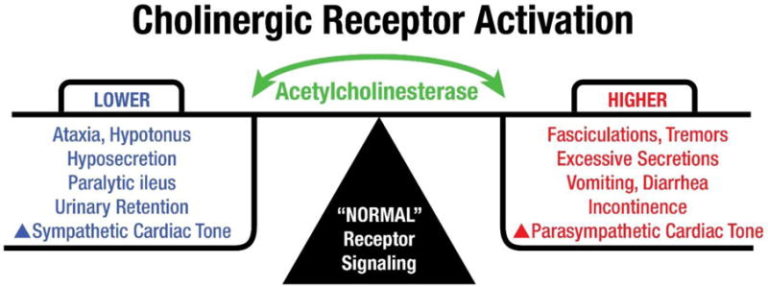
現在では、コリン作動性シグナル伝達が、骨格筋や平滑筋の収縮、自律神経後神経細胞の活性化、副交感神経末端器官の活性化(例:唾液腺、涙腺、気管支腺心活動の調節などを含む多くの末梢機能の制御に重要な役割を果たしていることが知られている。図1は、コリン作動性シグナル伝達によって制御される末梢運動機能および自律神経機能を図示したもので、コリン作動性受容体の活性化、アセチルコリンエステラーゼ活性、および機能的応答の関係を示している。
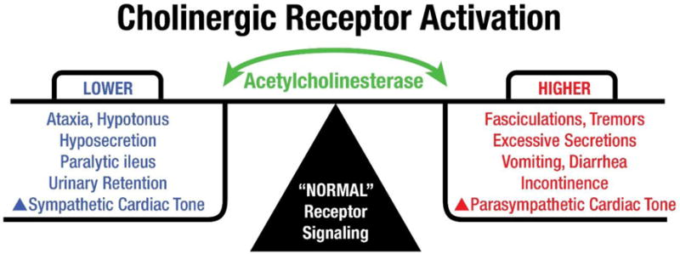
図1
アセチルコリンエステラーゼとコリン作動性受容体の活性化 正常な生理学的条件下では、AChEはコリン作動性シグナル伝達の調節においてダイナミックな役割を果たし、アセチルコリンを迅速に分解して神経伝達を終了させる。コリン作動性運動ニューロンはアセチルコリンを放出して骨格筋を活性化し、歩行や細かい運動制御を行う。同様に、副交感神経ニューロンは平滑筋を刺激して腸の蠕動運動、膀胱の収縮、唾液腺からの分泌、咽頭結節での緩慢な心拍を駆動する。AChE活性が抑制されると、コリン作動性受容体の活性化により、筋収縮の亢進、外分泌物の分泌、消化管障害、失禁、副交感神経緊張の亢進を引き起こし、心拍数の速度と力の低下につながる。AChE活性が高いと、コリン作動性受容体の活性化が低下し、筋肉や心臓の力や緊張が低下し、外分泌物が減少する。
前述のように、コリン作動性シグナル伝達に関する初期の研究は、神経筋接合部に焦点を当てていた。クロード・ベルナールの矢毒クラーレによる神経筋遮断の研究は、神経-筋シナプスの概念を発展させるのに役立った[47]。筋緊張を適切にコントロールすることは、多くの手術や救急の現場では不可欠な目標である。神経筋ブロック剤は、気管挿管を容易にし、内視鏡評価を行い、手術中の不動を維持するために広く使用されてきた。キュラーレは、神経筋接合部のニコチン受容体を競合的に非脱分極化するブロッカーとして作用する。アトラキュリウム、ベクロニウム、ロクロニウムなどの様々な非脱分極性神経筋遮断薬が開発され、神経筋伝達を遮断するために臨床的に実施されている。神経筋遮断が不要になった場合、筋緊張を速やかに回復させるためには、神経筋遮断を中止しなければならない。コリンエステラーゼ阻害薬(例えば、ネオスチグミン)は、これらの非脱分極性神経筋遮断薬の効果を逆転させるために使用されてきた。この目的のためにコリンエステラーゼ阻害薬が依然として使用されているが、アセチルコリンエステラーゼを阻害することによって作用しない逆転剤(サイクロデキストリンベースのスカベンジャーであるスガメデックス)が、ロクロニウムおよびベクロニウムの効果を逆転させるために使用されるようになってきている [48,49]。
非脱分極性受容体遮断薬とは対照的に、アセチルコリンの構造的類似体であるサクシニルコリンは脱分極性遮断薬であり、緊急挿管などの迅速な処置における神経筋遮断のためのゴールドスタンダードであり続けている[50]。サクシニルコリンの神経筋遮断は、通常、血漿BChEの触媒活性によって非常に迅速に反転する[51]。しかし、上述したように、BChEの触媒活性に遺伝的な違いがあるため、一部の個体では問題が生じていた。
明らかに、コリンエステラーゼ阻害薬は、サクシニルコリンによって誘導される神経筋遮断を逆転させるのには何の役にも立たず、実際には逆効果である可能性がある。しかし、AChE活性を遮断することによってアセチルコリンの分解を阻害することは、アセチルコリンシグナル伝達が障害されている障害において有益であるかもしれない[54]。アセチルコリン加水分解を阻害することによって改善されうる臨床状態の1つは、重症筋無力症であり、神経筋接合部における神経筋ニコチン受容体または関連タンパク質の自己免疫による破壊を伴う神経筋疾患群である[55]。神経筋接合部におけるアセチルコリンの分解を遮断し、ニコチン受容体の活性化を増強する能力により、コリンエステラーゼ阻害薬(例えば、ピリドスチグミン)は、ヒトおよび動物病院の患者の筋力を増強するために数十年にわたって使用されてきた [56]。しかし、筋特異的キナーゼに対する抗体を伴う重症筋無力症の一形態では、AChEを阻害しても効果がなく、実際にはコリンエステラーゼ阻害薬によって症状が悪化する可能性がある。もう一つのコリンエステラーゼ阻害薬である速効性可逆性阻害薬のエドロホニウム(テンシロン®)は、重症筋無力症の診断のためのテンシロンテストでよく使用されている。エドロホニウムの静脈内投与は、筋緊張の迅速(数秒)かつ劇的な短期的な改善をもたらする。エドロフォニウムはまた、頸部ジストニアおよび血流痙攣などの他の神経筋障害の診断にも有用である[57,58]。
コリンエステラーゼ阻害薬は、世界的な失明の主要原因である緑内障の治療に有用である[59]。一般に、滲出液の蓄積による眼圧の上昇は、視神経および網膜神経節細胞の変性をもたらす。眼圧を低下させる戦略は、ほとんどの緑内障の治療法として証明されている唯一のアプローチである [60]。抗CHE薬の眼内投与は、毛様体筋の収縮を促進し、眼圧を低下させるために海綿体網目を介した滲出液の流れを増加させることができる。他の薬剤、例えば、アセタゾラミドやドルゾラミドなどのスルホンアミド系炭酸脱水酵素阻害剤は、体液の形成を減少させ、プロスタグランジンFアナログ(ラタノプロスト、ビマトプロストなど)は、体液の流出を促進するために、これらの条件のためにコリンエステラーゼ阻害剤に取って代わられている[61]。興味深いことに、可逆性コリンエステラーゼ阻害薬ガランタミンは最近、緑内障の実験モデルにおいて網膜神経節細胞を保護し、局所血流を改善することが示されたが、眼圧とは無関係な方法で行われた [62,63]。
胃腸の緊張は、コリンエステラーゼ阻害薬によって効果的に調節することができる。副交感神経線維がアセチルコリンを放出して腸円筋および腸縦筋を収縮させるため、AChE阻害はこれらの作用を促進することができる。術後イレウス(手術後の胃の空っぽ化遅延)は、手術そのもの、麻酔薬、オピオイド系薬剤、その他の要因によって生じることがある。ネオスチグミンは胃排出を促進するが、いくつかの研究では、腸管吻合部からの重篤な漏出など、腸への悪影響を助長することが示唆されている [64,65]。同様に、機能性ディスペプシア、胃パレーシス、および大腸偽閉塞などの状態は、アコチアミドなどのコリンエステラーゼ阻害剤で治療されうる[66-68]。他の運動促進剤、例えばメトクロプラミドは、コリンエステラーゼ阻害剤と同様に胃の空っぽ化を促進し、GI運動ニューロンを活性化するために使用されるが、それらはアセチルコリンの分解をブロックするのではなく、アセチルコリンの放出を増加させることによって作用する [69,70]。
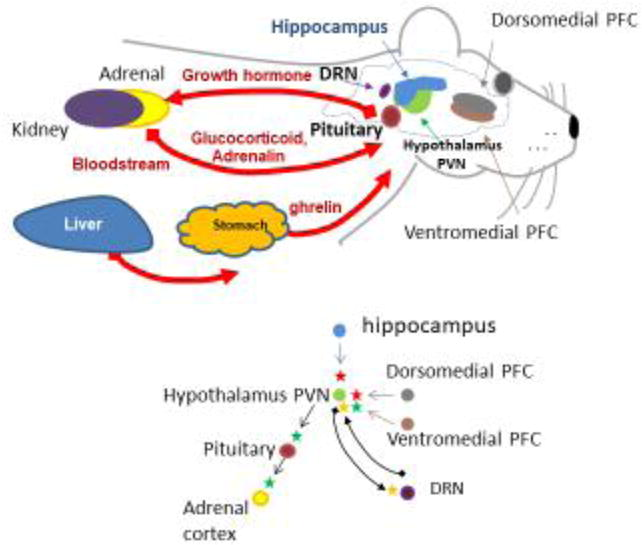
先に述べたように、触媒活性が低いかまたは存在しないBCHE変異体を発現する個体は一般的に無症状であり、BCHE阻害の薬理学的/毒性学的帰結についての研究は限られた量しか実施されていない。しかし、グレリンシグナル伝達における酵素の役割は、将来的には治療的(または毒性的)な標的となる可能性が高い。Liら[26]は、高脂肪食で維持されたBCHEノックアウトマウスは、BCHE+/+のマウスよりもかなり多くの体重が増加したことを報告している。興味深いことに、この研究では、肥満への道を歩んでいるマウスは、食物消費量の増加を示さなかったようである。実際、我々の後の研究では、この明らかに否定的な結果は、寝具材料に隠された損失によって容易に歪められる食物摂取量を測定するための手段の人工物であったかもしれないことを示唆している。いずれにしても、BCHEノックアウトのアシル-グレリンの血漿中濃度は、野生型の実験動物の約2倍であった。BChE以外にもカルボキシルエステラーゼやプロテアーゼなどのハイドロラーゼがアシル基を切断したり、ペプチド自体を分解したりする可能性がある[26,71]。げっ歯類はヒトよりもはるかに高いカルボキシルエステラーゼ血中濃度を持っているので、そのような違いは、いくつかの試験種と比較して、ヒトにおけるグレリンシグナル伝達に対する BChE 活性の相対的な影響に影響を与える可能性がある。それにもかかわらず、我々の研究チームによる最近の知見では、遺伝子導入後の血漿中BChE活性の著しい上昇は、血漿中のアシル-グレリンの劇的な減少と関連していることが示されている[72]。興味深いことに、高BChEマウスでは、攻撃的行動(自発的行動と侵入者誘発行動の両方)のレベルが低いことが確認された。多くの研究は、グレリンと感情/感情的行動との関連を示唆している [73-78]。グレリンシグナル伝達におけるBChEの役割は興味深く重要であるが、まだ十分に理解されていない [79]。したがって、グレリンの多くの生理的影響に関連した複雑なシグナル伝達における BChE とその阻害剤の効果を評価する研究は価値があると考えられる。図2は、脳内のグレリンのシグナル伝達と関連機能に対するBChEの広範な影響を示している。
図2
脳内グレリン代謝とシグナル伝達におけるBChEの役割 トップパネル。恐怖反応に関与する主要臓器、脳領域、経路。赤い矢印は血液を介した送達を示す。下のパネル。主な相互作用中枢:視床下部パルボ心室核(PVN背側前頭前皮質(PFC背側ラフェ核(DRN副腎皮質、下垂体。矢印は相互作用の方向を示す。緑=活性化、赤=抑制、黄色=調節。
VII. 中枢神経系におけるコリンエステラーゼと阻害の薬理効果
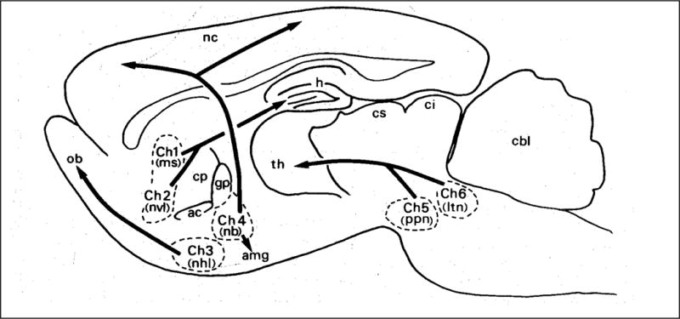
多くのエレガントな形態学的および免疫化学的研究により、脳内の6つのコリン作動性細胞核の記述につながった(Ch1-Ch6と呼ばれる)[80-83]。図3は、哺乳類の脳におけるコリン作動性核とその一般的な突起を示す、[80]からの引用である。これらの異なるコリン作動性線維によるびまん性の神経伝達は、認知、呼吸、運動などを含む多くの生理機能に影響を与える。さらに、いくつかの脳領域(特に線条体)には、コリン作動性介在ニューロンの複数のネットワークが含まれている[84,85]。このように、中枢神経系におけるAChEの阻害は、非常に幅広い機能に影響を与える可能性があり、これは早期のアルツハイマー病の治療の標的となっている。
図3
ラット脳のコリン作動性核と突起。Mesulam et al 1983年からの古典的な模式図。Ch1,内側中隔核、Ch2,対角線帯の垂直辺縁核、Ch3,対角線帯の水平辺縁核の側部、Ch4,メイナート基底核、淡蒼紅色苔癬、宿主下層核、羊状突起核、Ch5,pedunculopontinus核、Ch6,後背側辺縁核。他の構造:NC、大脳新皮質、OB、嗅球、TH、視床、H、海馬、cbl、小脳。
アルツハイマー病は壊滅的な神経変性疾患であり、世界中で推定3,500万人に影響を与えている[86]。Ch4(基底核)の細胞の広範な損失の発見とアルツハイマー前脳のコリン作動性マーカーの広範な減少[87-92]は、認知症のコリン作動性仮説につながった([93,94]でレビュー)。この仮説は、コリンエステラーゼ阻害剤の潜在的な治療効果を検討するための扉を開いた[95-97]。それ以来、選択的に結合するか、または多機能性を示す多くの天然および合成コリンエステラーゼ阻害剤がアルツハイマー病の治療のために評価されてきた(最近のレビュー[98-102]を参照のこと)。
現在、Mielkeら[103]によると、アルツハイマー病治療のために米国食品医薬品局(FDA)の承認を得ている薬剤には、以下のものがある。ガランタミン(ラザディン®、4aS,6R,8aS-5,6,9,10,11,12-ヘキサヒドロ-3-メトキシ-11-メチル-4aH[1]、ベンゾフロ[3a,3,2,2-ef][2]ベンザゼピン-6-オールリバスチグミン(エクセロン®、[3-[(1S)-1-(ジメチルアミノ)エチル]フェニル N-エチル-N-メチルカルバメートドネペジル(アリセプト®、2-((1-ベンジルピペリジン-4-イル)メチル)-5,6-ジメトキシ-2,3-ジヒドロ-1H-インデン-1-オン)などがある。1993年、コリンエステラーゼ阻害剤タクリン(コグネックス®、1,2,3,4-テトラヒドロアクリジン-9-アミン)は、アルツハイマー病の治療薬として初めてFDAの承認を取得したが、半減期の短さ(1日4回の投与が必要)と肝毒性の証拠により使用が制限されていた。最近のアルツハイマー病におけるコリンエステラーゼ阻害剤の有効性に関するメタ解析では、ドネペジル、リバスチグミン、ガランタミンはいずれも認知機能の向上や行動の改善など、比較的軽微ではあるが有意な効果を示したが、いずれも重篤な毒性のリスクを増加させるものではなかったと報告されている[104]。ドネペジルとガランタミンは中枢神経系のChEsに選択的に作用するが、3つの薬はいずれも吐き気、下痢、その他の好ましくない作用を引き起こす可能性がある[104-108]。残念ながら、これらは疾患の進行にはほとんど影響を与えない。興味深いことに、Triccoと共同研究者ら[104]は、ガランタミンは死亡のオッズ比の減少と関連していることを報告したが、米国とカナダの両方のファーマコビジランスデータベースでは、リバスチグミンで死亡のオッズ比が増加していることが検出された[105]。このように、現在のコリンエステラーゼ阻害薬はわずかな治療上の利点を持っているが、ChEsや他の高分子標的に作用する、より効果的な、または多目的の阻害薬の探索は続いている[109-111]。
中枢神経系コリンエステラーゼの非触媒的役割
シナプスのアセチルコリンレベルを増加させる阻害剤の薬物標的としての役割に加えて、AChEとBChEの両方が神経生物学において非触媒的な役割を果たすことが提案されている。多くの研究は、両方のコリンエステラーゼが神経発達において非触媒的な役割を持ち、脊椎動物のシステムにおいて「形態形成」的な役割を果たしている可能性を示唆している[112-116]。コリンエステラーゼの形態形成的役割を支持する最も印象的な知見のいくつかには、新生児ラットの脳発達中の視床皮質および小脳皮質突起におけるAChEの時空間的な発現パターンが含まれる[113,117]。これらのニューロンはコリン作動性ではなく、成人期にはコリン作動性の神経支配を受けていないが、発達の離散的なウィンドウ(皮質へのそれぞれの繊維の成長のタイミングと相関する産後の発達の第2週目にピークを迎える)の間、それらのニューロンは強烈なAChE染色を示す。興味深いことに、一過性に発現したAChE活性の阻害は、その後の神経のパターニングに影響を与えなかった[118,119]。一方、Yangら[120]は、クロルピリホスおよびクロルピリホスオキシンは、酵素を阻害しない低濃度でAChEを発現する培養感覚ニューロンの軸索成長を阻害する可能性があることを報告したが、同様の曝露はAChE -/-ニューロンではそのような効果はなかった。AChEをコードするcDNAをニューロンにトランスフェクションすると、感受性が回復した。ニワトリの神経発達モデルを用いて、Layerら[121]は、BChEとAChEの両方が脊椎動物の神経発達において形態形成的な役割を果たすことを示唆する証拠を提供した。特に興味深いのは、神経管発達中のBChE発現によるAChE陽性領域のコリン作動性線維の「伏線」であった [112,121,122]。これらの酵素は、アセチルコリンを不活性化することにより、少なくとも部分的にはコリン作動性シナプト形成とは独立して、神経突起の伸長を制御していることが提案された。これらの酵素は、成人中枢神経系においても非触媒的な役割を果たしている可能性がある。例えば、GraybielとRagsdale [123]は、霊長類の視覚経路におけるAChEとBChEの顕著な差異染色を報告している。BChEは、AChEのラベリングとは無関係に、側方性帯状突起の傍細胞層と視覚野の領域17に明瞭なラベリングを示した。著者らは、両コリンエステラーゼの分布の違いは、BChEがこの経路内のシグナル伝達に何らかの役割を果たしていることを示す指標である可能性を示唆した。
実質的な証拠は、アルツハイマー病の発症と進行におけるAChEとBChEの非触媒的役割を示唆している。アルツハイマー病は、加齢に伴う脳内の不可逆的な神経細胞死の発生率を大幅に高める。アルツハイマー病の特徴的な病変は、機能的なシナプス構造に取って代わるアミロイドタンパク質と神経原線維のもつれの蓄積である。これらの病変は典型的には、機能的なニューロン回路とは明確な関係のないパターンで、過剰なAChEとBChEの蓄積を伴っている。この特徴は重要な問題を提起している。酵素沈着はアミロイド毒性に対する代償反応なのか、それとも実際にはストレスを受けたニューロンにダメージを与えているのか?さらに複雑なことに、シナプスのアセチルコリンレベルを調節することに加えて、AChEは、酵素的触媒作用ではなく、タンパク質とタンパク質の相互作用を伴う非コリン作動性の機能を持っているようである[124-128]。したがって、神経細胞の発達に関する研究は、AChEが、おそらく細胞外マトリックスとの接着性相互作用を介して、神経細胞の成長を促進することを示唆している[128]。
アルツハイマー病の研究では、老人斑におけるAChEの一貫した局所蓄積は、この酵素がβアミロイド(A-β)と結合し、その沈着を促進するという仮説に早くからつながっていた。実際、試験管内試験モデルでは、AChEがA-βとAChEタンパク質の不溶性フィブリルの形成を促進し、A-β単独よりも細胞毒性が高いことが示されている。結晶構造データは、アミロイドとAChEタンパク質の間の相互作用の潜在的な座位を示唆している[129]。この座は、酵素の周辺部位の近くにあり、触媒峡谷の入り口付近の外表面に位置する。この構造的推論と矛盾しないように、ヨウ化プロピジウムや特定のモノクローナル抗体のような末梢部位特異的AChEリガンドは、AChEが試験管内試験でアミロイドフィブリルの形成を促進するのを防ぐことが発見されている[130]。これらの観察は興味をそそるが、アルツハイマー病の病態との関連性はほとんど推測の域を出ていない。今、我々は無傷の脳におけるアミロイド沈着に対するAChEの影響を現実的に評価する必要がある。
神経組織培養を用いた試験管内試験研究では、AChEがA-βと相互作用してアミロイドの沈着と凝集を促進し、神経細胞死につながることが示されている[130]。この仮説を生体内試験で検証するために、我々の研究室でヒトAChEを発現するようにTg2576マウスを遺伝子組み換えし、ヒトアミロイド前駆体タンパク質を発現するマウスの系統と交配させた[126]。これらの被験者は9ヵ月後に確実にプラークを発症した。結果として得られたF1ハイブリッドは、これらのヒトトランスジェニックの両方を脳内で発現させ、生後6ヵ月までに大脳皮質にA-β1-40および1-42の免疫化学的染色で容易に染色された本物の斑点を示した。これらの早期発症斑はまた、アルツハイマー病病理学の特徴として、ヒト患者の脳病変で見つかった他の成分に対して陽性に染色した。これらはCd11b、GFAP、そして再びAChEを含んでいた。全体的に、ハイブリッドマウスのプラーク発症は、2つの親系統のいずれかよりも30%〜50%早く始まった。また、プラーク負荷は年齢とともに増加し、9ヶ月と12ヶ月の2種類のトランスジェニックマウスでは、プラークが著しく増大し、数も多くなっていた。ELISAを用いた定量的免疫測定でも、9~12ヶ月目に脳内の総アミロイド含量の増加が確認された。これらの組織学的・生化学的な結果は、ヒトの アルツハイマー病 病理と顕著な類似性を示しており、AChE がアルツハイマー病の発症に関与していることを強く示唆している。
以上のことから、いくつかの知見は、高いAChEレベルを背景にA-βを発現させるとプラーク形成が増加することを示している。この相互作用のメカニズムはまだ不明であるが、試験管内試験での先行研究から、病理学的な事象の順序を推測することができる。培養中のタンパク質凝集の直接測定は、AChEが可溶性アミロイドペプチドの不溶性アミロイド線維への変換を促進する核形成因子として作用しうることを示している[130]。X線結晶構造解析、競合アッセイ、およびAChEリガンドとの計算上のドッキングによる構造解析はすべて、A-βとのタンパク質相互作用の可能性のある場所として、酵素の周辺部位を指摘している[131,132]。したがって、この相互作用をブロックするための最も効果的な化合物は、峡谷内のAChEの活性部位に結合する「古典的な阻害剤」であるとは限らない。実際には、より表面的な領域に向けられたリガンドがβアミロイドモノマーの凝集を抑制し、その後の神経細胞毒性を減少させる可能性があるようである。
現在アルツハイマー病治療のために承認されている抗CHEのうち、タクリン、ガランタミン、リバスチグミンは、すべてAChEの中心部位に主に結合している[133]。興味深いことに、ドネペジルは、芳香族酸残基との芳香族スタッキングを介して、触媒的なトリアッド領域から周辺のアニオン性部位に配向することができる[134]。このユニークな特徴は、ドネペジルが最近の臨床試験で明らかになったように、疾患の進行を遅らせるかどうかという議論に関心を持たせている。高度な分子モデリング技術を用いれば、AChEとA-βの相互作用をより効果的に阻害し、理想的には周辺部、特に骨格筋におけるAChEの阻害を最小限に抑えた薬剤を発見することが可能になるはずである。高いAChEとAPPの背景に早期のプラーク沈着を持つハイブリッドトランスジェニックマウスは、彼らがアルツハイマー病の進行を遅らせるのに役立つことができるかどうかを決定するために、そのような薬剤をテストするための特に良いモデルを表すかもしれない。
アルツハイマー病におけるBChEの役割はもっと議論の余地がある。この酵素は主に肝臓で生成されて全身循環に放出され、先に述べたように、そうでなければ毒性があるかもしれない植物性食品からの様々な生理活性エステル化合物を不活性化する役割を果たしている。しかし、BChEの第二の産生部位は脳であり、アセチルコリンの不活性化に寄与し、それによって主要な神経経路の調節に関与している。AChEのように、BChEはまた、アルツハイマー病の瀕死のニューロンに関連付けられているアミロイド斑に集中している。これらの特徴は、多くの神経学者や神経生物学者が、BChEがアルツハイマー病の発症に重要な貢献者であるか、あるいは主要なドライバーであると確信している。この見解は、脳のシナプスにおけるアセチルコリンレベルを高め、コリン作動性伝達と認知のための神経化学的機能を回復させることを期待して、サイムセリンのような選択的BChE阻害薬の臨床試験につながった。実際、このコンセプトは認知機能の改善と短期記憶力の向上につながったが、一時的なものにすぎなかった。残念なことに、試験されたBChE選択的阻害薬のどれも、神経細胞の死と不可逆的な認知機能低下という不可逆的なプロセスを遅らせることはできなかったし、ましてや逆転させることはできなかった。言い換えれば、これらの薬剤は、主にアルツハイマー病の初期段階では、緩和治療として確かに有用であることができるが、それらは疾患修飾剤ではない。脳病理が必然的に重度の神経細胞喪失へと進行すると、それに伴って有効性も低下する。
アルツハイマー病におけるBChEのメカニズム的役割の問題については、もしあるとすれば、集中的かつ継続的な研究にもかかわらず、完全な解明ができていない。最近、一部の研究者は BChE が アルツハイマー病 病理の実際のドライバーであると結論づけているが [135-137]、他の同じように有名な科学者たちは真逆のことを示唆するデータを発表している。前者の見解は、プラーク病変におけるBChEタンパク質のユビキタスな存在と、病変が進行するにつれて増加するこのタンパク質の豊富さに主に基づいている。しかし、プラーク病変におけるBChEの豊富さは「傍観者効果」であるという議論も可能である。具体的には、アミロイドの増加に伴ってBCHEがプラークに引き寄せられ、その影響は完全に中立的なものであるか、あるいはアミロイドによる神経回路への損傷を緩和するものである可能性がある。その概念のサポートは、ネイティブBCHEが試験管内試験でアミロイドフィブリルの自然形成を減衰させることを示したDiamantと共同研究者[130]から来ているが、C末端変異「K-バリアントBCHE」(若年性アルツハイマー病のリスク増加と強く関連している)は、その点で欠乏している。
我々の研究室の一つでは、若年性アルツハイマー病になりやすいいわゆる「5×家族性ADマウス」を用いた研究が始まっており、アルツハイマー病プラーク病変、神経細胞死、認知機能障害におけるBChEの役割に新たな光を当てることを期待している。予備的なデータから結論を出すには、まだ時期尚早である。それにもかかわらず、我々は、この酵素のmRNAをコードするAAV8ウイルスベクターを脳内に直接注入した後、脳のBCHEレベルの本質的に永続的な(すなわち、生涯)上昇を実証することができた。さらに、血液脳関門を容易に横断する新しい「PHP遺伝子導入ベクター」を用いて [138]、大脳皮質、小脳、大脳基底核の実質的にすべての領域で、非常に高く、本質的に永続的なBChE発現を生成することが可能であることを発見した [139]。この能力は、中枢神経系におけるBChEの役割を明らかにすることを目的とした研究を促進するはずである。
VIII. コリンエステラーゼ阻害剤の毒性学的用途
ChE阻害薬は様々な疾患の治療に使用することができ、また使用されてきたが、治療の裏側には毒性がある。驚くほど多くの微生物、植物、真菌、動物が抗ChEを開発している[140-142]。ChEは動物界全体に広く分布しており、すべての高等動物種において神経細胞のシグナル伝達において重要な役割を果たしているため、これら多くの生物によるChE阻害剤の広範な発現は、捕食に対する防御として進化してきた可能性が高い。
ChE阻害剤の毒性は170年以上前から認識されている。当時の代表的な毒性学者であったロバート・クリスティソンは、「試練による試験」のマメの毒性学的試験の最初の結果を報告した[143]。西アフリカのカラバル地域の先住民は、人が犯罪、通常は “魔術 “の無罪か有罪かを判断するために “試練の毒 “を使用することで知られていた。前述したように、カラバル豆(Physostigma venenosum)の抽出物は、後にChEsの強力な阻害剤であることが発見されたエセリン(Physostigmine)を含んでいる。抽出物の致死性は、1840年には早くもヨーロッパの宣教師によって指摘されていた。この毒性物質は、実際にはその効果的な「司法」使用につながる固有の特性を持っていたと推測されている(レビュー[144]を参照)。
エセリンの毒性、カルバメート構造および抗CHE作用が発見されて以来、他の多くのカルバメートコリンエステラーゼ阻害剤が合成され、特徴づけられてきた[145]。かなりの数が1960年代に殺虫剤として導入され、これらのいくつかは世界中で広範囲に使用され続けている[146]。カルバメート類が広く導入される前の1940年代から、多くの有機リン系コリンエステラーゼ阻害剤が殺虫剤として開発された[147]。カルバメートおよび有機リン系コリンエステラーゼ阻害剤はともに、AChEおよびBChEの活性部位セリン残基を共有結合的に修飾し、それによってすべてのコリンエステル加水分解を阻害する。エステラーゼによるカルバモイル部位の切断は、コリンエステル中のアシル基の加水分解よりもはるかに遅いが、有機リン剤によって阻害されたエステラーゼの再活性化の痛みを伴う長期化に比べれば、依然として迅速である[148]。
有機リン系コリンエステラーゼ阻害剤は、天然由来のものではない。テトラエチルピロリン酸塩は、1850年代に合成され報告された最初の有機リン系阻害剤である。有機リン系抗CHEのさらなる開発と特性評価は、第二次世界大戦前のドイツでGerhard Schrader博士の指導の下、1930年代半ばまで開始されなかった[149]。Schraderは、当時使用されていた一般的な天然殺虫剤の高コストと低入手性に対処するために、合成殺虫剤を探していた。シュレーダーの最も強力な殺虫剤の1つであるタブン(N-ジメチルホスホロアミドシアニデート)は、その後ドイツ軍の管理下に入り、化学戦争用の殺虫剤として使用されるようになった [150]。この研究室から生まれた他の有機リン化合物には,パラチオン(O,O’-ジエチル-O-p-ニトロフェニルホスホロチオエート)とその酸素アナログ(O,O’-ジエチル-O-p-ニトロフェニルホスフェート),パラオクソンが含まれている[147]。それ以来、多くの有機リン系抗CHEが合成されてきた。そのほとんどは、殺虫剤としての商業利用のために開発され、場合によっては、獣医学的およびヒトの治療薬(例えば、緑内障のためのジイソプロピルフルオロリン酸塩、駆虫剤としてのトリクロルフォン)としての医薬品としても開発された。
カルバメート系殺虫剤と有機リン系系殺虫剤は、現在でも世界で最も広く使用されている殺虫剤の一つである[151]。2012年には、有機リン系殺虫剤であるクロルピリホスとアセフェートは、米国で使用されている農薬の推定使用量で全体の14位と22位にランクされている。カルバメート系殺虫剤のカルバリルと有機リン系系殺虫剤のアセフェートとマラチオンは、最近まで家庭用の最も一般的な殺虫剤の一つであった。アセフェートは工業部門でも広く使用されていた。過去20年の間に、米国では多くの有機リン系型殺虫剤が市場から撤退したり、禁止されたり、使用が制限されたりしてきたが、その他の殺虫剤は依然として農薬全体の使用量の大部分を占めている。2012 年には、有機リン系 型殺虫剤は米国で使用されている全殺虫剤の約 38%を占めていた [151]。現在のところ、米国では複数の規制措置により、このような殺虫剤の使用が抑制されているが、特定の集団は依然としてコリンエステラーゼ阻害レベルにさらされている可能性がある[152]。
抗CHE農薬への曝露に対する世界的な懸念は依然として残っているが、それ以上に深刻なのは有機リン系神経剤中毒の脅威である。事実上すべての先進国は、これらの極めて有毒な化合物の備蓄を排除する協定に参加しているが、合成が比較的容易であることから、これらの化合物は継続的な懸念となっている。つい最近2017年4月、化学兵器禁止機構は、「神経ガス」サリンがシリアのカーン・シェイクンの住民に使用されたことを確認した。このように、不正な国家および/またはテロリストグループによる有機リン系神経ガスの潜在的な使用は、世界的な問題として残されている。
より容易に可逆的なコリンエステラーゼ阻害剤の一見逆説的な薬理学的使用は、「不可逆的」な阻害剤である有機リン系神経剤によるAChEの長期的な不活性化をブロックすることである[153]。本質的には、有機リン系神経剤に曝露される危険性のある個人は、ピリドスチグミンまたは別のカルバメート系抗CHEに事前に曝露することで保護され、酵素の活性部位への有機リン系アクセスを一時的に遮断することができる。短命の阻害剤を不可逆的阻害剤に曝露する前に投与すると、後者は酵素に結合することができず、自然に再活性化する。実際、このシナリオはいくつかの動物モデルで神経剤中毒に対する保護を示している [153-158]。この予防的アプローチの背後にある論理は、コリン作動性シナプスには「予備の」酵素があるので、コリン作動性シグナル伝達のダイナミクスを破壊することなく、一定レベルのAChE阻害を許容できるという概念に基づいている。この巧妙な予防戦略は、第一次ペルシャ湾岸戦争で実施された。兵士たちは、化学兵器への曝露の可能性を懸念して、ピリドスチグミンの様々な用量を与えられた。しかし、第一次ペルシャ湾岸戦争後の原因不明の「湾岸戦争病」におけるピリドスチグミンの潜在的な役割のために、しばらくの間、この適用には疑念の雲がかかっていた[159]。しかし、これらの疾患には他の原因、例えば心的外傷後ストレスなどがあったかもしれない。ピリドスチグミンがこれらの疾患に役割を果たしていなかったとしても、変動性が高く、環境ストレス因子にさらされている多様な人々のグループに、過剰な阻害を受けることなく、酵素分子を十分に遮蔽するための薬物を投与することは、リスクの高いアプローチであった。しかし、一つ確かなことは、コリンエステラーゼ阻害剤を治療や予防のために使用する場合、AChEの有益な阻害と毒性の阻害の間には常に微妙なバランスが存在するということである。薬剤が少なすぎると効果がなく、多すぎると危険である。
IX. 生体内でのChEの増加
体内のコリンエステラーゼレベルを高めることは、AChEを阻害することで毒性を誘発する化学物質、または主にChEによって不活性化される化学物質から身を守るために有益であると考えられる。ChE活性を高める主な動機は、1) 農業環境における抗ChE農薬への偶発的または意図的な曝露、2) 残留農薬を含む食品の摂取、または3) 化学戦争またはテロリズムにおける神経剤への意図的な曝露によって引き起こされる抗ChEの毒性を克服または防止することである。これらのシナリオはすべて、現在の状況で可能である。特に、積極的なモニタリングと厳格な環境規制がない発展途上国や地域では、その可能性が高いものもある。循環中のBChEのレベルを高めることは、2つの非常に異なる状況での保護戦略として評価されている。
第一に、精製ヒト BChE を大量に投与することで、実験動物を様々な 有機リン系 神経剤への致死的曝露から保護することが示されている。BChEは、化学量論的な方法で有機リン系分子を隔離またはスカベンジし、それらが脳および末梢組織のAChEを阻害してコリン作動性シグナル伝達を混乱させる前に、毒性分子を不活性化することができる[160]。実際、BChEおよびAChEの両方が、有機リン系神経剤のバイオスカベンジャーとして評価されている。十分な量で、これらの化学量論的結合タンパク質を投与すると、標的組織におけるAChE阻害を最小限に抑え、霊長類を含む複数の実験モデルにおいて、有機リン系毒物からの致死性を保護することができる。
有機リン系バイオスカベンジャーとしてのCHEの予防的使用には、循環からの迅速なクリアランスの一部に起因して、大量の精製ヒトタンパク質を必要とすることを含む障害がある。例えば、マウスにおけるヒトBChEの筋肉内(im)投与(13mg/kg、約0.3mg)は、約10~12時間で血中BChE活性のピークをもたらすが、70時間後にはピークの~25%しか残存しない[161]。マウスへのヒトBCHE 0.1~3mgの腹腔内投与と腹腔内投与の両方で、循環中のBCHE酵素活性の著しい上昇を引き起こし、12~24時間後にピークを迎えるが、120時間後にはベースラインに近い状態に戻っていた [162]。DoctorとSaxena [163]およびSaxenaと共同研究者ら[164]は、マウスおよびモルモットに投与した場合のヒトBChEの薬物動態、凍結乾燥酵素の長期安定性(少なくとも2年およびモルモットに神経剤VXとソマンをLD50用量投与した場合の完全な無標識生存について報告している。ヒトBChEの高用量(最大60mg/kg)を投与すると、酵素のピークレベルは24時間前後になり、少なくとも4日間は実質的なレベルが維持された [165]。同じ研究者らは、高用量の BChE 投与後に明らかな生理的・行動的徴候は認められず、血清化学や組織病理学的にも変化は認められなかったと報告している。アカゲザルにヒトBCHEを30mg/kg静脈内投与したところ、血中BCHE活性の著しい上昇が認められ、100時間後にはピークレベルの約25%以内に戻った[166]。これらおよび他の最近の研究は、外因性に投与されたヒトBChEが循環酵素活性を上昇させ、強力な有機リン系神経剤からの毒性から保護する可能性を示しており、酵素の高用量投与に対する有害反応の証拠はほとんどない。
前述したように、外因性に投与されたBChEは、有機リン系神経毒性から保護することができるが、その有効性は、数日以内に循環からタンパク質がクリアランスされることによって制限されている。多くの研究では、化学修飾、遺伝子導入、および “ナノフォーミュレーション “により、ChEの循環時間を増加させることが試みられている。AChEをバイオスカベンジャーとして用いた研究 [167-171] は、AChEのシアル化の程度が酵素の循環滞留時間に直接影響するという結論に至った。組換えBChEをポリシアリル化して化学的に修飾すると、マウスの静脈内投与後の平均滞留時間が6倍に増加し、そのような酵素は、いくつかの有機リン系神経剤に対する保護を提供するバイオスカベンジャーであることが証明された[172,173]。ポリエチレングリコール(PEG、すなわちPEG化)でタンパク質を修飾することは、生体内でのクリアランスを減少させるために数十年にわたって使用されてきた[174-177]。Cohenら[171]は、アカゲおよびヒトAChEのPEG化により、アカゲザルに投与された組換えアカゲおよびヒトAChEの平均滞留時間が大幅に増加したことを報告した。PEG化はまた、組換え四量体BChEの平均循環滞留時間を18.3時間から36.2時間に倍増させた[178]。循環時間のほぼ10倍の増加は、組換え単量体BChEをPEG化することによって得られた[179]。このように、PEGによるChEの改変は一般に循環時間の増加をもたらすが、PEG化されたタンパク質の後続投与により、抗体の発現および酵素活性のより迅速なクリアランスの報告がある[179,180]。
いくつかの研究では、有機リン系毒物に対する保護のためのBChE活性を増加させ、延長させるためのアプローチとして遺伝子導入を評価している。Chilukuriら[179,181]は、rHu-BChEをコードする組換えアデノウイルスで処理した(ivではなくipで処理した)BChE-/-マウスは、血中BChEレベルの上昇(野生型コントロールの約200倍)を示したが、処理後約5日後にピークを迎えたが、接種後10日目にはベースラインに戻っていたことを示した。血清中にはネイティブタンパクに対する抗体が検出された。同様のアプローチで、Parikhと共同研究者[182]は、有機リン系抗ChEsエホチオフェートおよびVX(O-エチル-S-2-N,N-ジイソプロピルアミノエチルメチルホスホノチオレート)の高用量(5-30倍のLD50)に対する血漿中BCHE活性および一過性の保護の最大3,400倍の増加を報告した。しかし、BChE活性は10日目までに再びベースラインに戻った。
バイオスカベンジャーとして有用な可能性のあるBCHEのナノフォーミュレーションが報告されている。Gaydessと共同研究者[183]は、約15 nmの推定直径を持つポリ-L-リジンとポリ(エチレングリコール)コポリマーとBCHEで作られたポリイオン性複合体を説明した。蛍光標識されたBChE-コポリマー複合体をマウスに注射したところ、少量のBChEが脳内に入ることが示された。2015年、Popeら[184]は、Gaydessら[183]の一般的なアプローチに従って合成された一連のBChE-コポリマー複合体について報告した。これらの複合体のサブセットは球状であり、直径の中央値は約35nmであった[185]。有機リン系抗CHEパラオキソンに対する試験管内試験感度、プロテアーゼおよび熱不活性化に対する耐性、およびパラオキソンに対する試験管内試験での「バイオスカベンジング」活性は、すべてネイティブBCHEと同等であった[184,185]。組換え二量体BChEもまた、CdSe/CdZnS量子ドットとコンジュゲートされている[186]。これらのコンジュゲートは酵素活性を部分的に保持し、パラオキソンに対して同様の感度を示した。Sokolovら[187]は、金ナノ粒子とコンジュゲートしたヒトBCHEは直径が約15nmであり、BCHE活性の興味深い増加を示したことを報告した。別の最近の研究では、ウシの血清BCHEを双性イオン性ポリマーゲル[188]でコーティングしたところ、熱やトリプシンによる不活性化に抵抗した直径15~30nmのナノ粒子が得られた。彼らはまた、遊離酵素と比較して循環時間が約3倍に増加し、重要なことに、繰り返し投与しても免疫感作を起こさないことを示した。Rahhalと同僚[189]は、1μmのBChE微粒子を生成するために金型にタンパク質の膜をラミネートし、馬のBChEの興味深い製剤を報告した。精製後、調製物は気腹によって投与され、気管内投与後の遊離酵素と同様のBCHE保持時間(48-72時間)であった。このような製剤の最適化は、有機リン系およびおそらく他の有害化学物質のためのバイオスカベンジャーのさらなる開発のために有望である。
ネイティブBChEがエステル型乱用薬物であるコカインの不活性化の主要な要因であることは以前から知られている[190]。しかし最近、一部の研究者は、BChEの突然変異がコカインの過剰摂取に有利に影響する程度までその機能を改善できるのではないかという考えを思いついた。酵素の活性部位におけるコカインドッキングのコンピュータベースのモデルの助けを借りて、この目標に近づくさまざまな研究室で急速な進歩が行われ、薬物結合と加水分解を改善するための予測に成功した[29]。現在、コカインの不活性化率を1000倍以上に高める、ほぼ最適に近いBChEバージョンが生成されている[191]。このようなコカイン加水分解型 BChE 変異体の外因性投与による有効性もまた、ネイティブ BChE よりも迅速に循環からクリアされるために苦しむ可能性がある。しかし、2つの変異型BCHEサブユニット間にジスルフィド結合を導入した部位特異的変異誘発により、ラットでは循環半減期が約2倍になることがわかった[192]。我々の手では、コカインヒドロラーゼで処理されたマウスとラットは、通常であれば1-2分以内に致死的になるであろうコカインの投与に対しては何の反応も示さなかった。対照的に、彼らは単に通常のケージサイドでの活動、食事、グルーミングを継続しただけで、ちょうど乗り物コントロールのように [72]。
非常に効果的なコカインヒドロラーゼの理論的重要性は、しばらくの間「クリーン」であった治療を求める中毒者が、弱い瞬間に「最後の一撃」で大幅に減少した薬物報酬を提供した後に再燃する可能性が低くなるということである。この効果を数ヶ月から数年の間維持するためには、最も有望なアプローチは、元使用者が毎日または毎週のように治療にとどまることを繰り返し決定する必要がないものであろう。私たちは、耐久性のある遺伝子導入のみがその要件を満たすことができると考えている。実際、このような薬剤を用いた我々の最近の研究では、遺伝子導入によって非常に高いレベルのBChEが、あからさまな障害を伴わずに生成され得ることが示されている。さらに、これらのレベルは、マウスからアカゲザルまでの実験動物において1年以上持続した(S. BrimijoinおよびM. Carroll、未発表データ)。
有機リン系バイオスカベンジャーまたはコカインヒドロラーゼとしてのBChEの安全性に関するいくつかの研究では、循環BChE活性が大量に増加しても、明らかな毒性の徴候は報告されていない。神経剤中毒またはコカイン乱用のいずれかの重症度は、循環 BChE レベルの長期にわたる大規模な増加による副作用の可能性のリスクを取ることを正当化するかもしれないが、グレリンの代謝における BChE の新たな役割が懸念されるかもしれない。BChEの長期的な上昇に伴うより微妙な生理的変化を評価するために、長期的な研究が行われるべきである。特筆すべきは、遺伝子改変されたBChEを高レベルで投与したマウスにおける情動行動の変化は、最初は戸惑ったが、攻撃性やストレス誘発性恐怖の減少など、非常にポジティブな効果をもたらしたことである [72,193,194]。
脳内AChEとBChEはともにアミロイド蛋白質に関連した老人斑に集中している。BChEの全身投与では中枢神経系での活性の増加は期待できないが、遺伝子導入のアプローチは実際に脳内での発現の増加につながるかもしれない。BChEがアミロイドの凝集やプラークの生成に何らかの役割を持っているとすれば、BCHEの発現量を増加させることでその活性が高まる可能性は非常に気になるところである。しかし、先に述べたように、メイヨーでは、アミロイドとタウタンパク質の脳プラークの早期形成と神経原線維のもつれの遺伝子を持つマウスを対象とした広範な、しかし未発表の研究では、脳のBChEレベルを何倍にも上げても病変の増加は見られなかった。
X. 結論
要約すると、AChEとBChEは動物界全体で進化した関連酵素である。複雑な生物は、主にAChEに依存した化学シグナル伝達経路を発達させていた。一方、これまでBChEの生理的な役割は不明瞭でした。実際、植物食品やエステル系薬剤に含まれる生理活性エステルの解毒以上の役割を持つ酵素であるというコンセンサスはなかったが、その状況は急速に変化してきている。多くの臨床疾患が、コリンエステラーゼ阻害剤の使用によって治療的に対処されてきた。一般に、コリン作動性シナプスにおけるアセチルコリン受容体の活性化の低下を伴う任意の状態は、コリンエステラーゼ阻害剤の適用によって部分的または完全に緩和され得る。このような状態には、神経筋障害、自律神経機能障害、およびアルツハイマー病が含まれる。すべての疾患は、AChEを阻害することによって回復することができるコリン作動性受容体活性化の欠乏を共有している。もちろん、これらの患者における過剰なAChE阻害は、治療から非選択的毒性につながる可能性がある。BChEの異常に低いレベルは、食物供給中のエステルの非効率的なクリアランスをもたらし、エステル系薬剤の不活性化を遅らせ、潜在的に毒性につながる可能性がある。さらに、最近の研究では、ペプチドホルモンであるグレリンのレベルと活性の調節における BChE の役割の可能性が指摘されており、グレリンのシグナル伝達の変化が BChE 活性に影響を与える外来物質の潜在的な結果であると考えられている。
2つのコリンエステラーゼ酵素、AChEとBChEは、神経筋機能、認知機能、感情機能に重要な影響を与える触媒特性を持っていると言っても良いように思われる。さらに、AChEとBChEは、タンパク質とタンパク質の相互作用に寄与する接着性などの特性を示し、アルツハイマー病のような障害にも潜在的な役割を果たしている。このため、AChEまたはBChEのタンパク質レベルまたはそれらの酵素活性のいずれかを操作することは、この疾患や他の神経変性疾患におけるタンパク質の毒性凝集に影響を与え、正の結果(治療)または負の結果(毒性)をもたらす可能性がある。これら2つのChEは、それぞれ数十年にわたって研究されてきたが、神経系の主要なシグナル伝達経路や機能との多元的な関係について、注目すべき新しい情報が次々と明らかになってきている。これらのCHEの触媒的または構造的特性のいずれかの変更は、多くの非常に重要な生理機能に関して、毒と治療の間の微妙なバランスをシフトさせる可能性があることが明らかになってきた。そして、これらの役割の範囲とパワーに関する発見が増えていることから、この知識を活用して毒性を回避しながら、幅広い病状の治療法の進歩を収穫することを期待している。