Contents
Cholinesterase inhibitors as Alzheimer’s therapeutics (Review)
www.spandidos-publications.com/10.3892/mmr.2019.10374

要旨
アルツハイマー病は、認知症の中で最も一般的な形態の一つである。アルツハイマー病は、認知機能や言語能力の低下を引き起こす中枢神経系の慢性的な症候群である。コリン作動性欠損はアルツハイマー病と関連しており、天然由来の阻害剤、合成類似体、ハイブリッドなど、様々なコリンエステラーゼ阻害剤がアルツハイマー病治療のために開発されている。現在、利用可能なアルツハイマー病治療薬は、主にコリンエステラーゼ阻害薬である。しかし、これらの薬剤は副作用を引き起こす可能性があり、病気の進行を完全に止めることができないため、その有効性は限られている。アルツハイマー病は多因子性疾患であることから、デュアル・マルチターゲット阻害薬が開発されている。本レビューでは、アルツハイマー病治療に用いられている阻害薬の臨床応用とその限界について考察する。さらに、本レビューでは、毒性が低く薬理活性が維持された新規薬剤の開発の現状と今後の方向性を示す。
序論
アルツハイマー病は認知症の60~70%を占め、全世界での発症数は2,430万人と推定されている。アルツハイマー病は、中枢神経系(中枢神経系)が進行性に悪化する慢性症候群である。アルツハイマー病は、意思決定、言語、記憶、学習、志向性、判断力などに進行性の障害を引き起こす(1)。アルツハイマー病の主な危険因子は加齢です(2)。しかし、身体的な運動は認知症の発症率を低下させる可能性がある(3)。
酵素コリンエステラーゼ(ChE)はアルツハイマー病の重要な治療標的である(4)。アルツハイマー病患者の認知機能低下の主な原因は、脳内のコリン作動性神経細胞の劣化と神経伝達の低下である(5)。
コリン作動性仮説(5)によると、アルツハイマー病の主な原因はアセチルコリン(ACh)合成の低下であるとされている。したがって、アセチルコリンエステラーゼ(AChE)の生物学的活性を阻害することにより、脳内のコリン作動性レベルを上昇させることが、潜在的な治療戦略の一つである。したがって、AChE阻害剤は、AChの分解を制限するために使用される。AChE阻害剤は、AChの濃度を高めることで神経細胞の機能を高めることができる(6)。
アミロイド前駆体タンパク質(APP)に由来するタンパク質分解断片であるβアミロイド(アミロイドβ)の進行性の合成および凝集は、アルツハイマー病発症に関与する追加の重要な因子である(7)。そのため、AchE活性とアミロイドβ凝集の両方を阻害するタクリンハイブリッド(8-10)とドネペジルベース(11)のデュアルインヒビターが開発されてきた。AChEとアミロイドβ切断酵素1の様々なデュアルインヒビターを設計するために計算科学的アプローチが用いられてきた(12)。
さらに、タオパシーはアルツハイマー病病態の重要な側面であり、τタンパク質の高リン酸化は、微小管関連タンパク質τの細胞内神経原線維のもつれの形成とそれに続く神経変性をもたらす(13,14)。τタンパク質を標的とした治療法は、τタンパク質の高リン酸化と凝集を抑制し、防止する(15-17)。現在、開発中のいくつかの薬剤が第III相臨床試験中であり、その中には、τホスファターゼを活性化したり、τキナーゼを阻害することでτリン酸化を阻害するメチルチオニウムも含まれている(18,19)。
アルツハイマー病は多因子性疾患であるため、研究者は、タンパク質のミスフォールディングやそれに伴うアミロイドβ凝集、τ凝集、金属代謝異常、酸化ストレス、AChレベルの低下など、アルツハイマー病に関与する複数の因子を阻害するマルチターゲット薬の開発に注目していた。しかし、マルチターゲットアルツハイマー病治療薬を同定するための研究はほとんど行われていない(20,21)。
アセチルコリンエステラーゼ
AChE(EC 3.1.1.1.7)(22)は、末梢神経系と中枢神経系を含むコリン作動性神経系に関与する重要な酵素である。AChEはAChの加水分解を触媒してコリンイオンと酢酸イオンを生成する(図1)。AChEの活性部位は大きな疎水性空洞である。AChEは2つのサブサイトから構成されている:i)エステル性サブサイト(ESおよびii)アニオン性基質結合サイト(AS)である。AChは中枢神経系に広く分布する神経伝達物質である。ASはAChの正に帯電した第4級アミンに結合し、他のカチオン性基質や阻害剤に結合することができる(22,23)。ESはSer200,Glu327,His440で構成される触媒トリアッドを含んでいる(24)。触媒三位一体は、酵素表面から〜20Å、塩基に向かって広がる狭い峡谷の底部に位置している。触媒三位一体の一部として、Ser200はプロトン移動によるコリンエステルの加水分解を担当している(22,23)。さらに、カチオン-π相互作用は、芳香族アミノ酸とAChの第4級アンモニウムの間に存在する(22)。
図1. AChEの触媒作用を模式的に表している。AChE、アセチルコリンエステラーゼ。
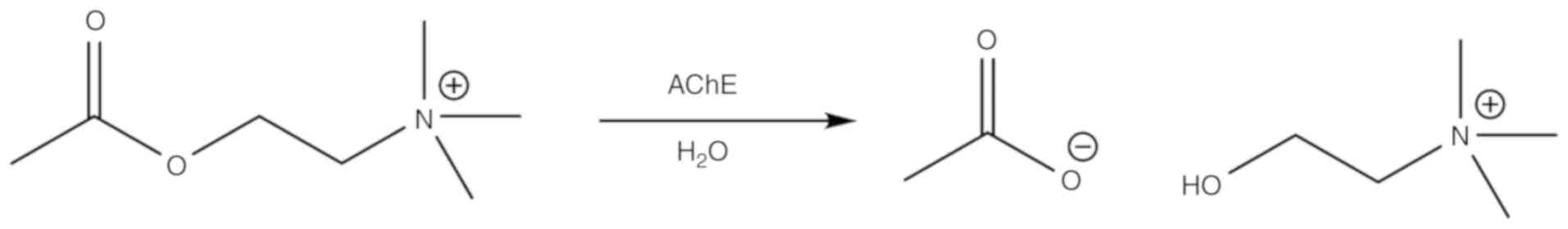
ACh結合タンパク質の原型である魚雷カリフォルニカAChE(TcAChE)の活性部位の特異的な構造的特徴は、多数の芳香族残基(~14アミノ酸)の存在からなる(25)。Trp84は、AChE-ACh相互作用にとって最も重要な芳香族アミノ酸であり、アラニンで置換されると反応性が3,000倍に低下する(26)。これらの部位に加えて、AChEは、基質特異性を付与する「アシルポケット」と、触媒中に負の酸素イオンと相互作用する「オキシアニオンホール」を有しており、AChEの触媒効率を高めている(27)。
従来のChE阻害剤
多くのChE阻害薬が開発されている(28,29)。ドネペジル、ガランタミン、リバスチグミン、メマンチンは、現在市販されているアルツハイマー病治療に用いられる4つの薬剤である(30-32)。しかし、これらの薬剤の有効性は限られており、これらの薬剤は様々な用量に関連した副作用、特に高用量での副作用を示している(28,29)。ガランタミンおよびドネペジルはAChE阻害剤である(28)が、リバスチグミンはAChEおよびブチリルコリンエステラーゼ(BChE)の両方の可逆的な阻害剤である。特筆すべきは、ドネペジルはBChEと比較してAChEに対して高い選択性を有することである。タクリン、ドネペジル、リバスチグミン、フィソスチグミンのAChE阻害力(IC50値)は、それぞれ77,6.7,4.3,0.67 nMである(29)。
ピスチグミン
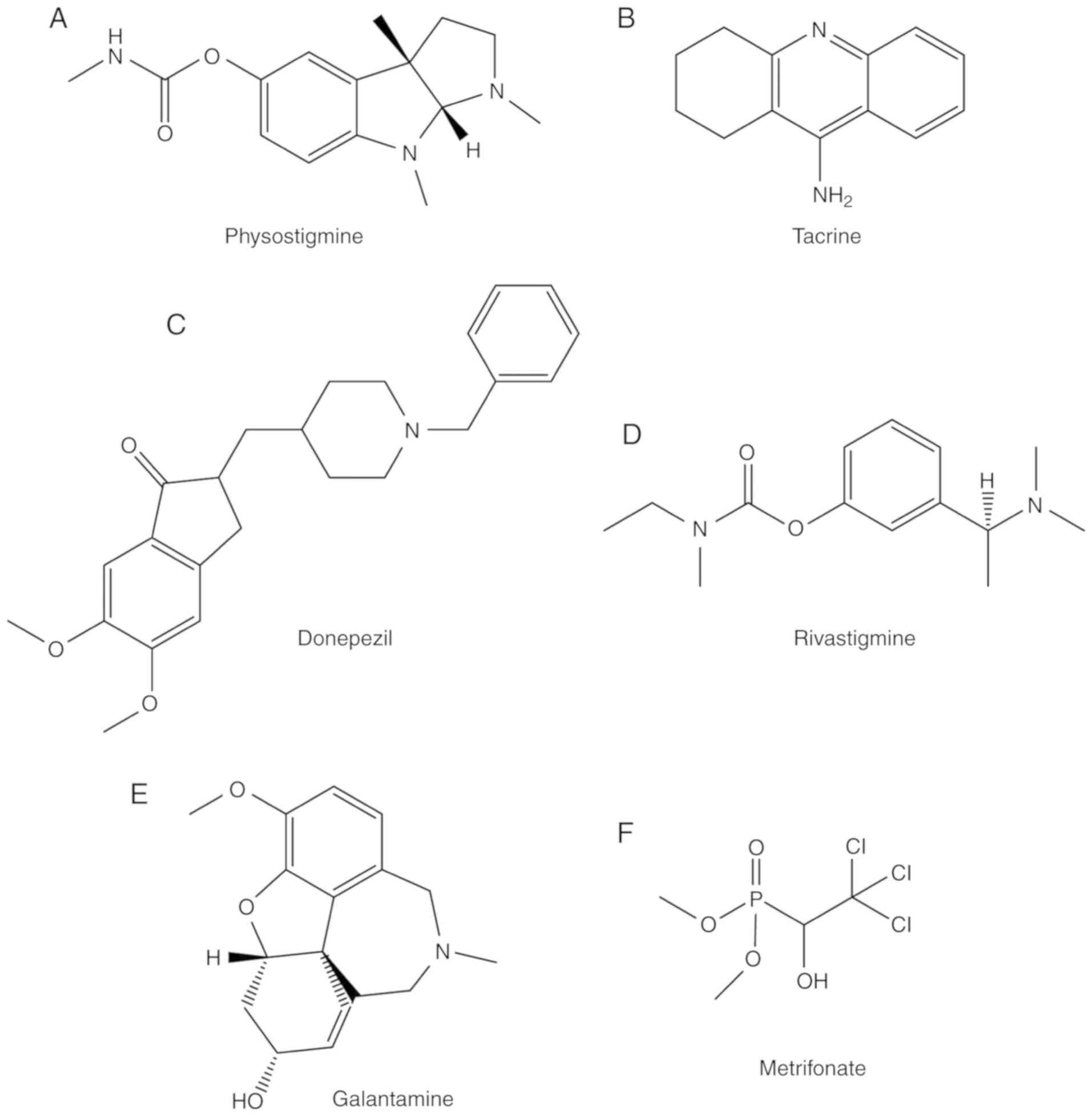
エセリンは、フィソスチグミンとしても知られており、1864年にカラバル豆から最初に単離された(33)、AChE阻害剤である(34)。ピスチスチグミンは血液脳関門(BBB)を通過することができるが、半減期が短く、多くの副作用があるため、この薬の治療指標は狭い(35)。一般的な副作用としては、下痢、胃痙攣、唾液の分泌量の増加、過度の発汗などがある(35)。これらの欠点のため、フィスチグミンはアルツハイマー病の治療のために承認されなかった。フィスチスチグミンの構造を図2Aに示す。
図2. 従来のコリンエステラーゼ阻害剤。(A)フィスチスチグミン、(B)タクリン、(C)ドネペジル、(D)リバスチグミン、(E)ガランタミンおよび(F)メトリホネートの分子構造が示されている。
タクリン
タクリンは1930年代に初めて合成され、もともとは筋弛緩拮抗薬と呼吸刺激薬として使用されていた(36)。タクリンは1980年代からアルツハイマー病患者に使用されており、1993年にFDAの承認を受け、2013年には使用を中止している。タクリンの分子構造を図2Bに示す。タクリンは、AChEの「アニオン性部位」に存在するアミノ酸残基Phe330とTrp84と相互作用する(37)。タクリンは、AChEおよびBChEの両方の有効な阻害剤である(38)。しかし、タクリンの使用は、吐き気、嘔吐、食欲不振、下痢および不器用さを含む多くの副作用のために制限されている(39)。さらに、タクリンで治療された患者は、この薬剤によって誘導される肝毒性のため、血液モニタリングを必要とする。さらに、タクリンの半減期が短いことや高用量での副作用があるため、治療効果を持続させるためには多剤併用が必要である(40)。タクリンは前述の副作用と肝毒性を理由に投与を中止した。
ドネペジル
ドネペジルは、1996年に軽度から中等度のアルツハイマー病治療薬として承認された(30)(図2C)。しかし、ドネペジルは不眠、吐き気、食欲不振、下痢、筋痙攣、筋力低下など様々な副作用を示する(41)。ドネペジルの高用量投与を受けた患者には、低血圧、重度の嘔吐、筋力低下、重度の吐き気、呼吸障害、徐脈などの症状が現れる(41)。ドネペジルは、ChE阻害作用に加えて、追加の作用機序を持つ可能性がある(42)。ドネペジルは、神経伝達物質レベルで作用するだけでなく、グルタミン酸誘発性興奮毒性の様々な側面の阻害、炎症性サイトカインの初期発現の減少、AChEの神経保護アイソフォームの誘導、酸化ストレス誘発作用の減少など、アルツハイマー病の発症に関与するほぼ全ての段階において、分子および細胞レベルでも作用する(42)。ドネペジルは、TcAChEの活性部位と末梢アニオン部位(PAS)を同時に阻害するというユニークな分子構造を示している(43)。しかし、ドネペジルはオキシアニオンホールや触媒三核と直接相互作用することはない(43)。
リバスチグミン
リバスチグミンは、2000年に軽度から中等度のアルツハイマー病の治療薬として承認された。また、パーキンソン病に伴う認知症の治療にも使用されている(44)。リバスチグミンの正確な作用機序は不明であるが、コリン作動性機能を高めることで薬理作用を発揮するのではないかとの仮説が立てられている(32)。リバスチグミン酒石酸塩は、BChEとAChEの両方を標的とする。リバスチグミン酒石酸塩はAChEに結合するカルバメートであり、このカルバメートはリバスチグミンを様々なフェノール誘導体に切断し、体内から急速に排泄される(45)。カルバメート部位は、ACh加水分解の際にAChのアセテート部位よりも高い親和性でAChEのESに結合する。したがって、酵素は一定時間不活性化される(45)。この効果は、その異常に遅い活性化動態を説明しているかもしれない(32)。リバスチグミンは、胃痛、体重減少、下痢、食欲不振、吐き気および嘔吐を含む主要な副作用を有する(46)。リバスチグミンの過剰摂取は、不規則な、速いまたは遅い呼吸、胸の痛み、遅いまたは不規則な心拍を含む多くの症状を引き起こす可能性がある(46)。リバスチグミンの構造を図2Dに示す。
ガランタミン
ガランタミンは、水仙の球根を含む多くの植物に含まれるアルカロイドである(47)。ガランタミンは、ロシアや東欧諸国では何十年も前から、筋萎縮症、筋無力症、中枢神経系に関連する感覚・運動障害の治療薬として使用されていた(48)。ガランタミンはニコチン性コリン作動性受容体に結合することも示されている。ChEに対するその活性は1950年代に確認された;Nivalinという名前で販売され、いくつかの神経疾患の治療に使用されている(49)。ガランタミンは2001年にアルツハイマー病の治療薬として承認された(31)。ガランタミンの化学構造を図2Eに示す。ガランタミンは、アルツハイマー病の認知症状の治療に有効であることが示されている。注目すべきことに、ガランタミンの用量を徐々に増加させると、この薬剤の忍容性が向上する可能性がある(50)。ガランタミンの主な副作用には、痙攣、重度の吐き気、胃痙攣、嘔吐、不規則な呼吸、錯乱、筋力低下および目の充血がある(51)。
メトリホネート
メトリホネート(図2F)は、長時間作用型の有機リン酸AChE阻害剤であり、統合失調症の治療に使用されている(52)。メトリホネートは、薬理学的に活性な代謝物である2,2,2-ジクロロビニルジメチルリン酸塩を介してコリン作動性神経伝達を改善することができ、アルツハイマー病の治療薬として試験されている(53)。メトリフォネートを1日1回投与すると、軽度から中等度のアルツハイマー病患者の認知機能を改善することができる(53)。メトリフォネートの忍容性は良好であるが、長期使用により神経筋伝達の問題や呼吸麻痺などの副作用が生じる(25)。そのため、第Ⅲ相臨床試験中に開発が中断された。
次世代のChE阻害剤
ChE阻害剤として、Phenserine、Tolserine、eserolineなどのPhysostigmine誘導体が開発されている。
フェンセリン
フェンセリンは、選択的で非競合的な AChE 阻害剤であり、AChE を阻害するだけでなく、試験管内試験 および 生体内試験 での APP の産生を減少させる (54)。さらに、フェンセリンの毒性は、タクリンやフィソスチグミンに比べて低くなっている(55)。特に、高齢の犬やラットでは、Phenserineの投与により記憶力や学習能力が向上することが示されている(54)。Phenserineはアルツハイマー病に対する臨床試験が行われたが、初期の第II相臨床試験では中程度の成功しか示されなかった(54)。
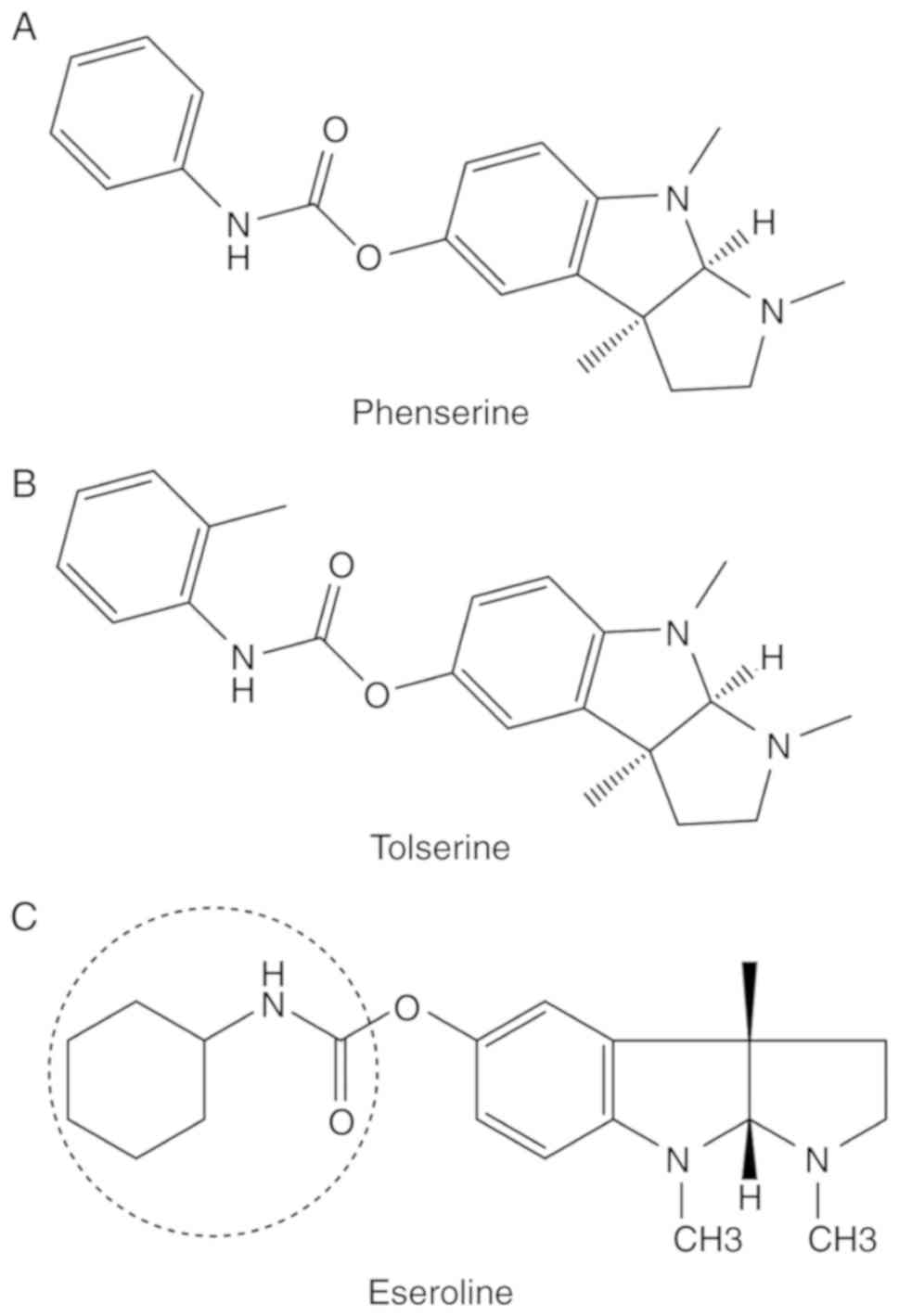
Phenserineは、その二重の抗アミロイドβおよび抗AChE作用により、アルツハイマー病治療のための新規戦略の開発に有望な薬剤であると考えられてた。しかし、2005年に、バイオ製薬会社のアクソニックス社は、縮小された2つの第III相臨床試験において、Phenserineは効果がなかったと発表した(56)。さらに、2010年には、以前の研究で、高用量のフェンセリンが軽度から中等度のアルツハイマー病患者の症状を改善する可能性があることが示された(57)。2016年には、Phenserineが臨床的な可能性を持つ非コリン作用も示すことが示された。フェンセリンは、マウスの外傷性脳損傷によって誘発される認知障害の治療に使用された(58)。特筆すべきは、臨床試験とそのメカニズムの研究が現在開発中であることである(59)。フェンセリンの構造を図3Aに示す。
図3.新規コリンエステラーゼ阻害剤。(A) phenserine、(B) tolserine、(C) eserolineの分子構造を示す。丸はエセロリンの活性部位を示す。
トルセリン
トルセリンの構造は、フェニルカルバモイル部位に2-メチル基が存在することで、フェンセリンとはわずかに異なっている(図3B)。2000年の前臨床研究では、トルセリンはヒトAChE(hAChE)に対してBChEの200倍の選択性があると結論づけられている。ヒト赤血球中のAChEに対するトルセリンの阻害濃度は0.01 µMである(60)。さらに、Ellman法を用いて30分間前処理した赤血球におけるヒトAChEに対する阻害濃度は0.0103 µMであった(61)。トルセリンのhAChEに対する効力は、フェンセリンやフィソスチグミンに比べて高い(62)。しかし、臨床モデルや前臨床モデルでの副作用や効果は明らかになっていない。
エセロリン
エセロリンはオピオイドアゴニストとして作用する(63)。1982年には、エセロリンがフィスチスチグミンの代謝物であることが示されたが、フィスチグミンとは対照的に、AChE阻害に対するエセロリンの効果は限定的で可逆的である(64)。様々なフィスチスチグミン類似体がChE阻害について分析されている(65)。エセロリンに由来するシクロアルキルカルバメート(図3C)は、BChEと比較して高い選択性でAChEに対して有効であることが判明した(65)。しかし、筆者の知る限りでは、最近の研究では、エセロリンの効果について報告されていない。
天然由来の阻害剤
フペルジン
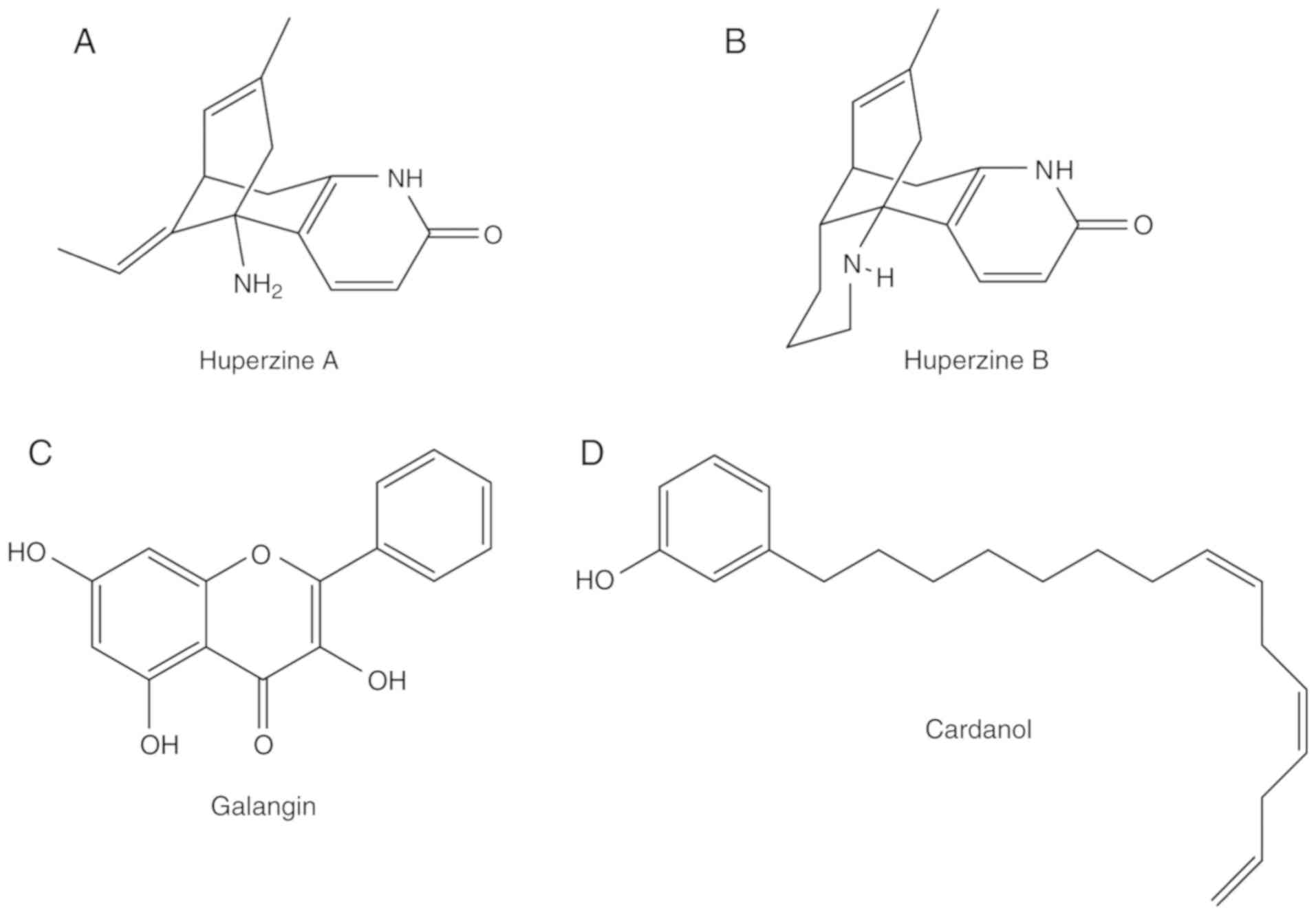
ハップはリコポディウムアルカロイドである。Hupは、ハーブのHuperzia serrata(66)から抽出・単離することができる。Hupには、合計で2種類のHupが存在する。Hup-AとHup-Bである(それぞれ図4AとB)。Hup-BはHup-Aの天然の同族体であり、AChのレベルを上昇させることから、アルツハイマー病や加齢に伴う記憶障害の治療や、記憶や学習の強化に用いられている(67)。Hup-Aはリバスチグミン、ガランタミン、タクリンよりも効果的である(67)。Hup-AはAChEの選択性が高く、強力な阻害剤である。しかし、BChEに対してはAChEに比べて活性が低い。タクリン-Hup-Aハイブリッドは、潜在的なAChE阻害効果を示している(67)。
図4. 天然由来のコリンエステラーゼ阻害剤。(A)フペルジンA、(B)フペルジンB、(C)ガランジン、(D)カルダノールの分子構造を示す。
Hup-AのプロドラッグであるZT-1はアルツハイマー病治療薬として開発中である。Hup-Aと-Bは共にAChEと同様の方法で相互作用する(68)。両方のHup分子は、π-πスタッキングを介してアニオン性部位と相互作用し、CH/π相互作用またはファンデルワールス力を介してTrp84およびPhe330と相互作用する(68)。Hupのα-ピリドン部位は、CH/π相互作用とH-結合を介してAChEの活性部位と相互作用する。Hupのカルボニル酸素はGly117のカルボニル酸素と反発する。その結果、Gly118とGly117の間のペプチド結合が反転する(68)。さらに、フリップしたペプチド平面構造は、Gly117の酸素とAla201およびGly119の窒素原子との間のH結合によって安定化される(68)。しかし、Hup-Aは、悪心、嘔吐、下痢などの軽度のコリン性副作用を引き起こす可能性がある(69)。
フラボノイド
フラボノイドは、そのフリーラジカル消去特性のために大きな関心を集めている。一連のフラボノイド化合物は、試験管内試験で効果的なAChE阻害活性を示している(70)。Alpiniae officinarumの根茎由来のフラボノールであるガランギンは、AChEに対して強力な阻害活性を示している(図4C)(70)。しかし、これらのフラボノイドの毒性については、前臨床試験および臨床試験では調査されておらず、ヒト試験も報告されていない。
カルダノール
2009年、Anacardium occidentaleから得られた様々な非イソプレノイド系フェノール性脂質がAChEに対する阻害活性について検討された(71)。特に、フェノール性脂質の一つであるカルダノールは有望な結果を示している(71)。また、カルダノールはカシューナッツの殻から抽出することができる(72)。しかし、その毒性については、前臨床試験や臨床試験ではまだ調査されていない。カルダノールの分子構造を図4Dに示す。
ハイブリッド阻害剤
ドネペジル-AP2238ハイブリッド
AP2238は二重結合部位を持つ最初に開発された薬剤であり、AChEの両方のアニオン性部位と相互作用することができる(73)。AP2238とドネペジルのAChEに対する活性は類似している。しかし、アミロイドβ媒介毒性の抑制効果はAP2238の方が高い(73)。そのため、一連のドネペジル-AP2238ハイブリッドが研究されてきた(74)。ドネペジル-AP2238ハイブリッドの構造を図5Aに示す。調査した22の化合物(74)のうち、2つの分子が強力な活性を示した。両方の化合物は、5つの炭素原子のアルキル鎖と、鎖の末端に存在するアミノ基を有しており、その結果、AChEのPASとの相互作用が増加している(74)。
図5.ハイブリッドコリンエステラーゼ阻害剤
(A)ドネペジル-AP2238,(B)ドネペジル-タクリン、(C)T6FAおよび(D)タクリン-ヒドロキシキノリンの分子構造が示されている。丸印はハイブリッドを形成している薬剤を示している。
ドネペジル-タクリンハイブリッド
Campsら(11)は、AChEの活性部位、末梢および中峡結合部位と同時に相互作用する一連のドネペジル-タクリンハイブリッドを設計した(図5B)。これらのハイブリッドは、AChE、BChE、およびAChEによって誘導されるアミロイドβ凝集を阻害することがわかった。ドネペジル-タクリンハイブリッドは、6-クロロタクリンとドネペジルのインダノン部位を組み合わせて合成され、親化合物に比べてhAChEの阻害効果が高いことがわかっている(11)。
タクリン-フェルラ酸(T6FA)ハイブリッド
T6FAハイブリッドは、タクリンと比較してより強力なAChE阻害効果を示し、同等のレベルでBChEを阻害している(図5C)。T6FAは、試験管内試験および生体内試験でアミロイドβを介したアルツハイマー病関連の病因を阻害する強力な活性を示している(75)。
タクリンと8-ヒドロキシキノリンのハイブリッド
タクリンと8-ヒドロキシキノリンのハイブリッドは、コリンエステラーゼを阻害し、レドックス活性金属と錯体を形成することでアミロイドβ凝集を減少させる薬剤である(図5D)。これらのハイブリッドは、タクリン単独よりもより効果的にAChEを阻害し、中枢神経系透過性の向上、低毒性、および抗酸化作用と銅錯形成作用を有することが示されている(38)。
L-モノアミン酸化酵素(MAO)(EC 1.4.3.4)は、モノアミンの酸化を触媒する(76,77)。最近では、強いBChE阻害能と中等度のhAChE阻害能を有し、抗MAO-A/B作用と抗酸化作用を有するマルチターゲット剤としてドネペジル-クロモン-メラトニンハイブリッドが開発されている(78)。さらに、タクリン-アクリジンハイブリッドは、アルツハイマー病治療のためのマルチターゲット剤として開発されている(79)。さらに、タクリン-炭水化物(80)とタクリン-T6FA(81)のハイブリッドは、強力なChE阻害能を示している。
合成類似体
目標とする薬理学的開発により消化管副作用や肝毒性を回避できることから、競争力のあるChE阻害薬として合成類似体が開発されてきた(82)。しかし、合成類似体はBBBを透過しない可能性があり、天然由来のChE阻害剤と比較して効果が低くなることが主な問題点である(83)。
タクリン類似体
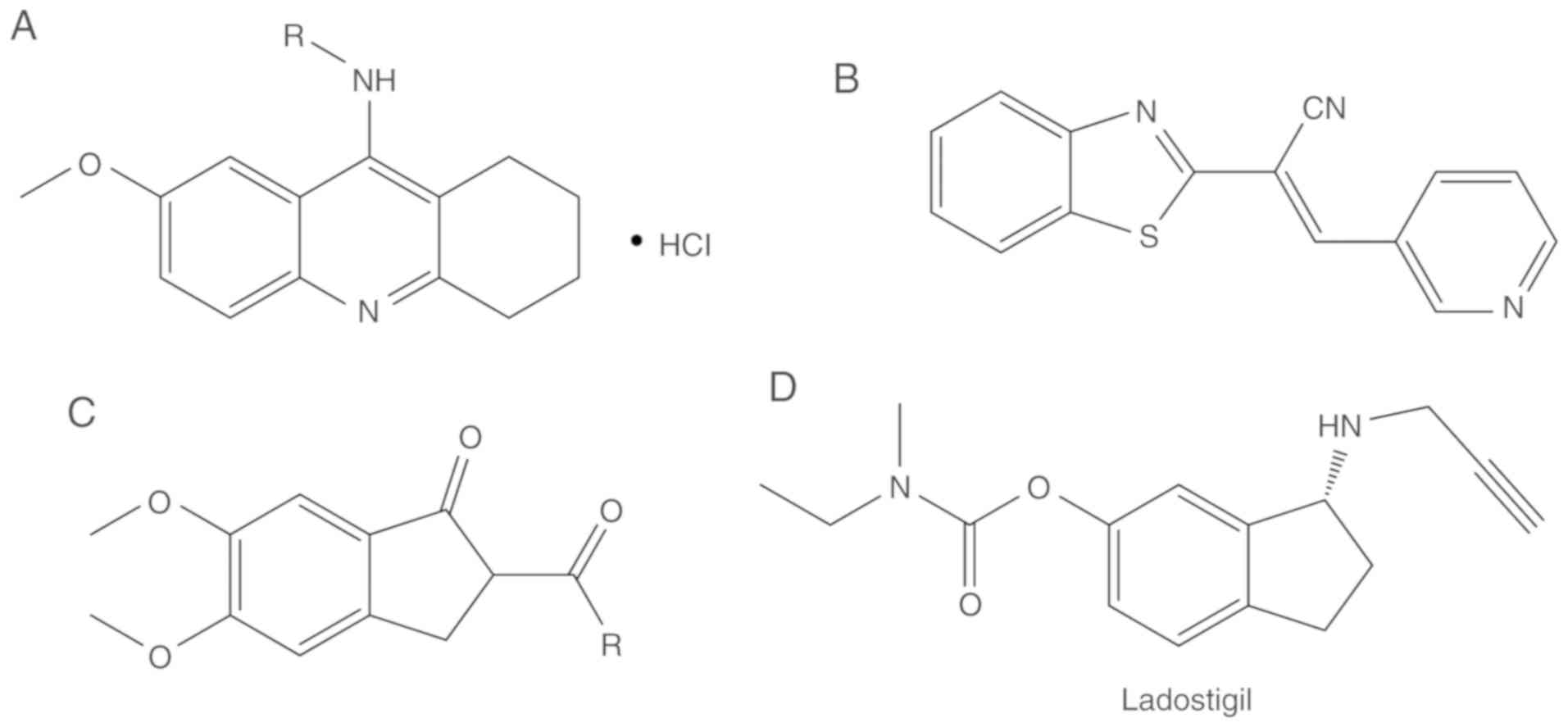
タクリンのアナログであるN-アルキル-7-メトキシタクリン塩酸塩(図6A)は、親薬タクリン(84)と比較して改善されたAChE阻害活性を示した。
図6. コリンエステラーゼ阻害剤の合成アナログ

A)タクリン類似体、(B)ヘテロアリルアクリロニトリル誘導体、(C)インデニル誘導体および(D)ラドスチギル。
E)-2(ベンゾ[d]チアゾール-2-イル)-3-ヘテロアリールアリアクリロニトリル誘導体
(E)-2(ベンゾ[d]チアゾール-2-イル)-3-ヘテロアリールアリアクリロニトリルは、2012 年から AChE 阻害剤として開発されている(図 6B)(84)。その中で最も強力な化合物は、ガランタミンよりもAChEに対する選択性が高いことがわかった。
インデニル誘導体
フェニル-5,6-ジメトキシ-1-オキソ-2,3-ジヒドロ-1H-2-インデニルメタノンの様々な類似体が2009年にAliらによって合成され、試験された(83)。それらのほとんどは中等度のAChE阻害作用を示した。Aliら(83)は、フェニル環上のメトキシ基の存在がAChEの阻害を有意に改善することを示唆した(図6C)。
ラドスチギル
ラドスチギルは、AChE阻害作用と神経保護作用を有する強力な抗アルツハイマー病薬である(図6D)。ラドスチギル[(N-プロパルギル-(3R)アミノインダン-5yl)-カルバミン酸エチルメチル]]は第IIb相試験中である(85)。
最近では、1,2,4-トリアジン足場(86)や1,2,3-トリアゾール-クロメノンカルボキサミド誘導体(87)がアルツハイマー病治療のマルチターゲット治療薬として開発されている。カルコン誘導体は、ChE阻害性を示している(88)。クロモン系足場は、ChEとMAOの二重阻害性を示している(89)。様々なドネペジルベースの多機能ChE阻害剤がアルツハイマー病治療のために開発されている(90)。
今後の方向性
最初のAchE阻害剤であるフィソスチグミン(30)が発見されて以来、より効果的な阻害剤を特定するために多くの研究が行われてきた。従来の阻害剤は天然由来の薬剤である。その他の阻害剤には、従来の阻害剤の類似体、天然化合物の誘導体、合成阻害剤のハイブリッドなどがある。これらの阻害剤は、従来の薬剤よりもマイルドな副作用を引き起こし、BBB透過性の改善や効果の増大などの改善された特性を有している可能性がある(11,67)。さらに、これらの化合物は、アルツハイマー病の進行を制限することができる。最近の報告では、AChE阻害が研究されているが(80,88,90)、ヒトで試験されているのは少数の新規薬剤のみである(18,60-62,78)。これらの阻害剤のほとんどは、動物モデル、または試験管内試験およびin silicoモデルを用いて研究されている。したがって、これらの薬剤の安全性、有効性および毒性を調べるために、ヒトでのさらなる研究が必要である。
AChE阻害薬は、アルツハイマー病の進行を完全に止めることはできず、臨床試験に至った様々なシングルターゲット薬は、アルツハイマー病を効果的に治療することができないでした。したがって、AChレベルの低下、タンパク質のミスフォールディングおよびそれに伴うアミロイドβ凝集、τタンパク質の高リン酸化、金属代謝異常および酸化ストレスを含むアルツハイマー病のすべての症状を標的とすることができる多機能性薬剤の開発が必要とされている。しかしながら、マルチターゲット薬の開発に焦点を当てた研究は限られた数しかない(79,81,89)。
構造-活性関係の研究によれば、新規な強力なマルチターゲット阻害剤の設計は、以下の特徴を有するべきである。i)正電荷を有する窒素原子の存在(91);2)窒素原子に結合したアルキル鎖の大きさが小さく、例えばメチル基(92);3)エステルのような水素結合を形成できる酸素原子の存在(93);4)ヒドロキシル基やメトキシ基のような電子供与性基の存在(83);およびv)窒素原子と酸素原子との間に炭素数2個の単位が存在すること(91)である。特筆すべきは、分子が大きいと活性が低下する可能性があるため、分子の全体的な大きさは小さいことである(94)。
結論
今回のレビューでは、アルツハイマー病治療のために開発されてきたChEおよびAChE阻害剤の概要が示された。これらの阻害剤には、天然由来の阻害剤、合成類似体、ハイブリッドなどがある。ChE阻害薬はアルツハイマー病を完治させるものではないが、これらの薬剤はアルツハイマー病患者の神経変性を制限するために推奨されている。現在のChE阻害薬はいくつかの副作用を引き起こす可能性があるため、異なる構造と作用機序を持つ新規な薬剤の開発が必要とされている。アルツハイマー病は多因子疾患であるため、マルチターゲット阻害剤の開発が必要である。したがって、今後のアプローチは、アルツハイマー病に関与する複数の因子を標的とすることができる単一分子の開発に焦点を当てるべきである。筆者の知る限りでは、このアプローチを用いた研究は限られた数しかない。マルチターゲット薬剤の開発は、分子モデリングや分子ドッキングなどの計算機的アプローチを使用することによって達成することができる挑戦的な作業である(95)。これらの方法は、新規阻害剤の設計に役立つ洞察を提供し、開発の時間とコストを削減することができる。本レビューは、薬理化学者や製薬業界にとって、アルツハイマー病治療のための新薬の設計と開発に役立つかもしれない。
