Contents
Cerebral Fructose Metabolism as a Potential Mechanism Driving Alzheimer’s Disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC7516162/
要旨
アルツハイマー病における認知機能の低下は、神経原線維のもつれ、アミロイド沈着、ニューロンコミュニケーションの喪失と病理学的に関連している。脳内インスリン抵抗性とミトコンドリア機能不全は、脳内フルクトース代謝がアルツハイマー病の重要な経路であるという仮説を支持する病因への重要な貢献者として浮上している。
フルクトースは、アデノシン一リン酸の尿酸への分解に伴って細胞内のエネルギーを低下させ、飢餓から動物を守る生存経路を活性化する栄養素である。果糖代謝によるエネルギー低下は、ミトコンドリア機能の低下、解糖刺激、インスリン抵抗性の誘導などにより、エネルギーと酸素の必要量を減少させながら、採食と食物摂取を刺激する。
果糖の過剰摂取などで果糖代謝が全身的に過剰に活性化されると、肥満や糖尿病の原因となる。ここでは、アルツハイマー病は、フルクトースの供給源の大部分が脳内産生によるものである脳内フルクトース代謝の過剰活性化によって引き起こされている可能性があることを示している。
このように、ミトコンドリアのエネルギー産生の低下は、神経細胞の解糖が不十分であることによって妨げられ、その結果、神経細胞が機能的かつ生存可能な状態を維持するために必要な脳エネルギーレベルが徐々に失われることになる。
本質的には、アルツハイマー病は、フルクトースが脳代謝と神経細胞の機能を阻害する食生活の変化によって引き起こされる現代病であると提案している。脳内フルクトース代謝を阻害することは、この病気の予防と治療のための新たな方法を提供する可能性がある。
キーワード
果糖、糖、尿酸、フルクトキナーゼ、AMPデアミナーゼ、ミトコンドリア
序論
アルツハイマー病は、米国における死因の第6位である。認知症の有病率は今後20年で倍増し、世界で8,100万人が罹患すると予測されている(Rizzi er al)。 したがって、アルツハイマー病の原因を特定し、効果的な治療法を確立することが急務となっている。
アルツハイマー病は、高リン酸化タウ蛋白質とアミロイドβペプチドを含む脳外βアミロイド斑からなる神経原線維のもつれを伴う脳萎縮および白質変性を伴う認知症と定義されている。アルツハイマー病は、アミロイドプラークが神経機能を変化させる作用を媒介しているという仮説が有力である(アミロイドカスケード仮説)。しかしながら、アミロイド形成の防止および/またはアミロイド沈着物の分解に焦点を当てたいくつかの臨床試験の結果は、期待外れのものであった(Anderson et al 2017;Morris et al 2018)。アミロイドカスケード仮説は否定されていないが、他の仮説として、脳内インスリン抵抗性およびグルコース低代謝の役割(Neth and Craft, 2017)神経炎症(組織変性部位での高いサイトカインレベルによって特徴づけられる)シナプス機能障害、および脳内ATPレベルの変化を伴うミトコンドリア機能障害の役割(Demetrius et al 2017; de la Monte, 2018)などが注目されている(Demetrius et al 2017; de la Monte, 2018)。2014; de la Monte, 2017; Cenini and Voos, 2019)。) また、アルツハイマー病が肥満や糖尿病、欧米型の食生活と関連している可能性があるという証拠もある(Arvanitakis et al 2004;Gomez-Pinilla and Yang 2018)。しかし、肥満と糖尿病はアルツハイマー病の危険因子であるが(Arnold et al 2018)アルツハイマー病はこれらの条件がなくても発症する可能性がある。したがって、アルツハイマー病の発症のための統一的なメカニズムは謎に包まれたままであった。
ここでは、脳内果糖代謝がアルツハイマー病の重要な要因である可能性を提案することで、先行する仮説をまとめる統一的な仮説を提示する。この仮説がどのようにして既知の危険因子を説明できるのか、そしてどのようにしてアルツハイマー病の病態生理を説明できるのか、その証拠を提示する。この仮説を理解するために、まずフルクトース代謝の理解における最近のブレークスルーをレビューし、それをアルツハイマー病の発症に関連付ける。
果糖代謝の最近の知見
私たちの食生活に存在する2つの主要な単純な糖質は、ブドウ糖と果糖である。ブドウ糖のポリマーはデンプンを構成し、パン、米、ジャガイモなどの高グリセミック炭水化物の主成分である。フルクトース、または果糖は、果物や蜂蜜に存在する主な砂糖である。私たちの食事療法の2つの一般的な追加甘味料は、ショ糖(テーブルシュガー)と高果糖コーンシロップ(HFCS)である。これらの甘味料の両方とも、グルコースとフルクトースが含まれており、グルコースとフルクトースは、ショ糖の二糖類として結合し、両方の異なる比率(通常55:45フルクトース:グルコース)のHFCSの単糖類として混合されている。一緒に、砂糖とHFCSの摂取量は、西洋の食事で摂取された総カロリーの15%を構成するが、異なる集団の総カロリーの25%に達する可能性がある(Yang et al 2014)。これらの甘味料はまた、スーパーマーケットの加工食品の70%に存在している(Ng et al 2012)。
フルクトースの生物学的効果はグルコースとは異なる
重要な洞察は、生物学的機能の違いに変換するグルコースおよびフルクトース代謝のユニークな違いの発見である。グルコースがほとんどの栄養素と同様にエネルギー産生燃料として作用するのに対し、フルクトースはエネルギーを蓄える燃料として使用されているように見える(Johnson er al)。 フルクトースのこの特徴は、細胞内でエネルギー(アデノシン三リン酸;ATP)を減少させるそのユニークな代謝に起因する(Maenpaaa et al 1968;van den berghe et al 1977)。メカニズムは、細胞内のリン酸塩およびATPレベルが低下するように急速にフルクトース-1-リン酸にフルクトースをリン酸化する特定の酵素、フルクトキナーゼC(別名ケトヘキソキナーゼC、またはKHK-Cとして知られている)によって媒介されている。ターンでは、低細胞内リン酸は、イノシン一リン酸(IMP)と最終的には尿酸(図1)にAMPの段階的な分解で、その結果、アデノシン一リン酸(AMP)デアミナーゼを活性化する。AMPデアミナーゼ2(AMPD2)の活性化は、AMPの除去をもたらし、それによってATPレベルを補充する細胞の能力を低下させ、一方、AMP活性化プロテインキナーゼ(AMPK)を阻害する尿酸の産生を刺激し、それによってATP生成を減少させる(Lanaspa et al 2012a; Cicerchi et al 2014)。肝内ATPレベルを減少させ、細胞内および血清尿酸レベルを増加させる果糖の能力は、清涼飲料水の摂取に伴って生じる(Le et al 2012; Bawden et al 2016)。対照的に、他の主要な食物群(グルコース、タンパク質、および脂肪)は、細胞内のエネルギーレベルを増加させるように作用する。
図1 フルクトースによって誘導されるプリン体分解経路
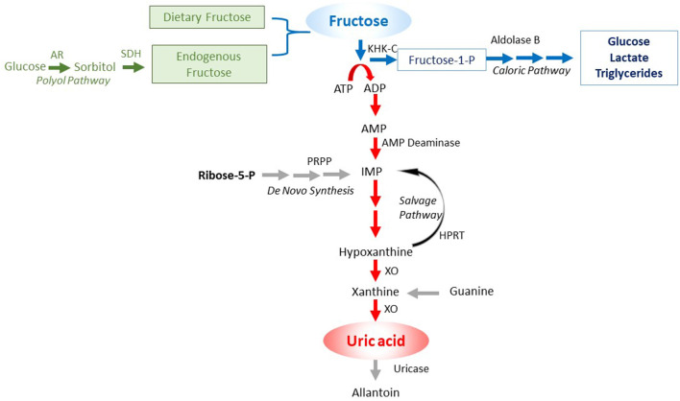
フルクトースは、食事から来るか、またはポリオール経路によって内因性に産生され得る。ターンでは、フルクトキナーゼC(KHK-C)によるフルクトースの代謝は、最終的に尿酸の生産につながるAMPデアミナーゼ(AMPD)の活性化をもたらし、細胞内リン酸の枯渇を伴うATPの消費につながる可能性がある。キー:緑色は果糖の供給源、青色は果糖代謝のカロリー経路、赤色は生存経路を活性化するヌクレオチド分解が関与する経路を示している。
尿酸の生成に伴う細胞内ATPレベルの低下は、マイトジェン活性化プロテインキナーゼ(MAPK)およびニコチンアミドアデニンジヌクレオチドリン酸(NADPH)オキシダーゼ(Maenpaa et al 1968; Kang et al 2002; Lanaspa et al 2012b; Sanchez-Lozada et al 2012)を含む様々なアラームシグナルを活性化する。細胞内酸化ストレスのバーストが、特にミトコンドリアで発生する(Lanaspa et al 2012a)。果糖は、Nrf2-Keap1抗酸化経路を阻害することにより、この効果を拡大する(García-Arroyo et al 2019a)。脂肪酸β酸化の遮断(エノイルCoAヒドラターゼの阻害による)および解糖へのシフトを伴うミトコンドリア機能の低下が起こる(Lanaspa et al 2012b; Softic et al 2019)。ミトコンドリア酵素であるアコニターゼ-2が阻害され、クエン酸塩蓄積につながり、それが細胞質に通過し、そこで脂質生成を刺激する。ミトコンドリアの機能不全を増強する乳酸生成が起こる(San-Millán and Brooks, 2017)。その結果、総エネルギー産生は低い状態に留まり、エネルギーの多くは好気性解糖によって産生される(Warburg効果;中川 et al 2020)。これは、細胞内ATPレベルの低下と協調して、細胞が低エネルギー状態を維持するのに役立つ。
エネルギー枯渇に関連する多くの生物学的効果は、細胞内尿酸の生成によって、部分的に、媒介される。尿酸は、細胞外環境では抗酸化剤でありながら、細胞内環境ではプロ炎症性であり、p38 MAPキナーゼおよびNF-κBを活性化し、NADPHオキシダーゼ誘導酸化ストレスを誘導し、化学戦術因子、血管収縮物質(レニン-アンジオテンシン系)および成長因子の産生を刺激する(Johnson et al 2013)。尿酸はまた、いくつかのメカニズムを介して内皮一酸化窒素のバイオアベイラビリティーを低下させる。フルクトースの生物学に関しては、ミトコンドリアの酸化ストレス、インスリン抵抗性の誘導、およびAMPKの阻害は、すべて尿酸に部分的に依存している(中川 et al 2006; Lanaspa et al 2012b; Cicerchi et al 2014)。
細胞内のエネルギーを低下させるフルクトース代謝の能力は、フルクトキナーゼC(KHK-C)とフルクトースの両方の存在を必要とする。果糖は、食事、特に砂糖およびHFCSを含む食品から得られることがある。しかしながら、フルクトースはまた、アルドース還元酵素(アルドース還元酵素)-ソルビトールデヒドロゲナーゼ(SDH)経路(ポリオール経路)の活性化によって組織内で生成され、これはグルコースを(アルドース還元酵素を介して)ソルビトールに変換し、次いでSDHによってソルビトールをフルクトースに変換する(表1)。律速酵素はアルドース還元酵素であるが、虚血、高オスモラリティ、アルコール、高血糖、フルクトースや尿酸そのものを含む様々な機序で誘導される(Johnson er al)。 また、加齢に伴い、脳や他の臓器でもアルドース還元酵素が誘導され、アルドース還元酵素活性が増加する(Cao Danh et al 1984;Kwee et al 1991)。果糖を含まない特定の食品もまた、アルドース還元酵素を活性化し、高血糖の炭水化物、塩分の多い食品、およびアルコールを含む内因性果糖産生を刺激する(Lanaspa et al 2013,2018;Wang et al 2020)。
表1 食事性果糖と内因性果糖のソース
| 食餌性果糖 |
| 蜂蜜と果物 |
| 甘味料(ショ糖、HFCS)を追加 |
| 内因性フルクトース(アルドースレダクターゼの誘導が必要) |
| 食品 |
| 高グリセミック炭水化物(ブドウ糖、でんぷん、じゃがいも、米、パン) |
| 塩辛い食べ物 |
| 虚血または低酸素症 |
| 組織損傷(外傷、血管損傷) |
| 高浸透圧 |
| 脱水 |
| 高尿酸血症 |
| エージング |
また、KHK-Cという酵素も調節されている。正常な条件下では、KHK-Cは主に小腸腸管上皮、肝細胞、および腎臓近位管細胞に存在するが、膵島、脂肪細胞、血管内皮、および脳(海馬および視床下部を含む;Diggle et al 2009;Oppelt et al 2017;Song et al 2017)にも存在する。KHK-C発現は、果糖または高尿酸レベルによって増強される(Roncal-Jimenez et al 2011;Lanaspa et al 2012c)。KHK-Cは、心臓などの虚血性組織においても誘導され得る(Mirtschink et al 2015)。
まとめると、果糖は単に食事から入ってくるだけではなく、体内でも生産されており、果糖を代謝する能力が調節されていることがわかる。
果糖代謝は進化に基づく生存経路を活性化する
飢餓状態にある動物は、脂肪貯蔵量が枯渇すると、生存を助けるために行動的・代謝的変化を起こす。これには、採食行動、エネルギー生産の低下、インスリン抵抗性の発達(筋肉内でのグルコースの取り込みを減少させ、それによって脳への取り込みを優先させる)などが含まれる(Koffler and Kisch, 1996; Cahill, 2006)。飢餓を回避するために、動物は冬眠前や長距離移動、営巣前などの食糧不足に備えて脂肪を蓄えている。多くの動物によって使用される1つのアプローチは、細胞内のエネルギーの低下が飢餓と同じ行動および代謝効果を誘発し、それによって脂肪を貯蔵するため果物や蜂蜜などの果糖を豊富に含む食品を摂取することは、宿主のための警報信号として作用する(Johnson et al 2013,2020)。
果糖代謝は、いくつかの生存経路を刺激する(図2)。
図2 果糖の生理的・病理学的効果
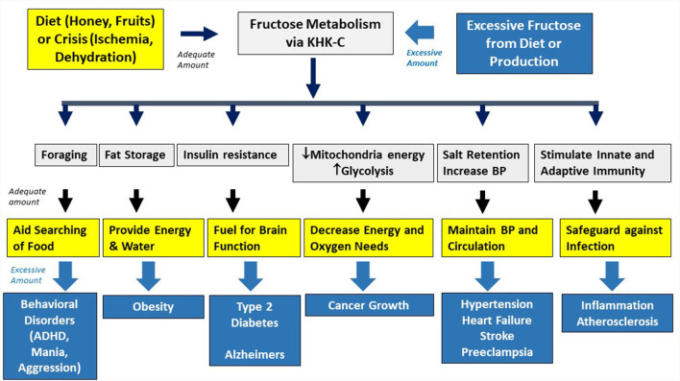
果糖は自然界では生得的な生存経路として利用されており、動物を食料や水不足から守る役割を果たしている。一方、果糖を含む糖類を過剰に摂取すると、この経路が過剰に活性化され、様々な代謝障害を引き起こす。
採食と空腹時の行動
マウスは、一般的に、それが慢性的に与えられる場合には、フルクトースよりもグルコースを好むが、砂糖が断続的に与えられる場合には、フルクトースは、より強い空腹反応を引き起こす(Rorabaugh et al 2015)。これは、側視床下部からのオレキシンの放出によって媒介される空腹反応と関連しており、グルコースで観察されるものとは異なる(Rorabaugh et al 2014)。このメカニズムは、視床下部におけるATPの枯渇を伴う可能性がある(Lane and Cha, 2009)。時間の経過とともに、動物は、脂肪の酸化を減少させながら、過剰な食物摂取を駆動するレプチン抵抗性を開発する(Shapiro et al 2008)。果糖はまた、尿中の水分保持をもたらすバソプレシンの産生を刺激する(Song et al 2017);しかしながら、保持された水は、細胞外空間から細胞内を通過し、新たに作られたグリコーゲンと結合する可能性が高く、その結果、継続的な渇きをもたらす(Johnson et al 2020)。尿酸へのATPの分解はまた、運動量の増加(Barrera et al 1989)探索行動、および衝動性(Sutin et al 2014)食物および水を求めて採餌するときに必要とされるすべての機能に役割を果たしている可能性がある(Robin et al 1998)。
ヒトを対象とした研究では、これらの知見がほぼ確認されている。フルクトースの投与は、グルコースよりも空腹感や甘いものへの欲求が強くなる結果、注意や報酬中枢に独特の影響を与え(Luo et al 2015)血中酸素濃度依存性(BOLD)MRIによる行動の制御に関与する皮質活動の低下と関連している(Purnell et al 2011)。
脂肪貯蔵量の増加
飢餓、渇き、および採食を刺激することに加えて、果糖は、肝臓、血液(トリグリセリド)および脂肪組織を含む脂肪の貯蔵を優先的に増加させ、それにより、貯蔵エネルギーだけでなく、必要な時に代謝水を提供する(Johnson et al 2016)。主なメカニズムは、脂質生成(アコニターゼの遮断から)および還元β脂肪酸酸化(エノイルCoAヒドラターゼの遮断から)をもたらすミトコンドリア酸化ストレスの誘導であるように思われる(Lanaspa et al 2012a,b; Softic et al 2019)。
低酸素からの保護
フルクトースによるミトコンドリア機能から解糖への切り替えは、酸素需要を最小限に抑え、エネルギー需要を減らすことで保護する。内因性に産生されるフルクトースは、裸のモグララットの低酸素の巣穴での生存の鍵を握っており(Park et al 2017)また、多くの種(ヒトを含む)の胎盤によっても産生されており、ここでは、血液供給が確立される前に発育中の胎児を保護する可能性がある(Jauniaux et al 2005)。
血圧の維持と炎症性経路の活性化
フルクトースはまた、血圧に影響を与え、おそらくバソプレシン、レニン-アンジオテンシン系、および他の血管収縮経路の活性化によって部分的に媒介されている。果糖はまた、近位尿細管におけるナトリウムの再吸収を刺激する(Cabral et al 2014)。果糖によって生成された尿酸は、内皮一酸化窒素を減少させ、酸化ストレスを刺激し、レニン-アンジオテンシン系を活性化することによって血圧応答を増加させる(Sanchez-Lozada et al 2020)。尿酸によって媒介されると思われる自然免疫の非常に活発な刺激もある(Joosten et al 2020)。これらはすべて、極限状態での生存を助けるための保護システムである。
脳の保護
インスリン抵抗性も発現し、骨格筋によるグルコースの取り込みを減少させ、それによって脳による優先的な取り込みをもたらす。
フルクトースは、食事から、または内因性に生産されたもののいずれかであり、多くの種が生存を助けるために使用されている(Johnson et al 2020)。興味あることに、この経路を強化し得る変異が、ヒトを含む様々な種で発生している(Johnson and Andrews, 2015)。一つの変異は、ウリカーゼ遺伝子に関与していた。ウリカーゼは、尿酸をアラントインに分解する酵素であり、ほとんどの哺乳類が尿酸値を調節する主要な方法である。私たちの初期の祖先はまた、ウリカーゼを持っていたが、彼らは主に果物を食べて生活していたので、彼らはまだ彼らが必要とする主要なエネルギーを提供するのに十分な果糖を食べることができた。しかし、残念なことに、中新世の時代には、世界的な冷え込みがあり、特に涼しい時期には果物が不足し、多くの類人猿が飢えて絶滅してしまった。この時期にウリカーゼの突然変異が起こり、果糖代謝の際の尿酸反応が増幅された。これは、果糖に反応して脂肪の貯蔵を高めることで、生存に有利な状態をもたらしたのである。すべてのヒトに存在するこの突然変異は、他のほとんどの哺乳類と比較して、フルクトースに対する我々の代謝応答を増幅させる(Johnson and Andrews, 2015)。
果糖とメタボリックシンドローム
ほとんどの狩猟採集者の食生活の設定では、果糖の摂取は果物と蜂蜜に限定され、肥満になり、メタボリックシンドロームはまれである。血清尿酸値も低い傾向にあり、血圧は正常範囲にある(Johnson et al 2005)。このような条件下では、果糖の摂取量は比較的少なく、生存経路が利用され、肥満の原因となるよりも飢餓から身を守るために利用される。果物やハチミツには、神経保護能力を持つフラボノイドなどの他の栄養素が含まれていることは注目に値する(Gomez-Pinilla and Nguyen, 2012)。
しかし、砂糖やHFCSの摂取量の著しい増加は、この経路を過剰かつ慢性的に活性化させ、メタボリックシンドローム、肥満、糖尿病のリスクを高める結果となっている(図2;Johnson et al 2013)。急速な摂取と相まって高フルクトース含有量が、より深遠な細胞内エネルギー枯渇をもたらし得る肝臓での高濃度につながるため、清涼飲料水などの液糖では特にリスクが高い(Sundborn et al 2019)。食事性果糖は主要な供給源であるが、高血糖炭水化物および高塩食への応答など、果糖の内因性産生もまた、メタボリックシンドロームを駆動する可能性がある(Lanaspa et al 2013,2018)。また、過剰な果糖が高血圧(Jalal et al 2010年)全身性炎症(Cox et al 2011年)および癌の転移および増殖のリスクを増加させるという証拠もある(Goncalves et al 2019;中川 et al 2020)。
時間の経過とともに、慢性的なミトコンドリア酸化ストレスは、損傷したミトコンドリアの蓄積および機能的なミトコンドリアの減少を伴うマイトファジーの障害を引き起こし(Shefa et al 2019)それにより、全体的なエネルギー産生および代謝に影響を与え、解糖への依存度の増加を引き起こす。低果糖食または低塩食はミトコンドリア数の回復を助けることができるが(Hernandez-Rios et al 2013年)解糖補償の障害などでエネルギーレベルが維持できない場合、細胞死が生じる可能性がある。慢性的なミトコンドリア酸化ストレスもまた、老化プロセスおよび老化関連疾患に役割を持っている可能性があり(Sun et al 2016)興味深いことに、低グレードの内因性果糖代謝もまた、特定の老化関連疾患とリンクしている(Roncal-Jimenez et al 2016)。
次に、この経路の慢性的な活性化がどのようにアルツハイマー病の病態の根底にあるかを議論する。
果糖代謝とアルツハイマー病
ここでは、フルクトース経路の全身的な過剰活性化がメタボリックシンドロームの役割を果たしているというデータと同様に、脳内のフルクトース「生存」経路の過剰活性化がアルツハイマー病の駆動原因である可能性があるという仮説を提示する。この仮説の重要な側面は、全身的には最小限の活性化にもかかわらず、脳内ではフルクトース系の過剰活性化が起こり、逆にフルクトース系の過剰活性化が起こる可能性があるということである。この仮説の強さは、疫学、臨床症状、生物学の様々な側面を一つの経路に結びつける一連の観察に基づいている(表2;図3)。
表2 脳果糖代謝がアルツハイマー病の役割を果たしている証拠
- フルクトースの食事摂取は、動物とヒトの認知機能障害と関連している
- アルツハイマー病のための多くの危険因子は内因性のフルクトースの代謝を活性化させる
- アルツハイマー病患者の脳内で果糖の代謝が活発になっている
- 脳果糖代謝はアルツハイマー病の発症に役割を持つかもしれない
- 脳内インスリン抵抗性と脳内グルコースの低代謝
- ミトコンドリアの機能不全とエネルギー枯渇
- 神経炎症
- アミロイド産生とタウ蛋白質の高リン酸化
図3 アルツハイマー病の発症に関する仮説
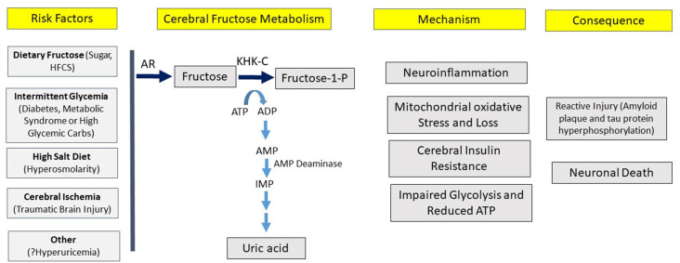
この仮説によると、様々な危険因子が脳内果糖代謝を誘発し、様々なプロセスを開始させ、アルツハイマー病の病理学的および臨床的症状につながる可能性がある。
フルクトースの食事摂取は、動物とヒトの認知機能障害と関連している
食事、特にフルクトース含有糖の役割、それは認知とアルツハイマー病のリスクに影響を与えるための潜在的なそれのかなりの関心があった(Beilharz et al 2015)。
動物モデル
砂糖やHFCSの摂取は、実験用ラットやマウスにおいて認知機能障害を誘発することが報告されている。例えば、ショ糖またはHFCSの投与は、ラットにおいて記憶障害と関連して海馬に炎症を引き起こし、この障害は、より高いフルクトース含量を有するHFCSを与えられたラットにおいてより悪化する(Hsu er al)。 液体で提供される砂糖(液糖)は、砂糖が固体の形態で投与される場合、または脂肪分の高い食事の場合よりも、より多くの認知機能障害を誘発する傾向があり、体重増加とは無関係に発生する(Beilharz et al 2016)。思春期ラットに砂糖を慢性的に与えると、成人期の認知機能障害の発症リスクも増加する(Reichelt et al 2015)。
げっ歯類における果糖の慢性的な摂取は、ペルオキシソーム増殖活性化受容体γコアクチベーター1α(PGC-1α)ミトコンドリア転写因子A(TFAM)およびサーチュイン1,およびcAMP応答エレメント結合タンパク質(CREB; Agrawal et al 2016)などのシナプス可塑性調節因子が関与する細胞エネルギー代謝に関連する海馬の経路を混乱させる。
フルクトース摂取ラットにおける認知機能障害は、BgnおよびFmod細胞外マトリックス遺伝子の変化を含む視床下部および海馬の両方における実質的なエピゲノムおよび転写リプログラミングと関連している(Meng et al 2016)。これらの研究は、フルクトースが細胞代謝とシナプス可塑性の界面を混乱させ、脳を神経障害に陥りやすくする可能性を示唆している。
砂糖のフルクトース成分によって駆動される記憶への影響は、オメガ3脂肪酸が少ない食事によって増幅される(Agrawal and Gomez-Pinilla, 2012)。フルクトースと飽和脂肪(ココナッツオイル)を組み合わせると、オメガ-6多価不飽和脂肪を豊富に含む脂肪(大豆油など)と組み合わせた場合よりも、記憶障害が悪化する。さらに、オメガ3脂肪酸の補充は、フルクトース誘発性メタボリックシンドロームおよびフルクトース誘発性認知障害の両方を改善することができる(Meng et al 2016)。対照的に、高脂肪食だけでは、通常、フルクトースと組み合わせない限り、記憶障害(空間記憶や短期記憶テストなど)を引き起こすことはない(Cordner and Tamashiro, 2015)。
ヒトの研究
糖分、特に清涼飲料水の摂取もまた、認知機能障害と関連している。Framingham Heart Studyでは、清涼飲料水やフルーツジュースの摂取は、エピソード記憶の悪化とともに、総脳量と海馬体積の用量依存的な減少と関連していた(Pase et al 2017)。総糖質摂取は、マレーシアの高齢者コミュニティ居住者の認知の悪化と関連していたが、天然の果物の摂取は保護的に見えた(Chong et al 2019)。同様の所見がプエルトリコの集団で報告されており、この研究では液体糖類の摂取は特に認知機能障害と関連していたが、天然の果糖源(果物など)は関連していなかった(Ye et al 2011)。別の研究では、高齢者の認知機能障害は、脂肪やタンパク質を多く含む食事と比較して、高炭水化物食によって増加することが報告されている(Roberts et al 2012)。同様に、糖質が低く、オメガ3脂肪酸が多い地中海式の食事は、保護効果があるように見える(Berti et al 2015)。最近、臨床研究では、被験者をより健康的な食事と高糖、高脂肪の食事に配置し、4日後に高糖、高脂肪の食事群で短期記憶と海馬機能の障害が示されることがわかった(Attuquayefio et al 2017)。総糖と液糖が認知機能障害と関連している可能性が高いという観察は、液糖がより顕著なATP枯渇と代謝効果を引き起こすことを示す研究と一致しており、一方で、天然果実を用いた否定的な研究は、果糖効果に対抗することが知られている果実に含まれる抗酸化物質とフラボノールの存在を考慮すると一致している(Sundborn et al 2019)。
これらの関連性は、人生の早い時期から始まっている可能性がある。妊娠中の清涼飲料水の母親の摂取だけでなく、幼児期の清涼飲料水の摂取は、小児の認知機能障害と関連している(Cohen et al 2018)。また、精製された炭水化物の摂取量が多い子どもは、非言語知能スコアが低いことを示している(abargouei et al 2012)。また、私たちのグループは、慢性的な糖質摂取と注意欠陥多動性症候群との強い実験的、病態生理学的、臨床的関連性をレビューした(Johnson et al 2011)。
アルツハイマー病の多くの危険因子が内因性果糖代謝を活性化する
前述のように、ヒトはフルクトースを生産することができる(フルクトネオジェネシス)が、唯一知られている方法は、ポリオール経路のアルドース還元酵素(AR)の活性化を経由することである(図1)。フルクトース経路がアルツハイマー病の発症の鍵を握っているとすれば、内因性フルクトース産生に関連する条件(表1)と認知症の発症との間に何らかの関係があることを示す証拠が期待できるかもしれない。
肥満、メタボリックシンドローム、糖尿病
メタボリックシンドローム、高トリグリセリド血症、2型糖尿病、および肥満は、すべてアルツハイマー病の危険因子である(Seaquist 2010;Solfrizzi et al 2011;・2005;Rosales-Corral et al 2015;Anjum et al 2018)。これらの状態はすべて、砂糖およびHFCSの食事摂取量の増加と関連しているが(Johnson et al 2013;MalikおよびHu 2015)実験的証拠はまた、これらの状態を内因性フルクトース産生と関連させている(Lanaspa et al 2013,2018)。糖尿病に関連する高血糖状態はまた、脳を含む内因性フルクトース産生に関連する複数の組織においてアルドース還元酵素を活性化する(Stewart et al 1967)。2型糖尿病を有する被験者における血糖コントロール不良は、記憶力を急性的に悪化させることも明らかにされている(Greenwood et al 2003)。糖尿病で産生される内因性フルクトースの量は、アルドース還元酵素をブロックすることで糖尿病マウスの非アルコール性脂肪性肝疾患(NAFLD)を予防するために重要である可能性がある(Qiu et al 2012)。
高血糖食
臨床研究では、精製された炭水化物(砂糖とパンや米などの高グリセミック炭水化物の両方を含む)の摂取と認知症の関連性が指摘されている(アミロイドβargouei et al 2012;Roberts et al 2012)。これは、フルクトース含有食品の含有によるものと解釈されるかもしれないが、マルトデキストリンがラットで記憶障害を引き起こす可能性があることを示す実験研究がある(Kendig et al 2014)。マルトデキストリンは果糖を含まず、デンプンに似た性質を持ち、ブドウ糖に分解される。しかし、我々のグループは、高血糖の炭水化物であるグルコースの摂取は、肝臓におけるアルドース還元酵素の活性化をもたらし、その結果、内因性フルクトースの産生をもたらし、それがメタボリックシンドロームおよびインスリン抵抗性の発症を促進することを報告している(Lanaspa et al 2013)。また、ヒトを対象とした研究では、グルコースの摂取により血清グルコースが上昇し、それが脳内でフルクトースに変換されることが示されている(Hwang et al 2017)。これらの研究から、高血糖の炭水化物もアルツハイマー病の潜在的な危険因子である可能性が示唆されている。
高塩分ダイエット
西洋式の食生活は糖分が多いというイメージがあるが、前世紀の間に塩分の摂取量が著しく増加している。今日、塩分の平均摂取量は約8~10グラム/日となっている。長い間、塩分を多く含む食生活は、高血圧や心血管疾患の原因となる可能性があることから、主に注目されてきたと考えられてた(He and MacGregor, 2011)。より最近では、高塩分摂取は肥満、メタボリックシンドローム、および糖尿病と関連している(Libuda et al 2012;Lanaspa et al 2018)。実験的研究では、これらの効果は、アルドース還元酵素および内因性フルクトース産生を刺激することが知られている食塩の高オスモラリティを誘導する効果によって媒介されている可能性が示唆されている(Suckling et al 2012; Kanbay et al 2018)(Ko et al 1997)。我々のグループは、高塩食によって肝臓や視床下部を含むマウスの複数の組織で内因性フルクトース産生が誘導され、メタボリックシンドロームの発症を伴うことを報告した(Lanaspa et al 2018)。果糖代謝を抑制した場合、メタボリックシンドロームも血圧上昇も発症しなかった(Lanaspa et al 2018)。
現在、高塩食と認知症の関連性が指摘されている。高塩食は、最初はマウスの探索行動を刺激するが、その後、視床下部への酸化ストレスを伴う短期・長期記憶の低下をもたらし、高齢動物では悪化する傾向がある(Liu et al 2014;Ge et al 2017;Guo et al 2017)。さらに、高塩食は視床下部のタウタンパク質の高リン酸化を誘導する(Faraco et al 2019)。高塩濃度はまた、培養胚性腎細胞におけるアミロイドアミロイドβペプチドを増加させる(Cheng et al 2015)。
トラウマ
外傷性脳損傷は、アルツハイマー病の発症リスクを高める(Al-Dahhak et al 2018)。実験的研究に基づいて、これは微小血管系の混乱を伴い、酸化ストレスを誘発する局所的な虚血をもたらす(Leker and Shohami, 2002)。虚血が酸化ストレスを引き起こすメカニズムの1つは、アルドース還元酵素およびフルクトース生成を刺激することによるものである(Andres-Hernando et al 2017)。外傷性脳損傷は、視床下部や肝臓の脂質代謝に関与する経路を活性化する(Rege et al 2019)。食事性果糖の摂取はまた、外傷性脳損傷に関連した酸化ストレスを拡大し、空間記憶障害の悪化、ミトコンドリア機能の低下、および脳内インスリン抵抗性の発達をもたらす(Agrawal et al 2016)。
アルコール
アルコールは、それ自体で認知症を誘発することができる一方で、被験者をアルツハイマー病に素因する(Venkataraman et al 2017)。アルコール摂取は、血清浸透圧を増加させることにより、ヒトおよび実験動物モデルの両方において、肝臓におけるアルドース還元酵素および内因性果糖産生を活性化することができる(Wang et al 2020)。アルドース還元酵素をブロックすることは、動物モデルにおいてアルコールに応答して肝性ステアトーシスの発生を抑制することも報告されている(Shi et al 2017)。アルドース還元酵素をブロックすることがアルコール誘発性認知症モデルにおいて有益であるかどうかは、我々の知る限りでは検証されていない。
老化
加齢は、認知機能の低下およびアルツハイマー病の発症リスクの増加と関連していることがよく知られている。興味深いことに、アルドース還元酵素の発現および活性は老化した脳で増加し、これは細胞内リン酸の低下(これはAMPD2を活性化する)およびソルビトールレベルの増加と関連している(Cao Danh et al 1984; Kwee et al 1991)。我々のグループはまた、低悪性度の内因性フルクトース産生が腎臓の老化関連病理を引き起こしている可能性があるという証拠を発見した。具体的には、フルクトキナーゼを欠失したマウスでは、フルクトースが最小限(5%未満)の通常の飼料を与えられていたマウスでは、老化に関連した腎臓病は発生しなかった(Roncal-Jimenez et al 2016)。
遺伝学
アルツハイマー病は、アポリポタンパクE4(Apo E4)遺伝子多型、およびゲノムワイド関連スクリーニング(GWAS;Beecham et al 2014)によって同定された多数の他の遺伝子と関連している。HFCSを投与されたヒトは、高トリグリセリド血症を発症することに加えて、アポリポタンパク質Eのpostprandiallyの上昇を示す(Price et al 2018)。さらに重要なことに、ニュートリゲノミクス研究では、齧歯類における果糖の消費が海馬などの認知処理に関連する脳領域における選択的なトランスクリプトームおよびエピゲノムのリプログラミングを促進することが明らかになった。ラットで発見されたフルクトースのシグネチャー遺伝子は、GWAS研究でアルツハイマー病のリスク因子として同定されている脂質生物学やエネルギー代謝に関連するトップ遺伝子と重複していた(Meng et al 2016)。
食事性果糖
興味深い問題は、フルクトースの大部分が全身循環に到達する前に腸および肝臓によって除去される場合、砂糖およびHFCSの摂取がどのように認知の変化を誘発するかということである(Jang et al 2018)。典型的には、フルクトースの血清レベルはグルコースと比較してかなり低く、清涼飲料水の摂取後は約5mg/dlである(Le et al 2012)。実際、標識されたフルクトースを利用した研究では、脳に到達するのはわずか1-2%であることが示唆されている(Oldendorf, 1971)。
このような低濃度の食事性果糖が脳機能に直接的な役割を果たしている可能性があるが、フルクトースの全身的な代謝が脳の代謝や機能に影響を与える因子や神経刺激の放出につながる可能性もある。一つの可能性としては、脳内での内因性果糖の産生・代謝を誘導している可能性がある。例えば、糖の摂取は、アルドース還元酵素(García-Arroyo et al 2017)SDH(García-Arroyo et al 2017)フルクトース輸送体(Glut5;Roncal-Jimenez et al 2017)をアップレギュレートする可能性がある。2011)およびフルクトキナーゼ(KHK-C; Korieh and Crouzoulon, 1991; Roncal-Jimenez et al 2011; Lanaspa et al 2012c)およびキサンチンオキシダーゼ(García-Arroyo et al 2019b)が正のフィードバックシステムを介して作用する。これが脳で起こる可能性があることは、食事性フルクトースがラットの脳(視床下部を含む)でフルクトーストランスポーターであるGlut5の発現を増加させることができることを報告している研究によって示唆されている(Shu et al 2006)。1つの可能性のあるメカニズムは、尿酸がアルドース還元酵素およびKHK-Cの発現を刺激することができる血液脳関門を自由に通過することができるので、肝臓での果糖代謝に続く循環への尿酸の放出によるものである可能性がある(PerheentupaおよびRaivio、1967)。別の可能性としては、肝臓でのATPの低下は、おそらくFGF21などの因子の放出によって、または迷走神経系への影響によって、中枢神経系効果を媒介することができるということである(Friedman, 2007; Talukdar et al 2016)。
果糖代謝はアルツハイマー病患者の脳内で活性化している
図1は、細胞内ATP枯渇につながるKHK-C依存性プリン体分解経路に焦点を当てて、フルクトースの生成と代謝に関与する手順を検討する。
アルツハイマー病の脳で生成される内因性果糖
アルドース還元酵素は、海馬を含むニューロンで発現している(Picklo et al 2001; Hwang et al 2017)。フルクトースの生成を伴うアルドース還元酵素の活性化は、ラットの脱水に続く脳において(Song et al 2017)ヒトのグルコース負荷に続く脳においても示されている(Hwang et al 2017)。重要なことに、アルツハイマー病患者における内因性フルクトース産生の証拠があり、ソルビトールおよびフルクトースの脳内レベルは通常の3〜5倍である(Xu et al 2016)。アルツハイマー病の被験者ではアルドース還元酵素の発現は変化しないが、ニューロン数の減少があるという事実は、ニューロンあたりのアルドース還元酵素発現および活性の相対的な増加を示唆している(Picklo et al 2001)。
アルツハイマー病脳におけるプリン分解経路の活性化
フルクトースが生成されると、それはKHK-Cによって代謝され、細胞内リン酸塩およびプリン体分解経路を誘発するATPの低下を誘発し、AMPD2によって代謝されてIMPおよびアンモニアを生成するAMPを生成する(van den Berghe et al 1977; 図1)。フルクトースはヘキソキナーゼによっても代謝されることがあり、これは正常ラット大脳皮質における重要な代謝経路である可能性がある(Hassel et al 2015)。しかし、この酵素が存在する場合、KHK-Cによって優先的に代謝される。実際、KHK-Cは視床下部や海馬を含む脳内で発現している(Oppelt et al 2017)。これまでのところ、アルツハイマー病患者におけるKHK-Cの発現を調べた研究はない。しかしながら、フルクトース代謝におけるプリン体分解経路の最初の酵素はAMPD2であり、研究は、アルツハイマー患者におけるAMPD-2の発現および活性の両方の増加を報告している(Sims et al 1998)。AMPD2の生成物の一つはアンモニアであり、いくつかの研究ではアルツハイマー患者における血中アンモニア濃度の上昇が報告されている(Adlimoghaddam et al 2016;Jin et al 2018)。また、ある研究では、アルツハイマー病患者の脳内でアンモニア産生が増加することが報告されている(Hoyer et al 1990)。
AMPD2によって生成されたIMPもまた分解され続け、最終的には、IMPにリサイクルされるか、またはキサンチンオキシダーゼによってさらに分解されて細胞内尿酸を生成することができるヒポキサンチンを生成する。結果として、アルツハイマー病患者の脳内では、より高い尿酸レベルが観察されると予想されるが、これまでの唯一の研究では、年齢をマッチさせた対照群との差は認められなかった(McFarland et al 2013)。しかし、一度エネルギー貯蔵が枯渇してしまうと(アルツハイマー型認知症の被験者で起こるように)さらなる尿酸形成のための十分な基質が存在しない可能性がある。
アルツハイマー病の潜在的なメカニズム
我々は、アルツハイマー病は西洋文化の比較的近代的な病気であり、それは慢性的なフルクトース代謝の障害を表しているという仮説を立てている(図3)。
ステップ1:内因性果糖は脳内で生成される
我々は、過剰な糖分とHFCSを食べることによって、無意識のうちに果糖生存経路が活性化され、最大のリスクは、大量の果糖が急速に摂取され、より深刻なATP枯渇をもたらす清涼飲料水を飲むことから始まることを示唆している。糖分の再摂取は、脳を含む様々な組織において、アルドース還元酵素、SDH、KHK-C、キサンチンオキシダーゼなどの内因性フルクトース産生と代謝の両方に関与する酵素の発現と活性をゆっくりと増加させる。他の食品もまた、塩分の多い食品、高血糖の炭水化物、およびアルコールを含むフルクトースの内因性産生を活性化する可能性がある。また、グルタミン酸はAMPD依存性経路を介して尿酸に代謝され(FeigelsonおよびFeigelson、1966)一方でIMPなどのプリン体は腸および肝臓で尿酸に分解され得るので、うまみに富んだ食品を食べることによってフルクトース経路を部分的に迂回することも可能である。他のメカニズムもまた、メタボリックシンドロームの被験者における食後高血糖のエピソード、1型または2型糖尿病の被験者における持続性高血糖、または外傷性脳損傷後の虚血など、フルクトースの脳内産生を増加させる可能性がある。局所的な尿酸産生がより重要であるかもしれないが、著しい高尿酸血症を有する被験者もまた、ある程度のリスクを負う可能性がある。
ステップ2:果糖は代謝され、生得的な生存経路を設定する
脳が KHK-C によるフルクトースの代謝を開始すると、アンモニアおよび IMP を生成する AMPD2 の活性化に伴うニューロンにおける ATP の一過性の低下がある。前述のように、AMPD2活性および発現は、血中および中枢神経系アンモニアレベル(Hoyer et al 1988年、1990)と同様に、アルツハイマーの被験者の脳で高い(Sims et al 1998年、1998)。アンモニアは、認知機能障害に寄与するかもしれないが、IMPは、細胞内尿酸がミトコンドリアの酸化ストレスと炎症を刺激することを考えると、病理学的により重要であるかもしれない尿酸に分解される。
ステップ3:細胞内尿酸が神経炎症を誘発する
Shao et al 2016)による重要な論文は、神経炎症物質としての尿酸の重要性を実証した。著者らはまず、ラットにおける高尿酸血症の誘導(ウリカーゼ阻害剤を用いた)が、衝動性に対する既知の効果に加えて認知障害を誘発しうることを示し(Sutin et al 2014)これがNFκBおよびToll様受容体4の活性化および炎症性サイトカイン産生(インターロイキン1bおよびインターロイキン6;Shao et al 2016)を伴う海馬の炎症と関連していることを示した。視床下部の炎症は、アラントイン(ウリカーゼの産物)が再現しなかったのに対し、海馬への尿酸の直接注入によって再現することができた。尿酸はまた、初代海馬細胞の細胞活性化と培養を引き起こした。最後に、高尿酸血症のヒトは、MRIで海馬領域のグリアーシスを示した(Shao et al 2016)。別の研究では、尿酸が細胞培養における神経細胞死の誘導においてアミロイドβアミロイドペプチドを増強し得ることが報告された(Desideri et al 2017)。これらの結果は、機能的MRIを用いた研究と一致しており、高尿酸血症者(特に男性)は、パタメンおよび淡蒼球を含む基底核において、より貧弱な認知およびより少ない自発的電気活動を示したことを実証した(Lin et al 2019)。
尿酸がアルツハイマー病に関与している可能性があるという議論は、アルツハイマー病が血清尿酸値の低下と関連しているという報告と矛盾しているように思われるかもしれない(Euser et al 2009;Ye et al 2016)。しかし、他の研究では、高尿酸血症が認知症を予測する可能性があることが報告されている(Khan et al 2016)。実際、高尿酸血症は、高齢者の記憶および単語処理の障害と関連しており(Schretlen et al 2007年)虚血性病理を示唆する白質の高強度シグナリングと関連している(Schretlen et al 2007)。また、高尿酸血症は、慢性腎臓病の被験者では認知機能障害と関連しており(Afsar et al 2011年)Rotterdam研究では高齢者では認知機能の悪化と白質疾患と関連していた(Verhaaren et al 2013)。
血清尿酸値の低下がアルツハイマー病患者によく見られる理由は、血清尿酸が全体的な栄養状態をも反映するからであると考えられ(Beberashvili et al 2016)アルツハイマー病の被験者は、認知症が現れる前であってもかなりの量の体重を失うことが多いことが知られている(Stewart et al 2005;Johnson et al 2006)。疾患過程における尿酸の重要性を支持するもう一つの論拠は、アロプリノールによる血清および細胞内尿酸値の低下が認知症の発症を予防するかどうかを調査した2つの疫学研究から得られたものである。台湾の縦断的研究では、尿酸値を下げる治療を受けた痛風患者は、治療を受けていない痛風患者や対照患者に比べて認知症発症リスクが30%低いことが明らかになった(Hong et al 2015)。メディケアの請求データを用いた別の研究では、アロプリノールまたはフェブキソスタットを服用している被験者は、これらの尿酸低下薬の高用量投与で認知症のリスクが低下することが示された(Singh and Cleveland, 2018)。
ステップ4:脳内インスリン抵抗性とグルコース低代謝
果糖生存経路は、エネルギー必要量を減らして食物摂取を促すことを意味しており、インスリン抵抗性の発達は、骨格筋によるグルコースの取り込みを減少させ、それによって脳によるグルコースの取り込みを有利にするための保護反応であった。しかし、海馬、視床下部、線条体、感音神経皮質などの脳の一部の領域では、インスリンをグルコース取り込みに利用しており、これはインスリン受容体-A(IR-A)によって媒介され、グルコース輸送体-4および8が関与している(Glut4およびGlut8; Neth and Craft, 2017)。これらのニューロンへのインスリンシグナル伝達が遮断されると、空腹および食物摂取をシグナルする。興味あることに、慢性的な果糖の摂取は、ラットの海馬におけるIR-Aおよびインスリン受容体基質-2(IRS-2)の活性化(リン酸化)を低下させることが明らかになっている(Agrawal et al 2016)。また、末梢性インスリン抵抗性は、血液脳関門のインスリン輸送体を阻害する血清インスリンレベルを上昇させることが知られており、それによって中枢神経系のインスリンレベルを低下させる可能性がある。また、末梢性インスリン抵抗性と脳ブドウ糖低代謝が頻繁に共存していることを示す研究もあり、それらが病的に関連していることが示唆されている(Burns et al 2013)。いずれにしても、アルツハイマー病患者では、脳内インスリンレベルとインスリン受容体の発現の両方が低下しているように見えるが、これは疾患の経過の初期に起こる(Agrawal and Gomez-Pinilla, 2012; Moreira, 2013)その結果、脳内インスリン抵抗性とインスリン受容体の発現が低下していることが明らかになった。
ターンでは、グルコースの取り込みをブロックすることは、大脳のエネルギー代謝にいくつかの負の効果を持つことが推定される(NethとCraft 2017)が、採餌プロセスを奨励するという生物への全体的な利益を持つ。また、ミトコンドリアへの酸化的ストレスは、ミトコンドリアの機能をさらに低下させ、最初は、初期のアルツハイマー病で時々観察されるように、解糖が補おうとし、潜在的にグルコースの低代謝の期間につながるだろう(Neth and Craft, 2017)。しかしながら、ニューロンは、この酸化ストレスから保護する必要があり、解糖を制限し、ペントースリン酸シャントを介してグルコースをシャントし、還元グルタチオンを生成することによってこれを行う(Herrero-Mendez et al 2009)。これは、その後、脳の低代謝と低細胞内ATPレベルにつながる。
フルクトース経路と一致して、早期発症のアルツハイマー病は、解糖、乳酸産生、酸化ストレス、減少したミトコンドリア呼吸、アンモニア生成、および低下した脳内グルコース代謝と関連している(Hoyer et al 1988,1990; CeniniおよびVoos 2019)。ミトコンドリアの酸化ストレス(および特にフルクトースまたは尿酸からの)のマーカーであるアコニターゼ活性は、アルツハイマー病患者の循環リンパ球において減少することが示され得る(Mangialasche et al 2015)。疾患が進行すると、脳内酸素消費量が低下し(Hoyer et al 1991)脳ATPの段階的な減少とともに、初期段階では約7%から50%以上の後期段階で減少する(Hoyer、1992)。ミトコンドリア密度が低下すると、いくつかのミトコンドリアは酸化的リン酸化を促進することによって補償を試みるかもしれないが(逆Warburg効果;Demetrius et al 2014)時間の経過とともに細胞エネルギーの漸進的な欠如はニューロンの終焉を引き起こす。
ステップ5:アミロイドプラークおよび神経原線維のもつれの形成
フルクトース代謝経路がアミロイドプラークおよび神経原線維のもつれの産生を促進する直接的なメカニズムは完全には明らかにされていない。末梢性インスリン抵抗性は脳アミロイドの増加と関連している(Morris et al 2016)が、この関連が因果関係を持つかどうかは不明である。糖(果糖)の摂取は、膵島に酸化ストレスを引き起こし、ヒアリン沈着および膵島の損傷をもたらし(Roncal-Jimenez et al 2011)後者は、アミロイドタンパク質の前駆体であるアミリンの発現を増加させることができる(HaydenおよびTyagi 2001)。理論的には、アミリンが放出された場合、アミリンは血液脳関門を通過し、そこでアミロイドβアミロイドと相互作用してアミリンアミロイドを生成する可能性がある(Jackson et al 2013)。
1つの可能性のあるメカニズムは、ヒートショックプロテインの産生を損なうことが知られている海馬におけるサーチュイン1の抑制(Agrawal et al 2016)を伴うインスリンシグナル伝達のフルクトース依存性障害(Imamura et al 2020)を伴う可能性がある(Westerheide et al 2009)。ヒートショックプロテインは、誤ったタンパク質を修復する役割を有し、障害されたHSP応答は、アルツハイマー病患者におけるタウタンパク質およびアミロイドの蓄積を素因とする可能性がある(Chen et al 2014; Despres et al 2017)。
これらの考えと一致するように、アルツハイマー病のマウスモデルにおける高糖食の投与は、血清および脳アミロイドレベルの有意な増加をもたらした(Yeh et al 2019)。さらに重要なことに、認知的に正常な高齢者を対象とした横断的研究では、高血糖炭水化物および/または高糖食の被験者は、陽電子放出断層撮影(PETスキャン)によって測定されるように、より高い脳アミロイド沈着を有し、高糖摂取の被験者はまた、ミニ精神状態検査(Mini-Mental State Examination)でより悪い成績を示した(Taylor et al 2017)。
細胞のエネルギー代謝の障害は、アルツハイマー病などの神経変性疾患の病因を加速させる可能性がある神経細胞の接続性と機能の維持に大きな負担を強いる(Gomez-Pinilla and Yang, 2018)。シナプスコミュニケーションは、ニューロンの機能および認知に不可欠であり、フルクトースに関連する細胞代謝の混乱は、単に細胞の生存を超えて、脳機能全体に大きなダメージを与えることができるようなエネルギーに非常に要求される。長期増強(LTP)と長期抑圧(LTD)の形でシナプス可塑性を維持するための海馬の能力-学習と記憶の電気生理学的相関関係は、フルクトースの給餌によって深刻に損なわれることが示されている(Cisternas et al 2015; Agrawal et al 2016)。
限界
アルツハイマー病の病態は複雑であり、複数の遺伝的・環境的要因が関与しており、我々の目的は、ミトコンドリアの機能不全、脳のエネルギー、脳のインスリン抵抗性、そして更なる研究を促す可能性のある食生活を結びつける新たな仮説を提示することである。我々は、水痘・帯状疱疹ウイルス感染など、同様の経路を誘発する可能性のある他の因子の役割を否定していない(Bubak et al 2019)。我々はまた、食餌性脂肪の役割は複雑であり、オメガ3からオメガ6へのバランスも重要である可能性があり、これが果糖代謝にどのように関係しているかについては、さらなる研究が必要であることを認識している(Simopoulos, 2013)。
要約
我々は、アルツハイマー病は、脳内の果糖代謝が過剰になった西洋文化に大きく牽引されているのではないかと仮説を立てている。果糖代謝は本来、採食行動を刺激し、エネルギーや酸素の需要を減少させることで生存の利益を提供することを意味していた。
残念ながら、脳内での慢性的な刺激は、ミトコンドリアの酸化ストレスと局所的な炎症を引き起こし、脳のエネルギーレベルの漸進的な低下をもたらす。
他の組織が減少したATPを補うために解糖を増加させる一方で、ニューロンではグルコースは、酸化ストレス誘発ミトコンドリアの損失に対抗するために抗酸化物質を生成するために、ペントースリン酸シャントに指示されている。その結果、グルコースの低代謝は、酸化ストレスを増加させ、ミトコンドリアの漸進的な損失が発生し、最終的にはニューロンの機能不全と死につながる。
このシナリオでは、アミロイドプラークと神経原線維のもつれは炎症反応の一部であり、傷害に関与しているが、疾患を推進する中心的な要因ではない。理論的には、脳内のKHK-Cを調節すること、あるいはAMPD2を調節することは、アルツハイマー病の予防と治療に新たな方法を提供するかもしれない。
