Contents
Cell-Mediated Immune Responses to COVID-19 Infection
要旨
2019年12月に武漢市(中国)で、後に世界保健機関(WHO)によってCOVID-19と呼ばれる新型コロナウイルス(CoV)による肺炎の前例のないアウトブレイクが発生した。厳格な封じ込めと検疫の努力にもかかわらず、COVID-19の発生率は拡大を続けており、160カ国以上で罹患率と致死率の波を伴う爆発的なアウトブレイクを引き起こし、重大な公衆衛生上の問題を引き起こしている。
過去20年間で、CoVによって引き起こされた2つの伝染病がさらに発生している:重症急性呼吸器症候群(CoV)は中国をはじめとする24カ国で大規模な伝染病を引き起こし、サウジアラビアでは中東の呼吸器症候群(CoV)は散発的な症例を引き起こし続けている。
これらのウイルスはいずれも下気道に感染し,ヒトでは肺炎として発症するが,新型のSARS-CoV-2はより感染力が強く,世界的に急速にパンデミックしていると考えられる。
本ミニレビューでは、ヒトを対象としたCOVID-19に対する細胞性免疫応答に焦点を当て、他の臨床的に関連するコロナウイルスと比較して、感染制御や病態制御におけるCOVID-19の役割を評価し、予防ワクチンや免疫療法の開発を加速させることを目的としている。
キーワード
SARS ・CoV-2, COVID-19, 自然免疫, 適応免疫, コロナウイルス
序論
2019年12月31日、中国の武漢市で、SARS-CoV-2と呼ばれる新型コロナウイルス(CoV)を媒介とする非定型肺炎の集団発生が報告された(1、2)。この「コロナウイルス病2019」(COVID-19)の発生は、世界保健機関(WHO)により世界的なパンデミックと宣言されており、2020年6月上旬には700万人以上の症例が発生し(3)、症例死亡率は約1%で、経済的・社会的にも大きな影響を与えている。現在までのところ、SARS-COV-2に対して承認された抗ウイルス剤や効率的なワクチンは存在しない。これらの理由から、SARS-COV-2の進行を阻止するために、世界的な集団の隔離やバリアジェスチャーの使用など、必要な公衆衛生対策が講じられている。
CoV は、鳥類や哺乳類を含む広範な宿主種に見られるポジティブセンス一本鎖 RNA ウイルスの一群である。β-CoVの多くは、動物およびヒトにおいて腸管および呼吸器感染症を引き起こす。COVID-19の人獣共通感染源は確認されていない;しかしながら、SARS-CoV-2の配列決定により、SARS-CoVとの同一性は最大80%、さらにはいくつかのコウモリのCoVとの同一性が明らかになった()。この類似性は、コウモリがウイルスの重要な貯蔵庫であることを示唆しており、ウイルスが直接ヒトに感染したか、あるいは別の未知の中間宿主を介して感染した可能性がある。COVID-19患者の160のゲノムを系統解析した結果、A、B、Cと名付けられた3つの主要な変異型が明らかになった;A型は中国で初めて検出された祖先型である。A型は中国で初めて検出された先祖代々の型である。A型とC型はヨーロッパとアメリカでかなりの割合で見られるが、B型は東アジアで最も多く見られる(6
2002年から 2003年にかけて、中国の広東省で重症急性呼吸器症候群(SARS)と呼ばれる「非定型肺炎」が初めて報告された。その後、この病気は37カ国に広がり、8,000人以上の患者が発生し、致死率は10%程度であった(7)。このようにして、ここ数十年で3回目の新しいCoVが種を越えてヒト集団に感染することになった。しかし、他の2つのCoVに比べて、SARS-CoV-2ははるかに伝染性が高い。これまでに世界で700万人以上の症例が診断され、2020年6月上旬までに世界で40万人以上の死亡者が出ており、基礎再生産数は2.2~3.3、死亡率は約2.3%と推定されている(3、9)。
SARS-CoV-2は他のCoVと同様に、表面にスパイク蛋白質を有する典型的なエンベロープ構造を有しており、この特徴が種間感染に大きな役割を果たしていることは間違いない。SARS-CoV-2とSARS-CoVのスパイク構造の特徴の類似性に基づいて、いくつかの研究グループは、SARS-CoV-2がヒトアンジオテンシン変換酵素2(ACE2)受容体を細胞侵入受容体としても利用していることを明らかにした(10, 11)。ACE2は主に血管内皮細胞と腎尿細管上皮で発現している。PCR解析の結果、ACE2はウイルスを保有することが示されている組織である肺や消化管にも発現していることが明らかになった(12)。また、CD147(basiginまたはEMMPRINタンパク質)がSARS-CoV-2のもう一つの細胞表面受容体である可能性も示唆された(13)。共免疫沈降法、ELISA法、免疫電子顕微鏡法により、抗CD147抗体(Meplazumab)がスパイクタンパク(SP)とCD147の結合を競合的に阻害し、標的細胞への感染を防ぐことを示した。抗CD147ヒト化メプラズマブ注射剤のClinical study of anti-CD147 humanized Meplazumab for injection to treat with 2019-nCoV pneumonia」(ClinicalTrials.gov identifier: NCT04275245)と題する第II相臨床試験が、SARS-CoV-2のSP結合およびその後の感染を防ぐことを目的として、中国で現在進行中である(14)。CD209L(L-SGN)は、SARS-CoVウイルスについて以前に記載されたように、SARS-CoV-2の別の可能性のある代替受容体として同定されている(15)。
このレビューでは、COVID-19感染における自然免疫および適応細胞免疫の役割の理解における最近の進歩のいくつかを強調し、病因への潜在的なリンクを論じる。
COVID-19の免疫病理学
急性感染症の症状は?
COVID-19の最初の症状は主に呼吸器疾患であるが、神経症状や消化器症状も見られる。主な感染様式は、感染者から飛沫を噴霧することで、主に鼻腔および喉頭粘膜を経由して、呼吸器から肺に侵入するという、密接な接触を介したヒトからヒトへの感染である。次に、より重症化した場合には、細胞外液による損傷や浮腫により、肺から末梢血にウイルスが侵入し、ウイルス感染症を引き起こす可能性がある。COVID-19は、ウイルスが感染する可能性のある無症候性の潜伏期間が2日から14日の間である可能性が高い(16)が、重要なことに、SARS-CoV-2 RNA検出の期間は十分に特徴づけられていない。Zhouら(12)は、鼻咽頭吸引液中のウイルス力価は、症状発症後10~15日で低下するが、臨床症状が悪化すると高値を維持することを発見した。しかし、検体中のウイルスRNAの存在が必ずしもウイルスの透過性と相関するとは限らないことは注目に値する;感染性ウイルスと非感染性ウイルス(死滅または抗体中和)を区別できないことが大きな限界である。SARSとMERSについては、大多数の患者で発症後少なくとも3週間はウイルスRNAが気道内に残存していることが以前に示されている(17)。
重症型の場合は?
COVID-19症例の80%以上は無症状または軽度の症状を呈し、残りの症例は重症または重症であった(2, 18)。COVID-19の死亡率(約1%)はSARS(10%)やMERS(30%)に比べて低いようである。COVID-19は他の病原性CoVと同様に、発熱、咳、倦怠感および/または筋痛を伴う典型的なインフルエンザ様症候群と関連している。SARSおよびMERS患者の4人に下痢が報告されているが、COVID-19患者では腸の症状はほとんど観察されないであった(2、18、19)。
中国での初期報告では、COVID-19患者の14%が入院し、そのうち5%がICU介入を受けたことが明らかになっている(20)。同様の割合は後に欧米でも観察されている(4)。重症者の中では、主に急性呼吸窮迫症候群(ARDS)による急性低酸素血症性呼吸不全が観察されている(20、21)。この段階では機械的換気の必要性が高く、40~100%の範囲である(22)が、脳炎や抗リン脂質症候群はまれである(23)。COVID-19の一般的な合併症には、急性腎障害、肝酵素の上昇、および心臓障害がある(23)。限られたCOVID-19の死後のデータでは、顕著な肺胞浮腫、フィブリン沈着、免疫細胞浸潤、腎機能障害、心機能障害、肝機能障害を含む重篤な多臓器障害が認められている(12、24)。
また、COVID-19入院患者の約90%が少なくとも1つの危険因子を有していたことが報告されている(www.cdc.gov/coronavirus/2019-ncov/index.html)。特に高齢であること、入院時の逐次臓器不全評価(SOFA)スコアが高いことは、院内死亡の確率が高いことと関連しているが、血中IL-6の上昇、高感度心筋トロポニンI、リンパ球減少症は重症COVID-19病ではより一般的に見られる(12)。サイトカインストームが、高齢者や免疫不全者(すなわち糖尿病患者)の感染の重症度を説明し、ほとんどが無症状であるが免疫系が完全に機能している若い集団では感染の重症度を説明しない理由はまだ不明である。しかし、SARS-CoV-2への曝露および感染時に観察される臨床例のばらつきは、ヒトの遺伝的要因がこのウイルスに対する反応にも影響を与えうることを示唆していると思われる。しかし、これまでのところ、その真の影響を決定するための研究はほとんど行われていない。
解析された患者によると、SARS-CoV-2は、おそらく小児と思春期を除いて、すべての年齢層に等しく感染している。未解明なのは、なぜ重症化する患者とそうでない患者がいるのかということである。この感染症の重症度に影響を与える可能性のあるさまざまなパラメータのうち、細胞性免疫応答の役割に焦点を当てる。
COVID-19病因の免疫制御における最近の進歩
通常、I型インターフェロン(IFN-α/β)は、ウイルスの複製を制限するための細胞内抗菌状態を生成することにより、防御の第一ラインを提供する。しかし、病原性CoVはIFN-α/βによって媒介される応答を減衰させるように特に適応されているようである(25, 26)。免疫応答のこの早期変調を説明するために、いくつかの仮説が提案された。SARS-CoVのOrf6タンパク質がカリオフェリン輸送を阻害し(27)、その結果、STAT1などの転写因子の核への輸入を阻害し、結果としてIFN応答を阻害することが示された。同様に、SARS-CoVのOrf3bタンパク質は、IFN-α/βの活性化に関与するインターフェロン調節因子3(IRF3)のリン酸化を阻害する(28)。中国では、COVID-19の治療ガイドラインでは、リバビリンとの併用でIFN-αの投与が推奨されていたが(29)、改善は記録されなかった。興味深いことに、IFN-αはSARS-CoV複製を効果的に阻害したが、IFN-βの50〜90倍の低さであった(30〜32)ことから、IFN-βが患者の治療においてより良い抗ウイルス成分であり得ることが示唆された。このように、欧州のDisCoVeRy試験では、皮下IFN-βとロピナビル/リトナビルの組み合わせが、ヒドロキシクロロキンとレムデシビルと比較されている。
IFN-α/β欠損によって媒介される「最前線」の抗ウイルス防御機構の喪失は、マクロファージ活性化症候群(MAS)様の病理学につながるサイトカインストームの誘導に関与している可能性がある(33、34)。このサイトカインストームは、COVID-19における病原性炎症の根本原因と考えられている。しかし、その最初の引き金はまだ知られていないが、それはおそらく、死にかけた細胞によって放出された大量のウイルス抗原の免疫系の検出に関係している。COVID-19の致死的症例の2人に1人はサイトカインストームを経験し、その82%は60歳以上である(35)。興味深いことに、インフラマソームの主要なタンパク質構成要素であるNLRP3が役割を果たしている可能性がある。加齢の間、肺の免疫細胞におけるNLRP3の豊富さと活性は着実に増加しており、肺線維化に寄与している(36)。加齢および血液学的癌の次に、肥満は、2型糖尿病と同様にCOVID-19致死の主要な危険因子である。肥満はNLRP3の活性を高め、ウイルス感染時の炎症を刺激することが知られている(37)。
サイトカインストームは、主にプロ炎症性サイトカイン(すなわち、IL-1β、IL-6、TNF-α)の高産生と関連している(図1)。例えば、IL-6産生は、無症状の患者と比較して、複雑なCOVID-19を有する患者では約3倍高い(38)。COVID-19肺炎患者におけるヒト化抗IL-6モノクローナル抗体であるトシリズマブの予備的データは、少数の患者における臨床的改善を明らかにしている(39)。同様に、インターフェロン・ガンマ誘導性プロテイン10(IP-10)は患者のウイルス負荷と相関し、単球-ケモタクティック・プロテイン3(MCP3)は肺機能の低下(PaO2/FAO2比)、肺障害(Murray Score)、および致命的な転帰と相関している(40)。全身性の炎症もH1N1の致死的な症例で観察され、肺の免疫細胞の大規模な浸潤に関連して、肺のIL-6およびIP-10濃度が高い(41)が、鳥類H5N1およびH7N9肺感染症の重症または致死的な形態でも報告されている(42, 43)。
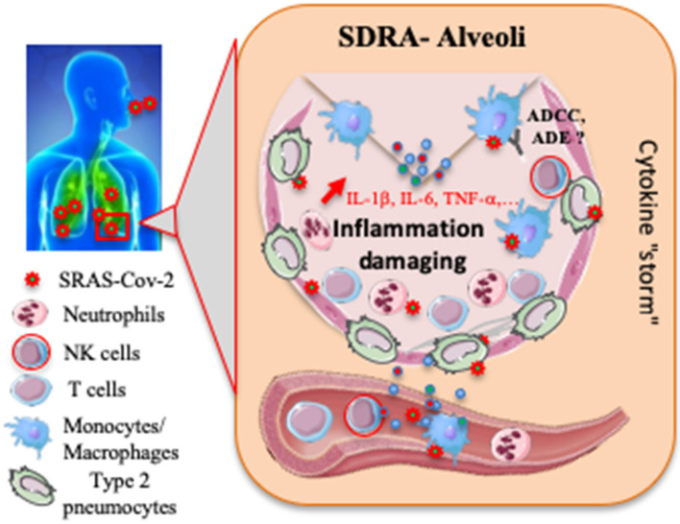
図1
SARS-CoV-2感染時の宿主免疫応答の提案。SARS-CoV-2のエアロゾル化された取り込みは、ACE2を発現する標的細胞、例えば肺胞2型肺炎球または他の未知の標的細胞の感染をもたらす。ウイルスは、制御されていないウイルス複製をもたらす抗ウイルスIFN-α/β応答を減衰させる可能性がある。好中球および単球/マクロファージの流入は、炎症性サイトカインの過剰産生をもたらす。肺の免疫病理学は、「」サイトカインストーム 「」の結果である可能性がある。NK細胞および特定のT細胞が活性化され、炎症反応を悪化させ、急性呼吸窮迫症候群(ARDS)に寄与する可能性がある。SARS-CoV-2の特異的Absは、ウイルスを中和するのに役立ち、抗体依存性細胞媒介性細胞毒性(ADCC)に関与したり、逆に抗体依存性増強(ADE)を誘導したりする可能性がある。現在までのところ、ほとんどの事象は憶測の域を出ないか、未知のままである。
細胞性免疫はどうなっているのか?
肺の上皮は、外部環境と直接接触する人体最大の表面(200m2以上)である。肺は、SARS-CoV-2のような様々な病原性粒子を微細な飛沫で含んだ空気を毎日約1万リットル吸い込んでいる。したがって、このような病原体への絶え間ない曝露は、挑戦を感知して宿主を保護するために、非常に効率的な免疫システムを必要とする。この目的のために、気道は、病原体からこの組織を防御するためにその表面全体に存在する粘液の層のような物理的障壁に恵まれているだけでなく、細胞および体液性の宿主防御機構の広大なネットワークにも恵まれている。
このネットワークは、主に気道の上皮細胞、樹状細胞(DC)および肺胞マクロファージで構成されている。これらの細胞は、ウイルス粒子の存在下でプロ炎症性下流免疫応答を誘発する。Liaoら(44)は、組織常駐型肺胞マクロファージの枯渇と気管支肺胞ラベージ細胞における炎症性マクロファージの蓄積が疾患の重症度と関連していることを発見した。しかし、SARS-CoV-2の単球/マクロファージ系統の炎症反応への影響をより詳しく調べるには、単球/マクロファージ系統のSARS-CoV-2への感染性をより詳細に調べる必要があるだろう。この急性炎症反応では、好中球も引き寄せられ、主に気管支肺胞腔に局在する(45)。一貫して、COVID-19+患者において好中球レベルの上昇が報告されている(46、47)。重要なことに、肺は全身循環における好中球の最も重要な貯蔵庫を構成している(全身の好中球の約40%)。好中球レベルの上昇は、好中球によって使用される最も強力な抗菌メカニズムとして考えられている両方の活性酸素種(ROS)と好中球細胞外トラップ(NET)の増加に関連付けられていることはもっともらしいである。これらの好中球由来の生成物の不適切なレベルは、肺に浸潤するマクロファージによって開始された「サイトカインストーム」の開発に寄与し、その後、肺組織の部分的な破壊に(図1)(2、48)。
粘膜関連不変T(MAIT)細胞は、自然免疫T細胞の集団を表している。MAIT細胞は、主要組織適合性複合体(MHC)クラスI関連タンパク質MR1によって提示される代謝物を認識する。MAIT細胞の抗菌活性の潜在的なエフェクターには、TNF-α、IFN-γ、IL-17A、IL-22、およびグランザイムBとペルフォリンの分泌が含まれる(49、50)。MAIT細胞頻度の変化は、いくつかのウイルス感染で報告されている;例えば、H7N9インフルエンザに感染した生存者では、致死者からのサンプルと比較して、より高い細胞数が認められた(51)。一貫して、初代末梢血単核細胞とH7N9感染A549気道上皮細胞の試験管内試験(in vitro)共培養は、MAIT細胞の細胞内IFN-γおよびグランザイムBレベルの増加と関連していた(51)。非常に最近の予備的なデータでは、COVID-19+患者におけるMAIT細胞の非常に有意な減少も示唆された;封入時の血中MAIT細胞におけるCD69活性化マーカーの発現は、COVID-19の重症度を予測するものであった(52)。
ナチュラルキラー(NK)細胞は自然免疫のもう一つの重要な要素である(53)。COVID-19患者では、以前にSARSで報告されたように、NK細胞の総数が著しく減少していることが急速に明らかになった(54)(55)。NK細胞は、活性化シグナルと抑制シグナルのいずれかを伝達する様々な受容体を発現している。これらのシグナルの統合は、細胞毒性活性およびサイトカイン分泌を含むNK細胞のエフェクター機能を制御する(53、56)。SARS-CoV-2に感染した患者では、NK細胞上でNKG2A発現が有意に増加した(54)。CD94/NKグループ2メンバーA(NKG2A)ヘテロ二量体受容体は、最も顕著なNK阻害性受容体の一つである。それは、他のHLAクラスI分子のリーダーペプチド配列に由来するペプチドを提示する非古典的な最小多型HLAクラスI分子(HLA-E)に結合する(57)。NKG2Aは、ペプチドを負荷したHLA-Eによってライゲーションされると、2つの阻害性免疫受容体チロシンベースの阻害モチーフを介して阻害性シグナルを誘導し、NKサイトカインの分泌と細胞毒性を抑制する(58)。SARS-CoV-2に感染した進行癌または転移癌患者を対象とした抗NKG2A(モナリズマブ)の存在下での臨床試験が進行中である(ClinicalTrials.gov Identifier: NCT04333914)。しかし、他の細胞マーカーの役割を決定し、疾患の進展に与える影響をよりよく測定するためには、NK細胞のより広範な表現型研究が必要となるであろう。COVID-19患者のNK細胞におけるNKG2Aレベルの増加と一致して、低多機能性が報告されている(54)。したがって、SARS-CoV-2は感染の初期段階でNK細胞が媒介する抗ウイルス免疫を破壊し、効率的な適応免疫の発達に影響を及ぼす可能性がある。NK細胞の能力を高めるために、SARS-CoV-2に感染した30人の肺炎患者を対象に、標準治療との併用によるNK細胞移植の安全性と効率性を評価する第I相臨床試験が進行中である(ClinicalTrials.gov識別子:NCT04280224)。
デングウイルス感染のような他の感染状況では、抗体(Abs)によるNK細胞の活性化は、ウイルス決定因子に特異的なAbsが二次感染を促進するときに生じる制御された抗体依存性増強(ADE)プロセスを増強することができる(図1)。興味深いことに、SARS-CoV感染者の血清がFc受容体を発現する細胞へのウイルスの侵入を促進することが以前に示されている(59, 60)。このメカニズムは、将来のワクチンや抗体をベースとした薬物療法の開発の指針とするために、COVID-19の文脈で広く研究されるべきである。
COVID-19患者に関する予備的なデータをまとめると、SARS-CoV-2は自然免疫系の異なるアームを回避および/または拮抗するために異なる戦略を用いている可能性が示唆される。
細胞適応免疫は?
COVID-19の非生存患者では、死亡するまで重度のリンパ球減少が観察された(12)。一貫して、ヒト患者におけるSARSの急性期は、入院患者の最大80%で顕著な白血球減少と関連しており、CD4およびCD8 T細胞の劇的な喪失と関連していた(61、62)。SARS-CoV感染患者では、Tリンパ球の感染がリンパ球減少と脾臓およびリンパ組織の萎縮に直接寄与することが示された(63)。リンパ球減少症は、SARS患者よりも程度は低いが、MERS患者でも観察される(64)。リンパ減少のメカニズムを理解することで、COVID-19の治療法の新たな戦略の開発への道が開ける可能性がある。いくつかの可能性のあるメカニズムが考えられる。(i) ウイルスはリンパ球に直接感染し、リンパ球死をもたらす可能性があり、最近Wangら(65)がSARS-CoV-1について報告したように。(ii) ウイルスは、骨髄や胸腺などの異なる標的臓器を損傷し、正常に機能しなくなる可能性がある。iii)炎症性サイトカインが大量に産生され、おそらくリンパ球のアポトーシスにつながる。(iv) リンパ球が感染した組織にロックダウンられる(図1)。これらの仮説を確認するためには、さらなる研究が必要である。重要なことは、リンパ球の消失は一過性であったことである;SARS患者のCD8+ Tリンパ球およびメモリーCD4+ T細胞は感染後2-3ヶ月および12ヶ月以内に正常に戻ったが、その他のCD4+ T細胞サブセットは健常対照者よりも依然として低かった(66)。
COVID-19患者を対象とした最初の研究では、CD4+ T細胞におけるIFN-γおよびTNF-αの低レベルが重症度と関連していることが明らかになった。一貫して、CD8+ T細胞において、疲弊した(PD-1+CTLA-4+TIGIT+)サブセットの頻度は、重症群で有意に高かった(67)。従って、重症患者におけるCD8+T細胞の機能性がない(低い)ことは、以前にSARS-CoV感染症で述べたように、効率的な感染制御に影響を与える可能性があった(67)。さらに、COVID-19は、CD4+およびCD8+ T細胞サブセット上のCD25、CD28およびCD69の発現によって決定されるT細胞活性化の有意な減少と関連していた(68)。他の多くの病原体に対する特異的なT細胞応答に関する情報が相次いでいるにもかかわらず、呼吸器CoV感染症についてはあまり知られていない。CD8+ T細胞は、典型的には、インフルエンザウイルスおよび他の呼吸器ウイルスの制御に必要である(68)。さらに、Tレジデントメモリー細胞(TRM)は、インフルエンザウイルスからの再感染を防ぐために重要である(69)。しかし、SARS-Co-V2感染におけるそれらの役割は、より詳細に決定されるべきである。SARS-CoVに感染した発生期マウスでは、CD4+ T細胞と特異的Absの両方が存在しない場合、CD8+ CTLだけではウイルスを除去するのに十分ではない(70)。
一方、SARS感染者におけるCD4+ T細胞の枯渇は、中和性AbsおよびTh1サイトカインの産生を減少させ、肺における炎症性単球の低いリクルートを誘導した。このメカニズムは、SARS-CoVに対する中和性Absの受動的な移行によって回避することができ、CD4が媒介する感染制御はAbsおよび/またはサイトカイン依存性のメカニズムを介して行われる可能性が高いことを示唆している。機械的換気を必要としたH1N1インフルエンザ肺炎の致死的なヒト劇症例では、肺における強力なエフェクターT細胞応答がIFN-γおよびIP-10の高産生とともに観察され、特定のT細胞の肺への大規模かつ効果的な転座が示唆された(41)。
HLAハプロタイプの遺伝的差異もまた、結核、ハンセン病、HIV、B型肝炎、およびインフルエンザについて以前に説明されたように、病原体に対する個人の感受性に寄与することが知られている重要なパラメータである(71)。例えば、HLA-A*11、HLA-B*35、およびHLA-DRB1*10は、H1N1感染に対する感受性をもたらす(72)。SARS-CoV-2については、ウイルスペプチド-MHCクラス-1結合親和性の予備的なin silico解析により、HLA-B*46:01を発現する個体は、SARSについて以前に示されたように、COVID-19に対して特に脆弱である可能性があることが示唆されている。同時に、HLA-B*15:03は、共通のヒトCoV間で共有される高度に保存されたSARS-CoV-2ペプチドを提示する最大の能力を示した(73、74)。この観察は、HLAの分布がSARS-CoV-2に対する細胞免疫応答に影響を与える可能性を示唆しており、世界中のCOVID-19感受性の違いを説明する可能性がある。しかし、特定のHLAハプロタイプが抗SARS-CoV-2免疫の発現と関連しているかどうかを理解することは、ワクチン戦略の開発にとって極めて重要であると思われる。興味深いことに、最初に利用可能な120のSARS-CoV-2配列(2020年2月21日現在)のうち、SARS-CoV-2に特異的ないくつかのB細胞およびT細胞エピトープが、COVID-19に対する保護を潜在的に誘導するスパイクおよびヌクレオカプシドタンパク質について同定された(75)。
結びのコメント
現在の観察では、SARS-CoV-2 は感染の初期段階で免疫応答を回避するように特に適応されていることが示されている。ほとんどのメカニズムは、不適切な1型IFN応答、大規模な炎症性サイトカイン産生、そしておそらくNK細胞機能の欠陥と関連している。予備的なデータはまた、Tリンパ球の枯渇によって示されるように、適応的な免疫回避を示唆している。しかし、現在のエビデンスでは、ヒト病原性CoVの制御にはTh1型応答が重要であることが強く示唆されており、特異的な中和性Absの存在と関連している。疾患の重症度と免疫応答の間には明らかな関係があるが、防御免疫の役割は現在のところ疑問の残るところである。
驚くべきことに、患者の中にはウイルス陽性のままである人もいれば、退院後に再発する人もいることが最近WHOによって報告されている(3)。このことは、現在強く想定されている第二波のパンデミックの発展にも影響を及ぼす可能性がある。ワクチンはこのパンデミックに対抗するための最良の方法であることに変わりはない。しかし、ワクチンの有効性の代替パラメータを定義するためには、回復した患者のT/B細胞応答をよりよくモニターし、川崎様症候群のいくつかの原因不明の症例を除いて、若年者の相対的な保護を含むCOVID-19患者の免疫応答への加齢の影響をよりよく理解することが重要であるはずである。異なるヒトCoV間で重複するエピトープが同定できれば、将来的に複数の病原性CoVから保護する交差反応性ワクチンの設計に役立つ可能性がある。
