Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC7359297/

www.chilipeppermadness.com/frequently-asked-questions/what-is-capsaicin
要旨
アルツハイマー病は加齢に伴う認知症の最も一般的な原因であり、現在は不治の病となっている。現在の臨床試験の失敗と修正可能な危険因子の確立により、リスクの高い集団におけるアルツハイマー病の介入は治療から予防へとシフトしている。
これまでの研究では、アルツハイマー病発症率と辛い食べ物の消費との間に地理的な重複があることが示唆されている。我々は以前、カプサイシンを多く含む食事の摂取が、40歳以上の人の認知機能の改善と血清アミロイドβ(アミロイドβ)値の低下と関連していることを報告した。
今回の研究では、唐辛子の辛味成分であるカプサイシンを摂取することで、APP/PS1マウスの脳のアミロイドβ負荷が減少し、認知機能の低下が改善されることを明らかにした。
カプサイシンは、アミロイド前駆体タンパク質(APP)の処理をα-切断へとシフトさせ、ジスインテグリン・メタロプロテアーゼ10(ADAM10)の成熟を促進することで、アミロイドβの発生を抑制することが、生体内試験および試験管内試験での研究で明らかになった。
また、カプサイシンがタウの高リン酸化、神経炎症、神経変性などの他のアルツハイマー病タイプの病態を緩和することも明らかにした。本研究は、カプサイシンがアルツハイマー病の治療薬候補であることを示唆しており、アルツハイマー病の予防・治療のための栄養補助食品として唐辛子またはカプサイシンを用いた臨床試験が必要であることを示している。
序論
アルツハイマー病は、加齢に伴う認知症の最も一般的な原因であり、社会的・経済的にも大きな負担を強いられている。アルツハイマー病を治す有効な治療法はなく、病気の進行を止める治療法もない。一連の臨床試験が失敗に終わったため、最近では、アルツハイマー病治療の戦略は病気の予防にシフトしており、リスクの高い人々を対象とした臨床試験が行われている1-5。実際、私たちの分析では、世界のアルツハイマー病症例の3分の1は、いくつかの共通の修正可能な危険因子6-8に起因していることを示唆している、そのほとんどは健康的な食事とライフスタイルによってコントロールすることができ、食事とライフスタイルの介入研究のホットスポット9,10を作っている。
唐辛子は、野菜やスパイスとして世界中で消費されている食文化の基本的な要素である。カプサイシンは唐辛子の主成分であり、辛味や辛味の原因となっている。これまでの研究では、中国におけるアルツハイマー病の発生率と辛味食品の消費との間に興味深い地理的な重複があることが示唆されている。中国西部(3.99/1000人)のアルツハイマー病発症率は東部(5.58/1000人)11よりも低く、西部では東部よりも唐辛子を使った料理の割合が高く、辛味の度合いが大きい12,13。以前、カプサイシンを多く含む食事の摂取は、40歳以上の人の認知機能の向上と血清アミロイドβ(アミロイドβ)値の低下と関連していることを報告した14。これらの知見は、カプサイシンがアルツハイマー病に対して保護的である可能性を示唆している。
本研究では、カプサイシンがアルツハイマー病の発症に保護的な役割を果たしているかどうかをさらに調べることを目的とした。我々は、APPswe/PS1dE9(APP/PS1)マウスを用いて、カプサイシンが脳のアミロイドβ負担および認知に及ぼす影響を調べ、ヒト神経芽腫SH-SY5Y-APP695細胞およびAPP/PS1マウスにおいて、カプサイシンがアルツハイマー病の発症にどのような影響を及ぼすかを検討した。さらに、APP/PS1マウスにおけるタウの高リン酸化、神経炎症、神経変性など、他のアルツハイマー病型病態に対するカプサイシンの効果を観察した。
研究方法
細胞培養と治療
ヒト神経芽腫SH-SY5Y-APP695細胞をヒト野生型APP69515で安定的にトランスフェクトした。細胞は、4mMのl-グルタミンと4500mg/Lのグルコース(HyClone、米国)を含むDulbecco’s modified Eagle’s medium(DMEM)中で、37℃、5%CO2で培養した。培地は、10%ウシ胎児血清(FBS、HyClone、USA)で補充した。細菌汚染を避けるためにZeocinTM選択抗生物質(Invitrogen, USA)を添加(100μg/ml)し、マイコプラズマ汚染試験を分析前に行った。カプサイシンとアミロイドβ発生との用量効果関係を観察するために、細胞を無添加(コントロール)または様々な濃度のカプサイシン(0.1,1,5,10,50μM)(Sigma-Aldrich, USA)(Sigma-Aldrich, USA)で24時間培養し、細胞をカプサイシンで処理した際の培養液はFBSを含まなかった。各群の細胞培養液をアミロイドβ40およびアミロイドβ42濃度のELISAに供し、細胞溶解物をAPP代謝物のウェスタンブロットおよびアミロイドβ40およびアミロイドβ42濃度のELISAに三重に供した。
MTT測定法
カプサイシンの毒性を評価するために、細胞を96ウェルプレート(5×104細胞/ml)に播種し、無添加(コントロール)または様々な濃度のカプサイシン(5,10,25,50,75,100,125,150μM)で24時間インキュベートした。 MTT[3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロマイド]アッセイの直前に細胞培養液を変更し、MTTとカプサイシンとの相互作用を回避した。その後、10μlのMTT(5mg/ml、Sigma-Aldrich、米国)溶液を4時間添加し、上清を除去し、100μlのDMSOを添加して色素結晶を溶解させた。490nmでの吸光度を読み取った。カプサイシンは、>75μMの濃度で細胞の生存能力を損なう。75μMの濃度では、細胞生存率が低下する傾向が見られた(補足図1)。
動物と治療
本研究におけるすべてのマウスの飼育手順および操作は、第三軍医大動物福祉委員会の承認を得た。C57BL/6バックグラウンドのAPP/PS1トランスジェニック(Tg)マウスとC57BL/6野生型(Wt)マウスは、ジャクソン研究所から入手し、大坪病院の動物施設で飼育した。マウスは、餌と水への自由なアクセスと12時間の明暗サイクルの下で収容された。Tgマウスには、生後3ヶ月から生後9ヶ月までの無作為化時に、通常の標準飼料(Tg対照群)または0.01%カプサイシン16,17を加えた通常飼料プラス(Tg cap群)を与えた(1群あたりn=8,雌半々、雄半々)。1日の摂取量とマウスの体重から、カプサイシンの1日の摂取量は約30mg/kgと推定した。ベースラインコントロールとして、年齢と性別をマッチさせたWTマウスを用いた。
行動試験
モリス水迷路(MWMY迷路、オープンフィールド試験からなる行動試験のバッテ リーを、以前に説明したように参加マウスの行動性能を評価するために実施した18,19。簡単に言えば、MWM試験は直径120cmの円形プールの中で実施され、ミルクで染色された不透明な水で満たされ、一連の空間的な合図で囲まれていた。水槽は想像上、4つの象限に分割されていた。直径9cmのプラットフォームは、1つの象限の水面下1cmに沈めた。MWM試験は、1日3回のプラットフォーム試験を5日間連続で行い、その後にプローブ試験を行った。プラットフォーム試験では、マウスはプール内を移動してプラットフォームの位置を確認し、脱出することができた。マウスが60秒以内にプラットフォームを見つけられなかった場合は、プラットフォームに誘導した。マウスがプラットフォームに脱出すると、60秒間プラットフォームに留まることが許された。空間学習能力をテストするために、移動した経路の距離と脱出遅延時間を測定した。プローブ試験では、プラットフォームを撤収した。マウスはプール内を1分間自由各象限に滞在した時間と環状突起の交差回数を記録し、記憶の統合を評価した。Y迷路試験は、自発的交替試験と新規腕探索試験から構成されている。Y迷路の装置は、黄色のプレキシグラスの3本の腕(長さ31cm、幅8cm、高さ31cm)を120度の角度で、中心点から放射状に配置したものである。自然交替試験では、マウスを片方の腕の端を壁に向けて置き、5分間迷路の中を自由に歩かせた。交替は、空間的作業記憶のテストを目的としたもので、3つの腕に連続して反復せずに、3つの腕が重なり合ったセットに入ったと定義された。新規腕探索試験では、マウスを家の腕の端に置き、片方の腕(新規腕)を閉じた状態で5分間迷路を探索させた。その間、マウスは迷路内の3本の腕すべてを5分間自由に探索させた。空間認識記憶を測定するために、新規腕への進入率と新規腕での滞在時間を分析した。オープンフィールド試験では、マウスをオープンフィールド装置(長さ50cm、幅50cm、高さ45cm)の中央に置き、5分間自由に探索させた。全移動距離を記録して自発的な運動量を測定し、中心帯と末梢帯の時間の比、リアッピング、グルーミング、排便、排尿の回数を記録して不安のような行動を測定した。すべてのパフォーマンスはビデオ記録され、画像解析ソフトウェア(ANY-maze, Stoelting, Wood Dale, IL, USA)を用いて解析された。
脳のサンプリング
マウスは生後9ヶ月で犠牲にした。マウスの体重には各群間で有意な差はなかった。目から採血し、麻酔下で通常の生理食塩水に0.1%NaNO2を100ml入れて心腔内灌流を行った。脳は先に記載されているようにサンプリングした20。簡単に言えば、左半球は4%パラホルムアルデヒドで固定され、冠状切片は、右半球がスナップ凍結され、液体窒素中の粉末に粉砕し、3つのバイアルに分けながら、組織学的分析のために35μmの厚さで切断された、秤量し、生化学的分析のために-80℃で保存されている。脳のサンプリングと組織学的・生化学的分析は、盲検化のために別の研究者が行った。
組織学と定量
アミロイドβプラークと脳アミロイド血管症(脳アミロイド血管症)
大脳実質のアミロイドβプラークについては、コンパクトなアミロイドβプラークについてはコンゴ赤で、コンパクトプラークとびまん性プラークを含む全アミロイドβプラークについてはフリーフローティング免疫組織化学(IHC)法を用いて脳組織切片を6E10抗体で染色した20。大脳皮質および海馬におけるコンゴ赤または6E10陽性染色の面積率およびプラーク数をImageJソフトウェアを用いて定量化した。脳アミロイド血管症はコンゴ赤染色で可視化し、海馬21の2スライスから手動で選択し、1スライスあたりの脳アミロイド血管症数を定量化した。
組織学と定量化では、各マウスの脳全体にまたがる5つの等間隔の組織切片(〜1.3ミリメートル間隔)のシリーズは、免疫組織化学染色(補足図2)のために使用された。すべての切片を染色し、写真を同時に同じ条件で撮影した。画像は、切片のグループ情報を盲検化した上で、同一条件でImageJソフトウェアを用いて解析した。
タウの病理、神経炎症、神経変性
免疫組織化学は、抗pS396-tau抗体(Signalway, USA)によるリン酸化タウの検出、抗CD68抗体(Abcam, UK)による微小膠原病の検出、抗グリア線維性酸性タンパク質(GFAP)抗体(Abcam, UK)によるアストロサイトーシスの検出に使用された。神経細胞のアポトーシスは、NeuN(Abcam、英国)およびカスパーゼ-3(Millipore、米国)の二重免疫蛍光染色により測定した。神経細胞の損失および神経突起の変性は、NeuNおよび微小管関連タンパク質(MAP)-2(Millipore, USA)の二重免疫蛍光染色により検出した。全面積に占める陽性染色の割合および積算蛍光強度は、ImageJソフトウェアを用いて定量化した。
ELISA
トリス緩衝液(TBS2%ドデシルスルホン酸ナトリウム(SDS)および70%ギ酸(FA)中でのタンパク質の逐次抽出には、脳粉末の1バイアルを使用した。TBS、SDSおよびFA中のヒトアミロイドβ42およびアミロイドβ40のレベルは、ELISAキット(Invitrogen社、米国)を用いて、製造者の指示に従って測定した。脳ホモジネート中のマウス腫瘍壊死因子α(TNF-αインターフェロン-γ(IFN-γインターロイキン-1β(IL-1β)およびIL-6を含む炎症性因子を、対応するELISAキット(R&D Systems,USA)を用いて測定した。
RNA抽出および定量的リアルタイムPCR
TRIzol試薬(Life Technologess,USA)を用いて、製造者の指示に従って脳粉末から全RNAを抽出した。各RNAサンプルについて、等量のtotal RNA(1μg)をiScriptTM cDNA合成キット(BIO-Rアルツハイマー病、USA)を用いてcDNAに逆転写した。qRT-PCRをcDNA(20μl PCRアッセイあたり50 ng RNAに相当)を用いてCFX96TM Real-Time System(BIO-Rアルツハイマー病、USA)上で行った。
ウェスタンブロット
ウェスタンブロット分析のために、脳粉末1バイアルをRIPA緩衝液に懸濁し、タンパク質を抽出した。同量のRIPA抽出されたタンパク質をロードし、4-20% PAGE Gels(KeyGEN BioTECH、中国)で分離し、ニトロセルロース膜に移した。ブロットは以下の一次抗体でプローブした。C末端フラグメント(CTF)-αおよびCTF-βを検出するための抗APP C末端抗体(ミリポア、米国アミロイドβ、全長APP(APPfl)および分泌APP(sAPP)-α(sAPPα)を検出するための6E10(バイオレジェンド、米国)。抗-a disintegrin and metalloproteinase 10(ADAM10)抗体(Abcam、英国);抗-β-secretase 1(BACE-1)抗体(Abcam、英国)。抗プレセニリン-1(PS-1)抗体(Abcam、英国);抗一過性受容体電位バニロイド1(TRPV1)抗体(Millipore、米国);抗ペルオキシソーム増殖因子活性化受容体α(PPARα)抗体(Abcam、英国);抗インスリン分解酵素(IDE)抗体(Millipore、米国)。抗ネプリリリューシン(NEP)抗体(ミリポア社、米国);抗高度糖化最終産物受容体(RAGE)抗体(ミリポア社、米国);抗リポ蛋白質受容体関連蛋白質1(LRP-1)抗体(アブカム社、英国);抗pS199-tau、抗pS396-tau、抗pT231-tau、Tau5抗体(シグナルウェイ社、米国)。抗シナプシン-1(SYN1)抗体(Millipore,USA);抗シナプス密度タンパク質95(脳卒中後認知症95)抗体(Millipore,USA);抗シナプソーム関連タンパク質25(SNAP25)抗体(Millipore,USA);抗ベシクル関連膜タンパク質1(VAMP1)抗体(Abcam,UK);抗β-アクチン抗体(Sigma,USA)を用いた。膜をIRDye 800 CW二次抗体(Li-COR、USA)でインキュベートし、Odyssey蛍光スキャナーを用いてスキャンした。バンド密度は、分析のためにβ-アクチンに正規化した。
統計情報
結果は、特に記載がない限り、平均±SEMとして示されている。2群間の統計的比較は、Studentのt検定またはMann-Whitney U検定を用いて行った。3つのグループを比較するために一方向ANOVAおよびTukeyの検定を使用し、複数のタイムポイントで2つのグループを比較するために二方向ANOVAを使用した。0.05未満のP値(両側)は有意と考えられた。すべての分析は、GraphPad Prismソフトウェア(バージョン7.0)またはSPSSソフトウェア(バージョン20.0)を使用して実施した。
結果
食事性カプサイシンがAPP/PS1マウスの認知障害を救う
アルツハイマー病の認知障害に対する食事性カプサイシンの影響を調べるために、APP/PS1マウスを用いてカプサイシン予防実験を行った。マウスには、アミロイドβ病理が形成されていない生後3ヶ月から0.01%カプサイシンを豊富に含む食事または標準的な食事を与え、広範なアミロイドβ病理と明らかな認知障害が生じる生後9ヶ月の時点で解析を行った。APP/PS1対照マウスは、Wtマウスと比較して、学習能力および空間参照記憶の障害を示したが、カプサイシン食を受けたマウスは、逃げ遅れの有意な減少によって反映されるような改善された空間学習能力を示し、MWM試験において、APP/PS1対照マウスと比較して、より多くのプラットフォーム領域の交差の数およびより多くの目標象限に費やされた時間によって反映されるより良い記憶の統合を示した(図1a、b)。プラットフォーム試験中の泳ぎ速度やプローブ試験中のプラットフォームまでのパスの長さには、各グループ間で差はなかった(補足図3a、b)。カプサイシン食を受けたAPP/PS1マウスはまた、Y迷路試験において、より多くの新規アームへのエントリーおよびより多くの時間を示し、これはより優れた空間認識記憶の反射であった(図1c)。しかしながら、マウスは、Y迷路の自発的探索試験において、異なる性能を示さなかった(補足図3c、d)。また、オープンフィールド試験では、カプサイシン処理したマウスでは、移動距離が長く、飼育回数が多く、中心帯と末梢帯の滞在時間の比率が減少しており、運動量の増加と不安様行動が示唆された(補足図1d、e)。以上のことから、食事性カプサイシンはAPP/PS1マウスの認知機能の低下を防できることが示唆された。
図1 カプサイシンはAPP/PS1マウスの行動性能を改善する
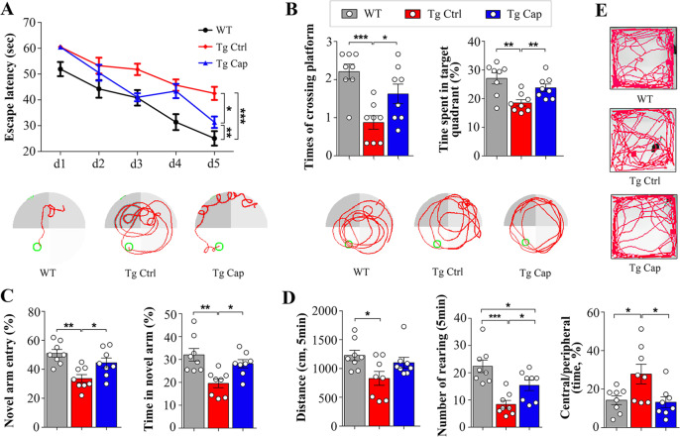
a モリス水迷路のプラットフォーム試験中の脱出潜時(双方向ANOVA)とモリス水迷路のプラットフォーム試験中の代表的なトレースグラフ。 b モリス水迷路のプローブ試験中のプラットフォーム横断時間と目標象限内での滞在時間(一方向ANOVAに続くトルコ検定)とモリス水迷路のプローブ試験中の代表的なトレースグラフ。d オープンフィールド試験における移動距離,リアリング数,中央部と周辺部での滞在時間の比率(一方向 ANOVA 後に Turkey’s test)。グループあたりN = 8。値は平均±SEMとして示されている。p < 0.05,***p < 0.01,***p < 0.001,両側。Tg APP/PS1トランスジェニックマウス、WT野生型マウス、カプサイシン、Ctrlコントロール。
食事性カプサイシンはAPP/PS1マウスのアミロイドβ病理学を減衰させる
アミロイドβプラーク形成前のカプサイシン処理がAPP/PS1マウスの脳におけるアミロイドβ沈着を抑制するかどうかを検討した。全アミロイドβプラークについてはアミロイドβIHC染色(6E10コンパクトアミロイドβプラークについてはコンゴ赤染色を行った。カプサイシンを投与したマウスは、APP/PS1対照マウスと比較して、大脳皮質および海馬の全プラークおよびコンパクトプラークともに面積率およびプラーク密度の有意な減少を示した(図2a,b)。また、コンゴ赤染色により、脳アミロイド血管症の形成を反映する血管壁のアミロイドβ沈着がカプサイシン投与マウスで減少することが示された(図2c、d)。これらのデータと一致するように、ELISAアッセイは、カプサイシンで処置したマウスの脳ホモジネート抽出物のTBS(細胞外可溶性アミロイドβSDS(細胞内可溶性アミロイドβ)およびギ酸(不溶性アミロイドβ)画分中のアミロイドβ42,アミロイドβ40および総アミロイドβのレベルが、対照と比較して有意に低いことを示した(図2e)。ELISAの結果から、APP/PS1マウスの脳内では、カプサイシンを摂取することにより、総アミロイドβ負荷が32.3%減少したことが明らかになった。以上の結果から、食事性カプサイシンはアルツハイマー病の予防効果があることが示唆された。
図2 カプサイシンはAPP/PS1マウスにおけるアミロイド沈着を改善する

a Tg Ctrl群およびTg Cap群におけるコンゴ赤染色および6E10免疫組織化学(IHC)染色の代表的な画像。インセットは、より高い倍率での代表的なプラークを示す。スケールバー、500μm。 b 大脳新皮質(NC)と海馬(HC)における6E10-またはコンゴ赤陽性プラークの比較。 c コンゴ赤染色を用いて可視化した脳アミロイド血管症(脳アミロイド血管症)の代表的な画像。インセットは、より高い倍率で脳アミロイド血管症の代表的な形態を示す。他の脳アミロイド血管症は黒星でマークされている。e 脳ホモジネートのTBS、SDSおよびギ酸(FA)画分中のアミロイドβ40,アミロイドβ42および総アミロイドβレベルをELISAで測定した比較。アミロイドβレベルは脳組織の重量に正規化した。N = 8/群、スチューデントのt-検定、両側。p < 0.05,***p < 0.01,***p < 0.001。棒グラフは平均±SEMを示す。Tg APP/PS1トランスジェニックマウス、カプサイシン、Ctrlコントロール。
カプサイシンは、APPの非アミロイド性処理を促進することにより、アミロイドβの生成を阻害する。
カプサイシンによるアミロイドβの還元機構を探るために、ヒト野生型APP695を過剰発現するヒト神経芽腫細胞であるSH-SY5Y-APP695細胞を、様々な濃度のカプサイシンの有無で処理した。アミロイドβは、神経細胞内でβ-セクレターゼとγ-セクレターゼによってAPPが逐次切断され、細胞外に分泌されることで得られる22。まず、細胞溶解液および培養液中のアミロイドβ40およびアミロイドβ42レベルを測定した。その結果、カプサイシン処理により、SH-SY5Y-APP695細胞溶解物中のアミロイドβ40とアミロイドβ42の両方のレベルが用量依存的に低下した(図3a、b)。培養液中のアミロイドβ40レベルもカプサイシンにより用量依存的に減少した(図3c3c)一方、培養液中のアミロイドβ42は低濃度のため検出されなかった(データは示されていない)。次に、細胞溶解物中の完全長APPおよびAPP処理産物のレベルを調べた。その結果、カプサイシンは全長APPの発現に影響を与えないが、用量依存的にCTF-α/CTF-βの比率を増加させることがわかった(図3d-f)。これらの結果から、カプサイシンはAPPの処理をα-切断へとシフトさせることでアミロイドβの生成を抑制することが示唆された。
図3 アミロイドβ代謝に対するカプサイシンの効果
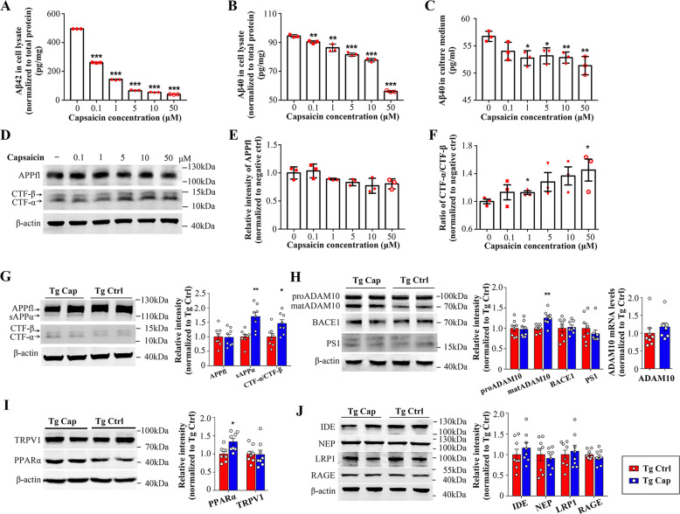
a-c 細胞溶解物中のアミロイドβ42およびアミロイドβ40レベル、および培養液中のアミロイドβ40レベルを、様々な濃度のカプサイシンの有無にかかわらず24時間処理したSH-SY5Y-APP695細胞においてELISA法で測定した。(N = 3,平均±SEM; スチューデントのt検定、両側。**p < 0.01,**p < 0.001) d 様々な濃度のカプサイシンを24時間投与した、または投与しないSH-SY5Y-APP695細胞における全長APP(APPfl)、CTF-αおよびCTF-βのウエスタンブロット。e, f ウェスタンブロットにより測定したSH-SY5Y-APP695細胞溶解物中のAPPflおよびCTF-α/CTF-βの比率の定量分析(N = 3,平均±SEM;スチューデントのt検定、両側。*p < 0.05, **p < 0.01)。 h 脳ホモジネート中のウエスタンブロットおよび qRT-PCR による APP 切断酵素および ADAM10 mRNA レベルの定量分析(N = 8/群、平均値 ± SEM; Student’s t 検定、両側。j 脳ホモジネート中の血液脳関門におけるアミロイドβ分解受容体およびアミロイドβ輸送受容体のウェスタンブロットおよび定量的分析(N = 8/群、平均±SEM; Student’s t test, 両側)。Tg APP/PS1トランスジェニックマウス、Cap Cap Capsaicin、Ctrl Control。
次に、APP処理に対するカプサイシンの効果を検証するために、APP/PS1マウスの脳ホモジネート中のAPPおよびその処理産物を測定した。試験管内試験での結果と一致して、カプサイシンは全長APPの発現に影響を与えなかった(図3g)。我々は、カプサイシンで処置したマウスの脳において、対照と比較して、sAPPαおよびCTF-α/CTF-βの比率が有意に増加していることを発見した(図(Fig.3g).3g)。我々の生体内試験での結果は、カプサイシンがAPPの非アミロイド性処理を促進することを介してアミロイドβ産生を抑制することを支持するものである。
上記の知見をさらに検証するために、我々はAPPの処理に関与するセクレターゼのレベルを測定した。ADAM10は、α切断を触媒し、APPの非アミロイド化処理を促進する主要なαセクレターゼである。ADAM10は、最初に不活性なプロ酵素(proADAM10)として生成され、そのプロドメイン23,24を除去した後、活性なプロテアーゼに成熟する。我々は、カプサイシン処理はAPP/PS1コントロールと比較してmatADAM10の脳レベルを有意に増加させるが、proADAM10タンパク質またはmRNA発現には影響を与えないことを発見した(図3h),3hカプサイシンはその成熟または活性化を促進することによってADAM10のレベルを増加させることを示唆している。しかし、APPのアミロイド生成処理を担うBACE1やPS1には有意な差は認められなかった(図3h(図3h)3h)。
脂肪酸代謝に関与する遺伝子を調節する転写因子PPARαの活性化は、APP25のADAM10介在性タンパク質分解を刺激する可能性があることが報告されている。APP/PS1マウスの脳内PPARαレベルを測定したところ、カプサイシンを投与したマウスの脳内PPARαレベルは、対照マウスに比べて増加していることがわかった(図3i)。また、カプサイシン受容体として知られるTRPV1のレベルも検出した。残念ながら、2つのグループ間のTRPV1発現の有意差は観察されなかった(図3i3i)。
さらに、血液脳関門(BBB)を越えて、アミロイドβ分解酵素IDEおよびNEP、およびアミロイドβトランスポーターLRP-1およびRAGEを含むアミロイドβクリアランス関連分子を試験した。これらのタンパク質のいずれも、両群間で有意な差を示していなかった(図3j)。我々の知見は、カプサイシンがAPPの処理をα-cleavageにシフトさせ、ADAM10の成熟を促進することでアミロイドβの生成を阻止することを示している。
食事性カプサイシンはAPP/PS1マウスにおける他のアルツハイマー病型病態を減衰させる
APP/PS1マウスの脳内でカプサイシンが他のアルツハイマー病型病態に影響を与えるかどうかを調べた。カプサイシンは、異なる脳領域および異なるリン酸化部位におけるタウの過リン酸化を有意に減衰させた。大脳新皮質および海馬の両方におけるフォスフォ・タウ(pS396)陽性ニューロンは、カプサイシン処理マウスの脳において、対照と比較して有意に減少した(図4a)。また、Ser199(pS199pS396およびThr231を含む複数のエピトープにおけるタウリン酸化のレベルは、カプサイシン投与群で減少したが、総タウ(tau5)は両群間で有意な差を示さなかった(図4b.4b)。神経炎症は、活性化ミクログリアおよびアストロサイトのレベルの減少、およびTNF-α、IFN-γ、およびIL-6を含むプロ炎症性因子のレベルの減少によって反映されるように、APP/PS1対照と比較して、カプサイシン処理マウスの脳内で有意に改善された(図4c、d)。カプサイシンはまた、APP/PS1マウスの神経変性を減衰させた。脳卒中後認知症95,SYN1,SNAP25およびVAMP1を含むシナプス関連タンパク質の免疫反応活性は、カプサイシンで処理したAPP/PS1マウスの脳内で有意に上昇した(図4e)。また、APP/PS1対照マウスと比較して、カプサイシン処理マウスでは、海馬において、NeuNおよびMap-2の蛍光染色強度が増加し、活性化されたカスパーゼ-3の強度が低下していた(図4f)。以上のことから、カプサイシンはAPP/PS1マウスの脳内でタウの高リン酸化、神経炎症、神経変性から保護することが示唆された。
図4 カプサイシンはAPP/PS1マウスのアルツハイマー病型病態を減衰させる。

a 大脳新皮質と海馬におけるPS396免疫組織化学染色とpS396陽性染色の定量分析の代表的な画像。インセットは、高倍率での代表的な形態を示す。スケールバー、50μm。 bウエスタンブロットと脳ホモジネートの複数のサイトでリン酸化タウの定量化。 c免疫染色と新皮質と海馬の活性化ミクログリオシス(CD68)とアストロサイトーシス(GFAP)の定量化。インセットは高倍率での代表的な形態を示す。スケールバー、500μm。 d Tg CtrlマウスとTg Capマウスの脳ホモジネート中の炎症性因子のELISAアッセイ。f 抗NeuNおよび抗MAP-2免疫蛍光で染色された海馬のCA1領域のニューロンおよび樹状突起の蛍光強度(相対積分密度)の代表画像および定量化、および活性化カスパーゼ-3免疫蛍光で染色されたCA3領域のニューロンのアポトーシス。スケールバー、20μm。グループあたりN = 8。データは平均±SEMとして示されている。スチューデントのt検定、両側。p < 0.05,***p < 0.01,***p < 0.001。Tg APP/PS1トランスジェニックマウス、CapCapsaicin、Ctrl Control、IntDen統合密度。
議論
アルツハイマー病の病因は多因子性であり、いくつかの潜在的に修正可能な危険因子と保護因子が同定されている。食事パターンは、アルツハイマー病26-29のリスクとリンクされている。健康的な食事は、多面的なライフスタイルの介入のアプローチの一つのコンポーネントとして、いくつかの試験で認知機能障害の予防に有益な効果を示している1,30-32。今回の研究では、唐辛子の主な辛味成分であるカプサイシンが、APP/PS1マウスの脳内アミロイドβ負荷を効果的に減少させ、神経変性を抑制し、認知機能を改善することを示した;生体内試験および試験管内試験試験では、カプサイシンがAPPの非アミロイド化処理を促進することでアミロイドβの生成を抑制することが示された。アミロイドβの過剰産生は、アルツハイマー病33,34の発症に重要な役割を果たしている。アミロイドβは、β-およびγ-セクレターゼを介したAPPの逐次的な切断によって生成される。あるいは、APPは、アミロイドβドメイン内でα-セクレターゼによって切断され、アミロイドβの生成を妨げることができる。α-セクレターゼ活性の増加は、競合的にAPPのβ-セクレターゼ処理およびアミロイドβ産生の減少を引き起こす35。ADAM10は、脳内のAPPのエクトドメインの脱落に関与する主要なα-セクレターゼである36,37。本研究では、カプサイシン処理によりADAM10の成熟度が上昇し、それによりアミロイドβ生成が抑制されることを見出した(図5)。さらに、カプサイシンはPPARαのレベルもアップレギュレーションしており、これはADAM10が介在するAPP25のタンパク質分解を活性化する可能性があり、カプサイシンはPPARαのアップレギュレーションを介してADAM10を活性化する可能性が示唆された。
図5 カプサイシンがアミロイドβの生成を阻害する様子を示す模式図
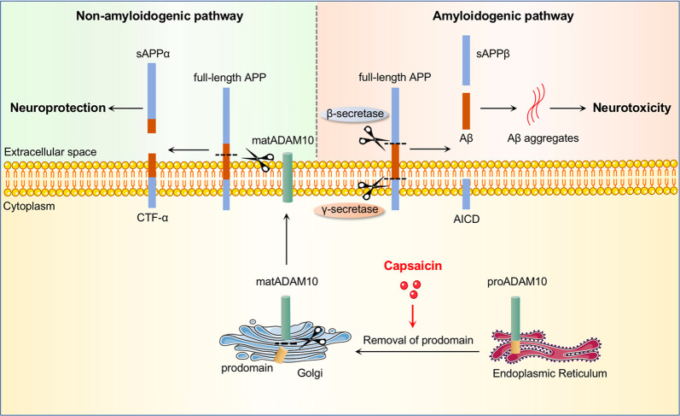
APPの処理には、非アミロイド原性経路とアミロイド原性経路がある。アミロイド生成経路では、β-およびγ-セクレターゼによるAPPの逐次的な切断によりアミロイドβが生成される。非アミロイド原性経路では、APPはアミロイドβドメイン内でα-セクレターゼによって切断され、アミロイドβの生成を妨げる。α-セクレターゼ活性の増加は、APPのアミロイド原性処理を競合的に阻害し、アミロイドβ生成を減少させる。proADAM10は小胞体で発現し、ゴルジ体で処理され、proADAM10のプロドメインが除去されて成熟ADAM10(matADAM10)が生成され、その後、matADAM10は形質膜に輸送され、触媒機能を実行する。カプサイシンはADAM10の成熟を促進し、それによってAPPの処理をアミロイド生成経路から非アミロイド生成経路にシフトさせ、アミロイドβの生成を阻止する。
アルツハイマー病患者では、ADAM10活性は脳脊髄液および脳サンプルの両方で低下している38,39。最近、ADAM10のプロドメインにいくつかのまれな変異が後期発症アルツハイマー病(高齢発症型アルツハイマー病)と関連しており、2つの変異はα-セクレターゼ活性を低下させてアミロイド病理を促進することが知られている40。今年、ゲノムワイド関連研究(GWAS)により、ADAM10に共通する変異が同定され、アルツハイマー病リスクの増加と関連していることが確認された41。これらの知見は、ADAM10のレベルと活性の低下がアルツハイマー病発症に関与していることを示唆しており、ADAM10は有望な治療標的である43。ADAM10 の過剰発現は、アミロイドβレベルを低下させ、プラークへの沈着を防止するとともに、動物の認知障害を救済することができる35。間接的なαセクレターゼ活性化剤として、GABA受容体モジュレーターであるエタゾレート、5-HT4アゴニストであるPRX-03140,緑茶由来のポリフェノール化合物であるエピガロカテキンガレートなど、いくつかの薬剤がアルツハイマー病の臨床試験段階に進んでいるが、現在までに結果は発表されていない(NCT00880412,NCT00693004,NCT00951834)。現在のところ、直接的なα-セクレターゼやADAM10活性化剤はアルツハイマー病治療には使用されていない。我々の知見は、カプサイシンが天然のADAM10活性化剤であり、アミロイド病理を減衰させ、アルツハイマー病から保護する可能性を示していることを示唆している。しかし、アミロイドβ生成に対するカプサイシンのADAM10介在性阻害効果を実証するためには、ADAM10の阻害またはノックアウトなどの更なるメカニズム研究が必要である。
TRPV1はカプサイシン受容体として知られている。最近の研究では、TRPV1を遺伝子的にアップレギュレーションすることにより、ADモデルマウスの脳内のアミロイドβ負担が減少し、生体内試験および試験管内試験で記憶力の低下やアミロイドβ誘発の神経細胞機能およびネットワーク障害が改善されたことが報告されている44,45が、議論の余地がある46。今回の研究では、カプサイシンを多く含む食事を与えたマウスと標準的な食事を与えたマウスでは、TRPV1の発現に有意な差は認められなかった。TRPV1はカルシウム透過性の非選択的陽イオンチャネルであることから、カプサイシンが空間構造を変化させることでTRPV1を活性化し、発現には影響を与えない可能性がある。
我々の以前のコホート研究では、40歳以上の被験者において唐辛子の消費が認知障害に対して保護的であることが示唆されている14。非常に最近の論文では、中国で実施されたオープンコホート研究において、唐辛子の摂取量の増加が記憶力の低下の悪化と関連していることが示唆されている47。しかし、この研究では、客観的な自己申告による記憶力低下を用いていることや、唐辛子の摂取量が多い被験者は低学歴であることから、大きなバイアスがかかっていた。今回の知見は、唐辛子の消費による認知への保護効果をさらに支持するものである。これまでの研究では、カプサイシンが野生型マウスやラットの認知能力を向上させることが報告されているが、45,48,49の議論があり、いずれの研究でもカプサイシン投与による明らかな副作用は認められていない。カプサイシンが野生型動物や健康なヒトで記憶力を向上させることができるかどうかを明確にするためには、さらなる研究が必要である。さらに、カプサイシンは、タウの病理と認知障害のみを示し、アミロイドβプラークを示さないストレスや薬物誘発性の非特異的ADモデルにおいて、タウの変化やアミロイドβ非依存性経路での行動障害を改善することが報告されている50-52。本研究では、APP/PS1トランスジェニックADマウスモデルを用いた。このモデルでは、タウの高リン酸化は二次的にアミロイドβ病変を示す。したがって、我々の研究では、タウのリン酸化と病態の減少は、主にカプサイシンによるアミロイドβ産生の減少に起因していると考えられる。これまでの研究と我々の研究は、カプサイシンが複数の病態を標的にしてアルツハイマー病を防御することを示唆している。我々の結果とは対照的に、別の研究では、カプサイシンを皮下注射することで、Sprague-Dawleyラットの膜結合APPのレベルが向上することが示された53。この研究では、カプサイシンを2日間に2回皮下注射することで急性・短期治療を行ったが、本研究や上記の研究では、カプサイシンを経口投与または胃内注入することで慢性的な長期治療を行っている。このことが、これらの研究間の結果の違いを説明しているのかもしれない。今回の研究で使用したカプサイシンの用量(30mg/kg)は、ヒトの1日の摂取量よりも多い。低用量(1~2mg/kg)のカプサイシンは抗てんかん作用を示した54,55 が、高用量(10~120mg/kg)のカプサイシンは動物モデルでてんかん促進作用を示したとの報告がある56,57。我々の研究では、カプサイシン投与マウスでは明らかな発作の発生や死亡率の増加は認められなかった。ヒトと動物の両方でアルツハイマー病のためのカプサイシンの安全かつ有効な用量は、今後の研究で決定する必要がある。
辛味食品の天然成分としてのカプサイシンは、アルツハイマー病の介入戦略としての潜在的な利点を持っている。唐辛子が世界中の食文化の重要な一部であり、香料としての応用の長い歴史を持っていることを考えると、アルツハイマー病予防のために利用することは可能である。さらに、カプサイシンは、肥満、心血管疾患、高血圧、動脈硬化などの様々な人間の疾患、そのようなアルツハイマー病の危険因子として確立されている16,17,58のための潜在的な治療分子である。以上のことから、現在およびこれまでの知見は、カプサイシンがアルツハイマー病の発症を促進する複数の経路を標的とすることでアルツハイマー病を予防する可能性があることを示唆している。
結論として、唐辛子の辛味成分であるカプサイシンのアルツハイマー病治療への応用を明らかにした。カプサイシンは臨床応用に向けて動き出しており、現在、難治性神経障害性疼痛、尿毒症性そう痒症、関節リウマチの緩和のためにクリームやジェルなどの外用剤として使用されている。今回の知見は、唐辛子やカプサイシンをアルツハイマー病予防のための栄養補助食品として使用する臨床試験の将来性を保証するものである。一方、世界的な疫学研究は、カプサイシンが豊富な食事とアルツハイマー病の有病率との関連を探るために価値がある。

