Can oral infection be a risk factor for Alzheimer’s disease?
オンラインで公開2015年9月17日
pubmed.ncbi.nlm.nih.gov/26385886/
Ingar Olsen1,* and Sim K. Singhrao2
要旨
アルツハイマー病(AD)は、将来、公衆衛生予算から莫大な資源を流出させる長寿の惨劇である。現在のところ、この認知症の最も一般的な形態の人間の診断バイオマーカーおよび/または治療法はない。アルツハイマー病には、家族性の早期発症のものと、散発性の後期発症のものがある。2つの主要な特徴であるアミロイドベータと神経原線維のもつれとは別に、炎症はアルツハイマー病神経病理学の特徴である。炎症は局所的な中枢神経系の障害および/または末梢感染によって引き起こされることがある。細菌(主に口腔内および非口腔内トレポネーマ種)ウイルス(単純ヘルペスⅠ型)酵母(カンジダ種)に至るまで、多数の微生物がアルツハイマー病脳内で疑われている。歯周病原体と非口腔トレポネーマ種の細菌との因果関係は、アミロイドβと炎症のリンクを介して提案されている。歯周炎は、日常的な一過性のバクテリウムによる無傷の細菌や病原性因子、炎症メディエーターを脳に与える末梢性口腔感染症を構成している。遺伝的危険因子が脳内の環境危険因子と出会うと、疾患が発現し、その中で神経認知が影響を受け、認知症の発症につながる可能性がある。アルツハイマー病の診断バイオマーカーや予防的治療法を見つけるという目標を達成するためには、まずその病態に寄与する病因のパズルを解く必要がある。そこで、本レビューでは、後期発症型アルツハイマー病(高齢発症型アルツハイマー病)の最も有力な病因として、口腔感染を取り上げた。
キーワード
アルツハイマー病、病態、微生物、口腔内細菌、直接原因
アルツハイマー病は神経変性疾患であり、認知症として顕在化する疾患群の中で最も一般的な例である。アルツハイマー病は、特に脳の海馬領域の萎縮と特異的な神経細胞死に関連している(1)。家族性発症型は全アルツハイマー病症例の約2%を占め、高齢発症型アルツハイマー病とも呼ばれる散発性の後期発症型は約98%を占めている。高齢発症型アルツハイマー病は遺伝的感受性を示し、その中でもアポリポ蛋白(APOEɛ4)遺伝子対立遺伝子(2)の遺伝が危険因子として知られており、疾患発現には環境因子が必要とされている。例えば、病原体と宿主の相互作用は、80歳以上の年に可能性が高い高齢発症型アルツハイマー病(3,4)と診断される場合、いくつかの高齢者の神経認知を悪化させることができる。したがって、このレビューの根拠は、共通の危険因子に依存している高齢発症型アルツハイマー病症例の膨大な割合の病因を説明しようとすることである。複数の科学者が、末梢感染(5-11)とそれに伴う全身性および局所性の炎症性メディエーター(11-13)がその一つであると提案している。これらのうち、経口感染によるもっともらしいリスクが本レビューの主な焦点である。
アルツハイマー病の有病率
アルツハイマー病は、すべての人への医療提供の質の高さに起因する長寿の負担である。この要因は、今後40年の間に私たちの社会で生きるアルツハイマー病の対象者が4倍になることに貢献する可能性が高い(14)。2050 年までに米国では約 1,300 万~1,400 万人が アルツハイマー病 を患う可能性があり、その総費用は 1 兆ドル以上に上ると推定されている。85歳以上でアルツハイマー病の診断を受ける確率は1:3を超えている(15)。英国では80歳以上の6人に1人が認知症である(16)。米国におけるアルツハイマー病の有病率の推定では、現在65歳以上の500万人以上がアルツハイマー病に苦しんでいることが示されている(1, 15)。約20万人の被験者が早期発症の家族性アルツハイマー病と診断され、この病気の医療費は年間約2000億ドルです(1)。アルツハイマー病が米国および世界中で急速に大きな健康問題になりつつあることは明らかであり、公衆衛生予算や介護サービスを財政的に消耗することになる。
アルツハイマー病脳の神経病理学的特徴
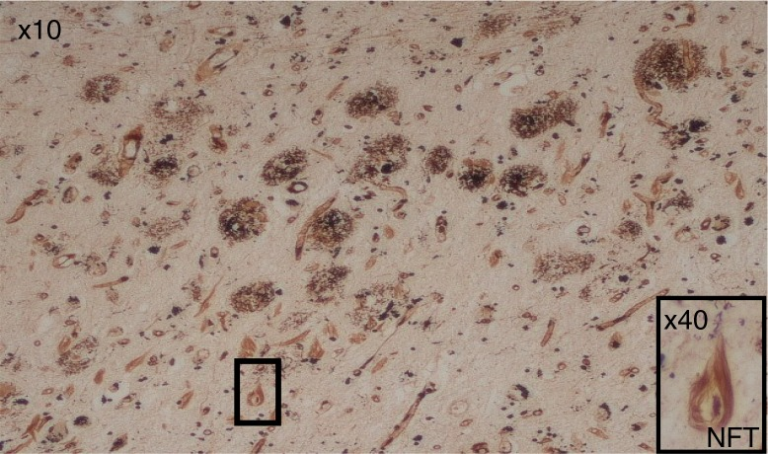
アルツハイマー病脳はいくつかの神経病理学的特徴を持っているが、そのうちの2つの主要な特徴(図1)は、進行中の神経変性過程のプロテオスタシスに由来しており、死後の疾患の確定診断には不可欠です(17)。ホールマークタンパク質の1つは、細胞外の不溶性プラークの形でフィブリルからなり、主にアミロイドβ(アミロイドβ)からなる(18)。可変サイズのこれらのペプチド沈着物は、より長いアミロイド前駆体タンパク質(APP)からそれを切断するセクレターゼ酵素(α-、β-、およびΥ-セクレターゼ)に依存する。初期の報告では、フィブリラーアミロイドβはアポトーシス誘導によりあらゆる種類の細胞を死滅させることが示されているため、神経毒性があることが示唆されていた(19)。しかし、アミロイドβ40とアミロイドβ42のアミノ酸残基からなる2つの不溶性フィブリラーアミロイドβアミロイドペプチドが知られており、これらはヒトの脳内で異なる生理学的状態を示す。科学者の間では、認知無傷者の加齢脳にもアミロイドβ斑が見られることから、より大きな(アミロイドβ42)ペプチドが神経毒性を示すという一般的なコンセンサスがある。しかし、認知機能が損なわれていない脳では、これらのプラークは数が少なく、通常は拡散性のアミロイドβ40型であり、まだ知られているように病理学的な意義はないように思われる。また、アミロイドβには可溶性の単量体型、二量体型、多量体型がある(21)。これらのアイソフォームの相対的な神経毒性は不明である(22)。
図1 アルツハイマー病の病理学的特徴である多数の細胞外アミロイドアミロイドβプラークと神経内神経原線維のもつれ(NFT)
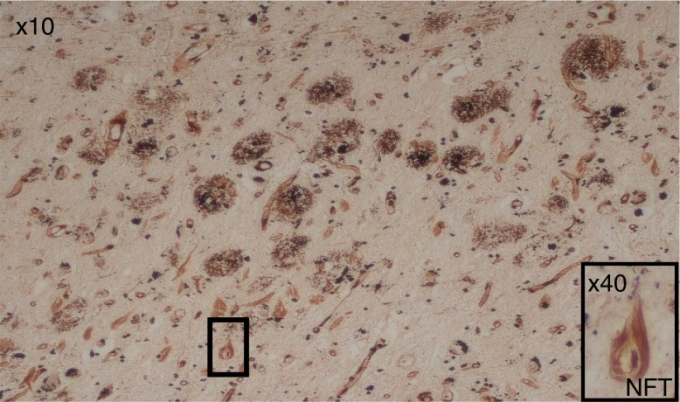
NFTはいくつかあるが、10倍、40倍の対物レンズ倍率で箱に入っているものは1つだけである。
より最近では、アルツハイマー病脳で放出されたアミロイドβ(40/42)ペプチドの線維状の形態はまた、感染から宿主を保護するために作用する「ディフェンシン」または自然免疫防御分子として認識された(23)。例えば、前述のアミロイド原性ペプチドはいずれも細菌の膜に結合し、その方法で細菌細胞を溶かすことができる。Aβは抗菌ペプチド(AMP)として作用しているが、脳の古代/近代の自然免疫防御機構の一部である可能性がある。AMPは、グラム陰性およびグラム陽性の細菌、エンベロープされたウイルス、原虫を標的とする強力な、広範なスペクトルを持つポア形成剤である(23)ことから、アルツハイマー病が感染源を持つという仮説を支持している。
さらに、老人斑(アミロイドβ42)は、ミクログリア細胞の活性化を刺激し、局所免疫応答を開始する引き金として認識されている(24)。活性化したミクログリアは、中枢神経系(CNS)における炎症の最も重要な原因である(25)。ミクログリアは多くの炎症促進性サイトカインを分泌し(24-26)、中枢神経系の感染に反応して細菌やその細胞破片上のパターン関連分子パターン(PAMPs)を認識する(27-30)。
もう一つのアルツハイマー病の病理学的特徴は、細胞内に高リン酸化タウと熱ショック蛋白質が蓄積して神経原線維のもつれ(NFTs)を形成することである。高リン酸化タウタンパク質は微小管の重合と安定性を変化させ、その機能を低下させる(31)。アルツハイマー病におけるNFTsは疾患の重症度を反映しているが、アルツハイマー病脳におけるNFTsの発生に対する病原体-宿主相互作用の意義は十分に理解されていない。現在の遺伝的証拠は、異常な自然免疫応答(32,33)とコレステロール脂質遺伝子(34)がアルツハイマー病発症においてより大きな意義を持つことを指摘している。機能不全免疫系と高脂血症の素因はまた、アルツハイマー病における血管病変と炎症、アミロイドβ沈着と微生物による血流低下の役割を支持している。
進行したアルツハイマー病の病態では、シナプス機能障害も記憶力の低下に関連した構造的欠陥である(35-37)。循環的な議論ではあるが、栄養不良はシナプスの段階的な喪失に一役買っており、生活中の歯の数が少ないことはアルツハイマー病の危険因子として知られている(38)。神経細胞は、複数の神経伝達物質を発現することで傷害に応答する能力を持っている。アルツハイマー病では、前脳基底部のコリン作動性ニューロンの選択的な喪失(39)もまた、認知機能の喪失と相関している(18,35)。
アミロイドカスケード仮説
アルツハイマー病の発症に関しては、いくつかの仮説が立てられていた。アミロイドカスケード仮説は、特に家族性のアルツハイマー病(40)のモデルとなっており、これは21番染色体上に位置するアミロイドβタンパク質前駆体と、14番染色体上に位置するプレセニリン1と2がそれぞれ関与する突然変異によって引き起こされる疾患であり、アミロイドβの沈着に向けてAPP遺伝子の処理を強化する(41,42)。GlennerとWong(43)によって最初に提案されたモデルは、神経変性疾患がアミロイドβの生成とクリアランスの不均衡に起因していると主張している。ゲノムワイド関連研究(GWAS)では、補体受容体1(CR1)遺伝子がアルツハイマー病の発症に役割を果たしていることが強調された(44)。膜結合調節タンパク質であるCR1の認識された役割の一つは、C3bオプソニンと結合する能力である(図2)。CR1 は特に赤血球膜に豊富に発現しており、老廃物を肝臓や脾臓に運ぶことで免疫複合体のクリアランスに関与している。CR1遺伝子は高齢発症型アルツハイマー病の危険因子であることから、脳内でのアミロイドβのクリアランス障害の可能性として機能喪失が示唆される。他の暫定的な説明としては、CR1タンパク質のアイソフォーム(長い型と短い型)の違い(45)が示唆されており、長い型はより多くのC3bと結合する能力を介して疾患プロセスへの関与が少なく、脳内でのアミロイドβのより効果的なクリアランスを促進する(46)。このプロセスは必然的に、より多くのアミロイドβプロテオスタシスの蓄積と補体経路の活性化を伴う疾患発現に有利な形で失敗する。アミロイド仮説は何度か修正されてきたが、特にアミロイドβの可溶性オリゴマーが、シナプス機能障害、萎縮、神経細胞の喪失につながるカスケードを開始する疾患の初期の前臨床段階に寄与している可能性があることが判明したためである(47)。
図2 APOɛ遺伝子ノックアウトマウス(ApoE-/ -)の24週目にP. gingivalisとの単回感染後、iC3bによってオプス化された海馬CAニューロンの免疫蛍光ラベリング(緑のドット)
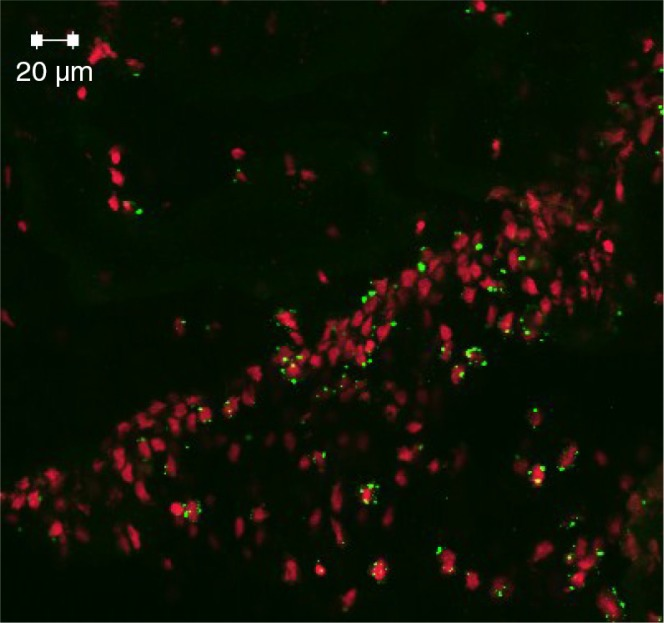
これは、経口感染が宿主の脳に影響を与えた間接的な証拠である。
炎症性仮説
内因性モデル
現在、アルツハイマー病の炎症仮説には、内在性と外在性の2つのモデルがある。内在性炎症モデルは、無傷の「血液脳関門」(BBB)が神経毒性免疫分子や全身性リンパ球の脳への侵入を制限していることを説明している。その結果、脳のグリア細胞は、異物の侵入を受けたときに局所的で完全な自然免疫系を生成することができる(26, 48-50)。歴史的に、神経炎症は主にアミロイド仮説の下流の結果であると考えられてきた。アミロイド原性ペプチドの存在により、ミクログリアが活性化され、炎症促進カスケードを開始し、神経細胞に変性変化をもたらす神経毒性物質が放出されるのである。GWASは現在、自然免疫遺伝子(44, 51)が危険因子であることを示唆しており、アミロイドβプラークとNFT(55)に関連して補体系の不適切な活性化(52-54)を介してアルツハイマー病病理学の炎症性要素の主要な役割を支持している。
外因性モデル
外因性モデルでは、BBBのない円周臓器と脈絡叢を用いて、血液血管系を介して提示された免疫課題とグリア細胞のコミュニケーションを説明している(56)。脳のこの領域からの細胞は、末梢血循環からのLPSを認識するために、CD14受容体とtoll-like receptor 4(TLR 4)を完全に装備している(27,28)。したがって、グラム陰性、高病原性の経口病原体、気管支肺炎、尿路感染症(3,4,7,57,58)に由来するような全身性感染症の要素は、中枢神経系を含むすべての臓器に到達する。血液中に侵入した細菌は、パターン認識受容体(PPR)やTLRを介して宿主細胞の自然免疫反応を誘発し、免疫メディエーター(サイトカイン)を分泌して異物を閉じこめ、撃退することで、局所および遠隔の細胞に感染の脅威を警告する。複数回の感染症エピソードに続く高齢者の認知症リスクの増加が報告されている(4)。さらに、全身性感染症は臨床的に診断された一部のアルツハイマー病患者のせん妄に寄与しているようであり、そのようなエピソードは前もって発症している認知状態を悪化させる可能性がある(3)。Holmesら(3, 57)は、サイトカインは感染から身を守るために宿主によって放出される一次メディエーターであるため、そのような二次刺激(IL-1βおよびTNF-α)が脳への影響を媒介し、間接的に認知機能の低下に寄与している可能性があると提案している。
アルツハイマー病に関連する非口腔内細菌
本庄ら(59)は、細菌と疾患の関係を評価するためのブラッドフォード・ヒルの基準を使用して、クラミドフィラ・ニューモニアエがアルツハイマー病の発症に関連する可能性の高い感染因子であることを発見した。MaheshwariとEslick(60)は、C. pneumoniaeとアルツハイマー病との間に強い相関関係を報告し、Shimaら(61)によると、C. pneumoniaeは現在、アルツハイマー病に関与すると提案されているすべての感染因子の中で最も信憑性の高いものである。Limら(62)は、アルツハイマー病の発症におけるプロおよび慢性炎症状態は、一部ではC. pneumoniaeの単球感染によるものである可能性を示唆している。典型的な細胞内抗原および非典型的なC. pneumoniae抗原からのC. pneumoniae抗体は、アルツハイマー病患者の脳の前頭皮質および側頭皮質の両方で同定されている(63)。アミロイド沈着とNFTは同じ領域で互いに隣接して検出され、C. pneumoniae感染がアルツハイマー病病理学の発達に関与していることを示唆している。
Balinら(9)は様々な手法を用いて、高齢発症型アルツハイマー病脳組織標本の80~90%にC. pneumoniaeが検出された。C. pneumoniae感染はAPOEɛ4対立遺伝子の発現と相関していた。その後、同じ研究者は、高齢発症型アルツハイマー病脳内のアストログリア、ミクログリア、ニューロン、内皮細胞、単球がこの細菌に寛容であることを示した。クラミジア菌を積極的に感染させる場合と持続的に感染させる場合とでは発症メカニズムが異なり、これらの菌が慢性疾患を引き起こすのは持続的な状態である(64, 65)。C. pneumoniaeは、2つのアルツハイマー病脳サンプルから、HEp-2細胞で1~2回の継代を経て培養された(66)。興味深いことに、この研究では、脳からの分離株はC. pneumoniaeの血管/アテローム株よりも呼吸器株との関連性が高いことが示された。このことから、脳のC. pneumoniae感染は気管支肺炎の二次感染であり、高齢発症型アルツハイマー病の末期であることが示唆された。
C. pneumoniae に関連するファージ phiCPAR39 と phiCPG1 は、細菌宿主のミトコンドリアに入り込み、アルツハイマー病 を開始する遅いウイルスとして働く可能性が示唆されている (67)。これらの著者らは、C. pneumoniaeファージによるミトコンドリアへの侵入が、神経変性疾患の発症における主要な開始イベントである可能性があると仮説を立てた。
25の関連する主に症例対照研究に基づくメタアナリシスにおいて、MaheshwariとEslick(60)は、アルツハイマー病とC. pneumoniaeまたはスピロヘータによって引き起こされた感染の検出可能な証拠との間に統計学的に有意な関連を発見した。彼らはスピロヘータ感染の証拠があった場合にアルツハイマー病の発生が10倍以上増加し(OR:10.61;95%CI:3.38-33.29)保存的リスク推定ではアルツハイマー病の発生が4倍以上増加した(OR:4.45;95%CI:2.33-8.52)と報告した。また、C. pneumoniae感染では、アルツハイマー病の発生が5倍以上に増加した(OR:5.66;95%CI:1.83-17.51)。したがって、細菌感染とアルツハイマー病との間には、両タイプの細菌で強い正の関連が示されたが、スピロヘータで最も強くなっていた。
梅毒のスピロヘータであるTreponema pallidumは、他の神経変性疾患の他に認知症を含む慢性的な精神神経疾患を引き起こす可能性があることが一般的に認められている(11)。T. pallidumは、全身麻痺の萎縮型の脳萎縮とアミロイドβ沈着を引き起こし(68,69)アルツハイマー病の病態におけるスピロヘータの関与を強く示唆している。梅毒などの慢性疾患は、頻繁にアミロイドの沈着に関連付けられている(68,69)。アミロイドは、アルツハイマー病におけるアミロイド沈着に寄与する可能性があるスピロサイトの不可欠な構成要素である(70)。梅毒の文脈で大脳皮質のスピロヘータ蓄積はまた、老人斑、NFTs、および顆粒液胞変性の形成につながるであろう(71)。
Miklossy (68, 69)は、Koch’s and Hill’s postulatesに従って、試験管内試験でアルツハイマー病の病理学的および生物学的特徴を誘発するスピロヘータの能力に関するデータを分析し、神経スピロヘータ症とアルツハイマー病との間のもっともらしい因果関係を実証した。データは、スピロヘータ症とアルツハイマー病(p=1.5×1,017,OR=20,95%CI=8-60,N=247)の間の統計的に有意な関連を明らかにした。哺乳類細胞をスピロヘータに曝露すると、アルツハイマー病の病理学的および生物学的特徴が試験管内試験で再現された(68,69)。歴史的観察は、慢性スピロヘータ感染が認知症を引き起こし、アルツハイマー病の神経病理学的特徴を再現するという結論を支持した(72)。Miklossy(72)によると、これらの観察は、様々なスピロヘータ感染症とアルツハイマー病の間の因果関係を支持するためのさらなる証拠を表している。
別のスピロヘータもまた、アルツハイマー病に関与していると示唆されているスピロヘータは、マダニベクターを介してヒトにトランスフェクションされるライム病の原因物質であるボレルリア・ブルグドルフェリである。梅毒とライム病の臨床的および病理学的症状には大きな類似性がある(72,73)。アルツハイマー病患者の脳におけるB. burgdorferiの発生は、最初にMacDonaldとMiranda(74)によって報告され、後にMacDonald(75,76)Riviereら(5)およびMiklossyら(77)によって確認された。興味深いことに、Buら(78)は、B. burgdorferi、C. pneumoniae、Helicobacter pylori、サイトメガロウイルス、および単純ヘルペス1型(HSV-1)からなる感染負荷がアルツハイマー病と関連していることを発見した。対照的に、Gutackerら(79)およびPappollaら(80)は、B. burgdorferiとアルツハイマー病との関連を示す証拠を発見しなかった。
他の細菌種の中では、H.ピロリ(単感染)がアルツハイマー病と関連していることが判明している(59)。これらの著者らは、アルツハイマー病の病理学は、脳に継続的に、そして時間をかけて徐々に影響を与える炎症性および酸化性の応答を持ついくつかの微生物によって開始され、増悪される可能性があることを示唆した。しかし、日本からの研究では、H.ピロリ菌の状態はアルツハイマー病と関連していなかったが、これはおそらく対照群での有病率が高いためです(81)。これは、H.ピロリ菌の感染をうまく根絶することがアルツハイマー病患者の死亡リスクを有意に低下させることと関連していることを明らかにしたKountourasら(82)によって反論された[HR(95%Cl)=0.287(0.114-0.725)p=0.008] (83)。
アルツハイマー病に関連する口腔内細菌
口腔内には、細菌のフィロタイプの印象的な範囲が存在する(84)。分子同定法では、約900種類の優勢な細菌種が検出されており、そのうち35%はまだ培養できていない(85)。口腔内マイクロバイオームプロファイルは個人差があるように見える(86)が、これは細菌マイクロバイオームが個人間で質的にも量的にも異なることを意味している。各個人は口の中に最大200種の異なる細菌を保有している可能性があり、異なる口腔部位のマイクロバイオームには大きなばらつきがある(84, 87)。さらに、主要な口腔疾患(う蝕、歯肉炎、侵攻性・慢性歯周炎、歯周病変、インプラント周囲炎、粘膜炎)の観点から、口腔内の常在菌・病原菌に関わらず、口腔内微生物叢の構成は変化し続けている(88-94)。特に歯周炎などのプラーク誘発性口腔疾患は、口腔内微生物叢の変化と関連している。口腔内には嫌気性細菌が優勢である。主要な歯周微生物の多くは嫌気性であり、例えば、Porphyromonas gingivalis、Treponema denticola、Tannerella forsythiaなどである。嫌気性菌の豊富さは、プラーク誘発性口腔疾患の発症に伴って増加する傾向にある。
歯周病菌の病原体はアルツハイマー病に関連している
このようなP. gingivalis、T. forsythia、およびT. denticolaなどの慢性歯周炎の主要な病原体は、遠隔臓器部位でのいくつかの炎症性疾患の開発に関与している。T. forsythiaを除いて、T. denticolaがスピロケイトを表す上記の名前の生物のすべての3つは、アルツハイマー病の脳で発見されている(5,8)。スピロケイトは、強力な神経向性である。彼らは神経線維に沿って、リンパ管を介して広がることができ(67,68)三叉神経および三叉神経節で検出されている(95)。スピロヘータとその抗原およびDNAは、アルツハイマー病との関連が発見されており、認知症につながる原因物質として強く示唆されている(68, 69)。14の研究では、異なる研究室や国の異なる著者によって、異なる技術を用いてアルツハイマー病でスピロヘータが検出された(レビューはMiklossy (68, 69)を参照のこと)。Riviereら(5)は、16のアルツハイマー病脳標本のうち14例で7種の異なる経口トレポネーマの存在を示した(図3)。スピロヘータはさらに、アルツハイマー病患者の脳から培養され、彼らが脳内で生存可能であることを示していた(67,68,77)。Miklossyは、Riviereら(5)によって実証されたように、経口品種(T. socranskii, T. pectinovorum, T. denticola, T. medium, T. amylovorum, T. maltophilum)を含む複数のスピロヘータによるアルツハイマー病の共感染を示唆した。スピロヘータは、哺乳類の神経細胞およびグリア細胞を器官型培養で曝露した後、アルツハイマー病の生物学的および病理学的特徴を再現した(68, 69)。
図3 84歳女性被験者のアルツハイマー病脳のポンズ領域の切片(文献(5)より、許可を得て)
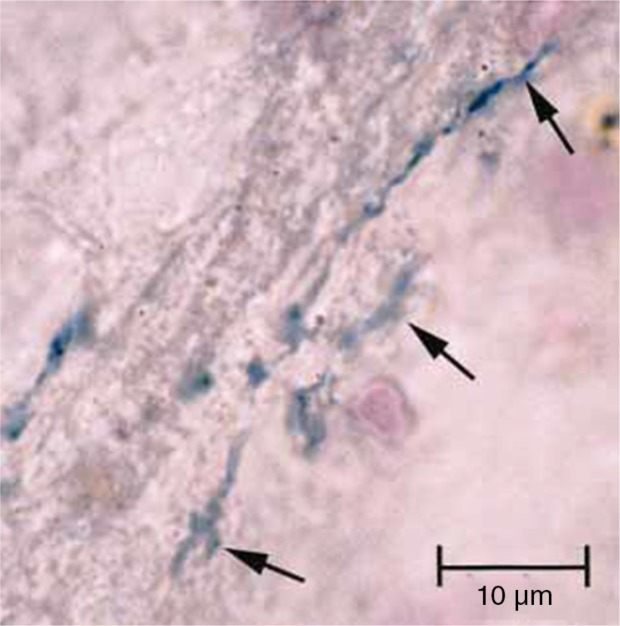
アビジン-ビオチンペルオキシダーゼ法を用いて抗T. pectinovorumで免疫染色した後、代謝的に活性なTreponema pectinovorum口腔内細菌(矢印)が濃紺色に染色されていることを示している。
それは、同等またはより長い死後の間隔を持つ対応するコントロールでの検出がなかった間に、歯周病菌からのLPSは、生活の間にアルツハイマー病の脳にアクセスすることができることが実証された(8)。この研究は、P. gingivalisなどの歯周病関連細菌に対する抗体の上昇がアルツハイマー病患者で発見されるという文献を裏付けるものである(7)。さらに、60歳以上の2,355人を対象としたNHANESの第3回研究では、歯周炎と認知機能障害、およびP.ジンジバリスに対する免疫グロブリンの測定値と認知テストの成績との間に関連性があることが明らかになった(96, 97)。この研究では、すべての参加者はベースライン時に認知機能は無傷であった。アルツハイマー病を発症した人は、ベースライン時に歯周病原体に対する血清抗体のレベルが高かった。この研究では、歯周病がアルツハイマー病の前に発症したという時間的関係が示唆された。
アルツハイマー病に関連する他の重要な歯周病原体は、Fusobacterium nucleatumとPrevotella intermediaである。NHANES試験では、アルツハイマー病患者のベースライン血清中のこれらの細菌に対する抗体レベルは、対照群と比較して有意に増加した(α=0.05)。この結果は、ベースライン年齢、Mini-Mental State Examinationスコア、および対立遺伝子APOEɛ4の状態をコントロールした後に有意であった。Nobleら(98)は、高い抗アクチノミセス・ネスランディー力価(>640 ng/ml、被験者の10%に存在)がアルツハイマー病のリスク増加と関連していることを発見した(HR = 2.0,95%CI:1.1-3.8)。この関連は、他の有意な力価(HR = 3.1,95%CI:1.5~6.4)を調整した後に強くなり、歯周病原体がアルツハイマー病と関連している可能性があることが確認された。
口腔内細菌病原体を運ぶ脳への可能性のある影響
アルツハイマー病脳で炎症が持続するという事実は、局所的な免疫原性のホールマーク蛋白質および/または末梢感染が主要な加害者であることを示唆している。これは、アルツハイマー病患者や実験動物の脳組織中のDNAと同様に微生物とその毒性産物を強調した報告によってサポートされている(下記参照)。細菌は、インテグリン受容体 CR3(CD11b/CD18)および TLR シグナル(99)と補体カスケード(100)を含む経路を活性化する。サイト/ケモカイン放出(TNF-α、IL-8)のためのNF-κBシグナル伝達経路(101)は、フリーラジカルを産生し、一酸化窒素を誘発し、アポトーシスを誘発する(102)。口腔、肺、消化管および尿路は、脳内微生物のもっともらしい供給源である。興味のある微生物の元の部位から脳への通過の可能性は以下の通りである。
スピロヘータ感染は、脳低灌流(103)脳血管病変、および重度の毛細血管ネットワーク障害を引き起こす可能性がある(68,69)。慢性スピロヘータ感染はまた、ゆっくりと進行する認知症、皮質萎縮、慢性炎症、およびアミロイドβ沈着を誘発することができ、アルツハイマー病脳で発生したものと区別がつかない(レビューについては文献68,69,72を参照のこと)。さらに、スピロヘータにさらされた培養神経細胞は、アミロイドβを産生する(104)。スピロヘータはまた、プラーク状、もつれ状、およびカール状繊維状の病変を形成することができる(72,105)。スピロヘータは宿主の防御を回避することで、潜伏感染を誘発し、ゆっくりと進行する。これは、補体カスケードを遮断することで、脳内でのスピロヘータの生存と増殖を促進する。スピロヘータは免疫力のある宿主でも生存し増殖することがある。興味深いことに、免疫系からのクリアランスを回避するT. pallidumの驚くべき能力により、スピロヘータは「ステルス病原体」と呼ばれるようになった(106)。スピロヘータ感染後の活性化された補体カスケード(11)は、中枢神経系の炎症の非特異的マーカーとして使用される可能性がある。スピロチート-宿主の相互作用は、自然免疫系と適応免疫系、フリーラジカル産生、アポトーシス、およびアミロイド沈着を活性化する様々な免疫応答を誘発する慢性炎症を開始し、維持する典型的なアルツハイマー病脳で見られる (107)。
P. gingivalisは、それが歯周病に関連した’炎症性’微生物群を確立し、維持することができるので、’キーストーン’歯周病原体の一つとして指定されている(108)。P. gingivalisは、最近Singhraoら(109)によってレビューされた、宿主の免疫防御を回避するための驚くほど多様な病原性因子を持っているため、このタスクを実行することができ、したがって、2つの主要な機能を果たしている:持続可能な炎症性環境を介したP. gingivalis自体の初期生存と、微生物の競合他社を排除することによる栄養源の持続性である(108)。
P. gingivalisエンドトキシンLPSは、リン酸基の数と脂質A脂肪酸の量、およびそれらの特定の位置の両方に違いがあることを示している。複数の脂質A構造の存在は、生来の宿主反応が分子を認識することをより困難にし、それによってP. gingivalisの病原性を助長する(110)。宿主の体内、例えば脳(8)で P. gingivalis LPS を見つけることの結果は、サイトカインの解放、補体の活性化、および脳内炎症の維持につながる TLR 媒介 NF-κB シグナル経路(111)の差動活性化のための免疫細胞のプライミングを含んでいる。
P. gingivalis は赤血球に付着することで循環食細胞を回避する(112)。P. gingivalisの積極的な侵入と、バイスタンダーの神経損傷を伴う感染誘発性補体活性化がApoE-/ -マウスの脳で検出された(113)。これは、細菌感染は、サイトカインや神経細胞が攻撃される補体カスケードなどの急性期タンパク質を含むメカニズムを介してアルツハイマー病の病理学の発展に寄与することができるという以前の概念を支持した。
アルツハイマー病に関連する経口ウイルス
単純ヘルペスウイルス(HSV)は、50歳以降の人口の70%以上に存在する(114-116)。末梢神経系に潜伏して持続し、周期的に再活性化する。特徴的には、HSV-1が内敵に指定されている(10)。エプスタイン-バーウイルスおよびサイトメガロウイルスを含むヘルペスウイルスは、侵攻性歯周炎において高コピー数で発見され、この疾患の発症において歯周病菌と相乗的に相互作用する可能性がある(117)。ヘルペスウイルスによって活性化された歯周感染は、局所的な宿主の防御力を損なう可能性があり、その結果、常駐する歯周病細菌の攻撃性を高める。この細菌は、順番に、ヘルペスウイルスの病原性を増強する可能性がある。
アミロイド含有プラークおよび/またはNFTにおけるウイルス関連タンパク質の高い割合は、アルツハイマー病の病理学におけるHSV-1の関与を裏付けるものである(118)。特に、De Chiaraら(119)は、脳内のアミロイドβ蓄積とHSV感染との関連を報告している。Itzhakiら(120)は、HSV-1がアミロイドプラークおよびNFTの主成分(すなわち、アミロイドβおよび高リン酸化タウ)を産生するだけでなく、これらのタンパク質の分解を妨げるオートファジーイベントをも妨害し、最終的にはアルツハイマー病脳への蓄積につながることを示唆した。さらに、HSV-1感染後のマウスモデルにおける試験管内試験および生体内試験での研究では、アミロイドβの蓄積が実証されている(121)。
多くの科学者が、脳内でのβアミロイドの産生とクリアランスの間に不均衡があることを示唆してきたが、この前提はWisniewskiら(122)がこのタンパク質の可溶性種の発見に基づいて最初に提案し、後にZlokovicら(123)によって確認されたものである。現在では、このタンパク質のクリアランス不良がアルツハイマー病脳の特徴であり、不溶性のアミロイドβ40/42プラークの形での蓄積につながることが広く受け入れられている。HSVとサイトメガロウイルスはアルツハイマー病の有無にかかわらず高齢者の脳で検出されているが(124-126)HSV-1ウイルスのDNAはアルツハイマー病患者のより高い割合で存在している(127)。それは特にアルツハイマー病で最も損傷を受けている脳領域である側頭葉と前頭前野に見られる(128, 129)。この関連性はまだ調査中であるが、HSV-1ウイルスのDNAがプラークの成熟過程と関連している可能性がある。Jamiesonら(127)は、ほとんどの若い人の脳にはHSV-1ウイルスが存在しないことを発見したが、これはおそらく、免疫の老化に伴って老年期に脳に侵入するため(130)あるいはウイルス自体が宿主の免疫防御を弱めるために最初に関与しているためであろうと考えられている。この後者の説明は可能性が高く、我々や他の研究者によって支持されている(131)。
HSV-1は、APOEɛ4対立遺伝子を持つ人の脳におけるアルツハイマー病の強い危険因子である(125, 132)。このウイルスは、休眠状態の搭乗者であるだけでなく、神経細胞内に潜伏した状態で持続したり、ニューログリア内で非常に低いレベルで複製したりすることもある(133)。持続する間、ウイルスは継続的に有害物質を放出し、低レベルで炎症性サイトカインを誘発するが、これは年齢、食事の質の低下、運動制限、さらには遺伝的な影響を受けやすい体質によって、すでに挑戦を受けている宿主にさらなる負担となる。ItzakiとWozniak(10)は、ストレスや末梢感染によって、脳内の潜伏状態からウイルスが周期的に再活性化する可能性があることを示唆している。これは、急性ではあるがおそらく局所的な感染を引き起こす可能性があり、APOɛ遺伝子によって調節された後続の損傷は、アミロイドβプラークおよびNFTの形成につながる可能性がある。
再活性化した感染の徴候である抗HSV IgMの存在は、抗HSV IgGはリスクに影響を与えなかったのに対し、アルツハイマー病のリスクをほぼ2倍にした(134)。小林ら(135)は、抗HSV-1 Ig抗体アビジー度指数が、アルツハイマー病患者だけでなく、アルツハイマー病の前駆症状である無気力性軽度認知障害の早期診断にも有用なバイオマーカーとなり得ることを示唆した。
HSV 血清陽性の再活性化は、アルツハイマー病 の発症と高い相関がある(136)。Letenneurら(136)は、アルツハイマー病の病態は率直な認知症の何年も前から始まっており、HSVの再活性化は脳ミクログリアへの強力な刺激として作用し、サイトカインレベルを上昇させ、神経組織病理学的変化の蓄積を増加させる正のフィードバックサイクルを誘発すると推測している。言い換えれば、感染に続いて局所的な中枢神経系の炎症反応が第一の刺激である可能性が高いのに対し、プロテオスタシスはアルツハイマー病の発症につながる第一のイベントの結果である。
Hillら(137)は、主要な第一次宿主防御機構である補体系からのHSV-1の回避、およびアルツハイマー病型神経病理学的変化に寄与することが知られているアラキドン酸カスケードの重要な要素の活性化におけるHSV-1誘導性miRNA-146aの役割を示唆した。
アルツハイマー病に関連する口腔内酵母
口腔内酵母感染は、特にカンジダ・アルビカンス(Candida albicans)が関与する二次的な日和見感染症であるが、カンジダ・グラブラータ(Candida glabrata)などの非アルビカンス種が関与することも増えてきている。高齢者の人口増加に伴い、重度の全身性真菌感染症は、過去30年間にこの年齢層で劇的に増加している(138, 139)。口腔内酵母は、歯周ポケット、根管内、粘膜上、および義歯の下(義歯口内炎)に存在することがある(140-142)。義歯口内炎は、全身性真菌症の原因となる酵母菌が多く付着した義歯を装着している高齢者に多く見られる。播種性真菌症は最近、アルツハイマー病患者で報告されている(143,144)。末梢血血清中にタンパク質や多糖類[(1,3)-β-グルカン]を含む真菌分子が検出され、アルツハイマー病患者の脳組織中に真菌タンパク質とDNAがPCRで検出された。キチン様真菌構造もアルツハイマー病脳で発見されており(145)キチナーゼ活性はアルツハイマー病の強力なバイオマーカーとして提案されている(146)。アルツハイマー病脳では、少数の細胞の細胞質物質が、酵母細胞に対する免疫反応性を持つ抗体によって標的化されていた(147)。これらの知見は、神経細胞が真菌に感染する可能性があるという考えと一致していた。興味深いことに、抗真菌治療は一部のアルツハイマー病患者の臨床症状を逆転させた(148,149)。
口腔内微生物はどのようにして脳に到達するのか?
血流の伝播
口腔内微生物の脳への伝播経路として最も可能性が高いのは、血流を介しての伝播である(150)。歯周炎患者の歯磨き、フロス、咀嚼、歯ぎしりの使用と同様に歯科治療を行うと、菌血症が発生する(151)。これは、日中に数回発生することがあり、口腔内細菌のために3時間まで続くと推定されている(152)。この菌血症は通常、体の免疫細胞によって封じ込められている。しかし、免疫防御力が低下している人、例えば高齢者では、細菌が口腔の隙間や血管チャネルに局在することがある(150)。
血液脳関門
無傷のBBBは血液中の微生物が脳にアクセスするのを防ぐ。しかし、加齢は口腔内微生物の過剰増殖、特に早期に定着し、BBBを弱体化させる炎症反応を誘発した嫌気性細菌や遊走性酵母の過剰増殖を助長する(16)。特筆すべきは、播種性カンジダ症のマウスモデルにおいて、磁気共鳴イメージング(MRI)によりBBBの完全性の喪失が確認されたことである(153)。完全性の損失は、微生物が血流を介して拡散し、静かにアルツハイマー病の病因に貢献することができる。免疫産生期には、自然免疫系が徐々に後天的な免疫系に取って代わる。これは、TNF-αなどの循環性プロ炎症性サイトカインの上昇に寄与する(16)。実際、プロ炎症性メディエーターはBBBを越えることができる(3,7,154)。APOEɛ4,TNF-αおよびおそらくEphrin Type-A Receptor 1 (EphA1)は、BBBの完全性に影響を与え、したがって、バクテリア、LPSおよび他の毒性のあるバクテリア製品や酵母のアルツハイマー病患者の脳への浸透に重要であると考えられている(16)。APOEɛ4は、シクロフィリンAマトリックスメタロプロテアーゼMMP-9経路(155)を活性化することにより、BBBの整合性に影響を与える。
また、BBBの伝染性は、年齢とともに増加し、このように微生物にアクセス可能な脳を作るアルツハイマー病の発病を促進することを示唆していることはもっともらしい。ヒトの若年性アルツハイマー病に関連しているAPP遺伝子の変異を持つマウスは、コントロールマウスと比較してBBBの伝染性の増加と老人性プラークの形成の増加を示した(156)。この変化は加齢とともに増加した。
脳室周囲臓器と血管周囲空間
血管周囲器官(ポリペプチド性視床下部ホルモンがBBBを乱すことなく脳を離れることを許可する)はBBBに依存しておらず(56)細菌(157)のための脳への別の入口の入り口として機能する可能性がある。Pooleら(8)は、細菌とその生成物もまた、血管周囲空間を介して全身循環を介して脳に直接アクセスする可能性があると仮定した。
嗅覚仮説
嗅覚仮説」は、病原性細菌が脳に入り、それによってアミロイドβとNFTの産生を誘発する潜在的な経路としての嗅覚管を示唆している(158)。嗅覚神経と三叉神経は、中枢神経系への直接の通過のためにBBBをバイパスするために歯周病原菌によって使用されることが知られている(5, 150, 159, 160)。三叉神経節における口腔トレポネムの同定は、このような伝播経路を支持している(5)。さらに、スピロヘータは、嗅床糸および嗅床路に沿って拡散する可能性がある(68, 69)。
嗅覚非被覆細胞(OEC)は細菌を巻き込み、活性化されたアストロサイトによって放出されたTNF-αに向かって移動する(161)。したがって、OECは、生きた細菌を脳内に輸送するための乗り物であり得る(すなわち、トロイの木馬)。嗅球は、ヒト(162)およびマウスのADモデル(163)におけるアルツハイマー病の神経病理学的軌跡において、NFTおよびアミロイドβ沈着が検出された最初の領域であった。
アルツハイマー病を促進する遺伝的、栄養的、環境的要因
若年性アルツハイマー病は遺伝的に決定されるが、高齢発症型アルツハイマー病は遺伝的要因と環境要因の相互作用に起因すると考えられている(12)。いくつかの変異遺伝子は、アミロイドβ(アミロイドβ)前駆体タンパク質(アミロイドβPP)遺伝子やプレセネリン-1(PSEN-1)およびPSEN-2遺伝子(164-166)などの家族性アルツハイマー病と関連している。高齢発症型アルツハイマー病の主な危険因子はAPOɛ4対立遺伝子の多型である(2)。また、高齢発症型アルツハイマー病(167, 168)と歯周炎(169-171)の両方において、サイトカイン関連遺伝子が炎症感受性に関与しているように思われる。したがって、TNF-αを増加させる多型もまた、アルツハイマー病と歯周炎の両方のリスクを増加させる(172,173)。Lambertら(174)は、インターロイキン-1(IL-1)(71,175-178)およびTNF-α(71,172,179-181)に関連する遺伝子の多型を含む20の異なる遺伝子座位が、アルツハイマー病に対する宿主の感受性を増加させ得ることを発見した。これら、20の遺伝子座の一つであるAPOɛ4遺伝子は、アルツハイマー病との相関性が高い(182)が、感染症の危険因子でもあり、炎症性メディエーターの発現を増加させる(11)。最近では、20万人以上の個人を対象としたGWASの要約統計を用いて、アルツハイマー病、C反応性蛋白(CRP)血漿脂質の間の遺伝的重複が示された(183)。また、その複雑で多因子性の病因を反映して、遺伝的リスクと毒素や細菌、ウイルス、真菌病原体などの環境リスク因子の間にも相互作用があるかもしれない(1)。
必須ビタミンB群、リン脂質、および他の微量栄養素のそのコンテンツを持つ食事は、新しい神経シナプス(184)を形成するために重要だ。栄養不足は、Singhraoら(150)によって簡単に論じられているように、高齢者と認知症の対象者の両方でよく見られる。
慢性歯周病とアルツハイマー病との関連
慢性歯周炎と高齢発症型アルツハイマー病との関連性を示す証拠が増えている(185)。横断的および縦断的研究では、歯肉出血、歯周アタッチメントの喪失、歯周プローブの深さ、歯槽骨の喪失、および歯周病原体に対する抗体が、共変量を調整した後の認知機能の低下および低下と有意に関連していることが実証されている(レビューは(12)を参照)。サイトカインを含む急性期タンパク質は、歯周病原体および/またはその病原性因子と間接的に関連している可能性がある(12, 13)。高齢者は口腔衛生を怠っていることが多く、これが再発性の慢性口腔感染を刺激する可能性がある(150)。これは再び炎症を促進し、混乱や認知症につながる可能性がある(3, 4, 154)。50~70歳の152人の被験者を20年間追跡調査したところ、歯周炎のレベルが高いほど認知レベルの低下と相関していた(186)。さらに、20~59歳の5,138人のコホートにおいて、歯肉出血と歯周アタッチメントの喪失は認知障害と有意に関連していた(187)。144人の修道女において、APOEɛ4をコードし、歯の本数が少ない人は、これらの危険因子のいずれかまたはどちらでもない人よりも急速な認知機能の低下を経験した(188)。臨床研究や疫学研究では、歯の喪失が記憶力の低下と関連していることが示された(6, 96, 187, 189)。地域居住者の男性597人を32年間追跡調査した別の研究では、歯の喪失、歯周ポケットの深さの増加、歯槽骨の喪失の進行は、特に45歳以上の人の認知障害と関連していた(190)。最近、de Souza Rolimら(191)は、軽度のアルツハイマー病患者では健常者よりも歯周感染症の頻度が高いことを発見した。アルツハイマー病の病態に関連したもう一つの興味深い特徴は、「逃亡した病原菌」による感染の低レベルである(16)。これらの「免疫寛容」細菌は、第一のニッチ以外の場所で黙々と増殖し、第二の場所での継続的な感染は、既存の免疫不全状態にある高齢者や衰弱した宿主の健康に重大な悪影響を及ぼす可能性がある。
アルツハイマー病の仮説的治療法と予防法
アルツハイマー病に対して有効な治療法や予防法はまだないが、いくつかのアプローチが提案されている。この点での取り組みは重要である。もし認知症の発症をわずか2年遅らせることができれば、今後40年間で2,200万人以上のアルツハイマー病の有病率を下げることができるかもしれない(14)。特筆すべきは、非常に高齢(90歳以上)でのAPOEɛ4対立遺伝子の継承は、85歳以上のリスクがある期間を迂回して、保護を与えるように見える(192)。
歯周病がアルツハイマー病に関与している場合は、歯周炎の予防は助けになるかもしれない。これが開始と アルツハイマー病 の悪化に任意の効果があるかどうかを参照してほしいに興味深いだろうが、10 年の観察期間はおそらく必要である。
軽度から中等度のアルツハイマー病患者を対象とした研究では、ドキシサイクリンとリファンピシンの3ヶ月間のコースは、6ヶ月の追跡期間中に認知機能の悪化を減少させた(193)。抗菌性化合物の使用はC. pneumoniaeの治療には効果がなかったかもしれないが、アルツハイマー病の認知機能低下には有益な効果があったと結論づけられた(193)。これは、多くの末梢感染の予防や減衰、またはプロ炎症性サイトカイン反応を減衰させることに関連している可能性がある。ミノサイクリンは、初期の、前プラーク神経炎症を修正し、アルツハイマー病様アミロイド病理学のトランスジェニックモデルでAPP切断酵素1(BACE-1)を阻害することが判明した(194)。炎症を阻害することは、アルツハイマー病様アミロイド病理学の初期のプレプラーク段階において有用な治療アプローチとなり得ることが示唆された。
認知症発症の少なくとも2年前から抗炎症薬を投与することで、疾患の進行を遅らせることができた(195-197)。抗炎症薬と抗菌薬を併用することも有益であろう(193)。いくつかの利用可能な非ステロイド性抗炎症薬(NSAIDs)の検討は、高齢発症型アルツハイマー病において有用なアミロイドβ修飾活性またはその他の治療的使用の活性を有するものは、そのうちのわずかなものであることを示した(レビューについては(1)を参照)。
ItzhakiとWozniak(10, 198)は、抗ウイルス療法およびおそらく初期のHSV-1に対するワクチン接種が有用であり得ることを示唆した。もしHSV-1がアルツハイマー病に関与しているのであれば、ワクチン接種は脳内でのアミロイドβの過剰な蓄積を防ぐことができる。HSV感染前に混合HSV糖タンパク質のワクチンを接種すると、マウスの脳内でのウイルス潜伏を防ぐことができた(199)。また、森(200)は、化学療法やワクチン接種を含む抗ウイルス療法はアルツハイマー病の予防・治療に有望であり、まだ検証が必要であると主張している。さらに、Carter (118)は、ワクチン接種や抗ウイルス剤、免疫抑制剤をアルツハイマー病の前または初期段階での治療オプションとして検討することを示唆している。興味深いことに、抗βアミロイド抗体を介して作用する免疫グロブリンの静脈内へのHSV-1感染細胞培養物の曝露は、アミロイドβおよびリン酸化タウの蓄積を減少させた(201)。
Stigmatella aurantiaca由来のアンジオテンシン変換酵素(ACE)は、ヒトACEと同様にアミロイドβペプチドを切断する可能性があり、アルツハイマー病に対する新しい治療法として使用される可能性がある(202)。さらに、Chiarini et al 203)は、最小限の認知障害または早期の段階で投与すれば、カルシライド薬はアルツハイマー病の進行を止め、患者の皮質ニューロン、認知能力、最終的には生命を維持することができると主張した。マウスを用いた研究では、アルツハイマー病や他のタウ症の治療薬としてタウ凝集阻害剤の使用が示唆されている(204)。
レスベラトロールは赤ワインに含まれるポリフェノールである。アルツハイマー病における毒性のあるβアミロイド蛋白質の凝集を直接妨害する能力が最近示されている(205)。レスベラトロールは、プロテオスタシスに関与する特定のタンパク質を標的とし、それによって凝集したアミロイドβの量を減少させることによって、アルツハイマー病のCaenorhabditis elegansモデルにおけるアミロイドβ誘導毒性を減少させることが発見された(206)。これは、週に2~7回の飲酒パターンの効果が、歯周病・歯周病感染症による抜歯歴のある男性の心筋梗塞リスクを減少させたという我々の以前の知見と一致している(207)。
アミロイドβオリゴマー形成またはアミロイドβ誘導細胞毒性の強力な阻害剤は、アルツハイマー病の治療的介入のための魅力的な手段であることが証明されている。Song et al 208)は、いくつかのC-グリコシルフラボン成分を含むセンティペデグラスの抗アルツハイマー効果が、アミロイドβオリゴマー形成に介入し、βサイトAPP切断酵素1活性を低下させることにより、神経細胞死の抑制を介して起こることを発見した。著者らは、センチペデグラスに含まれるコーンシルクの主要フラボノイドであるメイシンが、アルツハイマー病予防のための優れた治療薬候補になる可能性を示唆した。
アルツハイマー病のタウの重要なドメインに対する積極的な免疫化は、タウの凝集と神経原線維病理を除去した(209)。アルツハイマー病型のタウの過リン酸化は、広い範囲のアルツハイマー病リン酸エピトープに渡るワクチン接種により、トランスジェニックマウスで廃止された。Kontsekova et al 209)は、モノクローナル抗体DC8E8によって明らかにされたエピトープを網羅するタウペプチドでラットを積極的に免疫すると、タウのアルツハイマー病型高リン酸化の95%の減少を含む神経原線維性病理のすべての主要な特徴の除去につながったことを実証した。
結論
アルツハイマー病の主な形態である高齢発症型アルツハイマー病は、単一の原因を持っているようには見えない。それどころか、多くの要因が関与している可能性があり、それらが協調して作用している可能性がある。中でも、遺伝的要因と環境要因の両方が関与している可能性がある。微生物間であっても、脳は炎症を増強する能力に寄与する様々な微生物の攻撃を区別することができないため、協調作用が起こる可能性がある。原因の如何にかかわらず、全身の炎症は認知症の発症を予測する可能性がある。スピロヘータ、P.ジンジバリス、C.肺炎菌、H.ピロリ菌、単純ヘルペスI型ウイルス、カンジダなどの生物は、アルツハイマー病脳内の主要な候補病原体の一つである。アルツハイマー病を引き起こすイベントのカスケードでは、口腔微生物が役割を果たす可能性があり、特にトレポネム、P. gingivalis、Prevotella spp.、FusobacteriumとActinomycesなどの嫌気性細菌だけでなく、顔面嫌気性カンジダ種も。感染は認知症の症状が現れる何十年も前に起こる可能性があることを認識することが重要である。口腔内細菌とアルツハイマー病との因果関係を示す最も説得力のある証拠は、神経栄養学的にも運動性にも優れたスピロヘータであることが指摘されている。口腔内感染がアルツハイマー病の危険因子となりうる可能性はあるが、それだけではない。ヒトでの実験では、アルツハイマー病の重要なイベントやメカニズムを明らかにするために、長い曝露時間が必要になるかもしれない。産業界による協調的な努力と投資にもかかわらず、アルツハイマー病の治療法はまだない。抗生物質の長期使用によるアルツハイマー病の予防は現実的ではなく、耐性菌を選択する可能性がある。このことは、今後10年間でアルツハイマー病の有病率とその管理に関連する公費が大幅に増加すると予想されていることから、懸念されている。
歯周炎の嫌気性菌がアルツハイマー病に大きな役割を果たしているとすれば、歯周炎は修正可能であるため、歯科衛生と治療によって早期からのアルツハイマー病予防が可能となる。しかし、アルツハイマー病患者の口腔衛生の改善や歯周病治療は、患者が非協力的であることが多いため、困難な場合がある。また、このような患者の口腔ケアを支援するために、介護者を訓練する必要がある。
アルツハイマー病の主要な生物や重要な領域に対するワクチン接種は、いくつかの有益な効果をもたらしている。また、アルツハイマー病の発症を直接阻害する薬剤もいくつか試験されている。治療法を見つけるためには、これらの生物を標的とした特異的な治療法を開発できるように、臨床診断情報とアルツハイマー病の原因菌に関する知識が必要とされている。診断用バイオマーカーとしては、特定の口腔内病原体、特にP. gingivalisに対する抗体レベルの上昇は、アルツハイマー病の臨床症状が現れる何年も前からモニタリングツールとして使用される可能性がある。これは、おそらく早期に治療を開始しなければならないので、重要なことである。