Contents
- Can N-3 polyunsaturated fatty acids be considered a potential adjuvant therapy for COVID-19-associated cardiovascular complications?
- 要旨
- 1. はじめに
- 2. COVID-19と心血管合併症
- 3. COVID-19患者における心血管合併症の潜在的機序
- 図1. SARS-CoV-2によって誘発される心血管系合併症の潜在的なメカニズム
- 3.1. 直接的な病原体の侵入
- 3.2. 間接的な炎症反応-サイトカインストーム
- 表3. COVID-19患者におけるサイトカインストーム、炎症亢進状態、および関連する二次的臓器合併症を改善するために検討されている薬理学的アプローチの概要
- 3.3. その他のメカニズム
- 表4. COVID-19患者における高凝固性および血小板活性化を標的とした調査中の薬理学的介入の概要
- 表5. COVID-19に関連する心血管系傷害を減衰させるために提案されている薬理学的アプローチの概要
- 表6 SARS-CoV-2感染に続発するサイトカインストームおよび急性心臓損傷を標的とする薬剤を調査している進行中の試験の要約
- 4. 提案された経験的/支持的治療法の心血管系への悪影響
- 5. n-3多価不飽和脂肪酸の概要
- 6. 呼吸器感染症および/または敗血症患者における n-3 多価不飽和脂肪酸の役割
- 7. n-3多価不飽和脂肪酸の心血管系への利点
- 8. COVID-19の設定におけるn-3 PUFAsの潜在的な心保護メカニズム
- 9. COVID-19の文脈でn-3 PUFAsをいつ、どのように介入するか
- 10. まとめと結論
Can N-3 polyunsaturated fatty acids be considered a potential adjuvant therapy for COVID-19-associated cardiovascular complications?
www.ncbi.nlm.nih.gov/pmc/articles/PMC7534795/
要旨
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によって引き起こされるコロナウイルス病2019(COVID-19)は、現在、世界中で数百万人の確認され、増加している症例を持つ世界的なパンデミックにつながっている。新型のSARS-CoV-2は肺に感染して重度の急性呼吸器機能障害を引き起こすだけでなく、心血管系を含む複数の臓器や生理学的システムにも重大な機能障害をもたらす。
多くの研究で、ウイルス感染は免疫反応の亢進、高凝固、酸化ストレスを誘発し、COVID-19患者で観察された心血管系の不良な転帰に大きく寄与していることが示されている。現在までのところ、COVID-19に対するワクチンや治療法は承認されていない。したがって、COVID-19患者の全体的な予後を考えると、心血管系の保護および支持療法が急務であり、必要である。
文献の蓄積は、心血管系に対するn-3多価不飽和脂肪酸(n-3 PUFA)の有益な効果を実証しており、それには、制御されていない炎症反応の改善、酸化ストレスの減少、および凝固障害の緩和が含まれる。さらに、それは、n-3 PUFAs、エイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)は、それらの親化合物に起因する有益な効果の多くを媒介する内因性に生成された強力な生理活性脂質メディエーターのグループへの前駆体であることが実証されている。
n-3 PUFAsとその代謝物の良好な安全性プロファイルを考慮すると、それはCOVID-19患者の臨床管理のための潜在的なアジュバント療法としてn-3 PUFAsを考慮することは合理的である。
本論文では、COVID-19に続発する心血管系合併症の病態を概観し、n-3 PUFAsとその代謝物の有用性に寄与する可能性のあるメカニズムに焦点を当てる。
1. はじめに
新型コロナウイルスの最初のアウトブレイクは 2002年に中国で発生した重症・急性呼吸器症候群コロナウイルス(SARS-CoV)であり 2012年には中東呼吸器症候群関連コロナウイルス(MERS-CoV)が続いている。SARS-CoVとMERS-CoVはいずれも感染力が強く致死的であり、過去20年間で数千人の死亡者を占めている(de Wit, van Doremalen, Falzarano, & Munster, 2016; Zaki, van Boheemen, Bestebroer, Osterhaus, & Fouchier, 2012)。国際分類学委員会のコロナウイルス研究グループは 2019年の最近のアウトブレイクの原因となったコロナウイルスの新規性を評価し(COVID-19)それらは約79%のヌクレオチド同一性を共有しているので、SARS-CoVに関連していると正式に考え、それに応じて、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)または2019-新規コロナウイルス(Coronaviridae Study Group of the International Committee on Taxonomy, 2020; Ren er al 2020; Zhou er al)。) COVID-19の最近の噴火は 2019年12月下旬に中国湖北省武漢市で、原因不明の一連の肺炎症例が検出されたことで初めて報告された(Wang et al 2020)。感染力が強く、COVID-19は中国全土と世界のほとんどの国で急速に広がった。3月11日、COVID-19の拡散は世界保健機関(WHO)によって世界的なパンデミックと宣言され 2020年9月22日までに国際的に診断された累積患者数は31,346,086人、世界的な死亡者数は965,294人となった(https://coronavirus.jhu.edu/map.html 2020年9月22日)。
コロナウイルスは、動物とヒトの両方に感染し、呼吸器系、消化器系、心血管系、中枢神経系に影響を与える(Cui, Li, & Shi, 2019)。一貫して、SARS-CoV-2は主に肺を標的とするが、腎臓、心臓、血管、消化管および脳を含む他の多くの臓器およびシステムに影響を与え得る(Wadman, Couzin-Frankel, Kaiser, & Matacic, 2020)。COVID-19の症状は、下気道疾患とともに、筋痛、疲労、発熱および乾いた咳として顕在化する。場合によっては、重度の進行により、数日以内に急性肺障害(ALI)急性呼吸窮迫症候群(ARDS)呼吸不全、敗血症、心不全(HF)および突然の心停止に至る。重要なことに、高齢者および基礎的な健康状態を有する個体では、有意な罹患率および死亡率がある(Chen et al 2020;Huang et al 2020)。コルチコステロイドによる治療、抗ウイルス療法、機械的呼吸器支持が採用されているが、COVID-19に対する特異的な治療法はまだなく、したがって支持療法が最も重要である(Huang et al 2020;Wu & McGoogan 2020)(表1)。
表1. COVID-19患者に有益な効果をもたらす可能性のある薬理学的介入薬の概要
| 薬理学的介入 | 結論 | 参照 |
|---|---|---|
| ビタミンCとEを含む抗酸化剤 |
|
(Wang、Zhang、およびBai 2020) |
| メラトニン |
|
(Zhang et al。 2020) |
| 抗インターロイキン-6 |
|
(Akhmerov&Marban 2020 ; Hendren、Drazner、Bozkurt、&Cooper Jr. 2020 ; Rizk et al。 2020) |
| 抗TNF-α |
|
(Convertino et al。 2020) |
| ヤヌスキナーゼ(JAK)阻害剤 |
|
(Alijotas-Reig et al。 2020 ; Convertino et al。 2020 ; Richardson et al。 2020 ; Rizk et al。 2020) |
| 抗インターロイキン-1 |
|
(Alijotas-Reig et al。 2020 ; Rizk et al。 2020) |
| 顆粒球-マクロファージ-コロニー刺激因子(GM-脳脊髄液)阻害 |
|
(Rizk et al。 2020) |
| スタチン |
|
(Alijotas-Reig et al。 2020 ; Rizk et al。 2020) |
| ACEi / ARB |
|
(Akhmerov&Marban 2020) |
| N-アセチルシステイン(NAC) |
|
(De Flora、Balansky、&La Maestra 2020 ; Guglielmetti et al。 2020) |
| エイコサノイドおよび可溶性エポキシド加水分解酵素(sEH)阻害剤 |
|
(ハンモック、ワン、ギリガン、パニグラヒー 2020年) |
2. COVID-19と心血管合併症
ガス交換能力を損なう肺胞の炎症性疾患である肺炎と心血管系合併症との間の相関関係はよく確立されている(Cilli et al 2018;Corrales-Medina et al 2011)。例えば、基礎となる心血管疾患を有する患者は、市中肺炎を発症する可能性が高く(Corrales-Medina et al 2015)市中肺炎患者の約8〜25%は、入院中に少なくとも1つの心血管合併症を発症する。肺炎後の心血管系エピソードの誇張は、死亡率の増加と関連している(Corrales-Medina et al 2012;Viasus et al 2013)。これらの観察に沿って、SARS患者によく見られる頻脈および低血圧などの心臓合併症が、新規コロナウイルス感染症の患者で報告されている。さらに、SARS患者では、不整脈、心肥大および拡張機能障害が報告されている(Li et al 2003;Yu et al 2006)。さらに、MERS-CoVへの感染は、急性心筋炎、心筋浮腫および重度の左室機能障害と関連していた(Alhogbani, 2016)。
COVID-19の文脈では、基礎となる心血管合併症を有する患者および有していない患者の両方が、SARS-CoV-2感染に二次的に心血管合併症を発症する可能性がある。例えば、Wangらは、中国の武漢でCOVID-19に入院した138人の患者のうち、新たな心電図または心エコー図異常または高感度心筋トロポニンIの上昇によって証明されるような心臓障害が、全患者の7.2%および集中治療室(ICU)入院を必要とした患者の22%に存在したと報告している(Wang, Hu, et al 2020)。さらに、中国国家衛生委員会は、SARS-CoV-2に感染し、心血管疾患(心血管疾患)が知られていない患者の12%が入院中にトロポニン値の上昇または心停止を示し、17%が冠動脈性心疾患を有し、患者の35%が高血圧症を有していたと報告している(Zheng, Ma, Zhang, & Xie, 2020; Zhou er al)。 しかしながら、基礎となる心血管疾患を有するCOVID-19患者は、重篤な合併症を発症するリスクが高いという証拠が蓄積されている(Huang et al 2020; Wang, Hu, et al 2020)。例えば、SARS-CoV-2に感染している基礎疾患を有する高齢の心血管疾患患者は、重症化し、心臓損傷を発症し、または集中治療を必要とする傾向が高い(Guo et al 2020;Shi et al 2020)。基礎となる心血管疾患を有する患者の死亡率は10.5%と記載されており、これは一般集団の死亡率よりもはるかに高い(Epidemiology Working Group for Ncipemic Response & Prevention, 2020; Wu & McGoogan, 2020)。さらに、中国で実施された疫学研究によると、確定症例の4.2%、死亡例の22.7%が心血管疾患を併発している(Epidemiology Working Group for Nipc Epidemic Response & Prevention, 2020)。COVID-19患者の多くは、持続性低血圧、心筋損傷、心筋炎、左室機能障害、不整脈、およびHFを患っている(Guan, er al)2020; Guo er al)2020; Inciardi er al)2020; Zhou, Yu, er al)2020)。重要なことに、COVID-19患者から収集された心臓生検サンプルは、COVID-19患者の心筋炎の余分な証拠を提供する単核炎症性細胞の間質浸潤の増加を示した(Xu et al 2020)。したがって、COVID-19による二次的な心血管障害は、現在、臨床現場で注目を集めており(表2)米国心臓病学会は最近、SARS-CoV-2感染の心血管への影響を扱う臨床報告書を発表した(Mohammad Madjid et al 2020)。
表2. COVID-19関連心血管系合併症の概要
| COVID-19による心血管損傷 | 提案された傷害のメカニズム |
|---|---|
|
|
|
|
|
|
|
|
|
|
3. COVID-19患者における心血管合併症の潜在的機序
今日まで、COVID-19の病理学的特徴についての報告はほとんどなく、その結果、COVID-19による二次的な心筋損傷の正確な病態生理学的メカニズムはまだつかみどころのないままである。しかしながら、ウイルスによる直接的な損傷、過度に制御されていない炎症反応、冠動脈プラークの不安定性、血栓症および低酸素症が、可能性のあるメカニズムとして提案されている(Guo et al 2020;Zheng et al 2020;Zhou、Yu et al 2020)。重要なことに、感染の重症度、患者の特徴、および宿主の反応はすべて、心臓合併症の発生に関与する。COVID-19患者における心血管悪化の主な機序として提案されているものは、以下のようにまとめることができる(図1)。
図1. SARS-CoV-2によって誘発される心血管系合併症の潜在的なメカニズム
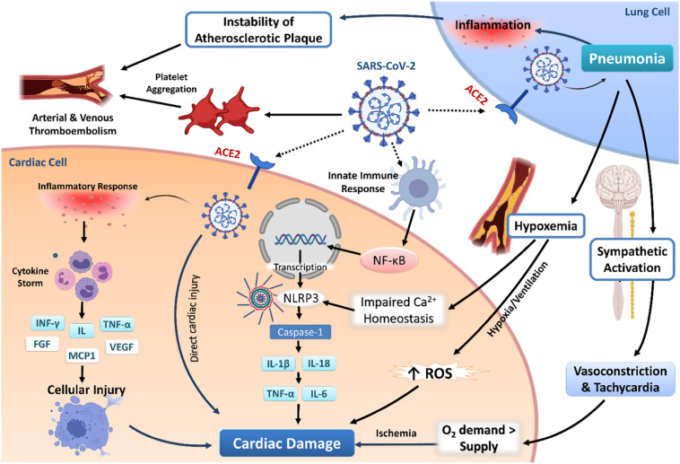
SARS-CoV-2は、細胞表面に発現しているACE2受容体を介してなど、さまざまな経路で心臓細胞に取り込まれる可能性がある。取り込まれた後、SARS-CoV-2は、直接的な作用および/または免疫応答の誘導により、IL、TNF-α、INF-γ、FGF、MCP1およびVEGFなどのプロ炎症性サイトカイン(「サイトカインストーム」)の放出をもたらすことにより、心臓に傷害を与えることができる。SARS-CoV-2は、NLRP3インフラマソームを含む自然免疫応答を誘発し、プロ炎症性サイトカインであるIL-1βおよびIL-18の活性化、および炎症性カスケード(IL-6およびTNF-α)の活性化を引き起こし、組織の損傷および線維化をもたらす。SARS-CoV-2誘発性肺炎では低酸素血症が発生し、Ca2+の恒常性が損なわれ、活性酸素の産生が増加し、NLRP3インフラマソームが活性化して心臓障害を引き起こす。肺炎に対する交感神経系の反応の活性化は、血管収縮と頻脈を引き起こし、冠血流を悪化させる。その結果、心筋のO2需要と供給のミスマッチが起こり、虚血が引き起こされる。SARS-CoV-2は冠動脈の動脈硬化性プラークを不安定化させ、血小板凝集を仲介して動脈血栓症や静脈血栓症を引き起こす。これらのSARS-CoV-2を介した作用が、観察された心血管障害に寄与している可能性がある。
ACE2,アンジオテンシン変換酵素2,Ca2+、カルシウム、FGF、線維芽細胞増殖因子、IL、インターロイキン、INF、インターフェロン、MCP-1,単球化学吸引性タンパク質1,NFκB、核因子κ-光鎖エンハンサー活性化B細胞。NLRP3,NACHT、LRR、PYDドメイン含有タンパク質3;O2,酸素;ROS、活性酸素種;SARS-CoV-2,重症急性呼吸器症候群コロナウイルス;TNF-α、腫瘍壊死因子-α;VEGF、血管内皮増殖因子。
3.1. 直接的な病原体の侵入
病原体の心臓組織への直接侵入は、重症肺炎患者において確認されている。例えば、重度の肺炎球菌疾患を有する患者の心筋において肺炎球菌が同定され、局所的な炎症反応を引き起こし、その結果、心臓損傷をもたらした(Xu, Shi, er al)。 Ouditらは、トロントでのSARS発生時にSARS患者から得られた剖検ヒト心臓サンプルの35%(7/20)にSARS-CoV RNAが検出されたことを報告しており、ウイルスによる心筋細胞への直接的な損傷の可能性を示唆している(Oudit et al 2009)。同じ報告書では、SARS-CoVのヒト株に感染したマウスを用いた研究で、SARS-CoVの肺感染も心筋感染を促進することが示されている(Oudit et al 2009)。SARS-CoV-2はSARS-CoVと遺伝的に関連していることから、類似のメカニズムを共有し、細胞侵入のための機能的な宿主細胞受容体であるアンジオテンシン変換酵素2(ACE2)を共有している可能性が高い(Gheblawi et al 2020)。重要なことに、ACE2は心臓および肺の両方で高度に発現しており(Patel, Zhong, Grant, & Oudit, 2016)証拠は、ACE2に対するSARS-CoV-2の親和性がSARS-CoVのそれよりも約10〜20倍高いことを示しており、これがSARS-CoV-2のより大きな病原性および急速な広がりの両方を説明している可能性がある(Gheblawi et al 2020; Hoffmann et al 2020)。全体として、SARS-CoV-2は心筋組織に直接感染し、重度の心臓損傷を引き起こす可能性がある(Wu er al)。 しかし、SARS-CoV-2による心筋組織の直接感染をさらに確認するためには、大規模な生検研究が必要である。
3.2. 間接的な炎症反応-サイトカインストーム
炎症は、COVID-19の設定で心血管障害の発症に重要な役割を果たしている。SARS-CoVおよびMERS-CoV感染と同様に、SARS-CoV-2感染はまた、過剰な宿主免疫応答を誘発し、サイトカインストームと呼ばれるプロ炎症性サイトカインの広範で制御不能な放出を導くことができる(Restrepo & Reyes, 2018; Zumla, Hui, Azhar, Memish, & Maeurer, 2020)。サイトカインは、様々な細菌およびウイルス感染症から防御するための免疫応答において極めて重要な役割を果たす。しかしながら、調節異常、増幅、および制御されていない免疫応答が、多臓器損傷およびSARS-CoV-2感染に続発する心血管損傷に寄与する系統的自己攻撃につながる免疫病理を引き起こす可能性があることも確立されている(Zhang et al 2020)。多数の研究は、インターロイキン-6(IL-6)IL-7,IL-8,IL-9,IL-10,IL-1β、IL-1RA、腫瘍壊死因子-α(TNF-α)顆粒球-マクロファージコロニー刺激因子、線維芽細胞増殖因子などのサイトカインの増加量を示している。COVID-19患者の血清中のマクロファージ炎症性タンパク質1α、血小板由来成長因子、単球化学吸引性タンパク質、血管内皮成長因子のうち、特にICU患者において (Chen, Zhou, er al)。) , 2020;Conti et al 2020;Huang et al 2020;Wang、Hu et al 2020;Zhang、Zhao et al 2020)。) 重要なことに、COVID-19患者における血清サイトカインレベルと死亡率との間には強い相関関係がある。増幅された制御不能な炎症反応は、影響を受けた細胞の細胞アポトーシスまたは壊死を誘導する。これに続いて、血管の透過性が増加し、炎症性単球、マクロファージ、好中球が様々な身体器官に蓄積され、炎症性カスケードを燃料とする(Channappanavar et al 2016)。悪循環は、サイトカインストームがさらに刺激され、免疫応答の制御が失われ、深刻な結果をもたらすことになり、状況を激化させる。このことをまとめると、制御されていない炎症性反応が、COVID-19患者で観察された有害反応の主要な要因であることを示している。その意味では、誇張された免疫反応を改善することがCOVID-19患者の臨床転帰を改善することになると考えられる(表3)。
表3. COVID-19患者におけるサイトカインストーム、炎症亢進状態、および関連する二次的臓器合併症を改善するために検討されている薬理学的アプローチの概要
| 薬理学的介入 | サンプルサイズと基準 | 治療プロトコル | 主な調査結果 | 結論 | 参照 |
|---|---|---|---|---|---|
|
|
|
|
|
(ChiCTR2000029765,2020) |
|
|
|
|
|
(Biran et al。 2020) |
|
|
|
|
|
(Xu et al。 2020) |
|
|
|
|
|
(Ramiro et al。 2020) |
|
|
|
|
|
(Cao et al。 2020) |
|
|
|
|
|
(Aouba et al。 2020) |
|
|
|
|
|
(Huet et al。 2020) |
自然免疫系は、パターン認識受容体、特にToll様受容体(TLR)を用いて、脂質、リポタンパク質、タンパク質および核酸を含むウイルスの病原体関連分子パターンを認識することにより、ウイルス感染を検出する(Li et al 2020)。TLRRの活性化は、転写因子核因子κ-光鎖-エンハンサー活性化B細胞(NF-κB)インターフェロン(IFN)調節因子3およびマイトジェン活性化プロテインキナーゼの発現を増加させ、これらはその後、無数の炎症性因子の発現を誘導する(Akirapla,2009)。例えば、SARS-CoV-2のTLRへの結合は、NF-κB炎症経路を活性化し、NLRP3(NOD-、LRR-、およびピリンドメイン含有3)インフラマソームの異なる構成要素の転写を誘発する(Chen、Moriymayama、Changan、&Inchinone 2019;Siu et al 2019)。NLRP3インフラソームは、主要な3つのコンポーネント、NLRP3足場、カスパーゼ活性化およびリクルートドメインを有するアダプターコンポーネントのアポトーシス関連スペック様タンパク質、および不活性なザイモゲンプロカスパーゼ-1(Elliott & Sutterwala, 2015; Latz, Xiao, & Stutz, 2013)から構成される大規模な多重タンパク質プラットフォームである。NLRP3インフラマソームが活性化され、一旦組み立てられると、プロカスパーゼ-1は、活性なエフェクタープロテアーゼであるカスパーゼ-1に変換され、これにより、プロ炎症性サイトカインであるpro-インターロイキン-1β(pro-IL-1β)およびpro-IL-18が、対応する活性型である炎症性IL-1βおよびIL-18へと切断および成熟することを引き起こす。これは、順番に、より多くの組織損傷、発熱、および線維化を誘導するTNF-α、IL-6,プロスタグランジンおよびロイコトリエンなどの炎症の他の下流メディエーターのカスケードを誘発する(Conti et al 2020;Yue et al 2018)。NLRP3インフラマソームカスケードによって誘発される堅牢な炎症反応に基づいて、この経路を標的とすることは、SARS-CoVs感染による制御不能な炎症の有害な結果を減少させることができる、潜在的な治療的価値を有する。
炎症は、動脈硬化、凝固病、冠動脈疾患およびHFなどの様々な心血管疾患に関与することがよく知られている(Libby, Ridker, & Maseri, 2002)。COVID-19の重症例の大部分では、サイトカインストームは、エリテマトーデス沈降速度およびC反応性蛋白(CRP)の上昇レベルと相まっている。その後、高凝固および播種性血管内凝固は、手足の血栓症、血小板減少症および壊疽として提示されるであろう(Siddiqi & Mehra, 2020; Zhang, Zhao, Zhang, er al)。 HF患者におけるTNF-αなどの重要なサイトカインの同定は、サイトカインと左室拡張/肥大および左室機能不全の重症度との間の強い正の相関を実証した(Dibbs et al 2003;Janchewski et al 2003)。他の証拠は、急性心筋炎および急性MIを有する患者において検出されたIL-1βおよびIL-6レベルの増加を示す(Xu, Shi, et al 2020)。IL-6レベルの増加は、全身性炎症を有する患者における長いQT-症候群と関連しており、トルサード・デ・ポインツなどの不整脈のより高いリスクにつながる(Aromolaran et al 2018)。同様に、IL-6のレベルは、急性冠症候群および慢性HF後の有害な心血管系イベントの予測因子として使用することができる(Fanola et al 2017; Held et al 2017)。IL-8の血清レベルは、急性MI患者において増加し、より高い死亡率と関連している(Cavusoglu et al 2015)。まとめると、炎症性マーカーの上昇とCOVID-19患者で観察された有害な心血管系転帰との間には強い相関関係があり、心臓障害の発生および進行における炎症性ストームの潜在的な役割を示唆していると結論づけることができる。
重要なことは、COVID-19に起因するより重篤な心臓合併症を発症するリスクの高い集団は、高齢、肥満、メタボリックシンドローム、高血圧、糖尿病の患者であることが報告されていることである。これらの疾患には共通して、免疫の変化により炎症性亢進状態が好まれ、炎症の解決が損なわれるという特徴がある(Bruunsgaard & Pedersen, 2003; Goldstein, 2010; Lawrence & Gilroy, 2007; Rius et al 2012)。したがって、従来の心血管治療に加えて、サイトカインストームの主要なステップおよび構成要素を標的とした抗炎症療法が、COVID-19の重症症例における心血管障害の治療戦略および管理として仮説が立てられる。異なる臓器における炎症反応は共通の経路を共有しているため、全身的な炎症反応を改善することは、心血管系に利益をもたらし、他の臓器にも潜在的な利点をもたらすであろう。
3.3. その他のメカニズム
COVID-19に関連する心血管障害の他の提案されたメカニズムには、冠動脈性動脈硬化性プラークの不安定性(Madjid, Vela, Khalili-Tabrizi, Casscells, & Litovsky, 2007)および血小板凝集活性の増加(Modica, Karlsson, & Mooe, 2007)が含まれ、過剰で制御不能な凝固および血栓症につながる(Milbrandt et al 2009)。肺炎に対する全身性の炎症反応は、内皮機能障害を誘導し、血液のプロコアグラント活性を増加させ、その結果、冠動脈の動脈硬化性プラーク内で炎症反応を誘発し、不安定で破裂しやすい状態にする。このことが、破裂した冠動脈プラークの上に閉塞性血栓を形成することに寄与している。COVID-19患者は低酸素、過剰な炎症、びまん性の血管内凝固により動脈血栓塞栓症や静脈血栓塞栓症を起こしやすいことが報告されている。COVID-19肺炎が証明された184人のICU患者を対象としたオランダの研究では、患者の3分の1が血栓と血栓性合併症を呈していた。これらの所見は、結果的に、すべてのCOVID-19患者において抗血小板および他の薬理学的血栓予防薬の使用を推奨することを補強した(Klok et al 2020)(表4)。
表4. COVID-19患者における高凝固性および血小板活性化を標的とした調査中の薬理学的介入の概要
| 薬理学的介入 | サンプルサイズと基準 | 治療プロトコル | 主な調査結果 | 結論 | 参照 |
|---|---|---|---|---|---|
|
|
|
|
|
(Tang、Bai、et al。 2020) |
|
|
1.アセチルサリチル酸(ASA)250 mgivの単回投与および経口クロピドグレル300mgの単回負荷投与 2.ASAおよびクロピドグレルを75mgで30日間経口投与 3.チロフィバン25μg/ kgをボーラス静脈内注射として、その後0.15μg / kg / min48時間の連続静脈内注入4.入院期間中のFondaparinux2.5 mg / day sc |
|
|
(Viecca、Radovanovic、Forleo、およびSantus 2020) |
SARS-CoV感染から回復した25人の患者を対象にWuらが実施した12年間の追跡調査では、患者が脂質代謝と心血管系を変化させる様々な代謝障害の影響を受けていることが明らかになった。これらの患者は、高脂血症、遊離脂肪酸の血清濃度の上昇、異常なグルコース代謝、および他の心血管系の異常に苦しんでいた(Wu et al 2017)。SARS-CoVとSARS-CoV-2の遺伝的類似性を考慮して、Zhangらは最近、COVID-19患者の治療選択肢として、抗炎症作用も有する脂質低下スタチンの使用を提案した。この研究では、COVID-19の13,981例のうち、スタチンの院内使用は、死亡リスクの低下および入院期間全体の炎症反応の有意な低下と関連していたことが報告されている(Zhang et al 2020)。このように、抗炎症作用を有する脂質低下薬の使用は、COVID-19患者の心血管アウトカムを改善する可能性があることを示唆している。
COVID-19患者は、肺機能の低下、炎症を起こした肺胞を横切るガス交換の障害、および異常な換気/灌流のために低酸素血症になりやすい。これは、心筋酸素供給量の減少、心筋虚血、およびカルシウムの恒常性の障害につながる。カルシウムバランスの障害は、NLRP3インフラマソームおよび異なる炎症性成分の活性化を誘発し、その結果、心筋細胞の死につながる(Mocccia et al 2020;Zhenghon et al 2020)。さらに、肺炎に対する全身的な反応は、重度の頻脈および末梢抵抗の増加を引き起こす交感神経活動の増加を含む。その後、血管収縮とともに急速な心拍数が生じると、心筋酸素要求量が上昇し、拡張期間隔(冠動脈灌流が起こる期間)が短縮されることがある。心筋の酸素要求量と供給量のミスマッチは、特に冠動脈疾患の既往がある場合には、心筋虚血や梗塞を引き起こす可能性がある(Corrales-Medina, Musher, Shachkina, & Chirinos, 2013)。ナトリウムおよび水の代謝障害(Dreyfuss, Leviel, Paillard, Rahmani, & Coste, 1988)内皮機能および血管緊張の一過性の障害(Benson, Akbarian, Adler, & Abelmann, 1970;Kumar, Wallace, Ramirez, Benson, & Abelmann, 1970)および心臓不整脈(Cilli er al 2018)もまた、COVID-19を有する患者における左室機能の低下またはHFの悪化に寄与する可能性がある。
集合的に、これらの影響はすべて、既存の心血管疾患を悪化させ、急性冠症候群、血栓症、心筋虚血、またはHFの増悪などの重篤なイベントを誘発し得る。実際、COVID-19患者の予後を改善するためには、重篤な有害心血管系イベントの予防および管理のための心血管系保護戦略が必要である(表5,表6)。
表5. COVID-19に関連する心血管系傷害を減衰させるために提案されている薬理学的アプローチの概要
| 薬理学的介入 | サンプルサイズと基準 | 治療プロトコル | 主な調査結果 | 結論 | 参照 |
|---|---|---|---|---|---|
|
|
|
|
|
(Deftereos et al。 2020) |
|
|
|
|
|
(張、秦、成、他 2020年) |
|
|
|
|
|
(Zhang、Zhu、Cai、et al。 2020) |
|
|
|
|
|
(( Lala et al。 2020) |
表6 SARS-CoV-2感染に続発するサイトカインストームおよび急性心臓損傷を標的とする薬剤を調査している進行中の試験の要約
| 薬理学的介入 | サンプルサイズと基準 | 治療プロトコル | 参照 |
|---|---|---|---|
|
|
|
(NCT04393246,2020) |
|
|
|
(Liu、Zhu、Zhang、Li、およびPeng 2020) |
|
|
|
(Rilinger et al。 2020) |
|
|
|
(Kulkarni et al。 2020) |
|
|
|
(ストックマン他 2020年) |
|
|
|
(Rodriguez-Rubio et al。 2020) |
|
|
|
(NCT04322188,2020) |
|
|
|
(Maes et al。 2020) |
|
|
|
(NCT04315298,2020) |
|
|
|
(NCT04324073,2020) |
|
|
|
(NCT04321993,2020) |
|
|
|
(NCT04362137,2020) |
|
|
|
(NCT04312009,2020) |
|
|
|
(NCT04311177,2020) |
|
|
|
(NCT04335032,2020) |
|
|
|
(NCT04322682,2020 |
4. 提案された経験的/支持的治療法の心血管系への悪影響
現在、COVID-19に対する防御または治療のための承認されたワクチンまたは有効な薬剤は存在しない;対症療法および経験的/支持療法のみが利用可能である。COVID-19に関連した死亡の多くは、主に肺炎ではなく、元々の患者の併存疾患に起因している(Wang et al 2020)。このことは、COVID-19患者の既往の併存疾患、特に心血管系の併存疾患に注目することの重要性を浮き彫りにしている。COVID-19患者、特に基礎的な心血管疾患を有する患者に提案され、適用されている心血管系の副作用を有する治療法への注意が重要である。注目すべきことに、COVID-19患者の不良な予後を改善するために提案されている治療法の多くは、心血管系の副作用と関連している。例えば、COVID-19患者を非ステロイド性抗炎症薬、グルココルチコイド、およびリバビリン、ロピナビル/リトナビル、INF-α、および抗生物質アジスロマイシンなどの抗ウイルス剤で治療することは、COVID-19患者の心血管リスクをさらに増加させ得る。
非ステロイド性抗炎症薬およびグルココルチコイドの過度の使用は、虚血、MI、不整脈およびHFを含むイベントのリスクを増加させる心血管系への劇症的な影響と関連している(England, Thiele, Anderson, & Mikuls, 2018; Roubille et al 2015)。コルチコステロイドは、炎症を緩和する可能性があるために、重症SARS-CoV感染症患者の治療のために処方されることがあるが(Wong et al 2004年)最近の証拠は、コルチコステロイドが、ウイルスクリアランスの遅延により、SARS-CoV-2に関連した肺損傷を悪化させる可能性があることを示唆している(Mehta、他 2020;Russell、Millar、&Baillie 2020)。抗ウイルス剤ロピナビルおよびリトナビルは、COVID-19を有する入院成人患者を対象とした無作為化対照非盲検試験で試験され、標準的なケアを超えたロピナビル-リトナビル治療では利益は観察されないと結論づけられている。さらに、ロピナビル-リトナビル投与を受けた患者の約14%は、主にQT延長のリスクを含む有害事象のため、14日間の全投与コースを完了することができなかった(Cao et al 2020)。これらの抗ウイルス薬の副作用は、QTcおよび/またはPR間隔の延長を引き起こす心臓の電気伝導系の変化を伴うことを強調することが重要であり、これは心房室ブロックおよびtrorsade de pointes不整脈を引き起こし、MIのリスクを増加させる可能性がある(Worm et al 2010)。さらに、これらのプロテアーゼ阻害剤の使用は、高血糖、高脂血症、およびリポジストロフィーのような代謝障害を引き起こし、これらはまた、有害な心血管系の転帰に寄与する可能性がある(Hill, Sawyer, & Gazzard, 2009; Tsiodras, Mantzoros, Hammer, & Samore, 2000)。最近、IFN-α2bは、中国の武漢でCOVID-19が確認された入院成人77名を含む非対照の探索的試験で使用された(Zhou et al 2020)。この試験では、IFN-α2bによる治療は、上気道でのウイルス検出可能期間を著しく減少させ、血中の炎症性マーカーIL-6およびCRPの上昇の間隔も減少させた。しかしながら、IFN-αによる治療は、高血圧、高トリグリセリド血症、および不整脈、MIおよび心筋症を含む直接的な心毒性と関連しており、基礎となる心機能障害を悪化させる可能性がある(Page 2nd et al 2016)。COVID-19で入院した患者を治療するためのIFNβ-1b、ロピナビル・リトナビルおよびリバビリンの有効性を試験するためのオープンラベル無作為化試験が実施されており、早期のトリプル抗ウイルス療法は、軽度から中等度の感染症を有する患者における症状の緩和および入院期間の短縮に有効であると結論づけられている(Hung, er al)。 しかしながら、リバビリンは、基礎となる心疾患を悪化させ、致死的および非致死的なMIにつながる可能性のある使用に関連した溶血性貧血について、米国で箱入り警告が出されていることは注目に値する(Durante-Mangoni et al 2011)。数多くの最近の研究は、オープンラベル非ランダム化臨床試験において、COVID-19の治療薬としてヒドロキシクロロキンおよびアジスロマイシンの使用を提案したが、肯定的な結果は得られなかった(Arshad et al 2020;Cavalcanti et al 2020;Gautret et al 2020;Tang et al 2020)。アジスロマイシンまたはヒドロキシクロロキンに関連するよく知られた副作用には、重度のQT延長の発現が含まれ(Gibson et al 2017)これは、COVID-19患者を治療するためにアジスロマイシンをヒドロキシクロロキンと併用すると悪化する(Choi, Lim, Chung, Choi, & Yoon, 2018; Mercuro et al 2020)。
現在、新規なCOVID-19治療薬を試験するために世界中で複数の試験管内試験実験および前臨床試験が行われており、これらは急速に臨床試験に移行している。重要なことは、初期の有効性の結果は小規模な臨床試験に限られており、安全性プロファイルが十分に明らかにされていないことである。安全性プロファイルは、心血管機能障害などの併存疾患を基礎疾患とするCOVID-19患者にとって極めて重要なものとなる。したがって、COVID-19に対する迅速な臨床応用と新規治療薬の広範な使用が求められているため、安全性プロファイルに継続的に注意を払うことが重要である。COVID-19の急速な世界的な普及は、高齢者患者や基礎的な合併症を持つ患者などの影響を受けやすい集団に影響を与え続けている。基礎となる心血管系の問題はCOVID-19の感染によって影響を受けているが、多くの既存および新規の治療法は直接的な心血管系への悪影響を有しており、新薬の研究開発において考慮すべき重要性が強調されている。
5. n-3多価不飽和脂肪酸の概要
長鎖n-3多価不飽和脂肪酸(n-3 PUFAs)は、食事源と非食事源の両方から得られる必須脂肪酸である。最も単純なn-3 PUFAはα-リノレン酸(ALA、18:3 n-3)である。体内に入ると、ALAは一連の伸長反応と脱飽和反応を経て他のn-3 PUFAに変換される。例えば、ALAは、さらにドコサヘキサエン酸(DHA、C22:6n-3)哺乳類の組織(Wiktorowska-Owczarek、Berezinska、&Nowak 2015)の2つの最も豊富なn-3 PUFAsに代謝することができるエイコサペンタエン酸(EPA、C20:5n-3)に代謝される。哺乳類は、ALAデノボを合成するために必要な酵素(デルタ-12およびデルタ-15デサチュラーゼ)を欠いている。このように、これらの脂肪酸は「必須」と記載されており、魚、他の海洋源、植物またはサプリメントなどの食事から得なければならない(Burdge & Calder, 2015; Sprecher, 1981)。逆に、リノール酸(LA、18:2 n-6)は、必須のn-6 PUFAの主要な供給源と考えられている。LAは、エロンゲナーゼおよびデルタ-4,-5,-6デサチュラーゼ酵素の同じシリーズによってアラキドン酸(AA、20:4n-6)にさらに代謝することができる。n-3 PUFAsは、n-6 PUFAsと同じ代謝経路を競うことができるように、n-3 PUFAsのサプリメントは、このように、代謝物のプロファイルを変更し、免疫系を含む体内の多数のシグナリング経路に影響を与える、不均衡な効果につながる(Arterburn、ホール、&Oken 2006)n-6 PUFA由来の代謝物の合成を減らすことができる。
6. 呼吸器感染症および/または敗血症患者における n-3 多価不飽和脂肪酸の役割
多くのヒトおよび動物研究が、重症SARS-CoV-2患者で観察される共通の特徴であるALIおよびARDS患者におけるEPAおよびDHAの有益な効果を調査してきた(Messina et al 2020;Nelson et al 2003;白井、吉田、松丸、豊田、および小倉 2015;Singer et al 2006)。Mancusoらは、21日間、n-3 PUFAsの供給源として魚油を含む経腸食を与えられたロングエバンスラットが、サルモネラエンドトキシンの静脈内注射によって引き起こされる急性炎症にさらされたことを実証した。n-3 PUFAを給餌したラットは、n-6 PUFAを濃縮した飼料を給餌したラットと比較して、肺微小血管タンパク質透過性の重症度が低く、肺好中球蓄積量が減少した(Mancuso et al 1997a; Mancuso et al 1997b)。さらに、刺激された肺胞マクロファージは、ALIの減衰におけるn-6 PUFAsよりもn-3 PUFAsの有益な効果を示唆するトロンボキサンB2(TxB2)およびプロスタグランジンE2(PGE2)などのAA由来の代謝物の低濃度を有していた(Mancuso et al 1997a; Mancuso et al 1997b)。Saedisomeoliaらは、DHAで事前インキュベートすることが有意にIL-6およびIFN-γ誘導性タンパク質の放出を減少させ、RV誘発性炎症を抑制することをライノウイルスRV-43およびRV-1Bに感染したCalu-3上皮細胞で実証した(Saedisomeolia, Wood, Garg, Gibson, & Wark, 2009)。これらの研究は、n-3 PUFAの抗炎症特性が、COVID-19の設定で有用である可能性がある細菌やウイルス感染症の二次的な肺の制御されていない免疫応答を減衰させる上で極めて重要な役割を果たすことを示している。
ALI、ARDSおよび敗血症の改善におけるn-3 PUFAsの役割を評価する試験からの臨床的証拠は限られている。Pontes-Arrudaらは、機械的換気を必要とする重度の敗血症または敗血症性ショック患者におけるEPA、γ-リノレン酸および抗酸化物質を豊富に含む食事の効果を調査した(Pontes-Arruda, Aragao, & Albuquerque, 2006)。このデータは、食事療法がICUおよび病院の臨床転帰の改善に寄与し、対照群と比較した場合の死亡率の低下と関連していることを示唆している。メタアナリシスでは、EPAとγ-リノレン酸を投与されたALI/ARDS患者の人工呼吸器の無呼吸日数、臓器不全、ICU滞在期間、死亡率の有意な減少だけでなく、酸素化と臨床転帰の関連する改善が報告されている(Pontes-Arruda, Demichele, Seth, & Singer, 2008)。早期敗血症患者を対象に、高用量のEPAとDHA(9g/dに1g/dのアスコルビン酸、400UI/12hのα-トコフェロール、100μg/dのセレンを加えたもの)を補充した食事の有効性と安全性を7日間評価した。研究者らは、患者のCRP、IL-6,プロカルシトニンのレベルが低下し、機械的換気の必要性が減少し、重症敗血症の発症が減少したことを発見した(Hosny, Nahas, Ali, Elshafei, & Khaled, 2013)。重度のARDS患者におけるn-3 PUFA含有飼料の有益な効果の証拠は、機械的換気の持続時間の減少、ICUの長さの短縮、および酸素化の改善などの同様の転帰を実証した(Langlois, D’Aragon, Hardy, & Manzanares, 2019)。これらの効果は、メタ分析で最近の系統的レビューで強調されている魚油脂質エマルジョンで濃縮非経口栄養療法を受けて重症患者は、感染症や敗血症(それぞれ40%と56%)だけでなく、約2日(Pradelli et al 2020)による入院とICU滞在の減少のためのリスクを低減したことを示した。合わせて、これらの研究は、n-3 PUFAの補給が複数の炎症性、呼吸器系、臨床転帰の観点から良好な結果をもたらすことを実証している。
最近、Bristrianは、サイトカイン分泌を抑制し、炎症反応を緩和するために、重度のSARS-CoV-2患者の治療に、EPAおよびDHA(4-6 g/d)を相当量含有する魚油乳剤の非経口補充を使用することを提案した(Bistrian 2020)。この考えに賛同して、Torrinhasらは、n-3 PUFAsの免疫調節特性が、特に高齢者、肥満、高血圧、腫瘍および糖尿病患者を含む重度の基礎疾患を有する入院した高リスク集団において、COVID-19の臨床転帰を改善するための重要かつ有益な効果を提供することを示唆した(Torrinhas、Calder、&Waitzberg 2020)。さらに、彼らは、重度のCOVID-19表現型に関連する有害な転帰を誘発する役割を持っているかもしれない既存の健康状態で観察された悪化した炎症状態を減衰させることによって、n-3 PUFAが追加の利益を提供する可能性があることを示唆した。
現在、SARS-CoV-2が確認された入院被験者におけるn-3 PUFAsの効果を調査するためのオープンラベル、無作為化対照試験が行われている(NCT04335032,2020)。本試験は240名の参加者で構成され、一方のグループは標準治療を受け、他方のグループはEPAカプセルを1日2g追加で提供される。介入は28日から90日の間に行われ、本疾患の治療におけるEPAの有効性、酸素飽和度、プロ炎症性IL-6レベル、死亡率、ICU滞在日数、入院日数、機械的人工呼吸の必要性が決定される。本研究の結果は得られていないが、生物活性脂質の経口または静脈内投与が、COVID-19に感染した患者の重症度を低下させ、および/または回復を高める可能性があることを示唆する証拠が得られている(Das, 2020a)。しかしながら、さらなる研究が必要であることは間違いない。
7. n-3多価不飽和脂肪酸の心血管系への利点
n-3 PUFAsおよびそれらの内因性に生成された代謝物の多くは、心血管疾患を含む多数の疾患に対する幅広い特性を有する生理活性脂質分子として作用する(Lordan, Redfern, Tsoupras, & Zabetakis, 2020; Lordan, Tsoupras, & Zabetakis, 2017; Moro, Nagahashi, Ramanathan, Takabe, & Wakai, 2016)。数多くの研究は、n-3 PUFAsのより高い消費量が、心血管疾患に関連する死亡数を低下させることを示唆している(Darwesh、Sosnowski、Lee、Keshavarz-Bahaghighat、& Seubert 2019; Kris-Etherton、Harris、Appel、& Nutrition 2003; Lee、O’Keefe、Lavie、& Harris 2009; Mozaffarian 2007)。例えば、Mozaffarianらは、米国成人コホート研究におけるn-3 PUFAバイオマーカーの高い血漿レベルが、非心血管死と比較して少ない心血管に起因する総死亡率の低下と関連していることを実証した(Mozaffarian et al 2013)。現在、n-3 PUFAsの摂取は、最近のMIなどの冠動脈性心疾患が優勢な個人の臨床的心血管疾患エピソードを予防するために、死亡率を低下させるだけでなく、入院および死亡率の数を減少させるために有病率の高いHFを有する個人にも推奨されている(Sacks et al 2017; Siscovick et al 2017)。
n-3 PUFAsの心血管系の利点は、心血管系のさまざまな要素に対する彼らの多元的な効果に起因する可能性がある。証拠は、n-3 PUFAsのより高い摂取量は、飽和脂肪酸を交換し、それによって動脈硬化性プラークを安定化させ、血栓形成の発生率を低下させるトリグリセリドレベルを下げることによって、脂質プロファイルに有益な効果を持っていることを示唆している(Plutzky、1999年; Thies et al 2003)。さらに、n-3PUFAは、細胞膜を豊かにし、脂質ラフトの構造および機能を変化させ、小器官および細胞機能の改善につながる(Din et al 2008年)自律神経の調子(Abuisssa、O’Keeefe Jr.Abuissa, Sastre, Steinhaus, & Harris, 2006)不整脈閾値の上昇(Anand, Alkadri, Lavie, & Milani, 2008)高血圧の改善(Geleijnse, Giltay, Grobbee, Donders, & Kok, 2002; O’Keefe Jr. et al 2006)。重要なことに、いくつかの実験的、臨床的、疫学的研究では、n-3 PUFA およびその代謝物の心保護効果は、主にそれらの免疫調節特性に起因するという仮説が立てられている。特に、新興の証拠は、炎症性ケモカイン、サイトカイン、および n-6 PUFAs に由来するプロ炎症性代謝物の循環レベルを低下させる n-3 PUFAs の能力を示している (Calder, 2013, Calder, 2017)。
8. COVID-19の設定におけるn-3 PUFAsの潜在的な心保護メカニズム
いくつかの臨床報告に基づいて、重度のALI/ARDSを有するCOVID-19患者はまた、敗血症および心停止のリスクの増加に苦しむ可能性がある(Huang et al 2020)。蓄積された報告は、n-3 PUFAが炎症の解決、敗血症の生存、および敗血症性心筋症に対する心臓の前提条件を改善し得ることを示している(Korner et al 2018; Leger et al 2019)。このレビューでは、n-3 PUFAが、主にそれらの免疫調節機能、抗酸化の可能性だけでなく、組織の止血を維持する能力に起因して、COVID-19に関連する心血管系の合併症から保護し、改善することができることを提案する。このセクションでは、n-3 PUFAとその代謝物の心保護メカニズムに焦点を当て、n-3 PUFAがCOVID-19に関連する心血管系合併症の治療や保護にアジュバントとして有用である可能性を示唆している(図2)。
図2. COVID-19の設定におけるn-3 PUFAsの潜在的な心保護メカニズム
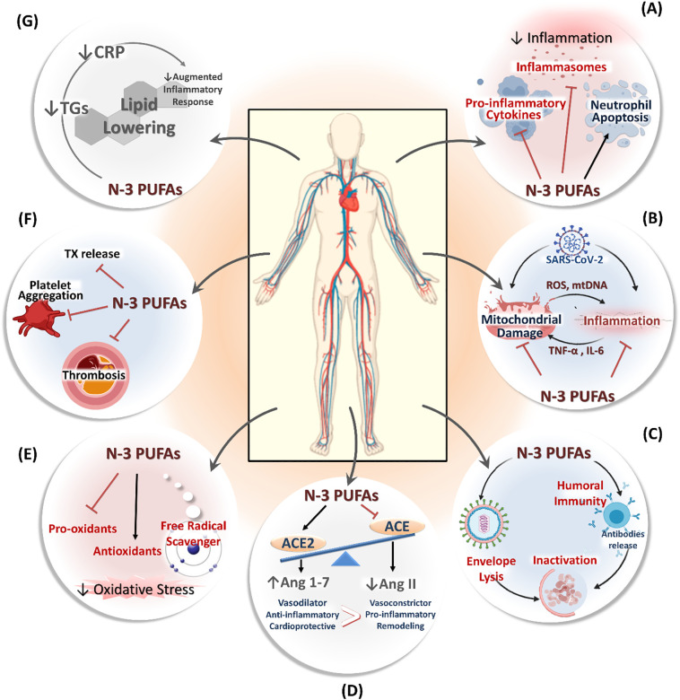
A)N-3 PUFAsは、制御されていない免疫応答を改善し、いくつかのメカニズムを介して抗炎症効果を発揮する。B)N-3 PUFAsは、ミトコンドリア機能不全と悪化した免疫応答の悪循環/相互作用を減衰させる。C)N-3 PUFAsは、全体的なウイルス負荷を減少させるために体液性応答を活性化することを介して、膜の完全性と間接的なメカニズムの両方の直接的な効果を介してウイルス感染を減衰させる能力を持っている。(D) N-3 PUFAs は、血管拡張性、抗炎症性、心保護 ACE2/Ang (1-7) エフェクターの賛成で RAAS システムを調節する能力を持っている。E)N-3 PUFAsは、抗酸化能力を高め、組織内の酸化ストレスを減衰させる。(F) N-3 PUFAs は抗血栓効果を発揮することによって凝固障害を改善する。G)n-3 PUFAsのトリグリセリド低下効果は、COVID-19を持つ患者で観察された誇張された炎症を鈍らせる上で重要な役割を果たす可能性がある。
ACE、アンジオテンシン変換酵素; Ang、アンジオテンシン; CRP、C反応性タンパク質; IL、インターロイキン; mtDNA、ミトコンドリアDNA; PUFA、ポリ不飽和脂肪酸; ROS、活性酸素種; TGs、トリグリセリド; TNF-α、腫瘍壊死因子α; TX、トロンボキサン。
8.1. n-3 PUFAsの抗炎症特性
前述のように、COVID-19患者における心血管障害の発症には、免疫系反応の悪化と制御不能な炎症が基本的なメカニズムとなっている。したがって、多くの実験的研究および臨床試験は、COVID-19の急性期および寛解期における心血管障害を制御するために、異なる炎症性成分を標的とすることが有望な戦略であると考えられることを示している(図3)。
図3. n-3 PUFAの抗炎症メカニズムの概要
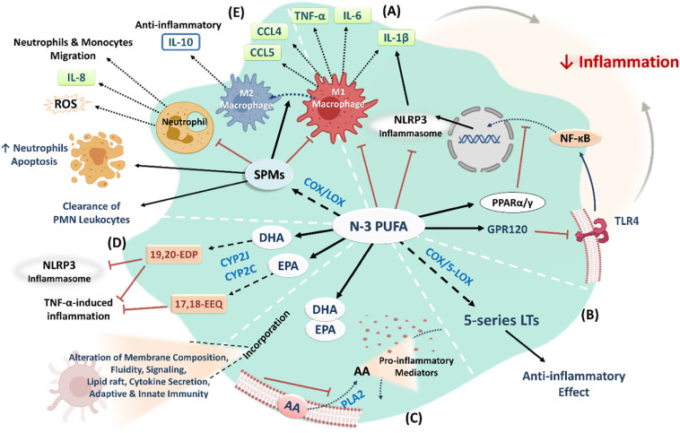
(A) N-3 PUFAは、炎症性サイトカイン、ケモカイン、接着分子の発現を調節し、NLRP3インフラマソームを阻害し、抗炎症転写因子(PPARα/γ)を活性化し、GPR120受容体を活性化して、TLR4媒介のNF-κBの活性化を阻害する。B)N-3 PUFAsはCOX/5-LOXにより5系列LTに代謝され、抗炎症作用を発揮する。C)N-3 PUFAは、炎症反応を変化させるAAなどのn-6 PUFAを置き換えることができる。N-3 PUFAは、細胞膜組成物、流動性および媒介されたシグナリングを変更する。D)N-3 PUFAs、DHAおよびEPAは、抗炎症特性を有する生理活性エポキシ脂質にCYPエポキシゲナーゼによって代謝される。E)N-3 PUFAsは、強力な抗炎症性モジュレーターとして作用するSPMにCOX/LOXによって代謝される。
AA、アラキドン酸;CCL、ケモカインリガンド;COX、シクロオキシゲナーゼ;CYP、シトクロムP450;DHA、ドコサヘキサエン酸;EDP、エポキシドコサペンタエン酸;EEQ、エポキセイコサテトラエン酸。EPA、エイコサペンタエン酸;GRP、Gタンパク質共役受容体;IL、インターロイキン;LOX、リポキシゲナーゼ;LT、ロイコトリエン;PUFA、ポリ不飽和脂肪酸。NFκB、核因子κ-光鎖エンハンサー活性化B細胞;NLRP3,NACHT、LRRおよびPYDドメイン含有タンパク質3;PLA2,ホスホリパーゼA2;PMN、多形核好中球;PPAR、ペルオキシソーム増殖因子活性化受容体;ROS、活性酸素種;SPMs、特異的プロ分解メディエーター;TLR、Toll様受容体;TNF-α、腫瘍壊死因子-α。
8.1.1. N-3 PUFAs は、いくつかの炎症性自然免疫成分の発現を調節し、マクロファージ応答を調節する。
NLRP3フラナソーム、IL-1β、TNF-α、およびIL-6応答を連結する中枢性自然免疫経路の「サイトカインストーム」および活性化は、COVID-19で報告された心血管系に悪影響を及ぼす過剰な炎症の主要な原因である。したがって、異なる構成要素を標的とすることは、COVID-19に続発する心臓合併症を改善するための有望なアプローチである(Huang et al 2020)。COVID-19患者におけるn-3 PUFAの使用に関連した直接的な臨床証拠はないが、心血管障害を含むいくつかの炎症性設定におけるn-3 PUFAの適用は、いくつかのメカニズムによって有害な免疫反応を改善することが実証されている(Rogero et al 2020)。n-3 PUFAsの抗炎症効果は、いくつかの以前の臨床所見(Calder, Carr, Gombart, & Eggersdorfer, 2020; Fritsche, 2006; Kiecolt-Glaser et al 2012; Vedin et al 2008)にわたって一貫しているようである。興味深いことに、Tanらは最近、高用量のn-3 PUFAサプリメント(1.5 g/日EPAおよび1.0 g/日DHA)が、慢性静脈性下腿潰瘍を有する中年または晩年患者における4週間の治療後に、IL-6,IL-1βおよびTNF-αの血漿レベルを著しく低下させることを無作為化比較試験で実証した(Tan, Sullenbarger, Prakash, & McDaniel, 2018)炎症を調節するための効果的な低リスクの食事介入としてn-3 PUFAを示唆している。この研究は、n-3 PUFAsがサイトカインストームIL-6,IL-1βおよびTNF-αの主要成分に対して直接的なモジュレーション効果を有し得ることを示している。
n-3 PUFAsは、心筋細胞、線維芽細胞、内皮細胞、単球およびマクロファージにおけるサイトカイン、ケモカインおよび接着分子を含む炎症性遺伝子の転写および発現を変調することができる(Collie-Duguid & Wahle、1996; De Caterina、Cybulsky、Clinton、Gimbrone、およびLibby、1994; Hughes、Southon、およびPinder、1996; Miles、Wallace、およびCalder 2000; Sanderson & Calder、1998)。これは、主に、NF-κBの阻害などの主要な転写因子の調節によって達成される(Kumar, Takada, Boriek, & Aggarwal, 2004; Lo, Chiu, Fu, Lo, & Helton, 1999. Novak, Babcock, Jho, Helton, & Espat, 2003; Zhao, Joshi-Barve, Barve, & Chen, 2004)またはペルオキシソーム増殖因子活性化受容体-α/γ(PPARα/γ)の活性化(Gani & Sylte, 2008; Zapata-Gonzalez er al)。 , 2008). PPARα/γの活性化は、NF-κBの活性化を直接阻害し、その核へのシャトルリングを防ぎ、炎症性バーストを減少させることができる(Matsumoto et al 2008; Mishra, Chaudhary, & Sethi, 2004; Poynter & Daynes, 1998; Ricote, Huang, Welch, & Glass, 1999; Vanden Berghe et al 2003)。興味深いことに、PPARアゴニストを用いたPPARの直接活性化は、COVID-19患者におけるサイトカインストームを鈍化および調節するための治療標的として提案され、n-3 PUFAが有望な効果を有し得ることを示唆している(Ciavarella, Motta, Valente, & Pasquinelli, 2020)。n-3 PUFAsによって誘導される別の重要な免疫調節機構は、強力かつ広範な抗炎症効果を媒介するGタンパク質共役型受容体120(GPR120)の活性化を含む。Ohらからの研究は、n-3 PUFAは、TLR4媒介の炎症反応を阻害する単球RAW 264.7細胞と一次腹腔内マクロファージの両方でGPR120を刺激することを示している。GPR120のノックダウンは、n-3 PUFAの消費に起因する保護効果を減衰させる(Oh et al 2010)。これらの研究は、n-3 PUFAが異なるメカニズムの経路を介して抗炎症効果を媒介することを一緒に証拠を提供する。
心臓マクロファージは、主に派生し、また、役割を持って常駐マクロファージとの感染に応答して炎症性単球から補充されている。簡単に言えば、マクロファージは、細胞およびマトリックスデブリを洗浄するために古典的なM1炎症性細胞に分化する(Epelman et al 2014)。その後、M1マクロファージは、分極化を受けて、IL-10を分泌して解決を促進し、創傷治癒および組織修復に貢献する交互に活性化されたまたは修復性のM2ステージへと変質することがある(Murray, 2017)。COVID-19の文脈での心筋へのマクロファージの移動および分極を制御することは、心臓損傷を制限するための暫定的なアプローチである(Frantz & Nahrendorf, 2014; Fujiu, Wang, & Nagai, 2014; Leblond et al 2015; van Amerongen, Harmsen, van Rooijen, Petersen, & van Luyn, 2007)。COVID-19では、過剰な心臓のリクルートおよびプロ炎症性M1マクロファージの蓄積は、潜在的に心血管損傷を悪化させる。注目すべきことに、M1マクロファージは、TNF-αおよびIL-1βのような多種多様なケモカインおよびサイトカインを分泌するので、自然免疫系および適応免疫系の両方から他の免疫細胞をリクルートして活性化する。この効果は、M2マクロファージによって媒介される修復相を阻害し、したがって、有害な心臓リモデリングを悪化させる(Dewald et al 2005;Gordon、Pluddemann、&Martinez Estrada 2014;Murray&Wynn 2011;ter Horst et al 2015)。
興味深いことに、証拠は、n-3 PUFAおよび/またはそれらの生物学的に活性な代謝物が、M1マクロファージによるIL-1β、TNF-α、およびIL-6の発現、産生および放出を鈍化させる能力を有することを実証している(Allam-NDoul, Guenard, Barbier, & Vohl, 2017; Liu et al 2014; Mildenberger et al 2017)。Schoenigerらは、n-3 PUFAが、炎症プロセスをダウンレギュレートし、微生物、R. equiおよびP. aeruginosaに感染したRAW 264.7マクロファージからのプロ炎症性サイトカインの産生および分泌を減少させる能力を有することを示した(Schoeniger, Adolph, Fuhrmann, & Schumann, 2011)。さらに、プロ炎症性NLRP3炎症酵素経路に対するEPAおよびDHAの阻害効果は、ヒトおよびマウスの一次マクロファージだけでなく、マクロファージ細胞株においても十分に記録されている(Iverson et al 2018;Kumar et al 2016)。Kumarらは、RAW 264.7細胞および腹膜マクロファージにおけるリポ多糖類(LPS)誘発炎症に対するALAの15-リポキシゲナーゼ(LOX)代謝物の効果を調査した。その結果、これらの代謝物の抗炎症効果は、PPAR-γ経路を介したNLRP3 inflammasome複合体の不活性化に関与していることが明らかになった(Kumar et al 2016)。N-3 PUFAsは、マクロファージの貪食能力を増加させることができ、これは、ジモサン粒子(Chang, Lee, Kim, & Surh, 2015)緑膿菌、Rhodococcus equi(Adolph, Fuhrmann, & Schumann, 2012)大腸菌(Davidson, Kerr, Guy, & Rotondo, 1998)およびアポトーシス細胞(Chang et al 2015)の巻き込みを通して示されている。n-3 PUFA処理時のマクロファージの貪食能の増加は、n-3 PUFAの取り込みによって引き起こされる細胞膜組成および構造の変化に起因し得ることが示唆されている(Hellwing, Tigistu-Sahle, Fuhrmann, Kakela, & Schumann, 2018; Schoeniger, Fuhrmann, & Schumann, 2016)。重要なことに、n-3 PUFAsは、マクロファージ細胞株およびマウス一次マクロファージにおけるM2分極を促進し、感染後の炎症および組織修復の解決を高めることが見出されている(Chang et al 2015; Ohue-Kitano et al 2018)。まとめると、免疫系に対するn-3 PUFAsの調節特性は、COVID-19との関連で心血管系に有望な有益な効果を与える可能性があり、その効果は、より大規模な臨床試験でのさらなる調査と確認が必要である。
8.1.2. n-3 PUFAs の抗炎症性 COX および LOX 由来の代謝物への移行
蓄積された文献は、n-3 PUFAsから生成された代謝物の強力な免疫調節特性、およびその結果として心血管系の健康への影響を実証している(Jamieson, Endo, Darwesh, Samokhvalov, & Seubert, 2017; Schunck, Konkel, Fischer, & Weylandt, 2018)。n-3およびn-6 PUFAの代謝は、親化合物が同じ代謝酵素を競合するが、プロまたは抗炎症性代謝物のいずれかの広い配列の産生をもたらすので、密接に相互に関連している。たとえば、シクロオキシゲナーゼ(COX)は、n-6 PUFA アラキドン酸(AA)を 2 連のプロスタグランジン(PG)と 2 連のトロンボキサン(TX)に変換し、リポキシゲナーゼ(LOX)酵素は AA を 4 連のロイコトリエン(LT)とヒドロキシコサテトラエン酸に代謝する。これらの脂質メディエーターは、プロ炎症性と考えられ、心血管障害を含む様々な病理学的プロセスに関与している(Innes & Calder, 2018; Kalinski, 2012; Lewis, Austen, & Soberman, 1990)。PGE2の合成および生産は、樹状細胞、マクロファージ、線維芽細胞および内皮細胞を含むいくつかの細胞で起こる。PGE2は、血管拡張、内皮透過性および痛みの増加を媒介するだけでなく(Ricciotti & FitzGerald, 2011)好中球、肥満細胞およびマクロファージの組織流入に寄与し、これらの細胞の分化に影響を与えることができる(Kalinski, 2012)。
N-3 PUFAsはまた、AAに由来する代謝物ファミリーと比較して、より少ない炎症性または抗炎症性代謝物のセットである3系列のPGおよびTxAsだけでなく、5系列のLTの生産をもたらすCOXおよび5-LOX酵素の基質として作用することができる(Corey, Shih, & Cashman, 1983; Lee et al 1984; Surette, 2008)。これらのエイコサノイドは、炎症に関連したいくつかの生理的応答の産生に関与しており、それらの不均衡は、いくつかの疾患において観察されている(Calder, 2006; Falck er al)。 例えば、ヒト炎症性細胞によるPGE2およびLTB4の産生は、魚油を豊富に含む食事で有意に減少した(Caughey, Mantzioris, Gibson, Cleland, & James, 1996; Lee et al 1985; Prescott, 1984; von Schacky, Kiefl, Jendraschak, & Kaminski, 1993)。したがって、COXおよびLOX酵素によるn-3 PUFAの代謝は、AA由来のプロ炎症性代謝物を減少させるだけでなく、より生物学的に活性な抗炎症性メディエーター(Goldman, Pickett, & Goetzl, 1983; Lee et al 1984; Lee, Mencia-Huerta, et al 1984)に向かって代謝プロファイルを変化させる。これは、COVID-19に関連する心臓合併症に対するn-3 PUFAsの中心的な抗炎症性およびその結果として心臓保護メカニズムの1つを表している可能性がある。
8.1.3. n-3 PUFAs 由来の特化したプロ分解メディエーター(SPM)の抗炎症性の特徴
n-3 PUFA の代謝もまた、高度に専門化されたプロ分解メディエーター(SPM)の別のグループを生成する。これには、EPA(E シリーズ、RvE1-2)および DHA(D シリーズ、RvD1-6)の両方から生成されるレゾルビン「分解相相互作用生成物」、ならびに DHA から生成されるプロテキンおよびマルシンが含まれる(Serhan et al 2002; Serhan、Chiang、および Van Dyke 2008)。COX経路とLOX経路の両方が、アスピリンの存在下でも非存在下でも異なるエピマーが生成され、これらの代謝物の合成に関与している(Mas, Croft, Zahra, Barden, & Mori, 2012)。
SPM は、進行中の炎症プロセスを終了させ、洗浄プロセスを促進し、組織の再生と創傷治癒を助け、組織のホメオスタシスを回復させるために不可欠な強力な抗炎症性および炎症解決特性を有している (Serhan et al 2000; Serhan et al 2002; Spite et al 2009; Titos et al 2011)。レゾルビン、プロテイン、およびマレシンの抗炎症効果には、いくつかの機序的経路が寄与している。これには、上皮細胞を横切る好中球および単球の遊走を防止すること、および炎症部位からの多形核(PMN)白血球、アポトーシス細胞および破片のクリアランスを促進することが含まれる(Campbell et al 2007;Serhan et al 2002)。Krishnamoorthyらは、レゾルビンが、CD11bまたはCD18などの好中球上の表面接着受容体の発現を低下させ、ケモカインIL-8の産生を減少させることにより、好中球の組織移動を阻害することを示した(Krishnamoorthy et al 2010)。さらに、PMN上のLTB4受容体に対するRvE1の部分的なアゴニスト/アンタゴニスト活性は、NF-κB活性化を阻害し、プロ炎症性サイトカイン産生を廃止し、PMN白血球浸潤を減少させる(Arita et al 2007; Serhan et al 2002; Serhan et al 2008)。レゾルビンは、好中球からの活性酸素種(ROS)産生を鈍らせ、好中球のアポトーシスおよびマクロファージによるクリアランスを誘導し、ケモカインシグナル伝達の阻害に寄与し得る(Ariel et al 2006;Schwab、Chiang、Arita、およびSerhan 2007;SerhanおよびChiang 2004)。さらに、Morinらは、DHAおよびモノグリセリドを富ませた食事が、高血圧のラットモデルにおけるプロ炎症性メディエーターCRP、IL-6,TNF-α、およびIL-1βのレベルの低下と相関するRvD2およびRvD3のレベルを有意に増加させることを実証した(Morin, Rousseau, Blier, & Fortin, 2015)。さらに、体液性免疫応答の調節におけるSPMの役割についての証拠が増加している。ラモンらによる研究では、DシリーズSPM(RvD1,17R-RvD1,RvD2)の前駆体である17-ヒドロキシドコサヘキサエン酸(17-HDHA)が、ヒトB細胞におけるIL-6分泌を減少させ、B細胞の抗体産生を増加させ、B細胞の抗体分泌細胞への分化を促進し得ることが示された(Ramon, Gao, Serhan, & Phipps, 2012)。これらの新しい知見は、SPMが無毒で支持性のあるアジュバントとして、またCOVID-19の場合のように特に感染時の抗炎症治療分子としての応用の可能性を強調している。
レゾルビン、プロテインおよびマレシンは、マクロファージの機能を調節する極めて重要な役割を果たしている。Sulcinerらは、RvD1,RvD2またはRvE1が、複数の腫瘍においてマクロファージのファゴサイトーシスを介したデブリのクリアランスを促進することにより、デブリ刺激癌の進行を抑制し得ることを実証している。これらのレゾルビンは、腫瘍細胞デブリと共培養したヒトマクロファージによる、TNF-α、IL-6,IL-8,ケモカインリガンド4およびケモカインリガンド5を含むプロ炎症性サイトカイン/ケモカインの放出を抑制した(Sulciner et al 2018)。マレシンは、マクロファージによって合成された硫化物の共役体であり、これは、急性炎症の解決にも参加しており、組織再生を促進するようである(Serhan et al 2009)。マレシン-1生合成は、マクロファージのM1(プロ炎症性)からM2(抗炎症性)表現型への変換を刺激する活性中間体(13S,14S-エポキシ-DHA)を含む(Dalli,Ramonon,Norrris,Collas,&Serhan,2015)。M2マクロファージがレゾルビン、プロテインおよびマレシンを分泌して炎症を減衰させ、恒常性を回復させることは注目に値する(Bouchery & Harris, 2017; Ramon er al 2016)同時に、マクロファージおよび他の細胞の貪食能を増強して、感染および損傷の部位(複数可)から破片を除去し、微生物クリアランスを強化する(Dalli et al 2013; Norris et al 2018; Poorani, Bhatt, Dwarakanath, & Das, 2016)。
炎症の解決におけるレゾルビンの役割は、ALIおよびARDSのいくつかの動物モデルにおいて実証されている(Gao et al 2017;Uddin & Levy 2011;Wang、Yan、Hao、およびJin 2018;Zhang et al 2019)。大腸菌エンドトキシンであるLPSに感染したラットおよびマウスモデルを用いて実施されたこれらの研究は、これらの分子のプロレボリューション効果が、例えば、肺胞マクロファージからのプロ炎症性サイトカインの発現および放出の減少による好中球浸潤の抑制に起因し得ることを示唆した(Uddin & Levy, 2011; Zhang et al 2019)。さらに、プロテインがインフルエンザの複製を減少させ(Morita et al 2013)潜在的に呼吸器ウイルス性疾患の炎症性発現に影響を与える可能性があることが実証されている(Russell & Schwarze 2014)。
重要なことに、プロ炎症性サイトカイン、TNF-αおよびIL-6は、それらの前駆体LAおよびALAからのAA、EPAおよびDHAの生成に不可欠なデサチュラーゼの活性を阻害するであろう(Das 2013)。したがって、COVID-19感染に続くような、IL-6およびTNF-αの高レベルに起因する炎症の相当程度が存在する実施例では、EPAおよびDHAの欠乏、およびそれに続くレゾルビン、プロテインおよびマレシンの生成の減少が起こり得る(Dass,2018)。したがって、PUFAおよび/またはそれらの代謝物、レゾルビン、プロテインおよびマレシンの投与は、COVID-19における炎症を解消し、回復を高め、サイトカインストームを制限するために、IL-6およびTNF-αの不適切な産生を抑制することができる(Das 2019)。ともに、研究は、n-3 PUFAの投与が感染症からの回復を高める可能性があり、さらに、適切な量で存在する場合には、感染症への応答を調節する可能性があることを示唆している。
8.1.4. 炎症の改善におけるCYP介在性代謝物の役割
循環器系に見られる構成的に発現するチトクロームP450(CYP)エポキシゲナーゼであるCYP2JおよびCYP2Cアイソフォームは、EPAを5つのレジオ異性体であるエポキセイコサテトラエン酸に代謝する(5. 6-、8,9-、11,12-、14,15-、17,18-EEQ)とDHAを6つのレジオキシドコサペンタエン酸(4,5-、7,8-、10,11-、13,14-、16,17-、19,20-EDP)に変換した(Arnold er al)。 , 2010; Konkel & Schunck, 2011; Westphal, Konkel, & Schunck, 2015)。) 最近の証拠は、17,18-EEQおよび19,20-EDPが、組織損傷の様々なモデルにおけるn-3 PUFAsのいくつかの抗炎症効果を媒介することを示唆している(Arnold et al 2010; Ulu et al 2014; Wang, Chai, Lu, & Lee, 2011)。例えば、Fangらは、19,20-EDPおよび17,18-EEQのレベルを増加させ、プロ炎症性PGE2を減少させることにより、代謝物プロファイルをより抗炎症状態にシフトさせる結果となる保護エイコサノイドパターンを産生することにより、n-3 PUFAが豊富な食事がマウスのMI傷害を減衰させることを実証した(Fang et al 2018)。n-3 PUFAの心保護効果はまた、NLRP3 inflammasome complex cascadeを減衰させる能力に起因している(Darwesh, Jamieson, Wang, Samokhvalov, & Seubert, 2019)。重要なことに、CYP由来のエポキシ代謝物の抗炎症性特徴は、多数のモデルにおいて報告されている。例えば、TNF-α誘導網膜血管炎症において、Capozziらは、19,20-EDPが血管接着分子および細胞内接着分子発現を改善し、ヒト網膜微小血管内皮細胞単分子膜への白血球付着を減少させることができることを実証した(Capozzi, Hammer, McCollum, & Penn, 2016)。さらに、17,18-EEQおよび19,20-EDPの腹腔内注入が、対応するマウスモデルにおいて、アレルギー性腸炎および腎臓線維化に対して保護することを示す証拠が示されている(Kunisawa et al 2015; Sharma et al 2016)。17,18-EEQは、NF-κBの阻害および転写因子PPAR-γの活性化を介して、肺癌の手術を受けた患者から得られたヒト肺組織において、TNF-α誘導性炎症を抑制することができた(Morin, Sirois, Echave, Albadine, & Rousseau, 2010)。DHAエポキシドの抗炎症特性は、炎症性疼痛の動物モデルを用いても十分に実証された。例えば、Morisseauらは、プロ炎症性カラギーナンと一緒にDHAエポキシドであるEDPsを雄のSprague-Dawleyラットの前足または脊髄に直接注入すると、有意な抗鎮痛活性が得られることを実証した。驚くべきことに、親の遊離脂肪酸DHAとそれに対応するジオールの両方が不活性であり、エポキシ脂質が親化合物の有益な効果の多くを媒介しているという仮説を支持するものであった(Morisseau et al 2010)。細菌性エンドトキシンであるLPSは、いくつかの心血管系の合併症を引き起こす可能性のある炎症性傷害を誘発するという顕著な役割を持っている。HL-1心臓細胞を使用した研究では、19,20-EDPは、ヒストン脱アセチル化酵素Sirtuin-1の活性化を阻害することにより、LPS刺激性炎症性傷害から保護され、プロ炎症性転写因子NF-κB(Samokhvalov, Jamieson, Vriend, Quan, & Seubert, 2015)を活性化した。蓄積された証拠は、n-3 PUFAのCYP-エポキシゲナーゼ代謝物の抗炎症特性が、心血管損傷のモデルにおける保護応答を活性化する上で実質的な役割を有することを示唆している。しかしながら、保護特性がCOVID-19感染による二次的な心血管系傷害を制限するかどうかを明らかにするためには、さらなる調査が必要である。
8.1.5. N-3 PUFAs は細胞膜の構造と機能を変化させる ・脂質ラフトの調節
細胞内では、n-3 PUFAsは、レベルの上昇が既存のn-6 PUFAsを置き換えるリン脂質膜に組み込まれ、それによって脂質ラフトの組成および特性を変化させることが見出され得る(Lordan et al 2017; Lordan et al 2020)。膜二重膜へのn-3 PUFAsの取り込みの増加は、膜の組成、流動性および機能を変化させることにより、免疫調節効果を媒介する役割を持ち得る。これらの変化は、自然免疫応答および適応免疫応答の両方において、膜媒介シグナル伝達、タンパク質トラフィッキング、生理活性脂質の生成、サイトカイン分泌および遺伝子活性化に影響を与える。例えば、流動性の変化は、TLR4サブユニットの二量体化および発現を妨害し、下流の炎症反応をブロックすることができる(Ciesielska & Kwiatkowska, 2015; Takashima et al 2016)。n-3 PUFAによるこれらの効果の証拠は、樹状細胞の成熟、マクロファージ機能およびTおよびB細胞の分極/活性化に影響を与えることが実証されている(片桐、清川、&藤本 2001; Kim et al 2010; McMurray、Bonilla、&Chapkin 2011; Rockett、Salameh、Carraway、Morrison、&Shaikh 2010; ShaikhおよびEdidin 2006,ShaikhおよびEdidin 2008)。興味深いことに、DHAは、リン脂質膜の流動性を高める大動脈内皮細胞の血漿膜におけるn-6 PUFAsおよびコレステロールの置換においてEPAよりも優れているようである(Hashimoto, Hossain, Yamasaki, Yazawa, & Masumura, 1999)。
ほとんどの細胞タイプにおいて、AAは、膜リン脂質中の優勢なn-6 PUFAである(Yaqoob, Pala, Cortina-Borja, Newsholme, & Calder, 2000)。単球、好中球、マクロファージ、リンパ球などの炎症性免疫細胞は、しばしばその膜中に多量のAAを含む。正常な炎症反応の間は、膜中の多量のAA組成が重要である。ストレス条件下では、ホスホリパーゼA2の活性化は、多くのプロ炎症性代謝物の代謝および生産につながる細胞膜からAAを解放する(Ford, Hazen, Saffitz, & Gross, 1991; Hazen, Ford, & Gross, 1991; Leslie, 2015; Mancuso et al 2003)。n-3 PUFAsとのサプリメントは、あまり炎症性または抗炎症性代謝物優勢に代謝プロファイルをシフトすることにより、ストレス刺激に応答して免疫細胞反応を変化させることができる細胞膜のEPAとDHAとAAの置換につながる(Brouard&Pascaud、1990;Faber et al 2011;Gibney&Hunter、1993;Grando et al 2009)。したがって、リン脂質中のEPAおよびDHAなどのn-3 PUFAsを増加させることは、制御されていない炎症性応答の間の有害な影響を緩和するという潜在的な利益を有する(Lordan et al 2020)。
8.2. N-3 PUFAsは、COVID-19の病態におけるミトコンドリア機能不全を改善する可能性を有する
正常な生理学的条件の下では、すべての身体器官および生理学的システム、特に心血管系にとって、エネルギーを供給し、異なる細胞機能を維持および調節するだけでなく、機能的なミトコンドリアを多数維持することが不可欠である(Murphy, et al 2016)。ミトコンドリアの健全なプールを維持することは、増加したエネルギー需要を満たすために、”ミトコンドリアバイオジェネシス “と呼ばれる新たに生成されたミトコンドリアの形成と、ミトファジーを介して不可逆的に損傷したミトコンドリアの効率的な除去との間の微妙なバランスに依存している(Bayeva、Gheorghiade、&Ardehali 2013; Meyers、Basha、&Koenig 2013)。ミトコンドリアの損傷、生合成の低下およびマイトファジーの障害は、糖尿病、心血管疾患、老化、およびウイルスおよび細菌感染を含むいくつかの病態に暗示されている(Cho, Kim, & Jo, 2020; Kim, Ahn, Syed, & Siddiqui, 2018; Rovira-Llopis et al 2017; Srivastava, 2017; Wu, Zhang, & Ren, 2019)。COVID-19による二次的な心血管障害の病因に関与する内在的なメカニズム(s)は完全には理解されていないが、ミトコンドリアのホメオスタシスの変化が主要な寄与因子であり得る(Grivennikova, Kareyeva, & Vinogradov, 2010; Melser, Lavie, & Benard, 2015; Murphy, et al 2016; Saleh, Peyssonnaux, Singh, & Edeas, 2020)。注目すべきことに、COVID-19患者において観察される睡眠および食欲障害、エネルギーの喪失、疲労および筋力低下などの症状は、ミトコンドリアの苦痛の枢要徴候である(Filler et al 2014)。
最近の研究では、ミトコンドリアと自然免疫炎症反応との間の相互作用または相互作用のレベルが同定された。ミトコンドリア機能不全は、制御されていない炎症性応答のトリガーおよびターゲットの両方と考えられている(Gurung, Lukens, & Kanneganti, 2015; Mohanty, Tiwari-Pandey, & Pandey, 2019; Yu et al 2014)。そのようなものとして、これは、COVID-19による二次的な心血管系傷害の悪化におけるミトコンドリア恒常性の障害の潜在的な役割を暗示している(Darwesh、Jamieson、他 2019; Darwesh、Keshavarz-Bahaghighat、Jamieson、及びSeubert 2019; Keshavarz-Bahaghighat、Darwesh、Sosnowski、及びSeubert 2020; Samokhvalov et al 2018)。炎症性メディエーターは、ミトコンドリアの代謝および機能を変化させるいくつかの細胞内カスケードを誘発することがよく知られている。例えば、COVID-19患者からの血清中に見られるプロ炎症性サイトカインTNF-α、IL-1βおよびIL-6は、ミトコンドリアの酸化的リン酸化を阻害し、ATP産生およびミトコンドリアROS産生を阻害し、傷害を悪化させる(Jo, Kim, Shin, & Sasakawa, 2016; Naik & Dixit, 2011)。さらに、IFN-γおよびIL-6は、ミトコンドリアの活性酸素産生を増加させ、電子輸送鎖の活性に直接影響を与え、これは、ミトコンドリア膜の透過性、改変されたミトコンドリアダイナミクスおよび細胞死を引き起こす可能性がある(Li et al 2013)。
逆に、直接的なミトコンドリア損傷は、炎症性サイトカインの産生を悪化させ、疾患の予後を悪化させることが判明した。簡単に言えば、SARS-CoV-2に感染した患者で観察される肺炎、低酸素症、カルシウム恒常性障害などの病理学的変化は、間接的にミトコンドリア機能障害を誘発する可能性がある。さらに、Singhらによって実施された非常に最近の研究では、興味深いことに、SARS-CoV-2のRNAおよびRNA転写物の両方が、宿主細胞のミトコンドリア機能をウイルスに有利なようにハイジャックするミトコンドリアを直接標的とし、ミトコンドリアに局在化できることが示された(Singh, Chaubey, Chen, & Suravajhala, 2020)。その後、SARS-CoV-2は、除去を回避し、ウイルスの複製および進行を容易にするために、宿主細胞のミトコンドリア機能を操作する。これらの効果は、ミトコンドリアDNAおよび活性酸素の細胞質内での放出につながる(Herst, Rowe, Carson, & Berridge, 2017; Kozlov, Lancaster Jr., Meszaros, & Weidinger, 2017; Mittal, Siddiqui, Tran, Reddy, & Malik, 2014; Starkov, 2008; Twig & Shirihai, 2011; West er al 2015)は、COVID-19重症度のホールマークサイトカインであるNLRP3 inflammasomes、IL-1βおよびIL-6(Jo et al 2016; Naik & Dixit 2011; Nakahira et al 2011; West et al 2015)などの中枢性プロ炎症性サイトカインの活性化および放出を駆動する。したがって、心血管損傷を悪化させる上で重要な役割を持つミトコンドリア損傷と炎症の悪循環を強調している。したがって、ミトコンドリアはCOVID-19の治療成績を改善するための戦略的な治療標的と考えられている。
数多くの研究は、n-3 PUFA、およびそれらのエポキシ脂質代謝物の心保護特性は、健康なミトコンドリアプールを維持し、ストレス条件下で誇張された炎症反応を減衰させる能力を伴うことを実証している。例えば、n-3 PUFAsは、効率的なATP生成を促進するミトコンドリア機能を高めるミトコンドリア膜リン脂質組成物を、濃縮を介して心臓保護効果を付与することができる(ダダ、オシェア、&スタンレー 2009; Samokhvalov、Jamieson、Fedotov、遠藤、&Seubert 2016)。虚血再灌流傷害のマウスモデルにおいて、DHAおよびそのエポキシ代謝物である19,20-EDPの両方は、ミトコンドリア機能を温存し、NLRP3 inflammasome応答を減衰させることにより、虚血後の機能回復を改善することができた(Darwesh, Jamieson, et al 2019)。さらに、最近のデータは、合成EDPアナログが、ミトコンドリアの恒常性維持と抗酸化防御の保存を介して虚血再灌流傷害に対する心保護効果を与えることを示しており、これは有害な生得的NLRP3インフルマゾーム応答を鈍化させた(Darwesh et al 2020)。以前のデータでは、19,20-EDPは、ミトコンドリアの生合成と完全性を維持することにより、細菌性エンドトキシンであるLPSの細胞傷害からHL-1心臓細胞を保護したことが実証されている(Samokhvalov et al 2015)。これらのデータは、n-3 PUFAsおよびその代謝物が、ミトコンドリアの質を維持し、有害な免疫応答を改善することを介して、心血管系傷害のモデルにおいて有益な保護応答を提供することを示唆している。しかしながら、COVID-19の文脈で提案された仮説を調査するためにさらなる研究が必要である。
8.3. ウイルス負荷に対するn-3 PUFAsの直接的および間接的な効果
EPAおよびDHAは、慢性炎症性疾患を改善するために広く使用されてきたが、ウイルス感染症に対するそれらの効果は依然として限定的である(Das, 2018; Husson et al 2016; Ingram, Eaton, Erdos, Tedder, & Vreeland, 1982; Juers, Rogers, McCurdy, & Cook, 1976; Territo & Golde, 1979)。いくつかの証拠は、EPA、DHAおよび他の食餌性不飽和脂肪酸が、ウイルスエンベロープの漏出または溶解を直接引き起こすことによってウイルスを不活性化し得ることを示しており、これは、膜の完全性を破壊するか、またはこれらの病原体に対する抗体を産生するために体液性免疫系を活性化する(Dass,2018,Dass,2020a;Hilmarson,Larusson,&Thormar,2006;Konn,Gitelman,&Inbar,1980)。Moritaらは、n-3 PUFA由来の脂質メディエーターであるプロテインD1が抗ウイルス活性を示し、インフルエンザAウイルスの複製を著しく減衰させ、雄性C57Bl/6Jマウスの重症インフルエンザ感染における生存率を改善することを実証した。この研究は、内因性プロテインD1がインフルエンザウイルス複製の自然抑制因子として致死的感染を減衰させることの重要性を強調した(Morita er al)。 別の研究では、Ramonらは、DHA由来のSPMである17-HDHAのH1N1インフルエンザウイルスに対する免疫応答を改善する能力を評価した。その結果、17-HDHAは、抗体分泌細胞の数およびH1N1抗体のレベルを増加させることにより、ウイルスに対する体液性免疫を増強することができ、その結果、マウスの生のH1N1インフルエンザ感染に対するより大きな保護をもたらした(Ramon et al 2014)。より最近、Braz-De-Meloは、ジカウイルスに感染した神経芽腫SH-SY5Y細胞へのDHA前処理が、それらの生存性および増殖を増加させ、ミトコンドリア機能を回復させ、ウイルス負荷を減少させ、ウイルスとの戦いにおいて有用な治療ツールとしてn-3 PUFAsを同定し、抗炎症反応を誘発したことを示すことによって、ウイルス感染に対するn-3 PUFAsの有益な効果を強調した(Braz-De-Melo et al 2019)。さらに、Yanらは、EPAとDHAは、エンテロウイルスA71とコキサッキーウイルスA16の両方の手、足、口病の最も一般的な原因の複製を阻害することができることを示している(Yan et al 2019)。まとめると、n-3 PUFAは、膜の完全性に対する直接的な効果と、全体的なウイルス負荷を減少させるために体液性応答を活性化する間接的なメカニズムの両方を介してウイルス感染を減衰させる能力を有すると結論づけることができる。
対照的に、EPAとDHAのサプリメントの免疫抑制効果は、ウイルス感染症に対する免疫応答を減少させ、このように体内からの除去を損なうことができる。魚油を補給してH1N1インフルエンザウイルスに感染したC57BL/6Jマウスは、対応するコントロールと比較して、死亡率が40%高く、ウイルス負荷が70%高かった。さらに、処理したマウスは、CD8+Tリンパ球の数が著しく減少し、炎症性メディエーターIL-6およびTNF-αのmRNA発現が減少した(Schwerbrock, Karlsson, Shi, Sheridan, & Beck, 2009)。同様に、EPAとDHAを豊富に含む高脂肪食を摂取したBALB/cマウスでは、インフルエンザウイルス感染後、IFN-γ、血清免疫グロブリンG、肺免疫グロブリンA特異的抗体のレベルが低下しており、ウイルス特異的な肺T細胞の細胞毒性を示していた。これらの結果から、EPAとDHAを豊富に含む食事を補給すると、ウイルスクリアランスを遅らせることで免疫応答が損なわれる可能性が示唆された。しかし、n-3 PUFAを給与したマウスは最終的にウイルスをクリアすることができ、対照群と同様に感染前の食物消費量と体重に戻ったので、感染の過程で気付いた違いは最終的な結果に影響を与えなかった(Byleveld, Pang, Clancy, & Roberts, 1999; Byleveld, Pang, Clancy, & Roberts, 2000)。重要なことに、他の要因がこれらの反対の結果に寄与しており、例えば、マウスに魚油を補給すると、初期の体重減少が典型的に観察される(Byleveld et al 1999)。さらに、SARS-CoV-2ウイルスを用いた徹底的な対照動物試験は実施されておらず、ウイルス間の有意なばらつきを考慮する必要がある。したがって、SARS-CoV-2ウイルス感染症に特異的に関連する免疫応答におけるEPAおよびDHAの役割を理解するために、さらなる研究が必要である。
8.4. COVID-19の設定におけるレニン-アンジオテンシン・アルドステロン系の調節にお
けるn-3 PUFAsの役割
レニン-アンジオテンシン・アルドステロン系(RAAS)は、自然帰化、血液量、血圧を調節する血管機能の重要な調節因子である。簡単に言うと、アンジオテンシンI(Ang I)はアンジオテンシン変換酵素(ACE)によって代謝され、血管収縮剤アンジオテンシンII(Ang II)を形成する。心臓および血管におけるアンギオテンシン1受容体へのアンギオテンシンIIの蓄積、長時間および過剰な結合は、血管収縮、高血圧、心肥大、活性酸素産生の増加および有害な線維化を含むいくつかの効果を媒介する(Fyhrquist, Metsarinne, & Tikkanen, 1995; Perazella & Setaro, 2003)。文献の蓄積は、Ang IIが心臓リモデリングに重要な役割を果たす可能性のある炎症性サイトカインとして作用することを示している(Gibbons, Pratt, & Dzau, 1992; Griendling, Minieri, Ollerenshaw, & Alexander, 1994)。逆に、肺、腎臓、心臓および血管内皮層を含むほとんどの組織で発現する1型の積分膜糖タンパク質であるマスターレギュレーターACE2は、Ang IIを代謝して血管拡張剤アンジオテンシン(Ang 1-7)を産生し、Ang IIの作用から心血管系を保護することができる(Das, 2018; Kumar & Das, 1997; Yan et al 2020)。その血管拡張性の他に、Ang-(1-7)は、TNF-α、IL-6,血管接着分子、単球化学吸引性タンパク質-1およびマクロファージ浸潤を減少させることによって炎症の解決を促進し、重度の免疫応答の間の心筋細胞および内皮細胞の生存を高める(Simoes e Silva, Silveira, Ferreira, & Teixeira, 2013; Zhang et al 2015)。したがって、いくつかの臨床研究および実験研究では、Ang IIの増加およびACE2の減少によるRAASの調節障害が、有害な炎症性応答および心血管障害の悪化につながることが報告されている。したがって、ACE2の活性を維持することは、RAASのバランスを維持し、血管収縮、ナトリウム保持および線維化に対する効果を維持する上で不可欠であり、高血圧、HF、MIおよび他の心血管疾患に対する保護効果を引き出す可能性がある(Crackower et al 2002; Patel et al 2016; Wang, Gheblawi, & Oudit, 2020)。
最近の証拠は、SARS-CoV-2が標的細胞に入るためにACE2を内在化受容体として使用することを実証している。SARS-CoV-2のスパイク(S)糖タンパク質は、宿主細胞表面上の標的ACE2受容体を認識して相互作用し、感染サイクル中のウイルス侵入を媒介する(Letko, Marzi, & Munster, 2020; Yan er al)。 スパイクタンパク質のACE2への過剰な結合は、ACE2受容体のダウンレギュレーションを導く(Jung, Choi, You, & Kim, 2020)。この知見は、SARS-CoVに感染した動物モデルにおける報告と一致する(Crackower et al 2002;今井 et al 2005;Kuba et al 2005)。ACE2レベルの低下は、過剰な炎症性反応を引き起こし、肺および心血管系の両方に悪影響を及ぼす(Crackower et al 2002; Imai et al 2005; Kuba et al 2005)。これらの有害な影響は、ACE2の機能が部分的に低下することで、サイトカインストーム、炎症、血管収縮、血栓症の感受性の増強を含む支配的なアンジオテンシンIIの影響をもたらすことで説明できる。これらの作用は、素因のある患者における高血圧、HFおよび他の心血管障害を悪化させることにより、心血管の負担をさらに増大させる(Liu, Blet, Smyth, & Li, 2020; Oudit et al 2009)。重要なことに、Ang IIの蓄積は、ウイルス負荷および肺損傷と正の関連があった(Liu et al 2020)。さらに、ACE2の活性および/または数の減少は、Ang-(1-7)産生の欠乏をもたらし、その結果、その抗炎症性、血管拡張性、および心血管保護効果の損失をもたらす(Lelis, Freitas, Machado, Crespo, & Santos, 2019; Patel et al 2016)。したがって、RAASの阻害は、炎症性ストームを減衰させ、末梢臓器損傷を改善するのに役立つ可能性があるという仮説が立てられている。興味深いことに、最近のデータは、既往症のためにACE阻害剤またはARBで治療されているCOVID-19を有する個体は、ACE阻害剤またはARBで治療されていない個体と比較して、28日間の全死因死亡のリスクが低いことを示している(Wang et al 2020;Zhang et al 2020)。ARBおよびACE阻害剤は、ACE2に直接影響を与えないが、ACE2活性および有益なAng-(1-7)産生を間接的に上昇させ、有害なAng IIの過剰産生に対抗する(Hanff, Harhay, Brown, Cohen, & Mohareb, 2020)。したがって、ACE2およびその下流のエフェクターであるAng-(1-7)のレベルを維持することは、COVID-19による二次的な心血管損傷を制限する可能性があることが提案された(Wang, Edin, et al 2020)。
興味深いことに、いくつかの報告は、n-3 PUFAsがAng IIおよびACE2レベルの両方を調節することによってRAASシステムを調節し得ることを示した。例えば、新興の文献は、n-3 PUFAsおよびその内因性に生成された代謝物が直接ACEの発現および活性を減少させ、それによってアンジオテンシンII形成および心血管系の負担を減少させることができることを示している(Kumar & Das, 1997)。さらに、それは3週間のためのn-3 PUFA豊富な食事とマウスの補充は、ACE2のアップレギュレーションを介して減衰したAng-II誘導血圧をもたらしたことが実証されている(Ulu et al 2013)。あるいは、以前に議論されたように、細胞膜へのn-3 PUFAの組み込みは、重要な特性を変化させ、その結果、ACE2に対するSARS-CoV-2のタンパク質数および親和性に影響を与えることができる(Candelario & Chachchisvilis, 2013; Das, 1999, Das, 2020b; Glende et al 2008)。これらの研究を合わせると、これらの研究は、SARS-CoV-2感染の調節におけるn-3 PUFAの新規な役割を示唆しており、アジュバント療法としての潜在的な利益は、Ang-(1-7)の産生を増加させ、Ang IIのレベルを低下させ、それによってCOVID-19をトリガーとする心血管系合併症を制限することを含む。
重要なことに、ACE2のアップレギュレーションおよび増強された活性を示す証拠は、ACE2がSARS-CoV-2の感染を促進することを示唆している(South, Diz, & Chappell, 2020)。したがって、一部の研究者は、COVID-19患者においてACE阻害剤およびARBを中止すべきであることを提案した(Diaz 2020;Esler & Esler 2020)。しかしながら、心臓ACE2に対する直接的な影響に加えて、サイトカインストームを誘発するような他のメカニズムが、SARS-CoV-2誘発性傷害に著しく寄与するであろう(Chen, Li, Chen, Feng, & Xiong, 2020)。Yangらが行った最近の研究では、ACE阻害剤/ARBを使用した高血圧のCOVID-19患者は、ACE阻害剤/ARBを使用していない高血圧のCOVID-19患者よりも死亡率が低いことが実証された(Yang et al 2020)。さらに、Manciaらは6272人の患者を調査し、RAAS阻害薬の使用とCOVID-19の感受性または発症との間に関連はないことを明らかにした(Mancia, Rea, Ludergnani, Apolone, & Corrao, 2020)。その意味で、米国心臓協会(AHA)米国心臓病学会(ACC)および米国心不全学会(Heart Failure Society of America)の発表した声明は、ACE阻害剤/ARBの継続を強く推奨している(Zhang, Zhu, Cai, er al)。 これらのデータを合わせると、ACEおよびAng IIを標的とする治療法は、SARS-CoV-2感染の可能性を高めるようには見えないが、COVID-19患者の臨床悪化を助長する炎症反応および血管収縮を和らげる役割を有する可能性があることが示唆される。
まとめると、SARS-CoV-2感染はACE2の内在化とダウンレギュレーションを誘導し、それがAng IIの分解を制限することで患者の病状を悪化させる可能性があることが示されている。Ang IIレベルの上昇は、血圧の上昇、炎症性免疫細胞の心臓への過剰な勧誘および浸潤、ならびに炎症性サイトカインの分泌の増加を含む心血管系へのいくつかの有害な影響を誘発する。ACE2レベルの低下は、Ang-(1-7)の形成低下と関連しており、その血管拡張作用、抗炎症作用、心血管疾患保護作用が失われる。したがって、ACE阻害剤、ARBs、n-3 PUFAsなどのRAAS系の不均衡を是正する治療法による介入は、転帰を改善する可能性がある。
8.5. N-3 PUFAs は抗酸化特性を持っている。
RNAウイルス感染による肺炎誘発性低酸素血症は、細胞代謝によるエネルギー産生を低下させ、嫌気性発酵、細胞内アシドーシス、および活性酸素の発生を増加させる(Li et al 2020)。その後の増加した活性酸素産生は、DNA、脂質およびタンパク質を含む様々な細胞構成要素にダメージを与える。増加した活性酸素レベルは、抗酸化防御システムを枯渇させ、その結果、重度の酸化ストレスおよび免疫応答の慢性的な活性化をもたらし、組織の損傷および損傷を悪化させる(Khomich, Kochetkov, Bartosch, & Ivanov, 2018; Reshi, Su, & Hong, 2014)。
いくつかの研究は、n-3 PUFAが、抗酸化酵素(例えば、スーパーオキシドジスムターゼ)をアップレギュレートし、プロオキシダント酵素(例えば、一酸化窒素合成酵素)をダウンレギュレートし、フリーラジカルと直接相互作用する可能性があることに起因する抗酸化特性を有していることを明らかにしている。n-3 PUFAsの抗酸化作用は、肺、腎臓および心血管系を含む様々な器官において実証されている(Darwesh et al 2020;Darwesh、Jamieson et al 2019;Darwesh、Keshavarz-Bahaghighat et al 2019;De Caterina 2011;Mozaffarian & Wu 2011)。Andersonらは、患者が選択的心臓手術を受ける前に2〜3週間の期間、n-3 PUFAs(3.4g/日EPAおよびDHAエチルエステル)の中等度高用量を投与され、その後、手術中に心筋組織が右心房から解剖されたことを報告した。興味深いことに、患者から得られた心筋組織は、グルタチオンペルオキシダーゼ-1,グルタチオンペルオキシダーゼ-4,NADPH-キノンオキシドレダクターゼ-1,チオレドキシンレダクターゼ-2,総グルタチオンなどの主要な抗酸化物質の発現と活性がコントロール患者と比較して増加していることに起因する抗酸化能力の向上を示した。さらに、活性酸素の実質的な発生源であるミトコンドリア外膜結合酵素モノアミンオキシダーゼもまた、n-3 PUFA処理患者から得られた心筋組織において有意に低い活性を有することが決定された(Anderson et al 2014)。興味深いことに、DHA由来のエポキシ脂質で灌流された単離されたマウスの心臓は、抗酸化剤チオレドキシン-1およびチオレドキシン-2のより良い活性と相関する改善された虚血後の回復を持っていた(Darwesh、Jamieson、他 2019)。重要なことに、COVID-19では、特に進行期およびICUでは、重度の炎症、低酸素血症および高酸素濃度の機械的換気は、必然的に肺および心臓内で局所的および全身的に顕著に活性酸素の発生を増加させる。従って、増加した n-3 PUFAs およびそれらの対応する代謝物が誇張された炎症および ROS の生成の有益な制御を提供するであろうという仮説を立てることができる。
8.6. N-3 PUFAsは、凝固症を改善する可能性がある。
COVID-19患者の臨床検査では、一部の患者で重篤な凝固障害が発生していることが示されている。これは、血小板減少、プロトロンビンの延長、Dダイマーの上昇、フィブリン分解産物レベルの上昇およびフィブリノーゲンレベルの低下などのマーカーによって証明されるように、広範な微小血管血栓症および凝固因子の消費によって反映される(Tang et al 2020)。オランダのICU COVID-19患者184人を対象とした研究では、38%が異常な血栓を有し、33%が同定された血栓を有すると報告された(Klok et al 2020)。重要なことに、血栓は肺塞栓、心血管合併症、または脳卒中を引き起こす可能性がある。さらに、長期のベッドレストは、重症SARS-CoV-2感染患者における静脈血栓塞栓症のリスクの増加と関連している(Iba, er al)。 したがって、重症SARS-CoV-2感染患者に対する抗凝固剤(ヘパリンなど)の積極的な適用が推奨されており、より良好な予後と関連しているようである(Tang, Bai, er al)。 Tangらは最近、低分子量ヘパリンを中心とした抗凝固療法が、重症SARS-CoV-2感染患者における予後の改善と関連していることを示す研究を発表した(Tang, Bai, er al)。
n-3 PUFAは、血小板活性化因子およびトロンビン、コラーゲン、およびアデノシン二リン酸を含む他の血栓経路に対して強力な抗血栓効果を示す極性脂質を含む(Lordan et al 2020;Tsoupras et al 2019;Tsoupras、O’Keeffe、Lordan、Redfern、およびZabetakis 2019)。n-3 PUFAsの増加したレベルは、血小板リン脂質膜組成物を変化させ、心血管疾患の進行および血栓性合併症を変化させると予測される血小板機能に影響を与える可能性がある。Adiliらは、EPAとDHAが血小板膜に作用して、COX-1と12-LOXを介して血小板の凝集とTXの放出を減少させることを概説し、これは、止血と血栓症における血小板機能の調節に大きく貢献する血小板の有益なオキシリピンのグループに脂肪酸を代謝する(Adili, Hawley, & Holinstat, 2018)。これは、健康な被験者に4週間EPAを補給すると、血小板凝集の初期段階である血小板活性化が低下したことを実証したParkとHarrisによって支持されている(Park & Harris, 2002)。証拠は限られているが、EPAはCOX基質であるため、血小板機能を変化させる点でDHAよりも活性が高いようである。しかし、DHAはTxA2およびPGH2受容体の親和性を低下させるようである(Park & Harris, 2002)。EPAおよびDHAの食事補給は、健康な被験者において血小板の活性化および凝集を減少させることが示されているが、心血管疾患のような血小板の多動原血栓症状態においては、より高い推奨用量のn-3 PUFAが必要とされるかもしれない(Adili er al)。 n-3 PUFAsのこれらの抗凝固特性は、SARS-CoV-2感染者の重症症例における血小板凝集に対する潜在的な効果を示唆している。我々の現在の知識レベルでは、n-3 PUFAsが重症COVID-19に関連する凝固障害を緩和するかどうかについての推測を許可するにすぎない。
8.7. COVID-19の文脈におけるn-3 PUFAsの脂質低下特性
糖尿病、脂質異常症、血漿コレステロールおよびトリグリセリドの異常、および冠動脈性心疾患などの併存疾患を有する患者は、心臓合併症、敗血症、ARDSおよび死亡などの重篤なCOVID-19の転帰を受けやすい(Chen et al 2020;Petersen et al 2020;Shi et al 2020;Wang、Hu et al 2020;Zhou、Yu et al 2020)。COVID-19に関連する急性炎症性症候群は、プラークを不安定化させる能力を有し、これは虚血性イベントを引き起こし得る(Madjid et al 2007)。最近の研究では、COVID-19の結果として死亡した個体において、血清トリグリセリド濃度が有意に高いことが示されたが、これは、リポタンパク質リパーゼ活性の低下を引き起こす炎症性TNF-αレベルの増強に起因する可能性が高い(Chen, Wu, et al 2020; Skevaki, Fragkou, Cheng, Xie, & Renz, 2020)。空腹時トリグリセリドおよび空腹時血漿グルコースレベルの積であるトリグリセリド-グルコース指数は、インスリン抵抗性のためのサロゲートマーカーとして使用される(Ren et al 2020)。より高いトリグリセリド-グルコース指数を有するCOVID-19患者は、より重篤なCOVID-19感染および死亡を経験することが示されている。さらに、高密度リポ蛋白コレステロール(HDL-c)のレベルもCOVID-19患者において減少し、その減少の大きさは疾患の重症度と相関している(Hu, Chen, Wu, He, & Ye, 2020)。一般に、HDL-cは抗炎症性および抗血栓性であると考えられている(Suzuki et al 2010; van der Stoep, Korporaal, & Van Eck, 2014)。したがって、より重症のCOVID-19症例で観察された頑健で不適応な炎症性および高凝固性反応は、一部ではあるがHLD-cレベルの低下および脂質プロファイルの異常に起因している可能性がある。COVID-19感染が脂質プロファイルを急性に変化させる可能性があること、脂質異常症と糖尿病、冠動脈疾患、肥満などの疾患との関連性を考えると、COVID-19患者の血漿脂質プロファイルを正常化することが臨床的に有用であるかどうかは疑問である。
スタチンおよび他の脂質調節療法の使用は、糖尿病、メタボリックシンドローム、および冠動脈疾患を有する患者を含むリスクの高い患者(重度のCOVID-19転帰の危険因子である条件)における一次性または二次性の心血管イベントのリスクを減少させることができる(Stone et al 2013)。13,000人以上のCOVID-19患者を対象とした大規模なレトロスペクティブ研究では、抗炎症作用を有する強力な脂質低下剤であるスタチン療法の院内使用が、非スタチン使用者と比較して死亡率の低下と関連していることが示されている(Zhang, Qin, Cheng, er al)。 この重要な研究は、スタチンがACE2発現を介してCOVID-19ウイルスの病理を増強する可能性があるという以前のドグマを崩し、実際にはCOVID-19の治療において圧倒的に有益である可能性がある。しかしながら、スタチン単剤療法にもかかわらず、脂質異常症の患者の多くは依然としてトリグリセリドレベルの持続的な上昇に苦しんでおり、これは、冠動脈疾患、心臓イベント、およびより重篤なCOVID-19感染の転帰の危険因子であり続ける可能性がある(Ballantyne et al 2012;Davidson et al 2007)。n-3 PUFA補給のトリグリセリド低下効果は、多数の臨床試験で実証されている(Abdelhamid et al 2020;Ballantyne et al 2012;Chan et al 2003;Maki et al 2013;Yanai et al 2018;Zhou et al 2019)。トリグリセリドの低レベルは、利用可能な二次性血球貪食細胞性リンパ組織球症スコアシステムからのスコアに基づいて、サイトカインストームを発症するより低いリスクを提示する(Mehta, er al)。 さらに、n-3 PUFAsは、高トリグリセリド血症患者においてCRPを有意に低下させることが示されている(Ballantyne et al 2012)。したがって、COVID-19患者におけるn-3 PUFAsの使用のための根拠は、感染誘発性呼吸器障害の減衰だけでなく、患者のウェルビーイングの全体的な改善および併存疾患による潜在的な合併症の予防にも焦点を当てている。
9. COVID-19の文脈でn-3 PUFAsをいつ、どのように介入するか
重症または重症患者の補助療法としてn-3 PUFAsを考慮する上で重要な側面は、介入の時間、治療の持続時間、投与量、調製物の組成物および投与経路である。患者が必要とする支持療法のタイプと強度は、疾患の重症度と入院のための可能な必要性に依存している。既存の文献は、それが膜AAの段階的な置換に起因する生物学的効果を発揮するためにn-3 PUFAsの標準的な用量のために数週間または数ヶ月かかる可能性があることを示している。それは、n-3 PUFAsと急性サプリメントは、特にALI(マーティン&Stapleton 2010)とのそれらの重症患者の炎症反応に影響を与えるかもしれないという仮説が立てられている。例えば、無作為化臨床試験では、EPA、DHAとγ-リノレン酸のレベルが上昇したと致命的に病気のALI患者の毎日の経腸栄養が有意に肺の炎症を減少させ、4日間で酸素化を改善したことを示した。これは、機械換気の持続時間、ICUの滞在期間、死亡率の減少と関連していた(Gadek et al 1999年;Singer et al 2006)。機械換気を必要とする敗血症患者を研究したPontes-Arrudaらの試験では、EPA、γ-リノレン酸および抗酸化物質を豊富に含む食事を最低4日間一定の割合で摂取することで、ICUおよび病院の転帰、酸素状態、無呼吸日数の改善に寄与し、28日間隔での死亡率の低下と関連していた(Pontes-Arruda et al 2006)。
重症患者における非経口魚油エマルジョンの有益な効果を示唆する多くの研究がある。例えば、魚油を含む脂質エマルジョンを重症患者に非経口的に補給することは、炎症の減少、ガス交換の改善、およびICUおよび入院期間の短縮と関連していた(Zhao & Wang 2018)。Mayerらの研究では、敗血症の患者は、オメガ3 FAリッチ脂質エマルジョンまたは標準的なオメガ6リッチ脂質エマルジョンを5日間受けるようにオープンラベル試験で無作為に割り付けられた。魚油注入後2日以内に、遊離n-3脂肪酸が増加し、n-3/n-6比がAAよりもEPAとDHAを好んで逆になり、n-3脂肪酸が単核白血球膜に速やかに取り込まれ、3日で最大の効果に達した(Mayer et al 2003)。さらに、7日間、n-3 PUFAで濃縮された非経口脂質エマルジョンは、ラットの酢酸誘発性大腸炎を減少させることが判明した(Campos et al 2002)。Wangらが実施した無作為化比較試験では、重度の急性膵炎患者が、アミノ酸、グルコース、脂肪を同量含むが脂質組成が異なる非経口栄養を5日間受けるように無作為に割り付けられた:対照群は大豆油ベースの脂肪溶液を受け、オメガ3群は魚油を受けた。興味深いことに、魚油またはn-3 PUFAsで治療された患者は、5日間の非経口栄養後に炎症性マーカーCRPが著しく低下し、酸素化指数が改善された(Wang, Li, Li, & Li, 2008)。
一緒に、これらの研究は、重症の設定でn-3 PUFAsの急性経腸または非経口投与が有意に臨床転帰を改善することができることを示した。注目すべきことに、EPAおよびDHAのかなりの量を含む魚油エマルジョンは、重症の成人および小児の両方において優れた安全性記録を有することが示されている(Calder, 2009, Calder, 2019; Nandivada, Fell, Gura, & Puder, 2016)COVID-19患者のような重度のストレス状態での使用に適した候補を作る。しかし、これまでに完了した研究では、COVID-19の設定でn-3 PUFAsと介入するための用量、投与経路、および最良のタイミングを決定的に決定することはできない。より多くの研究は、COVID-19のコンテキストでn-3 PUFAsのルーチン使用についての決定的な推奨事項の前に間違いなく必要とされていることは間違いないが、特にその投与データと危機的な病気の患者で経腸および非経口の両方のn-3 PUFAsの薬物動態学的研究は非常に変数と不完全であることを行うことができる。
10. まとめと結論
要約すると、COVID-19は世界中で急速に広がっており、ウイルスに関する我々の理解は限られている。現在までのところ、この病気を治療したり、その合併症から保護したりするための効果的で承認された治療法やワクチンはない。SARS-CoV-2の主な標的臓器は肺と考えられているが、ウイルスは他の多くの臓器に影響を与え、多臓器の損傷を引き起こす。心血管系の損傷は、COVID-19患者の突出した臨床的特徴として指摘されている。RAASの制御異常は、COVID-19患者において有害な炎症反応を引き起こし、心血管障害を悪化させる可能性がある。したがって、Ang IIに対抗する薬剤による介入は、劇症的な心血管系の転帰を予防するための潜在的な役割を持つ可能性がある。ACE2レベルの上昇はSARS-CoV-2感染性の増加の懸念を高めるかもしれないが、我々はここで、n-3 PUFAがAng II誘発の有害なシグナル伝達を制限し、Ang(1-7)の心保護効果を高めることにより、COVID-19患者の心血管系の転帰に対して有害ではなく有益である可能性があることを提案している。
このレビューでは、我々はCOVID-19に二次的に心血管合併症の異なるメカニズムを強調し、これらの心血管合併症を緩和する上でのn-3 PUFAの潜在的な役割に向けて注目を集めている。現在、COVID-19患者のn-3 PUFAsの有益なまたは劇薬効果の直接的な証拠はない。しかし、それはn-3 PUFAsおよび/またはそれらの生物学的に活性な代謝物の食事または非食事摂取は、心血管合併症の予防と管理につながる多くの有益なアクションを持っている前の議論から明らかである。n-3 PUFAおよび/またはその生物学的に活性な代謝物は、過剰な免疫応答の多くの悪影響を調節し、エンベロープされたウイルスを不活性化し、マクロファージの貪食能を強化し、凝固障害を改善し、細胞シグナリングおよび遺伝子発現を変更し、ストレス条件下で生成される脂質代謝物のパターンをより抗炎症性の代謝物プロファイルにシフトし、心臓の抗酸化能力を強化する可能性がある。n-3 PUFA のこれらの有望な効果にもかかわらず、SARS-CoV-2 感染症の設定でこれらの提案された効果をテストし、翻訳するために、より多くの実験的、無作為化対照試験および疫学的研究が保証されている。
