Brain-Gut-Microbiota Axis in Alzheimer’s Disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC6326209/
要旨
脳-腸-マイクロバイオータ軸に沿った障害は、神経変性疾患の発症に大きく寄与している可能性がある。アルツハイマー病は、アミロイドβ(アミロイドβ)プラークと神経原線維のもつれの形成に関連した認知機能の漸進的な低下を特徴とする認知症の最も頻繁な原因である。
腸内細菌叢の変化は、腸管バリアの透過性を高め、免疫活性化を誘導して全身の炎症を引き起こし、その結果、血液脳関門が障害され、神経炎症、神経損傷、最終的には神経変性を促進する。近年、アミロイドβは自然免疫応答に関与する抗菌ペプチドとしても認識されている。しかし、アミロイドβは制御異常状態では有害な性質を示す可能性がある。
重要なことは、分子模倣を介した細菌性アミロイドは、ミスフォールディングのクロスシーディングを誘発し、ミクログリアのプライミングを誘導する可能性があることである。アミロイドβの播種と伝播は、脳-腸-マイクロバイオータ軸の異なるレベルで起こる可能性がある。
アミロイド拡散の潜在的なメカニズムには、神経細胞間または遠位神経細胞間の拡散、血液脳関門の直接交差、またはアストロサイト、線維芽細胞、ミクログリア、および免疫系細胞などの他の細胞を介した拡散が含まれる。実験データおよび臨床データの増加に伴い、神経変性における腸内細菌叢と腸内細菌叢と宿主の相互作用が重要な役割を果たしていることが確認されている。
腸由来の炎症反応の収束は、高齢者の加齢や貧弱な食生活と相まって、アルツハイマー病の発症に寄与している。食物療法やプロバイオティクスサプリメントによる腸内細菌叢構成の改変は、アルツハイマー病の新たな予防・治療法を生み出す可能性があると考えられる。
キーワード
アルツハイマー病、アミロイド、血液脳関門、消化管マイクロバイオーム、炎症
序論
脳-腸軸は、中枢神経系(中枢神経系)と消化管の間の双方向の一定のコミュニケーションを反映している。また、腸内細菌叢が脳と腸の相互作用に影響を与えていることを示す証拠も増えてきている1。このコミュニケーションのメカニズムには、神経系、免疫系、内分泌系、代謝系のシグナル伝達が含まれている2 。消化管機能を制御する神経ネットワークである腸神経系(ENS)は、独立して機能するか、交感神経(前脊椎神経節)と副交感神経(迷走神経)のシグナル伝達を介して中枢神経系の影響を受ける能力を持っている。無菌マウスを用いた動物実験の結果は、初期の脳の発達と成人の神経新生において腸内細菌叢が重要な役割を果たしていることを示唆している1,2。
高齢者では、免疫系の過剰刺激により、慢性的な低悪性度の炎症状態(「炎症」)が生じる。これは、腸管バリアの破壊、循環中の炎症性サイトカインや細菌由来の生成物のさらなる増加、血液脳関門の障害、神経炎症につながる4。潔癖症のないマウスを用いた研究の結果から、ミクログリアの成熟にマイクロバイオータが影響を与えていることが確認されている。これは、細菌の代謝産物である短鎖脂肪酸(SCFAs)によって媒介される可能性がある。同様に、微生物のトリプトファン代謝産物は、アリール炭化水素受容体を介してアストロサイトの活性を調節する。微生物は末梢免疫細胞の活性化とサイトカインプロファイルに影響を与え、全身および中枢神経系の炎症や損傷だけでなく、神経発達にも影響を与える。
また、腸内細菌叢は、セロトニン、ドーパミン、SCFAs などの神経伝達物質や神経調節物質の直接合成を介して中枢神経系の機能に影響を与える可能性がある6,7 。重要なことに、腸内細菌叢のシグナル伝達は、セロトニンを含む様々なホルモンや神経伝達物質を産生する腸管アロマフィン細胞の機能を調節している可能性がある6 。
この疾患の主な特徴は、アミロイドβ(アミロイドβ)の沈着に続いて、高リン酸化されたタウタンパク質からなるプラークや神経原線維のもつれが形成されることである9 。タウについては、軸索微小管の安定性を調節する高可溶性タンパク質である。タウ仮説によれば、このタンパク質の変性・凝集型は神経変性に寄与する毒性刺激として作用すると考えられている9。
アルツハイマー病は発症年齢によって、65歳以前から始まる早期発症(若年性アルツハイマー病)とそれ以上から始まる後期発症(高齢発症型アルツハイマー病)に分類される。全症例の1~5%を占める若年性アルツハイマー病は、常染色体優性遺伝を持つAPP、PSEN1,PSEN2遺伝子の変異に関連していることが大半を占めている8,10。アミロイドβの量の増加または凝集傾向は、アルツハイマー病を引き起こすのに十分であり、アミロイドβの凝集は疾患の発症に重要です10。これらの遺伝子は、アミロイド前駆体タンパク質(APP)代謝、免疫応答、炎症、細胞内輸送、脂質代謝に関与するタンパク質をコードしており、潜在的な病原因子を示している。
本レビューでは、動物実験や利用可能な臨床観察から得られた結果に基づいて、アルツハイマー病の病態における脳-腸-微生物軸の制御異常の役割に関する最近のデータを紹介する。また、アルツハイマー病における腸内細菌叢の変調の潜在的な治療的意味合いについても簡単に議論されている。
アミロイドプラーク形成
中枢神経系
アミロイド斑は、主にAPPの切断産物であるアミロイドβから構成されている11 。この膜貫通タンパク質は、神経細胞の発生、シグナル伝達、細胞内輸送など様々な生物学的プロセスに関与している12,13 。APPは、非アミロイド原性経路(α-およびγ-セクレターゼ)またはアミロイド原性経路(β-およびγ-セクレターゼ)のセクレターゼによって処理される11,12。アミロイド原性経路では、様々な長さのアミロイドβペプチドが生成されるが、その中でも最も頻度が高いのはアミロイドβ40であり、プラークの中心部を形成するアミロイドβ42ペプチドはそれほど多くはないが神経毒性が高い4。これらのペプチドは凝集してオリゴマー、プロトフィブリル、フィブリルを形成して老人性プラークに沈着し、その中間の形態が最も神経毒性が高い(図1)4,12,14 単量体およびオリゴマー構造は、最初のシードの末端に結合しており、最終的にはこのようにして新たなアミロイドシードを生成して破断し、このプロセスを自己増殖させる14.14。種子形成のプロセス(核形成段階)は、最も時間のかかるステップであり、熱力学的に不利であり、生理学的条件では発生しない可能性がある。
図1
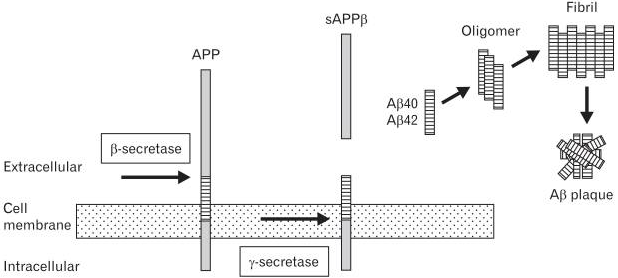
アミロイドβ(アミロイドβ)プラーク形成。アミロイドβはアミロイド前駆体タンパク質(APP)の切断産物である。APPは膜貫通型のタンパク質で、β-セクレターゼとγ-セクレターゼの2つの酵素が関与するアミロイド生成経路を介して切断され、β-セクレターゼは細胞外の位置でAPPを切断し、γ-セクレターゼは細胞膜内の位置でAPPを切断する。ミスフォールドされたタンパク質(アミロイドβ40とアミロイドβ42)は、タンパク質のオリゴマー、フィブリル、アミロイドプラークへの凝集を促進する種として作用する。フィブリルが破れて新しい種を形成し、その過程の自己増殖を可能にする。
興味深いことに、アミロイドβは最近、自然免疫系の一部である抗菌ペプチド(AMP)として認識されている16,17 。さらに、単量体のアミロイドβはほとんど抗菌活性を示さないが、その凝集能は抗菌性の多孔質構造を形成することを可能にしている17 。MyD88 は、TLR3 を除くほぼすべての TLR が核内因子κB(NF-κB)などの転写因子を活性化するために使用する普遍的なアダプター蛋白質である18 。この過程で産生されたNF-κBがアミロイドβ変換酵素とともにβ-およびγ-セクレターゼを活性化してアミロイドβを形成する18。
腸管神経系
ENSは消化管の内在神経系である。神経細胞はマイクロサーキットで構成されており、中枢神経系とは独立して消化管機能の調節を可能にしているが、システムは相互に接続されており、互いに影響を与え合っている。20 パーキンソン病(PD)では、ほぼ80%の患者に消化管機能障害がみられ、運動機能障害が先行している。実際、大脳皮質のα-シヌクレイン症は、パーキンソン病の病理学の初期指標であることが示唆されている21 。大脳皮質におけるAPPの規則的な発現は、アルツハイマー病においても大脳皮質の関与の理論を支持する。APPトランスジェニックマウスでは、腸管ニューロンにアミロイドβが蓄積し、腸管ニューロンの量の減少、運動機能障害、炎症に対する脆弱性の増加をもたらする。
アルツハイマー病発症における腸内細菌叢の役割
細菌性アミロイド
腸内細菌叢は、かなりの量のアミロイドの供給源である。最もよく研究されている細菌アミロイドは、大腸菌によって産生されるcurli(カーリ)である。アミロイドタンパク質の生産は、細菌細胞がバイオフィルムを形成し、物理的または免疫因子による破壊に抵抗するために互いに結合するのに役立つ。25,26
腸内での細菌性アミロイド蛋白質への曝露は、免疫系のプライミングを引き起こし、その結果、脳内での神経細胞アミロイドの内因性産生に対する免疫応答を増強する可能性がある。
Chenらによる先駆的な研究27では、curli産生大腸菌に暴露されたラットは、curli産生能力のない細菌に暴露されたラットに比べて、腸と脳の両方で神経細胞のα-シヌクレイン(α-シヌクレイン)沈着が増加し、ミクログリア症とアストログリア症が増強されたことが示されている。さらに、curliを産生する細菌に曝露された動物の脳では、TLR2,IL-6,およびTNFの発現が増加していることが明らかになった。
分子模倣を介して細菌のアミロイドは、1つのアミロイド原性タンパク質(curli、タウ、アミロイドβ、α-syn、およびプリオン)は、病原性のβシート構造を採用するために別の(例えば、異なる一次構造を有する宿主タンパク質)を引き起こすクロスシードを誘発し、プリオンタンパク質として機能することがある。細菌性アミロイドによるアミロイド原性タンパク質の交差播種は、生体内試験および試験管内試験の両方で報告されている28,29。
リポ多糖類
動物モデルを用いた実験研究では、細菌性リポ多糖類(LPS)を脳の第 4 脳室に注入すると、アルツハイマー病 に見られる炎症性および病理学的特徴の多くが再現されることが示されている30。また、マウスの腹膜腔内への LPS の注入により、海馬領域での アミロイドβの上昇が長期化し、認知障害を引き起こすことが示されている。
最近では、アルツハイマー病患者の海馬や大脳新皮質の脳溶解物にLPSの存在が検出されている34。また、アルツハイマー病患者のLPSの血漿中濃度も健常者に比べて有意に高い38 。他にも大腸菌piliタンパク質37や核酸39などの細菌産物もヒトの脳内で発見され、アルツハイマー病患者ではより多く見られた。
LPSは自然免疫系のミクログリア細胞に発現するTLRを活性化し、共通の損傷や病原体に関連する分子パターンを認識する。CD14によるTLR4の活性化はまた、アミロイドβ41およびS100A8/A9タンパク質に対する炎症反応を媒介する42。
腸内炎症と腸管バリア機能障害
腸内炎症のプロセスは、粘膜構造障害の場合には、循環から腸粘膜へ、あるいはさらには腸管腔への多形核細胞の移動を引き起こす。腸内炎症のプロセスは、便のカルプロテチン濃度を評価することによって間接的に測定することができる。S100A8/A9のヘテロ二量体であるこの小さなカルシウム結合タンパク質は、好中球の細胞質タンパク質含量の60%に寄与し、抗菌性を有する43。S100A8およびS100A9タンパク質は、本質的にアミロイド原性アミノ酸配列を有し、アミロイドβやα-synなどのアミロイドポリペプチドに酷似したアミロイドオリゴマーおよびフィブリルを形成することができ、試験管内試験での単量体および二量体S100A9は、アミロイドβフィブリル化を誘導することがある44,45。アミロイドプラーク形成時にマクロファージやミクログリアから分泌されるS100A9は、神経細胞においてもその発現を誘導し、これらはTLR4や高度糖化最終産物受容体(RAGE)経路を介してミクログリアをさらに活性化させる可能性がある44。44 糞便中のカルプロテキン濃度の上昇は、ある研究ではアルツハイマー病患者の70%近くに認められ、循環に移行して神経炎症に寄与すると考えられていた。糞便カルプロテチンの上昇によって発現する腸管上皮バリアの完全性と腸管免疫系の活性化の類似した変化は、パーキンソン病患者でも報告されている47 。腸内炎症および腸内バイオシスは腸管バリア機能障害と直接関連しており、腸管透過性の亢進(「リーキーガット」)は神経変性のプロセスに寄与している可能性がある48,49。
腸管バリアは、粘液層、腸管上皮、前頭葉で構成されている。このバリアの障害は、細菌(アトポビオシスとして知られているプロセス)や有害物質の血流への移動を引き起こす透過性の増加につながる50-52。反対に、小腸では、高濃度の抗菌剤が細菌の細胞表面への到達を妨げているにもかかわらず、粘液は細菌と同じくらい大きな粒子の侵入を可能にしている。53
ムチン分解細菌Akkermansia muciniphilaの豊富さは、腸管バリア機能を改善し、肥満や全身性炎症を減少させる54,55
ラクトバチルス・プランタラム(Lactobacillus plantarumニッスレ大腸菌(E. coli Nissleビフィドバクテリウム・インファンティス(Bifidobacterium infantis)などのプロバイオティクス株が腸管バリアを強化し、タイトジャンクションを形成するタンパク質の発現を増加させる。
様々な病原性大腸菌株、サルモネラ菌、シゲラ菌、ヘリコバクター・ピロリ菌、ビブリオ菌、クロストリジウム菌などがタイトジャンクションの変化を媒介している。また、アミロイド沈着と関連するもう一つの神経変性疾患である筋萎縮性側索硬化症のマウスモデルにおいても、タイトジャンクション構造の損傷と腸管透過性の増加が認められている。
腸内細菌叢組成の変化に加えて、小腸の細菌量の増加は、小腸細菌過剰増殖(SIBO)に見られるように、透過性にも影響を与える。
神経炎症
アミロイドプラーク近傍でのミクログリア、反応性アストロサイト、補体の活性化により発現する神経炎症は、アルツハイマー病のよく知られた特徴である60 。
61 アルツハイマー病の初期段階では、低アミロイドβ濃度はCD14とTLRを介してミクログリアを活性化し、ファゴサイトーシスとアミロイドクリアランスを促進する。61 ミクログリアへの過剰な刺激と、NF-κB、プロ炎症性サイトカイン、反応性酸化ストレスや硝化ストレスを介した神経炎症性シグナ ルの増加は、神経細胞とグリア細胞の死につながる。
神経変性や老化に見られるミクログリア活性化の閾値の変化は、反復または慢性の全身感染の結果である可能性がある。65 細菌性アミロイドでプライミングされたミクログリア細胞は、脳内のアミロイドβに対してより反応性が高い可能性がある。
アミロイドの拡散
アミロイドβの播種と伝播は、動物モデルに基づく実験で十分に証明されている。アルツハイマー病脳からのアミロイドβ抽出物を用いた脳内注入はアミロイド形成を導き66,1つの脳領域でのアミロイドの播種は脳の神経解剖学的に接続された領域に拡散する15,67
少量の不溶性で凝集しやすいアミロイドβ42が播種されると、それは他の可溶性で豊富なアミロイドβ40のオリゴマー化と拡散を促進するテンプレートとして作用する68。68 興味深いことに、アミロイドβ抽出物の腹腔内注射は、脳内でのアミロイド沈着にもつながる。
神経輸送
アミロイド蛋白質であるα-synは、パーキンソン病の特徴である細胞内沈着物を形成しており、腸壁の髄膜神経細胞で発見された58 。迷走神経の背側運動核は、α-syn 沈着物を最初に含む脳領域の一つである26 。これらのデータは、ミスフォールドされたタンパク質が腸-脳軸に沿って広がっていることを示唆している58 。さらに、生きている細胞は、エキソサイトーシスを介してタンパク質を放出することもある。
これらのタンパク質はその後、他のニューロンに取り込まれ、ミスフォールドされたタンパク質が局所的に伝達されるようになる。吸収されたミスフォールドされたタンパク質は、細胞の影響を受けやすいタンパク質の構造変化を引き起こす可能性がある。71
誤って折り畳まれたタウタンパク質の細胞外から細胞内への伝播、それに続く細胞内でのタンパク質の誤った折り畳み、凝集、他の共培養細胞への移行が試験管内試験で観察された。72 細胞外アミロイドβ沈着に加えて、このタンパク質は神経細胞内に蓄積される。この過程は、神経原線維のもつれ形成や細胞外アミロイドβ沈着に先行して、疾患経過の初期に観察される。
血液脳関門の障害
正常な状態では、可溶性アミロイドβはRAGEを介して血液から脳へ、逆方向には低密度リポ蛋白質受容体関連プロテイン1を介して輸送される。
この過程は、生きているヒトの脳のMRI研究で確認され、学習と記憶に関連した海馬での年齢に依存した血液脳関門の破壊が示された。
アルツハイマー病の動物モデルにおける腸内細菌叢
2016年、Minterら77は初めて、抗生物質による腸内細菌叢多様性の摂動が神経炎症とアミロイドーシスに影響を与えることを、アルツハイマー病のマウスモデルで報告した(表1)。APPトランスジェニックマウスの糞便サンプルからバクテリア16SリボソームRNAの配列決定を行った別の研究の結果では、コントロール野生型マウスと比較して腸内細菌叢の組成に有意な差があることが明らかになった79。この変化には、リケネラ藻の増加、Allobacillum、Akkermansiaの減少が含まれていた79 。Akkermansiaの減少は、認知症発症の危険因子として知られている肥満や2型糖尿病(55)と関連していた90 。さらに、微小膠原病の減少とサイトカインプロファイルの変化が観察された。また、従来から飼育されているAPPトランスジェニックマウスのマイクロバイオータを用いて無菌マウスを再コロニー化すると、脳アミロイドβ病理が増加したが、野生型マウスのマイクロバイオータを用いた場合には、この増加は抑制されていた79。同様に、パーキンソン病のモデルとして用いられたα-synを過剰発現させた無菌マウスでは、対照マウスと比較してα-syn内包物の減少とミクログリアの活性化が認められた91。興味深いことに、パーキンソン病患者由来の細菌による再コロニー化は身体障害を増強し、この細菌株が産生する異なるSCFAプロファイルと関連していた91。
表1 アルツハイマー病の病態における微生物叢の役割に関する動物研究の最新データ

アルツハイマー病における腸内環境悪化の臨床データ
34-39,60,92-102 これらの病原体には、肺炎クラミドフィルラ、93 ボレリア・ブルグドルフェリ、その他のスピロヘータ94 や単純ヘルペスウイルス 1 型などが含まれる。最近発表された研究では、APPトランスジェニックマウスにおけるヘリコバクターとオドリバクターの増加とプレボテラのレベルの低下が明らかになった。
また、アルツハイマー病患者の脳脊髄液や血清中のH. pylori特異的IgG抗体の有意な増加が認められた。17 もう一つの可能性として、病原体の侵入口は嗅覚神経である可能性があるが、嗅覚神経の漿膜は鼻腔と脳の間の唯一の関門であるためである。
表2 アルツハイマー病の病態における微生物群の役割に関する最近の臨床データ

腸内細菌叢が脳機能に及ぼす影響については、常に研究が進められており、ストレス関連疾患や脳障害の病態形成への脳-腸-微生物軸の寄与のメカニズムが明らかにされつつある。腸内細菌叢の変化が疾患の重要な病態生理学的要因の一つである過敏性腸症候群では、いくつかの予備的な結果は、アルツハイマー病または非アルツハイマー病の認知症発症のリスクも増加していることを示唆している106 。
最近行われた研究では、抗炎症性の Escherichia/Shigella の増加と抗炎症性の Eubacterium rectale の減少が、認知機能障害と脳アミロイドーシスを持つ患者の末梢炎症と関連している可能性があることが明らかになった。相対的な細菌の豊富さは、アルツハイマー病の病理学の脳脊髄液のマーカーの増加と相関していた。
貧しい食生活は微生物の多様性の低下と関連しており、高齢者の局所的・全身的な炎症の増加に寄与している。冒頭で述べたように、この現象は「炎症現象」と呼ばれている2,3。
複数の併存疾患が直接、あるいは抗生物質、メトホルミン、プロトンポンプ阻害剤などの使用薬によって、腸内細菌叢の組成に影響を与える3。
アルツハイマー病の治療標的としてのマイクロバイオータの変調
108 数多くの研究の結果は、腸管上皮の完全性を高め、バリア破壊から保護し、炎症反応を抑制し、神経炎症と神経変性の開始または伝播を抑制することにより、プロバイオティクスの有益な効果を確認している3,109。
例えば、Enterococcus faeciumとLactobacillus rhamnosusがTNF-α産生を減少させることが試験管内試験で示されており、動物実験ではこれらのプロバイオティクス株の補給が酸化ストレスマーカーを減少させ、脳内の抗酸化酵素を誘導することが示されている。
また、臨床研究では、乳酸菌とビフィズス菌をベースとしたプロバイオティクスの補給は、アルツハイマー病患者のMini-Mental State Examinationのスコアを有意に改善したと報告されている。
抗生物質治療は、腸内細菌叢の調節のためのもう一つの選択肢であり、SIBOや病原菌による腸内コロニー化の治療に適用できる。驚くべきことに、パーキンソン病患者において、リファキシミンによるSIBOの治療は、胃腸症状の改善だけでなく、運動の変動ももたらした。
糞便微生物移植は、神経変性疾患の病態解明のための多くの動物モデルに用いられている。113 おそらく、健康な若いドナーからの糞便微生物叢移植は、高齢者の腸内細菌叢の多様性と安定性を回復させることができると考えられている。
しかし、腸内マイクロバイオータを改変するための最も効果的なアプローチの一つは、食事介入である。114,115
植物性食品、プロバイオティクス、抗酸化物質、大豆、ナッツ類、オメガ3多価不飽和脂肪酸の多量摂取、飽和脂肪、動物由来のタンパク質、精製された砂糖の低摂取を特徴とする健康的な食事は、炎症反応を抑制し、インスリン抵抗性を低下させ、神経認知障害のリスクを低下させ、最終的にはアルツハイマー病のリスクを低下させることが示されている63,116。
結論と展望
アルツハイマー病の発症に腸内細菌叢が寄与しているというエビデンスが増えてきている(図2)。大量のアミロイド、LPS、その他の毒素の供給源としての腸内細菌叢は、全身の炎症や生理的バリアの崩壊に寄与している可能性がある。細菌またはその生成物は、特に高齢者では、消化管および口腔から中枢神経系に移動する可能性がある。
細菌性アミロイドは、プリオンタンパク質のクロスシードミスフォールディングとして作用し、ネイティブアミロイド凝集を増強することがある。さらに、腸内細菌叢の産物はミクログリアを刺激し、中枢神経系の炎症反応を亢進させ、その結果、病的なミクログリア機能、神経毒性の増加、アミロイドクリアランスの障害をもたらす可能性がある。
抗菌ペプチドとしてのアミロイドβの役割を考慮すると、感染性または無菌性の炎症因子がTLRを介してアミロイドβの形成を促進する可能性がある。腸内マイクロバイオータ組成の変調は、アルツハイマー病の潜在的な治療標的として利用できる可能性がある。
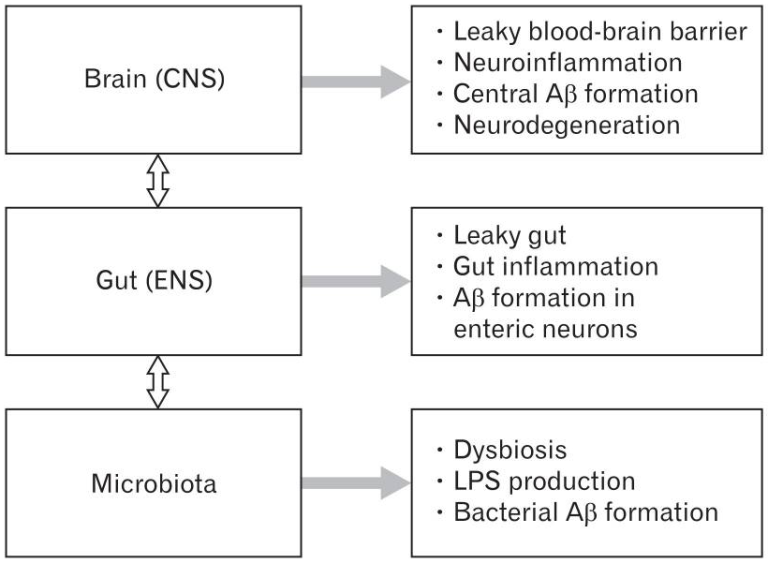
図2
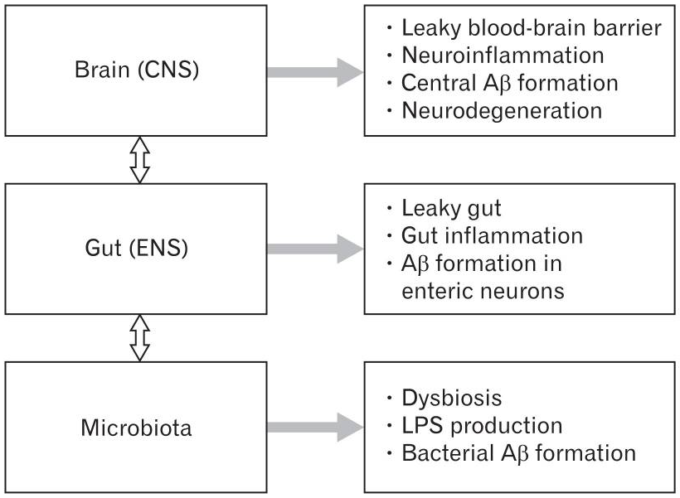
アルツハイマー病における脳-腸-微生物軸の乱れ 中枢神経系(中枢神経系)や腸内神経系(ENS)を含む脳-腸-微生物軸の乱れは、アルツハイマー病の発症に関与していると考えられている。
腸内細菌叢は、病原菌由来のリポ多糖類(LPS)や炎症促進性サイトカインの合成により、局所および全身の炎症をアップレギュレートすることが知られている。腸内細菌叢の変化は、腸管バリアや血液脳関門の透過性を高め、腸、全身、中枢神経系レベルでの炎症をさらに促進させる可能性がある。アミロイドβ(アミロイドβ)の形成は、脳神経系と中枢神経系で行われる。また、アミロイドは腸内細菌叢から大量に分泌されている。
これまでのところ、アルツハイマー病や他の神経変性疾患における腸内細菌叢の役割に関するデータは、前臨床または横断的なヒト研究に基づいている48,108。アルツハイマー病研究を強化し、前進させるためには、遺伝子、マイクロバイオータ、食事、老化の間の複雑な相互作用を調査する大規模な疫学研究を実施すべきである。
また、メタボロームプロファイリングを含めたマイクロバイオータの組成と機能の評価に関する方法論的な問題も考慮する必要がある。さらに、神経変性疾患の病態生理における腸内および口腔・鼻腔内のマイクロバイオータ以外の他のマイクロバイオータの関与については、これまで検討されていない48,117
。最近では、アルツハイマー病の病態の多次元的な性質を考慮して、現在の加齢、認知、および腸内細菌叢を含む様々な生物学的、社会的、環境的要因との関係を再評価する可能性が示唆されている118 。