Contents
Brain-Derived Neurotrophic Factor: A Key Molecule for Memory in the Healthy and the Pathological Brain
www.ncbi.nlm.nih.gov/pmc/articles/PMC6692714/
要旨
脳由来神経栄養因子(BDNF)は、学習や記憶に関連する可塑性の変化に関与する重要な分子である。BDNFの発現は高度に制御されており、健康な被験者ではBDNFレベルに大きなばらつきがある。BDNF の発現の変化は、正常・病理学的な加齢や精神疾患と関連しており、特に海馬や海馬傍野などの記憶プロセスに重要な構造物では、その変化が顕著に見られる。また、運動や抗うつ薬の投与などの介入により、正常・病理状態でのBDNFの発現が増強されることが知られている。
本レビューでは、BDNF の発現がどのように制御されているのか、病理学的な脳ではどのように発現が変化するのか、また、このニューロトロフィンを増強することが知られている介入がどのように臨床的な関連性を持つのかについての研究をまとめるために、げっ歯類とヒトからの研究について記述する。
我々は、BDNFは多くの病態に共通して発現が制御されていないため、神経変性疾患や精神神経疾患の有効なバイオマーカーではないかもしれないが、多くの病態に共通する記憶関連(ニモニック)症状の発生や進行に特異的に関連するマーカーとして考えられる可能性があることを提案する。
キーワード
BDNF、海馬、海馬周辺皮質、アルツハイマー病、記憶、うつ病、ストレス
講座のページ
BDNF: シナプス可塑性と記憶の動的制御プレーヤー
脳由来神経栄養因子(BDNF)は、発生期の神経細胞集団の生存と分化に重要な役割を果たす神経栄養因子ファミリーに属している(Huang and Reichardt, 2001)。成人脳においても、BDNFは高い発現レベルを維持し、興奮性および抑制性のシナプス伝達および活性依存性の可塑性を制御している(Tyler et al 2002; Wardle and Poo, 2003)。
BDNFの発現は、転写と翻訳の間に制御され、また翻訳後の修飾によっても制御される。複雑なマルチレベルの制御が存在することは、BDNFの機能の重要性と多様性を示している。転写は、活性依存性および組織特異的発現を決定する複数のプロモーターによって制御される(Timmusk et al 1993;Chen et al 2003)。ラットでは、少なくとも4つのBDNFプロモーターが同定されており(Timmusk er al)。 1993それぞれのプロモーターが、8つのノンコーディングエクソンのうちの1つを含むmRNAの転写を駆動し、共通の30のコーディングエクソンにスプライシングされた、BDNF転写物の不均一な集団を生成する。BDNFのスプライシングは、ヒト(Liu et al 2005)、マウス(Hayes et al 1997)、ラット(Timmusk et al 1993)を含むいくつかの種について記述されている。さらに、特定のBDNFエクソンの発現はエピジェネティックなメカニズムによって制御されている(Lubin er al)。
脳内での BDNF の発現パターンについては、げっ歯類とヒトの両方で海馬、扁桃体、小脳、大脳皮質で高レベルの BDNF が検出されており、海馬のニューロンで最も高いレベルが検出されている (Hofer et al 1990; Timmusk et al 1993)。より低いレベルのBDNFが、肝臓、心臓、肺などの臓器で検出されている(Ernfors et al 1990; Maisonpierre et al 1991)。各トランスクリプトの調節は、神経細胞の活動(Metsis et al 1993)運動(Oliff et al 1998)抗うつ剤(Russo-Neustadt et al 2004)ストレス(Lauterborn et al 1998)およびエストロゲンなどのホルモン(Singh et al 1995)のような因子によって制御および/または調節される。
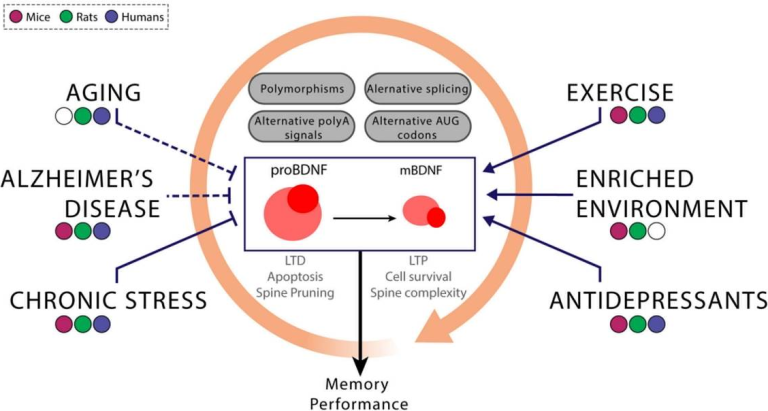
脳由来神経栄養因子は、前駆体proBDNFとして合成され、これは樹状突起または軸索のいずれかに貯蔵され(Lessmann et al 2003)細胞内または細胞外で切断を受け(Lee et al 2001;Mowla et al 2001)成熟したBDNFタンパク質を生成する。BDNFは、活性に依存して、プロおよび成熟BDNFの混合物として放出される(Pang et al 2004)。興味深いことに、BDNFとproBDNFは、細胞機能に対する相反する効果に関連しており、BDNFタンパク質の機能は、さらに複雑なレベルを与えている。proBDNFの形態は、病理学的条件下と非病理学的条件下の両方で分泌される(Barker, 2009)。プロBDNFは、p75 NTR受容体と優先的に結合し、長期抑制(LTD)を促進し(Woo et al 2005)アポトーシスを誘導する(Friedman、2010)。一方、成熟形態のBDNFは、チロシンキナーゼ受容体(TrkB)に特異的に結合し、細胞の生存を促進し(Volosin et al 2006)長期増強(LTP)を促進し、脊椎の複雑性を増加させる(McAllister et al 1999;Zagrebelsky et al 2005)。p75NTRがTrkB受容体と共発現すると、ニューロトロフィンの結合親和性が増加し、それによってリガンドの識別が容易になる(Bibel et al 1999)。このように、プロBDNFは、非病理学的条件下でのBDNF活性の調節機構の一部と考えることができる。さらに、TrkB受容体の切り詰められた形態は、シナプスからBDNFを内部化してクリアすることにより、BDNFシグナル伝達の支配的なネガティブインヒビターとして作用することができる(Haapasalo et al 2002;図1)。
図1
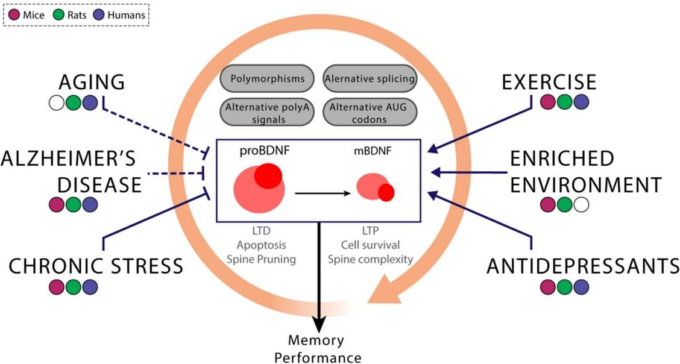
遺伝的要因と環境要因の相互作用は、BDNF 変異体の発現を調節する。BDNF遺伝子の発現は多くのレベルで制御されている。特定のエクソンを含むこと、およびポリアデニル化部位および/または開始コドンの異なる使用は、BDNFバリアントだけでなく、例えば、BDNF mRNAの安定性の修正を介して、その発現の時間的ダイナミクスも修正する。これらの調節のいずれかのレベルでの変動は、健常者または疾患を有する被験者において成熟したBDNFの差動レベルをもたらし得る。これらの差異は、遺伝的要因(すなわち、Val66Metおよび他の多型)または環境的要因(慢性ストレス、運動、および他の要因の中でも特に)に関連している可能性がある。ヒトで行われた相関研究に加えて、非ヒト動物モデル、特にげっ歯類モデルの使用は、これらの要因の間で上記のように図式化されたある種の関係を確立することにつながる可能性がある。鈍い矢印はBDNF発現の減少を示し、尖った矢印はその逆のパターンを象徴している。加齢、アルツハイマー病の発症、慢性的なストレスへの曝露がBDNFの発現低下と関連していることは一致しているが、一部の研究ではこれらの関連性が見られなかったり、逆のパターンが見られたりしている(破線で示されたケース)。一方で、運動、環境、抗うつ薬などの外部介入により、BDNFの発現を高めることができるものもある。そのため、前述の介入は、BDNFの発現低下に関連した認知障害の治療法となる可能性がある。これらの外的要因は相互に影響し合う可能性があるため(オレンジ色の丸い矢印で示されている)BDNF発現に対するこれらの変数の効果の間の因果関係を決定する際には、これらの潜在的な相互作用のすべてを考慮に入れることが重要である。
多くの研究で、成人脳の可塑性変化の調節に BDNF が重要な役割を果たしていることが示されているが、その中には、シナプス強度の増大に関連したトラフィッキングの調節(Caldeira er al)。 BDNFは、長期増強(LTP)において重要な役割を果たしていることから、シナプスの統合を促進することで記憶の形成と維持をサポートする細胞メカニズムの重要な一部であると考えられている(Bramham and Messaoudi, 2005)。この仮説によれば、BDNFは、長期増強(LTP)の安定化につながる脊椎形態の変化を促進することで、記憶の蓄積を増加させると考えられる。また、BDNFは樹状突起の数、大きさ、複雑さを増加させる(Horch and Katz, 2002; Alonso er al 2004)。さらに、BDNFは、細胞生存の変化(Lee et al 2007)および増殖(Katoh-Semba et al 2002)を介して神経新生を増加させる。
シナプス結合の変化は記憶の保存をサポートしていると考えられている。BDNFと学習や記憶とを直接結びつける証拠はいくつかある。例えば、BDNFは空間記憶と認識記憶の両方のプロセスの基礎となる可塑的な変化のメディエーターである可能性がある(Kesslak et al 1998; Mizuno et al 2000; Cirulli et al 2004; Bekinschtein et al 2007; Heldt et al 2007)。
本レビューでは、成人脳の認知機能における BDNF の役割に焦点を当て、加齢や神経精神疾患、神経変性疾患に伴う認知機能の変化に対する BDNF の治療効果の可能性を評価する。特にニーモニック機能への効果に注目している。
BDNF Val66Met多型について
ヒトBDNF遺伝子では、BDNFのプロドメインのコドン66のMetからValへの置換で同定された共通の一塩基多型(rs6265またはVal66Met多型と呼ばれる)は、BDNF含有小胞のシナプス標的化とBDNFの活性依存性ニューロン放出に影響を与える(Egan et al 2003)。Met66ホモ接合体ノックインマウスは、試験管内試験で活性依存性シナプス可塑性の選択的障害を示した(Ninan et al 2010)。さらに、ValキャリアにおけるproBDNFの外因性適用は長期抑制(LTD)を促進し、長期増強(LTP)を阻害したが、Metキャリアでは阻害されなかった(Kailainathan et al 2016)。この一塩基多型は、ヒト集団における頻度が高く(ヨーロッパのサンプルでは、最大30%のMetキャリア(Egan et al 2003)BDNFの血清レベルの低下(Ozan et al 2010)と関連しているため、大きな関心事となっている。この多型は、シナプス可塑性(Kleim et al 2006)や記憶能力(Hariri et al 2003)などの脳の構造的な違い(Pezawas et al 2004)や機能的な違いと関連している。これらの構造変化のいくつかは、海馬(Szeszko et al 2005年海馬傍回、前頭前皮質、扁桃体(Matsuo et al 2009年;Montag et al 2009)などの特定の領域における体積的な減少を含む。Met対立遺伝子の存在は、短い遅延と長い遅延の両方での言語タスクでのニーモニックパフォーマンスの低下と関連しており、また、作業記憶と空間記憶タスクでの欠損とも関連している(Dempster et al 2005; Hansell et al 2007; Goldberg et al 2008)。ほとんどの研究は主に項目記憶、特に言語記憶を評価する課題を対象としているので、他のより複雑な認知機能への影響はまだ検証されていない(Mandelman and Grigorenko, 2012)。Yogeethaら(2013)は複数のタイプの記憶を評価し、視覚空間記憶への影響のみを発見したが、Razら(2009)は連想記憶の追加効果を述べている。
健康な被験者におけるMet対立遺伝子の投与量、海馬の容積/活性化、記憶能力に関するこれらの相関研究に加えて、脳の構造と機能におけるVal66Met多型の役割についての証拠は決定的ではなく、メタアナリシス研究でさえも相反する結果のパターンを示している。Kambeitzら(2012)は、Val66Met多型がヒトの宣言的記憶能力、海馬体積、海馬活性化に及ぼす影響を決定するために、3つの別々のメタアナリシスを実施した。彼らは、Valホモ接合体と比較してMet対立遺伝子のキャリアでは、これらすべての測定値が減少しており、この効果は年齢、性別、診断基準などのランダム変数では説明できないことを報告した。しかし、Doddsら(2013)は、fMRIデータの効果量はボクセルの選択方法に影響されやすく、Kambeitzらで用いられたものは効果量の推定値を膨らませた可能性があると主張している。実際、Mandelman and Grigorenko(2012)によるメタ解析では、BDNF Val66Met多型と一般的な認知能力、記憶力、実行機能、視覚処理能力、認知流暢性などの表現型との間には有意な関連は認められなかった。彼らは、この文献の不一致を説明するための代替シナリオを仮定し、行動の類似性によってグループ化するのではなく、認知表現型を脳の活性化経路に応じて分類すべきであることを提案した。重要な研究グループでは、Val66Met遺伝子型と記憶力との関連は認められなかったが(Tsai et al 2008; Houlihan et al 2009; Karnik et al 2010)BDNF多型と記憶力との関連は、おそらく空想的なものではない。BDNF遺伝子が生涯にわたって発揮する効果の違いや、BDNFレベルに影響を与えることが知られている性別、ストレス、運動などの変数の影響が制御されていないために、特定のサンプルでは効果が希釈されている可能性がある。さらに、MetキャリアはBDNFレベルの欠乏を補うことができるかもしれない。実際、fMRIの研究では、キャリアではない場合と比較して、エピソード記憶タスクの実行中に内側側頭葉の活動が増加していることが示唆されており、これは潜在的な欠陥を「隠す」可能性がある(Dennis er al)。 結論として、これらの研究は、Met対立遺伝子の存在が認知能力、特にエピソード記憶において不利になる可能性があることを示唆している(レビューについては、Bath and Lee, 2006を参照のこと)。
加齢脳におけるBDNF
加齢は認知障害の発症の主なリスクである(Horn and Cattell, 1966)。認知機能は加齢とともに徐々に低下するが、これはおそらく、認知機能に重要な脳領域のシナプス可塑性の漸進的な低下につながる細胞や代謝の変化の結果である(Barnes, 1994; Smith et al 2000; Erickson and Barnes, 2003)。老化は、灰白質の著しい縮小(Driscoll et al 2003年、2009年;Raz et al 2005年シナプスの数の重要な減少(Burke et al 2006年および神経可塑性関連タンパク質の変化(Assuncao et al 2010年;Erickson et al 2010)に関連している。海馬は可塑性に関連する分子のレベルが高い脳領域であり(Neves et al 2008)、体積減少につながる加齢に関連した細胞の変化に特に敏感である(Greene and Naranjo, 1987; Lee et al 1994; Rosenzweig and Barnes, 2003)。特に歯状回の局所的な抑制性および興奮性回路において多数の変化が報告されている(Patrylo and Williamson, 2007)。さらに、歯状回における成人の神経新生の低下は、中年期から出現し、老化の過程を通じて継続している(Drapeau er al)。 また、前頭前野や内耳皮質などのエピソード記憶形成に関連する他の構造もまた、体積減少を示し、認知機能の低下に寄与している可能性がある(Driscoll et al 2009)。
細胞レベルでは、海馬の長期増強(LTP)の変化も高齢動物で報告されており、長期増強(LTP)の誘導、維持および/または発現に関連した障害が、誘導に用いた刺激パターンに依存している(Erickson and Barnes, 2003; Gooney et al 2004)。MTL領域における長期増強(LTP)および長期抑制(LTD)の閾値の変化が長期記憶の障害と関連していることを考えると(レビューはKumar, 2011を参照)加齢に伴う認知障害も長期増強(LTP)機能の変化と関連している可能性がある。
実際、加齢に関連する最も一貫性のある可塑性関連の欠損の一つは、神経栄養シグナルの減少である。歯状回におけるBDNF-長期増強(LTP)は高齢脳で障害されており、アンパカインの投与などの操作による内因性BDNFの誘導によって元に戻る可能性がある(Rex et al 2006)。シナプス可塑性の機能不全およびニューロン活動の変化は、さまざまな認知課題におけるパフォーマンスの低下と関連している(Linch et al 2006)ので、BDNFレベルの変化を加齢に依存する認知機能の低下およびニューロンネットワークの構造的および機能的完全性の関連する変化と関連させるための努力が行われてきた(レビューは、Tapia-Arancibia et al 2008を参照のこと)。Mattsonら(2004)は、加齢に伴う認知機能の低下は、加齢の影響を受ける脳の主要領域におけるBDNFの発現低下と関連している可能性を示唆している。この考えと一致するように、老化した霊長類およびヒトではBDNFの循環濃度が低下し(Hayashi et al 2001;Shimada et al 2014ラットでは脳内濃度が低下している(Silhol et al 2005)。高齢化したげっ歯類では、BDNFシステムは、転写、タンパク質合成および処理の減少を含む様々なレベルで影響を受けている(Calabrese et al 2013)が、他の出版物では、加齢に関連した可塑性変化とBDNFとの間の関連を見つけることができなかった(Lapchak et al 1993; Driscoll et al 2012)。発見された減少は、海馬の収縮(Erickson et al 2010)空間記憶の低下(von Bohlen und Halbach、2010)および神経細胞の萎縮(Murer et al 2001)と相関している。例えば、非障害ラットを対象とした水迷路課題の後、高齢動物と比較して、より高いBDNF mRNA誘導レベルが報告された(Schaaf et al 2001)。高齢者で観察されたBDNFのレベルの低下は、TrkB受容体の発現および活性化の低下とproBDNFおよびp75NTRのレベルの増加を伴っており、BDNFのシグナル伝達経路およびproBDNFから成熟BDNFへの処理において、年齢に関連したさらなる障害が存在することを示唆している。さらに、これらの変化は、ウォーターラジアル迷路のパフォーマンスと負の相関を示した(Buhusi et al 2017)。さらに、恐怖条件付け後の特定のBDNF転写物の誘導は、高齢ラットにおいて変化している(Chapman et al 2012)ことから、加齢は、安静時のニューロトロフィン発現の低下と関連しているだけでなく、特定のタスクに応答してBDNFの機能障害につながる可能性があることが示唆されている。このことは、活動や経験に依存した構造的・機能的な接続性の変化におけるBDNFの前述の役割と一致している。
しかし、いくつかの研究者は、加齢に伴うBDNFの変化や増加を認めていない、あるいは増加さえも認めている(Lapchak et al 1993; Narisawa-Saito and Nawa、1996; Newton et al 2005)。このことは、海馬のBDNFの喪失が加齢に伴う認知機能の低下に関与するメカニズムの一部ではないことを示唆している可能性がある。しかし、神経細胞死が加齢に伴う認知機能低下の重要な要素であることは間違いない(Morrison and Hof, 1997)ことを考えると、神経細胞の変性に対する一過性のBDNF関連の反応が、いくつかの研究で報告されている海馬のBDNFレベルの上昇の根本的な理由である可能性がある。しかし、脳内の BDNF の 生体内試験 での測定は不可能であるため、ヒトでの研究は中枢神経系における BDNF のレベルに関する推論に頼っている。BDNFが血液脳関門を通過する可能性があるという証拠があることから (Pan et al 1998)、これらの研究では血清BDNFが脳内BDNFレベルの代理であると仮定している。一貫して、中枢神経系におけるBDNFの測定値(脳内BDNF、b-BDNF)は、末梢からのBDNFの測定値(血清BDNF、sBDNF)と相関している(Sartorius et al 2009;Klein et al 2011)(Rasmussen et al 2009)。しかし、血清中の BDNF の機能的意義については議論の余地がある。BDNFは、血小板、リンパ球、骨格筋細胞および平滑筋細胞などのいくつかの末梢部位でも分泌され、また、最近の研究では、BDNFが血液脳関門を横断することができるという考えに疑問を呈している(Pardridge et al 1998; Di Lazzaro et al 2007)。これらの測定におけるもう一つの重要な考慮事項は、BDNFのプロ型と成熟型が測定されているかどうかであり、成熟型BDNFを区別することができるのはいくつかのアッセイのみであり、それらが相反する効果を有し得ることを考慮すると、これらを考慮に入れるべきであるからである(Polacchini et al 2015)。この理由から、血清研究の結果は、研究間で報告されたsBDNFレベルの不一致の潜在的な原因となり得るため、慎重に解釈されるべきである。末梢血由来の神経細胞由来の濃縮細胞外小胞の使用は、血漿と比較して脳の変化をより密接に反映し得るので、これらの問題を回避する新しい方法を提供し得る(Mustapic et al 2017; Suire et al 2017)。
BDNFレベルの低下が、上述したようなシナプス可塑性におけるその役割のように、正常な脳機能に有害であり得ると考える理由はいくつかある。もう一つの理由は、BDNFが海馬ニューロンに対して様々な栄養効果を発揮し、それがニューロン細胞死の有害な影響を打ち消すのに役立つ可能性があるということである(Almeida et al 2005)。実際、海馬におけるBDNFの高レベルは、成人における歯状回前駆細胞の生存および分化の両方に関連しており(Pencea et al 2001年;Shetty et al 2004)BDNFの低レベルは、高齢動物における欠損した神経新生に関連している(Apple et al 2017)。さらに、BDNFは、老化中の抗酸化防御の一部として酸化ストレスとともに増加することが知られている(Mattson et al 2002)。神経細胞の喪失は正常な老化の重要な構成要素であるが、学習および記憶障害には有意に寄与しない(West, 1993; Rapp and Gallagher, 1996; Rasmussen et al 1996)ことから、老化に関連する記憶障害は、シナプス生理学の変化および異常な細胞シグナル伝達に関連している可能性が高く、それが接続性の変化に寄与している可能性があることが示唆される(Lister and Barnes, 2009)。
加齢に関連した神経解剖学的変化は明らかであるが、認知機能の低下のパターンには健康な人でも大きなばらつきがある(Morris and Price, 2001)。記憶能力もまた、おそらく多くの認知過程において年齢に敏感であるため、一部は遺伝的な制御下にある(Payton, 2006)。特に、認知機能の遺伝性は、脳資源の減少に伴って生涯にわたって増加し(Haworth et al 2010)認知機能の低下における差異の3分の1を占める可能性がある(Finkel et al 2005)ため、遺伝的差異が認知能力の個人差を説明する可能性がある。アポリポ蛋白E(APOE)(Wisdom er al 2011)とBDNF(Miyajima er al 2008)は、健常者の認知パフォーマンスの変動と他の遺伝子よりも高い頻度で関連しているが、いくつかの結果は確実に再現されていない(Harris and Deary, 2011)。
BDNFは生涯を通じて減少するので(Erickson et al 2010)Val/Met多型と加齢に伴う認知機能の低下との関連を評価することは興味深いことであろう。例えば、宮島ら(2008)は健常高齢者のMetホモ接合体において言語記憶の低下を報告しており、Sambataroら(2010)は、Metキャリアはエンコーディングと検索の両方において海馬の活性化が加齢に伴うより大きな低下を示していることを明らかにしている。これらの結果を考慮すると、この多型は、特に神経伝達物質や神経栄養因子レベルの遺伝的変化による認知機能の個人差を理解するのに役立つ可能性がある(Raz and Lustig, 2014)。しかし、APOE多型とBDNF多型の両方が分散の2.3%未満を占めるという報告があるため、これらの結果を解釈するためには、他の遺伝子との関連や環境因子との相互作用の複雑な相互作用を考慮に入れることが基本的である。身体運動(Cotman and Berchtold, 2007)カロリー制限(Mattson et al 2003)エストロゲンレベル(Scharfman and Maclusky, 2005)環境濃縮(van Praag et al 2000)など、多くの環境因子やホルモン因子がBDNFレベルに影響を与える可能性があり、BDNFを加齢に伴う記憶障害や海馬萎縮と結びつけることは困難である。例えば、BDNFの遺伝子型は、身体運動がエピソード記憶のパフォーマンスと脳の容積に及ぼす影響を調節することができる。これは、Valホモ接合体のみが、より大きなMTL体積および海馬灰白質で身体運動の恩恵を受けたのに対し、Metキャリアでは逆の効果が認められたという事実から明らかである(Brown et al 2014)。別の研究では、65歳以上のコホートにおいて、認知機能低下と身体活動との関連の強さは、Met対立遺伝子の数が多いほど増加しており、身体活動の少ない高齢者ではMet対立遺伝子が認知症の脆弱性をもたらす可能性が示唆されている(Kim er al)。 一方、Metキャリアの加齢に伴う実行機能の低下に対する脆弱性が減少したとの報告もあり(Harrisberger et al 2014)タスクを支える領域に関連した認知機能に対するBDNFの影響が異なることを示唆している。
認知機能に対するBDNFの影響は、生涯にわたって変化する可能性がある。実際、BDNF Val66Met 多型が脳構造や認知機能に及ぼす影響は、年齢に依存して異なることが明らかになっている。(2003; Pezawas er al 2004)高齢者(主に75歳前後のサンプル)では、Val/Val保有者では、内耳皮質の厚さ、白質路の完全性、およびエピソード記憶能力が低下していた(Harris er al 2006; Erickson er al 2008; Voineskos er al 2011)。tPAなどの開裂分子は加齢とともに減少することが知られているため(Cacquevel et al 2007)この効果は開裂レベルの変化と関連しているのではないかという仮説が立てられている。もう一つの説明としては、加齢に伴う疾患の独立した発生などの他の要因が脳構造や認知への影響を増大させるため、生涯にわたってBDNF遺伝子型の浸透性が低下することが考えられる(Lindenberger et al 2008)。実際、MetキャリアはVal/Val被験者よりも前頭葉機能が保存されていることを示唆する結果がある(Gajewski et al 2012)。高齢のMetキャリアはまだニーモニック性能に欠損があり、加齢に伴って記憶課題において急激な障害を経験し(Kennedy et al 2015)Val/Val個体と比較して中立的な顔を記憶する性能が低下していることを示す研究があるので、この点で矛盾する結果を説明するのに役立つかもしれない(Mascetti et al 2013)。
加齢は通常、記憶機能の低下を伴う(Erickson and Barnes, 2003)。エピソード記憶は、手続き的記憶や非宣言的記憶よりも、特に加齢に敏感である(Verhaeghen et al 1993) (Light, 1991)。エピソード記憶の範囲内では、いくつかの側面が他の側面よりも老化に対して脆弱であることがある。例えば、複数の情報の断片の結合を必要とする連想記憶の課題は、老化のプロセスに対してより敏感になり得る(Naveh-Benjamin, 2000; Old and Naveh-Benjamin, 2008)。この欠損は、主に空間記憶(Tanila et al 1997;Oler and Markus、1998)と認識記憶の喪失(Moss et al 1988;Danckert and Craik、2013)に関連している。特定のニーモニックプロセスの加齢に対する脆弱性は、これらの機能のそれぞれが、加齢に伴う機能低下の速度が異なる脳領域によって支えられていることによると考えられる(Buckner, 2004)。ECからDGへの入力が減少すると、新規刺激と慣れ親しんだ刺激が類似している場合には、新規刺激と慣れ親しんだ刺激の識別に重要な感覚情報からHPを奪うことになる可能性がある(Wilson et al 2005; Holden and Gilbert, 2012)。エピソード記憶機能をサポートすると考えられている内側側頭葉領域(MTL)は、加齢および/または病理学的機能不全の間に起こる細胞の変化に対して特に脆弱である(Jobst er al)。 エピソード記憶の低下は海馬体積の減少と相関しているので(Charlton et al 2010)、これらの変化は加齢に関連したニーモニック障害を説明することができるかもしれない。MTLにおけるエピソード記憶のためのもう一つの重要な構造は、新奇刺激と馴染みのある刺激の識別に関与する領域である(辺縁皮質)である(Malkova et al 2001; McTighe et al 2010)。加齢はラットとヒトの両方で識別力を変化させ、新しい刺激を馴染みのあるものとして識別する傾向を強めている(Plancher et al 2009; Burke et al 2010)。この効果は、いくつかのケースでは、物体の特徴を結合する能力の欠如として解釈され、単一の構成要素の親しみやすさに基づいて意思決定が行われるようになった。その結果、見慣れた特徴の新しい構成を検出することができなくなるのである(Jones and Jacoby, 2005)。実際、特徴の複雑さと曖昧さは、高齢ラットにおける認識記憶障害の決定変数として提案されている(Burke et al 2011; Gamiz and Gallo, 2012)。高齢動物の脳内では、いくつかの分子的・生化学的変化が報告されており、それが関連する認知障害の一因となっている可能性がある(Liu et al 2008; Moyer et al 2011)。新規物体への曝露は辺縁皮質におけるBDNFレベルの上昇と関連しており(Romero-Granados et al 2010また、曖昧な刺激(および明確に区別できない刺激)の存在下での親しみやすさの識別は、タスク後の制限された時間窓の間にBDNFアンチセンスODNを注入すると損なわれるので(Seoane et al 2011; Miranda et al 2011; Moyer et al 2011BDNFアンチセンスODNを注入した場合には、BDNFアンチセンスODNは、タスク後の制限された時間窓の間のBDNFアンチセンスODNを注入した場合に障害される。2011; Miranda et al 2017BDNFは、分子的および生化学的変化と加齢に伴う空間記憶および認識記憶の両方の障害のパターンとの間のリンクを確立するのに役立つ可能性のある興味深い分子候補である。特に、最適な認知機能は神経細胞の効率的な可塑性と関連しているため、これらの記憶障害は、BDNFのような可塑性関連タンパク質の発現と制御の変化と関連している可能性がある。
この考えに対応して、BDNFの発現低下は、いくつかの神経疾患に見られる神経細胞の萎縮や死と関連していることが知られている(Murer et al 2001)。外因性BDNFの投与は、加齢に伴う神経系の病理学的変化を防ぐことができ(永原 et al 2009)[しかし、一貫性のない結果についてはFischerら(1994)を参照のこと;レビューについてはFumagalliら(2006)を参照のこと]、また、加齢動物におけるBDNF誘発の長期増強(LTP)と空間記憶能力の両方を回復させることができる(Rex et al 2006)。BDNF はシナプス可塑性、神経新生、神経細胞の生存、脳障害に対する保護に関連していることから (Bath and Lee, 2006)、上記の結果は BDNF がシナプス修復分子として作用する可能性を示唆している。例えば、TrkBアゴニストである7,8-ジヒドロキシフラボンの急性投与は、試験管内試験で高齢ラットの海馬におけるシナプス可塑性を回復させる(Zeng et al 2011)など、この考えを支持するいくつかのエビデンスがある。さらに、慢性的な治療はまた、加齢に伴って通常減少する背骨レベルを同時に正常化することで、文脈的恐怖条件付けおよび誘発恐怖条件付けにおける加齢に伴う障害を予防する(Zeng et al 2012)。さらに、Lou/Cラットは、その長い寿命にわたって保存された認知性能を示す老化の成功した動物モデルである(Kollen et al 2010Wistarラットよりも高い海馬BDNFを示し、年齢とともにproBDNFの減少を示した。これは、高齢のWistarラット(タピア-アランシビア et al 2008)で見られるproBDNFの増加とは対照的である。しかし、ラットの神経保護やニーモニック性能に対するBDNFの有益な効果は、年齢の増加とともに減少する(Sohrabji and Bake, 2006)が、おそらく処理とシグナル伝達経路の追加的な変化によるものと考えられる。シナプス可塑性と記憶におけるBDNFの役割と一致し、高齢のLou/Cラットでは、認識記憶課題における短期・長期記憶の低下や長期増強(LTP)の低下を示すことはなかった(Kollen et al 2010)。しかし、Silholら(2007)は、学習に関連した認知訓練が高齢動物のTrkB受容体の発現を増加させ、また、高齢ラットと若齢ラットの両方でproBDNF処理を増加させることを発見し、学習がBDNF経路の強化につながり、特にこの経路が影響を受ける高齢動物では、BDNF経路が影響を受けていることを示している。
BDNFとアルツハイマー病
BDNF の減少は、正常な加齢条件下だけでなく、ハンチントン(HT)アルツハイマー病(アルツハイマー病パーキンソン病などの病態においても報告されている。しかし、これらの病態では、変性の影響を受ける脳領域によって認知障害のプロファイルが大きく異なる。例えば、アルツハイマー病では海馬、頭頂部、側頭葉、前頭前野、海馬(Hock et al 2000)HTでは線条体、運動野(Zuccato et al 2008)で最も深いBDNF欠損が報告されている。ここでは、アルツハイマー病は他の神経機能に影響を与えることなく、主に宣言的記憶の障害として始まるので、ここではアルツハイマー病に焦点を当てることにする(Walsh and Selkoe, 2004)。この特徴は、海馬、副島皮質、扁桃体では始まるが、一次感覚野や運動野では始まらないという病気の変性プロファイルに関係していると提案されている(Selkoe, 2001)。
神経栄養因子がアルツハイマー病の病因、特にBDNFのために重要であるという考えを支持するかなりの量の研究がある。BDNFタンパク質とmRNAレベル(Hock et al 2000年およびproBDNF(Peng et al 2005)と同様に、アルツハイマー病患者の死後の脳では、年齢をマッチさせた対照群と比較して減少し、TrkBレベルの変化はなかった(Savaskan et al 2000)。この減少は、アルツハイマー病の潜在的な前駆段階である軽度認知障害(MCI)(Shimada et al 2014)においても報告された(Flicker et al 1991)。さらに、BDNFの減少した循環レベルもMCIで発見された(Forlenza et al 2010)。BDNFレベルは、疾患の重症度や患者のエピソード記憶能力と相関しており(Peng et al 2005)これらの低下が疾患の病態と関連している可能性を示唆している。結論として、BDNFとproBDNFのダウンレギュレーションは、早期アルツハイマー病に関連する基礎的なメカニズムであると考えられている(Peng et al 2005)。しかし、Laskeら(2006)は、アルツハイマー病初期の患者は後期の患者に比べて有意に高いsBDNFレベルを有しており、また、年齢をマッチさせた対照群に比べても有意に高いことを発見した。このことは、BDNFレベルに二次的に影響を与える可能性のある細胞密度と樹状突起の喪失を伴うため、BNDFのダウンレギュレーションとこの神経変性疾患の発症との間の因果関係を確立することが困難であることを強調している。これに関して、アルツハイマー病患者の海馬および頭頂皮質におけるBDNFおよびTrkB濃度の増加を報告する死後および血清レベルの研究もある(Durany et al 2000年; O’Bryant et al 2009年)。この増加は、βアミロイドの分解による修復に寄与する代償メカニズムと関連している可能性がある。さらに、他の潜在的なモデレーターが、これらの研究で見られる違いや不均一性に寄与している可能性がある。診断基準、疾患のステージ、性別および教育、ならびにBDNFレベルを上昇させることが知られているアセチルコリンエステラーゼ阻害剤または向精神薬などの薬理学的治療の使用の違い(Leyhe et al 2008)または免疫細胞などの中枢神経系以外の他の潜在的な原因に由来する可能性がある(Kerschensteiner et al 1999)。
シナプスの喪失が認知障害の主要な相関関係であり、プラークやもつれの存在よりもはるかに強いことを考えると(Terry et al 1991)最近では、アルツハイマー病を「シナプス病理」として捉える見方がある(Lippa et al 1992; Heffernan et al 1998)。アミロイドβモノマーは、通常、発火シナプスで生成・分泌され、シナプス調節に積極的な役割を持ち(Giuffrida et al 2009年神経細胞の機能に重要な役割を果たしているため、毒性はないが神経保護的である(Abramov et al 2009)。アミロイドβモノマーは、シナプス機能を調節する多くの因子の一つであり、PI3K/AKT経路を介してCREBを活性化し、CREB調節された持続的な転写およびBDNFの放出を導くことができる(Giuffrida et al 2018; Zimbone et al 2018)。このようにして、BDNFは、多くのシナプス調節因子の収束点として作用し得る。アルツハイマー病では、神経毒性のあるβアミロイド(アミロイドβ)オリゴマーが、アミロイドβモノマーの自己組織化から形成される。これらのオリゴマーは、異なる方法で神経毒性を促進することができる(Pearson-LearyおよびMcNay、2012)。Arshavsky(2006)は、記憶関連領域の選択的脆弱性は、実際には、記憶の統合のプロセスに必要とされる特定の細胞の修飾の結果であり得ることを示唆した。アルツハイマー病における重要なイベントは、神経栄養因子(NTF)のレベルにおける病原性アミロイドβ媒介の変化である(Budni et al 2015)。病原性アミロイドβオリゴマーは、PI3K/AKT経路を活性化し、CREB活性化を誘導することができないので、アミロイドβオリゴマーのレベルの増加は、アルツハイマー病患者およびアルツハイマー病のマウスモデルの脳におけるCREB活性化の障害につながる可能性がある(Bartolotti et al 2016)。可溶性アミロイドβオリゴマーは、CREB制御転写(Caccamo et al 2010)およびNMDA型グルタミン酸受容体のトラフィッキング(Snyder et al 2005)などの学習および記憶プロセスに重要なシグナル伝達経路を変化させることが知られている。したがって、これらの経路の変化は、疾患の病因において重要な役割を果たす可能性がある。アルツハイマー病におけるBDNFの変化したレベルは、アミロイドβ蓄積の下流にあり、CREB転写のアミロイドβ誘発性調節障害と関連している可能性がある(Caccamo et al 2010; Pugazhenthi et al 2011)。BDNFはアミロイドβの蓄積を修飾しないとしても、アミロイドβが認知的・構造的側面に及ぼす影響を調節する上で重要な機能を持つ可能性がある(Nagahara er al)。 BDNFは、アミロイドβの分解に寄与し、タウの高リン酸化を防ぐことで、アミロイドβを介した毒性から保護する(Elliott et al 2005; Tapia-Arancibia et al 2008)。この意味で、BDNFはプラーク近傍のミクログリア細胞やアストログリア細胞で発現し、神経炎症から保護することで神経細胞の生存をサポートし(Lindvall et al 1994;Kerschensteiner et al 1999アポトーシスを抑制すると考えられる(Tamatani et al 1998)。一方、アミロイドβは、CREBの減少を介して試験管内試験でBDNF mRNAをダウンレギュレーションし(Rosa and Fahnestock, 2015BDNFの逆行性軸索輸送を阻害し(Poon et al 2011プロBDNFの成熟BDNFへの変換を阻害する(Zheng et al 2010)。また、細胞を死滅させない濃度でも、BDNFによって媒介されるシナプス可塑性を阻害する(Wang et al 2006)。このダウンレギュレーションはプラークの出現前に起こり、アルツハイマー病動物モデル(Francis et al 2012)やMCI(Peng et al 2005)での記憶障害とリンクしている。アミロイドβ誘導毒性のメディエーターであるタウは、それ自体で、試験管内試験および生体内試験の両方で、トランスクリプトIVを介してBDNFを有意にダウンレギュレートすることができる(Rosa et al 2016)。前述したように、多くの研究は、血清BDNFレベルの低下がMCIを有する個体において検出され得ることを発見したので、BDNFの損失がこのシナプス機能障害の初期イベントとして関与し得ることを推測したくなる。しかし、MCI患者を対象とした研究の間にはいくつかの矛盾が存在するため、これらの推測には慎重にならざるを得ない。それにもかかわらず、これらの結果は、アミロイドβアミロイド毒性の調節におけるBDNFの重要な役割を示唆しており、BDNFの調節障害がアルツハイマー病に関連したシナプス機能障害やニーモニック障害に寄与する可能性を示唆している。このデータは、BDNFの発現の変化は、アルツハイマー病の発症の中心的なものではあるが、他のシナプス関連タンパク質の初期の機能変化の影響である可能性を示唆している。特に、これらのタンパク質の 1 つは、その単量体の形で脳のシナプス可塑性と神経細胞の生存に正常な生理学的な役割を持っているし、実際に BDNF の転写と放出を制御することによってこれらの BDNF の変化に積極的な役割を持つことができる アミロイドβ可能性がある (Parihar と Brewer、2010 年)。いずれにしても、記憶や認知に対する BDNF の有益な効果は、そのシナプス修復機能を反映している可能性がある。
また、細胞の微小環境の変化は、神経細胞の生存率や増殖活性の低下を引き起こす可能性がある(Drapeau and Nora Abrous, 2008)が、病理学的な状態での特定の神経細胞の変性に寄与している可能性がある。この間、BDNFレベルの変化は、加齢に関連した海馬の体積変化、および病理学的状態に関連した萎縮に寄与する(Erickson et al 2012)。認知症の兆候のない高齢者では年間1-2%もの海馬の萎縮があるという証拠があるが、アルツハイマー病患者では年間3-5%まで悪化している(Jack et al 1998)。MCI患者では、海馬の容積は認知症への急速な転化を予測する(Jack er al)。
ほとんどの研究では、BDNF遺伝子型がアルツハイマー病発症リスクと関連していないことを報告している(Combarros et al 2004年;西村 et al 2004年;Li et al 2005)[ただし、女性にのみ存在する効果の証拠を参照(Fukumoto et al 2010)]、ゲノムワイドアソシエーション研究では、BDNF Val66Met多型とアルツハイマー病発症リスクとの関連を見つけることはできなかった(Lambert et al 2013)。しかし、いくつかの研究では、Valキャリアにおけるアルツハイマー病リスクの増加を報告している(Ventriglia et al 2002年;松下 et al 2005年;Voineskos et al 2011)。他の研究では、MetキャリアとMCI患者におけるエピソード記憶の低下率および海馬萎縮の増加率との間の関連を発見した(Forlenza et al 2010;Lim et al 2013,2016)が、アミロイドβ蓄積は影響を受けない(Lim et al 2013)。文献の間には一定の矛盾があるが、Val66Metで見られるアルツハイマー病の発症におけるBDNFの役割は、他のBDNF多型でも再現されている(Kunugi et al 2001; Riemenschneider et al 2002)。研究間の一貫性の欠如は、MCI患者ではより多くのBDNFが循環し、アルツハイマー病患者ではより少ないBDNFの、疾患の異なるステージにおけるBDNFの効果の違いに関連している可能性がある(Yu et al 2008; Forlenza et al 2010)。BDNF のレベルの低下は、BDNF 遺伝子の影響を隠して、アルツハイマー病 の神経細胞死とリンクしている可能性がある。アルツハイマー病の重症度が進むにつれて、疾患に起因する病理学的変化の複雑さが増すので、BDNF Val66Met多型とアルツハイマー病との関連は、疾患がほとんどニーモニックパフォーマンスの微妙な変化のみを示す前臨床段階では、より明らかであるべきである(Fahnestock, 2011)。
神経栄養因子は、神経細胞やシナプスの機能障害を緩和するだけでなく、アルツハイマー病における認知機能の低下にも関与する(Fahnestock, 2011)。より高いsBDNFは、将来の認知症やアルツハイマー病の発生に対する保護と関連しており(Weinstein et al 2014衰えの速度が遅くなることを予測している(Laske et al 2011)。同様に、薬理学的または有酸素運動によって誘導されるBDNFレベルの変化は、アルツハイマー病発症リスクのあるヒトおよびアルツハイマー病の動物モデルの両方において、認知機能の改善およびシナプス機能障害の減少に関連している(Baker et al 2010; Intlekofer and Cotman, 2013)。これらの効果は、病変誘発性の神経細胞の変性を予防するBDNFの能力と関連している可能性がある(Morse et al 1993; Kiprianova et al 1999)。この考えによれば、病変後のBDNFの遺伝子導入は、BoNTxによって誘発された内耳皮質の損傷がアルツハイマー病の病理を模倣するために使用されたADモデルにおいて、学習能力とシナプス可塑性の障害を部分的に回復させた(Ando et al 2002)。神経幹細胞移植やCREB結合タンパク質遺伝子導入は、アミロイドβプラークとタウの病理学が蔓延しているにもかかわらず、ADマウスモデルにおいてBDNFを介して空間記憶欠損を逆転させた(Blurton-Jones et al 2009; Caccamo et al 2010)。最近の研究では、アミロイドトランスジェニックマウスの内耳皮質への BDNF の送達は、アミロイドプラーク負荷の変化なしに、神経細胞の萎縮とシナプスの損失を逆転させ、神経細胞のシグナル伝達を調節し、関連するニーモニック障害を減少させた (Nagahara et al 2009) BDNF はアミロイドに依存しない機構を介してその保護効果を発揮することができることを示している。さらに、7,8-ジヒドロフラボン(7,8-DHFネオトロフィン(神経栄養因子産生を刺激するヒポキサンチン誘導体)およびニューロペップ-1(BDNF調節ペプチド)は、アルツハイマー病の動物モデルにおいて、あるいは前臨床試験においても記憶障害を逆転させることが示されている(Glasky et al 1994; Deviおよび大野、2012; Shin et al 2014)。このようにして、BDNFは、神経変性に対する運動とカロリー制限の保護効果を媒介し得る(Vaynman et al 2004b)。このことは、現在進行中の道筋であるMCI患者の認知症発症リスクを予防したり、認知症への進行を遅らせることができる行動介入を開発する必要性を強めている。これらの新しい道筋の多くは、抗酸化的な食事、環境の豊かさ、社会的相互作用から、身体的または認知的な運動に至るまでのライフスタイルの変化を、潜在的な介入策として指摘している(Fahnestock et al 2012)。
慢性ストレスがBDNFに及ぼす影響と精神疾患へのリンク
慢性ストレスは、アルツハイマー病や認知障害の発生に関与する因子として知られている(Wilson et al 2007c)。生物の生理学的状態の制御に関与する構造は、慢性ストレスによって変調を受けやすい。特に、海馬は、回避的な状況への長時間の曝露によって変化する(Kim et al 2015)。これらの異常は、空間記憶課題および新規物体認識の欠損(Luine et al 1994;Vedhara et al 2000;BakerおよびKim、2002)に反映されるだけでなく、長期増強(LTP)の抑制(Artola et al 2006)のようなシナプス可塑性プロセスの変化(Shors et al 1989;KimおよびYoon、1998)にも反映される。慢性的なストレスは典型的にはBDNFの海馬発現を低下させる(Smith et al 1995; Murakami et al 2005)が、ストレスの原因が消失すると、海馬は認知障害やシナプス障害の改善を示す(Sousa et al 2000; Hoffman et al 2011)。
これまでに、慢性ストレスによって引き起こされる劇症的な影響を軽減するために、さまざまな戦略が評価されていた。慢性的な拘束ストレスプロトコルの前にラット海馬にBDNFを注入すると、MWMと長期増強(LTP)の学習と記憶の障害から保護することができる(Radecki et al 2005) また、ストレスプロトコルの前にBDNFに対するshRNAを投与すると、ストレス後の休息期間中に空間参照記憶の障害を回復させることができる。
運動は、BDNFの脳レベルを増加させるためのよく知られた戦略であるので、慢性的なストレスに対するBDNFの直接投与の効果を模倣する非侵襲的な方法として提案されている。Radahmadiら(2016)は、慢性ストレスプロトコル後に運動に反応して海馬のBDNFが増加することを発見した。一方、Diefら(2015)は、30日間の水泳トレーニングプログラムに従った動物が、慢性ストレスにさらされた後にT迷路でのパフォーマンスを向上させ、この向上は海馬BDNFのアップレギュレーションと相関していることを示した。また、Kwonら(2013)は、ストレスプロトコルを開始する12週間前からトレッドミルランニングを開始し、それを継続して行った慢性的なストレスを受けたマウスにおいて、BDNFが介在することでMWMのパフォーマンスが改善されたことを報告している。
Shafiaら(2017)は、心的外傷後ストレス障害のラットモデルにおける運動(単独またはフルオキセチンとの併用)の緩和効果を調査した。このモデルでは、恐怖条件付けと消息、抑制的回避タスク、場所認識記憶の障害を示している。興味深いことに、ほとんどの試験において、併用治療の効果は運動のみで得られたものと同様であった。また、Garzaら(2004)の研究と一致し、運動単独と運動+抗うつ薬は海馬のBDNF発現を増強するが、抗うつ薬単独では増強しないことも明らかにした。
エンリッチド環境(EE)は、標準的な住宅条件と比較して海馬のBDNFレベルを増加させることが示されている(Novkovic et al 2015)。したがって、EEは、慢性ストレスの影響からの全身および神経の回復を促進するための簡単な方法である可能性がある。Shilpaら(2017)は、10日間の不動化(2時間/日)に続くEEへの曝露が、橈骨腕迷路のバージョンの空間記憶欠損と抑うつ的な行動を改善することを示した。回復は、BDNF’sを含むいくつかのシグナル伝達カスケードの変調を介して達成されるようである。
Seongら(2018)は、EEは、慢性ストレスプロトコルに動物を曝露した後に発生した場合、フルオキセチンと同様に有効であることを示唆したが、治療の成功を確立するためには、ストレスプロトコルの有効性の追加の測定が必要であろう。興味深いことに、EEまたはフルオキセチンのいずれかを投与されたラットの海馬では、対照群(ストレスを受けたが後処理を行わなかった)と比較してBDNFレベルが増加していた。慢性ストレスがうつ病様症状と関連していることを考えると(Garcia, 2002; Calabrese et al 2009)抗うつ薬を用いて得られた結果は驚くべきものではないように思われる。慢性ストレスに対する抗うつ薬の作用機序やBDNFの関与についても広く研究されているが、一貫した結果は得られていない。Larsenら(2010)は、慢性的な抗うつ薬の投与により、慢性的な予測不可能なストレスに起因する抑うつ様行動が逆転し、背側海馬の顆粒細胞層におけるBDNF mRNAの発現が増加したことを示した(ストレス因子への曝露とは無関係に)。別のストレスモデルを用いて、Tsankova ら(2006)は、社会的敗北ストレスプロトコルに曝露されたマウスにイミプラミンを慢性的に(急性ではなく)投与することで、行動変容を正常化することができた。
レスベラトロールのように、もともと他の疾患の治療に使われていたが、動物モデルではある程度の抗うつ効果を示している化合物に注目した研究もある。レスベラトロールとクルクミンは、慢性的に投与すると、それぞれ慢性的な拘束と予測不可能なストレスによって誘発される行動および生化学的変化を抑制し、それらの効果はBDNFの発現の増加によって媒介されると考えられている(Xu et al 2006; Zhang et al 2017)。Zhouら(2017)は、バイペリデンが慢性的な予測不可能なストレスによって誘発されるうつ病様症状を緩和し、ショ糖選好性、新規性抑制摂食、強制水泳試験のパフォーマンスを増加させることを示している。重要なことに、これらの効果はTrkBアンタゴニストK252aによる前処理によって阻害された。
これらのエビデンスは、BDNFが海馬におけるストレス誘発効果からの回復を促進することを示唆しているので、興味深い疑問が浮かび上がってく。BDNFは、ストレッサーの存在下で慢性ストレスの影響を逆転させることができるのだろうか?
Radahmadiら(2016)は、ストレス因子に曝露されている間の運動(「保護運動」)の効果を試験した。予防的運動や治療的運動とは異なり、BDNF海馬レベルの増加は認められなかった。一方、Millerら(2018)は、マウスを用いて、運動とストレスが共起している場合の慢性的なストレス関連障害に対するランニングの潜在的な緩和効果を探った。彼らは、運動した群(ストレスを受けた群と受けていない群)の両方で、鎮静した群と比較して、TrkB受容体の発現レベルが高いことを発見し、運動によるストレスの負の結果の緩和がBDNFによって媒介される可能性があるという仮説を支持した。
慢性ストレスプロトコル(期間とストレス因子の種類)によって、異なる対照的な結果が得られている(Vasquez er al)。 BDNFは、慢性ストレスの動物モデルにおける正常な認知表現型の回復の背後にある重要な基礎分子であるように思われる。BDNFは、非侵襲的なプロトコルおよび/または薬剤(その一部は臨床試験で使用されている)で増加させることができるという事実は、ヒト治療のための魅力的なものとなっている。
ストレス、特定の遺伝子、および精神疾患の発生との間のリンクは、広範囲に研究されており(Abbott et al 2018それらの多くの病因における遺伝子環境相互作用の因果関係が推定されている(Rogers et al 2019)。実際、精神疾患は遺伝子と環境の相互作用から出現する臨床的実体と定義することができる(レビューは、Gallo et al 2018)。
精神疾患とBDNF
ここ数年、動物モデルや臨床研究からの証拠は、神経栄養因子の調節障害が双極性障害(BD)大うつ病性障害(MDD)統合失調症(SZ)の病因に重要な役割を果たしている可能性を強く示唆している(Duman and Monteggia, 2006; Autry and Monteggia, 2012; Nieto er al)。 神経可塑性におけるBDNFの役割から、BDNFの発現と記憶障害に伴う認知症状との間には関連があると考えられる(Autry and Monteggia, 2012)。
ニーモニック領域は、BD(Zhou et al 2018; Lin et al 2019)、MDD(Roca et al 2015; Ahern and Semkovska, 2017)、または統合失調症(Ricarte et al 2017)のような異なる精神疾患において一般的に影響を受ける。さらに、BDおよびMDD患者の死後脳組織の研究では、BDNFレベルが、海馬(Reinhart et al 2015)および前頭前野(Dwivedi et al 2003)のような記憶プロセスに関与する構造物において低下していることが報告されている。統合失調症の場合、死後の脳組織分析では、より議論の余地のある結果が示されている。前頭前野と海馬で BDNF の発現が増加したという研究もあれば(Takahashi er al)。 BDNFはもともと、BD、MDD、統合失調症、またはアルツハイマー病の早期発見のための病理学的な脳機能の実行可能な指標として考えられていたが、BDNFは多くの神経精神疾患の非特異的なマーカーであるように思われるため、バイオマーカーとしての識別力は非常に限られている。
BDは遺伝的要因と環境的要因の相互作用から出現する神経精神疾患であり、マニアックなエピソードと抑うつ的なエピソードの切り替えが特徴である(レビューは、Harrison et al 2018)。BDNFシグナル伝達が、BDのために使用されるいくつかの薬理学的治療法によって生じる生理学的効果に関与していることが提案されている(Shaltiel et al 2007)。また、BD患者の初回エピソードではsBDNFが減少し、1年間の薬理学的介入後にはsBDNF濃度が上昇することが示されている(Palomino et al 2006)。また、sBDNFはマニアックなエピソードやうつ病のエピソードの期間と正の相関があることが報告されている(Dias et al 2009)。この証拠は、エピソードに関連した脳構造の変化が末梢性BDNF濃度と関連している可能性を示唆している。Caoら(2016)は、Val66Met BDNF多型を呈するBD患者では、対照群およびMDD患者と比較して海馬体積が減少することを示している。さらに、海馬体積とエピソード記憶課題のパフォーマンスとの関連性を提案している。別の研究では、BDNF Val66Met多型を有するBD患者において、末梢のBDNFがエピソード記憶課題におけるパフォーマンスと相関することが示されている(Chang er al)。 これに沿って、最近の研究では、sBDNFの高レベルが、言語記憶を含む良好な認知パフォーマンスと関連していることが示されている(Mora et al 2019)。この証拠は、BD患者におけるBDNF発現の変化が、エピソード記憶障害に関連する海馬形成の構造的変化を生じさせる可能性を示唆している。にもかかわらず、ほとんどの研究では、注意力や作業記憶などのエピソード記憶課題で良好なパフォーマンスを発揮するために重要な他の認知領域での変化が報告されている(レビューについては、Sole et al 2018)。このように、BDNFの調節障害は、より複雑な症状のプロファイルの出現と関連している可能性がある。このような理由から、BDにおけるBDNFとエピソード記憶との関係は依然として不明である。
大うつ病性障害は、世界的に最も一般的な気分障害の一つであり、快楽活動の追求の欠如と否定的思考の存在によって特徴づけられる(Kim and Moore, 2019)。抗うつ薬として使用されるほとんどの一般的な薬剤は、セロトニントランスポーター(SERT)をブロックし、ラペー核後シナプス内の細胞外セロトニンを増加させることから(レビューのために、Teissier et al 2017セロトニン放出のミスバランスが抑うつ症状の病因と関連している可能性が提案されている(レビューのために、Liu et al 2018)。BDNFは、大脳皮質における5-HT含有ニューロン末端の成長および再構築を調節し(Mamounas et al 1995ラペー核におけるBDNFの投与は、ラットにおける抑うつ症状に関連する行動を減少させる(Siuciak et al 1997)。さらに、MDD患者は、エピソード記憶(Jayaweera et al 2016)を含む様々な領域で認知機能の低下を示すが(Zuckerman et al 2018これらの障害は最近になって初めて詳細に研究された。多くの研究は、sBDNFがMDDで減少することを示している(Molendijk et al 2011)。Oralら(2012)は、うつ病エピソードを再発している患者は、最初のエピソードで罵倒していた患者と比較して、sBDNFのレベルが低いことを発見した。興味深いことに、抗うつ薬治療はsBDNF濃度を増加させる(Molendijk et al 2011)が、sBDNFの低下がこの病理学で観察される記憶課題のパフォーマンス低下と相関するかどうかについては、コンセンサスが得られていない(Oral et al 2012)。
統合失調症の場合、さまざまな研究により、sBDNFのレベルが異なる領域の認知パフォーマンスと相関することが示されている(Carlino et al 2011)。統合失調症患者において基底sBDNFが増加しているか減少しているかについてはコンセンサスが得られていないにもかかわらず(Fernandes et al 2015いくつかの研究では、記憶力パフォーマンスとsBDNFレベルとの間に相関があることが示されている(Zhang et al 2012; Hori et al 2017)。興味深いことに、統合失調症における薬理学的介入のプロ認知効果がBDNFによって媒介される可能性があるという証拠がある(Einoch et al 2017)。例えば、Zhangら(2018)は、オランザピンによる12週間の慢性治療により、BDNFの血漿中濃度の上昇がもたらされたことを明らかにしている。さらに、BDNF濃度は記憶力のRBANSスケールで認知パフォーマンスと正の相関を示した。薬理学的介入がニーモニック症状の軽減に有効であっただけでなく、特定の認知領域、特に記憶力を強化するために、異なる認知訓練プロトコルも設計された(Guimond et al 2018; O’Reilly et al 2019)。Fisherら(2016)は、統合失調症患者を対象にコンピュータによる認知トレーニングを実施し、このプログラムに曝露された患者は、対照群と比較して、より高いレベルのsBDNFを提示した。彼らは記憶力の向上を観察したが、sBDNFと記憶力の間の因果関係は明らかにされていない(Heitz et al 2018)。
治療戦略の利益の根底にある潜在的なメディエーターとしてのBDNF
上記の結果を考慮すると、加齢に伴う認知機能障害と神経精神疾患に関連した認知機能障害の両方の治療ターゲットとしてBDNFを使用することを提案したくなるだろう。しかし、BDNFの脳関門への浸透性が悪く、血漿上での半減期が短いことから、このような考えを実用化するには多くの困難があることがわかっている。さらに、遺伝子治療やBDNF模倣療法は、多くの副作用に遭遇しており、その効果は放棄されている(Thoenen and Sendtner, 2002)。臨床的にもっともらしい代替的アプローチとしては、内因性BDNFの産生を自然に増加させることが考えられる(Balkowiec and Katz, 2000)。この意味で、疫学研究は、身体運動、食事および社会活動、教育などの多くの生活様式因子が、認知機能障害および認知症の長期的なリスクを低下させる可能性があることを示唆しており(Larson et al 2006; Wilson et al 2007b; Verburgh、2015)動物研究は、この考えと一致している(Adlard et al 2005)。
特に、孤独な人では、アルツハイマー病発症のリスクが非常に高くなる(Wilson et al 2007a)ことから、社会的相互作用が病気の発症を遅らせる可能性があることが示唆されている。身体活動は、病気の進行に影響を及ぼす可能性のあるもう一つの生活習慣因子である。疫学的研究と介入研究の両方からの最近の報告は、病理学的状態における神経可塑性を増加させるための戦略として身体活動を使用するという考えを補強している(Gregory et al 2012)。運動や社会的相互作用などの行動が学習や記憶プロセスに及ぼす影響については、十分に研究されてきた。研究者らは、頻繁な社会活動と認知機能の改善との間に関係があることを発見している(Stern, 2006)。同じ方向で、身体運動による認知機能の改善も十分に報告されている(Smith er al)。 身体運動は、脳の構造的変化を改善するだけでなく、加齢に関連した認知機能の低下からも保護することが示されている(Voss et al 2013; Duzel et al 2016)。
ライフスタイルの実施が脳に影響を与える能力を持っていることを考えると、中心的な問題は、エネルギー代謝や社会的刺激のこれらの変化がどのように脳の構造に影響を与え、認知機能を改善するためにシナプス可塑性や分子システムと相互作用するのかということである。
現在のモデルでは、これらの生活習慣因子の影響を、血管系や神経栄養・神経伝達物質支持系の変化という観点から説明している(Vivar et al 2013)。これらの変化の中で、前述の生活習慣操作の全てに存在するのはBDNFだけである。BDNFは、APP/PS1マウスにおいて、対偶者との社会的相互作用によって増加し、記憶障害の逆転につながる(Hsiao et al 2014)。また、BDNFレベルの低下は肥満や高血糖などのエネルギー代謝障害と関連していることから、BDNFはエネルギーの恒常性の調節にも重要であると考えられる(Rios et al 2001)。実際、高脂肪食は海馬のBDNFレベルを低下させ、学習および記憶を損なうことが示された(Molteni et al 2002a)。さらに、BDNFの増加は、最近メタレビューで議論されたように、運動後に報告された最も一貫した変化の一つである(Szuhany et al 2015)。運動によって誘発された認知機能の改善におけるBDNFの基本的な役割を支持する最も頑健な実験は、BDNFの遮断が運動によって誘発された認知機能の改善を障害した実験である(Vaynman et al 2004a; Garcia-Mesa et al 2014; Kim and Leem、2016)。Vaynmanら(2004a)は、運動によって誘発されたMWM課題における学習の増強が、運動期間中に投与されたTrkB-IgGによって阻害されたことを示した。さらに、運動は閾値以下の経験(物体位置記憶課題)の獲得を可能にし、この効果はBDNFに依存していた。同様の効果は、BDNF siRNAを用いてBDNFの機能を低下させたIntlekofer and Cotman(2013)によって報告されている。
実用性を考えると、身体活動は治療/予防戦略としてより可能性のあるライフスタイルの変化である。研究の大部分は、神経認知機能を維持・改善するための非薬理学的かつ低コストの治療法として有酸素運動の考えに焦点を当てている(Hillman et al 2008)。いくつかの縦断的なトレーニング研究のメタアナリシスでは、タスクの種類に関係なく運動が認知機能を改善することが示されている(Colcombe and Kramer, 2003)。最近の研究では、この効果が確認され、海馬依存性の空間記憶や文脈記憶のタスクだけでなく(Albeck et al 2006; Luo et al 2007)、HPよりも辺縁皮質に大きく依存していると考えられている物体認識などの非空間記憶も運動によって改善することが示されている(Hopkins and Bucci, 2010)。有酸素運動の1回のセッションは長期記憶に恩恵を与えるが、短期記憶には影響しない(Roig et al 2013)。さらに、運動は高齢動物において、経験後の制限された時間窓の間に特異的に記憶を改善することができ、記憶の定着過程における運動の特異的な役割を補強している(Snigdha et al 2014)。興味深いことに、多くの研究では、運動介入の有効性を評価する際に性が重要な変数である可能性があり(Barha et al 2017)これはBDNFの性特異的な作用機序と一致している(Chan and Ye、2017)。介入のタイミングも関連している可能性がある。外傷性神経損傷のいくつかのモデルでは、損傷に先立って介入が行われた場合、BDNFの誘導は神経細胞の変性を減少させ、認知転帰を改善した(Bruce-Keller et al 1999年;Zhang et al 2011)。運動の効果はやや短命であるが(Alaei et al 2007; Hopkins and Bucci, 2010)、一部の介入は損傷後に行われても転帰を改善することがある(Griesbach et al 2004)。しかし、効果の持続期間は、運動暴露中の対象者の年齢に依存する。思春期の運動訓練は物体認識タスク直後のBDNFレベルには影響しなかったが、タスクの2週間後に行われた場合、辺縁皮質のBDNFレベルの増加につながった。成人期では、運動はタスク直後にBDNFレベルを増加させたが、この効果は2週間未満で短命であった(Hopkins et al 2011)。これらのデータは、運動が学習に関連した可塑的な変化を年齢に依存して調節する可能性を示唆している。運動の利点は多くの成長因子に関連しているが、数週間の継続的な運動後に一貫して上昇するのはBDNFだけである(Molteni et al 2002b)。この神経トロフィンは海馬および皮質領域で急速に誘導され(Cotman and Berchtold, 2002)運動後数日間は上昇したままである(Erickson et al 2010)。さらに、BDNFレベルは、運動プログラム終了後数日後であっても、その後の閾値以下の運動暴露によって、急速にピークレベルまで再誘導されることがある(Berchtold et al 2005)。
運動は一様に脳領域に影響を与えるのではなく、より選択的に脳領域に影響を与えることから、運動誘発性可塑性に関与する分子経路の場所特異性が示唆される。興味深いことに、運動がBDNFの発現に及ぼす影響は、前海馬、小脳、前頭前野などのニーモニック機能に関連する領域では起こるが、線条体のような他の領域では起こらないことが明らかになった(Neeper et al 1996)。このことは、運動によるsBDNFレベルの増加が海馬体積の変化と関連しており、その変化が空間記憶能力と相関していることを示す以前の報告と一致している(Erickson er al)。
運動が可塑性に及ぼすプラスの効果は、BDNFレベルが低下している高齢者に特に関連している(Erickson et al 2010)。老化した脳にはまだ可塑性があることを考えると、生活習慣に関連した経験は、可塑性プロセスを募集し、老化の有害な影響を打ち消す方法となり得る(Churchill er al)。 老化した動物では、海馬の神経新生とBDNFレベルは運動によって増加することがある(Marlatt et al 2012)。これらの効果は、若年動物で見られるものほどロバストではないが(van Praag et al 2005)BDNFの増加は、精神的な衰えを改善し、記憶機能を改善するようである(Erickson et al 2012)。実際、長期的な運動プログラムは、ニーモニック障害の最初の兆候が現れた後でも、これらの認知障害を救済することができる(Tsai et al 2018)。最近の臨床試験では、MCI患者に対する有酸素性心肺トレーニング対ストレッチの影響を検討し、トロピック因子およびAb-40およびAb-42循環レベルに関連した性差認知改善が報告された(Baker et al 2010)。
また、身体活動は認知症の発症リスクの低下と関連している(Friedland et al 2001)。多くの臨床試験では、軽度のアルツハイマー病患者がフィジカルトレーニングプロトコルを受けた場合、認知機能の改善および精神症状の発生率の低下が指摘されている(Hoffmann et al 2016年;Cammisuli et al 2018)。しかし、いくつかの研究では、環境の充実が身体的運動のみよりも認知に有益である可能性が示唆されている(Wolf et al 2006;Cracchiolo et al 2007)。
協調運動(Niemann et al 2014)や認知トレーニング(Basak et al 2008;Hall et al 2009)もまた、高齢者の灰白質可塑性を誘導し、認知機能を高めることができる。しかし、事前訓練によって生じる改善は通常、領域制限的であり、過去の経験によって影響を受けた記憶系にのみ作用する(Markowska and Savonenko, 2002; Green and Bavelier, 2008)。それにもかかわらず、様々なタスクや文脈に対して事前経験が一般化した利点を示す報告もある(Buschkuehl et al 2008)。2年間の間に栄養および心血管リスク因子をコントロールした身体的および認知的トレーニングの組み合わせは、認知症を発症するリスクのある高齢者の認知パフォーマンスの改善につながった(Ngandu et al 2015)。動物実験では、環境エンリッチメントは多面的な介入と見ることができる。それは、社会的エンリッチメント、身体運動、環境変化からなり、BDNFレベルを増加させ、物体認識、空間学習、運動能力などの異なる領域における学習と記憶を強化することが示されている(Greenough et al 1972; Frick and Benoit、2010)。感覚の豊かさと身体活動の両方の組み合わせは、これらの要素が単独で与えられた場合よりも、神経細胞の可塑性に大きな影響を与える。このことが、ヒト研究における独創的な治療法の提案の動機となった。例えば、以前の身体活動プログラムよりも高い認知的要求と協調的要求を持つ新規なダンスプログラムは、同等の心血管要求を持つ従来のスポーツプログラムよりも、高齢者グループにおいてより多くの灰白質増加を誘導した(Muller et al 2017; Rehfeld et al 2018)。
認知機能に対する運動の効果に関する重要な問題の1つは、心血管/筋肉活動と中枢神経系との間のクロストークの原因となるメカニズムを確立することである。筋肉のより高い代謝率は、その後可塑性に関連する遺伝子発現をアップレギュレートし、損傷から脳を保護する可能性のあるシグナル分子の分泌につながる可能性がある。このようにして、BDNFのような可塑性分子が上昇すると、学習に関連するその後の変化に備えて脳を活性化させたり、学習経験中に活動に依存した方法で選択的に分泌されたりする可能性がある。その結果、運動は学習や記憶に重要な一般的な分子機構の活性を高める可能性がある。この見解によれば、CREB、NMDARsサブユニット、BDNFなどの分子は運動後に特に誘導され(Molteni et al 2002b海馬のような記憶形成に重要な脳領域は身体活動によって選択的に影響を受ける(Vaynman et al 2004b)。
BDNF の運動による神経保護効果は、シナプス可塑性や構造可塑性の調節を介したものであると考えられる。運動によって誘発される可塑性の変化には、神経新生の増加(van Praag et al 1999b; Merkley et al 2014神経樹状突起のより大きなアーボライゼーションおよびシナプス形成(Eadie et al 2005; Dietrich et al 2008ならびに長期増強(LTP)の振幅の増加および閾値の減少(van Praag et al 1999a)が含まれる。これらの効果はBDNFレベルの同時上昇を伴うので(Ding et al 2006; Ferris et al 2007)、BDNFが潜在的なメディエーターである可能性がある。さらに、より大きな樹状突起の複雑性および神経新生を伴う血管化の増加(Morland et al 2017)は、運動後の海馬体積の増加を説明し得る(Erickson et al 2011)。神経新生の加齢に関連した進行性の低下は、神経新生促進因子のレベルが低い非寛容な微小環境と関連している。しかしながら、この微小環境は、依然として環境変化に応答しており、増殖のための分子的合図を提供するために、後期であっても刺激することができる(van Praag et al 2005年;Kronenberg et al 2006年;Lugert et al 2010年;Silva-Vargas et al 2013年;Smith et al 2018)。BDNFのような成長因子レベルの変化は、疾患や老化の結果として見られる神経新生の減少の根底にある可能性があり、老化した脳は成長因子の神経新生刺激効果に応答する能力を保持している。
BDNFの外因性適用は、高齢動物の海馬の神経新生レベルを回復させることができる(Scharfman and Maclusky, 2005)。同様に、運動誘発性の神経新生の増加は、身体活動に依存した学習や記憶の強化に必要である(Clark et al 2008)。このことから、神経新生がBDNFによって媒介されるこの認知機能の増強の基質である可能性があるという考えに至った(Bekinschtein et al 2011)。
BDNF のもう一つの潜在的な有益な効果は、正常および病理学的老化の動物モデルにおいて、神経細胞を酸化的損傷や興奮性ストレスから保護する能力(Cheng and Mattson, 1994; Wu er al)。 実際、BDNFは神経系に対する様々な種類の障害に応答してアップレギュレーションされている(Hsu et al 1993; Yang et al 1996; Hayashi et al 2000)。運動レジームは、老化した動物に特徴的な酸化的細胞損傷の蓄積および機能障害を減少させることができ(Radak et al 2001)BDNFの選択的な抑制は、神経細胞の興奮毒性に対する脆弱性を増加させ(Jiang et al 2005アミロイド生成を増加させる(Matrone et al 2008)。
加齢や精神疾患、疾患に関連した記憶障害の症状を改善したり、予防したりするために、体系的な運動プログラムを確立することには明確な興奮があるはずであるが、この治療法にはまだ多くの限界が存在する。このアプローチの最も重要な欠点の一つは、高齢者の慢性疾患の高い有病率が運動パフォーマンスと実行可能性に影響を与え、特に高強度のプロトコルの場合、治療の潜在的なリスクを増大させることである(Hundley et al 2001)。これは、アドヒアランスが低いことが知られているこれらの種類の治療に従うモチベーションに直接影響を与える(Kosse et al 2013)。治療のアドヒアランスに影響を与えることなく、高齢の被験者の認知や神経生理学にポジティブな影響を与えることができるので、より低い強度のプログラムの方が良い選択かもしれない(van der Bij et al 2002)。また、時間がないことも、有酸素運動の定期的な練習を避ける主な理由の一つであることが報告されている(Gillen and Gibala, 2014)。そのため、より効率的なトレーニングプログラムの開発が望まれている。Pietrelliら(2018)は、生後2~18ヶ月間の低・中程度の強度の有酸素運動の実践が、前頭前野や海馬など様々な脳構造のBDNFを増加させ、加齢による正常な衰えを減少させることを動物で実証した。さらに、このプロトコルは、新規物体認識と文脈識別能力の両方を改善した。Szuhanyら(2015)は、ヒトのBDNFレベルに対する急性および定期的な運動の影響を調べるためにメタアナリシスを実施した。彼らは、1セッションの運動による中等度の効果は、定期的な運動プログラムの後に実行された場合に増強されることを発見した。彼らは、運動の各エピソードはBDNF活性の「用量」をもたらし、この「用量」の大きさは、定期的な運動によって時間の経過とともに増強されることを示唆している。
一方で、組換えBDNFを直接治療に利用しようとする試みには、多くの方法論的な限界があることがわかっている。BDNFをベースとした治療法を臨床応用する上での主な問題の一つは、脳への送達の問題と、組換え蛋白質の半減期が非常に短いため、より長い間隔で発現を持続させることが課題となっている。この意味で、いくつかの前臨床研究では、BDNF を細胞貫通ペプチドに融合させ、AAV コンストラクトに充填し、これらの AAV コンストラクトを中枢神経系に経鼻的に送達することを目的とした研究が行われている(Arregui et al 2011; Ma et al 2016)。A10日間のAAV処置は、マウスにおけるうつ病様行動を緩和することができ(Ma et al 2016BDNF線条体ニューロンへのAAV送達は、神経新生を誘導し、HDの動物モデルの寿命を増加させた(Benraiss et al 2012)。有益ではあるが、AAVの使用は、生物分配の困難さおよびウイルスに対する免疫原性によって制限されてきた。代替的なアプローチは、BDNFおよび他の有益な因子を発現することができ、炎症およびアポトーシス部位への選択的なトロピズムによって脳の損傷部位に移行することができる幹細胞移植の使用である(Kidd et al 2009年;Joyce et al 2010年;Fink et al 2015年;Deng et al 2016年;Pollock et al 2016)。間葉系幹細胞移植は、HDのマウスモデルにおける行動障害の改善を示しており、また、萎縮が減少し、神経新生が増加することにより、神経変性過程を遅らせている(Dey et al 2010; Benraiss et al 2013; Pollock et al 2016)。
ニューロンネットワークにおけるBDNFシグナル伝達を増加させる「自然な」非侵襲的な方法としての運動の使用に代わる可能性として、既に臨床使用可能な薬剤の投与がある(Stranahan et al 2009)。多くの薬剤は、BDNFレベルに影響を与えることができる。メマンチンおよびドネペジルは、用量依存的にBDNFレベルを著しく増加させるアルツハイマー病の症状を緩和するために使用される医薬化合物である(Marvanova et al 2001年;Leyhe et al 2008年;Meisner et al 2008)。
アンパカインは、BDNFレベルに影響を与える興奮性伝達を増加させることができるので、良い候補である。ラット海馬スライス培養において、臨床的に試験された非常に短い期間のアンパカイン処理は、曝露後数日間持続するBDNFタンパク質レベルの上昇をもたらした(Lauterborn et al 2003年)。最近出現したもう一つの治療法の可能性は、BDNFレベルを増加させるための経頭蓋磁気刺激(TMS)の使用である。TMSは、老化したマウスで通常減少していたBDNFおよびTrkBのレベルを回復させ、空間記憶を改善した(Zhang et al 2015)。
結論として、加齢に伴う認知機能の低下や病的変性を軽減するいくつかの環境や生活習慣の介入は、BDNFの産生を増加させることも可能であり、BDNFが神経保護的であることを示唆している(図1)。認知訓練が記憶領域のセットに選択的に作用する集中的なアプローチであり、薬物が侵襲的であることを考えると、潜在的な治療アプローチを考えるとき、運動は依然として「お気に入り」である。
結論
BDNF は、シナプス可塑性や記憶過程において重要な役割を果たしているが、病態における認知症状の病因における BDNF の役割は明らかにされていない。BDNF が介在する可塑性の変化は、記憶の統合の基盤となる神経生物学的基質の一つとして提案されており、BDNF の変化は、神経変性疾患や精神神経疾患の動物モデルや正常な状態での記憶能力に直接影響を与えることが示されている。
ヒトの死後脳組織では、BDNF の発現は海馬や扁桃体などの記憶関連構造で高くなっている。しかし、ヒトでは、BDNF の発現をコントロールすることができないため、記憶と BDNF の関係は未だに相関関係にあると考えられている。このような困難さにもかかわらず、多くの研究では、BDNF の発現をアップレギュレートまたはダウンレギュレートした条件下での記憶パフォーマンスを解析することで、これら 2 つの要因の間に因果関係を確立しようと試みられていた。
脳内BDNFの発現はsBDNF濃度と相関していることから、この関連性を利用して、ヒトの正常・病理学的条件でのニーモニック機能にBDNFが関与していることが広く研究されていた。実際、この血中測定可能なタンパク質の濃度は、さまざまな障害における記憶障害と相関している。さらに、Val66Met 多型による BDNF の輸送および放出の変化は、健常者および疾患者における BDNF 濃度とニーモニック性能および記憶関連領域の構造変化との相関にも使用されている。
運動、フルオキセチンの慢性投与、認知トレーニングなどの介入は、sBDNFの集中力を高め、記憶課題のパフォーマンス向上と相関することが示されている。BDNFを神経変性疾患や精神神経疾患のバイオマーカーとして使用するという当初の考えは、BDNFレベルの変化は多くの病態に共通しており、BDNFの識別価値と有効性を強調するために破棄された。しかし、本研究で得られたデータを考慮すると、BDNF は、この認知領域の障害を共有する多くの病態に共通するニーモニック症状の発生や進行に特異的に関連するマーカーとして考えられることが示唆される。さらに、BDNF は、これらのニーモニック症状と闘うことができる治療法のほとんどを収束させる共通の因子であることが示された。