Contents
Biological Properties of Vitamins of the B-Complex, Part 1: Vitamins B1, B2, B3, and B5
www.ncbi.nlm.nih.gov/pmc/articles/PMC8839250/
オンライン公開 2022年1月22日
概要
この総説は、必須ビタミンB1、B2、B3、B5に関する現在の知見をまとめたものである。これらのビタミンB群は食事から摂取しなければならないが、ビタミンB3は例外で、アミノ酸のトリプトファンから合成することも可能である。これらのビタミンはすべて水溶性であるため、食品を洗ったり茹でたりすると水に移行して一部が失われること、細胞内への浸透には膜輸送体が必要なこと、過剰分は速やかに腎臓から排出されるため安全であることなどが、主な特徴である。ビタミンB群の治療的利用は低ビタミン血症などに限られるが、一般に安全性が高いため、他の病態での利用も検討されている。ビタミンB3の一種であるニコチン酸は、グラム投与で脂質低下作用があることが知られているため、唯一の例外である。また、論文では以下のように総括されている。(i) 生体液中のビタミンB群の現在の検出方法 (ii) これらのビタミンの食品およびその他の供給源(一般的な加工および保存方法がその含有量に及ぼす影響を含む) (iii) それらの生理的機能。
キーワード:チアミン,リボフラビン,ナイアシン,パントテン酸,必須ビタミン
1. はじめに
20世紀に入り、栄養所要量の調査から重要な発見があった。当初は脂溶性のビタミンAと水溶性のビタミンBの2つの化合物に過ぎないと考えられていたが、その後の研究により、ビタミンBは溶解度を同じくする様々な化合物の複合体であることが明らかになった。本総説では、「ビタミンB群」に属する個々のビタミンの発見、供給源、生理的役割、薬理学的利用、潜在的毒性、相互作用について簡潔にまとめている。第一部は、ビタミンB1-チアミン、B2-リボフラビン、B3-ナイアシン、B5-パントテン酸に関するもので、第二部では、「B群」の残りのメンバーに関する情報を提供する。
2. チアミン-ビタミンB1
2.1. はじめに・性質
1897年、最初のビタミンとしてビタミンB1が発見され、当時は「ビタミン」と呼ばれていた。1926年に単離され、10年後に合成された。この物質はアミノ基を持つため、”vital amine” (「生命のアミン」)と呼ばれ、前述のように、当初は微量栄養素のグループ全体、つまり以前はビタミン、現在はビタミンとして知られているものに名前が付けられた[1]。ビタミンB1は、低ビタミン血症の神経症状を防ぐことから、以前は「アニューリン」とも呼ばれていた。現在では、むしろチアミンと呼ばれている。この用語は、分子内に硫黄とアミノ基の両方が存在することを反映している。チアミンは、ピリミジン(正確には4-アミノ-2-メチルピリミジン)とチアゾール/4-メチル-5-(2-ヒドロキシエチル)-チアゾリウム/環がメチレン橋で結合した水溶性の化合物である(図1)[2,3,4,5]。
図1 チアミン(ビタミンB1(上))とチアミンピロリン酸(TPP(下))の構造
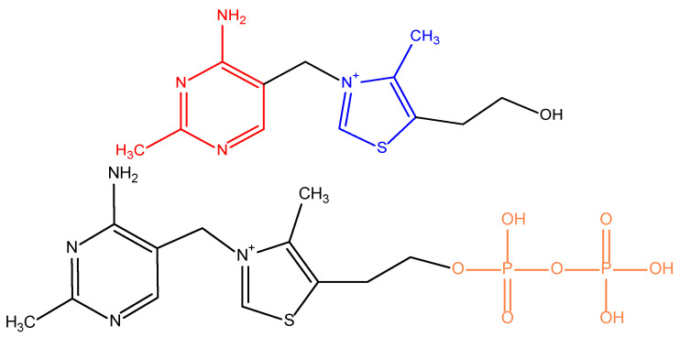
遊離のチアミンは塩基性で、酸性pHでは安定だが、紫外線やガンマ線照射で分解され、熱に弱い。アルカリ溶液中や酸化剤の存在下では、チアミンは蛍光物質であるチオクロムに変換され、食品や医薬品中のビタミン濃度を測定するのに用いられる[3]。
医薬品では、通常、固体の水溶性チアゾリニウム塩、例えば、チアミン塩酸塩やチアミン一硝酸塩の形で使用されている。また、ビタミンの合成親油性誘導体、例えばアリチアミンもあり、これらは生体膜をより容易に通過することができる[6]。
生体内では、チアミンは主にエステル、例えばチアミン一リン酸(TMP)、チアミン二リン酸(チアミンピロリン酸/TPP/またはコカルボキシラーゼとも呼ばれる;図1参照)、チアミン三リン酸(TTP)の形で存在することがあります。近年、アデノシンチアミン二リン酸やアデノシンチアミン三リン酸など、他の形態もヒトで発見されている[6,7]。
2.2. チアミンの供給源
植物、菌類、およびほとんどの細菌はチアミンを合成するが、その他の生物(すべての動物、および多くの原核生物と単細胞真核生物)はチアミンの供給を外部からの摂取に頼っている [8,9,10,11,12,13,14]。したがって、ヒトにおいて、チアミンは食事から継続的に供給される必要がある必須ビタミンである[15]。ヒトにとって最も一般的なチアミンの栄養源は、全粒穀物、パン、肉(特に豚肉)、豆類であり、精白小麦粉、精米、野菜、果物はあまり有用ではない。[11,16,17,18,19]。ナッツ類もチアミンが豊富である[20,21]。いくつかの食品に含まれるチアミンの量は、表1に示すとおりである。
表1 特定食品中のチアミン含有量
| 食べ物 | チアミン含有量(μg/ 100g) | 参考文献 |
|---|---|---|
| オーツ麦 | 520–763 | [ 11、90 ] _ _ |
| 小麦 | 276〜525 | [ 58、90、91 ] _ _ _ _ |
| 米、玄米 | 300〜413 | [ 11、22、59、92 ] _ _ _ _ _ _ |
| ライス、ホワイト | 50〜80 | [ 11、22、59、92 ] _ _ _ _ _ _ |
| トウモロコシ | 246〜385 | [ 11、90、92 ] _ _ _ _ |
| ライ | 316〜350 | [ 11、90 ] _ _ |
| オオムギ | 191〜399 | [ 11、56、91 ] _ _ _ _ |
| キビ | 358–421 | [ 11、93、94 ] _ _ _ _ |
| ソルガム | 277〜380 | [ 93、94、95 ] _ _ _ _ |
| 大豆 | 874〜1300 | [ 11、20、59 ] _ _ _ _ |
| レンズ豆 | 433–873 | [ 11、96、97 ] _ _ _ _ |
| 落花生 | 600 | [ 20 ] |
| マカダミアナッツ | 365〜1195 | [ 11、21 ] _ _ |
| ピスタチオナッツ | 654〜870 | [ 11、20、21 ] _ _ _ _ |
| ヘーゼルナッツ | 317–643 | [ 11、21 ] _ _ |
| クルミ | 227〜340 | [ 20、21 ] _ _ |
| アーモンド | 192〜210 | [ 11、20、21 ] _ _ _ _ |
| ニンニク | 200 | [ 11 ] |
| じゃがいも | 80〜170 | [ 11、59、92 ] _ _ _ _ |
| にんじん | 66〜130 | [ 11、98 ] _ _ |
| キャベツ | 61〜230 | [ 11、98 ] _ _ |
| トマト | 37〜50 | [ 11、98 ] _ _ |
| ブロッコリー | 71〜150 | [ 11、98 ] _ _ |
| カリフラワー | 60 | [ 98 ] |
| ほうれん草 | 78〜90 | [ 11、98 ] _ _ |
| オレンジ | 87 | [ 11 ] |
| アボカド | 67 | [ 11 ] |
| いちご | 20〜24 | [ 11、98 ] _ _ |
| りんご | 17〜40 | [ 11、98 ] _ _ |
| 白パン | 100 | [ 99 ] |
| 茶色のパン | 210 | [ 99 ] |
| 豚肉 | 600〜950 | [ 59、78、100 ] _ _ _ _ |
| 牛肉 | 50〜160 | [ 78、100 ] _ _ |
| 鶏の胸肉 | 40〜170 | [ 78、100 ] _ _ |
| レバー、牛肉 | 189 | [ 101 ] |
| レバー、豚肉 | 283 | [ 101 ] |
| シーチキン | 130 | [ 102 ] |
| イワシ | 10 | [ 102 ] |
| パン酵母 | 1880年 | [ 101 ] |
| ヒラタケ | 50〜150 | [ 103、104 ] _ _ |
| ボタンマッシュルーム | 70〜94 | [103,105] |
| Milk | 30–70 | [11,59,92,106] |
| Yogurt | 50–60 | [106] |
| Cheese, cheddar | 29 | [101] |
| Eggs | 40–80 | [92,107] |
しかし、いくつかの食品には、チアミンの吸収を不活性化または阻害する、いわゆる抗チアミン因子(チアミナーゼ、チアミン拮抗剤など)も含まれている。それらの食品の常用は、チアミン欠乏症の発症に関与していると考えられている[22,23,24,25]。チアミナーゼは、チアミンを切断して不活性化する熱に弱い酵素で、特定の生魚や発酵した貝類、アフリカのカイコの幼虫、シダ植物(例:Pteridium aquilinum, Marsilea drummondii, Equisetum arvense)、いくつかの細菌(例:Bacillus and Clostridium species)に含まれています。これらの抗チアミン活性は、調理によって除去することができる。熱に安定なチアミン拮抗物質には、フェノール化合物(特にオルト-ジヒドロキシ基を持つもの、例えばタンニン、カフェ酸、クロロゲン酸)およびカフェイン、テオフィリン、テオブロミンなどのメチルキサンチンがあり、ブルーベリー、キンマ、コーヒー、茶などの植物由来のいくつかの食品に含まれている。これらはチアミンと反応し、非吸収性のチアミン・ジスルフィドを生成する。これらの化合物の破壊過程は、例えば、多くの野菜や果物に含まれるアスコルビン酸(チアミンと一緒に摂取すると保護的な役割を果たす)、酒石酸やクエン酸(酸性化剤)によって防ぐことができ、またチアミンとタンニンの接触を遅延させることができる。後者は、食事中ではなく、チアミンを含む食事の数時間後にお茶を摂取することで達成できる[11,15,22,23,24,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46]。100℃の酸性条件下で調理することにより、チアミンから微量のオキシチアミンのようなチアミン代謝拮抗物質が生成される。オキシチアミンは末期腎臓病患者において蓄積され、トランスケトラーゼの阻害を招き、これらの患者に悪影響を及ぼす可能性がある[2,47]。最後に、キャッサバ植物(Manihot esculenta)に含まれるシアノゲニック配糖体(リナマリンとロタウストラリン)は、チアミン分子の硫黄と結合して、このビタミンをピリミジン部位とチアゾール部位に分解し、ビタミンは不活性となる[48]。また、チアミンは亜硫酸塩に非常に敏感で、特に高いpHではその傾向が強い [16,22,49,50]。亜硫酸塩や重亜硫酸塩が保存料として使用されている野菜、果物、ひき肉などでは、亜硫酸塩によるチアミンの切断が大きな損失要因となっています [51]。チアミンは、調理水中の残留塩素によっても切断される[22,52,53]。銅イオンの存在もチアミンの分解を促進する[22,54]。
食品の一次及び二次加工は、チアミン含量に不利な影響を与える可能性がある[22,24,55]。穀物については、すべての穀物は構造的に胚乳(80-85%)、胚芽(2-3%)、ふすま(13-17%)で構成されている[56]。チアミンは、他の微量栄養素と同様に、穀物全体に均等に分布しているわけではありません。穀物の製粉、精製(小麦及びトウモロコシ)又は精米(米)の際に除去される糠の部分及び胚芽は、胚乳よりもはるかにチアミンが豊富である[57]。製粉された精製小麦粉のチアミン含量は、全粒粉に比べて40-80%減少している[22,56,57,58]。同様に、白米におけるチアミンの損失は、玄米と比較して75-82%である[11,22,59,60,61]。様々なトウモロコシの精白品に含まれるチアミンの量は、全粒粉と比較して36-82%減少している[62,63]。
チアミンの安定性は、酸性溶液中(例えば、酸性の果汁や飲料中 [22,51])では、加熱しても良好である [22,24,53,64].中性およびアルカリ性条件、熱、酸化剤、還元剤、放射線などいくつかの要因で非常に分解されやすい[16,17,24,51,53,54,64,65,66,67,68,69]。チアミンは溶解性のため水に溶け出し、捨てられる浸し水や煮汁から失われる。また、食品の種類、使用方法、温度、時間によって、調理中の加熱によって破壊される[21,22,53,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89]。
ゆでる、煮る、焼く、揚げるなどの調理法は、食肉中のチアミンを損失させる。豚肉ではそれぞれ70%、38-55%、18-40%、10-50%、牛肉では60-80%、55-68%、12-38%、55%でした[53, 70, 100, 108]。肉類をはじめ、加水や滲出液などの調理液の摂取は、前項で述べた理由でチアミンの損失を妨げている。例えば、チアミン含量は、スープと一緒に煮た牛肉では33〜40%、肉汁と一緒に煮込んだ豚肉では30%減少するが、牛肉と豚肉のみでは60〜80%、55%減少する[53,70,100]。豚肉、鶏肉、ラム肉、牛肉などのパン粉を付けて揚げた肉は、パン粉を付けていない変種よりも15~40%多くチアミンを含んでいる[70]。初期の脂肪含量が低い食肉ほど、加熱調理処理中に多くの水分を失い、その結果チアミンがより多く溶出するので、脂肪含量は食肉の加熱処理の過程でビタミン保持に良い影響を与える要因である可能性がある[74]。
米のチアミン含量は、炊飯前の洗浄、煮沸、煮込み、焼き、揚げによりそれぞれ37-50%、25-52%、20-25%、15-30%、10-30%減少する [15,22,53,70,71,72,73,82,109,110].ジャガイモを蒸す、煮る、焼く、揚げることで、それぞれ15%、20%(皮付きは25%)、15-20%、20-40%のチアミンが失われます[70,71]。一般に、茹でるよりも蒸す方が、水への溶出によるチアミンの損失を妨げるので好ましいとされている[111,112]。茹でて水気を切らない、茹でて水気を切る、焼く、茹でて水気を切って焼いたパスタのチアミン量の減少は、それぞれ20%、35%、20%、45%である[72]。豆類では、調理によって20-25%のチアミンが失われ、圧力調理によって56-58%のチアミンが失われる[70,74]。調理や缶詰の色調保持のためにエンドウや豆類に炭酸水素ナトリウムを添加する習慣は、アルカリ性環境によるチアミンの大きな減少をもたらす[22,113]。
白パンの焼成時のチアミンの損失は15~37%である[51,114]。ライ麦の焼成よりも小麦の焼成の方がチアミンの含有量は減少する[115]。ケーキの混合物にベーキングパウダーを使用すると、アルカリ性条件下でのチアミンの安定性が悪いため、チアミンは50%以上という著しい減少を示す[74]。
スクランブルエッグ、ハードクック、目玉焼きは、調理中にそれぞれ5%、20%、30%のチアミンを失う[70]。牛乳の熱によるチアミンの減少は、通常、低温殺菌牛乳、超高温処理牛乳、殺菌牛乳、エバポレーテッドミルクでそれぞれ10%、5-15%、30-40%、30-50%であり、全乳では低脂肪乳や脱脂乳よりも低い[74]。ドナー人乳は、ホルダー殺菌(62.5℃、30分)または現在のレトルト処理の代替(121℃、15 PSI、5分)で処理でき、保存期間を延ばすことができる。チアミンの含有量は前者では影響を受けないが、後者では約42%減少する。これらの損失は臨床的に重大であり、保存性の高いドナーミルクを長期的な給餌の選択肢とする場合には、栄養強化が必要となる場合がある [118]。
食品中のチアミン含量に対する押出し加工[119,120]、保存技術としてのガンマ線照射[68,121,122,123,124]、缶詰[125,126,127]、冷凍[89,126]、保管条件[81,86,105,126,128,129,130,131]、食用種子発芽による影響 [90,94,95,96,132,133] もまた、これまで報告されてきている。
様々な食品成分がチアミンの安定性に影響を与えることが示されている。デンプン及びタンパク質(卵アルブミン及びカゼイン等)は保護的である。マンニトール、イノシトール、フルクトースは、グルコースとは対照的に、加熱処理中のチアミンの破壊速度を遅らせることができる [40,51,65]。ニンニクに含まれるアリシンは、球根を切ったり砕いたりすると、チアミンと反応して、より親油性で吸収率の高いアリチアミンになる [22,134,135,136,137] が、これについては後述する。
パーボイリングは精米の品質を向上させ、前述の方法とは対照的に精米のチアミン含量を増加させることができる食品加工法の一例である-籾米を水に浸し、蒸して、精米前に乾燥させる [23,138,139,140,141]。蒸すことによってチアミンや他の栄養素が外層から胚乳に移動し、精米によって外層を除去してもチアミンが失われないため、茹で米は高度に精米しても十分なチアミンを保持することができる[22,23,142,143]。パーボイルド精米とノンパーボイルド精米におけるチアミンの損失は、玄米と比較してそれぞれ33-40%、75-85%である[22,144]。
食品加工はチアミンの含有量にほとんど悪影響を与えるが、ヒ素のような有害な成分を最小限に抑えるために加工が必要な場合もあることを強調しておく。これはコメの場合であり、コメの無機ヒ素含有量は小麦や大麦よりも一桁多いので、穀物の中では例外的である。その理由は、植物が無機ヒ素を取り込み、穀物に転流させることができるからである。さらに、水田における半水系の嫌気性栽培環境は、根からのヒ素の取り込みを促進する[145,146]。米粒では、ヒ素は特に籾殻と糠に蓄積され、胚乳への蓄積はかなり少ない [147,148,149,150]。無機ヒ素は多くの病的状態を引き起こす可能性があることが明確に示されている [151,152,153,154,155,156,157,158,159,160,161,162].調理前の研磨や水洗い、余分な水を捨てての煮沸は、ヒ素の効率的な削減につながるが、同時に前述のビタミンB1の損失にもつながる [149,150,151,156,158,163,164,165,166,167,168,169].実際、ヒ素に関しては、米の調理と消費に関する勧告の結果、特に乳幼児など一部の人口集団においては、栄養的な観点よりも安全性の観点が優先されている [151,154,156].
チアミンは自然界に広く存在するが、比較的少量である。天然資源からの抽出は経済的に採算が合わないため、化学合成によって製造する必要がある[59]。工業的に関連するチアミンの合成はすべて,Greweジアミン(4-アミノ-5-アミノメチル-2-メチルピリミジン)というピリミジン中間体を主要な構成要素として用いている.この中間体の合成には、アクリロニトリルまたはマロノニトリルが一般的な出発物質として用いられる。その後、3つの化学的ステップを経て、チアゾール環があらかじめ形成されたピリミジン部位(Grewe diamine)上に直鎖状に構築され、チアミンが得られる[59,170]。チアミンの生合成経路は非常に複雑であり、その制御も複雑であるため、微生物発酵の成功は限られている。したがって、チアミン発酵が現在の低コストの化学製造プロセスに対して競争力を持つためには、高い収率を必要とするため、大規模な代謝工学のブレークスルーが必要となるであろう[171]。
多くの国では、食品にチアミンを強制的または自主的に強化することで、天然のチアミンを含む食品からの不足しがちな摂取量を補い、人工的な食事によるビタミン供給源としている[12,23,92,172,173,174,175,176,177,178,179]。いくつかの高所得国では、強化食品が消費されるチアミン総量の約半分に寄与している[175,180]。小麦粉、トウモロコシ粉、米は、一般的にチアミンを強化した食品である[61,92,181,182,183,184,185,186]。品種改良と遺伝子工学によって作物中の天然の微量栄養素レベルを増強するバイオフォート化は、カロリー摂取のほとんどを主食作物に依存する人々のために、食事性チアミンの量を増加させる長期的に持続可能なアプローチを提供する。努力はなされているが、ヒトへの給餌試験を行ったものはなく、さらなる研究が必要である [92,172,187,188,189,190,191]。
2.3. チアミンの薬物動態
食事から摂取されたチアミンは、近位小腸(上部空腸)で容易に吸収される。吸収は用量に依存し、2つのメカニズムが関与する:経口摂取量が5mg未満である限り、キャリアを介した能動輸送;および高用量では受動拡散である [192] 。
食事性チアミンのほとんどはリン酸化型で、吸収される前に腸内ホスファターゼによって遊離型チアミンに加水分解される [193]。
遊離チアミンは、主にTHTR1(SLC19A2遺伝子にコードされる)とTHTR2(SLC19A3遺伝子にコードされる)という2つの飽和高親和トランスポーターによって腸管粘膜細胞(腸細胞)へ取り込まれる(図2)。THTR1 トランスポーターはアピカルブラシボーダー膜と基底膜に存在し、THTR2 はアピカル表面にのみ存在する [194,195,196,197].さらに、チアミンに特異的でない他のトランスポーター(例えば、有機カチオントランスポーターOCT1,3)もこのプロセスに関与している[198]。
図2 チアミンの腸管への取り込み
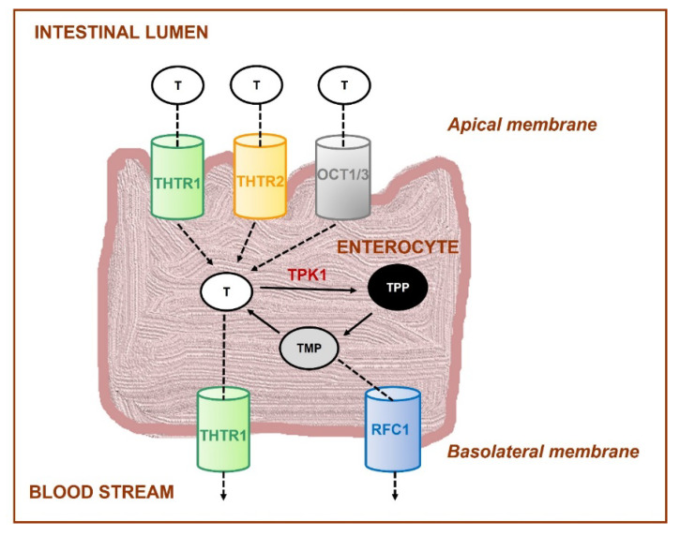
THTR1キャリア(SLC19A2遺伝子にコードされる)、THTR2キャリア(SLC19A3遺伝子にコードされる)、OCT1/3、有機カチオントランスポーター1/3、RFC1、還元葉酸キャリア(SLC19A1遺伝子にコードされる)、T、チアミン、TMP、チアミン一リン酸、TPP、チアミンピロリン酸、TPK1、チアミンホスホキナーゼ
また、ヒトは大腸の細菌叢からビタミンB1を摂取しており、そこでチアミンとTPPの両方が合成される。チアミンは腸管細胞と同様のキャリアーを介したメカニズムで大腸細胞に取り込まれ、TPPはヒト大腸チアミンピロリン酸トランスポーター(SLC44A44遺伝子にコードされている)によりこの細胞へ入る。
腸から門脈循環への輸送は、基底膜を介し、THTR1キャリアによって行われる。もう一つの輸送体は還元型葉酸輸送体(RFC1、SLC19A1遺伝子にコードされている)と呼ばれ、チアミン一リン酸(TMP)は輸送するが、遊離チアミンは輸送しないので、あまり重要ではない。
全血中の総チアミン(遊離チアミンとそのリン酸化体)濃度は、75〜200nmol/Lの範囲である。チアミンは循環血液中に入ると、THTR1トランスポーターとTHTR2トランスポーターによって赤血球膜を通過する。TMPの輸送には、RFC1が再び関与している。赤血球の内部ではリン酸化が起こり、TPPが形成される。その結果、血中のチアミンの80%はTPPの形で赤血球に存在することになる。血漿中には、遊離チアミン、TMP、タンパク質結合型TPPとして、低濃度のビタミンだけが存在する[198,199]。
血液からチアミンは、先に述べたトランスポーター、すなわちTHTR1、THTR2、OCTによって様々な組織の細胞に取り込まれ、RFC1によって再びTMPの移動が可能になる(図3)。THTR1、THTR2ともに骨格筋、心臓、腎臓、肝臓、膵臓、脳、胎盤、脂肪組織など様々な臓器の細胞で高発現しています[5,200]。
図3 チアミンの細胞内への取り込み
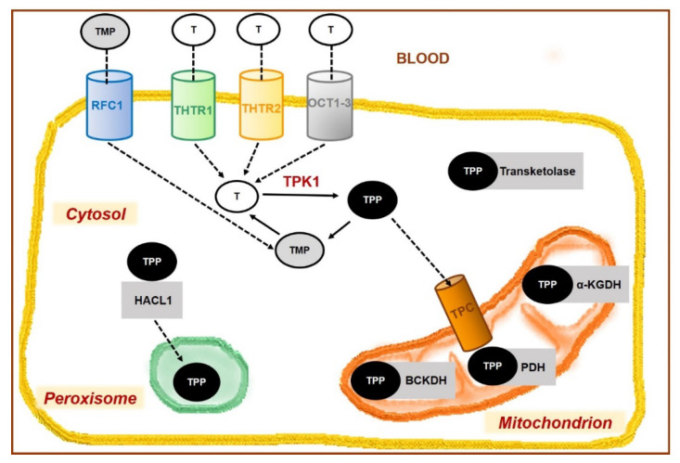
THTR1キャリア(SLC19A2遺伝子にコードされる)、THTR2キャリア(SLC19A3遺伝子にコードされる)、OCT1-3、有機カチオントランスポーター1-3、RFC-1、還元型葉酸キャリア(SLC19A1遺伝子にコードされる)、TPC、チアミンピロホスフェートキャリア(SLC25A19遺伝子にコードされる)。T、チアミン;TPP、チアミンピロリン酸;TMP、チアミン一リン酸;TPK1、チアミンホスホキナーゼ;BCKDH、分岐鎖αケト酸デヒドロゲナーゼ;PDH、ピルビン酸デヒドロゲナーゼ;αKGDH、αケトグルタル酸デヒドロゲナーゼ;HACL1、2ヒドロキシアシルCoAリアーズ1
細胞内では、遊離チアミンが細胞質キナーゼであるチアミンピロホスホキナーゼ(TPK1)によりリン酸化され、チアミンピロリン酸(TPP)が生成される。この合成には、マグネシウムとアデノシン三リン酸(ATP)が必要である[201]。TPPは代謝活性型であり,細胞質(例えば,トランスケトラーゼ),ミトコンドリア(下記及び図3,図4参照)における複数の酵素反応において重要な補因子として作用する[202,203,204].TPPのミトコンドリアへの輸送は、SLC25A19遺伝子にコードされるチアミンピロリン酸担体(TPC)を介して行われる。
図4 チアミンピロリン酸(TPP)を補酵素として必要とする細胞内経路
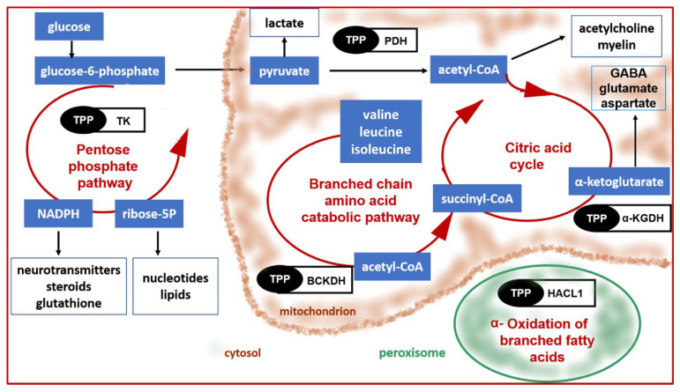
BCKDH:分岐鎖α-ケト酸脱水素酵素、PDH:ピルビン酸脱水素酵素、α-KGDH:α-ケトグルタル酸脱水素酵素、TK:トランスケトラーゼ、HACL1:2-ヒドロキシアシルCoAリアーゼ1。
チアミンは半減期が約10日の水溶性ビタミンであるため、人体に大量に蓄積されることはない。体内量は約25~30mgである。摂取量が十分でない場合、2~3週間かけて欠乏症になることがある。
チアミンの排泄は主に腎臓で行われ、その速度は糸球体濾過と尿細管再吸収/分泌の両方に依存する。近位尿細管での尿から血液への再吸収は、主に腎尿細管細胞の刷子縁膜にある既述のトランスポーターTHTR1、THTR2、OCT1および基底側膜のTHTR1およびOCT2/3によって可能となります。当然のことながら、基本的なトランスポーターであるTHTR1とTHTR2は、チアミン欠乏時に発現が上昇する。生体内にチアミンが過剰に存在する場合、再吸収は活発な分泌に切り替わる。したがって、高いチアミン血漿濃度は高い有効性をもってクリアされる。この場合、チアミンは血液からの輸送中にTHTR1およびOCT2/3を介して腎尿細管細胞の基底膜を通過し、OCT1および多剤・毒素押出タンパク質(MATE1およびMATE2k)によりブラシボーダー膜を介して尿細管細胞から尿中に輸送される。利尿剤の長期使用は、チアミン欠乏症を引き起こすことが知られています。チアミンは糞便経由でも排泄されるが、これは主に細菌由来のチアミンに関係するもので、汗や母乳経由でも排泄される[2,5,198,205]。チアミン濃度は通常母乳で0.14-0.21mg/Lの範囲であり、レベルは食事に依存する[23]。
2.4. チアミンの生理機能
チアミンは、前述の活性型であるTPPの状態で、炭水化物および分岐鎖アミノ酸の代謝に関連するいくつかの重要な酵素の補因子として機能している。この役割に加えて、チアミンは、核酸前駆体、ミエリン、神経伝達物質(アセチルコリンなど)の合成、抗酸化防御など、数多くの細胞プロセスに不可欠である(図4)[6]。
ミトコンドリアでは、TPP依存性酵素であるピルビン酸脱水素酵素(PDH)、α-ケトグルタル酸脱水素酵素(α-KGDH)、分岐鎖α-ケト酸脱水素酵素(BCKDH)が、ATPを生産できる経路に関与しています。PDHはクエン酸サイクル(クレブスサイクル)でピルビン酸からアセチルCoAへの酸化的脱炭酸を触媒し、α-KGDHはα-ケトグルタル酸をクエン酸サイクルの主要中間体であるスクシニルCoAへ変換する。およびBCKDHは分岐鎖アミノ酸(バリン、イソロイシン、ロイシン)の酸化を触媒し、結果としてアセチルコエンザイムAおよびスクシニルCoAを中間体として生成する[193,206,207,208]。
細胞質では、TPP依存性のトランスケトラーゼがペントースリン酸経路に関与しており、グルコースを利用してリボース5-リン酸とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)を生成し、ヌクレオチド、脂質、神経伝達物質の合成や抗酸化防御に重要である [209].別のTPP依存性酵素である2-ヒドロキシアシル-CoAリアーゼ1(HACL1)は、ペルオキシソームに存在する。この酵素は、分岐脂肪酸のα酸化に必須である[210]。
2.5. チアミンの欠乏
チアミンの生理的役割の知識に基づいて、欠乏すると酸化的代謝が低下する。生化学的な結果としては、ATPの産生不全、乳酸の産生増加による乳酸アシドーシス、神経伝達物質(アセチルコリン、グルタミン酸、アスパラギン酸、GABAなど)の合成の減少が挙げられる。トランスケトラーゼ活性(TK)の低下は、核酸やグルタチオンの合成を阻害し、α-KGDHの機能不全は、ヘム合成の欠損につながる。中枢神経系(CNS)や心臓は、酸化的脱炭酸によって生成されるATPに強く依存しているため、これらの器官はチアミン欠乏に対してより敏感である。
チアミン摂取量の不足、吸収または代謝の障害、および需要の増加が、ビタミンB1欠乏症の主な理由である[211]。チアミン摂取不足は、ビタミン不足の食事(例えば、歴史的に精米による)、飢餓、または炭水化物の多い食事によって引き起こされることがある。一方、食事で十分な量のチアミンを摂取しているにもかかわらず、上記の報告のようにチアミナーゼやチアミン拮抗薬を高濃度に含む食品の摂取により、チアミン欠乏症が発症することがある。その他、チアミンの吸収を低下させる要因として、加齢、吸収不良、アルコール乱用などが挙げられる[15,25,48]。
また、チアミンホメオスタシスの主要な制御因子、例えばチアミン輸送体、チアミンピロホスホキナーゼ(TPK1)、BCKDHの障害を引き起こすいくつかの遺伝子欠陥がある。THTR1の機能障害は糖尿病、巨赤芽球性貧血、難聴を引き起こすが、トランスポーターTHTR2、ミトコンドリアTPPトランスポーター、酵素TPK1、BCKDHの欠損は主に重度の障害を伴う脳症、早期死をもたらす(表2) [26,212,213].
表2 チアミンの輸送と代謝における遺伝的欠陥。
| 欠乏 | 遺伝子変異 | 疾患 | 症状 |
|---|---|---|---|
| THTR1 | SLC19A2 | チアミン反応性巨大芽球性貧血(TRMA、ロガー症候群としても知られる) | 巨赤芽球性貧血、糖尿病、難聴 |
| THTR2 | SLC19A3 | ビオチン-チアミン反応性脳症 | 一時的な脳症、歩行運動失調、発作、球麻痺 |
| ミトコンドリアTPPトランスポーター | SLC25A19 | アーミッシュの致命的な小頭症 | 重度の先天性小頭症、1年以内の死亡、一時的な脳症 |
| TPK1 | TPK1遺伝子 | チアミン代謝機能障害症候群5 | 一時的な脳症、運動失調、ジストニアおよび痙縮、歩行能力の喪失 |
| BCKDH | DBT遺伝子 | メープルシロップ尿症(MSUD) | 精神発達障害、発作、嗜眠、進行性神経変性、耳垢および尿中のメープルシロップ臭 |
妊娠や授乳、発熱、甲状腺機能亢進症、炭水化物を多く含む食事は通常、チアミンの消費量増加と関連しており、利尿剤の使用や下痢はチアミンの枯渇を助長する [211]。チアミンの深刻な欠乏は、神経症状や心血管系症状を主とする脚気、ウェルニッケ脳症、コルサコフ症候群など多くの症候群を引き起こす[214]。
脚気は、臨床的に明らかなチアミン欠乏症とも呼ばれ、紀元前2600年頃に中国の文献に記載されている。乾性脚気の主な特徴は、知覚障害や麻痺を引き起こす末梢神経障害です。神経障害の初期に「灼熱性足症候群」を起こすことがあります。また、足や腕の感覚低下や脱力感、筋肉痛など、いくつかの特徴的な症状があります。
湿性脚気は、心血管系の症状が主で、主に心臓を冒し、心電図(ECG)の異常を特徴とする心臓の異常を引き起こし、最終的には、浮腫、頻脈、心臓肥大を伴ううっ血性急性心不全に至ることもある[215,216]。日本では、慢性アルコール中毒患者において、代謝性アシドーシスを伴う急性劇症型低ビタミン心筋症が報告されている。この状態は、文献上、湿性脚気「しょうしん」と呼ばれている [217,218]。
小児では、乳児脚気として知られるチアミン欠乏症は、チアミン欠乏症の母親から母乳で育てられたり、チアミン欠乏症の食事をしている乳児に発生する。この疾患の特徴は、発症が早く、主に神経系および心臓系の症状、例えば、嘔吐、頻脈、不穏、不眠、痙攣、麻痺、失声、心機能障害、心不全を伴う急性状態であることである。適切なチアミンの補給がなければ、可能な限りの支持療法にもかかわらず、多くの場合、すぐに死に至る。初期段階を乗り切った子供たちは、発達障害、例えば、運動や運動技能の障害、てんかん、運動機能の喪失、言語障害などを抱えながら生き続ける [219,220]。
重度のチアミン欠乏症は、より深くCNSに影響を及ぼすことがある。この大脳脚気は、ウェルニッケ脳症およびコルサコフ精神病と呼ばれる[221,222]。ウェルニッケ脳症の診断は、眼球運動障害、歩行失調、および認知障害を含む徴候の「三徴候」に基づいて行われる。治療せずに放置すると、不可逆的な神経学的損傷により、コルサコフ精神病として知られる別の臨床症状が引き起こされることがあります。この症候群は、最近の記憶の喪失、記憶喪失、自白を伴う。チアミン欠乏による脳機能への有害な影響は、脳の酸化的代謝への強い依存性によって説明することができる[15,222]。ウェルニッケ脳症がコルサコフ精神病を伴う場合、その組み合わせはウェルニッケ・コルサコフ症候群と呼ばれる [223]。この症候群は、栄養失調やチアミントランスポーターの遺伝子変異など、他の疾患でも観察されるが、アルコール乱用の最も深刻な神経精神的後遺症の1つである。アルコールはチアミンの腸管吸収を阻害するようである。動物実験によると、小腸ではエタノールがチアミン輸送体THTR1の遺伝子発現を阻害するが、チアミン輸送体THTR2の遺伝子発現は阻害せず、大腸ではTHTR1およびTHTR2の両方の遺伝子発現を阻害することが示唆されている。したがって、チアミンが腸管に存在しても、アルコールが存在すると吸収されない。慢性アルコール中毒の人の80%までは、消化管吸収が低下するため、チアミン欠乏症になります。このようにアルコールがチアミン吸収に影響を与えるため、チアミン投与は静脈内投与にする必要があります。さらに、アルコールを乱用する人々は、通常、チアミンを含む必須栄養素の摂取が不十分である[224,225]。
生体液中のビタミンB1の分析の詳細な概要は、他のビタミンとともに、表3および補足データ表S1にまとめられている。
表3 ヒト生体試料中のビタミンB1-5の定量方法の概要。
| 技術 | 感度nmol/L | 分析物 | マトリックス | 利点 | 短所 | 参照。 | 発行年 |
|---|---|---|---|---|---|---|---|
| LC-MS | LOQ-LLOQ 0.15–246.32 (B 1 –B 5) |
B 1、B 1 -TMP、B 1 -TPP、B 2、B 2 -FAD、B 3 -NAM、B 5 | 母乳 血清 全血 乾燥血液(VAMS ) 血漿 涙尿 |
|
|
[ 227、228、229、230、231、232、233、234、235、236、237、238、239 ] _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ | 2011〜2020 |
| HPLC-FLD | LOQ-LLOQ 0.5–23.51 (B 1 -TPP) |
B 1、B 1 -TMP、B 1 -TPP、B 2、B 2 -FAD、B 2 -FMN | 全血 乾燥血液スポット 血漿 ヒューマンミルク |
|
|
[ 240、241、242、243、244、245 ] _ _ _ _ _ _ _ _ _ _ | 2011〜2020 |
| HPLC-PDA | LOD 212.56–4.09×10 3 (B 2 –B 3 -NAM) |
B 1、B 2、B 3 -NAM | 血漿 尿 |
|
|
[ 246、247 ] _ _ | 2009〜2014 |
| センサー/ナノドット/ CL/ FLD / ECD |
LOD6.8 × 10-6–0.25 × 10 3 B 1 |
B 1、B 2 | 尿 血清 血漿 |
|
|
[ 248、249、250、251、252 ] _ _ _ _ _ _ _ _ | 2002〜2020 |
| 微生物検査キット | LLOQ 64.98–83.93 (B 3 –B 5) |
B 3、B 5、 | 血清 |
|
|
[ 253、254 ] _ _ | 2021年 |
| HPLC-FLDキット | LOD 1.18–12.71 (B 1 -TPP–B 2 -FAD) |
B 1、B 1 -TPP、B 1 -TMP、B 2、B 2 -FAD、B 2 -FMN | 血漿 全血 |
|
|
[ 255、256、257、258 ] _ _ _ _ _ _ | 2021年 |
| ELISAキット | LOD0.93 × 10-3–6.93( B 1 –B 2) |
B 1、B 2 | 血清 形質 細胞培養上清 組織 母乳 精子 尿 |
|
|
[ 259、260、261 ] _ _ _ _ | 2021年 |
LOD、検出限界;LOQ、定量限界;LLOQ、定量下限;B1、チアミン;B1-TPP、チアミンピロリン酸/二リン酸;B1-TMP、チアミン一リン酸。B2、リボフラビン;B2-FAD、フラビンアデニンジヌクレオチド;B2-FMN、フラビンアデニンモノヌクレオチド;B3、ナイアシン;B3-NAM、ニコチンアミド;B5、パントテン酸;CL、ケミルミネッセンス。ECD:電気化学検出、ELISA:酵素結合免疫吸着法、FLD:蛍光検出、HPLC:高速液体クロマトグラフィー、LC-MS:液体クロマトグラフィーと質量分析の結合、MRM:多重反応モニタリング、PDA:フォトダイオードアレイ検出、SIM:選択イオンモニタリング、VAMS:容量吸引マイクロサンプリング。
2.6. チアミンの薬理学的利用
チアミンは栄養補助食品として入手可能であり、深刻な欠乏症の場合には貴重な医薬品となる。マルチビタミンのサプリメントには、通常約1.5mgのチアミンが含まれています。毎日摂取しなければならない生体の最適な供給のための推奨食事許容量(RDA)は、女性で1.1mg/日、男性で1.2mg/日である[226]。年齢と性別に応じたチアミンの推奨食事許容量を表4に示します。
表4 チアミンの推奨される食事許容量
| 個人 | 状態、年齢 | 用量(mg / kg) |
|---|---|---|
| 成人男性 | 1.2 | |
| 大人の女性 | 1.1 | |
| 妊娠 | 1.4 | |
| 授乳 | 1.4 | |
| 子供達 | 0〜6か月 | 0.2 |
| 7〜12か月 | 0.3 | |
| 1〜3年 | 0.5 | |
| 4〜8年 | 0.6 0.6 | |
| 9〜13歳 | 0.9 | |
| 青年期の男性 | 14〜18歳 | 1.2 |
| 青年期の女性 | 14〜18歳 | 1.0 |
重篤な患者では、体内のチアミン供給量は5-7日以内に枯渇する。したがって、重症感染症、手術、多発性外傷の患者では、組織での必要量が増えるだけでなく、主に尿中の損失が増えるため、ビタミンの投与量は何倍も多くなる。このような場合、体重70kgの患者の1日投与量は、100-300mgの静脈注射となる [262,263]。
ビタミンB1欠乏症の治療については、幅広い治療アプローチとチアミンの用量が文献に報告されている。重度の欠乏症(例:脚気)の場合、世界保健機構は、成人では1日50~100mgのi.v.投与、その後1週間程度10mg/日の点滴投与、その後少なくとも6週間は1日3~5mgの点滴投与を推奨している。乳児期のチアミン欠乏症には、初回投与量を25~30mgと少なめにし、その後は成人と同様の筋肉内投与と経口投与を行う。ウェルニッケ・コルサコフ症候群の初期の患者には、チアミンとして1回50〜100mgを1日2回皮下または静脈内投与する。その後、ビタミンを数週間経口投与する必要がある[22,264]。チアミンは、表2に示すように、チアミンの輸送と代謝の様々な遺伝的障害に関連する症状に対しても摂取される。チアミンの吸収障害は、その非経口投与によって回避される。活性型TPPを非経口的に投与することも可能である[265]。
さらに、チアミンは、その症状でチアミンアビタミノーシスに似ている神経障害(様々な起源の多発性神経炎)を治療するために使用されている。その他の用途としては、チアミン不足のリスクのある一部の患者、例えば、糖尿病、心不全、HIV感染症、アルツハイマー病などの治療がある[3,266,267,268]。
前述のように、水溶性チアミンの生物学的利用能には限界がある。この制限を克服するために、チアミンの脂溶性誘導体が開発された。最初の親油性チアミンアナログは、1950年代にニンニク(Allium sativum)抽出物から単離された。これはアリル・ジスルフィド誘導体で、アリチアミンとして知られている。アリチアミンは、チアミンよりも腸内で吸収されやすく、安定性が高く、チアミナーゼによって分解されることもない[22, 134, 135, 136, 137]。その後、アリチアミンの分子構造に基づいて、スルブチアミン(O-イソブチリルチアミンジスルフィド)、フルスルチアミン(チアミンテトラヒドロフルフリルジスルフィド)、ベンフォチアミン(S-ベンゾイルチアミンO-一リン酸、図5参照)などの合成誘導体が合成されてきた。これらの脂溶性誘導体は、受動拡散により膜を通過しやすく、律速的輸送を回避できるため、吸収率が高い。また、水溶性チアミン塩酸塩や硝酸塩と比較して、経口投与時の生物学的利用能が向上している。したがって、治療目的にはより適している[135,269]。
図5 ベンフォチアミン(左)、アリチアミン(右)の構造。
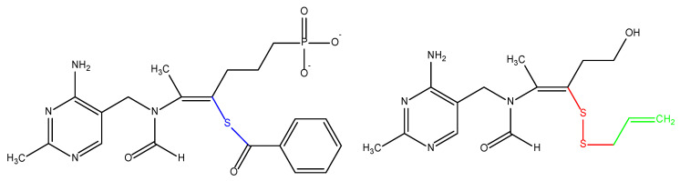
臨床での使用が増えているベンフォチアミンは、摂取後、腸内で脱リン酸化され、親油性の高いS-ベンゾイルチアミンとなり、生体膜を容易に通過する。組織内ではチアミンに変換され、さらに既知のチアミン代謝物(チアミン一リン酸およびTPP)に変換されることが知られている[270]。ベンフォチアミンは生物学的利用能が向上し、効能が改善されるため、水溶性チアミンと比較して不顕性チアミン欠乏症や顕性チアミン欠乏症の治療に効果的である。チアミン低栄養症は、主に高カロリー食と現代の食生活に特徴的なビタミンの低摂取との間の不一致のために、考えられているよりも一般的であることに言及されるべきである[271]。
チアミンと比較して、ベンフォチアミンは、アラキドン酸、マイトジェン活性化プロテインキナーゼ(MAPK)、核転写因子κB(NF-κβ)、グリコーゲン合成酵素キナーゼ3(GSK 3)、血管内皮増殖因子受容体2(VEGFR2)および先進糖化最終産物(AGEs)などいくつかのシグナル伝達経路に影響を与えることが示されている(図6を参照のこと)。これらのシグナル伝達経路は様々な病態に関与しているため、ベンフォチアミンは、炎症、神経変性疾患(アルツハイマー病など)、糖尿病関連の血管合併症(神経障害、網膜症、腎症、心不全)など、関連疾患の治療に有用であると考えられる[272,273]。
図6 ベンフォチアミンのその他の効果]
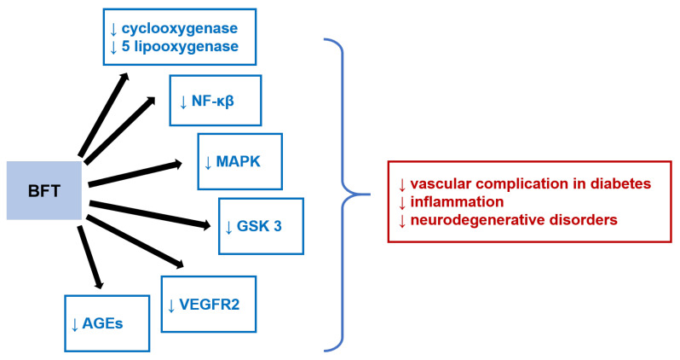
NF-κβ, 核転写因子κB; MAPK, マイトジェン活性化プロテインキナーゼ; GSK 3, グリコーゲン合成酵素キナーゼ 3; VEGFR2, 血管内皮増殖因子受容体 2; AGEs, 高度糖化最終産物.
臨床現場では、ベンフォチアミンは他のビタミンB群(主にシアノコバラミン/B12/とピリドキシン/B6/)と併用し、疼痛管理補助剤として使用されることが多い(例:糖尿病性多発神経炎、帯状疱疹後神経痛、三叉神経痛など)。いくつかの臨床試験で、この組み合わせの効果は、個々のビタミンに見られる効果よりも有意に大きいことが示されている。研究での投与量は様々である[274]。
2.7. チアミンの毒性
チアミンは毒性が低く、安全であると考えられています。動物実験では、マウスにおけるチアミン塩酸塩のLD50(p.o.)は3~15g/kg体重の範囲と記載されている[275]。
ヒトにおいて、経口摂取されたチアミンは、通常、1日数百ミリグラムの用量であっても、副作用なしに長期間投与される。したがって、経口摂取されるチアミンは、副作用のリスクが非常に低い。これは、5mg以上の経口摂取は吸収の有効性が低いことと関連している。さらに、吸収された過剰のチアミンは尿中に排泄される。非経口的なチアミン補給を受けている個人において、最もよく報告される副作用は、熱感、蕁麻疹、そう痒症、血管浮腫、発汗、チアノーゼ、アナフィラキシーを含むアレルギー反応に起因している [264].
報告では、100~300mg(i.v.)の用量でまれに、より頻繁には1日500mg(i.v.)までの高用量で有害事象の事例がある。アレルギー体質の人は、過敏性反応を避けるため、チアミンサプリメントを摂取してはならない。チアミンは授乳中に使用しても安全である [276] 。非経口的なチアミン製品の中には、アルミニウムを含むものがある。したがって、これらの製品は、アルミニウムの蓄積とそれに続くアルミニウム毒性を避けるために、腎障害のある個人、特に未熟児には注意して使用されるべきである [277]。
2.8. チアミン欠乏に関連する薬物-ビタミン相互作用
チアミンの尿中排泄を増加させ、しばしばビタミンB1欠乏症を引き起こす利尿剤(主にフロセミド)のほか [278] 、チアミンの動態に影響を与える可能性のある薬物が存在する。細胞増殖促進剤である5-フルオロウラシルは、チアミンの活性型TPPへのリン酸化を阻害する [279]。抗がん剤として使用されるヤヌスキナーゼ2(JAK2)阻害剤のフェドラチニブは、重要な腸のチアミン輸送体THTR2を阻害し、ウェルニッケ脳症の発症に寄与する [280]。メトホルミンもTHTR2において薬物-ビタミン相互作用を引き起こす[281]。
3. リボフラビン・ビタミンB2
3.1. 導入と特性
リボフラビン(ビタミンB2)は、ビタミンB群から単離された2番目のビタミンである。また、メチル化イソアロキサジンコアとリビチル側鎖からなる水溶性の黄橙色有機化合物で、溶解性を高め、活性補酵素の生合成を可能にしている。リボフラビンは熱や大気中の酸素に対して比較的安定で、特に酸性環境下では安定です。光には非常に敏感で、還元剤によって分解され、アルカリ性溶液では不安定です [17,51,69,282,283,284,285,286,287,288,289]。
牛乳中に存在することはチアミンよりも早く1879年に既に確認されていたが、その単離と化学合成は数十年後の1930年代に成功した[290,291]。その特性の大部分と健康に対するその重要性は以前から知られていたが、代謝性疾患、片頭痛、その他多くの適応症におけるこのビタミンの潜在的な使用に関する新しい情報が現れている。
3.2. リボフラビンの供給源
リボフラビンは必須ビタミンであり、ほとんどの生物にとって重要な酵素の補酵素であるため、様々な食品に含まれています。植物、菌類、およびほとんどの細菌 [14,292,293,294,295,296,297,298] は、リボフラビンを合成する能力があります。一方、ヒトや動物には内因性の生合成経路がないため、食事から外来的に摂取する必要があります[299,300,301]。欧米諸国で実施された人口調査によると、牛乳およびその他の乳製品が全体のリボフラビン摂取に最も寄与しており、肉、穀物、野菜がそれに続いています[284,302,303,304,305]。卵、豆類、ナッツ類、キノコ類、内臓肉(レバー)も重要なビタミン源である [17,283,306,307,308]。いくつかの食品におけるリボフラビンの含有量は、表5に示すとおりです。
表5 特定食品中のリボフラビン含有量
| 食べ物 | リボフラビン含有量(μg/ 100g) | 参考文献 |
|---|---|---|
| オーツ麦 | 139 | [ 11 ] |
| 小麦 | 57〜265 | [ 56、58、309 ] _ _ _ _ |
| 米、玄米 | 40〜140 | [ 11、61 ] _ _ |
| ライス、ホワイト | 20〜60 | [ 11、61 ] _ _ |
| トウモロコシ | 80〜201 | [ 11、92 ] _ _ |
| ライ | 200〜251 | [ 11、56 ] _ _ |
| オオムギ | 100〜114 | [ 11、56 ] _ _ |
| キビ | 210〜290 | [ 11、93 ] _ _ |
| ソルガム | 50〜150 | [ 93、94、95 ] _ _ _ _ |
| 大豆 | 870 | [ 11、20 ] _ _ |
| レンズ豆 | 61–211 | [ 11、113、310 ] _ _ _ _ |
| 落花生 | 100 | [ 20 ] |
| マカダミアナッツ | 162〜367 | [ 11、21 ] _ _ |
| ピスタチオナッツ | 160〜447 | [ 11、20、21 ] _ _ _ _ |
| ヘーゼルナッツ | 113〜370 | [ 11、21 ] _ _ |
| クルミ | 150〜395 | [ 20、21 ] _ _ |
| アーモンド | 1138–1432 | [ 11、20、21 ] _ _ _ _ |
| ニンニク | 110 | [ 11 ] |
| じゃがいも | 32〜36 | [ 11、92、111 ] _ _ _ _ |
| にんじん | 10〜58 | [ 11、98 ] _ _ |
| キャベツ | 20〜40 | [ 11、98 ] _ _ |
| トマト | 20〜10月 | [ 11、98 ] _ _ |
| ブロッコリー | 117〜120 | [ 11、98 ] _ _ |
| ほうれん草 | 180〜189 | [ 11、98 ] _ _ |
| カリフラワー | 90 | [ 98 ] |
| オレンジ | 40 | [ 11 ] |
| アボカド | 130 | [ 11 ] |
| いちご | 20〜22 | [ 11、98 ] _ _ |
| りんご | 26〜40 | [ 11、98 ] _ _ |
| 白パン | 110 | [ 99 ] |
| 茶色のパン | 160〜322 | [ 99、309 ] _ _ |
| 豚肉 | 100〜309 | [ 78、92、100 ] _ _ _ _ |
| 牛肉 | 90〜170 | [ 78、92、100 ] _ _ _ _ |
| 鶏の胸肉 | 30〜120 | [ 78、92、100 ] _ _ _ _ |
| レバー、牛肉 | 2760 | [ 101 ] |
| レバー、豚肉 | 3000 | [ 101 ] |
| シーチキン | 70 | [ 102 ] |
| イワシ | 340 | [ 102 ] |
| ヒラタケ | 200〜210 | [ 103、104 ] _ _ |
| ボタンマッシュルーム | 384〜390 | [ 103、105 ] _ _ |
| パン酵母 | 1113 | [ 101 ] |
| 牛乳 | 169〜180 | [ 11、92、311、312 ] _ _ _ _ _ _ |
| ヨーグルト | 160〜270 | [ 106、311 ] _ _ |
| チーズ、チェダー | 441 | [ 101 ] |
| 卵 | 457〜500 | [ 92、107 ] _ _ |
食品の加工と保存はリボフラビン含有量に影響を与える可能性があります[51]。穀物の一次加工は、リボフラビン含有量を著しく減少させる[313]。製粉された精製小麦粉中のリボフラビン量は、全粒小麦粉と比較して38~73%減少する[56,57,58]。同様に、白米および各種トウモロコシの精白製品におけるリボフラビンの損失は、玄米[60,61,109]および全粒トウモロコシの核[62,63]と比較して、それぞれ33〜57%および60〜75%である。
リボフラビンの損失は、通常、熱処理中にむしろ低い(12-15%) [21,51,75,84,86]である。加熱調理処理(ボイル、シチュー、ロースト、フライなど)中の食肉中のリボフラビンの主な低下(10〜30%)は、調理水またはドリップへの浸出によるものとされています。スープや肉汁などの調理液を含む肉の消費は、リボフラビンの大部分を保持する可能性があります[70,73,77,100,108,112,314]。豆類では、煮沸すると水への溶出によりリボフラビン含量が約25%減少するが、煮込みはリボフラビンを保持する[70,74]。豆類を茹でると、事前にアルカリ溶液(炭酸水素ナトリウム)に浸すと、リボフラビンの損失が大きくなる[113]。米のリボフラビン量は、炊飯前の洗浄と過剰な水での茹でにより減少する。これらの損失はそれぞれ11-26%、25-35%である[82,110]。同様に、キノコを茹でたり、煮たり、揚げたり、焼いたりすると、料理全体(煮汁、ソース、スープを含む)で5%のリボフラビンの損失が生じ、水を捨てて茹でる場合は、さらに30%のリボフラビンの量の減少が起こります [70]。同様の状況は野菜のリボフラビンにも現れ、前者の処理ではリボフラビンが5%減少し、後者では30%減少するため、茹でるよりも蒸すことが好まれる[70,72,73,111]。リボフラビンは牛乳の加熱やチーズの焼成にもほとんど影響を受けません[71,72]。牛乳の低温殺菌や超高温処理では、リボフラビンの損失は約2%である。一方、牛乳の煮沸では、時間に依存したビタミンレベルの減少が注目されている[116,315,316]。オート麦の全粒粉とトウモロコシのグリッツの押出処理では、リボフラビンの損失はなく、14%減少しています[119]。小麦パンや強化クッキーの焼成時のリボフラビンの損失は、10%と2-24%である[76,115]。卵のゆで卵、ポーチドエッグ、揚げ卵は、それぞれ6%、18%、8%リボフラビン含有量を低下させる[107]。缶詰工程は、ポークランチョンミートと同様に、野菜やキノコのリボフラビン含有量をわずかに減少させる可能性があります[125,126]。
キノコのリボフラビン量は冷凍保存中に著しく減少したが [81,105,128]、フリーズドライ食品では1℃、30℃、40℃の24ヶ月間の保存で3%しか減少しなかった[129]。冷凍前処理であるブランチングによる冷凍野菜中のリボフラビンの損失が報告されている[126]。リボフラビンは電離放射線に対して比較的安定であり、食品の殺菌方法として利用されている[51,68,121,122,123,124,288]。
リボフラビンの安定性に影響を与える最も重要な要因は350-560 nmの範囲の光であり,特に液体媒体中では400-520 nmの範囲の光による影響が最も大きい[51,286,287,288].蛍光灯の光は直射日光よりも害が少ないが、透明な包装の製品は小売店のストリップ照明の影響を受けることがある[51]。リボフラビンは牛乳の加熱処理に対して安定ですが、牛乳および乳製品における損失の主な原因の1つは光への暴露によるものです。光にさらされた液体ミルクは、2時間以内にリボフラビン含有量の20~80%を失う可能性があり、損失の速度と程度は、光の強さ、温度、およびさらされた容器の表面積に依存します[51,117,287,315]。リボフラビンは光照射により切断され,また高活性酸素種を形成し,他の化合物との光増感反応に関与する[284,285,288].このように、リボフラビンの光増感により、葉酸、チアミン、アスコルビン酸(ビタミンC)、ビタミンA、D、Eなどの他のビタミンも著しく失われ、特にタンパク質の酸化損傷や脂質の酸化(例えば、不飽和脂質の分解や毒性のあるコレステロール酸化物の生成など)を引き起こす光照射に対する食品の感受性に重大な影響を与えるようになります[285,286,288,317]。したがって、リボフラビン食品源は暗黒環境(適切な容器または暗黒条件)で保管することが重要である[306]。また、超高圧ホモジナイザーによる粒子径の縮小により、光にさらされた牛乳中のリボフラビンの分解速度が低下し、その結果、ビタミンの光分解に関連する波長の散乱と吸収により、牛乳の透明度が低下することが確認されています[318]。リボフラビンの光増感による不飽和脂質及びタンパク質の分解は、乳及び乳製品における光誘起の強いオフフレーバーの発現に関与している[284,285,317,319]。同様の光酸化はチーズ、バター、飲用ヨーグルトでも起こるが、固体または半固体構造であるため、表面の酸化ダメージは限定的である[286]。乳児への栄養補給に使用される貯蔵ヒト乳中のリボフラビンは、日光に曝されると非常に光分解を受けやすい。この分解により、生後0~6ヶ月の乳児の推奨摂取量の範囲内でリボフラビンが減少する可能性がある。しかし、冷蔵保存した場合は、2週間程度は安定です[320,321,322]。このため、バンクされたヒトのミルクは、保管中や加工中に光から保護する必要がある[322]。これは,リボフラビンによって感作された苦味のあるホップ酸(イソフムロン)の光分解に由来するものである[286].蛍光灯や日光から保護する褐色のボトルなど、適切な包装が必要である [285,286]。濃縮パスタ製品中のリボフラビン含量は、常温で8ヶ月間保存した場合、暗所では大きく変化しない(0.8%の損失)のに対し、昼光下では徐々に減少する[130]。リボフラビンは透明な包装に包まれた白パンで、明るい小売りの場所に保管されても安定した状態を保っています[51]。これとは反対に、発芽した食用種子や穀物では、種によってリボフラビン値が4倍まで増加する [90,94,95,96,132,133,323]。
ヒトおよび動物栄養学に使用されるリボフラビンは、1950年代からリボース(グルコースから容易に得られる)、3,4-ジメチルアニリンおよびバルビツール酸からの化学合成により工業的に製造されている[282,324,325]。1990年代には、自身の代謝必要量を超える量のリボフラビンを生産するいくつかの微生物株を用いた発酵プロセスが工業規模で実施された[282,295]。2000年頃、従来の化学プロセスとバイオテクノロジープロセスの両方を数年間並行して使用した後、前者は後者に置き換えられ、経済的かつ生態学的に実現可能になった(前者に対してコストは43%削減) [282,299,301,326,327].今日、商業的なリボフラビン生産はもっぱら微生物発酵によって行われ、主な微生物は子嚢菌のAshbya gossypiiと細菌のBacillus subtilisです [299,300,326,328,329,330,331,332,333,334,335,336].
強化食品は、多くの国でリボフラビンの追加的な食事源として役立っています [17,92,173,174,178,179,181,182,305,337]。リボフラビンを強化した最も一般的な食品は、調理済み食品を含むシリアル、小麦粉およびトウモロコシ粉、パン、乳製品、ベビーフードである[11,174,282,307,317]。作物をリボフラビンにバイオフォーティファイ ンするための大規模な研究は行われていません [61,92]。しかし、乳酸菌は、発酵食品中のリボフラビン濃度を向上させるために研究されています。乳酸菌は、ヨーグルト、チーズ、発酵ソーセージ、ピクルスなど、多種多様な発酵食品の製造のための食品産業におけるスターターカルチャーとして世界中で使用されています。乳酸菌の中には、リボフラビンを合成できる菌株もあり、その場で食品を強化できる実用的な利点があります。食品産業における乳酸菌の広範な応用を考慮すると、リボフラビンを生産できる乳酸菌は、リボフラビンを増加させた日記や穀物ベースの機能性食品の開発の可能性を持っています。そのような食品は、消費者が毎日の推奨摂取量を満たすのに役立ち、臨床的および潜在的なリボフラビン欠乏の予防に役立つ可能性があります[300,326,338,339,340,341,342,343,344,345]。
3.3. リボフラビンの薬物動態
3.3.1. 吸収
リボフラビンは通常、タンパク質と結合しているか、補酵素であるフラビンモノヌクレオチド(FMN)およびフラビンアデニンジヌクレオチド(FAD)の形で存在しています。消化酵素によるタンパク質の変性後、FMN/FADは腸のアルカリホスファターゼによってフラビンタンパク質から遊離し、その後、リボフラビンは腸上皮の刷子縁膜に存在するピロホスファターゼによってFMN/FADから遊離する [346].また、ヒトの腸内細菌もビタミンを産生する。ヒトの微生物叢は、このビタミンの1日の必要量を完全に供給することはできないが、リボフラビン欠乏ラットモデルで示されるように、低い食事摂取量をある程度補うことができる[342,347]。大腸内の細菌が産生するリボフラビンは、大部分が吸収可能な形態で存在する [348,349]。
遊離したリボフラビンは、腸管細胞に存在する特異的なトランスポーターによって輸送される。これらのトランスポーターのいくつかは最近クローニングされ、Solute Carrier Family 52 (SLC52 または Riboflavin Transporter Family) のメンバーとして特徴づけられました:hRFVT1 (SLC52A1), hRFVT2 (SLC52A2), hRFVT3 (SLC52A3) [350,351,352]. この担体を介した輸送は特異的であり、構造類似体やルミフラビン、FMN、FADなどの代謝阻害剤によって阻害される。SLC52A2 はリボフラビン類似物質に加えて,アミロライドによっても阻害された[353].これらのトランスポーターの細胞および組織レベルでの局在は異質である(表6).腸管細胞によるリボフラビンの内腔側への取り込みは主にSLC52A3によって行われ、基底膜から血液への輸送は同じファミリーの別のメンバーであるSLC52A2によって促進されます(図7)。SLC52A2とSLC52A3はリボフラビンの吸収・輸送に極めて重要であり、Brown Vialetto-Von Laere症候群(BVVLS)などの代謝性疾患との関連性が指摘されている。SLC52A1はこのトランスポーターファミリーの他のメンバーの欠損を補うことができないが、これはその組織や細胞分布の違いによるものと考えられる(表6) [350,352,354,355].
図7 リボフラビンの吸収
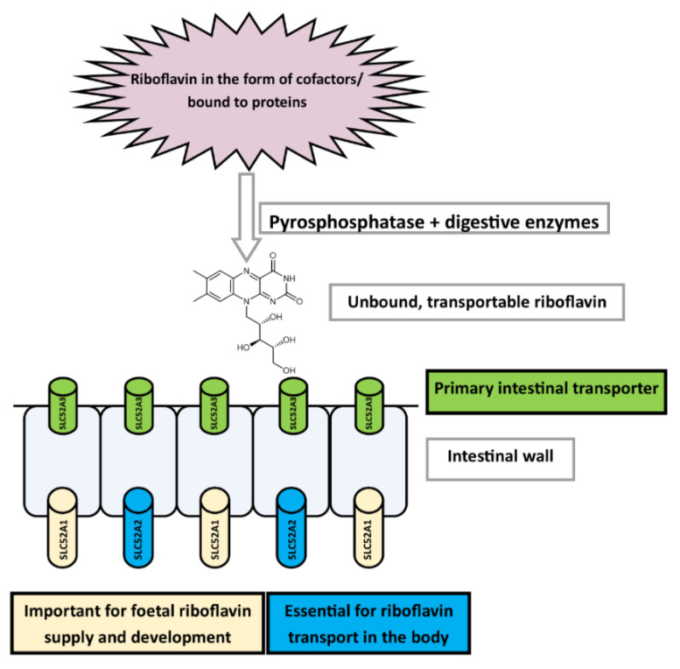
腸でのリボフラビン取り込みの大部分はSLC52A3によって可能となり、他の2つのトランスポーターは主に血液への基底部輸送と他の細胞での輸送を担っている
表6 ヒトにおけるリボフラビントランスポーターの組織局在性
| トランスポーター | ローカリゼーション | 機構 |
|---|---|---|
| SLC52A1 | 胎盤、小腸 | Na +、Cl –、pHに依存しない |
| SLC52A2 | ユビキタス、脳と唾液腺が高い | Na +、Cl –、pHに依存しない |
| SLC52A3 | 精巣、小腸 | Na +、Cl –独立した、pH感受性、中性pHでの活性の約1/2、pH5.5と比較した場合のpH8.5での1/3 |
3.3.2. 代謝
細胞内への取り込みと輸送 細胞内に取り込まれたリボフラビンは、リボフラビンキナーゼとFAD合成酵素の2つの酵素によって生理活性型に変換されます (次項参照)。逆も可能であるが、FMN/FADからリボフラビンを遊離させる細胞内加水分解酵素は不明である。吸収後、ほとんどのフラビンは血球、特に赤血球に局在し、赤血球には遊離リボフラビンは微量にしか含まれていないが、FMNとFADはかなりの量が含まれている[356]。血漿中のリボフラビンもアルブミンと免疫グロブリンに結合していますが、その量は細胞レベルよりかなり低いです。これらの化合物の血漿と赤血球の濃度の比較は、表7に見ることができます
表7 血漿および赤血球中のB2ビタミンの濃度。
| Vitamer | 血漿中濃度の中央値(nmol / L) | 赤血球濃度の中央値(nmol / L) |
|---|---|---|
| リボフラビン | 10.5 | 無視できる |
| FMN | 6.6 | 44 |
| 流行 | 74 | 469 |
血漿中濃度の中央値(nmol/L) 赤血球濃度の中央値(nmol/L) ビタマー
リボフラビン 10.5 無視可能
FMN 6.6 44
FAD 74 469
データは文献[356]による。
フラビン補酵素の合成 リボフラビンは細胞内に取り込まれた後、速やかに活性型に変換され、酵素の補酵素として機能します。フラビン補酵素の合成には、2つの酵素が必要である。リボフラビンキナーゼ(ATP: riboflavin 5′ phosphotransferase, EC 2.7.1.26) は、ATPからリボフラビンにリン酸基を転移させてFMNを生成し、FAD合成酵素(ATP: FMN adenylyltransferase, EC 2.7.7.2) はFMNからFADをアデニル化している(図8)。細菌では、これらのステップは両方ともFAD合成酵素という二重機能性酵素によって触媒される[357,358,359]。ヒトをはじめとする真核生物のFAD形成酵素は、細菌のFAD合成酵素とは無関係であるため、今後の抗菌薬開発のターゲットとして期待されており、高活性かつ高選択的な抗菌薬の開発が期待されている[360]。
図8 補酵素の生合成
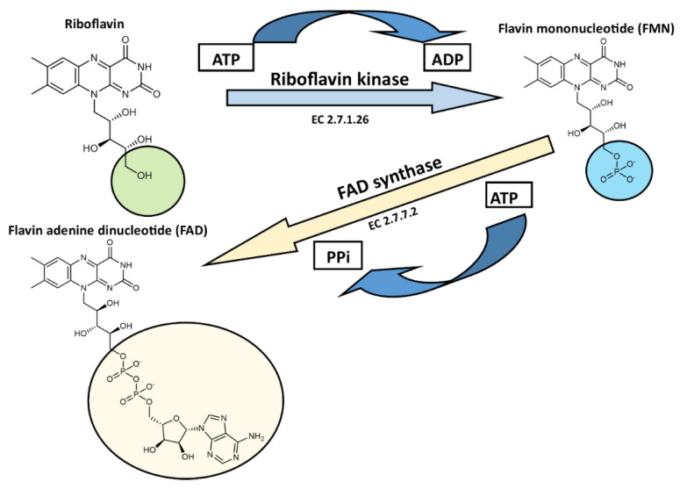
リボフラビンは、促進輸送機構によって細胞内に侵入した後、リボフラビンキナーゼとFAD合成酵素の2つの細胞質酵素によって生物活性型に変換される。ATP-アデノシン三リン酸、ADP-アデノシン二リン酸、PPi-ピロリン酸。詳細な説明は本文を参照
排泄 リボフラビンは水溶性ビタミンであるため、主に尿中に排泄されます。尿中のリボフラビンの大部分は、未変化体のリボフラビンの形で存在しますが、いくつかの代謝物も見つかっています。これらには、7α-および8α-ヒドロキシリボフラビンが含まれる。8α-スルホニルフラビンも少量ではあるが見つかっている。10-ヒドロキシエチルフラビン、ルミフラビン、およびその他のルミクロム化合物は、リボフラビンの腸内分解の産物であるため、ヒトの尿中には微量にしか存在しない[355,361]。
3.4. リボフラビンの生理機能
3.4.1. フラボタンパク質
リボフラビンの生理活性体であるFMNとFADは、いずれも2個の電子を可逆的に供与または受容することができるイソアロキサジン環を有しています。したがって、これらの補酵素を利用するヒトの酵素の大半は、還元酸化反応を触媒する。ヒトのフラボ蛋白質の解析から、1つの転移酵素と1つのリアーゼを除いて、これらの酵素はすべて酸化還元酵素であることが示されている(Supplementary Data Table S2)[362]。異なる種のフラボタンパク質のデータベースを複合的に解析した結果、91%の酵素が酸化還元酵素であり、同様の結果が得られた[363]。FMNに比べ、FADを補酵素として利用する酵素の数が多い。実際,ヒトのフラボ酵素のうち,FMNを補酵素として利用しているのは16%に過ぎない.ほとんどのフラビン酵素(90%)は、その補酵素を非共有結合で結合し、FADの場合は、主にタンパク質構造のロスマンフォールドを利用している[362,363]。
3.4.2. フラボタンパク質のヒトの健康における重要性
フラボ蛋白質は、コエンザイムA、コエンザイムQ、ヘム、ピリドキサール5-リン酸、各種ホルモンなど、他の補酵素の合成にも関与している。これらの過程が阻害されると、人間にとって重大な結果をもたらす。
ヘムの生合成は、細胞質でもミトコンドリアでも行われる。ミトコンドリアに存在する酵素の一つであるプロトポルフィリノーゲンIXオキシダーゼ(PPOX、EC 1.3.3.4)はFAD依存性であり、この酵素の活性低下は異型ポルフィリン症として知られる遺伝子異常を引き起こす。この疾患は、様々な臨床型と発症時期があり、生命を脅かす重篤な急性発作を起こすことがあります。残念ながら、この疾患の原因から、現在は予防的、対症療法的な治療しかできません。特定の薬物や日光などの増悪因子を避けることに加え、ゴナドトロピン放出ホルモンアナログ製剤により、月経前症候群の再発を予防することが可能です。急性期には、一般に麻薬性鎮痛剤と吐き気・嘔吐止めのセトロンが併用されます。軽度の発作には、プロトポルフィリンIXの酸化体であるヘミンを投与する必要があります。皮膚の増悪には、疼痛性病変に対する鎮痛剤と感染症に対する抗生物質が必要です。局所ステロイドはほとんど効果がない [362,364] 。
ビタミンB6の活性型であるピリドキシン5-リン酸の生成も、フラビン酵素であるピリドキシン5-リン酸オキシダーゼに依存している。この酵素の遺伝的欠損が数例報告されているが、予後は非常に悪く、治療法も限られている。ほとんどの患者は新生児てんかん性脳症を発症し、後に精神遅滞に悩まされた[362,365]。同様に、ビタミンB5からの補酵素Aの生成も、FMNを利用するフラボ蛋白質、ホスホパントテノイルシステインデカルボキシラーゼ(EC 4.1.1.36)に依存している。この特定の酵素の欠損は記録されていないが、この経路に関与する他の酵素の突然変異が重篤な症状で報告されている[362,366,367]。
コエンザイムQ10は、呼吸鎖反応と電子輸送の適切な機能に不可欠である。この生合成はcoq6遺伝子にコードされるフラボ酵素、モノオキシゲナーゼに依存している。この酵素の欠損がQ10欠乏症の原因となり、ほとんどの患者でステロイド抵抗性ネフローゼ症候群と感音性難聴を引き起こすことが明らかになった。これらの患者では,補酵素 Q10 の補充により,腎症の寛解と神経症状の進行の停止がもたらされる[362,368,369,370].
フラボプロテインは、甲状腺ホルモンの生合成とヨウ素のリサイクルの両方において重要な役割を担っている。T3およびT4合成に必要な過酸化水素は2つのFAD依存性酸化酵素によって供給され、不活性ヨードチロシンの脱ハロゲン化はFMN依存性脱ハロゲン化酵素によって行われる。このデハロゲナーゼのいくつかの対立遺伝子変異は、活性不足を引き起こし、甲状腺機能低下症を引き起こした [362,371,372,373].
3.5. リボフラビン欠乏症
食事による摂取不足は、数カ月間の欠乏の後、臨床的に現れる。症状は、咽頭痛、高血糖、口腔・粘膜の浮腫、ケイレンを含み、脱毛、皮膚の炎症、貧血、舌の腫脹、白内障発症、吸収不良、神経機能障害に進行することもある(図9) [307,374,375].
図9 リボフラビン欠乏症の代表的な症状。
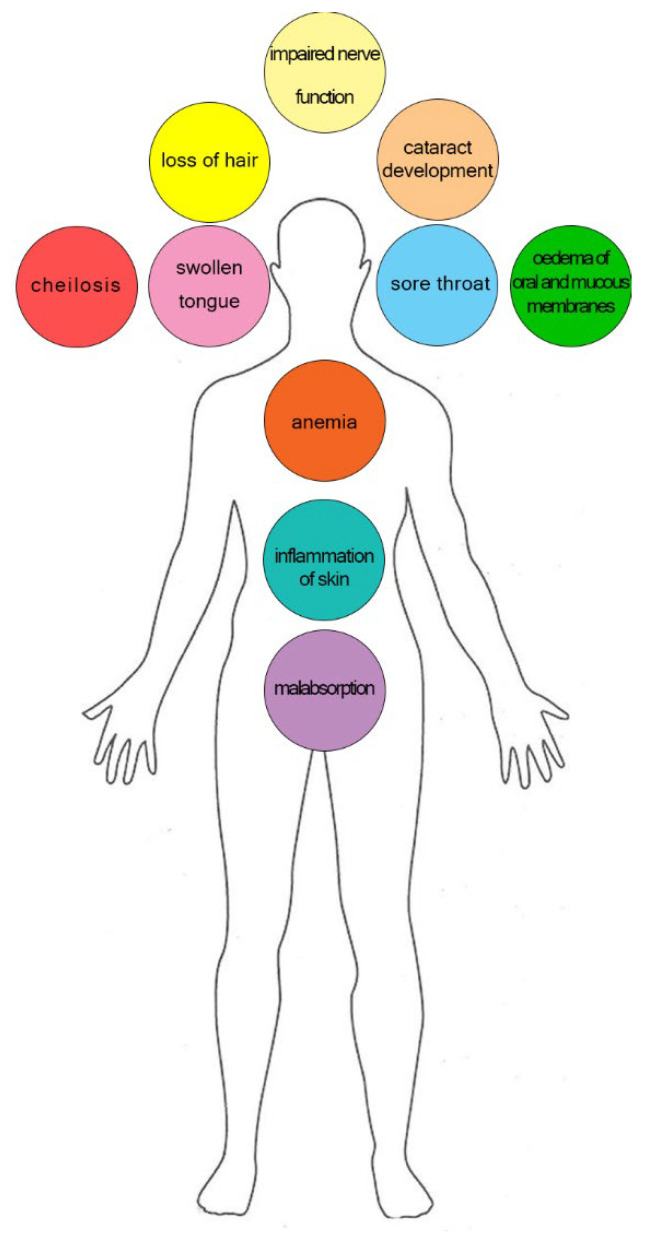
リボフラビンを十分に供給することの重要性とその欠乏の意味は,かなり以前に,リボフラビンの乏しい餌を与えたマウスのミトコンドリア機能と代謝の障害として観察されました[376].フラボプロテオームは前述の多くの生物学的プロセスに関与しているため、リボフラビンの不足またはこれらの遺伝子の変異は、幅広い表現型と臨床症状を持つ多くの代謝障害をもたらしています。
3.6. 分析的測定
リボフラビン値の分析的測定方法は、表3および補足データ表S1にまとめられている。リボフラビン量の概日変動が小さいこと、代謝が速いこと、半減期がかなり短いことから、現在、リボフラビン量の定量には、より生物学的に信頼性の高い別の方法が採用されています。これらの方法は、赤血球グルタチオン還元酵素活性化係数やピリドキサミンリン酸酸化酵素活性など、フラビン依存性酵素の酵素活性の推定に基づいている。前者は簡便で信頼性の高い方法であるが、グルコース-6-リン酸デヒドロゲナーゼ(G6PD)欠損のある被験者には適さない。これらの個体では、G6PD欠乏症の個体でも信頼できる、より感度が高く信頼できる方法であるピリドキサミンリン酸オキシダーゼ活性を使用すべきである[356,377]。
3.7. リボフラビンの薬理学的利用
リボフラビンの補給は、フラビン補酵素の輸送または合成の欠乏を補うか、フラビンタンパク質のフォールディングまたは安定性を改善することにより、いくつかの先天的代謝異常における有効で確立した治療法の選択肢となるものです。
多重アシル-CoAデヒドロゲナーゼ欠損症(MADD)は、電子伝達鎖の欠損による脂肪酸、アミノ酸、コリンの代謝異常で、劣性遺伝性の疾患である。重症のMADD患者は主にホモ接合体またはヘテロ接合体の機能喪失型変異体を保有しており、軽症のMADD患者はタンパク質のフォールディングと安定性に影響を及ぼす変異体を保有している。重症のMADDは発症が非常に早く、多くの場合新生児期に発症し、多臓器が侵され、患者は一般に発症から1年以上生存することはない。一方、軽症のMADDは発症が遅く、筋力低下、低血糖、脳症、まれに心筋症などの軽度の臨床症状を呈します。この2つの変異型の原因が異なり、臨床結果も異なるため、リボフラビン補充が軽症MADD表現型に優れた効果を示す一方、重症MADDにはほとんど効果がないことは驚くべきことではありません。ミオパチー表現型の遅発性患者は、98%の症例でリボフラビン補給に反応した [378,379] 。
リボフラビンの有益な効果は、アシル-CoAデヒドロゲナーゼ9欠損症の患者数名でも観察されている。治療に反応したすべての患者がこの遺伝子のミスセンス変異を保有していたことを考慮すると,そのメカニズムは軽度のMADD患者と類似している可能性が高い.リボフラビンは、フラボタンパク質を含むいくつかの先天性代謝異常に対して評価されているが、リボフラビン補給の有効性について決定的な結論を出すには、より多くの臨床試験が必要である。このトピックの詳細については、Mosegaardらによるレビュー [307]を参照してください。
リボフラビン輸送体の欠損は、Brown-Vialetto-Von Laere症候群およびFazio Londe病として知られる遺伝的ニューロン障害と関連している [379,380] 。これらの欠陥は、高用量のリボフラビン補給で効率的に治療できる。早期診断が、深刻な障害の発生を防ぎ、患者の安定化に最も重要である。これらの突然変異の症状は、O’Callaghanらによるレビューで徹底的に記述され要約されている。患者の多くは、聴覚障害(87%)、筋力低下(83%)、神経障害(89%)に苦しんでいる [380] 。ミトコンドリアの FAD トランスポーター(遺伝子 SLC25A32)の変異を持つ患者も最近報告されている。この欠陥もリボフラビン補充に反応するが、MADDとは異なる臨床症状を示す[379,381,382]。
リボフラビンの輸送または利用の障害によって引き起こされる疾患に対するリボフラビンの使用の可能性とは別に,いくつかの臨床試験で,リボフラビンが片頭痛の治療に有効であることが示されています.片頭痛の正確な原因やその詳細な分子的経過は不明であるが、様々な研究により、ミトコンドリアの機能障害と片頭痛の発生率との間に関連があり、特定のミトコンドリアハプロタイプはこの種の頭痛をより発症しやすいことが示されている。実際、リボフラビンによる治療は、特定の遺伝子型を持つ患者さんで有意に良好でした。抗てんかん薬やプロプラノロールなど従来から使用されている予防薬を超える効果はなかったが、副作用のリスクはリボフラビン投与群で有意に低かった。リボフラビン投与群の患者さんの治療に対する忍容性は非常に高く、副作用の発生率はプラセボ投与群と同程度でした。片頭痛予防にリボフラビンを使用する際の薬物動態および遺伝的要素に関してさらなる研究が必要であるが、このビタミンの興味深い前向きな使用法である [383,384].
ビタミンB2は、他のいくつかの可能性のある適応症でも試験されている。現在使用されている薬剤の有効性には至りませんでしたが、食事からの摂取または低用量の補充によるリボフラビンの摂取で肯定的な効果が報告されていることから、有効な補助剤であると考えられます。リボフラビンの抗酸化作用は、虚血再灌流による酸化傷害に有効であることが証明されています。これらの特性は、SH-SY5Y神経芽細胞、ウサギの心筋、およびラットの肺および脳挫傷などの様々なモデルを使用して報告されています[385,386,387,388]。
リボフラビンは、臨床的に使用されている薬剤との併用療法で使用された場合、いくつかの肯定的なアジュバント効果も示しています。抗生物質との併用により,リボフラビンは生存率を向上させた;しかしながら,今のところ動物実験しかない[389].リボフラビンは,in vitroで単独でマラリア原虫に効果を発揮するほか,マラリア治療でクロロキンと併用すると,貧血を減らし,感染症の全体的な転帰を改善した[390,391].リボフラビンは、免疫反応の重要な部分でもあり、好中球や単球の増殖とその食作用を促進し、特に炎症反応や侵害受容の軽減に有益です[389,392,393,394]。リボフラビンの光増感特性は、HIV、偽狂犬病ウイルス、西ナイルウイルス、パルボウイルス、エシェリキアコリ、リーシュマニア属などの不活性病原体に長波長紫外線と組み合わせて使用することができる[389]。白内障の形成は加齢と関連しており、リボフラビンは加齢性白内障に対して一定の予防効果を示した。また、白内障患者の大半はリボフラビンが不足しており、白内障形成の予防にこのビタミンが重要であることが証明された[395,396]。
食事からのリボフラビン摂取量が増加した女性では、月経前症候群の発症リスクが大幅に減少(35%)することが観察されている[397]。いくつかの研究では、リボフラビン摂取量の増加と相関する乳がん、肺がん、卵巣がん、および大腸がんの発生率の低下と、動物モデルにおけるメラノーマの転移の減少が示されている。一方、リボフラビンの欠乏は、食道がんなどのがんに対する高い感受性と関連しています[389]。
リボフラビンは2型糖尿病の改善にも効果があり、主にグルタチオンの回復に関与するが、マウスでは血糖値の低下やGLUT-4トランスポーターの発現の増加も観察されている[398]。
3.8. リボフラビンの毒性
これまでのところ、リボフラビンの消化管レベルでの飽和輸送の影響もあり、下痢や嘔吐などの消化器系の軽微な非特異的症状を除けば、リボフラビンの過剰摂取や毒性の報告はありません(たとえ高用量を投与した場合でも) [284,383,399,400].
3.9. リボフラビンの薬物動態に影響を与える薬物相互作用及び生理的機能に影響を与える薬物相互作用
3.9.1. ホウ酸
この化合物は防腐剤として局部に使用されますが、経口摂取などの中毒の場合、明らかなリボフラビンの枯渇が観察されています。この薬物動態学的相互作用は、ホウ酸がポリヒドロキシル化合物と容易に反応することに基づいています。したがって、リボフラビン-ホウ酸塩の複合体が形成される。この複合体は、リボフラビンの水溶性を増加させ、したがって、リボフラビンの尿中排泄の増加とその後のリボフラビン貯蔵量の枯渇と低ビタミン症をもたらす [401,402] 。
3.9.2. ドキソルビシン
この抗悪性腫瘍化合物は著しいリボフラビン欠乏を引き起こし、その副作用の一因となる可能性があります[403,404]。その理由は、フラビン補酵素合成の阻害である。
3.9.3. 抗精神病薬
フェノチアジン系の古い抗精神病薬の中には、フラビン補因子と構造が似ているものがあり、そのためフラビン依存性酵素を競合的に阻害することが可能である。特にクロルプロマジンは、D-アミノ酸オキシダーゼなどのフラビン依存性酵素を阻害することが可能であった。また、in vivoでのリボフラビンのFADへの取り込みも阻害した。この生合成経路はチロキシンによって刺激され、チロキシンがラットのモデルでフラビン生合成を増加させることが示された。クロルプロマジン治療によるこの経路の妨害は、甲状腺機能低下症で観察されるのと同様の状態を引き起こした。リボフラビンの利用率の低下に加えて,治療用量のクロルプロマジンを投与した動物では,リボフラビンの尿中排泄量も有意に増加した[405,406,407,408,409,410].この効果は、ラットモデルを用いて、心臓で最も顕著であった[411]。
3.9.4. 抗うつ薬
三環系抗うつ薬はフラビン化合物と構造的に類似しており、フラビンの代謝、利用、排泄に相互作用することができるが、その影響はクロルプロマジンの場合ほど大きくはない。しかし、この相互作用のメカニズムは同じである可能性が非常に高い [401,407,411]。
4. ナイアシン-ビタミンB3
4.1. 導入と特性
ナイアシンはビタミンB3として知られ、水溶性ビタミンB群の第3のメンバーである。ナイアシンという用語はニコチン酸(NA、ピリジン-3-カルボン酸)を示すが、主にニコチンアミド(ピリジン-3-カルボキサミド)およびニコチンアミドリボシドなどの関連する誘導体の一群を示すためにしばしば用いられる[412,413,414]。ほとんどの食事性ナイアシンはNAとニコチンアミドの形態であるが、一部の食品には少量のニコチンアミド・アデニン・ジヌクレオチド(NAD)およびニコチンアミド・アデニン・ジヌクレオチド・リン酸(NADP)が含まれる。
ナイアシンは、両方の形態(NAとニコチンアミド)で、最も安定な水溶性ビタミンであり[74]、通常、水系と固体系の両方で大気中の酸素、酸、熱、光に対して高い耐性を持っている[69,75,131,415,416,417,418]。
4.2. ナイアシンの供給源
植物、ほとんどの菌類、細菌はナイアシンを合成する[14,419,420,421,422,423,424]。ヒトを含むほとんどの哺乳類(ネコを除く;例えば[425])は、必須アミノ酸のトリプトファン[426]を、主に肝臓で部分的にニコチンアミドに変換できるため、トリプトファンもナイアシンの食事源と考えられている[427,428,429,430]。この点で、ナイアシンは水溶性ビタミンの中では特異な存在である[418,430,431]。換算には個人差があり、約60mgのトリプトファンは1mgのナイアシンに相当する[92,432,433,434]。しかし、ナイアシンの生産に利用できるようになる前に、タンパク質合成にトリプトファンが優先的に使用されることがある[417,429]。一般的な条件下では、食事のトリプトファンの約2%のみがナイアシンに変換される[428,429,435]。この変換は、特に十分な量の高品質タンパク質、ビタミンB2及びB6の摂取[427,430,436,437,438,439]など多くの要因にも影響されるが、外来のニコチンアミドそのものには影響されない[440]。ナイアシンは食事から摂取しなければならないが、トリプトファンは1日に必要なビタミンB3の約50%を食事から摂取できるため、明らかに大きく寄与している[417,441,442,443]。ナイアシンの主な食事源は、肉、全粒穀物、牛乳・乳製品である[18,303,432,444]。ピーナッツ、魚、キノコ、酵母はナイアシンを豊富に含む [308,417,435,444,445,446,447,448]。豆類やナッツ類もナイアシンを供給する有用な食品である [441,449]。コーヒーの定期的な消費も、ヒトのナイアシン摂取に顕著に寄与している[450,451,452,453,454]。一部の食品におけるナイアシンの含有量は、表8に示すとおりである。牛乳、チーズ、卵など、トリプトファンを含むタンパク質を多量に含む食品も、ナイアシンの適切な供給源である[435,441,444]。
表8 特定の食品におけるナイアシン含有量。
| 食べ物 | ニコチン含有量(μg/ 100g) | 参考文献 |
|---|---|---|
| オーツ麦 | 961〜2370 | [ 11、90、339、466 ] _ _ _ _ _ _ |
| 小麦 | 4957〜5700 | [ 56、90、92、93、339、466 ] _ _ _ _ _ _ _ _ _ _ |
| 米、玄米 | 3500〜5433 | [ 11、61、92、93、109、339、467 ] _ _ _ _ _ _ _ _ _ _ _ _ |
| ライス、ホワイト | 1300〜2400 | [ 11、61、92、109、466、467 ] _ _ _ _ _ _ _ _ _ _ |
| トウモロコシ | 1900〜3630 | [ 11、92、93、339 ] _ _ _ _ _ _ |
| ライ | 1700〜4270 | [ 11、56、90、339、466 ] _ _ _ _ _ _ _ _ |
| オオムギ | 4523〜5200 | [ 11、56、339、466 ] _ _ _ _ _ _ |
| キビ | 4500〜4720 | [ 11、93、339 ] _ _ _ _ |
| ソルガム | 2920〜4880 | [ 93、94、339、468 ] _ _ _ _ _ _ |
| 大豆 | 1623年 | [ 11、20 ] _ _ |
| レンズ豆 | 1930〜2605 | [ 11、96 ] _ _ |
| 落花生 | 12100 | [ 20 ] |
| マカダミアナッツ | 2473 | [ 11 ] |
| ピスタチオナッツ | 1300 | [ 11、20 ] _ _ |
| ヘーゼルナッツ | 1800 | [ 11 ] |
| クルミ | 570 | [ 20 ] |
| アーモンド | 3618 | [ 11、20 ] _ _ |
| ニンニク | 700 | [ 11 ] |
| じゃがいも | 1035〜1573 | [ 11、92、111 ] _ _ _ _ |
| にんじん | 837〜983 | [ 11、448 ] _ _ |
| キャベツ | 234〜323 | [ 11、448 ] _ _ |
| トマト | 400〜683 | [ 11、448 ] _ _ |
| ブロッコリー | 639〜814 | [ 11、448 ] _ _ |
| カリフラワー | 600 | [ 98 ] |
| ほうれん草 | 724〜1000 | [ 11、448 ] _ _ |
| オレンジ | 249〜282 | [ 11、448 ] _ _ |
| アボカド | 1738年 | [ 11 ] |
| いちご | 291〜600 | [ 11、448 ] _ _ |
| りんご | 91〜126 | [ 11、448 ] _ _ |
| 白パン | 1600 | [ 99 ] |
| 茶色のパン | 3800 | [ 99 ] |
| 豚肉 | 5600〜5900 | [ 78、92、100、469 ] _ _ _ _ _ _ |
| 牛肉 | 4600〜6500 | [ 78、92、100、466、469 ] _ _ _ _ _ _ _ _ |
| 鶏の胸肉 | 6801〜9181 | [ 78、92、100、466 ] _ _ _ _ _ _ |
| レバー、豚肉 | 13,200 | [ 101 ] |
| レバー、牛肉 | 15,300 | [ 101 ] |
| シーチキン | 21,900 | [ 102 ] |
| イワシ | 10,100 | [ 102 ] |
| ヒラタケ | 4952〜5870 | [ 103、104、308、470 ] _ _ _ _ _ _ |
| ボタンマッシュルーム | 2800〜3300 | [ 103、470 ] _ _ |
| パン酵母 | 12,300 | [ 101 ] |
| 牛乳 | 89〜130 | [ 11、92、471 ] _ _ _ _ |
| ヨーグルト | 90〜200 | [ 106、472 ] _ _ |
| チーズ、チェダー | 52 | [ 101 ] |
| 卵 | 50〜75 | [ 92、107 ] _ _ |
ナイアシンの吸収または利用における異なる食品の干渉に関するデータはほとんどない。お茶はナイアシンのバイオアベイラビリティに影響を与えない [33]。例えば、ソルガムやトウモロコシのようなロイシンを多く含む穀類を主食とする集団では、食事によるロイシンの過剰摂取がトリプトファンからのナイアシン合成に拮抗する可能性が示唆されている [416,428,455,456,457,458,459].しかし、ロイシンのペラグラジェニック効果についてはまだ議論の余地がある [93,416,460,461,462,463].
食品加工はナイアシンの含有量に影響を与える可能性がある[415]。穀物に関しては、製粉とそれに伴う胚芽や重要な微量栄養素が多く含まれる穀物の外層の除去からなる一次加工によって、ナイアシンも大きく失われることになる[99,313,416,464,465]。精製された小麦粉とライ麦粉のナイアシン含有量は、全粒粉とライ麦粉に比べて、それぞれ75-82%と51%減少している[56,313]。同様に、コーンミールでは、ナイアシンは全粒粉のコーンフラワーと比較して47%減少する[63]。玄米と比較して、ナイアシンの損失は、非パーボイルドとパーボイルド白米(すなわち精米)においてそれぞれ64-79%と38%である。その理由はチアミンの場合と同様で、ナイアシンの一部はパーボイリング中にビタミンが豊富な外皮層から胚乳に拡散し、その結果、次の精米時に保持されるからである[109,140,142]。
ナイアシンは肉、野菜、豆類の加熱処理中も安定である。通常、調理水やドリップへの溶出がその損失の主な原因であり、約5〜55%を占めることがある [70,72,73,74,75,78,97,108,111,113,415,473,474,475,476]。例えば、ゆでた牛肉のナイアシン含有量は生肉のそれと比べて45%であり、残りの55%はスープ中に発生する[100]。煮汁を捨てなければ、ナイアシンの全体的な損失は最小限にとどまる[416,444]。ナイアシンの損失はブランチング中に水によって洗い流されるため、10-25%である。高温で短い水ブランチングは、低温で長いブランチング時間よりも保持が良く、スチームブランチングは水ブランチングよりも優れている[415]。米中のナイアシン量は、炊飯前の洗浄(リンス)と、捨てられる余剰水でのボイルにより、それぞれ3〜13%、25〜50%減少する[109,110]。炊き水を残すと、米の煮炊きではナイアシンの損失は発生しない[72]。水洗いは玄米のナイアシンにほとんど影響を及ぼさないが、濃縮パーボイルドとノンパーボイルド白米のナイアシンレベルを減少させる(後者ではかなり)。可変量の水で炊くと、水量が増えるにつれてナイアシン含量が低下する。この損失は玄米ではあまり現れず、パーボイルドでない白米で最も大きくなる[163]。ナイアシンはパンの焼成中も安定である[415]。強化クッキーの焼成によるナイアシンの損失は、焼成温度と時間に依存して約1〜12%であり、比較のために同じ条件でリボフラビンとチアミンはそれぞれ2〜24%と2〜50%であった[76]。ナイアシンは牛乳、チーズ[72,472]、卵の加熱処理中にも安定であり、野菜やポークランチョンミートの缶詰加工中にも安定である[125,126]。
牛肉の死後熟成では、7日間で最大30%のナイアシンが失われるが、残ったナイアシンは調理中に比較的安定である[415]。穀物(オート麦とトウモロコシ)中のナイアシンの保持に対する押出技術の効果も調査された;オート麦とトウモロコシでナイアシンの損失はなく、それぞれ10〜25%の減少が観察された[119]。湯通しした野菜の脱水に関する研究では、脱水の過程でキャベツのナイアシンがさらに5-15%損失することが示された[415]。ナイアシンは、リボフラビンと同様に、食品の殺菌技術として用いられる電離放射線に対して比較的安定である[68,122,124,415,477]。強化パスタ製品中のナイアシン含量は、保存条件(暗所、常温の日光下、冷蔵庫)とは無関係に、8ヶ月間の保存中にわずかながら(5.4〜6.4%の減少)だけ徐々に減少した[130]。ボタンマッシュルーム中のナイアシン量は12ヶ月間の冷凍保存で減少した[105]。
穀類では、ナイアシンはほとんどが吸収されないエステル化体、すなわちニコチン酸が多糖類にエステル化したナイアシチン、およびニコチン酸がポリペプチドや糖ペプチドにエステル化したナイアシノーゲンとして存在する(調理後でも)。これらの結合型のうち生物学的に利用可能なのはごく一部(約25~30%)で、胃酸で加水分解される可能性がある[424,442,444,465,478,479,480,481]。ナイアシンのエステル結合型の生物学的利用能は、食品をアルカリで処理してエステル結合を加水分解することで大幅に改善できる [22,415,442,444,478,482,483,484,485,486].ニクタマリゼーションは、トウモロコシの穀粒の熱アルカリ処理で、トウモロコシの技術的、栄養的、および感覚的特性を改善し、マイコトキシンを大幅に減少させます。このプロセスでは、トウモロコシ粒を水酸化カルシウム溶液で煮沸し、その後蒸煮してニクタマル(蒸煮トウモロコシ)を得、これを十分に洗浄し、挽いてマサ(湿った生地または乾燥させて粉)を作ります。そこから様々な製品が得られ、トルティーヤが最も人気があります [63,487,488,489,490,491,492,493,494,495]. ニクタマリゼーションは、ナイアシンを含むいくつかのビタミンB群に31-32%の損失をもたらす[22,488,496]。しかし、ナイアシンは、上記のように、生のトウモロコシよりもアルカリ処理されたトウモロコシの方が利用しやすくなっています。ニクタマリゼーションによって、トウモロコシに含まれる利用可能なナイアシンの量が効果的に2倍になることがわかった[497,498]。マヤ人とアステカ人によって開発され、今日ではアメリカなど他の国でも使用されているこのプロセスは、結合したナイアシンを効果的に放出し、ペラグラの発生率が非常に低いメソアメリカの集団において、少なくとも部分的にはペラグラに対する防御に関係しているようである [62,416,418,458,483,484,489,492,494,499].一部の研究者は、結合したナイアシンではなく、アミノ酸バランスの変化が、生物活性とペラグラジェン作用における生と石灰処理トウモロコシの違い、例えばイソロイシン/ロイシン比の増加の原因であると仮定しています [458,487,495,500]。それにもかかわらず、アルカリ処理トウモロコシの有益な抗ペラグレーゲン作用が立証されました。
ナイアシンは、加熱によってその前駆体から放出されることがある[416,501]。コーヒー生豆を焙煎すると、アルカロイドのトリゴネリン(ベタインのN-メチルニコチン酸)から脱メチル化によりNAが生成される[416,435,502]。焙煎豆のニコチン酸含有量は、焙煎時間と温度(=焙煎度)に依存して約10〜25倍に増加する[416,503,504,505]。焙煎の度合い、コーヒー品種、コーヒーの抽出技術は、コーヒー1杯のNA量に影響を与える[416,452,502,504,506]。平均して、1杯で1日の推奨NA摂取量の約9%をカバーできるため、コーヒー摂取がナイアシン1日の供給量の顕著な一部を構成する可能性がある[452,502]。焙煎はピーナッツのナイアシン含有量を増加させた(11-33%) [507]。小麦パンの焙煎は、熱によって結合型から解放されるため、ナイアシンを65%増加させた[508]。
発芽したソルガム(35-45%増)[94,509]、雑穀(22%増)[94]、レンズ豆(9-83%増)[96]、小麦(19%増)[132,510]、トウモロコシ(64-142%増)でナイアシン含有量が増加する[509,511]. レンズ豆の粉を自然発酵させると、ナイアシンの量が24-91%増加した[310]。ライ麦のサワードウ発酵では、乳酸菌の活性によりニコチンアミドの含有量が10倍に増加した[512]。
ビタミンB3の工業的生産は、現在、化学合成と生触媒をベースにしている[171,513,514,515,516]。化学的プロセスは、2-メチル-5-エチルピリジン、3-メチルピリジン(3-ピコリン)、または3-シアノピリジンを出発物質として利用し、アセトアルデヒド、ホルムアルデヒド、パラアルデヒド、2-メチルグルタロニトリル、アンモニアなどの単純化合物から合成される [417,443,517,518]。化学的経路では,高温,高圧,金属触媒(バナジウム,チタン,ジルコニウムの酸化物など),有害な化学物質を必要とし,通常,副産物を含む不要な廃棄物の形成と関連している[417,443,515,519].一方,生体触媒プロセスは,酵素を触媒として利用するものであり,温和な条件で操作でき,特異性と収率の点で非常に効率的である[417].また、これらのプロセスは、環境に優しく安全である[520]。ビタミンB3の製造のための生体触媒的方法に焦点を当てた集中的な研究が行われている[420,519,521,522,523,524,525,526,527,528,529,530,531,532]。ニコチンアミドは、3-シアノピリジンから、ニトリルのアミドへの水和を触媒する酵素ニトリルヒドラターゼを含む固定化細菌細胞Rhodococcus rhodochrous J1によって工業規模で生産される[417,443,520]。分離されたニトリルヒドラターゼの安定性が低いため、全細胞が生物触媒として使用される[531]。ビタミンB3の工業的な発酵手順はまだ確立されていない。高収率の生体触媒プロセスを備えた発酵的なものを開発する動機付けはほとんどない[171,513]。
天然のナイアシン供給源と並んで、強化食品はビタミンの追加的な食事供給源となる[92,173,175,178,179,183,185,186,416,424,533,534,535]。小麦粉、トウモロコシ粉、米のナイアシン強化は、多くの国で義務づけられている [92,163,181,182,417,536]。ナイアシンは、パン、朝食用シリアル、パスタにも添加されている[174,416,443,449]。
バイオフォート化、すなわち品種改良や遺伝子工学によって作物の天然微量栄養素レベルを増強することに関しては、どの作物においてもナイアシン含有量を増強する努力はなされていない[92]。しかし、小麦粒のナイアシンの遺伝的変異が評価されたが、ナイアシンの含有量は遺伝性が低いだけであり、したがって、植物育種によって大幅に増加させることはできそうにない[92,537,538]。一方、色素米の異なる品種は、ナイアシン含有量に幅広いバリエーションを示し、これは将来の育種構想のためのリード戦略を提供する可能性がある[92,539]。バイオフォート化の第二のアプローチ、すなわち遺伝子組換え技術によるナイアシン合成のアップレギュレーションは、ナイアシンの生合成経路が複雑であり、その遺伝子制御がよく分かっていないため、少なくとも短期的にはありえないようである[538,540]。また、植物はビタミンB3の生合成経路の変化に対して非常に敏感であることを示唆する報告があり、植物の成長と発達に負の影響が観察されている[172]。トウモロコシは、米や小麦などの他の穀物とは対照的に、もともとトリプトファンが乏しいため、アミノ酸プロファイルを改善する試みがなされている[62,416]。従来の植物育種技術によって、高品質タンパク質トウモロコシのトリプトファン含有量を2倍にすることが成功し、トリプトファンバイオフォート化品種のいくつかは商業化されている [92,541,542,543,544,545,546]。
4.3. ナイアシンの薬物動態
4.3.1. 吸収と分布
NADおよびNADPが食品から摂取されると、腸内で酵素的にニコチンアミドに変換され、NAとともに吸収される[547]。ナイアシンの主な吸収部位は小腸であるが、一部は胃で吸収される[412,413,414]。ニコチンアミドの吸収は迅速であり、低濃度ではNa+依存性の促進拡散によって媒介される。3~4gの超高用量で摂取した場合も、ナイアシンはほぼ完全に吸収されるが、そのほとんどは受動拡散によってである[548]。
ナイアシンはすべての組織に輸送され、そこで主な活性体である補酵素NADに変換される。ナイアシンの両形態は単純拡散によって細胞に入るが、ニコチン酸とニコチンアミドの両者は促進輸送によっても赤血球に入り、循環予備プールを形成してこれらの細胞の機能を支える [549] 。
4.3.2. 代謝
NAD合成 哺乳類では、生化学的に活性な形態であるNADは、ビタミンB3グループのすべての分子(NA、ニコチンアミド、ニコチンアミドリボシド)とトリプトファンから合成することができる(図10)。
図10 哺乳類におけるNAD合成経路

食事由来のNADの生産に関わる生化学反応。青い矢印は、NAD+消費酵素の活性と、こうして放出されたニコチンアミドがサルベージ経路に入ることを示す。詳細な説明は本文を参照。
NADはナイアシンから、Preiss-Handler経路の3つの代謝ステップによって生成される。まず、NAはニコチン酸モノヌクレオチド(NAMN)に変換される。この反応はニコチン酸ホスホリボシルトランスフェラーゼ(NAPRT)という酵素によって触媒され、5-リン酸-α-D-リボース-1-二リン酸を共基質として使用する。続いてNAMNは、酵素ニコチンアミドモノヌクレオチドアデニルトランスフェラーゼ(NMNAT)により、ATPを利用してニコチン酸アデニンジヌクレオチド(NAAD)に変換される。最終的には、NAD合成酵素(NADS)により、グルタミンからアミノ基を導入してNAADのニコチン酸部分をアミド化し、さらにATPを1分子消費してグルタミン酸が生成される。
ニコチンアミドからのNADの合成は、重要なサルベージ経路をたどる。この経路は、NADを利用する多くの生化学的反応の際に放出されるニコチンアミドの再利用を可能にする。サルベージ経路では、まずニコチンアミドホスホリボシルトランスフェラーゼ(NAMPT)という酵素が触媒となり、ニコチンアミドが生成されます。このニコチンアミドからニコチンアミドモノヌクレオチド(NMN)への変換は、局所的なNAD合成の律速段階である。従って、NAMPT活性は、局所的なNADの利用可能性の重要な調節因子であり、下流のNAD消費酵素の調節因子である[550]。NAMPTは、より多くのNADを利用可能にすることによってヒト細胞の老化を遅らせることが指摘されており[551]、NAMPTの発現が概日リズム機構によって制御されていることから、おそらく概日リズムとNAD救済経路の間に直接的な関連を形成しているものと思われる[552]。NADサルベージ経路の最終段階はNMNAT酵素によって触媒され、NAMNからNADへの変換と同様である。
ニコチンアミンリボシドからのNAD合成の第3の経路は、ニコチンアミンリボシドキナーゼ(NRK)酵素によるこの分子のリン酸化によって開始され、NMNが形成される。NMNはその後、上述したようにNMNATアデニル基転移によってNAD合成に利用される。
NADの最後の重要な供給源は、デノボ合成-アミノ酸トリプトファンのNADへの変換-である。これらの合成反応は、トリプトファンをNAMNに変換するキヌレニン経路で始まる[553]。臨床的に重要なのは、この生化学的経路のいくつかの酵素が、ビタミンB2やB6の欠乏によって阻害されることである[554]。NAMNは、Preiss-Handler経路においてNAMNをNADに変換するのと同じ反応を用いて、NAAD(NMNATによって触媒される)、そしてその後、NAD(NADSによって触媒される)に変換される。
NADのリサイクル NAD+を消費する酵素/サーチュイン、CD38、ポリ(ADP-リボース)ポリメラーゼ/の活性により、NADの損失が続いており、酵素的にNAD+を切断して、通常ニコチンアミドを生成している。このような高度なNAD消費は、食事からの摂取では補うことができない。代わりに、ニコチンアミドは、NAMPTとNMNATの酵素活性を含む前述のサルベージ経路を使用して、NADにリサイクルされる。ほとんどのNADはこの方法で回収されるため、NAMPTの活性はニコチンアミドレベルやナイアシンの食事摂取量よりもNAD濃度に大きな影響を与える[555]。
NADPの合成 NAD+は、NADキナーゼの活性によって、異なる酸化還元電位を持つ分子であるNAD+リン酸(NADP+)に変換されることができる。この反応では、NADのアデノシンリボース部分の2′-ヒドロキシル基に、ATP由来のリン酸基が1つ転移されることが多い。NADP+の代わりにNADPHを生成し、NADHを基質として利用することも可能である。したがって、NADP合成はNADの利用可能性に決定的に依存し、NADシグナル反応に加えて、もう1つのNAD消費プロセスとみなすことができる[556]。
4.3.3. ナイアシンの排泄
消費されたNAは、肝臓でアミド化経路と抱合経路という2つの別々の代謝経路によって、広範な初回代謝を受ける[557]。アミド化経路は、高親和性で低容量の代謝経路である [558]。これはニコチンアミドとピリミジン代謝物を生成し、ナイアシンの肝毒性に関連している。共役経路は、低親和性で高容量のプロセスであり、ニコチン尿酸(NUA)のようなNAのグリシン共役物が形成される。NUAは、薬物として投与された高用量ナイアシンの典型的な副作用である血管拡張と紅潮に関与していることが示唆されている[557,559]。
吸収が速いため、吸収速度は医薬製剤に強く依存し、医薬製剤からのナイアシンの放出速度が決定される。即時放出型製剤は、NAの溶解と吸収が速く、低容量アミド化経路を飽和させ、薬物の大部分がNUAに代謝されることになる。このことは、NAの高いピーク濃度と相まって、フラッシングの高い発生率をもたらす。徐放性製剤は、時間をかけてゆっくりと薬物を放出するため、薬物の大部分がアミド化経路で代謝され、しかし、より大量の肝毒性代謝物を生成する [557,558]。
肝臓は、残存する過剰なニコチンアミドをN1-メチルニコチンアミド、N1-メチル-2-ピリドン-5-カルボキサミド、および他のピリドン酸化生成物にメチル化し、これらは尿中に排泄される。ナイアシンの摂取量が非常に多い場合、未代謝のNAおよび/またはニコチンアミドが尿中に存在する可能性もある[560]。
4.4. ナイアシンの生理的機能
NADおよびNADPの幅広い機能は、3つの明確なカテゴリーに分けることができる。
(A) 補酵素。第一のカテゴリーは、還元および酸化(レドックス)反応にNADおよびNADPを補因子として利用する酵素に関係する。酸化還元反応では、NADとNADPはともに還元型(NADHとNADPH)と酸化型(NAD+とNADP+)の間で揺れ動く。還元型と酸化型の比率は様々な要因で変化するが、NADやNADPの総量は変化しない。
(B) 基質。NAD利用の第二のカテゴリーは、NAD+消費酵素群に依存する。これらの酵素は、NAD分子のADP-リボース部分を転移する反応において、酸化型NAD+のみを基質として使用する。これらの反応はNAD+の酵素的分解を必要とするため、NAD+を消費し、他の細胞内反応に利用できる総NAD+濃度の減少につながるのである。
(C) リガンド。比較的最近発見された第3のタイプのNAD+の機能は、プリン受容体群のリガンドとして機能することである。NAD+の放出は、シグナル伝達分子として、血管平滑筋細胞、膀胱、消化管、脳、および神経分泌細胞で観察されている[561,562,563,564]。NAD+に感受性のある受容体は、単球、血管内皮、あるいは大腸の細胞で検出された[565,566,567]。
4.4.1. 酸化還元反応
NADとNADPはともにレドックス・カップルを形成し、ほとんどの代謝プロセスにおける400以上の酵素反応において重要な補因子となっている[414]。レドックスカップルであるNAD+/NADHは主に酸化的・異化的反応に関与し、NADP+/NADPHは還元的・同化的反応に最も多く接続される。これは、2つのカップルの酸化還元電位の違いによって可能となる。生理的な条件下では、酸化型NAD+と還元型NADPHが一般的な形態である[424]。
酸化型NAD+によって促進される酸化的異化反応の例としては、解糖におけるピルビン酸の生成、アセチルコエンザイムAの生成、クレブスサイクルにおける完全異化が挙げられる。これらによりNADHが生成され、ミトコンドリア呼吸鎖を介したエネルギー産生が促進される。さらに、ミトコンドリアでの脂肪酸のβ酸化にもNAD+が必要である。NAD+が関与する異化過程の一般的な概要を表9に示す。
表9 NADまたはNADPを補酵素とする生化学的酸化還元反応
| NAD + / NADH | 異化 | NAD + →NADH | 解糖 | ブドウ糖→ピルビン酸 |
| 嫌気性グルコース酸化 | 乳酸↔ピルビン酸 | |||
| 脂肪酸のB酸化 | パルミトイルCoA→アセチルCoA | |||
| アミノ酸異化作用 | アミノ酸→アセチル/パルミトイルCoA | |||
| クレブス回路 | アセチルCoA/ピルビン酸→エネルギー | |||
| 同化作用 | NADH→NAD + | グリコネオジェネシス | 乳酸/ピルビン酸↔グリコーゲン | |
| 脂肪合成 | ブドウ糖→TAG | |||
| ステロイド合成 | コレステロール→様々なステロイド | |||
| NAD + →NADH | コレステロール合成 | アセチルCoA→コレステロール | ||
| NADPH / NADP + | 同化作用 | NADPH→NADP + | 脂肪酸合成 | アセチルCoA→パルミチン酸塩 |
| コレステロール合成 | アセチルCoA→コレステロール | |||
| 胆汁酸合成 | コレステロール→コール酸、ケノデオキシコール酸 | |||
| ステロイド合成 | コレステロール→様々なステロイド |
NAD+/NADHは、いくつかの同化反応の補因子でもある(表9)。グルコース濃度が不十分な場合、解糖系酵素の酵素平衡が逆転し、還元型NADHを利用できるようになり、細胞は乳酸、ピルビン酸、アセチルコエンザイムAなどの基質から糖新生によりグルコースを合成できるようになる。NADHはトリグリセリドの合成(グリセロール-3-リン酸の合成)やテストステロンからジヒドロテストステロンの合成(5α-リダクターゼの補酵素として)において補酵素として機能する[568].
還元型NADPHは、例えばコレステロールや脂肪酸の合成など、多くの同化生化学的プロセスにとって重要である(表9)。グルタチオン/脂肪酸の過酸化、チトクロームP450を介した反応、酸化ストレスに対するチオレドキシン防御、免疫酸化防御反応に関わる還元反応において必須の補因子である[569]。コレステロールの合成における重要なステップは、HMG-CoA還元酵素(スタチンの既知の薬理標的)による3-ヒドロキシ-3-メチルグルタリルCoA(HMG-CoA)からのメバロン酸の合成であり、NADPHを補因子として必要としている。また、コレステロールを起源とする様々な合成反応:胆汁酸やステロイドホルモンの合成にもNADPHが必要である。
赤血球にはミトコンドリアがないためか、高濃度のNADPHが存在する。このNADPHの利用可能性により、グルタチオン還元酵素の継続的な活性が可能となり、その結果、グルタチオン/脂肪酸ヒドロキシペルオキシダーゼ酵素が、鉄と酸素に富んだ赤血球の環境における酸化的ストレスを軽減することが可能となる。
NAD+/NADHとNADP+/NADPHのレドックスカップルは、エタノールやその他のアルコールの分解にも重要な役割を担っている。エタノールはいくつかの代謝反応によって、アセトアルデヒドに、そして酢酸に変換される。アセトアルデヒドへの変換は、シトクロムP450システム2E1(O2とNADPHの消費とスーパーオキシドの生成を伴う)またはアルコールデヒドロゲナーゼ(ADH、NAD+からNADHを生成)のいずれかの酵素によって触媒されることが可能である。続くアセトアルデヒドの酢酸への酸化はアルデヒド脱水素酵素(ALDH)により触媒され、これもNAD+を必要とする[570]。ADHによる代謝が優先経路であるが、高アルコール摂取または慢性アルコール摂取は、P450経路によるエタノール代謝を誘発し、肝毒性のリスクを高め、NAD+のレベルを減少させる。このNAD+濃度の低下とNADH濃度の上昇が著しい場合、NAD依存性酵素の酵素平衡がシフトする。このようなNAD+/NADH比のシフトは,エタノール解毒組織における乳酸の蓄積や糖新生の阻害,低血糖,クレブスサイクルでのエネルギー産生の阻害をもたらす可能性がある[424].
NAD+/NADHおよびNADP+/NADPHの両方は、すべての細胞における細胞呼吸鎖の機能にとって重要である。NAD および NADP は、他の細胞内区画と比較してミトコンドリア内に高濃度で存在し、心筋のようなミトコンドリアの多い組織は、ミトコンドリアの少ない組織(例えば、肝臓)よりも多くの NAD を含んでいます。
酸化還元反応におけるNAD型の役割は、酸化型(NAD+/NADP+)と還元型(NADH/NADPH)の分子の比率に強く依存しており、この比率が変化すると多くの酵素反応の平衡が変化することになる。さらに、この比率はNAD代謝のいくつかの酵素の活性だけでなく、すべての細胞内代謝過程(クレブスサイクル、解糖、糖新生、脂肪酸合成、ミトコンドリア呼吸鎖など)により絶えず影響を受ける。NAD/NADPの酸化還元状態は、任意の細胞および状況における生化学的エネルギー代謝の複雑なセンサーを表している。したがって、NAD は、全体的なエネルギー生産、エネルギー消費、および栄養に関する情報を統合する機能を持つ指標分子として機能する。
4.4.2. 基質としての NAD
細胞代謝の指標としてのNADの機能と複雑に関連しているのは、NAD+が細胞のエピジェネティックな情報を制御するいくつかの酵素の基質であるという事実である。NAD+は、その濃度が最も大きく変動し、様々な代謝の状況を最もよく反映する形態である。NAD+の濃度は、栄養摂取、運動、および概日リズムによって変化する[571]。NAD+とエネルギー代謝のこの密接な関係は、骨格筋におけるNAD+の利用可能性の増加が酸化的リン酸化を促進し、NAD+の補充がエネルギー代謝を改善する治療目標に使用できるという興味深い考えを引き起こした[572,573]。
代謝状態に影響されることに加え、NAD+濃度はNAD+消費型酵素によって直接制御される。このため、これらの NAD+ 消費酵素を活性化する刺激や状況に応答して、代謝過程を直接制御することができる。NADを継続的に消費する酵素のグループがいくつか同定されている。これらは、サーチュイン、ポリ(ADP-リボース)ポリメラーゼ(PARP)、ADP-リボシルサイクラーゼである。
4.4.3. ADPリボシルシクラーゼ
ADPリボシルシクラーゼ群は、酵素CD38とそのホモログCD157から構成される。その機能は、NAD+から環状ADP-リボースを生成し、同時にニコチンアミドを放出することである[574,575]。両者は好中球や内皮細胞に発現し、免疫反応に伴うシグナル伝達に関与していることから、免疫細胞活性化マーカーとみなされている。合成された環状ADPリボースはセカンドメッセンジャーとして細胞内シグナル伝達経路を活性化し、小胞体の受容体を活性化することで細胞内Ca2+濃度を上昇させる[569]。マウスでCD38を欠損させると、炎症部位への免疫細胞の移動が欠損し、感染症の発生率が上昇する[576]。
CD38/157によるサイクリックADP-riboseとCa2+の放出はオキシトシン放出の調節にも関与しており、社会的行動の調節に関与している可能性がある。CD38/157の発現量や遺伝子多型は自閉症スペクトラム指数と関連しており,NAD+の不足によるこれらの酵素の機能障害はペラグラに典型的な認知症や精神病に関連している可能性がある[577].
4.4.4. ポリ(ADP-リボース)ポリメラーゼ(PARP)
PARPスーパーファミリーの酵素は、標的タンパク質の特定の部位にADPリボースの翻訳後修飾を生成する。ニコチンアミドとリボースの間のグリコシル結合を切断し、NAD+を分解してニコチンアミドを放出し、ADP-リボース部分を標的タンパク質に結合させる。
現在までに,ヒトでは17種類のPARPグループの酵素が同定されている [578,579,580] .その中で、最初に結合したADP-リボースにさらにADP-リボース単位を付加し続け、翻訳後修飾としてADP-リボースのポリマー(PAR)を作る、真のポリメラーゼであることが示されているのは、PARP1、PARP2、PARP5a、PARP5bの数種のみであった。多くのPARPの酵素活性は、ADP-リボース単位を1つだけ結合させることに限定されている。
最も活性が高く、最も特徴的なPARP酵素はPARP1である。PARP1は、DNA鎖切断を検出し、それに結合した後に活性化される。活性化されたPARP1はNAD+を消費し、大きなPAR分子を標的タンパク質(PARP1自身を含む、ここで酵素活性を不活性化する)に付着させる[580]。この負のフィードバックループは、グリコヒドロラーゼによる PAR の迅速な分解とともに、DNA の損傷が存在する限り、細胞周期の進行を効果的に短期間抑制し、十分な DNA 修復を可能にし、損傷細胞の分裂を防止することを意味する。しかし、過剰なDNA損傷はPARP1の過活性化を招き、NAD+の枯渇と細胞死を引き起こす。この機構は、癌予防のプロトコルとみなされている[581]。一方、このようなPARP1の過活性化とそれに伴うNAD+の激しい枯渇を抑制することで、炎症や虚血・再灌流傷害後の細胞死を防ぐことができる[582,583,584]。
オラパリブ、ニラパリブ、タラゾパリブなどの薬剤による PARP1 の薬理学的阻害は、最近、いくつかの形態の癌の治療法として承認されました。この治療法は、複数の種類の腫瘍で検出された二本鎖DNA切断経路の相同組換え修復(HRR)の欠陥を利用したものである[585]。PARP1 を阻害すると、修復されない一本鎖 DNA 断片が蓄積し、二本鎖 DNA 断片が形成されます。これらは、インタクトなHRRを持つ細胞では効果的に修復される。しかし、HRRを欠損した腫瘍細胞では、「パリブ」が致死を引き起こす[586,587]。
このようにDNA修復におけるADPリボシル化の役割はよく知られているが、NAD+を消費するこの酵素の機能は、この一般的な見解を超えて拡張している。DNA修復に加えて、ADP-リボシル化はDNA複製と細胞分裂、転写、感染、ストレスへの応答、および老化の制御に関与している[588]。この幅広い機能の配列は、多くのタンパク質相互作用の調節、転写の制御、およびエピジェネティックな制御を基盤としている。
4.4.5. サーチュイン
サーチュインはクラスIIIヒストン脱アセチル化酵素(HDAC)ファミリーの一員であり、その酵素活性にはNAD+の分解が必要であるとされています。現在までに哺乳類では7つのサーチュインホモログが同定されている(Sirt1-Sirt7)[589]。NAD+の利用可能性やNAD+/NADHの酸化還元比の変化が触媒活性に直接影響するため、サーチュインは細胞のエネルギーや酸化還元状態のセンサーとして機能し、クロマチン構造に直接影響を与える。
HDACとしてのサーチュインの主な機能は、標的タンパク質上のリジン残基を脱アセチル化することである。これは、Sirt1-Sirt3、Sirt5、Sirt6が優先的に行う活性である。このプロセスの第一段階として、サーチュインはNAD+分子からニコチンアミド部分を切り離す。その後,標的タンパク質からアセチル基が残りのADP-リボースに転移し,脱アセチル化タンパク質と2-O-アセチル-ADP-リボースが得られる(図11)[590].Sirt4とSirt7では脱アセチル化活性は検出されていない:これらの酵素はNAD+を利用してADP-リボース基を標的タンパク質に転移させる。この酵素活性は、Sirt2やSirt3と共通している(デアセチラーゼ活性に加えて)。
図11 サーチュインによるNAD+枯渇のメカニズム
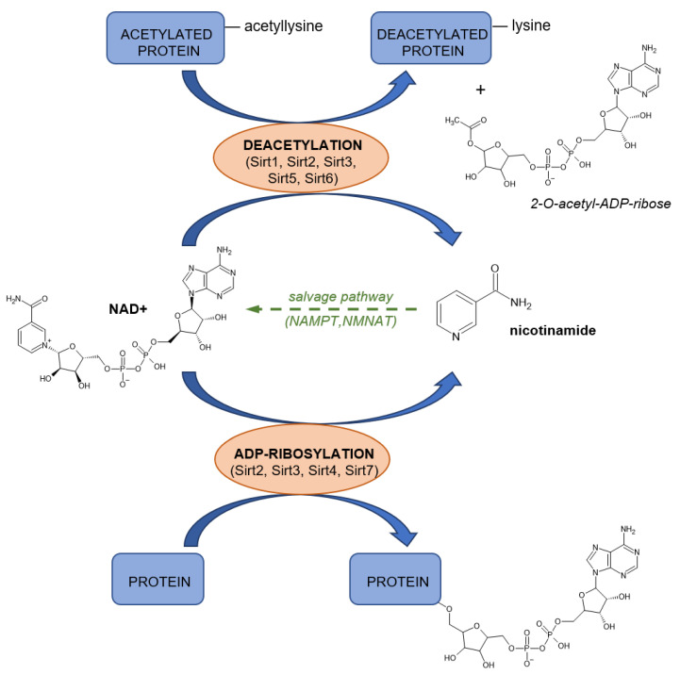
NAD+は、サーチュインが触媒する2種類のタンパク質修飾に必要である。ニコチンアミドはその過程で切断され、サルベージ経路を経てNADに再生される。
サーチュインは、いくつかの方法でNAD+と関係している。(1) その活性は利用可能なNAD+のレベルに直接依存し、またNADHやニコチンアミドのレベルが上昇すると、サーチュインの活性は直接阻害される。これは、直接的なNAD+および酸化還元状態のセンサー機構である。(2) サーチュインは、他のNAD+消費型酵素と利用可能なNAD+を奪い合う。PARP1などのNAD+利用能の高い酵素は、特に限られた細胞内マイクロドメインにおいて、サーチュインの活性を変化させる濃度までNAD+を枯渇させる可能性がある。(3)サーチュインは、概日リズムの転写因子であるCLOCKやBMAL1を制御し、その結果、NAD合成に重要な酵素であるNAMPTの発現を制御していることが報告されている。これは、NAD+の概日振動につながる制御ループを形成し、Sirt1およびSirt6と直接的に関連している[571,591,592]。
サーチュイン活性の一般的な結果は、転写因子活性の直接的な制御と同様に、クロマチン構造の変化という形でエピジェネティック情報を変化させることである。具体的には、サーチュインは、酸化的代謝、抗酸化防御、およびミトコンドリアにおける遺伝子発現を制御する転写因子を標的としています[593]。さらに、サーチュインは、ユビキタスな発現と細胞内局在の違いにより、筋形成、糖新生、インスリン分泌、脂肪形成、DNA修復、老化を調節することができる [594,595,596,597].
要約すると、代謝、栄養、および概日リズムの複雑な相互作用があり、そこではNAD+が中心的な役割を果たし、代謝および食事の情報と転写調節を結びつけている。NAD+を消費する酵素の集団的な活動は、細胞シグナル伝達をクロマチン制御およびエピジェネティック制御と統合し、環境条件の変化に応じた転写および遺伝子発現の調整を可能にするメカニズムであると言える。
4.5. ナイアシン欠乏症
ナイアシン欠乏症は、1735年にフランスの医師フランソワ・ティエリーとスペインの医師ガスパール・カサルによって初めて報告された。この病気は “ペラグラ”(”荒れた肌”)として1771年に初めて言及されている[598]。ペラグラは、3つの一般的な症状(皮膚炎、痴呆、下痢)を意味する「3Ds」または「4Ds」病として特徴付けられるようになり、死に至る(4Ds)可能性がある。ペラグラの流行は数百年前から始まっており、その多くは単調な食事(特に未加工のトウモロコシ)によるビタミンB3摂取不足が原因であった。生体液中のビタミンB3濃度の分析検出法を表3および補足資料表S1にまとめた。
ペラグラの詳細な疫学と症状については、他の場所でレビューされている(例えば、文献[599,600])。ペラグラは、ナイアシン不足の食事や緊急事態に関連して、発展途上国にまだ存在する[601,602,603]。現在、EUや米国では、食品にビタミンB群が強化されているため、ペラグラは非常にまれである。ナイアシン欠乏の最も一般的な原因は、アルコール中毒(35%)、薬物(26%)、摂取不足(16%)または吸収不良(13%)である[554]。ペラグラの治療には、食生活の改善とビタミンB3(NAまたはニコチンアミド)の10~300mg/日、最も重症の場合は1000mg/日の用量の補給が必要である。B3補給療法では、一般に、血管拡張や潮紅を起こさず、毒性も低いニコチンアミドがNAより好ましいとされている。
4.6. ナイアシンの薬理学的使用
NAやその他のビタミンB3は、数十年にわたり薬物治療薬として使用されてきた。しかし、近年、さまざまな疾患の分子メカニズムが解明され、ペラグラや脂質異常症の治療に使われてきたナイアシンが、それ以外の病態にも応用される可能性が出てきた。さらに、ナイアシン欠乏症(ペラグラ)に対抗するためのビタミンB3の投与と、異なる病態の治療における生理的・薬理学的用量のナイアシンの使用は、区別することが重要である。
4.6.1. 動脈硬化、脂質異常症、心臓血管のリスク
60年以上前、Rudolf Altschulは、NA(ニコチンアミドではない)の超生理学的用量が、ビタミンの機能に関連する生理学的効果とは無関係の正の効果を持つことを実証した[604]。グラム量のNA(1000〜3000mg/日、最高6000mg/日)の投与は、冠動脈疾患の治療において総死亡率を低下させながら、総コレステロール血漿濃度を低下させ、低密度リポタンパク質(LDL)コレステロール値を低下させ、高密度リポタンパク質(HDL)コレステロール値を増加させた[605]。その後の研究により、これらの効果は、NAのニコチン酸受容体へのアゴニスト作用によって媒介されることが示された。
ニコチン酸受容体 GPR109A NA受容体GPR109Aは、クラスAロドプシン様GPCRのGタンパク質共役型受容体(GPCR)ファミリーに属し、Giファミリーに結合している。GPR109A は、白色および褐色脂肪組織、脾臓、およびマクロファージ、単球、樹状細胞、好中球などの免疫細胞で有意に発現しています[606,607]。免疫細胞では、Giの活性化は一般にphospholipase Cβまたはphosphoinositide 3-kinaseの活性化につながる。免疫細胞におけるその役割はまだ不明である。
脂肪細胞を含む他の細胞型では、Giの活性化はアデニルシクラーゼを阻害し、細胞内cAMPレベルを減少させる。したがって、NAによるGPR109Aの活性化は、Gs共役型受容体(β-アドレナリン受容体、β-ARなど)の作用を打ち消し、その活性化によってcAMP濃度が上昇し、プロテインキナーゼAが活性化される。脂肪細胞では、プロテインキナーゼAがいくつかのタンパク質、特にトリアシルグリセロール加水分解に必須のタンパク質、ホルモン感受性リパーゼ(HSL)とペリピンのリン酸化に寄与していると考えられる。リン酸化されたペリリピンは、リン酸化活性化されたHSL(およびもう一つのリパーゼ-脂肪トリアシルグリセロールリパーゼ、ATGL)がトリアシルグリセロールを含む脂質滴にアクセスすることを可能にする。そして、これらのリパーゼはトリアシルグリセロールを遊離脂肪酸(FFA)とグリセロールに加水分解する(図12上段)。
図12 GPR109A受容体の機能
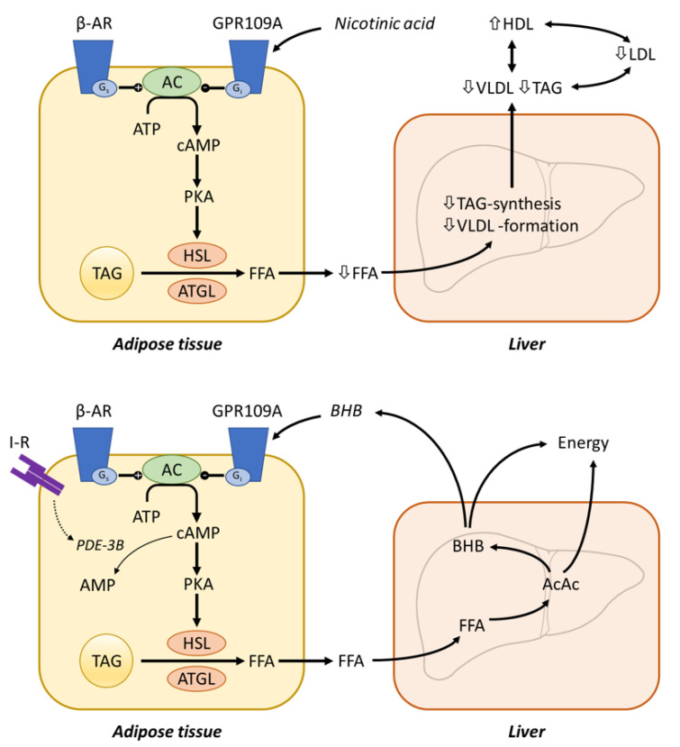
(上段)ニコチン酸の代謝作用。ニコチン酸受容体の活性化は、脂肪細胞からの遊離脂肪酸(FFA)の動員を抑制し、肝細胞でのVLDL産生を低下させ、結果として血漿中のVLDL/LDL濃度を低下させる。TAGは、コレステロールエステル転移タンパク質(CETP)を介してHDLへのコレステロールの移動を阻害する。(下段)GPR109A の生理的役割の可能性。空腹時には、交感神経系の活動の亢進とインスリン濃度の低下により、TAGのFFAへの分解が促進される。肝代謝では、エネルギー源としてβ-ヒドロキシ酪酸(BHB)とアセト酢酸(AcAc)が産生される。BHBは脂肪組織での脂肪の異化を制限する負のフィードバックループを形成する。
GPR109Aを選択的に活性化するナイアシンの誘導体がいくつか開発され、この受容体の内因性リガンドを同定するために大きな努力が払われてきた。生理的血中濃度が低いため、NA 自身が内因性アゴニストとして作用する可能性は低い。GPR109Aの活性化は、飢餓時に肝臓で産生されるケトン化合物であるβ-ヒドロキシブチレートによって証明されている[608]。Β-ヒドロキシ酪酸は、アセトンやアセト酢酸のような他のケトンがこの受容体に活性を持たないにもかかわらず、約750μMのEC50でGPR109Aのアゴニストとして作用します。このことは、飢餓状態におけるニコチン酸受容体 GPR109A の生理的な役割を示している。このような条件下では、交感神経系の高い活性が脂肪細胞のβ-アドレナリン受容体を刺激し、一方でインスリンのレベルは低い。その結果、細胞内のcAMPレベルが上昇し、脂肪分解が促進される。放出されたFFAは肝臓でβ-ヒドロキシ酪酸やアセト酢酸などのケトン体に代謝され、エネルギー源となる。β-ヒドロキシ酪酸の濃度は飢餓状態でミリモル領域に達し、GPR109Aの活性化によりβ-ヒドロキシ酪酸は脂肪分解を阻害する[609]。このように、β-ヒドロキシ酪酸は飢餓時の脂肪分解促進刺激に対抗し、この機構は絶食時のエネルギー保存のための負のフィードバックループを形成すると考えられる(図12下段)。
ニコチン酸の作用機序 NAの抗脂肪分解作用はβ-ヒドロキシブチレートと同様で、GPR109A受容体の活性化、cAMP/PKAシグナルカスケードの阻害、脂肪分解の阻害、脂肪細胞からのFFAの放出が介在していると考えられる。このことは、個々のタイプの脂質粒子に対するNA作用の時間的差異によって裏付けられているようである。NAを投与すると、血漿中のFFA濃度が非常に急速に(数分以内に)低下する。これに続いて、VLDLとトリアシルグリセロールが減少し(2~4時間)、何日も経ってからLDL濃度が減少する[610]-この時間経過は、確立した生化学的関係に従うものである。
脂肪細胞の脂肪分解を抑制するGPR109A受容体の活性化が、脂質異常症および動脈硬化におけるNAの主な作用機序であると思われるが、いくつかの代替/相補的な機序が提案されている。
(1) 細胞培養実験により、NAが肝細胞のジアシルグリセロールアシルトランスフェラーゼ2(DGAT2)を直接阻害することにより、トリアシルグリセロールの合成を抑制することが示唆された[611]。その結果、ApoBの分解が促進され、ApoBを含有するVLDLの形成が減少することになる[612]。しかし、DGAT2に対するこの効果は、NAを薬理学的に最大量投与した後に到達する血漿濃度よりも約100倍高いNA濃度においてのみ検出された[613]。
(2)NAがHDL濃度を増加させるメカニズムは、現在のところ明確には分かっていない。現在受け入れられている仮説は、VLDL/LDLとHDL間のトリアシルグリセロールとコレステロールの交換を間接的に妨害していると主張するもので、これはコレステロールエステル転移タンパク質 (CETP) によって媒介されるものである。CETPは、VLDL/LDLからHDLへのTAGと引き換えに、HDLからVLDL/LDLへのコレステリルエステルの双方向の移送を促進する[614]。NA投与後、VLDLおよびLDL中のトリアシルグリセロール含量が減少するため、このTAGとコレステロールの交換が減少し、結果としてHDL-コレステロール値が増加すると予想される。このことは、生理的にCETPを発現しないマウスからの観察結果[615]や、CETPを阻害するとHDLレベルが同様に上昇する実験結果[616,617]からも支持されている。いずれにせよ、このHDL増加作用はGPR109Aによって媒介されているようである。ニコチン酸の合成誘導体でGPR109Aのアゴニストであるアシピモックス(図13)は、GPR109Aアゴニストではないニコチンアミドが血漿コレステロールに影響を及ぼさないのに対し、NAと同様のスペクトルの効果(HDL上昇を含む)を持つ[618]。
図13 脂質低下薬として使用されるニコチン酸の合成誘導体アシピモックスの構造
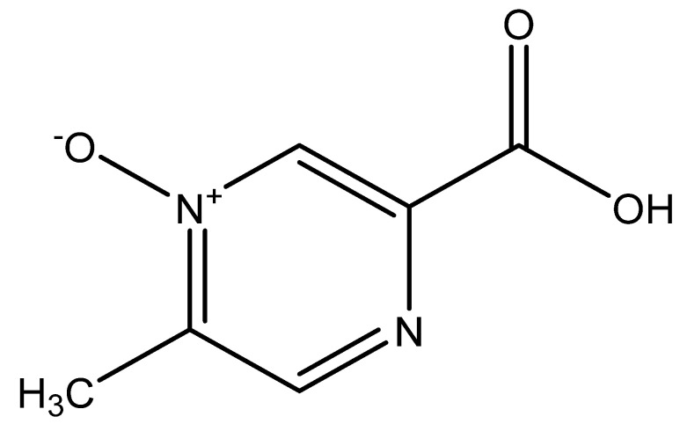
(3) NAがHDL値を増加させるもう1つの提案されたメカニズムは、ApoA含有リポ蛋白の異化の抑制である[619,620]。ここでも、これらの細胞培養研究は、通常の治療用血漿中濃度よりもはるかに高いNA濃度でこれらの効果を報告している。
(4) LDL/HDL濃度に対する上述の効果に加え、NAの直接的な抗動脈硬化作用が示唆されている。脂肪細胞 [621] および「非発泡性」マクロファージ [622] では、NAがGPR109Aを刺激し、転写因子ペルオキシソーム増殖因子活性化受容体γ (PPARγ) および肝臓X受容体α (LXRα) の発現を増加させることが分かっている。PPARγおよびLXRαは、次に、in vitroおよびex vivoでのコレステロールのアンロードに関与するATP結合カセットA1(ABCA1)およびG1(ABCG1)トランスポータータンパク質の転写を増強し[623,624]、実験動脈硬化の退縮に直接関与していると考えられる[625,626]。これらの観察と末梢マクロファージにおけるGPR109Aの発現が記録されていることから、動脈硬化病変におけるマクロファージ泡沫細胞からのコレステロールの除去と逆コレステロール輸送の刺激によって、少なくとも部分的にNAが抗動脈硬化作用を発揮することが可能である。
4.6.2. 加齢
加齢は、多くの病態生理学的変化を伴う複雑なプロセスである。現在、老化の2大要因として、DNA損傷の蓄積と、DNA損傷に起因するミトコンドリア機能不全が認められている。これらの要因は両方ともNADの利用可能性に依存しているため、NAD+レベルが老化と代謝の変化の関連性を示すと規定されている[593,627,628,629,630,631]。
様々な動物モデルからのデータは、加齢とNAD+レベルの低下との間に強い相関があることを示唆している[632,633,634]。この栄養に依存しないNAD+の損失の要因は、サーチュイン、CD38およびPARPsの活性の増加である[635,636]。PARP活性の増加は、DNA損傷の蓄積に対する反応であり、加齢におけるNAD+の枯渇に寄与している。同時に、PARP1の阻害[552,637]またはNAD+レベルの回復[638,639]は、少なくともいくつかの老化のモデルにおいて、老化表現型の改善をもたらすものであった。このNAD+の利用可能性の低下は、ミトコンドリア機能障害および代謝における加齢に関連した変化を防ぐために重要な、正常なサーチュイン活性を阻害する[595]。
NAD+前駆体の補給が、加齢したヒト集団においてミトコンドリア機能を改善し、DNA修復を促進するかどうか、また、サーチュインの低分子活性化因子と相乗効果を発揮して加齢時の健康寿命をさらに延ばすかどうかは不明である。
4.6.3. がんと細胞死
上記と同様のメカニズムで、遺伝毒性ストレスはNAD+の急激な枯渇を引き起こし、細胞死につながる。細胞培養神経細胞に直接 NAD+を補給すると、アポトーシス死から保護され [640]、ミトコンドリア NAD+の増加は、一般的な NAD+枯渇によって引き起こされる細胞死を防ぐことができた [555]。
さらに、NAD+枯渇は酵素平衡のシフトを引き起こし、細胞の代謝に変化をもたらす(ワールブルグ効果)。このような調節障害から細胞を保護することを目的とする老化の状況とは異なり、いくつかの研究では、薬理学的なNAD+枯渇により、確立した抗癌剤の細胞毒性効果を高める可能性が検討されている。NAD+の減少は、抗酸化防御システムを破壊することでがん細胞を酸化損傷に感応させ、DNA修復を妨げることで細胞死を誘発し、シグナル伝達経路を細胞障害性の方向へシフトさせる[641,642]。
4.6.4. 神経系疾患
パーキンソン病 パーキンソン病の基本的な特徴は、黒質におけるドーパミン作動性ニューロンの変性であり、その結果、運動機能の調節障害と、主にドーパミン合成の不足によって引き起こされる典型的な症状が発症します。
ドーパミンの合成経路にはいくつかの補酵素が必要であり、その一つがNADPHである。NADPHとPDの直接的な関連は確立されている。PD患者は一般的に健常者に比べてNADの血中濃度が低く、これらのNAD低濃度はGPR109Aの高発現と相関していた[643]。ナイアシンの食事補充はNAD濃度とGPR109A発現の両方を正常化し、その後PD患者の認知機能と運動機能の改善をもたらした[644]。外因性NADの同様のポジティブな効果は、細胞培養ヒトPDモデルで記述され、NAD濃度の増加は、ミトコンドリア機能不全と酸化的損傷に対して保護効果を発揮した [645].
PD(および潜在的には他の神経変性疾患)におけるNADのこの神経保護効果のいくつかのメカニズムが提案されている。例えば、Sirt1の活性増加、PARP1の活性減少、ミトコンドリア機能およびミトコンドリア生合成の回復、酸化還元NAD+/NADHバランスの回復および酸化ストレスの抑制、ミスフォールドしたタンパク質およびDNA損傷の毒性の減少、神経栄養因子およびシグナリング経路の活性増加など [428].
多発性硬化症 炎症に関連した進行性の神経変性は、多発性硬化症の基本的な病理学的メカニズムである。大きな進歩にもかかわらず、主に炎症をターゲットとする現在の治療オプションは、病気の進行を防ぎ、神経変性を停止させるために必ずしも効率的ではありません。実験データは,NAD+の枯渇と酸化ストレスによるミトコンドリア機能不全が多発性硬化症の発症に寄与していることを示唆している(文献 [646] に総説あり).まもなく、NMNATまたはSirt1の活性の増加は、いずれも多発性硬化症のモデルにおいて神経保護効果をもたらし、ニューロンにおけるNAD+レベルの増加を目的とした薬理学的介入は、より詳細に研究されるべきであると示される。
統合失調症 ペラグラが重症化すると、統合失調症に似たペラグラ型認知症を発症する。統合失調症患者は一般にビタミンB3の摂取量を増やしても改善しないが [449] 、ナイアシン補充療法に反応する患者の亜集団は存在する。これらの観察から、ナイアシン欠乏症と精神分裂病の脳の根本的なメカニズムに類似性があることが示唆される。ある研究では、慢性統合失調症患者はNAD+/NADH比が著しく低下していると報告されており [647]、これは統合失調症の病因と脳内のレドックス不均衡およびNAD+欠乏との関連を示しているものと思われる。
4.6.5. 皮膚がん予防
ナイアシン欠乏症のもう一つの典型的な症状は、光線過敏症で、日光にさらされた部分の発疹、角化症、真皮線維化などの皮膚障害である。ナイアシンによる治療と生理的なNAD+濃度の回復により、皮膚は回復する。NAD欠損ヒトケラチノサイトは、成長率の低下、アポトーシスの増加、酸化ストレスの増加により、DNA損傷の割合が増加する。さらに、NAD+の利用可能性の低下は、皮膚細胞培養における光感作をもたらし、DNA損傷によるPAR形成とサーチュインの発現レベルを低下させた[648]。動物モデルの実験では、中程度のナイアシン欠乏はマウスのUV-B処理に反応して皮膚がんの発生率を増加させ、ニコチンアミドの経口投与は光発がんを抑制し得ることが実証されている[649]。
このことは、ヒトでしばしば見られる軽度のビタミンB3不足でも皮膚がんリスクを高める可能性があることを示している。臨床の場では、ナイアシンの皮膚機能に対するプラスの効果は長い間知られてきた。ニコチンアミドは、創傷治癒を改善し、しわの深さの減少および皮膚表面構造の平滑化を引き起こし、表皮バリア機能を改善し、皮膚への光損傷を軽減し、乾癬の治療に使用されている[650,651]。別の研究では、ある種の皮膚がんの再発に対する経口ニコチンアミドの保護効果が実証されている[652]。
4.7. ナイアシンの毒性
薬理学的用量(最大6000mg/日)のNAの最も重大な副作用は潮紅であり、初回暴露時の発生率は80%にも達する[653]。紅潮は、胸部および顔面に限定された皮膚血管拡張によって引き起こされ、しばしば灼熱感およびそう痒症を伴う。この副作用は二相性であり、20~30分後に最初の速い相が生じ、40~60分後にゆっくりとした第二の相が生じる。
顔面紅潮は、プロスタノイドの皮膚産生が増加することによって媒介される。NAは、樹状細胞またはマクロファージのGPR109A受容体を活性化し、ホスホリパーゼA2によるアラキドン酸の産生を誘発する [654] 。第一段階は、プロスタグランジンD2(PGD2)濃度の上昇とDP1受容体の活性化によって媒介される。遅発性の第2相は、真皮PGE2ケラチノサイト経路 [655] または他のメディエーター、例えばヒスタミン、サブスタンスP、アドレノメデュリンまたはカルシトニン遺伝子関連ペプチド [656] により誘発されると考えられている。
顔面紅潮は、50%の患者においてNA治療の中止の原因となっており[653]、動脈硬化および脂質異常症の治療におけるNA使用の最も重大な欠点となっている。この副作用を最小限に抑えるために、様々なアプローチが用いられてきた。フラッシュの発生率と程度は、NAの血漿中濃度のピーク値(cmax)と相関しており、即時放出型または急速放出型の製剤で最も一般的である。フラッシングの発生を抑えるために、夜間に発症し、苦痛が少なくなるようにNA投与のタイミングを計ることができる。NAを12時間または24時間かけて放出する徐放性製剤は、フラッシングの発生を最大60~80%減少させたが [657] 、抗高脂血症および抗動脈硬化作用は低く、血漿トランスアミナーゼ活性上昇で示される肝障害 [658] も高い [659,660] 。
NA後のフラッシングを軽減するもう一つのアプローチは、PGD2の産生と効果を減少させることである。アセチルサリチル酸やインドメタシンなどのシクロオキシゲナーゼ阻害剤は、一部の患者においてNAの忍容性を改善するためにうまく使用されたが、普遍的に有効というわけではない [653]。DP1受容体拮抗薬であるラロピプラントの使用は、より成功している。その主な効果は、顔面紅潮の第一段階を80%減少させることであり [661] 、NAとlaropiprantの併用製剤が開発されるに至った。
フラッシング以外のNAの副作用には、頭痛、胸焼け、消化性潰瘍、悪心・嘔吐、乳酸アシドーシス、低血圧などがある[609,662]。NAがインスリン抵抗性を増加させるという報告があり、糖尿病患者におけるNAの使用について懸念が提起されている[663,664]。GPR109Aアゴニストのアシピモックスはインスリン抵抗性を誘導しないが、NAと比較してFFA低下作用に明確な違いがあり、NAによるインスリン抵抗性は、クラスとしてのGPR109Aアゴニストの副作用なのか、NAに特有の副作用なのかは不明なままである。その後、いくつかの臨床試験で糖尿病患者におけるリスクベネフィット比を分析した結果、コントロールされた2型糖尿病患者におけるNAの使用は安全であり、血糖値または糖化ヘモグロビン(HbA1c)をわずかに上昇させるだけであることが示された[665, 666, 667]。
いくつかの病的状態の治療におけるニコチンアミドの開発および新規適用の新しい傾向とともに、ニコチンアミドの長期使用に関する安全性の懸念が提起されている。ニコチンアミドは、エネルギー代謝、DNA修復、タンパク質翻訳、あるいはエピジェネティックな制御への影響を含む、幅広い多様な薬理作用をもたらすものである。しかし、現在、ニコチンアミドの潜在的な副作用の評価は不十分であり、個々の報告も乏しいのが現状である。最近のレビュー[668]は、これらの懸念のいくつかに対処しているが、より多くの疑問を提起し、ニコチンアミドの安全性プロファイルの体系的評価の必要性を強調している。
5. パントテン酸-ビタミンB5
5.1. 紹介と性質
ビタミンB5は、パントテン酸として知られ、食品中に遍在する水溶性ビタミンである。パントテン酸は、1931年にR. J. Williams博士がSaccharomyces cerevisiaeを用いた研究中に発見した[669]。彼は、非常に顕著な方法で酵母の成長を刺激する未同定の栄養素の存在を示す証拠を提示し、1933年に、「あらゆる場所」を意味するギリシャ語の「panthos」を用いて、この栄養素を命名した[670]。その後、パントテン酸欠乏動物を用いた実験により、その基本的な重要性が証明され、その結果、ビタミンとして分類されるようになった。
純粋なパントテン酸は粘性のある液体である。pKaは4.41である。加水分解される酸性環境よりも弱アルカリ性環境でより安定であり、最大安定性はpH5-7である。その分解は熱によって加速される。湿気から保護されている場合は、大気中の酸素と光に対して中程度に安定です。パントテン酸は通常パントテン酸カルシウムとして投与されるが、これは固体で光、熱、酸素に対してパントテン酸より安定であるが、アルカリ性および酸性条件下では不安定である。また、パントテン酸の固形物としてパントテン酸ナトリウムがある。しかし、吸湿性があるため、その使用は制限されている[69,415,671,672,673]。
5.2. パントテン酸の供給源
パントテン酸の生合成は、植物、菌類、およびほとんどの細菌で行われる。ヒトまたは動物の生物および一部の細菌は、このビタミンを合成する能力がないため、外因性の供給に依存している [14,423,431,540,671,672,674,675,676,677,678,679,680,681,682,683,684,685,686].人間の食事において、パントテン酸はどこにでも存在し、植物および動物由来の食品に広く分布している。主な供給源は、肉、内臓(肝臓および腎臓)、卵、牛乳、チーズ、ナッツ、マッシュルーム、酵母、全粒穀物、豆類、アブラナ科野菜(ブロッコリーまたはカリフラワーなど)、アボカド、ジャガイモおよびトマトである[445,672,687,688,689,690,691,692,693]。パントテン酸の摂取に主に寄与するのは、消費量の多さから肉製品、パン、乳製品、野菜である[471,692,694]。パントテン酸の最も豊富な天然供給源の1つは、ローヤルゼリーである[672,692,695,696,697]。いくつかの食品におけるパントテン酸の含有量を表10に示す。食品以外にも、大腸の腸内細菌叢がヒトのパントテン酸供給全体に寄与している可能性が高いが、現在のところその程度は不明である [14,672,690,698,699,700,701,702,703].ともあれ、パントテン酸は大腸の腸内細菌叢によってデノボ(de novo)合成されることは明白である。この複雑な反応には、2-ジヒドロパント酸およびβ-アラニンという2つの基本的な構成要素が必要である。Magnúsdóttirらは2015年、パントテン酸を合成する能力を持つヒトの腸内細菌を予測した。この予測は、パントテン酸およびCoAの生合成に必要な機能性酵素を含む細菌ゲノムの構造に基づいています。パントテン酸を生産する能力は、ほぼすべてのバクテリオイデス菌とプロテオバクテリア菌に存在する。また、これらの菌株はCoAまで生合成を継続することが可能である。また、少数のActinobacteriaとFirmicutesもパントテン酸を合成することができる。一方、Fusobacteriaのような一部の細菌はパントテン酸を生産することができない。これは後に実験的に証明され、実際、Bacteroides fragilis, Bacteroides thetaiotaomicron, Bacteroides vulgates, Escherichia coli, Helicobacter pylori, Klebsiella pneumonia, Listeria monocytogenes, and Salmonella EntericaはビタミンB5を合成することができる [423].
表10 特定の食品におけるパントテン酸の含有量
| 食べ物 | パントテン酸含有量(μg/ 100g) | 参考文献 |
|---|---|---|
| オーツ麦 | 800〜1350 | [ 339、671 ] _ _ |
| 小麦 | 950〜1200 | [ 339、671 ] _ _ |
| 米、玄米 | 660〜1860 | [ 61、99、109、339、467 ] _ _ _ _ _ _ _ _ |
| ライス、ホワイト | 250〜1080 | [ 61、99、109、467、671 ] _ _ _ _ _ _ _ _ |
| トウモロコシ | 420〜650 | [ 339、671、705 ] _ _ _ _ |
| ライ | 1340〜1460 | [ 339、512 ] _ _ |
| オオムギ | 280 | [ 339 ] |
| キビ | 850 | [ 339 ] |
| ソルガム | 1550〜1630 | [ 468 ] |
| 大豆 | 793–1431 | [ 101、710 ] _ _ |
| レンズ豆 | 1030〜1430 | [ 710 ] |
| 落花生 | 1412〜1767 | [ 714、715 ] _ _ |
| マカダミアナッツ | 800 | [ 716 ] |
| ピスタチオナッツ | 470〜500 | [ 716、717 ] _ _ |
| ヘーゼルナッツ | 900 | [ 716 ] |
| クルミ | 470〜600 | [ 716、717 ] _ _ |
| アーモンド | 300〜471 | [ 716、718、719、720、721 ] _ _ _ _ _ _ _ _ |
| ニンニク | 596 | [ 101 ] |
| じゃがいも | 350〜440 | [ 98、671 ] _ _ |
| にんじん | 270 | [ 98 ] |
| キャベツ | 210 | [ 98 ] |
| トマト | 290〜320 | [ 98、671 ] _ _ |
| ブロッコリー | 610〜1300 | [ 98、671 ] _ _ |
| カリフラワー | 1010-1040 | [ 98、671 ] _ _ |
| ほうれん草 | 280 | [ 98 ] |
| オレンジ | 240〜370 | [ 671、699 ] _ _ |
| アボカド | 1390〜1460 | [ 101、717 ] _ _ |
| いちご | 300〜370 | [ 98、671、699 ] _ _ _ _ |
| りんご | 61〜100 | [ 98、101、671 ] _ _ _ _ |
| 梨 | 70 | [ 699 ] |
| 白パン | 300〜460 | [ 99、699 ] _ _ |
| 茶色のパン | 630〜760 | [ 99、699、705 ] _ _ _ _ |
| 豚肉 | 500〜700 | [ 101、671、722 ] _ _ _ _ |
| 牛肉 | 500〜750 | [ 101、671、722、723 ] _ _ _ _ _ _ |
| 鶏の胸肉 | 870〜1500 | [ 101、724、725 ] _ _ _ _ |
| レバー、牛肉 | 7170〜7900 | [ 101、671 ] _ _ |
| レバー、豚肉 | 6650〜6800 | [ 101、671 ] _ _ |
| シーチキン | 230〜500 | [ 102、705 ] _ _ |
| イワシ | 690〜1090 | [ 102、705 ] _ _ |
| ヒラタケ | 1300 | [ 470 ] |
| ボタンマッシュルーム | 1360 | [ 470 ] |
| パン酵母 | 4900 | [ 101 ] |
| 牛乳 | 320〜580 | [ 106、471、671、699 ] _ _ _ _ _ _ |
| ヨーグルト | 450〜500 | [ 106、699 ] _ _ |
| チーズ、チェダー | 413〜500 | [ 101、699 ] _ _ |
| 卵 | 1350〜1600 | [ 107、671 ] _ _ |
食品加工により、パントテン酸の含有量が変化する場合がある [415,688] 。小麦、米、トウモロコシなどの穀物を脱皮して細かくしたり粉にしたりする穀物の製粉は、食べやすさの向上、調理時間の短縮、食品を作るために行われるが、微量栄養素を豊富に含む穀物部分を取り除くため、パントテン酸のかなりの損失となる [99,109,445,464,687,704]。粉砕によって、小麦とトウモロコシのパントテン酸含有量は、全粒穀物と比較して、それぞれ50-55%と64-88%減少する[63,99,705]。パントテン酸の損失は、玄米と比較して、非パーボイルドとパーボイルド白米でそれぞれ50-67%と18-25%である [61,99,109,705].
パントテン酸はpH5-7の熱処理中では非常に安定である。食品の準備および調理中のパントテン酸の損失は通常あまり大きくないが [69,415]、水、スープ、肉汁、ドリップなどの調理液への溶出によってかなりの損失が生じることがあり、これらを調理した食品と一緒に消費すると、ビタミンの大部分が保持される [70,73,74,706,707,708]-…。豚肉、牛肉、鶏肉のパントテン酸含量は、蒸し煮、煮込み、特に煮沸によって減少し、肉では溶出によってのみ15-50%減少する。料理全体では、10-20%の減少にとどまります。揚げ物はビタミン値を20%減少させ、肉にパン粉をつけると10%しか減少しない[70]。同様に、異なる方法による調理中に魚のパントテン酸の減少がもたらされる[70,102,706]。ジャガイモを皮ごと蒸す、煮る、焼く、揚げるなどの調理では、いずれも10%程度のパントテン酸の損失が生じるが、皮をむいたジャガイモを煮た場合は30%に達する可能性がある[70,73]。また、野菜では、ゆでたり蒸したりすると、料理全体で通常10%、野菜だけではそれぞれ30~40%、15%の減少をもたらす[70,73,98,709]。煮物、揚げ物、焼き物では、野菜のパントテン酸量は10%減少する[70,73]。豆類の茹でる際の24-67%のパントテン酸の損失は、予備浸漬法と調理時間に影響される[74,710,711] 米の茹では、パントテン酸量が59-66%減少する[99]。そのため、特に調理した野菜を調理液なしで食べる場合は、茹でるよりも蒸すことが好まれる[70,98,709,712]。ポーチドエッグ、ゆで卵、目玉焼きは、調理によってそれぞれ4%、7%、9%のパントテン酸を失う[107]。牛乳では、牛乳の通常のpHが最適なpH安定性の範囲内であるため、パントテン酸は低温殺菌中も安定であり、牛乳は一般に加工中に10%未満しか失われない[74,415,713]。
製パンでは、混練段階ではパントテン酸の有意差は観察されなかったが、焼成時には12%の穏やかな減少が記録された。このことは、パントテン酸が光や酸素よりも熱に敏感であることを示している[508]。ピーナッツを160℃と180℃で焙煎すると、パントテン酸の量はそれぞれ24%と92%減少する。したがって、ピーナッツは適切に処理すれば優れた供給源となり得る[726]。
缶詰は、パントテン酸の含有量の様々な減少につながります。豚肉のランチョンミートでは、熱処理の時間と温度によって1~43% [125]、動物由来の食品(肉、魚、乳製品など)、野菜、果物および果汁では、それぞれ20~35%、46~78%、51% [705] です。Averrhoa bilimbi果実の抽出物におけるパントテン酸の熱分解速度論は、温度の上昇によって分解が促進されることを示し、それはまた線形時間依存的であった[727]。食品の保存方法として用いられる電離放射線による処理は、パントテン酸含量に重要な影響を及ぼさない[124,477]。ニクタマライズ(すなわち、アルカリ処理)されたトウモロコシをベースとする食品には、パントテン酸が少ない [62,488]。
粉ミルク [728] とHippophaë rhamnoides(シーバックソーン)の果汁 [729] 中のパントテン酸量に対する保存条件の影響も研究されている。安定性は、保存中の時間、温度、水分、酸素の有無によって異なる影響を受けました。
野菜で18-63%、豆類で29-71%、果物や果汁で7%、魚で4-55%の減少が報告されている[672,690,705]。冷凍肉を解凍すると、他のビタミンB群とともにパントテン酸がドリップで移行しますが、ドリップで見つかった解凍肉からのパントテン酸の量は、豚肉で7%、牛肉で33%となっています。ロスを防ぐために、ドリップを回収して利用することが推奨される[707,730,731]。
パントテン酸(主にカルシウム塩の形で、パントテニルアルコールとしても)は、食品、医薬品、化粧品分野、および飼料(最後の目的では、生産量の約80%が使用される)用に商業生産されている[671,672,732]。現在、パントテン酸の工業的生産は、化学反応と酵素反応の組み合わせに基づいている。パントテン酸は®-異性体のみが生物活性を有するため、高価で厄介な光学異性体の化学的ラセミ分離を回避するために、生体触媒ステップは特に重要である[171,671,672,732,733]。パントテン酸は、2つの主要な構成要素である®(R)-パントラクトンとβ-アラニンの縮合によって得られます。パントラクトンは、イソブチルアルデヒド、ホルムアルデヒドおよびシアン化水素から合成される。(R)-パントラクトンを分離するために、いくつかの化学的および微生物学的方法が開発されてきた。商業化されている生体触媒プロセスの1つは、Fusarium oxysporumの固定化細胞を用いて、その酵素であるラクトナーゼを利用して行われるものである。この酵素は、(R)-パントラクトンのみを立体選択的に加水分解して(R)-パント酸に変換し、そのままの(L)-パントラクトンから容易に分離できる。(R)-パント酸はラクトン化し、さらに (R)-Pantothenic acid に変換し、 (L)-Pantolactone はラセミ化してリサイクルできる [170,671,672,732,733,734]. β-アラニンの工業的合成には,アクリロニトリル,アンモニア,水酸化ナトリウム,またはアクリル酸,アンモニアを出発原料とする2つのプロセスが主に用いられている[671]が,β-アラニンの代替生産法としてバイオテクノロジー的手法(生物変換,発酵)が近年注目され,工業的要求値に達する収量を得ている[735,736,737].
パントテニルアルコール(パンテノール)は,それ自身はビタミン活性を持たないが,動物やヒトの体内で定量的にパントテン酸に変換される[672],(R)-パントラクトンおよび3-アミノ-1-プロパノールを出発物質として化学合成により製造されている[671,738].パントテン酸を製造するための微生物発酵の開発には、多大な努力が払われています[171,739,740]。このアプローチの主な利点は、所望の立体異性体である(R)-パントテン酸を直接生成することである[672]。パントテン酸の過剰生産については、遺伝子組み換え細菌であるEscherichia coli、Corynebacterium glutamicum、Bacillus subtilisを用いて有望な結果が得られたが、発酵プロセスはまだ工業化されていない [171,671,680,732,738,740,741,742,743,744,745,746,747,748].報告された発酵の高い生産性にもかかわらず、消費された炭素源で十分に高い製品収量を確保するために、代謝フラックスが主にパントテン酸に向かう、さらに適した菌株を開発するためのさらなる研究が必要であり、そうでなければ発酵経路は、現在使用されているパントテン酸の製造方法に対して経済的に競争力を持つようになる[738]。
パントテン酸を用いた食品の強化については、通常の集団における欠乏症がないこと、およびパントテン酸が遍在しているため、ほとんどの天然の食事源から1日の必要量を容易に満たすという事実から、成人におけるそのビタミン摂取量は一般に適切であると考えられてきた[99,749]。パントテン酸(パントテン酸カルシウムまたはパントテン酸ナトリウムまたはデキスパンテンオールとして)は、誤った栄養または栄養不良による欠乏を防ぐため、または特定の栄養要求のために、様々な食品(牛乳ベースの製品、朝食シリアルおよび米粉など)に添加される(ベビーフード、例えば。低カロリー、低カロリー、ビタミン豊富な食品) [174,337,671,694,749,750,751,752,753] がある。作物のパントテン酸のバイオフォート化に関しては、育種や遺伝子工学によって植物のパントテン酸レベルを高める可能性を探る広範な研究は行われていない [61,679,680,754]。
5.3. パントテン酸の生理機能
ビタミンB5は、酵母と哺乳類の細胞において、コエンザイムA(CoA)とアシルキャリアタンパク質(ACP)の合成に不可欠である[755]。CoAは、多くの異化反応と同化反応において重要な役割を果たす。脂肪酸、コレステロール、アセチルコリン、胆汁酸などの合成に必要である。また、代謝や遺伝子発現の調節にも関与しています。CoAは、脂質、糖質、タンパク質などの大きな有機分子を処理するのに必要です。これらの反応は、アセチル-CoA、スクシニル-CoA、プロピオニル-CoA、イソバレリル-CoA、イソブチリル-CoA、α-メチルブチリル-CoA、脂肪アシル-CoAなどのアシル化CoAの形成でエネルギーを生成する [756]. パントテン酸およびその誘導体の構造を図14に示す.
図14 パントテン酸、パンテチン、パンテチン、アセチルCoAの構造
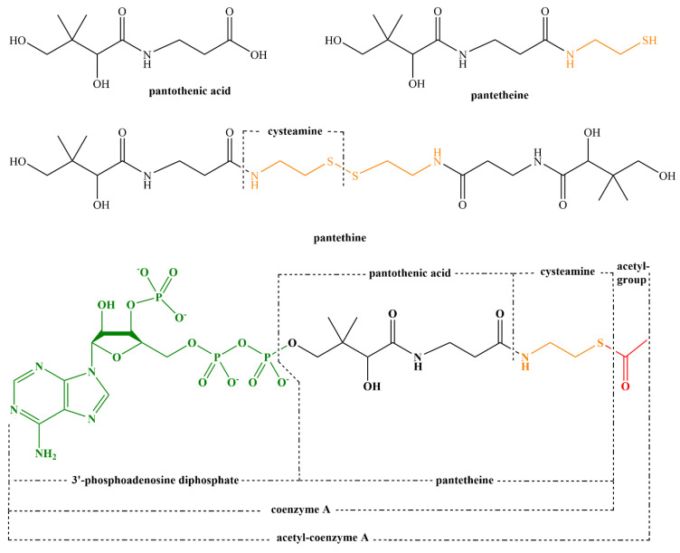
ACPは脂肪酸の合成に重要である。不活性型であるapo-ACPで発現している。ホロACPへの活性化には、補欠基(4′-phosphopantetheinyl moiety)の付加が必要である。これは、4′-phosphopantetheinyl transferaseによって触媒されるCoAとの反応の間に起こる[757]。パントテン酸の1日の平均推奨摂取量は、補足データ表S3 [412]に以下のように記載されている。
5.4. パントテン酸の薬物動態
5.4.1. 吸収
ビタミンB5は、主にその誘導体である4′-ホスホパンテインとCoAの形で食事に含まれています。いずれの場合も、吸収される前に一連の加水分解反応を経てパンテテインまたはパントテン酸に変換される必要がある(補足資料図S1)。
CoAの変換は、まず腸管内腔に存在するアルカリホスファターゼによって脱リン酸化され脱ホスホ-CoAとなり、その後CoAまたは脱ホスホ-CoAのヌクレオチドの5′-ホスホジエステル結合が加水分解されてリン酸化パンテテインに至る。この反応は、エクトヌクレオチドピロホスファターゼ/ホスホジエステラーゼ(ENPP)により触媒される[756,758]。ENPPには7つのアイソフォームが知られている.ENPP1〜5は二リン酸結合を加水分解し、ENPP2は分泌型であり、リン脂質中のホスホジエステル結合を加水分解することが好ましいとされている。その他の型はすべて膜貫通型タンパク質である。ENPPs 1と3は可溶性アイソフォームであり,ほとんどすべての組織で検出されるが,通常は特定の細胞型に関連している[758,759].次のステップは、ホスホパンテインからパンテテインへの加水分解である。この反応は、再びアルカリホスファターゼによって触媒される。パンテチンからパントテン酸およびシステアミンへのこの最終変換段階は、内腔および腸組織に存在する基質特異的パントテイナーゼの制御下にある[756,758]。この酵素は、パンテチンのアミド結合を1つだけ分解する。ヒトのパントテイナーゼのアイソフォームは3種類知られており、vascular non-inflammatory molecules、略してバニンと呼ばれている(VNN1-3)[760]。VNN1アイソフォームは腸細胞の先端側に存在し、同じタイプは肝細胞や腎臓のネフロン近位尿細管のブラシボーダーなど、CoAの回転が高い他の組織にも存在し、パントテン酸の救済とリサイクルを助けている [761].
血清中のCoAの変換は腸管内腔での変換と同様であるが、血清中のCoAは、以前に脱リン酸化される前にENPP1またはENPP3によってホスホパンテインに直接加水分解される可能性がある[756]。
初期のラット研究では、パントテン酸およびパンテチンの小腸への取り込みは受動拡散を介して行われ、これは主に高濃度のビタミンで可能であると報告されている[760,762]。しかし、その後の低濃度のパントテン酸を用いた研究により、吸収は飽和型ナトリウム依存性マルチビタミントランスポーター(SMVT)により行われることが示された[701,763](図15)。この輸送系はNa+依存性グルコーストランスポーターファミリーに属し、ビオチン、その特定の類似体、およびリポ酸も輸送する。このトランスポーターは主にカルボキシル基を含む分子の長い側鎖側と相互作用し、そのような部位は前述のすべての物質中に存在する。輸送は、Na+とパントテン酸のカップリング比が2:1の電気泳動で行われる。Na+は非常に重要であり、他の陽イオンで置き換えることはできない。パントテン酸輸送の親和力定数は約2μMである[763].
図15 小腸の膜輸送
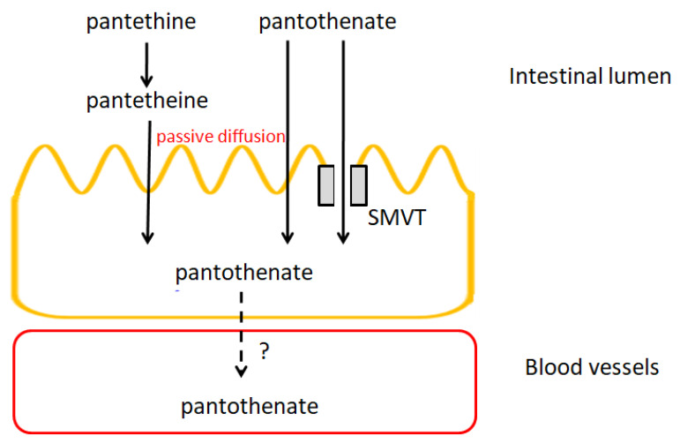
SMVT、ナトリウム依存性マルチビタミントランスポーター。
小腸と同様に、パントテン酸は大腸で同じトランスポーターSMVTを介して吸収される。しかし、パントテン酸が腸管細胞から腸管基底膜を経て血流に移行するメカニズムに関するデータはない[701]。
Shibataら(1983)は、放射性標識14C-pantothenateを腸管内腔に投与して5時間後に、腸管内腔に投与量の5.4±3.5%、腸管組織に10.1±4.1%を検出しただけであった。したがって、パントテン酸の大部分は吸収され、分布していた[760]。
パンテチン(パントテン酸のジスルフィド誘導体でパンテチンの安定型)は、腸管壁を通過する間にかなりの程度(80%)パンテチン、次いでパントテン酸に加水分解される [764,765].実際、シスチン症患者の血漿中には、パンテチンではなくパントテン酸が検出された(検出レベル5-10%未満)ことが報告されている[765]。少なくともパントテン酸の24時間尿中排泄率によると、パンテチンはラットのパントテン酸カルシウムと比較して約1.5倍高い吸収率であった[764]。
5.4.2. 分布
パントテン酸は遊離型で血液中に輸送され、アルブミンとは結合しない [766]。組織と赤血球に速やかに取り込まれる。実際、赤血球中の濃度は血漿/血清中よりも高い [767] 。赤血球への輸送は受動拡散によって行われる。取り込みも排出も非飽和的で、Na+やグルコース濃度、pHの違いにも影響されない。赤血球はパントテン酸の代謝能力が低いため、他の組織へのパントテン酸の輸送体としてのみ利用されている可能性が高い。赤血球では,パントテン酸は4′-phosphopantothenic acidに変換され得るが,さらにCoAに変換されることはない[768].したがって,パントテン酸は赤血球内でパントテン酸,4′-phosphopantothenic acidおよびパンテチンの形で輸送される[760,768].異なる組織、例えば肝臓、肺、腎臓、心臓、脂肪組織、胎盤への取り込みは、SMVTを経由する[769,770]。また、このトランスポーターは血液脳関門を通過する輸送も可能である[771]。
また、放射性同位元素で標識したパントテン酸を直接腸管内に投与したラットでの分布試験では、ビタミンB5は組織に濃縮され、血液中には低量しか残らないことが確認された。最も多く検出されたのは筋肉(34.7 ± 2.5%)で、肝臓(12.1 ± 2.2% )、腎臓(5.2 ± 0.7% )、結腸(4.2 ± 0.3%)にも少量検出されました。その他の臓器(心臓、胃、精巣、脳、肺)では、1%前後あるいはそれ以下の量であった[760]。
5.4.3. 代謝
ビタミンB5の恒常性は、食事、微生物による生産、内因性CoAの分解の3つの供給源によって保証されています。パントテン酸の細胞内におけるCoAへの変換を図16に示す。
図16 CoAの生合成
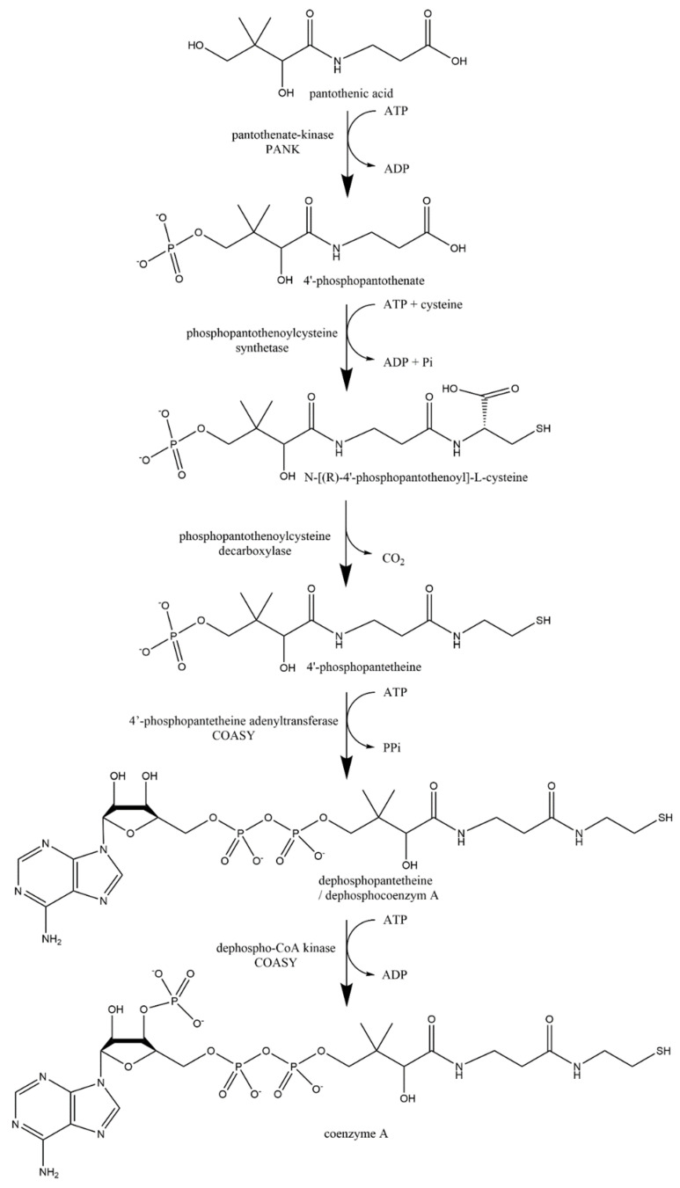
5段階の経路は、パントテン酸キナーゼ(PANK)によるパントテン酸の4′-ホスホパントテン酸へのリン酸化で始まる。次に、4′-ホスホパントテン酸はシステインと縮合する。この反応はphosphopantothenoylcysteine synthetaseによって触媒され、N-[(R)-4′-phosphopantothenoyl]-L-cysteineが生成される。この生成物をphosphopantothenoylcysteine decarboxylaseの存在下で脱炭酸し、phosphopantetheineを生成する。最後の2段階は、4′-ホスホパンテインのリン酸化による脱ホスホパンテインの生成と、リボースの3′-ヒドロキシ基のリン酸化によるCoA生成である。この2つの反応はCOASYと呼ばれる酵素によって触媒され、2つの酵素活性を示す。4′-ホスホパンテインアデニルトランスフェラーゼ(第4反応を触媒)と脱ホスホ-CoAキナーゼ(第5反応を触媒)である。
5.4.4. 排泄
パントテン酸は主に尿から排泄されます。ろ過されたパントテン酸は、生理的な濃度であればSMVTを介して近位尿細管の刷子縁から再吸収される。このことは、ラット腎臓膜小胞を用い、NaCl存在下、異なる濃度勾配でパントテン酸をインキュベートした実験により証明された。腎臓のSMVTを介した輸送は飽和状態(Km 7.30 µM、Vmax 34.8 pmol/mg protein per min)で、構造的に類似した化合物(4′-phosphopantothenateおよび4′-phosphopantetheine)により阻害される可能性がある[766]。
より高濃度では、パントテン酸は尿細管分泌を受ける。分泌機構はペニシリンと同じであり、このプロセスを阻害することができる[766]。論理的には、プロベネシドもこのプロセスを阻害していることになる[772]。
灌流ラットの腎臓試験では、パントテン酸は腎臓組織でCoA(4.9 ± 0.9%)、dephospho-CoA(6.3 ± 3.1%)、パンテチン(8.0 ± 1.2%)、4′-phosphopantetheine(9.5 ± 2.9%)に代謝されるが、尿中には純酸のみ排泄されるとされていた [766](Perfusion Ratney et al. パントテン酸カルシウム20 mgをヒトに経口投与した場合、6時間後に21.3 ± 1.5%しか排泄されず、尿中への排泄は比較的遅かった [773]。ビタミンB5の尿中排泄の程度は、食事中のビタミン量に依存するようである。その排泄量は60〜72%と比較的高く、食事中の含有量はほぼ十分であることが示唆された[767,774,775]。
5.5. パントテン酸欠乏症
ビタミンB5は様々な食品に含まれているため、一般的に欠乏症は少ないが、重度の栄養失調の人や動物で観察されることがある。しかし、多栄養素の欠乏のため、ビタミンB5に特異的な欠乏症状を特定することは非常に困難である。このため、いくつかの実験的なビタミンB5欠乏症の研究が行われた。ヒトまたは動物にパントテン酸を含まない食事を与えるか、ビタミン拮抗剤であるω-メチルパントテン酸(パントテン酸キナーゼ阻害剤)を補充するか、またはこれらのアプローチを組み合わせて行われた [776,777,778,779,780]. ビタミン B5 の検出のための分析方法を表 3 および補足データ表 S1 にまとめている。
5.5.1. 動物におけるビタミンB5欠乏症の症状
動物におけるパントテン酸欠乏症の主な症状は、成長障害、皮疹、消化器症状および運動失調、協調性喪失、筋力低下などの神経症状である。同様の症状は、ヒトの研究でも現れている。症状については、表11でより詳しく説明しています。
表11 パントテン酸欠乏症の症状
| 症状 | ソース | |
|---|---|---|
| 齧歯動物 (ラット、マウス、モルモット) |
成長:遅滞、体重の減少 | [ 778、779、783、792、793、794、795、796 ] _ _ _ _ _ _ _ _ _ _ _ _ _ _ |
| 皮膚と粘膜:毛皮の波打ちと変色、薄毛、脱毛症、鱗状の落屑を伴う皮膚の乾燥、鼻汁、目の水やり | ||
| 消化管:下痢、十二指腸の変化(Lieberkühn陰窩-拡大、過形成、陰窩間のスペースの増加、萎縮;絨毛の減少、直方体または扁平への上皮の変化、潰瘍、穿孔および慢性病変につながる)、唾液分泌 | ||
| 神経系:後肢の筋力低下、けいれん、昏睡 | ||
| 腺:副腎病変 | ||
| 鳥 (アヒルの子とひよこ) |
成長:遅滞、体重の減少 | [ 783、797、798、799 ] _ _ _ _ _ _ |
| 皮膚:鱗状皮膚炎、皮膚病変、くちばしと目の周りのかさぶた、羽毛の色素脱失、皮膚浮腫 | ||
| 神経系:重度の運動失調、転倒する傾向、立ち上がれない、喘ぐ | ||
| 腺:ファブリキウス嚢と胸腺のリンパ球壊死、および脾臓のリンパ球不足 | ||
| 豚 | 成長:体重増加の失敗、食欲不振 | [ 800、801、802 ] _ _ _ _ |
| 肌:抜け毛、コートのざらつき | ||
| 消化管:下痢、重度の結腸病変 | ||
| 神経系:運動失調、感覚ニューロンの病変、片方の手足を地面から突然持ち上げる、異常な歩行、歩くことも立つこともできない | ||
| 呼吸器系:咳と鼻分泌物 | ||
| 犬 | 成長:遅滞 神経系:突然の脱力感、昏睡、急速な呼吸数と心拍数、けいれん、後肢の痙縮 |
[ 784、803 ] _ _ |
| 消化管:食欲減退、胃腸症状、胃炎または腸炎 | ||
| 腺:脂肪肝、まだらの胸腺 | ||
| 血液:ブドウ糖と塩化物の血中濃度は低く、非タンパク質窒素は上昇していました | ||
| 泌尿器系:出血性腎変性 | ||
| 人間 | 神経系:頭痛、神経過敏、落ち着きのなさ、喧嘩、過度の倦怠感、しびれ、知覚異常、筋肉のけいれん、振戦および特有の歩行に関連する協調障害 | [ 776 ] |
| 消化管:腹部のゴロゴロ、下痢、みぞおちの灼熱感、逆流 | ||
| 腺:副腎皮質刺激ホルモンに対する好酸球反応の喪失、インスリンに対する感受性の増加 |
ラットにおけるパントテン酸の欠乏は、繁殖上の問題および胚の実装の失敗とその後の再吸収を引き起こす可能性がある [781]。妊娠中の欠乏は、胎盤の内分泌機能に影響を与え、プロゲステロン及びアセチルコリンの産生低下、及び胎児の発育不全に関連する [782]。報告された異常の中には、脳や目の欠陥、趾出血や浮腫、心室間中隔欠損、大動脈弓パターンの異常、水腎症や水尿管、内足、尾部欠損、口蓋裂、皮膚欠損などが属する [781].
パントテン酸無添加食がCoAの動態に与える影響は興味あるところである。予想通り、欠乏食はラットの肝臓、副腎、腎臓、心臓のCoA含量を著しく低下させることになる。しかし、副腎だけはすぐに減少し、他の組織では減少に3週間のタイムラグがあった。さらに6週間経過しても、組織には通常の含有量の35-40%が残っており、減少は緩やかであったが、過度な減少ではなかった。子ガモでは、最初の欠乏の兆候は10-15日後に観察された。実験5日目から肝臓と心臓のCoA濃度を測定したところ、正常値の40%まで急速に減少した。両実験動物の肝臓は、ピルビン酸の利用能力の低下を示した[783]。肝脂肪症に関するデータは曖昧である。パントテン酸欠乏イヌは脂肪肝を発症したが、パントテン酸欠乏ラットでは高コレステロール食(1%コレステロール)を与えても脂肪肝は観察されなかった[784,785]。ただし、これらのラットは脂肪肝の沈着に抵抗性があり、血清および肝臓コレステロールのレベルは対照と比較してわずかに上昇しただけであったことを言及しておく必要がある[785]。
5.5.2. ヒト被験者のビタミンB5欠乏症の症状について
ビタミンB5拮抗剤であるω-メチルパントテン酸を投与されたヒトは、イライラ、落ち着きのなさ、喧嘩っ早いなどの性格の変化を呈した。ビタミンB5含有量の不足した食事(8週間)を摂取したヒトでも同様の症状が発現した[776]。同様の実験は、1976年にFryらによって行われ、彼らはパントテン酸を基本的に含まない食事が人間の健康に及ぼす影響をテストした。しかし、その研究では、欠乏の臨床症状は観察されなかったが、一部の被験者は食事欠乏期間(63日)の終わりに元気がなく、疲労を訴えた[786]。
また、アルツハイマー病に罹患した一部の脳領域では、対照群と比較してパントテン酸の低レベルが検出された。ビタミンB5の枯渇が病態生理に関与しているのか、それとも単に根底にある神経病理学的プロセスの結果なのかはまだ不明である [787]。
5.5.3. パントテン酸キナーゼ2の突然変異
パントテン酸不足の症状は、パントテン酸キナーゼ2の変異を持つ個体でも追跡可能である[788]。パントテン酸キナーゼ(PANK)には3つの活性型アイソフォーム(PANK1α,PANK1β,PANK2,PANK3)が知られており,それぞれ異なる細胞区画(ミトコンドリア,サイトゾル,核)に存在している.また,4′-phosphopantetheineに対して弱いホスファターゼ活性を持つ不活性型PANK4も存在する[756,758].PANKはパントテン酸のリン酸化に必須であり(図16)、その後、CoA生合成の次のステップでシステインと縮合するホスホパントテン酸の形成に必須である。PANK2アイソフォームはミトコンドリアに存在する唯一のPANKsである。PANK2 の変異は、パントテン酸キナーゼに関連した神経変性を引き起こす。ホスホパントテン酸が生成されず、システインが淡蒼球に蓄積し、鉄と結合して酸化ストレスを促進することで組織障害を引き起こし、神経変性を起こし、パーキンソン病などの酸化ストレス障害のリスクを高める[788]。パントテン酸キナーゼ関連神経変性には、古典型と非定型の2つの形態がある。古典型は、早期(6歳以前)に発症し、進行が速いことが特徴である。臨床的特徴としては、歩行障害、姿勢障害、四肢痙縮、脊椎変形、ジストニア、振戦、網膜色素変性症、顎関節症などがある。まれにパーキンソニズムや精神神経症状がみられることもある。非定型の初発症状は、生後1年から28年までと、さまざまな年齢で出現する。古典型と重複する徴候もあるが、非定型型は攻撃性が低く、ほとんどの患者は成人期まで重篤な運動障害なしに推移する [789,790,791] 。
5.6. パントテン酸の薬理学的使用
5.6.1. トリアシルグリセロール, コレステロール
脂質代謝への影響は、多くの臨床試験で研究された。動物実験ではパントテン酸の方がCoAの肝臓合成を誘導する効果が高かったため、パントテン酸の代わりにパンテチンが使用された。パンテチン(0.1%)はラット肝ホモジネートにおいてCoAの合成を45%増加させたが、同量のパントテン酸は増加させなかった。さらに,0.1%パンテチンをラットに2週間投与したところ,FFAのレベルが減少した.この効果もパントテン酸を投与した場合には観察されませんでした[804].
臨床試験では、パンテチンの用量は600または900 mg/日に達し、さまざまな形の脂質異常症に苦しむ患者に投与され、いくつかの研究では、糖尿病の患者も含まれています。これらの研究のほとんどは、トリアシルグリセロール、LDL、VLDLに対する低下効果を証明し、HDLレベルは上昇するか、変化しないことがわかった。
心血管リスクが低~中等度の患者において、16週間(1~8週目は600 mg/日、9~16週目は900 mg/日)のパンテチンによる治療的生活習慣および食生活の改善により、16週目の総コレステロールおよび8~16週目のLDLコレステロールがプラセボと比較して有意に低下することが観察されました。また、非高密度リポ蛋白コレステロールでも8週と12週で減少傾向が認められ、16週で有意となった。CoQ10は両群ともベースラインより有意に増加し、ホモシステイン値は変化しなかった[805]。
同様に、混合型高脂血症患者において、パンテチン300mgを1日3回、8週間投与したところ、投与終了時に総コレステロールとLDLコレステロールが13.5%(ともに)、HDLコレステロールが10%上昇するという有意な低下が観察されました。また、血中トリグリセリド濃度はプラセボに比べ30%低下しました[806]。
また、糖尿病の有無にかかわらず、高コレステロール血症及び/又は高中性脂肪血症患者にパンテチン600mg/日を経口投与し、基礎値と比較した3ヶ月間の試験で、コレステロール血症、トリグリセリド、LDLコレステロール及びアポリポ蛋白Bの減少、HDLコレステロール及びアポリポ蛋白Aの増加が報告されました[807]。
また、登録後のサーベイランス試験では、高脂血症患者及びⅡ型糖尿病患者において、LDLコレステロール値及びトリグリセリド値が低下し、HDLコレステロール値が基礎値より上昇することが確認されました。また、インスリン依存性糖尿病(I型)患者においては、総コレステロールのみ効果が確認された。一般に、投与期間が長いほど効果が顕著であった[808]。腹膜透析を受けているI型およびII型糖尿病患者の高脂血症治療に焦点を当てた研究でも、2、4、6ヶ月の時点でトリアシルグリセロール、VLDL、LDLがベースライン値と比較して徐々に有意に減少することが観察されました。しかし、HDLコレステロールは変化しなかった[809]。
5.6.2. シスチン症
パンテチンはシステアミンの供給源であり、したがって、腎性シスチン症の治療に示唆される可能性がある。システアミンは、シスチン症のリソソームに入り、シスチンをシステインおよびシステアミン-システイン混合ジスルフィドに還元し、リソソームから自由に出ることができることによって、シスチン症細胞中のシスチン含量を効果的に減少させる[765,810]。白血球のシスチン枯渇は、シスチン症の治療の指標として機能する。システアミンは、白血球のシスチンを90%以上枯渇させることができる。腎性シスチン症の4人の小児にパンテチンを70~1000 mg/kgの用量で経口投与した研究では、白血球からのシスチン枯渇の効果は低かった(80%以上には達しなかった)。このため、パンテチンは腎性シスチン症の治療には推奨できないが、システアミン不耐性の場合には使用できる可能性がある[765]。
5.6.3. 皮膚障害
にきび 軽度および中等度の尋常性ざ瘡に対するパントテン酸の経口投与の影響を、男女 10 名(平均年齢 31.8 ± 8.4 歳)を対象として試験した。パントテン酸(2.2 g/日)は、他のビタミン(チアミン、リボフラビン、ナイアシン、ピリドキシン、葉酸、シアノコバラミン、ビオチン、L-カルニチン)と共に投与された。投与8週間後に病変数がベースライン20.45±10.44から11.18±6.38に有意な減少が見られた。被験者の60%が顕著な改善を、30%がわずかな改善を報告したが、被験者の1人は変化なしと報告した[811]。無作為化二重盲検プラセボ対照試験では、顔の全体的な病変数の減少に対する同じ製品の有効性が証明されました[812]。
局所治療(眼、鼻粘膜、皮膚) 還元型ビタミンB5であるデクスパンセノール(D-パンテノール)は、主に皮膚や粘膜の局所治療に使用されています。しかし、その効果はビタミンB5の生理機能とは関係なく、吸湿性に基づく保湿効果によるものと思われる。2~5%の濃度でクリーム、エモリエント剤、ドロップ、ゲル、ローション、オイル、軟膏、溶液、スプレーとして局所的に使用することができます[813]。デクスパンセノールは、上皮を保護し、細胞増殖を促進する。創傷治癒時には、表皮のバリア機能の回復を助け、抗炎症活性を有し、創傷閉鎖をサポートします[814]。
デクスパンセノール含有クリーム(5%)の治癒特性は、5%ラウリル硫酸ナトリウム溶液を4時間塗布した表皮病変で確認され、1週間、1日2回のクリーム塗布により、角層の水分補給が著しく促進され、皮膚の粗さと炎症が減少した[815]。他の研究では、ドデシル硫酸ナトリウム(0.5%)誘発の皮膚バリア機能不全に対するデキスパンテン含有エモリエント剤の効果が確認されました。デクスパンセノールは、皮膚の水分補給を改善し、角質層のセラミド3、およびFFAとコレステロールの含有量を増加させ、常在菌による皮膚の再コロニー化もサポートしました[816]。
デクスパンセノールをワセリン軟膏に配合すると、ワセリンクリームそのものよりも、切除型CO2レーザーで光損傷を受けた皮膚の病変サイズを有意に早く、顕著に縮小させ、再上皮化も良好でした [817]。デクスパンテン(5%)を含む軟膏の保護効果は、対照の軟膏基剤と比較して、刺激性おむつ皮膚炎において酸化亜鉛との組み合わせでも見られました[818]。デクスパンテンオール5%水油製剤を1日4~8回2週間投与すると、刺青を入れたばかりの皮膚のバリアーが回復した。この研究の欠点は、効果が対照群と比較されていないことである [819]。
小児のアトピー性皮膚炎の治療において、デクスパンテン(5%)軟膏はヒドロコルチゾン(1%)軟膏と同等の効果を発揮したため、軽度および中程度のアトピー性皮膚炎の治療の代替手段として使用できる [820]。
授乳中の母親の外傷性乳首の治療にデクスパンセノールクリーム(5%)を使用すると、純粋なラノリンまたは0.2%のペパーミントオイルのクリームを8時間ごとに14日間投与した場合と比較して同じ治療効果があった[821]。
表面レーザー切除後の角膜上皮の傷に2%のデクスパンセノールを滴下しても、角膜上皮の再生にはほとんど効果がなく、一般に、2ヶ月の使用で臨床的な関連性はほとんどないとされた[822]。しかし、デクスパンセノールはドライアイの治療に有効であり、デクスパンセノールを含まない点眼薬と比較して、角膜上皮の透過性の障害に優れた改善効果を発揮することが明らかにされています[823]。
デクスパンセノールは、急性アレルギー性または非アレルギー性鼻炎の治療や鼻の手術後に、α-シンパソミクスを含む局所鼻腔充血除去剤(スプレーおよび点滴)にも添加される。Oxymethazoline(0.05%)とdexpanthenol(5%)の配合製剤は、急性アレルギー性鼻炎または鼻の手術後の患者において、xylomethazoline(0.1%)単独よりも優れた有効性を示した。鼻づまりの緩和が有意に良好で、回復時間が短く、くしゃみ、鼻汁、刺激感の有意な改善も観察されました[824]。同様に、キシロメタゾリンにデクスパンセノールを添加すると、キシロメタゾリン単独と比較して、鼻閉、鼻漏、鼻甲介の過形成、鼻粘膜の発赤が有意に減少しました[825,826]。
5.7. パントテン酸の毒性
5.7.1. 急性毒性
ビタミンB5の毒性は非常に低いようである。イヌおよびサルにパントテン酸カルシウムを1 g/kg経口投与しても毒性症状は認められず、このことは検査した臓器に病理学的変化がないことから確認された。また,マウスおよびラットにおける経口,皮下,腹腔内および静脈内投与時のLD50は高い値を示した.マウスのLD50は,10 g/kg(acral),2.7 g/kg(s.c.),0.92 g/kg(i.p.),0.91 g/kg(i.v.) であった。経口投与した10 g/kgではラットは毒性症状を示すことなく生存し,その他のLD50はそれぞれ3.5 g/kg(s.c.),0.82 g/kg(i.p.),0.83 g/kg(i.v.) であった。致死量は i.v. 及び i.p. 投与後 2 時間、経口及び s.c. 投与後 6~12 時間で呼吸不全を起こした[827]。
5.7.2. 慢性毒性
同様に、ビタミンB5の慢性毒性は非常に低く、したがって、このビタミンは一般に安全であると考えられている。パントテン酸カルシウムを50または200mg/日で190日間飼育したラット、イヌ(1日量50mg/kg)およびサル(1日1g、体重4~5kg)で6カ月間飼育した場合、慢性毒性症状および病理学的臓器変化は検出されなかった[827]。
パントテン酸の耐容上限摂取量は、毒性報告がないため、設定されていない。パントテン酸カルシウムの大量摂取(10~20 g/日)のみが、ヒトに軽度の下痢を引き起こす可能性がある [828] 。パンテチンもまた、忍容性が高い。いくつかの研究では、副作用がまったく報告されていない [807]。高用量のパンテチン(900mg/日)で治療された少数の患者は、軽度の胃の不快感およびそう痒症を訴えた [808,809]。ビタミンB5(300mg/日)とビタミンH(10mg/日)を2ヵ月間摂取した76歳の女性で、好酸球性胸水が発生した1例の報告がある。彼女は胸痛と呼吸困難のため入院した。血液検査では、好酸球濃度が高い(1200-1500個/mm3)炎症性症候群が認められた[829]。
6. 結論
今回は、ビタミンB群4種の情報をまとめました。これらのビタミンは、水溶性であるため食物の煮沸による損失が大きいこと、特定のトランスポーターを必要とすること、赤血球への貯蔵、尿中への排泄、安全性に至るまで、多くの類似した特性を有している(表12)。最後に、唯一の例外はビタミンB3の一種であるニコチン酸で、これはいくつかの副作用を引き起こす可能性があるが、一方で高脂血症の治療に適した薬剤として投与することができる。それとは反対に、ここに記載した他のビタミンの使用は、低ビタミン血症またはビタミンの機能的欠乏に関連した特定の状態の場合にのみ、明確に有益である。しかし、その毒性は低いか、あるいは全くないため、多くの可能性のある適応症について研究されてきた。
表12 記載されているビタミンの生物学的特性のうち、一般的なものを抜粋
| ビタミン | 輸送 | 血液貯蔵 | 排泄 | 毒性/副作用 |
|---|---|---|---|---|
| チアミン | トランスポーター媒介+受動拡散 | 赤血球-TPPとして | 尿 | なし/マイナー |
| リボフラビン | トランスポーターが仲介 | 赤血球—FADとして | 尿 | なし/マイナー |
| ニコチン | トランスポーター媒介+受動拡散 | 赤血球 | 尿 | 紅潮、頭痛、乳酸アシドーシスまたは肝毒性を引き起こす可能性のあるニコチン酸の高用量を除いて、なし/マイナー。 |
| パントテン酸 | トランスポーター媒介+受動拡散 | 赤血球 | 尿 | なし/マイナー |
