Contents
Benzodiazepines and Related Drugs as a Risk Factor in Alzheimer’s Disease Dementia
www.ncbi.nlm.nih.gov/pmc/articles/PMC6960222/
要旨
ベンゾジアゼピン(BZD)およびZ-drugsは、抗不安作用、催眠作用、筋弛緩作用があるため、医療現場で広く処方されている化合物である。しかし、慢性的な使用により、多くの患者で乱用、依存、再発がみられる。さらに、高齢者はポリファーマシーによる薬物相互作用だけでなく、薬力学、薬物動態の変化にも影響を受けやすい。
このような状況は、認知機能障害の出現やアルツハイマー病のような病態の発症リスクを高める。本研究では、BZDやZ-drugsの使用と認知機能の低下との関係に焦点を当てて、アルツハイマー病の有無にかかわらず成人を対象にBZDやZ-drugsの効果を評価した臨床研究をまとめた。
さらに、これらの薬剤がアルツハイマー病の発症に関与している可能性のある経路についての分子証明を見つけることに焦点を当てた前臨床研究の評価もある。さらに、本研究では、アルツハイマー病の有無にかかわらず、高齢者患者におけるBZDとZ剤の使用に関する利用可能なデータ(1990年~2019)をまとめた。
最後に、不眠症治療のためのBZDおよびZ-drugの使用とアルツハイマー病バイオマーカーの出現との関係を分析した。結果は、時間の経過とともに患者の状態を悪化させる悪循環を指摘している。
同様に、BZDを使用している患者でもアルツハイマー病を患っている患者の綿密なモニタリングの必要性が浮き彫りになった。その結果、今後の研究では、メラトニンアゴニストのような他の物質を用いた高齢者の不眠症治療戦略の最適化に焦点を当てていく必要がある。
キーワード
ベンゾジアゼピン系薬剤、アルツハイマー病、認知症、認知、危険因子
序論
睡眠障害は、健康な被験者の脳脊髄液中のアミロイドβ(Aβ)レベルを増加させ、神経変性の進行および軽度認知障害(MCI)の出現に寄与することが報告されている(Lopess et al 1999;Virta et al 1999.2007; Modabbernia et al 2011; Consensus and Statements 2014; Di Meco et al 2014; Benedict et al 2015; Gage et al 2015; Chen et al 2016; Gaugler et al 2016; Kincheski et al 2017; La Frenais et al 2017; Livingston et al 2017; Atkin et al 2018; Burke et al 2018)。) 前臨床レベルでは、3xTgマウスにおける睡眠遮断が慢性ストレス因子として作用し、環状アデノシン一リン酸(cAMP)応答エレメント結合(CREB)の減少を有利にし、シナプス可塑性および認知機能に影響を与えることが記載されている(Di Meco et al 2014)(図1)。睡眠制限は、記憶障害およびシナプス損傷に寄与する脳のプロ炎症性サイトカイン[腫瘍壊死因子アルファ(TNF-α)インターロイキン1ベータ(IL1-β)およびIL-6]の高レベルと同様に、コルチコステロンの血漿レベルの上昇を伴って、マウスのアミロイドβ(アミロイドβ)誘発性記憶障害に対する感受性を増加させることが記載されている(Kincheski et al 2017)。その結果、睡眠変化はアルツハイマー病のような散発性病態の発症の主要な危険因子となっており、バランスのとれた生理的な睡眠期間を回復させる薬剤によって適切に管理する必要がある(Kincheski et al 2017;Hennawy et al 2019)。
図1 不眠症とベンゾジアゼピン系薬剤がアルツハイマー病リスクを増加させる可能性のある経路を模式的に示したもの
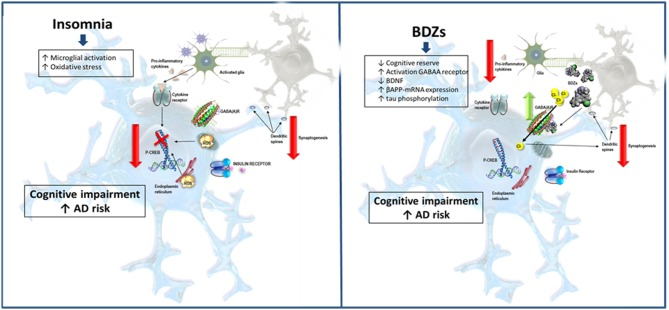
不眠症は中枢神経系のストレス因子であり、ミクログリアの活性化と酸化ストレスを誘導する。同様に、酸化ストレスはp-CREBのリン酸化レベルを低下させ、樹状突起やシナプスを変化させることで認知障害に関与している可能性がある。さらに、睡眠障害はβアミロイドなどの有害代謝物のクリアを妨げる。これらは炎症性サイトカインの産生を増加させ、アミロイドβプラークの形成につながる。さらに、BZDはGABAA受容体を活性化するため、興奮性シナプスを妨害し、認知的予備力を低下させる。さらに、これらの薬剤はBDNFを減少させ、βアミロイド前駆体タンパク質(APP)のmRNAレベルとタウのリン酸化を増加させることが示されている。これらの機序はいずれも、神経炎症を介して認知機能障害のリスクを高め、シナプス可塑性や脳インスリンシグナルを低下させ、アミロイドβプラークや神経原線維のもつれを蓄積させる可能性がある。
ベンゾジアゼピン(BZD)およびその類似のZ-drugsは、不安、神経質、痙攣状態、うつ病、および精神病に対して医療現場で一般的に使用される向精神薬である。また、短期の急性不眠症の治療のための骨格筋弛緩薬や催眠薬としても作用する(Dolder et al 2007)。分子レベルでは、BZDsおよびZ-drugsは、神経伝達物質であるγ-アミノ酪酸(GABA)の受容体上での抑制活性を促進し(Duke et al 2018)受容体に結合したイオントロピーチャネルを介した塩素イオンの流れを有利にし、神経細胞膜の過分極を産生する(SigelおよびErnst 2003)。GABAA受容体は、異なる行動および薬理学的応答を媒介する5つのタンパク質サブユニットからなるイオントロピー性受容体である(Mehdi, 2012; Duke et al 2018)。GABAA受容体のα1サブユニットは鎮静作用に関与すると考えられており、α2とα3サブユニットは抗不安作用と抗うつ作用を発揮する。最後に、α5サブユニットは記憶や学習などの認知機能の制御に関与している(Rissman et al 2007; Savić et al 2010)。
薬物動態学的な観点から、BZDおよび関連薬物は、その半減期によって3つのグループに分けられる。それは、長い(24時間以上)中間作用(6〜24時間)または短い(6時間未満)のいずれかである。通常、短・中間作用型のBZDは不眠症に、長作用型のBZDは不安症に処方されるが、その効果は年齢や肝臓の代謝能力によって変化する。老年期は酸化代謝の低下と関連しており、薬物動態や薬力学の変化により薬物半減期の延長を引き起こす(Taipale et al 2015;Hessmann et al 2018)。実際、高年齢におけるこれらの薬剤の長期使用(2ヶ月以上)は、重篤な副作用をもたらし、耐性および依存性、転倒および骨折のリスクの増加、ならびに認知プロセスの障害を引き起こすことが示されている(Pharmd er al 2003; Obradovi et al 2005; Stewart 2005; Rissman et al 2007; Savić et al 2010; Rosenberg et al 2012; Makaron et al 2013; Biétry et al 2017; Nørgaard et al 2017; Duke et al 2018; Picton and Pharm 2018; Underlien et al 2018; Scott and Aricescu 2019)。)
高齢者患者におけるBZDおよび他の催眠薬の認知への影響は、現在、集中的な研究分野である(Carlisle, 2017)。最近の研究では、Kurlawalaらは、BZDによる3年間の治療後に短期記憶喪失の発症を呈した76歳男性の症例を報告した(Kurlawala et al 2018)。磁気共鳴画像研究により、認知機能の低下は海馬および大脳皮質の萎縮の結果である可能性があることが明らかになった(Barker et al 2004;Hessmann et al 2018;Kurlawala et al 2018;Pictonら、Pharm et al 2018)。GlassらおよびKripkeらのグループによって行われた研究では、催眠薬の副作用が60歳以上の人口で達成される利益を上回ることが報告されており、一部の患者の死亡リスクを増加させるまでに至っている(Glass et al 2005; Kripke et al 2012; HammondおよびEsclapez 2015年)。その結果、これらの結果を受けて、国立衛生研究所および米国老年医学会のビアス基準は、エスゾピクロン、ゾルピデム、およびザレプロンなどの分子を「潜在的に不適切な薬物」としてリストアップした(Consensus and Statements, 2014; Investigations, 2015; Taipale et al 2015; Wennberg et al 2018)。BZDsは避けるべきであるか、または短期的かつ特定の状況にのみ処方すべきであると判断された(Letter, 2019; Walsh and Roth)。しかしながら、BZDsおよびZ-drugsは、睡眠不足の患者には依然として広く不適切に処方されている(Gunja, 2013; Pariente et al 2016; Nørgaard et al 2017; Richardson et al 2018)。
幸いなことに、睡眠不足の状況を治療するために、BDZに代わるものが存在する。Sateiaらは、不眠症治療のための臨床実践ガイドラインをJournal of Clinical Sleep Medicineに発表した(Sateia et al 2017a,b)。その原稿の中で著者らは、睡眠時発症型不眠症に対してラメルテオンを提案している。この薬剤はメラトニン受容体に選択的に結合し、BZD長期治療に伴う依存性や他の重要な副作用を回避する。同じ論文では、著者らはまた、不眠症における睡眠維持のためにZ-drugsまたはBZD催眠薬を推奨している(Sateia et al 2017a)。2018,米国食品医薬品局(FDA)は、不眠症の治療のためのいくつかの非BZD化合物を承認した(Richardson et al 2018)。これらには、エスシタロプラム、ドキセピン、トリミプラミン、アミトリプチリンなどの抗不安作用または鎮静作用を有する抗うつ薬、およびトラゾドンおよびミルタザピンなどの複素環系薬剤が含まれる(Gunja, 2013; Richardson et al 2018)。
本論文の目的は、BZDとZ-drugの使用のリスクと、アルツハイマー病症例における認知機能低下の出現におけるそれらの役割について、発表された資料をレビューし、議論することであった。
ベンゾジアゼピン系薬剤および関連薬剤誘発性認知障害に関与する潜在的な分子機序
BZDや向精神薬が認知障害を誘発する分子メカニズムは不明であるが、いくつかの仮説が示唆されている(Gage et al 2015)。これらのメカニズムを図1にまとめた。
1つの仮説では、BZDの高齢長期消費者は限られた認知的予備力を示すとしている。この概念は、脳内に強力で冗長なシナプス結合が存在するために、脳内の加齢に関連した変化や疾患に関連した変化に耐える能力を指す。このメカニズムにより、明確な認知臨床症状や記憶喪失を発症することなく、より長い期間の神経変性疾患に耐えることが可能になると考えられている(Stern, 2012)。BZDsやZ-drugsはGABAA受容体モジュレーターであるため、脳の活性化を低下させ、シナプス可塑性を低下させ、患者の新しい記憶を作成する能力に影響を与える。このように、BZDsは記憶に必要な興奮性シナプスの機能を阻害する。さらに、高齢者における社会的ネットワークの喪失は、認知機能にも影響を与える追加要因として作用する可能性がある。同様に、加齢期の睡眠障害に対するBZD治療は、社会的コミュニケーションネットワークを作成する能力を制限し、認知症の発症を促進し得る(Wan et al 2004;Pariente et al 2016;Mohamad et al 2019)。
GABAA受容体の組成もまた、催眠薬に関連した認知機能の変化に関与している可能性がある。海馬および大脳皮質の深層にほぼ独占的に存在するα5GABAAサブユニットへのBZDsの結合が、サルにおける文脈情報の記憶を損なうことが報告されている(Wan et al 2004;Mohamad et al 2019)。注目すべきことに、ゾルピデムは、α5GABAAではなく、α1GABAAへの親和性によって説明できる視覚的手がかりに基づくタスクのパフォーマンスを損なうことはなかった(Mohamad et al 2019)。さらに、BZDの記憶障害効果は、α1GABAA選択的BZDアンタゴニストβ-カルボリン-3-カルボキシレート-3-ブチルエステルによってブロックされないことが報告されているが、α5GABAAアンタゴニストXLi-093はトリアゾラムの効果をブロックしたが、ゾルピデムの効果はブロックしなかった(Caraiscos et al 2004;Mohamad et al 2019)。これらの知見は、BZD関連認知障害におけるα5GABAA受容体の特異的な役割を示唆している。さらに、最近の報告では、CA1海馬および大脳皮質におけるα5GABAAのシナプス外強直抑制の調節が、海馬における記憶プロセスを改善および調節しうることが示唆されている。したがって、α5GABAAの負の調節は、神経疾患における認知機能障害に対する潜在的な治療法の開発のための適切なターゲットとなり得る(Caraiscos et al 2004)。反対に、Joksimovićらは、α1GABAAサブユニット受容体の活性化がネズミの空間学習能力に影響を与える可能性があることを実証した(Joksimović et al 2013)。また、α1GABAAサブユニットが前向性健忘、鎮静、運動不能、抗痙攣BZD効果に関与していることも報告されている。
また、Marczynskiが紹介した「脳老化のGABA作動性脱力仮説」は、ラットにジアゼパムを投与すると脳内のブドウ糖利用が低下するという事実に基づいている(Marczynski, 1995, 1998)。細胞内のアデノシン三リン酸(ATP)レベルの低下は老化とアルツハイマー病の特徴であることから、脳内のBZDs-GABA受容体複合体の代謝的影響を考慮すると、老化によるアルツハイマー病の素因となる可能性が論理的に考えられる(Marczynski, 1995)。これについては、BZDsのアンタゴニストであるフルマゼミルの投与により、ネズミのグルコース利用が増加することが報告されている(Marczynski, 1998)。このことから、BZDの認知機能への悪影響を説明するメカニズムとして、BZDアゴニストの脱分極作用や抑うつ作用が脳のエネルギー代謝を低下させる可能性が考えられる。また、BZDアゴニストは、副腎性内分泌ニューロトロフィンファミリーの作用を阻害する可能性がある。実際、神経成長因子(NGF)関連タンパク質が神経細胞の生存、成長、維持に関与していることはよく知られている。この意味で、Zhaoらは、ジアゼパムを長期投与したマウスでは行動の変化が見られ、海馬シナプトフィシンと脳由来神経栄養因子(BDNF)のレベルが低下したことを報告している(Zhao et al 2012)。BDNFは、(i)シナプス後膜のα-アミノ-3-ヒドロキシ-5-メチル-4-イソオキサゾールプロピオン酸(AMPA)受容体の数を増加させ、(ii)長期増強(LTP)を促進し、(iii)海馬におけるGABAA受容体の発現を減少させ、抑制性のGABA作動性神経伝達を減少させることにより、シナプス伝達の機能的側面に影響を与えることから、これは重要な問題であると考えられている(Jovanovic, 2004)。このようなメカニズムにより、BZDは軸索の両方向への輸送を阻害し、神経原線維のもつれの形成を増加させ、さらにβAPP-mRNA遺伝子の発現を誘導し、アルツハイマー病のリスクを増加させる可能性があると考えられた。さらに、グルタミン酸レベルは、神経細胞のCa2+の恒常性を不安定化させることでも影響を受け、神経細胞はグルタミン酸の影響をより受けやすくなる可能性があると考えられている(Jovanovic, 2004)。
最近、Whittingtonと共同研究者の興味深い研究では、ミダゾラムがC57BL/6マウスのタウリン酸化を増加させたことが報告された(Whittington et al 2019)。その結果、著者らは、最も頻繁に使用されているBZDがアルツハイマー病リスクの増加に強く関与している可能性があるため、タウリン酸化に対する効果を深く評価すべきであることを示唆した。実際、可溶性タウオリゴマーを含むタウの病原性形態は、疾患の初期段階で、いくつかのメカニズムによって神経細胞機能障害および認知機能低下を促進し得る(Forner et al 2017;TracyおよびGan 2018)。同様に、Marciniakらは、タウタンパク質が、認知プロセスにおいて基本的な役割を果たす脳インスリンシグナル伝達の調節に関与し得ることを報告した(Marciniak et al 2017)。彼らは、アルツハイマー病の前臨床モデルにおけるインスリンシグナル伝達の変化が、タウの変化を介して起こりうることを示した。
アポリポ蛋白質E(APOE)4対立遺伝子がADの危険因子であることもよく知られている(Stonnnington et al 2009)。この対立遺伝子の存在は、他のAPOE対立遺伝子変異体と比較した場合、アミロイドβ蓄積の増加だけでなく、認知機能の低下および疾患発症の増加と関連している。この点に関して、Pomaraらは、APOE4対立遺伝子を持つ高齢者キャリアにおいて、ロラゼパムの急性投与による認知的副作用に対する感受性が増加したことを報告している(Pomara et al 2011)。このように、APOE4は向精神薬を媒介とした認知機能低下のリスクにもなり得ると考えられる。同様に、同じグループは、非常に長いTranslocase of Outer Mitochondrial Membrane 40 Homolog (TOMM40) Poly-T Lengthを持ち、かつϵ4対立遺伝子を持たない被験者もまた、BZDに関連した認知機能低下のリスクが高い可能性を示唆した。したがって、アルツハイマー病の危険因子としての催眠薬に対するAPO E遺伝子型の影響は関連性があると考えられ、APOE4遺伝子型解析は、リスクのある患者へのBZD処方を回避するための医師の指針となる可能性がある。最後に、Stonningtonらは、中年(50~65歳)の認知機能正常成人にロラゼパム2mgを急性投与したところ、ε4キャリアは非キャリアと比較して、言語エピソード記憶と視覚空間記憶/実行機能の低下が高かったことを報告している(Stonnington et al 2009)。
しかし、アミロイドβは、他の2つの興奮系(コリン作動性神経伝達およびグルタミン酸神経伝達)の動的なGABAバランス調節の結果として、抑制性GABA作動性伝達にも間接的な影響を及ぼす可能性がある。興味深いことに、興奮性系と抑制性系の間の不均衡が、アミロイドβによって引き起こされるシナプス機能障害の根底にあることが最近示唆されている(Rissman et al 2007)。
臨床研究
2018年11月から 2019年2月までの間に、研究テーマにリンクした臨床研究について、3つの認知度の高いデータベースで文献レビューを実施した。Web of Science、Scopus、PubMedを利用した。コロケートされたキーワードは以下の通りであった。アルツハイマー病 AND ベンゾジアゼピン、ベンゾジアゼピン AND 認知機能障害、ベンゾジアゼピン AND 認知機能低下、催眠薬 AND 認知機能低下、Z-drugs AND 認知機能低下、催眠薬 AND アルツハイマー病。キーワードを組み合わせてデータベース検索と雑誌検索で統合した。使用した用語は、リストされたキーワードを組み合わせるためにANDを使用して検索し、可能であれば検索の重複を取り除くためにORを使用して検索した。著者の検索で見落としていたり、無視されていた可能性のある検索された論文の参考文献も評価した。
これらの研究はすべて、以下の包含基準のもとで十分に調査され、検討された。
- すべての論文は 2019年2月までにヒトを対象に実施された研究を発表したものでなければならない。
- すべての論文は英語で書かれていなければならない。
- 主要アウトカムは認知機能の低下とアルツハイマー病に焦点を当てたものでなければならなかった。
ケースコントロール研究
このセクションでレビューされた研究のデータは、表1に記載されている。
表1 高齢者およびアルツハイマー病患者の認知機能低下の遅延に対する BZD および Z-drugs の効果を調査した厳選された症例対照研究の概要。
| 参考文献 | 目的 | 介入 | 被験者数 | 主なアウトカム指標 | 調査結果 |
|---|---|---|---|---|---|
| Lagnaoui etal。(2002) | フランスのコミュニティ居住人口の大規模な代表的なコホートにおけるBZDと認知症との関連を調査すること。 ボルドーのPAQUID (PersonnesAgéesQuid)研究プログラムからのデータ。 |
1989–1997 | 150件のケースと3,519件のコントロール。 65歳以上。英国を拠点とするClinicalPractice ResearchDatalinkのデータ |
認知障害は、ミニ メンタルステート評価(MMSE)とCTスキャナーを使用して評価されました。 診断は 精神障害の診断と統計マニュアル(DSM-III-R)とNINCDS-ADRDAに基づいていました |
BZDの消費は、高齢者の認知症の危険因子を構成します。 |
| ウーら (2009) | 長期のBZD使用と認知症のリスクとの関連を調査すること。ネストされたケースコントロール研究(台湾) | 1997〜 2004年 | 4,626人の対照被験者と779人の認知症患者が催眠薬で治療されました。45歳以上。 | 鎮静催眠薬の累積投与量DDDと平均日数(年間)。 | 催眠鎮静薬の長期使用はADリスクを高めます。 |
| ウーら (2011) | BZDの中止が認知症のリスクに影響を与えるかどうかを調査すること。ネストされたケースコントロール研究(台湾) | 1997〜 2007年 | 認知症の8,434人の患者と16.706人の対照被験者。45歳以上。 | BZDの中止。 | ADのリスクはBDZとともに増加しますが、BZDの中止とともに減少します。 |
| Billioti de Gage etal。(2012) | BZDの使用と認知症との関連を評価すること。 | 1987–1989 | 1,063人のコミュニティ居住者。 65歳以上。 |
精神障害の診断と統計マニュアル、第3版、改訂版(DSM-III-R)に基づいて評価された認知症。 | BDZの使用は、認知症のリスク増加と関連していた。 |
| Billioti de Gage etal。(2014) | 以前のBZD使用とADのリスクとの関連を評価し、潜在的な用量効果関係を調査する(カナダ) | 2000〜 2009年 | 1,796人のAD患者と7.184人の対照。66歳以上。 | ADの最初の診断(指標日)(ICD-9(国際疾病分類、第9改訂) | 3か月以上前に治療を受けた高齢者では、BZDとADのリスク増加との間に用量効果関係は見られませんでした。 |
| Imfeld etal。(2015) | BZDの使用と認知症のリスクとの関連を評価すること。 | 1998〜2013 | ADの16,823人の被験者と血管性認知症の9,636人の被験者で、 それぞれが1人の対照とランダムに一致しています(年齢、性別、一般診療、フォローアップの期間)。65歳以上。これらのBZDを使用した研究期間は、ADの診断から2年、血管性認知症から3年でした。 |
特定の認知症検査の記録に基づくアルゴリズム[例、ミニメンタルステート検査(MMSE)、時計描画検査(CDT)、または短縮精神検査(7分画面)]、専門家への紹介、 脳画像[コンピューター断層撮影( CT)、磁気共鳴イメージング(MRI)、または単一光子放射型コンピューター断層撮影(SPECT)]症状(記憶障害、失語症、失語症、または 無知症)は、特定の認知症サブタイプの診断をサポートします。 |
BZDの長期使用は、ADまたは血管性認知症のリスク増加とは関連していません。 |
| Gomm etal。(2016) | ドイツの公的医療保険データAllgemeineOrtskrankenkassen(AOK)で、60歳以上のドイツの大規模な人口におけるBDZとZ薬の消費および認知症との関連を調査する。これは、少なくとも80歳の人口の約50%をカバーします。 | 2004〜 2011年のフォローアップ。 | 60歳以上の21,145例(認知症)および84,580例の対照。 | 認知テスト。 | 高齢者にBDZとZ薬を定期的に使用すると、認知症のリスクが大幅に高まります。 |
| Saarelainen etal。(2016) | 著者らは、ADの診断の2年前と3年後に投与されたBZDとZ薬の効果を評価しました。フィンランドのMEDALZコホート。 | 2005〜 2011年 | ADの51,981人の患者と159.974人の対照。 | ADは、国立神経伝達障害および脳卒中研究所、アルツハイマー病および関連障害協会、ならびに診断および統計マニュアル、第4版の基準に基づいて診断します。 | BZDの使用はAD患者でより高いです。BDZは抗AD薬の有効性を低下させる可能性があります。 |
| Biétryetal。(2017) | 以前のBDZの使用とADのリスクとの関連。スイスの大手健康保険会社であるHelsanaGroupからのデータ。 | 2013〜 2014年 | 1,438人のAD患者と1,438人の対照。 | 2013年または2014年ADの診断介しドネペジルための解剖治療化学分類(ATC)コードN06DA02を使用して、アセチルコリンエステラーゼ阻害剤またはN-メチル-D-アスパラギン酸受容体アンタゴニスト、メマンチン(一般に治療ADに使用される薬剤)の記録された第一回の使用、N06DA03リバスチグミンの場合、ガランタミンの場合はN06DA04、メマンチンの場合はN06DX01 | 認知症の診断に先立つ2年間のBZDの使用は、ADを発症するリスクの増加とは関連していませんでした。 |
| Saarelainen etal。(2018) | AD患者の全国コホートにおける新BZDおよび関連薬(BZDR)の使用に関連する死亡リスクを調査すること。フィンランドのMEDALZコホート。(フィンランド) | 2005〜 2011年 | 70,718人のAD患者。 | ADは、国立神経伝達障害および脳卒中研究所、アルツハイマー病および関連障害協会、ならびに診断および統計マニュアル、第4版の基準に基づいて診断します。 | BZDの使用は、AD患者の死亡リスクの増加と関連しています。 |
| Tapiainen etal。(2018) | 累積消費量と治療期間を考慮して、BDZと関連する薬物使用およびADのリスクとの関連を評価すること。 | 2005〜 2011年 | 2005年から2011年に臨床的にAD診断が確認された70,719人の被験者と282,862人の一致した対照。 | DSM-IVおよびNINCDS-ADRDA基準に基づくAD診断。慢性疾患(COPD、喘息、脳血管認知症、糖尿病)、他の物質の乱用、社会経済的地位、AD診断の5年前の抗うつ薬または抗精神病薬の使用など、いくつかの交絡因子が考慮されました。 | BZDおよび関連する薬物使用は、ADのリスクの適度な増加と関連していた。BZDの異なるサブカテゴリー(BZD、Z薬、短時間/中作用または長時間作用型BZD)間で大きな違いは観察されませんでした。 |
Lagnaouiらは、ネステッド症例対照研究において、GABAA活性化剤投与後に認知症のリスクがわずかに増加したと結論づけている(Lagnaoui et al 2002)。それにもかかわらず、著者らは、抗精神病薬のような中枢神経系(中枢神経系)に影響を及ぼす可能性のある他の評価されていない薬剤への曝露の影響が結果に偏りを与えた可能性があることを認めている。別の研究では、同じグループがアルツハイマー病患者におけるBZD使用の有病率を3ヶ月間評価し、高齢のアルツハイマー病患者におけるBZD使用に対する意識を高めた(Lagnaoui et al 2002)。同じ著者は、BZDとアルツハイマー病との関連を調べるために、カナダの高齢女性の大規模な代表的なコホートからのデータを使用してケースコントロール研究を実施した。彼らは、BZDの以前の使用と認知機能低下のリスクの増加との間の関連について、有意ではない傾向を発見した。おそらく、症例数(n = 73)と対照(n = 437)の数が少ないため、統計的有意性に達することができなかった。
Wuらは、1997年から 2004年までの45歳以上の人を対象とした国民健康保険調査データベース(NHIRD)を用いて、台湾で2件の症例対照研究を実施した(Wu et al 2009)。本研究の主な結論は、BZDまたは類似薬物の長期使用は、有病者および慢性使用者において、最大8年間の追跡調査で認知症および認知機能の変化のリスクの増加と関連している可能性があるということであった。また、著者らは、認知症リスクはBZDの累積投与量が多く、BZDへの暴露期間が長いほど関連していることも示唆している(Wu et al 2009)。2つ目の研究では、同じグループはBZDの中止が認知症リスクを低下させる可能性があるため、この関連性は可逆的であると述べている(Wu et al 2011)。
2012年には、Billioti de Gageらがフランスの集団を対象に研究を行った。その主な結論は、BZDの新規使用はアルツハイマー病リスクの約50%上昇と関連しているというものであった(Billioti de Gage et al 2012)。2014年には、同じグループがケベック州(カナダ)の高齢者集団を対象に、アルツハイマー病と診断される5年前までの10人の間で、用量と処方理由(不安、抑うつ、不眠)の両方を考慮して、BZDsへの曝露の影響を評価した(Billioti de Gage et al 2014)。彼らは、BZDの慢性的な使用は、1日用量が91~180mg/kg(毎日処方されたものとして表現される累積用量、3~6カ月間)の場合にアルツハイマー病リスクの上昇と関連しており、180mg/kg以上の用量(6カ月以上の曝露期間)でさらに上昇すると結論づけた。
Gommらは、定期的に催眠薬を処方されている患者では、非使用者と比較して認知症リスクが21%増加したと報告している(オッズ比[OR]1.21,95%信頼区間[CI]1.13~1.29;p<0.001)(Gomm et al 2016)。また、著者らは、BZDの初回処方から認知症と診断されるまでに約3年の期間が存在することを報告している。この研究では、APOE4対立遺伝子を持つ人や教育レベルが低い人など、アルツハイマー病の潜在的リスクが高い人のための特定の選択方法を作成していなかった。同様に、この研究は催眠術の常用者の分析にのみ焦点を当てていた。
Saarelainenらは、マッチドコントロールと比較したアルツハイマー病患者の集団におけるBZDとZ-drugsの効果を調査するために 2005年から 2011年の間にアルツハイマー病と診断された70,718人のフィンランドのコホートを対象とした研究を行った(Saarelainen et al 2016)。著者らは、これらの向精神薬は、抗コリンエステラーゼ薬またはメマンチンのいずれかのアルツハイマー病治療に使用される薬剤の有益な効果を阻害する可能性があると結論づけた。さらに、BZDで治療されたアルツハイマー病患者は、そのような薬剤を使用しなかった患者に比べて、最大41%高い死亡リスクを示した。Z-drugsは死亡リスクを増加させなかったが、著者らは認知症の人ではより安全とは考えられないことを示唆した(Saarelainen et al 2018)。
別の研究はフィンランドの広い集団で6年間行われた(Tapiainen et al 2018)。現在、これはBZDとZ-drugsのアルツハイマー病リスクへの影響を評価した最大規模の研究である。さらに、著者らは、別の併用向精神薬を調整した後のオフ比(OR)が1.06(95%CI 1.04~1.08)であったことから、BZDsとZ-drugsはアルツハイマー病リスクを緩やかに増加させると結論づけた。彼らは、BZDのサブカテゴリー(作用時間が長いか短いか)の間に有意差は見いだせなかった。
物議を醸しているのは、BZD/Z-drugsが認知機能低下のリスクを増加させるという考え方に疑問を呈する研究があることである。例えば、Infeldらが行った研究では、BZDの長期使用はアルツハイマー病のリスクを増加させないことが示された(Imfeld et al 2015)。期間とベンゾジアゼピンの種類で層別化し、過去のBZD使用との関連でアルツハイマー病または血管性認知症を発症する95%信頼区間(CI)で調整オッズ比(aOR)を算出した。アルツハイマー病診断の1年前にBZDを開始した人のアルツハイマー病発症のORは2.20(1.91~2.53)であり、2~3年前にBZDを開始した人ではヌルに落ちた[aOR 0.99(0.84~1.17)](Imfeld et al 2015)。同じ系統で、Biétryらは、アルツハイマー病診断前に2年間のBZDと関連薬物治療を行った後のアルツハイマー病リスクを評価した(Biétry et al 2017)。その結果、アルツハイマー病発症リスクはBZDやZ-drugsとは関連性がないことが示された。同様に、BZDの半減期もアルツハイマー病リスクとは関連していなかった(Biétry et al 2017)。
コホート研究
このセクションでレビューされた研究のデータを表2に示する。
表2 コホート研究
| 参考文献 | 目的 | 介入 | 被験者数 | 主なアウトカム指標 | 調査結果 |
|---|---|---|---|---|---|
| ロペスら。(1999) | 向精神薬の使用と認知、機能、およびADとの関連を調べること | 1983–1988 | 82.2歳のアルツハイマー病の179人の患者は平均6.6 | 認知障害は、ミニメンタルステート評価(MMSE)を使用して評価されました | BZDはADのリスクを高めます |
| エリュールら (2007) | アルツハイマー病患者の病気の進行に対するいくつかの薬の効果を調べること。 | 報告されていない | 82.2歳のアルツハイマー病患者257人は平均6.6標準偏差 | アルツハイマー病の診断は、NINCDS-ADRDA基準に従って行われました。 | 抗精神病薬とBZDは、これらの薬で治療された患者のより大きな認知機能低下と関連していた。 |
| Rosenberg etal。(2012) | キャッシュ郡認知症進行研究からのコミュニティで確認されたインシデントAD症例における、認知、機能、および神経精神症状を伴うAD診断後の観察年数で割った薬物使用年数を表す持続性指数を通じて向精神薬の長期的関連を調べること | 報告されていない | 335人の参加者がインシデントADと診断されました | 認知障害はミニメンタルステート評価(MMSE)と臨床認知症評価でした | 向精神薬の使用は 、ADのより急速な認知および機能低下と関連していた |
| Hessmann etal。(2018) | ドイツのニーダーザクセン州にあるドイツの公的疾病基金(Allgemeine Ortskrankenkasse AOK、2018)で保険をかけられた認知症患者のBZD処方の継続性を評価すること | 2014〜 2015年 | 認知症の1,298人の被験者。 | 2014年の認知症の診断、国際疾病分類に従って特定 | 認知症患者では、長時間作用型BZDの使用を避ける必要があります。 |
| Lee etal。(2018) | 韓国国民健康保険データベースからの後ろ向きコホート研究による韓国人集団における鎮静催眠薬の使用とADのリスクとの関連 | 2002〜 2015年のフォローアップ。 | 268,170人の被験者。 50歳以上 鎮静催眠薬の投与量は、定義された1日投与量(DDD)によって標準化されました。 |
30 DDD以上の鎮静催眠薬を処方された、これまでに曝露された人と曝露されていない人との比較。 | ADのリスクは、鎮静催眠薬にさらされた被験者の方が高かった。(GABAA受容体アゴニスト)。360 DDDを超える鎮静催眠薬に曝露された患者は、治療を受けていない患者と比較して、認知症のリスクが高いことを示しました。 |
| グランデ他 (2019) | 初期の認知変化に苦しんでいるプライマリケア患者の最初の認知変化に対するBDZの効果を調査すること。データは、REMIND(REteMilanese INtegrata per le Demenze)データベースから取得されます。 | 報告されていない | ミラノ大都市圏の353人の一般開業医(GP)によって登録された4,249人の被験者(平均年齢77.0±8.2)。) | ミニメンタルステート検査(MMSE)を使用した、アドホックトレーニングを受けたGPによる認知機能の評価 。 |
BZDの使用は、最初の認知的愁訴のあるプライマリケア患者の 認知 能力低下のリスク増加とは関連していません。 |
BZDs/Z-drugsと関連薬物の認知機能への関連性を評価したいくつかのプロスペクティブおよびレトロスペクティブなコホート研究では、議論の余地のある結果が報告されている。
例えば、Lopezらの研究では、アルツハイマー病患者におけるBZDsの使用は慎重に行うべきであり、転倒のリスクのためにその使用は適切ではないと結論づけている(Lopez et al 1999年)。また、不眠症の治療においては、抗ヒスタミン薬などの他の薬剤の使用を示唆している。また、Ellulらは、抗精神病薬やBZDの処方は、アルツハイマー病患者の認知機能低下を加速させる可能性があることを示唆した(Ellul et al 2007)。プロスペクティブで長期的な「Caerphilly研究」では、BZDの使用と血管性認知症と非血管性認知症の両方を発症するリスクの増加との関連性も証明された(Gallacher et al 2012)。著者らは、22年以上の追跡調査を行った男性の代表的なサンプルを調査した。その結果、BZDの使用で認知症のリスクが有意に高くなることが報告された。さらに、Rosenbergらは、抗精神病薬とBZDsは高い持続性指数に関連した認知機能低下の増加を示すことを示唆した(Rosenberg et al 2012)。Leeらは、鎮静催眠型抗うつ薬と抗精神病薬の使用後のアルツハイマー病のリスクを評価した(Lee et al 2018)。興味深いことに、アルツハイマー病のリスクは、定義された1日用量(DDD)を30回以上投与された患者で高かった。同様に、本研究では、異なるグループのBZDが評価され、中間的なBZDが最も高い認知症リスクと関連していた。この研究では、アルツハイマー病のリスクはBZDsと鎮静催眠薬と関連しており、この関連は用量依存性であると結論づけた(Lee et al 2018)。台湾で行われた別の研究では、Chenらは1995年から 2010年までに登録された患者2300万人を対象としたNHIRDのデータを使用し、人口の99%を占めてた(Chen et al 2012)。著者らは、使用された催眠薬を明確に示しており、2つのグループに分類されていた。BZDとZ-drugsの2つのグループに分類された。その結果、長期不眠症の患者では、どちらの催眠薬も認知症の危険因子と考えるべきであることが示唆された。同様に、BZDsとZ-drugsの高処方量と認知症リスクとの間に関連性が認められ、これは先行研究と一致している(Tapiainen er al)。
不安を持つ高齢者はアルツハイマー病発症のリスクが高い可能性が提案されており、MCIやアルツハイマー病を持つ成人のアミロイドβレベルの上昇に関与していた(Pietrzak et al 2015)。そこで、Burkeらは、アルツハイマー病発症リスクにおける抗不安薬の役割を調査した。同様に、彼らは、現在高齢発症型アルツハイマー病の最も重要な危険因子であるAPOE ε4との関連を評価した(Burke et al 2018)。この研究の重要な知見の1つは、ε4キャリアはアルツハイマー病発症の統計的に有意に高いリスクを有していたことであった;しかしながら、この効果は抗不安薬の使用によって緩和された。抗不安薬、アルプラゾラム、ロラゼパム、パロキセチン、またはベンラファキシンは、特に、MCIおよびアルツハイマー病発症における不安の関連を改善する可能性がある。しかし、同じ研究で著者らは、クロナゼパムは不安を伴うε4の使用者の間でMCI発症のリスクを統計的に有意に増加させたことを報告しており、クロナゼパムによって変化する認知の分子メカニズムがあることを示唆している。
発散的には、Grayらによって発表された前向き集団ベースのコホート研究では、平均7年間の追跡調査後にBZDの累積投与量に関連した認知症リスクが調査された(Gray et al 2016)。彼らは、低用量または中用量のBZD治療を受けた人の認知症リスクの増加はわずかであったと報告している。しかし、この研究では、BZDはアルツハイマー病のリスクを増加させないと結論づけている(Gray et al 2016)。さらに別の研究チームは、アセチルコリンエステラーゼ阻害薬(ドネペジル、ガランタミン、リバスチグミン)やメマンチンなどの抗認知症薬で治療された最近診断された軽度アルツハイマー病の患者を調査した。著者らは、アルツハイマー病と向精神薬の使用増加との関連を報告している(Törmälehto et al 2017)。しかし、向精神薬の投与は認知パフォーマンスの変化とは関連していなかった(Törmälehto et al 2017)。最後に、Grandeおよび共同研究者は、短時間および長時間作用型BZDsで治療された患者は、25.4;95%CI 25.1〜25.7の修正MMSE平均スコアを示したが、非治療患者は25.9;95%CI 25.3〜26.4(短時間作用型BZDs);25.3;95%CI 25.2〜25.5(長時間作用型BZDs);(p=0.156)であったことを示した(Grande et al 2019)。したがって、著者らは、BZDsの使用は、初期の認知機能の変化に苦しんでいる患者の認知損失の増加とは関連していないと述べている。
表3 縦断的研究
| 参考文献 | 目的 | 介入 | 被験者数 | 主なアウトカム指標 | 調査結果 |
|---|---|---|---|---|---|
| Bierman etal。(2007) | 高齢者の認知機能に対するBZD使用の影響を評価すること。 人口ベースの研究であるアムステルダムの縦断的老化研究(LASA)からのデータ |
9年間のフォローアップ | 55〜85歳の2,105人の被験者。 | ミニメンタルステートによって測定された一般的な認知機能; 聴覚言語学習テストで測定されたエピソード記憶; RavenのColoredProgressive Matricesからの12項目(AおよびB) の2つの サブセットによって測定された流動性知能 。コーディングタスクの調整されたバージョンによって測定された情報処理速度。 |
治療期間とBZD使用への累積曝露は、高齢者の認知機能に悪影響を及ぼしました。ただし、この影響は小さかった。 |
| Boeuf-Cazou etal。(2011) | VISAT研究(老化、健康および仕事)(フランス)からの認知機能人口に対する長期BZD消費の影響を調査すること。前向きコホート研究。 | 10年間のフォローアップ | 32、42、52、および62歳の男性1,660人と女性1,577人。BDZの使用に応じて、非ユーザー、臨時ユーザー、およびログタームユーザーに分類されます。 | 認知機能は、5つの認知テスト(即時自由想起テスト、遅延自由想起テスト、認識テスト、数字記号置換サブテスト、視覚探索速度テスト)を使用して評価されました。 | BDZの長期使用は、女性の長期記憶に特定の障害をもたらします。 |
Boeuf-Cazouらは、若年成人を対象とした研究で、BZDsの長期暴露が長期記憶障害をもたらすのは女性のみであるが、その変化が老年期の認知症発症リスクと関連しているかどうかを確認するためには、より長い期間の観察が必要であると結論づけている(Boeuf-Cazou et al 2011)。
しかし、Shashらは「The Three-City Study」と名付けられた大規模な集団コホート研究で、1999年から開始された65歳以上の非入院患者を対象に、BZDの短半減期と長半減期、および他の向精神薬の認知症への影響を比較した。その結果、半減期の長いBZDの使用者は認知症発症リスクが60%上昇したと結論づけている(Shash et al 2016)。また、BZDsの4年以上の慢性使用が認知機能低下リスクの増加と関連しているかどうかも検討された(Paterniti et al 2002)。その結果、BZDの長期使用は高齢者の認知機能低下の有意な危険因子であることが明らかになった(MMSE、Trail Making Test、Digit Symbol Substitution)。最後に、BZDsは認知能力を低下させることが報告されているが、その効果は小さいものであった。また、高齢者の認知機能への悪影響は、BZDの治療期間や累積投与量の増加が原因であることが示唆されている(Bierman et al 2007)。
表4 横断的研究
| 参考文献 | 目的 | 介入 | 被験者数 | 主なアウトカム指標 | 調査結果 |
|---|---|---|---|---|---|
| Taipale etal。(2015) | BZDと関連薬物の消費、特に長期の消費の有病率、およびADの有無にかかわらず地域在住の個人間の関連要因を調査すること。 | 2002〜 2006年 | 研究に含まれた人の数は、ADのある個人で24,966人、ADのない個人で24,985人でした。この研究は、MEDALZ-2005(医薬品の使用とアルツハイマー病)コホートのデータに基づいています。このコホートには、2005年末にフィンランドでADと診断され、ADのない個人と一致するすべての地域在住の個人が含まれます。 | INCDS-ADRDAおよびDSM-IV基準に基づくADの診断。 | BDZの長期使用は、認知を損なう可能性があり、重篤な有害事象に関連する可能性があります。 |
| Hessmann et al。、2019 | ドイツ、ニーダーザクセン州の認知症患者におけるBZD処方の継続性を評価すること。 | 2014〜 2015年 | 認知症の98人の被験者。 | 2014年の認知症の診断、国際疾病分類に従って特定 | 認知症患者は長時間作用型BZDの使用を避ける必要があります。 |
Muraらは、フランスで65歳以上の人を対象に、BZDの慢性使用が認知機能低下に及ぼす影響を評価するための横断的・縦断的研究を行った(Mura et al 2013)。研究には合計5,195人が参加し、そのうち969人がBZDの慢性使用者であった。その結果、慢性的なBZD使用は認知パフォーマンスの低下と関連していたが、加齢に伴う認知機能の低下の加速とは関連していなかった。しかし、著者らは、BZDは認知パフォーマンスを悪化させ、認知的予備力の枯渇を増加させ、認知症の発症を早める可能性があると述べている(Mura et al 2013)。その後、別のチームは、フィンランドの集団におけるBZDとZ-drugの使用の有病率を評価することを目的とした(Taipale et al 2015)。著者らは、アルツハイマー病患者の約半数が4年間の追跡調査中にBZDとZ-drugを使用しており、アルツハイマー病患者はアルツハイマー病なしの患者よりも長期的にBZDを使用していたと結論づけた。別の研究では、同じグループは MEDALZ-2005 集団から採取した アルツハイマー病 患者の BZDs と Z-drugs に関連した脳卒中 (虚血性または出血性) のリスクを調査した。その結果、BZDsとZ-drugsを使用したアルツハイマー病患者では虚血性脳卒中のリスクが20%増加することがわかった。しかし、出血性脳卒中のリスクは上昇しなかった(Tolppanen et al 2017)。
反対に、国立加齢医学研究所(NIA)ADCからデータを収集したZhangらは、BZDsと認知機能低下との関連はないと報告した(Zhang et al 2016)。
メタアナリシス
Zhongらは、参加者45,391人、認知症症例1,891例を対象とした5つの研究を含むメタ解析で、BZDの長期使用と認知症との関連を調査した。さらに著者らは、BZDの用量を22%増加させた場合に関連する潜在的な認知症リスクを評価した(リスク比1:22,95%CI 1.18-1.25)。彼らは、長期のBZD使用者は非使用者と比較して認知症のリスクが高いと結論づけた(Zhong et al 2015)。
順番に、Heらは10件の研究をプールし、BZDと認知症リスクとの関連を評価した。PubMedとEmbaseのデータベースを用いて 2017年9月までの関連出版物を系統的に検索した。文献検索では、BDZsの長期使用と認知症リスクとの関連を分析した観察研究に焦点を当てた。彼らの主な所見は、BZDを使用している高齢者において認知症リスクが有意に増加していることを指摘していた。この効果は、半減期が長く、治療期間が長いBZDsの使用と関連していた(He et al 2019)。
最後に、BZDsとアルツハイマー病のリスクについて、12件のプロスペクティブおよびレトロスペクティブなコホート研究とケースコントロール研究のメタアナリシスが報告された。研究チームは、BZDs(主に長効性のもの)とZ-drugsの使用が認知症の発症と関連していると結論づけた。しかし、この研究では、BZDsのアルツハイマー病への影響と血管性認知症への影響を区別しておらず、長時間作用型と短時間作用型のBZDsを区別していなかったため、いくつかの限界が示されていた(Lucchetta, 2018)。
考察
今回のレビューでは、加齢やアルツハイマー病の認知機能低下のリスク因子としてBZDを指摘するエビデンスについて考察した(Paterniti et al 2002;Zhang et al 2016;Picton and Pharm 2018)。
睡眠障害は加齢とともに増加し、アミロイドβを含む脳内の有害物質や老廃物のクリアランスを変化させる(Clinton et al 2011)。睡眠障害は、神経炎症反応の出現による生理代謝機能の変化、酸化ストレスの増加、アミロイドβの蓄積などにより、神経変性やアルツハイマー病に寄与する可能性が報告されている(Phan and Malkani, 2019)(図1)。さらに、不眠症は高血圧、糖尿病、およびより高い肥満リスクとも関連している;それらのすべてがアルツハイマー病に寄与している(Clarke et al 2018; Frozza et al 2018)。このことを念頭に置き、特に高齢者における不眠症診断の増加を考慮すると、このような状況は、睡眠の質を向上させるために、成人集団における催眠薬の消費量の増加につながっている。しかし、それにもかかわらず、また、それらの摂取から派生する可能性のある結果を見て、それらのリスクについての意識を大幅に高める必要がある。実際に、BZD の消費は認知的情動の出現を好んで、アルツハイマー病 患者の死亡数を増加させることを報告するいくつかの研究がある (Imfeld 他 2015; Saarelainen 他 2017; Grande 他 2019)。しかし、すでに評価したように、論争があり、他の研究者は、BDZsにはそのような有害な効果がないと擁護している(Picton and Pharm, 2018)。したがって、BZDが高齢者の不眠症の様々な尺度を改善するとしても、その臨床的価値は議論の余地があり、メラトニンアゴニストは、睡眠障害を管理しようとする場合には、はるかに安全な選択であり得る(Investigations, 2015)。高齢者の不安症の治療には、セロトニン取り込み阻害薬(セルトラリン)などの他の薬剤の投与がより適切である可能性がある(Consensus and Statements, 2014; Investigations, 2015)。
結局、BZDやZ-drugsが認知機能低下やアルツハイマー病のリスクを増加させるメカニズムはまだ解明されていない;ここでは、いくつかの具体的な仮説を論じた。分子生物学のおかげで、GABAのα1サブユニットはBZDが媒介する認知機能低下に重要な役割を果たすことが示されている。したがって、BZD部位での正のアロステリック変調によって誘導されるα1GABAA受容体の高活性化が、前臨床モデルにおいて空間学習や記憶障害に関与していることが報告されている。また、主に海馬で発現しているα5サブユニットの活性化は、BZDによって誘導される記憶欠損状態の一端を説明する可能性がある。したがって、α5GABAを標的とした化合物は認知機能を改善し、アルツハイマー病や他の認知症における治療の可能性があると考えられる(Adrienn et al 2017)。BZDsが認知に影響を与え、おそらく海馬のα5GABAAを介して作用してアルツハイマー病のリスクを増加させ、一方でZ-drugs(α5GABAA非依存性)はより低いリスクをもたらすことが考えられる。さらに、神経炎症過程はそれ自体がアルツハイマー病の危険因子である。脳のミクログリアは神経炎症において顕著な役割を果たしており、プロ炎症性サイトカインの分泌と関連している。同様に、α5GABAA受容体活性は、炎症過程によって増強され、おそらく炎症誘発性記憶障害において重要な事実である(Marczynski, 1998)。さらに、BZDなどの薬物は、タウタンパク質のリン酸化を介して認知機能の低下やアルツハイマー病リスクを増加させる可能性があり、これはまた、脳インスリン受容体のシグナル伝達を阻害する可能性がある(Jovanovic, 2004; Whittington et al 2019)。
これらの記述された効果にもかかわらず、BZDは睡眠を改善することによって間接的にアルツハイマー病の発症に対する保護効果を発揮する可能性があるという仮説が立てられる(睡眠潜時、覚醒回数、睡眠の持続時間と質に対する臨床効果を介して)(Guzmán et al 2018)。このパラダイムでは、BZDsによるGABAA受容体活性の増強は、グルタミン酸の神経伝達を阻害し、それによってアルツハイマー病の発症に対するグルタミン酸の興奮毒性効果から保護しうるとしている(Fastbom et al 1998)。さらに、いくつかの臨床試験では、BZDと認知機能低下やアルツハイマー病のリスクとの間に関連性がないと報告されていることも注目すべき点である。
結論として、向精神薬と認知機能低下との因果関係を確実にするのに十分なデータはない。しかし、高齢者におけるBZDsとZ-drugsに基づく治療戦略は、広く評価され、モニタリングされるべきである(Monzani et al 2015; Yi et al 2018)。利用可能なデータを検討した結果、論争の的となる疑問が残っている:潜在的な認知喪失リスクがあるにもかかわらず、高齢者の睡眠を改善するためにBZDsやZ-drugsを処方することは安全なのか?私たちは、Z-drugsとの極めて慎重な態度を支持する十分なデータがあり、アルツハイマー病の高齢者におけるBZD処方の回避を強く信じている。
