アルツハイマー病 オートファジー障害
関連記事
![]() オートファジー促進因子TFEB(転写因子EB)10の活性方法
オートファジー促進因子TFEB(転写因子EB)10の活性方法
オートファジーの役割
オートファジーとは、細胞に備わっている細胞内の不要なタンパク質を分解する仕組みのひとつ。
・異常なタンパク質を分解して蓄積を防ぐ
・過剰に合成されたタンパク質の分解
・栄養飢餓などによりタンパク質をリサイクルしてアミノ酸を供給
・細胞質内に侵入した病原微生物の排除
など、生体の恒常性維持に関与する。
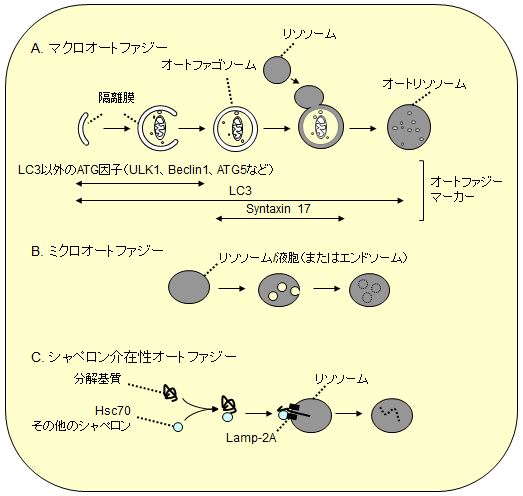
3つのオートファジー
マクロオートファジー
オートファジーとだけ書かれるとき、通常このマクロオートファジーを意味する。
細胞質成分やオルガネラを包んだオートファゴソームがリソソームと融合してオートリソソームを形成し、包んだ内容物を分解する。
マクロオートファジーの標的には、以下の損傷や酸化したオルガネラも含まれる。
- ミトコンドリア(マイトファジー)
- 小胞体(ERphagy)
- ペルオキシソーム(ペキソファジー)
- 脂肪滴(リポファジー)
- フェリチン(フェリチノファジー)
- チモーゲン顆粒(ザイモファジー)
ミクロオートファジー
オートファゴソームを介さず、直接リソソームの膜から細胞質成分を取り込み内部で分解する。
シャペロン介在性オートファジー
シャペロンと分解基質の複合体をリソソーム膜上の受容体(LAMP-2A)が認識してリソソーム内に取り込み分解する。
square.umin.ac.jp/molbiol/proffessional2.html
神経変性疾患におけるオートファジー
アルツハイマー病、筋萎縮性側索硬化症(ALS)、家族性パーキンソン病などの疾患では、オートファジー経路に異常が生じており、疾患の発症機序に多くの影響を与えている。
オートファジーがタウ凝集体、アミロイドβの蓄積と関連して、アルツハイマー病の進行に対する保護因子として機能することは、これまでの研究で実証されてきている。
オートファジーの複雑なネットワーク
オートファジーには基盤的な180のタンパク質候補が関与しており、相互作用により複雑にオートファジーネットワークが築かれていることがわかってきた。
神経変性疾患におけるオートファジー経路への介入としてmTORが第一世代の標的として知られているが、オートファジーの複雑な仕組みが解明されるにしたがってより多くの薬物標的が必要となることが強調されてきている。
オートファジーの診断
オートファジーの臨床的に有用なバイオマーカーはまだ研究されていない。
オートファジー活性はアルツハイマー病進行を促進する?
アルツハイマー病初期のオートファジー
アルツハイマー病におけるオートファジーの役割にはまだ議論の余地がある。
多くの研究が、オートファジーの活性によるアミロイドβおよびアミロイドβ発現の低下を報告している。
アルツハイマー病の初期の段階では、適度に活性化されたオートファジー-リソソーム系は損傷したオルガネラを処理し、ニューロンの生存を促進する。
そのため、アルツハイマー病初期でのオートファジー誘導剤は新しい有効な治療を提供する可能性がある。
対照的にアルツハイマー病後期においてオートファジーを活性化させることは、アミロイドβ産生の加速により疾患の重症度を高める可能性がある。
www.ncbi.nlm.nih.gov/pubmed/15657430/
アルツハイマー病進行後のリソソーム障害
進行性のアルツハイマー病では、疾患の酸化ストレスによる過剰なオートファジーにより、リソソーム分解に障害が生じる可能性がある。
加齢によっても増加するリソソームの分解障害は、アミロイドβの過剰蓄積を引き起こしアポトーシスを誘導する可能性がある。
オートファジー-リソソーム系は、健康なニューロンと病的なニューロンでは異なる役割を果たすことが見出される。
www.ncbi.nlm.nih.gov/pubmed/15528435/
リソソームの抑制
オートファジー制御に基づく治療は、オートファジープロセスの標的化に関して慎重な特定を必要とする。
リソソームの消化能力が抑制されることで、アミロイドβや他の有毒物質のリソソーム内蓄積を防ぎ、細胞の生存を促進する可能性がある。
www.ncbi.nlm.nih.gov/pubmed/22108004/
逆行性輸送の欠陥
アルツハイマー病ではオートファゴリソソームの成熟と逆行性輸送が妨げられる。これは、神経変性ニューロン内にオートファジーの中間体の大量の蓄積をもたらす。
このことはアルツハイマー病におけるオートファジー誘導がアミロイドβのクリアランスに失敗によって蓄積を引き起こす可能性がある。
www.ncbi.nlm.nih.gov/pubmed/18032783/

www.ncbi.nlm.nih.gov/pubmed/28318364
オートファジー促進によるタウオパチー治療
オートファジーを高めることによるタウオパチー治療の可能性。
www.ncbi.nlm.nih.gov/pmc/articles/PMC5382950/
アルツハイマー病オートファジー障害 3つの経路
PI3K/Akt/mTOR経路
PI3K / Akt / mTORシグナル伝達経路は、酸化ストレス、感染、ガンなど特定の条件において活性されるオートファジーの主要な調節因子。
mTORはタンパク質の合成と分解、寿命、細胞骨格の形成の調節に関連しており、成長および生存経路と関連する。 mTORシグナル伝達の異常な増加は、細胞から細胞外空間へのタウ分泌の開始と異常なリン酸化タウのの形成にも寄与する。
多くの研究により、PI3K / Akt / mTOR経路が、アルツハイマー病において加齢に伴う認知機能低下と関連しているという証拠が増えている。
PI3Kは、インスリン様成長因子-1(IGF1)などの成長因子によって活性化され、下流のAktのリン酸化が促進される。リン酸化Aktは、mTORC1を阻害する。
アルツハイマー病病理ではPI3K / Akt / mTOR経路の高活性化と低活性化の両方を含んだ調節不全が関与することが示されている。
www.ncbi.nlm.nih.gov/pmc/articles/PMC4589734/
mTOR複合体1(mTORC1)
mTORC1は、栄養センサーであり細胞の成長と増殖の中心的な制御因子。mTORC1は、ラパマイシン、インスリン、成長因子、ホスファチジン酸、L-ロイシンなどの特定のアミノ酸と誘導体、酸化ストレス、身体運動などの刺激によって調節される。
AMPKはmTORC1を阻害する。
www.ncbi.nlm.nih.gov/pubmed/18439900/
mTOR複合体2(mTORC2)
ラパマイシン非感受性MTOR(ラパマイシンはmTORC2に対して長期間の曝露による特定の細胞がにおいてのみ阻害作用をもつ。)
www.ncbi.nlm.nih.gov/pubmed/16603397/
mTORC2の破壊は、耐糖能の低下およびインスリン感受性低下の糖尿病様症状を引き起こす。
www.ncbi.nlm.nih.gov/pmc/articles/PMC3324089/
アルツハイマー病患者脳(剖検)のmTORC1は、活性されており患者の認知障害の重症度と相関していた。しかしmTORC2では変化していないことが観察された。
www.ncbi.nlm.nih.gov/pubmed/23979023/
mTORC2の刺激はアルツハイマー病におけるインスリン抵抗性の克服に有益であることを提案する。
www.ncbi.nlm.nih.gov/pmc/articles/PMC5577393/

www.ncbi.nlm.nih.gov/pmc/articles/PMC2821969/
シナプス可塑性
mTORは単なるタンパク質合成の翻訳オンオフスイッチとして作用するのではなく、異なる時間帯において間翻訳速度を細かく調節するバルブとして作用している可能性が高いことが示唆される。
mTOR活性によるタンパク質の過剰産生および産生減少の両方が、学習および記憶の障害に寄与しているとみられる。
www.ncbi.nlm.nih.gov/pmc/articles/PMC2821969/
mTORシグナル伝達経路の活性は、アルツハイマー病初期に起こる。
アミロイドβはPI3K-Akt-mTOR軸を過剰活性することが報告されており、これらはMCIおよびアルツハイマー病被験者において見出された。(前臨床期アルツハイマー病では見られなかった)
www.ncbi.nlm.nih.gov/pubmed/25645581/
アミロイドβ
アミロイドβはPI3K/Akt経路の活性化因子であり、その次にmTORを活性化する。アミロイドβは用量依存的にmTOR活性を増加させるが、著しくアミロイドβレベルが増加すると、mTORシグナル伝達を減少させると考えられている。
www.ncbi.nlm.nih.gov/pubmed/15953364
onlinelibrary.wiley.com/doi/full/10.1111/jnc.13037
アミロイドβクリアランス
mTORはオートファジーの負の調節因子であり、mTORシグナル伝達の活動亢進はアルツハイマー病内のアミロイドβクリアランスを減少させる可能性がある。
www.ncbi.nlm.nih.gov/pubmed/18670193
タウ
mTOR阻害剤であるラパマイシンは、タウ、CRMP2などのタンパク質翻訳を抑制することで軸索形成を阻害する。
www.ncbi.nlm.nih.gov/pubmed/19648118
www.ncbi.nlm.nih.gov/pubmed/19210753
ラパマイシン投与によるタウ病理の改善
www.ncbi.nlm.nih.gov/pubmed/20178983
AMPK/Ulk1経路
AMPK/ULK経路は、mTORとは独立して、オートファジーを活性化することのできる主要な調節因子であると報告されている。
www.ncbi.nlm.nih.gov/pubmed/25132405
アデノシン-リン酸活性化プロテインキナーゼ(AMPK)は、細胞代謝によるAMP/ATP比のアップレギュレーションによって活性化される。
活性化されたAMPKは下流のULK1複合体をリン酸化しオートファジーを誘発する。またULK1複合体はmTORC1を抑制することによってもオートファジーを誘導する。
一部の化合物は、AMPK / ULK1依存性オートファジーの活性化を強化することにより、タンパク質凝集体を除去し、ADマウスの認知障害を改善できることが報告されている。
www.nature.com/articles/srep14728

AMPK-ULK1経路は、in vitroでのプリオン感染によって活性化される。
www.ncbi.nlm.nih.gov/pmc/articles/PMC4589734/
Bcl-2/Beclin-1 経路
抗アポトーシス因子
オートファジータンパク質であるベクリン1と抗アポトーシスタンパク質Bcl-2の相互作用によるバランス調節は、オートファジーを制御する重要なメカニズムのひとつ。
ベクリン1は、オートファジー、アポトーシス、エンドサイトーシス、食作用を含むさまざまな細胞プロセスに関与する。
www.ncbi.nlm.nih.gov/pubmed/24729948
アルツハイマー病初期で低下
遺伝学的には、オートファジーの主要な役割を担うBeclin-1の発現レベルが、アルツハイマー病の疾患の初期において低下していることが報告されている。
www.ncbi.nlm.nih.gov/pubmed/18497889/
隔離膜形成
Beclin1(ベクリン1)の欠乏は、ハンチントン病の原因とされるハンチントンの蓄積の増加と関連する。
ベクリン1はオートファゴソームとなる隔離膜の形成に必須のイニシエーター。
ベクリン1の過剰発現はオートファジーを活性化し、神経変性を改善できることが示されている。
www.ncbi.nlm.nih.gov/pubmed/27715386
APPとAPP代謝産物の低下
ベクリン1のノックダウンはAPPとアミロイドβの蓄積を増加させ、過剰発現はエンドリソソームを促進し、細胞APPレベルを低下させた。in vitro
www.ncbi.nlm.nih.gov/pubmed/20937944
アミロイドβクリアランスの回復
ベクリン経路に依存するオートファジー誘導剤を使用したアルツハイマー病マウスモデルでは、アミロイドβクリアランスの促進と記憶回復の改善効果を示した。
www.ncbi.nlm.nih.gov/pubmed/28806762
ミクログリア・神経炎症
ベクリン1発現の阻害は、ミクログリアの炎症反応を増加させる。
www.ncbi.nlm.nih.gov/pubmed/21723251/
慢性LPS誘発炎症は、海馬ベクリン1発現を低下させる。
サルビアノール酸Bは、オートファジーの調節を介してマウスのLPS誘発による行動障害と神経炎症反応の改善を示した。
www.ncbi.nlm.nih.gov/pubmed/29212498/
カンナビノイド受容体2(CB2R)
CB2Rの欠失は、マウス脊髄のベクリン1発現を減少させる。
www.ncbi.nlm.nih.gov/pubmed/25417929/
オートファージー関連因子
ATG7
ATG7はオートファジーを制御する重要な遺伝子
ATG7ノックアウトマウスでは記憶障害を示すことが研究で明らかになっており、記憶機能と関与する。
molecularneurodegeneration.biomedcentral.com/articles/10.1186/1750-1326-7-48
TFEB(転写因子EB)
サイクリン依存性キナーゼ5(CDK5)
Cdk5の詳しいメカニズムはわかっていないが、多数の研究が神経変性疾患におけるCdk5の調節不全との関係を示している。Cdk5の減少により基礎的オートファジーが損なわれ、ニューロンの機能が損なわれる可能性が示されている。
www.ncbi.nlm.nih.gov/pmc/articles/PMC5760206/
CDK5はオートファジー調節キナーゼ。中枢神経系で高い密度で存在する。
www.ncbi.nlm.nih.gov/pubmed/21368891/
アミロイドβ
CDK5はアミロイドβの代謝に影響することがわかっており、APP代謝に重要なBACE1タンパク質の発現および活性を制御している可能性がある。
www.jbc.org/content/287/10/7224
www.spandidos-publications.com/10.3892/mmr.2015.4382
アミロイドβは一次皮質ニューロンのCdk5活性を増加させる。
link.springer.com/article/10.1007%2FBF02686115
アルツハイマー病
Cdk5は、海馬の神経新生やシナプス機能など、さまざまな認知機能と関連する生物学的プロセスを調節する。海馬Cdk5の遺伝子制御(サイレンシング)は、アルツハイマー病マウスの記憶能力を改善した。
www.ncbi.nlm.nih.gov/pubmed/25864429/
CDK5タンパク質の発現はアルツハイマー病患者の前頭皮質では増強されているが、脊髄液中では発現が減少している。
www.ncbi.nlm.nih.gov/pubmed/22223639/
www.ncbi.nlm.nih.gov/pubmed/25428253/
クラステリン(CLU)
オートファゴソーム形成
クラステリンは、ATG8Eとの相互作用によりオートファゴソーム生合成に関与するシャペロンタンパク質。
www.ncbi.nlm.nih.gov/pubmed/25503391/
認知機能・脳細胞への影響
クラステリン遺伝子変異は、海馬の連結性に影響を及ぼす。
www.ncbi.nlm.nih.gov/pubmed/25673992
クラステリンは遺伝子変異は、若年成人の脳領域の白質の完全性の低いプロファイルを示した。
www.ncbi.nlm.nih.gov/pubmed/21543606
クラステリン遺伝子経には、若年成人の皮質灰白質の体積と作業記憶のパフォーマンスに影響を示す。ApoE遺伝子は作業記憶には影響を与えずクラステリンとの相互作用は見られなかった。
www.ncbi.nlm.nih.gov/pubmed/24967550
アルツハイマー病
クラステリンはアルツハイマー病と関連する遺伝子候補(3番めに低いp値)のひとつであり、メタアナリシスはアルツハイマー病の病因におけるクラステリン変異の関与を示した。
www.ncbi.nlm.nih.gov/pubmed/23892938
アミロイドβ
クラステリン mRNAは、アルツハイマー病患者の海馬でアップレギュレーションを示し、アミロイドβの分布に影響を与える。
www.ncbi.nlm.nih.gov/pubmed/27248362/
クラステリンタンパク質は、アルツハイマー病患者の血漿ではなく脊髄液でアップレギュレーションされており、アルツハイマー病の状態およびCSFタウ/アミロイドβ比と有意に関連していた。
www.ncbi.nlm.nih.gov/pubmed/26545630/
クラステリンタンパク質はアミロイドβと相互作用し、その凝集を低減し、その毒性効果から保護する。
www.ncbi.nlm.nih.gov/pubmed/26884339/
タウタンパク質
アルツハイマー病タウ過剰発現マウスモデルではクラステリンタンパク質がアップレギュレートしていることが示された。アルツハイマー病関連クラステリン多型rs11136000は、アルツハイマー病患者の脊髄液中のタウタンパク質のレベルを調節する。
www.ncbi.nlm.nih.gov/pubmed/25051234/
グリア線維性酸性タンパク質(GFAP)
グリア線維性酸性タンパク質(glial fibrillary acidic protein、GFAP)
GFAPは中枢神経系(CNS)のアストロサイトの主要な中間フィラメントタンパク質。
末梢神経系(PNS)の非ミエリン化シュワン細胞、および腸内グリア細胞で唯一見られる中間フィラメント(IF)IIIタンパク質。
GFAP mRNAの発現は、いくつかの核内受容体ホルモン、成長因子、リポ多糖(LPS)によって制御されている。
www.ncbi.nlm.nih.gov/pubmed/25975510/
GFAPの異常な蓄積はオートファジーを誘発する
www.ncbi.nlm.nih.gov/pmc/articles/PMC2902290/
GFAPはLAMP2Aと結合する。
www.ncbi.nlm.nih.gov/pubmed/20797626/
アルツハイマー病患者の高いGFAP
複数の研究により、アルツハイマー病患者の組織においてGFAPレベルの増加が認めらた。
GFAPレベルは、前頭皮質、海馬、脊髄液中で増加する。
www.ncbi.nlm.nih.gov/pubmed/24269023/
www.ncbi.nlm.nih.gov/pubmed/26485083/
GFAP発現は、マウスの視床下部のカンナビノイド受容体1(Cnr1)によって調節される。
www.ncbi.nlm.nih.gov/pubmed/20168044/
カンナビノイド
カンナビノイド受容体2の活性化は、自己免疫性脳脊髄炎マウスミクログリアのオートファジーの活性化およびNLRP3インフラマソームの阻害を介して病因を緩和する。
www.ncbi.nlm.nih.gov/pmc/articles/PMC6492996/
www.biochemsoctrans.org/content/41/6/1583
content.iospress.com/articles/journal-of-alzheimers-disease/jad141635
微小管関連タンパク質タウ(MAPT)
微小管関連タンパク質タウ(MAPT / TAU)
MAPT遺伝子はタウタンパク質をコードする。オートファジーは、tauDeltaC(Asp(421)で以上に切断されたタウ)の分解の主な経路であり、アルツハイマー病患者の脳に見られる。
tauDeltaCはHsp70相互作用タンパク質のC末端にタウよりも効率的に結合する。
www.ncbi.nlm.nih.gov/pubmed/20466727/
HDAC6
オートファジー機能障害は、タウの凝集に重要な役割を果たしており、タウ、おそらくHDAC6活性の阻害を介してオートファジーを制御する可能性がある。
www.ncbi.nlm.nih.gov/pubmed/19074461/
www.ncbi.nlm.nih.gov/pubmed/19457097/
カルパイン阻害
カルパインは、カルシウムにより活性化される細胞内プロテアーゼ。プロテアソームやオートファジーとは異なり,基質タンパク質の限定的切断によって機能や構造を調節・変換する。
ヒトには15のカルパイン遺伝子が存在し、50以上のカルパイン分子種が存在する。
カルパイン1とカルパイン2は、神経機能においては反対の役割を果たしているようであり、シナプス可塑性、神経保護vs神経変性効果の関係を媒介する。
linkinghub.elsevier.com/retrieve/pii/S0166223616000205
カルパインは、アルツハイマー病、パーキンソン病など多くの神経変性疾患では、過剰活性が検出されている。
カルパインは神経変性疾患モデルにおいて、複数の経路によりオートファジーを負に制御することが示されており、増悪因子と位置づけられている。
www.jneurosci.org/content/36/38/9933
カルパインは、オートファジー経路に関与する複数の基質タンパク質の活性を切断し変更する。カルパインはオートファゴソームの形成、基質認識、および貨物の分解に影響を及ぼすことにより、オートファジーを調節する。
カルパインのその特性から一つの薬で多くに作用する魔法の薬となる可能性を秘めていると考えられている。
seikagaku.jbsoc.or.jp/10.14952/SEIKAGAKU.2016.880704/data/index.html
Aspergillus japonicas E-64(エポキシスクシニル)
www.ncbi.nlm.nih.gov/pubmed/15763548
カテプシンD(CTSD)
カテプシンDは、APPタンパク質の分解に関与するリソソームプロテアーゼ。
www.ncbi.nlm.nih.gov/pubmed/27333034/
カテプシンDは、アミロイドβペプチドの処理、アミロイドプラークの除去に関与する。
www.ncbi.nlm.nih.gov/pubmed/8930981/
www.ncbi.nlm.nih.gov/pubmed/24898658/
カテプシンD遺伝子多型(rs17571)は、アルツハイマー病と関連する。しかし対立遺伝子保有患者ではアミロイドβ42レベルに有意な変化は観察されなかった。脊髄液タウレベルは有意に低下させた。
www.ncbi.nlm.nih.gov/pubmed/16652347/
フォークヘッドボックスO1(FOXO1)
FOXO1遺伝子は、ニューロンのオートファジー調節に役割を果たす転写因子をコードする。
www.ncbi.nlm.nih.gov/pubmed/21325132/
FOXO1突然変異rs7981045は、アセチルコリンエステラーゼ阻害剤治療に対するアルツハイマー病患者の反応不良リスクと関連していた。
www.ncbi.nlm.nih.gov/pubmed/25364236/
ユビキリン(UBQLN1)
UBQLN1遺伝子は、ATG8Eとの相互作用により、オートファゴソームとリソソームの融合に関与するユビキチン様タンパク質をコードする。
academic.oup.com/hmg/article/19/16/3219/629479/
UBQ-8I多型UBQLN1はメタアナリシスにおいて、アルツハイマー病リスクの増加と有意に関連していた。
www.ncbi.nlm.nih.gov/pmc/articles/PMC4238758/
www.tandfonline.com/doi/abs/10.3109/00207454.2014.943369?journalCode=ines20
アルツハイマー病患者の海馬では、UBQLN1タンパク質はジストロフィー神経突起に局在し、側頭皮質および前頭皮質では減少している。
ユビキチンC末端加水分解酵素L1(UCHL1)
UCHL1は、ニューロンに豊富に存在するユビキチン特異的ヒドロラーゼ。
ユビキチン鎖を加水分解して、分解の標的となるタンパク質がプロテアソームにアクセスできるようにし、遊離ユビキチンの生成と安定化をもたらす。
science.sciencemag.org/content/347/6220/1260419.long
UCHL1機能の欠陥は、タンパク質のミスフォールディングおよびタンパク質毒性、2型糖尿病における膵臓β細胞の脆弱性に対する初期の寄与因子であることを示している。
またオートファゴソームとリソソームの融合を調節するLAMP2との相互作用により、オートファジーに影響を与える。
www.tandfonline.com/doi/full/10.4161/auto.28478
www.ncbi.nlm.nih.gov/pmc/articles/PMC5087675/
UCHL1はBACE1のリソソーム分解に関与する。
doi.org/10.1111/j.1474-9726.2012.00854.x
IP3受容体(IP3R)
カルシウムイオン(Ca2+)は、細胞の複雑な調整に関わっており、細胞質、小胞体、ミトコンドリア、リソソームの間で、シグナル伝達カスケードを誘発するために循環している。
小胞体の主要なCa2+放出チャネルであるイノシトール1,4,5-三リン酸受容体(IP3R)は、そのCa2+シグナル伝達の制御において重要な役割を果たす。
IP3受容体はCa2+の代謝経路を刺激するだけでなく、アポトーシス感受性を高め、常に稼働している基礎的オートファジーを阻害する。
www.ncbi.nlm.nih.gov/pubmed/28725634

www.ncbi.nlm.nih.gov/pmc/articles/PMC5497685/
ドーパミン受容体D2・D3
ドーパミン受容体サブタイプによってオートファジーを差別的に調節する。
D2、D3はオートファジーの正の調節因子であり、D1、D5は負の調節因子として作用する。
www.ncbi.nlm.nih.gov/pubmed/29786666
アンモニアは、ドーパミン受容体D3およびMTORを介してオートファジーを誘導する。
www.ncbi.nlm.nih.gov/pubmed/27077655
フコキサンチンの濃度依存的D3/D4アゴニスト効果
www.ncbi.nlm.nih.gov/pubmed/31323226