Contents
Autoimmune diseases – New insights into a troublesome field
www.ncbi.nlm.nih.gov/pmc/articles/PMC8188057/
オンラインで2021年6月1日公開
要旨
自己免疫疾患(AD)をより深く理解するためには、慢性炎症疾患の診断と管理における最新の知見を取り入れることが重要である。臓器特異的あるいは臓器限定的で全身性の自己免疫疾患では、医師は診断を下す際にジレンマに陥ることが多く、より明確な病名が見つからないと、一種の恥ずかしさを感じることがある。自己免疫疾患はしばしば他の疾患と重複しており、自己免疫疾患の優れた診断法は、洗練された病理組織学的、免疫病理学的、および一般的な臨床検査の分析が可能になって初めてエビデンスに基づくものとなる。免疫蛍光分析、ウェスタンブロッティング、CUT & RUN技術により、自己抗体反応部位を関連するDNA配列上に特定することができる。ポリメラーゼ連鎖反応技術とCRISPR-Cas9,合成ノンコーディングRNAのプールをスクリーニング実験に使用する新しい遺伝子編集者は、自己免疫疾患の診断の進歩につながることが期待されている。現在、COVID-19に対するワクチンとしてmRNAが使用されていることから、自己免疫疾患sの治療戦略にmRNAや長鎖非コードRNAを使用することへの信頼性が高まっている。自然免疫、補体系、ワクチン学、老化に関する新しい知識をアルツハイマー病患者の治療に取り入れることで、疾患修飾薬の治療手段が拡大し、本来は慢性炎症性疾患用に設計された抗サイトカインモノクローナル/バイオシミラー抗体を自己免疫疾患用に再利用することが可能となる。この総説では、最も関連性の高いアイデアをまとめている。この総説に含まれる症例報告では、自己免疫疾患、慢性炎症、および/または顆粒状疾患を区別することの難しさが強調されている。
キーワード 自然免疫、サイトカイン、補体、モノクローナル抗体、バイオシミラーI
図解
1. はじめに
国際疾病関連健康問題統計分類(ICD)では、自己免疫疾患(AD)が最近発表されたリストの中で重要なグループを形成している。このグループには、単一の病理学的実体を持つ様々な自己免疫疾患が含まれている[1]。
免疫系の脱線は、ほとんど単一の臓器にしか影響を与えない。しかし、そのような場合、対象となる臓器は、組織学的にも機能的にも異なる損傷を受ける。重篤な状況や遺伝的な背景を持つ患者では、最初に標的となった臓器から自己免疫疾患が広がり、非臓器特異的(NOS)になることがある。このような全身性自己免疫疾患への進展は、しばしば慢性炎症や免疫老化が原因となって起こる。免疫老化は、80歳以上の高齢者に自己免疫疾患の発症のピークをもたらす([2,3])。しかし、巨細胞性動脈炎や原発性胆汁性胆管炎などの一部の疾患を除いて、ほとんどの自己免疫疾患は事前に発症のピークを迎える[4]。自然免疫についての理解が深まるにつれ、Toll様受容体(TLR)などのマーカーを持つ細胞や、エンドソームを認識することで、病原体関連分子パターン(PAMPs)や損傷関連分子パターン(DAMPs)が作用するようになってきた。微生物に由来するPAMPは炎症を引き起こし、腫瘍や死滅した細胞、特定の放出細胞(RNAなど)を含む宿主細胞上のDAMPは、低酸素などのさまざまな(自動)シグナルに反応する[5]。
どちらのタイプの受容体も、対応するTLRに結合することで、感染体や損傷した細胞に由来するRNAがプロセスに入ってくると、自己免疫疾患への道が開かれることになる[6]。重複するエフェクター機能は、異なる細胞タイプに異なる機能を与えようとする人々を悩ませる厄介な問題である。最近では、破壊的なFAPa+THY1-クローンとは異なるFAPa+THY1+マーカー陽性の線維芽細胞を用いたマウスの研究により、IMID損傷特性を持つ「クリーンな」細胞サブセットを同定することができた[7]。自己免疫疾患の主な標的としての免疫系はほとんど関係なく、関係する場合は、免疫血液学的障害として現れる。B細胞を介した自己免疫疾患に罹患すると、患者は低悪性度非ホジキンリンパ腫[9]や、関節リウマチ、全身性エリテマトーデス(SLE)クローン病などの免疫関連疾患、低悪性度非ホジキンリンパ腫を含むリンパ腫などを発症するリスクが高まる[10]。
臓器特異性を追求した自己抗体同定技術は、数十年来、自己免疫疾患s診断の最先端の診断ツールであったが、現在、一連の新しいアプローチによって完成されつつある。(i) 蛍光ウェスタンブロッティング、(ii) CUT & RUN技術:リコンビナント・プロテインAとマイクロコッカル・ヌクレアーゼ(pA-MN)の融合アッセイ [11] では、未固定の伝染性細胞を抗体とインキュベートすることで、試験管内試験 ICレベルで実際に明らかになった関連するDNA配列 [12] における自己抗体反応のまさにその部位を調べることができる。また,ポリメラーゼ連鎖反応(PCR)技術やCRISPR-Cas9(新しい遺伝子編集機)[13]も,合成cRNAのプールをスクリーニング実験に用いることで,自己免疫疾患の診断を進化させることができる。このレビューでは、補体系の洗練されたアッセイ[14,15]とそこから導かれる治療法の選択肢についても更新する。
自己免疫疾患sが診断されると、治療が問題となる。初期のアプローチでは、低用量のアルキル化剤および/またはステロイドを使用していたが、本稿執筆時点では驚くべきことに、多くの臨床医は今でもこれらの組み合わせから始めて、後に免疫抑制剤/ラパログ(シロリムス)やモノクローナル抗体/バイオシミラーを含む最新のレジメンに切り替えている。ラボ分析の進歩により、多くのパラメータを含む患者のチャートを描くことができるようになり、そこからサイトカインや補体系のプロファイルをより詳細に調べることができるようになった [16,17]。がん治療に免疫療法を用いるというアイデアは、1957年にがん免疫モニタリングの理論を提唱したThomasとBurnetに由来する。彼らは、リンパ球が自然発生的な突然変異によって変化した体細胞を識別し、排除するためのセンチネルの役割を果たしていることを示唆した。がんに対する免疫療法(CAR-T、PD-1) [18]のアプローチは、自己免疫疾患の治療を刺激し、その逆もまた然りである。Borel/Stähelinがシクロスポリンを発表したとき、臓器移植を可能にする測定された免疫抑制の新しい章が開かれた。実際、ここで蓄積された経験は、現在ラパログで改良されている自己免疫疾患の治療に対するより深い洞察につながった[19]。免疫チェックポイントと呼ばれる新語は、おそらく自己免疫疾患を併用したがん治療を明確にしたいと考えている[20,21]。
ここでの我々の貢献は、自己免疫疾患sアバターを現在の洞察に近づけ、最新のラボ診断ツールを提示することで、前例のない治療の選択肢を開くことである。
2. 自己免疫疾患における自然免疫系の役割
顆粒球、単球、NK細胞、gδ細胞、group 2 lymphoid cells (ILC2s) [22]、樹状細胞、マクロファージを含む免疫系の自然免疫は、自己免疫疾患sの管理においてはあまり注目されていない。NK細胞は、最近、治療手段として利用可能であることが確認された[23]。免疫パフォーマンスのプロファイリングには、自然免疫細胞も含まれるようになった[24]。このように遅れているのは、免疫系のこの部門は適応免疫の特権であり、自己免疫や感染症の攻撃を受けている間は、いかなる適応からも完全に守られているという長年の見解から来ているのかもしれない。ワクチン接種や自己免疫の脱線に対しても、この免疫系の貢献は不活性化されていた。遺伝学的研究は、ゲノミクスと高解像度シングルセル分析を用いて、病気の重症度と転帰を決定する自己免疫疾患のヒント[25]を提供している[[26], [27], [28]]。21世紀の現在の生活様式では、自然免疫が鍛えられ、加齢に伴う慢性炎症の一部となっている可能性があり、DAMPsのリガンドが自己免疫疾患を引き起こすためにオーバーシュートすることが考えられる。したがって、エピジェネティクスは、遺伝的素因の上に立つと自己免疫疾患を引き起こす過剰な反応に責任があるかもしれない。IFN-αなどのサイトカインは、免疫細胞を刺激し、IFN応答遺伝子に依存して、自然免疫と獲得免疫の間の橋渡しをする[29]。
液性側では、補体系とプロテインCのような古いタンパク質が自己免疫疾患に関与している。多タンパク質の集合体であるインランマソームは、適応免疫に必要なインターロイキン(IL)の産生、すなわちIL-1βとIL-18の起源となっている[30]。さらに、古典的経路、代替経路、レクチン経路を経て補体が活性化されると、C3a、C5a、SC5b-9などの生物学的に活性な分子が生成される。補体タンパク質を標的とした自己抗体は、補体の活性化と抑制の間で均衡を保っている。高免疫グロブリンD(HIDS)症候群は、メバロネートキナーゼの欠損を構成的に特徴としており[32]、HIDSが自己炎症性疾患であることを示している。HIDS患者は、発熱、リンパ節腫脹、関節痛、肝脾腫脹、皮疹(レイノー症候群)を繰り返する[33](図1)。
図 1自然免疫と自己免疫疾患
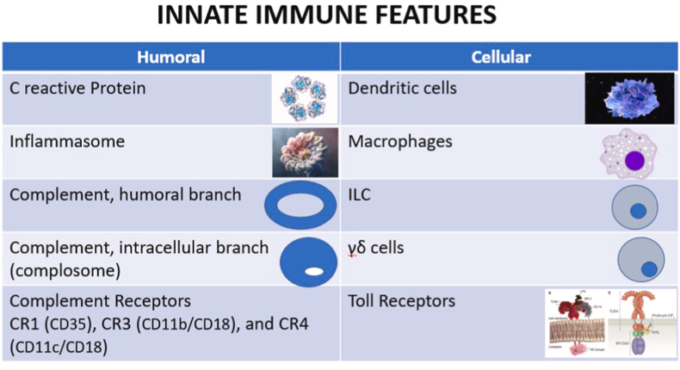
この図は、自己免疫疾患に関与する(可能性のある)主な自然免疫プレーヤーを示している。タンパク質オリゴマーであるインフラマソームは、カスパーゼ-1の活性化を制御する受容体/センサーであり(図示せず)感染性微生物や宿主タンパク質に由来する分子(自己抗原)に反応して炎症を誘発する。慢性炎症性疾患やその他の全身性自己免疫疾患にも関与しているとされる。細胞内のC成分であるコンプソームの役割については、現在、さらに詳しく調べているところである。
3. 自己免疫疾患における獲得免疫の役割
免疫系が自己を攻撃する際の主力となるもの。自己免疫疾患の診断の原点は体液性免疫の狂いであると診断されている。単ドメイン重鎖抗体(sdAbs)は、同一分子内で抗原結合部位の特異性が異なる二重特異性抗体を含む、従来の抗体(Abs)の抗原結合特性の研究を可能にした。ラクダ科動物は、自然に軽鎖を持たないユニークな機能的Absのレパートリーを持っている。90年代初頭に発見されたsdAbsやVHHリガンドは、そのサイズが小さい(12-15kD)ため、従来のIgGでは利用できなかったエピトープに到達することができる。さらに、これらのリガンドは標的に強い親和性で選択的に結合する。現在では、ラクダの重鎖、単一ドメインのAbsを用いて、遠隔地や隠れた抗原のエピトープにアクセスできるようになっている[34]。医薬品の開発や診断の精度向上のために、sdAbsは自己抗体の検出を前例のない精度と情報価値にまで高めるために使用される。ユニークなVHHドメインの作成は、自己反応性sdAbsを包含し続け、自己免疫疾患sの治療と理解のための新しい機会を提供するだろう[35]。
3.1. 自己免疫疾患の診断におけるルーチン検査
病歴、基本的な身体検査、および疾患の臨床像に適合した機器を用いた特別な検査(例えば、CTなど)に加えて、臨床検査室における自己免疫疾患s診断は、臨床免疫学における診断に重要な多くの特別なアッセイから恩恵を受ける。ここでは、間接的な免疫蛍光検査、EIA(酵素免疫測定法)ELISA、イムノブロット(ラインブロット、ドットブロット)などを紹介している。リウマチのスクリーニング・クラシックスの一つに、間接免疫蛍光法によるHep2細胞上の抗核抗体(ANA)の測定がある。これらのANAパターンの顕微鏡評価は、数年前からICAP命名法(パターンAC-0~AC-29,ICAP(International Consensus on Antinuclear Antibody Pattern)www.anapatterns.org)に基づいて行われている。
この命名法では、核の免疫蛍光(例:ICAP AC1,ホモジニアスパターン)だけでなく、Hep2細胞の細胞質の免疫蛍光(例:ICAP AC21 mitochondria-like)も評価していることに注目すべきである(図2)。これは、患者の治療に大きなメリットがある。実際、両方の部分的な評価(核と細胞質)はお互いに補完し合い、特定のACパターンがどのような疾患で発生するかの手がかりとなる。ICAP AC21(ミトコンドリア様)の場合のように、原発性胆汁性胆管炎の可能性を示唆するものがある[36]。
図2自己免疫疾患を検出するためのルーチンの検査戦略
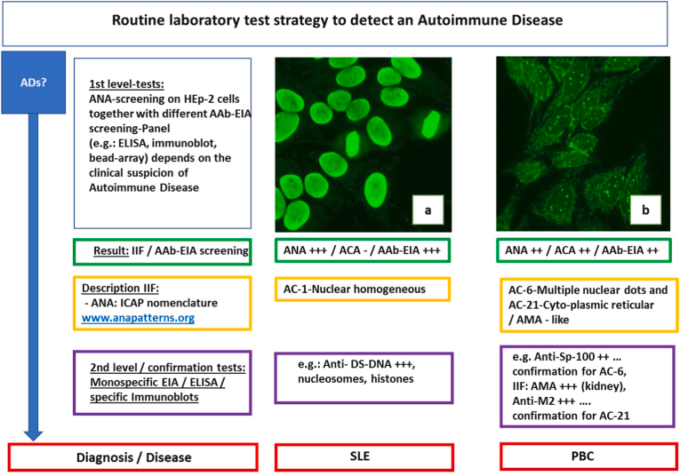
(例)。自己免疫疾患 (Autoimmune disease), IIF (Indirect immunofluorescence), AAb-EIA (Autoantibody-enzym-immuno-assay), ANA (Anti-nuclear antibodies), ACA (anti-cytoplasmic antibodies), AMA (Anti-mitochondrial antibody.). パネルa, b: HEp-2細胞上のANA (Euroimmun, Lübeck, Germany), 画像はリッシュ博士の研究室より, SLE (全身性エリテマトーデス), PBC (原発性胆汁性胆管炎)。
間接免疫蛍光法を用いた抗ミトコンドリア抗体のさらなる確認分析と、M2抗体の特異的EIAにより、自己免疫性肝炎の疑いのある診断を確定することができる[37]。
これらのANA-ICAP ACパターンは、反応性細胞質を伴う異なる力価レベルで頻繁に複合的な混合パターンを示す場合には、検証業務を担当する認定検査室の専門家にとって非常に困難である。
3.2. 非免疫学的検査法への拡張
臨床免疫学部門は、血液学、臨床化学、感染症血清学/微生物学などの古典的なルーチン検査と関連していることが多く[38]、さらに、遺伝子解明HLAタイピングなどの付加的な側面にも依存している。自己免疫疾患の診療所や専門センターでは、さらに、組織学的サンプリングや、キャピラリー顕微鏡検査や機能検査(シルマーテストなど)などの古典的な検査を行っている。
実施されたすべての検査項目の組み合わせにより、臨床医の仮診断が立証され、その結果、適応され最適化された自己免疫療法の基盤が拡大する。
転写因子であるIFN制御因子5(IRF5)は、自然免疫と適応免疫の橋渡しをする中心的なメディエーターである。IRF5がどのようなメカニズムで疾患の発症に寄与しているのかはまだ明らかになっていないが、多くのデータは、IFN-α、IL-6,IL-7,TNF-α、IL-12などの炎症性サイトカインの発現や、病原性自己抗体の産生を制御する役割を担っていることを示している[39]。自由軽鎖カッパ(FLC – K)とラムダ(FLC-K)を個別に評価したり、比率で計算したりすることは、全身性(S自己免疫疾患)と単一臓器性の自己免疫疾患を区別するのに役立つ。そのメンバーは、炎症、適応免疫応答、癌、発生生物学に関わるシグナル伝達経路の制御に不可欠な役割を担っている。このファミリーのオリジナルメンバーであるFKBP12は、細胞周期の生理学的な制御タンパク質であり、免疫抑制剤であるタクロリムス(FK506)やシロリムス(RapamycinR)の結合パートナーとしてよく知られている。
3.3. 免疫複合体
「免疫複合体」という呼称は、様々な文脈で抗原に対する抗体の結合を表すために使用される。多くの場合、臨床医は、血液中に循環しているか、滑液、胸水、膿瘍などの様々な体液中に浮遊している可溶性のICを理解している。これに対して、組織結合型ICは、可溶性ICが組織に付着したり、局所的にICが形成されたりして生じるものである。多くの検査法は、試薬として使用される特異的な抗体によって検出される抗原を定量することに基づいている。最後に、細胞表面マーカーは、標識された抗体によって明らかにされる。
全身性自己免疫疾患であるSLEは、高いレベルの循環抗核自己抗体(ANA)と重度の免疫調節障害を特徴としている[42]。免疫異常は、遺伝的感受性および/または環境的誘因によってもたらされる可能性がある。循環しているSLE-ICsは、しばしば抗原(ウイルス?)のDNAを含んでおり[43]、SLEの特徴である[44]。何十年もの間、臨床医はICを軽視していたが、研究室でのICの投与は可能であり、市販の検査も豊富にある。免疫複合体の検出には、Panel utilizing、Raji cell immune complexおよびC1q binding assayがある。
ICは疾患の活動性や治療スケジュールのモニタリングに重要だ。C成分で装飾されたICは、免疫細胞の一連の受容体に結合し、細胞の活性化を開始する。B細胞の取り込みは、胚中心反応に影響を与え[45]、抗原への曝露を延長・強化する。B細胞濾胞は、濾胞性樹状細胞の細胞質延長の密なネットワークを特徴とし、しばしば免疫複合体の形で抗原を接触させている。
循環する免疫複合体は、通常、Raji細胞免疫複合体とC1q結合アッセイの両方を含むパネルを用いて検索される。過去50年間、SLEの治療薬として承認された新薬は、ヒト腫瘍壊死因子α(TNF-α)に特異的なヒトIgG1κモノクローナル抗体であるゴリムマブのように、わずかしかない。自己免疫疾患は、ウイルス(SARS-CoV-2)[46]や細菌(Campylobacter jejuniなど)に感染することで発症すると考えられており、分子模倣が示唆されている[47]。新しい標的の1つは,転写因子のIRFファミリーのメンバーであるIFN制御因子5(IRF5)かもしれない。その後の研究で、IRF5が自然免疫と適応免疫、マクロファージの分極、細胞成長の調節、アポトーシスにおいて重要な役割を果たしていることが明らかになった[39]。現在、IRF5は、自己免疫疾患感受性遺伝子として同定されている。IRF5の多型は、炎症性腸疾患、原発性胆汁性肝硬変、関節リウマチ、SLE、全身性硬化症など、実際に自己免疫疾患や炎症性疾患と関連している[39]。
3.4. コホートにおけるリスク評価
より深い洞察を得るために、病気のリスクを分析するために、言い換えれば、健康や長寿を、年代を指標にするよりも正確に予測するために、現在、一連の生物学的現象が提唱されている。これらの現象には、DNAメチル化パターン[48]、[49]、[50]、炎症[51]、遺伝子発現コンステレーション[52]、フレイル指標[53]、血清タンパク質レベル[54]、IgGグリコシル化[55]などがある。免疫病理学的な損傷に対する防御として、これらの特徴は、自己免疫疾患sの発症に対する自然の抵抗と見なすことができるかもしれない[56]。
老化は、慢性的な炎症状態(「炎症老化」)と関連しており、その後、自己免疫疾患sを発症する可能性が高くなる。環境因子による免疫細胞を含む非分裂細胞および分裂細胞のエピジェネティックな変化が、加齢疾患に見られる炎症と自己免疫の両方に関与している可能性がある。サイクリックGMP-AMP合成酵素はDNAセンサーであり、小胞体に移動してインターフェロン遺伝子の刺激因子として作用する[57]。このような経路が、高齢者を襲う自己免疫疾患に干渉していることを疑う人はほとんどいないだろう。
4. 健康と病気の間を決める微生物の衝突
61歳の男性のCOVID19によるホジキンリンパ腫の寛解は、ニュースを揺るがした[58]。リンパ増殖性疾患、自己免疫疾患、ウイルス性疾患の三角形の中で、人間の免疫病理を支配する相互関係が明らかになった。この患者では、SARS-CoV-2ウイルスが抗腫瘍免疫反応を引き起こしたと思われる。
ベルン大学では、CRISPRスクリーニングを用いて、コロナウイルス感染症を治療できる、臨床的に承認された免疫抑制剤を特定した。フォルカー・ティールを中心とするチームは、いくつかのオートファジー関連遺伝子が、パンデミック中のSARS-CoV-2ウイルスと新興のSARS-CoV-2ウイルスの両方を複製するために必要な共通の宿主防御因子であることを発見した。研究チームは、臨床承認されている医薬品であるシクロスポリンAとアリスポリビルを用いてイミュノフィリンを阻害することで、初代ヒト鼻腔上皮細胞におけるSARS-CoV-2ウイルスの複製を用量依存的に減少させることができると結論づけた[59]。CRISPRは、T細胞に影響を与えることで自己免疫疾患を治療するための切り口となる。Tヘルパー2型(Th2)細胞の活性化から分化までを支配する制御回路を解剖することができるかもしれない。実際、CRISPRを用いた新しいアプローチは、遺伝子を直接編集するのではなく、ハサミを使って遺伝子が発現しないようにする、遺伝子サイレンシング療法である[61]。
このアプローチは、重いCOVID-19で働いている「サイトカイン・ストーム」の背後にあるゲノミクスを黙らせるために使われるようになるかもしれない;自己免疫疾患に関心のある人々は、COVID-19が自己免疫疾患に似ていることを認識した[62,63]) [64].
5. 自己免疫疾患sにおける補体系の役割
補体系(図3)は、防御に不可欠なメンバーであり、標的をオプソニン化して溶解し、宿主の完全性を維持するが、反対にその活動が宿主に向くこともある。
図3
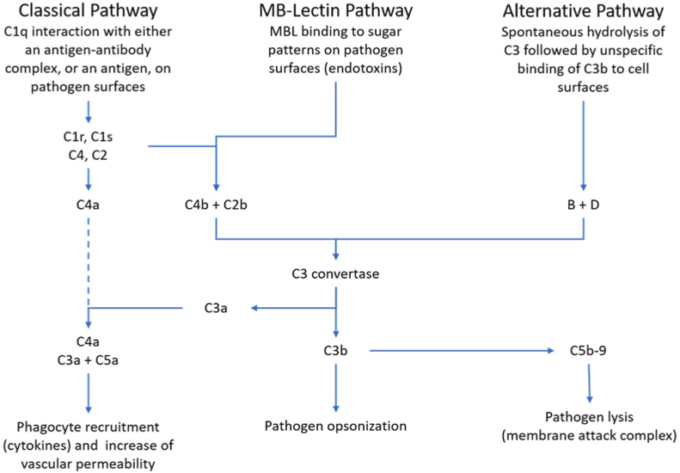
補体系は、自己免疫疾患における免疫病理学的事象を構成するネットワークの一部である。アナフィラトキシン、C3a、C5aおよびSC5b-9複合体を産生するCの活性化は、サイトカイン産生細胞を活性化するため、サイトカインストームの少なくとも部分的な原因となることは明らかである。
Cを臨床治療に取り入れる突破口となったのは、溶血性尿毒症症候群(HUS)患者のほとんどの治療に血漿交換を必要としなくなったmAb薬剤、エクリズマブである([65]。このC5に対するmAbは、当初、発作性夜間ヘモグロビン尿症(PNH)の治療に有用であることが判明し、ペグ化ペプチドによるC3の標的化など、新しいアプローチへの視線が続いていた[66]。これまで難解とされてきたCシステムに対する臨床医の関心が高まった。現在、ANCA陽性の血管炎患者を治療するためのC5a受容体阻害剤であるアボカパン[67]や、寒冷凝集素病(C自己免疫疾患)を治療するためのC1を標的としたヒト化mAbであるスチムリマブ[68]が話題になっているが、この研究では、古典的なC経路の活性が阻害され、CH50も低下した。この研究では、古典的なC経路の活性が阻害され、CH50も低下した。スチムリマブは、時折自己免疫疾患を阻害することで知られるC1qのレベルには触れなかった。AIHAの持続的な寛解を得るために、ベンダムスチンとリツキシマブの4サイクルを提案する著者もいる[69]。
もちろん、まれなC成分の欠乏症は、精製された成分で治療される(例:血管神経性浮腫におけるC1INH[65])。眼科医にとって、Cシステムは変性後視力疾患の評価において重要なツールとなっている[8]。Cに関する深い知識は,Cを抑制するだけでなく,自己免疫疾患を治療するための新しい治療アプローチのアイデア・制作をもたらした[70]。SARS-CoV-2感染におけるCシステムの重要性は、最近、体液中のSC5b-9レベルの上昇をもたらす3p21.31遺伝子座のch3クラスターrs 11385942変異体の発見によって強調されている[71]。この記事を書いている時点で、Frontiers in Immunologyの特集号で、COVID-19や自己免疫疾患におけるCとその役割に焦点を当てた特集が組まれている[72]。
6. ワクチンとアジュバントの役割
6.1. 疾病予防から治療への移行
COVID -19を予防するために、RNAにコード化された抗原情報を全身に届けるために最適化されたmRNAワクチンのリポソーム製剤(mRNA-LPX)(図4)が脚光を浴びている。
図4
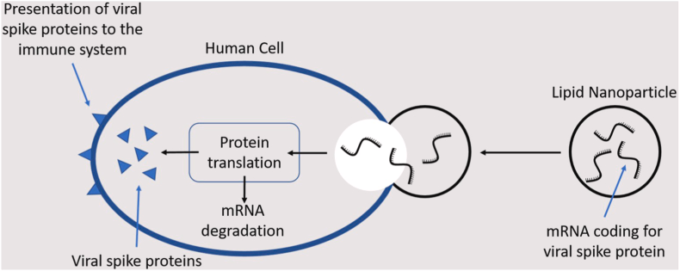
このスケッチは、リポソームに埋め込まれたmRNAをベースにした強力なワクチンが、迅速かつ効率的に機能することを示している。このようなアプローチは、多発性硬化症のマウスモデルを用いて予想されたように、自己免疫疾患sにおいて有望である[73]。樹状細胞(図1も参照)は、Tヘルパー細胞によって認識される抗原提示細胞である。この図は、lnc_mRNAの自己免疫疾患s治療への応用を示唆している。
動物モデルの少なさにもかかわらず、mRNAワクチンは、自己免疫疾患を含むより広い応用分野へと変化していくであろう[74]。いずれのmRNAワクチンも、自己免疫疾患を誘発するかどうかはまだ疑わしい。COVID-19の病態生理に関する日々の知識の蓄積は、同様にサイトカインの不均衡を特徴とする自己免疫疾患の分野にも波及している[75]。次世代シーケンサーは、トランスクリプトームの画像を提供し、自己免疫疾患や癌の治療に期待されている長鎖非コードRNA(lncRNA)の役割を特定した。CH3-シュードウリジンを含むmRNAワクチンのリポソーム製剤は、抗原特異的寛容性を誘導し、マウスでは、そのようなmRNAが実験的自己免疫性脳脊髄炎を予防したり[73]、病気の進行を抑えたりすることができる。
6.2. 不都合な影響
イスラエルの免疫学者がワクチンのアジュバントが自己免疫疾患を誘発すると仮定したとき、多くのクリニックが診断(Shoenfeld-Syndrome)を追求した [77]。それにもかかわらず、これらのワクチンが使用中止になったものはなかった。
治療用抗体は、がん、自己免疫疾患、炎症性疾患の治療に応用され、今なお成長を続けている。我々の見解では、ポリクローナル・ポリシフィックIgGによる自己免疫疾患治療の始まりは、1980年代初頭にさかのぼる[78]。
エミール・フォン・ベーリングが、我々の種に含まれるある化合物が、感染症に襲われた後も活性を維持し、同じ捕食者によるその後の侵入から我々を守ることに気付いたとき、彼はこの発見がどんな結果をもたらすのかをほとんど理解していなかった。バランスのとれた抗イディオタイプネットワークの発見は、大部分が「IVIGはどのように機能するのか」という質問に対する答えとしてもたらされた。[79]. IVIGは、免疫不全の患者の代わりになるだけでなく、自己免疫疾患で機能していない制御ネットワークを調節する[78]。自然界で抗体が果たす役割は、”anti – “という接頭辞の意味を超えている。これらのタンパク質には、調節能力が備わっている。免疫グロブリン療法は、その結果の一つに過ぎない。しかし、我々は現在、T細胞活性の負のレギュレーターであるPD 1をダウンレギュレートすることができるチェックポイント阻害剤(PD 1阻害剤)の黎明期にある。
ワクチンや内在的な手段、すなわち抗PD-1抗体を用いることで、腫瘍細胞に対するT細胞の活性を高めることができるようになった。抗PD1抗体のクローンの中には、試験管内試験でPD1の機能を刺激するものもあれば、阻害するものもある[80]。ヒト化マウスモデルでは、Ig遺伝子セグメントがde novo V(D)J組み換えを起こして抗体クローンを生成している様子を見ることができたが、背景にあるドライバーとしての体細胞超変異は除外されていない。このようなチェックポイント抗体療法は、がん治療にとどまらず、自己免疫疾患に苦しむ患者を救う手段にもなると考えている。診断ツールは、自己抗体の結合能力を特定する可能性を更新しつつある。放射性同位元素で標識された結合パートナー、例えば細胞に基づくアプローチは、分子イメージングの扉を開いた[81]。電子線トモグラフィーはその流れを汲んでいるが、これらの技術は非常に高感度であるため、健康や病気とは何かについて疑問を投げかけている。新薬の開発には、最近開発された「DeepBAR」(Bennett acceptance ratio method)と呼ばれる方法が有望であると思われる[82]。これは、抗体の受容体/リガンド領域とそのエピトープを調べることができるからである。
この手順は、バイオシミラーなどのドラッグデザインで使用される標準的な結合自由エネルギーの計算に役立つかもしれない[83]。
mAb技術が動物実験からヒトの治療へと進み[84]、それに伴って複数の特異性がプールされるようになった[85]ことで、自己免疫疾患を抗体で治療するアプローチが勢いを増し、エピトープを非抗体で覆うという研究者の幻想が高まっている。 抗体ではない標的分子と同等の親和性を持つアフィマーと呼ばれる小さなタンパク質は、現在の抗体ベースの検出システムよりも優れている。特に、アフィマーは、その発現を抑制するために使用される抗イディオタイプ抗体を誘発しないからである[86]。アフィマー試薬は,治療用の抗体イディオタイプに選択的に結合するため,米国の規制当局の基準を満たす検量線を得ることができる。また,ダイナミックレンジは,市販の試薬と比べても遜色ないものであった。したがって、アフィマータンパク質は、選択と製造が容易な有望な抗イディオタイプ試薬といえる。また,アフィマー蛋白質は,薬物動態学的測定に必要な感度,特異性,一貫性を備えている[87]。
治療用抗体と結合する抗イディオタイプアフィマータンパク質は、従来の抗体に代わるアフィニティ試薬として導入されている。DeepBARは、化学と機械学習を組み合わせて、薬物分子のタンパク質への結合親和性を設計するための計算を高速化する(下記参照)。血清中のこれらのバイオ治療薬の薬物動態解析のためのノンブリッジングELISAアッセイを開発した。ACE2,TMPRSS2プロテアーゼは、SARS-CoV-2の感染力を促進し、炎症性サイトカインであるIL-6,G-脳脊髄液はCOVID-19の重症度を悪化させる。最近では、MEK阻害剤(MEKi)であるVS-6766,トラメチニブ、セルメチニブが、ヒト細胞におけるACE2の発現を低下させ、サイトカインネットワークの破壊的な活動を抑制することが示された[23]。MEK阻害剤は、炎症性サイトカインを抑制すると同時に、NK細胞が病気の進行状況を把握するのを助ける[23]。
シクロホスファミド(続いてアザチオプリン)またはリツキシマブとステロイドを用いた治療法は、過去数十年間、ほとんどの自己免疫疾患に対して標準的なアプローチとなっていた。しかし、mAbやバイオシミラーの登場により、その状況は一変した。免疫病理をより深く理解することができるのは、治療の側面から、また、特定の(最初は実験的な)レジメンに反応する疾患からである。
7. 症例報告
この診断は、炎症性疾患と自己免疫疾患sの境界線上にあり、免疫複合体が存在するかしないかに関わらず [90,91]、肺、眼、関節が侵されている。2012年6月、プレドニゾンを含む点眼薬で治療した前部ぶどう膜炎から始まった。2014,反対(右)の点眼療法で2015年8月再発にぶどう膜炎が治った。2015,患者は10kg減量し、乾いた咳と胸部の痛みを発症した。一過性とはいえ1ヶ月間の右頬の耳下腺炎が2015年に沿って臨床像を完成させた。2016年1月:左目のかすみ目、網膜血管炎を伴う両側汎発性ぶどう膜炎(図5,図6)。
図5

フローチャート II型サルコイドーシスと診断された症例の報告で、7年間の経過。実際の自己免疫疾患sの治療法を非自己免疫疾患sに導入していることに注意してほしい。
図6 図5の症例報告の図解

(A)では視神経乳頭の上に網膜肉芽腫がある。(Heidelberg Retinal Tomography). (B)レイノー現象(右手)。C)はサルコイドーシスのリンパ節と肺の参加を示す胸部CTカット。
肺を含めたCT検査でサルコイドーシスの実質的な証拠を発見:ステロイド療法を開始し、60mg/日を徐々に5mg/日に減らす。2016年8月:網膜血管炎の再発により、メトトレキサート(MTX)15mg/d、後に20mg/dの投与が必須-優れた反応->プレドニゾンを中止。2019年3月:多発性関節炎当初はエタネルセプトで無駄に治療していたが、アダリムマブ(ヒュミラ™)に変更、自力で効率を落として2020年9月にMTX継続を理由にインフリキシマブ(レミケード™)に変更、アダリムマブを中止。なお、主に自己免疫疾患の治療のために開発されたキメラ型mAbであるインフリキシマブは、患者の健康を改善し始めた。再発した前眼部ぶどう膜炎(左眼)はグルココルチコイド外用薬に反応したが、右眼で再発し、網膜にまで及んでいる。発症から4年後、プレドニゾン5mg/日では効果が不十分だったため、MTXを最初は20mg/日、後に15mg/日で追加したところ、初期に良好な効果が得られた。ステロイド誘発性白内障は 2016年12月に左眼が 2017年10月に右眼が透明なレンズに置換された。2019年3月に多発性動脈炎が発症し、最初は足首関節、膝に発症したが、滑液は500細胞/ml、クリスタール検索は陰性であった。かなり早い段階で、手、右肘、両膝が痛くなり、左脛骨神経と右正中神経が神経障害を起こした。また、一過性の帯状疱疹のエピソードがあり、眼にも影響があった。また、一過性の帯状疱疹が発生し、眼球にも影響を及ぼした。この症状は時折、疲労症候群に覆われる。Raynaud現象が見られたが、毛細血管造影検査では微小血管障害は見られなかった。300mgのインフリキシマブiv(レミケード™ x4/週)の下では、このサルコイドーシスの主観的な感覚は、この記事を書いている時点で行ったり来たりしている。エタネルセプト、ヒュミラ(アダリムマブ)インフリキシマブに関わるそれぞれの薬を図5に示する。
このケースは、当初想定されていなかった病気に薬を再利用する例として挙げられる。このケースでは、もともと関節リウマチの治療薬として開発されたインフリキシマブが、サルコイドーシスの治療薬として処方された。免疫系疾患は、家族単位でまとまって発症することがある。サルコイドーシス患者の集団では、シェーグレン症候群、SLE、自己免疫性肝炎、強直性脊椎炎、多発性硬化症(MS)セリアック病、自己免疫性甲状腺疾患、潰瘍性大腸炎の相対リスク推定値が2.1から 11.6の間で大きく変動することがある。まだサルコイドーシス患者の親族では、サルコイドーシス、多発性硬化症、セリアック病、1型糖尿病、バセドウ病、関節リウマチ、クローン病、潰瘍性大腸炎の相対リスク推定値は1.3から5.8の間で変化している[88]。
最後に、自己免疫疾患sという用語は、自己反応性細胞の存在を共有する大規模な病名グループを表すものであることを述べなければならない。現在の診断ツールと(実験的および/または再利用された)治療への反応は、ここで説明したようなより深い洞察を提供してくれる。
症例報告の公表にあたっては、図版を含めてインフォームド・コンセントを得ている。患者のプライバシー権を尊重している。
