Association Between Obstructive Sleep Apnea, Its Treatment, and Alzheimer’s Disease: Systematic Mini-Review
www.ncbi.nlm.nih.gov/pmc/articles/PMC7815938/
オンラインで公開 2021年1月6日
概要
閉塞性睡眠時無呼吸症候群(OSA)とアルツハイマー病は、高齢者に多く見られる疾患である。閉塞性睡眠時無呼吸症候群は、脳脊髄液中のβアミロイド、T-tauおよび/またはP-tauタンパク質レベルに著しい変化をもたらし、しばしばアルツハイマー病発症の危険因子とされる。アルツハイマー病の根本的なメカニズムはまだ完全には解明されていないが、OSAとアルツハイマー病を関連付ける仮説がすでに提唱されている。このシステマティック・ミニレビューでは、まず、OSAとアルツハイマー病のリスク上昇との関連を支持する最近の知見について述べ、次に、OSA治療がアルツハイマー病のリスク低下に好影響を与えることを示唆する証拠を示す。
キーワード
閉塞性睡眠時無呼吸症候群(OSA)アルツハイマー病、睡眠障害・睡眠時呼吸障害、持続的陽圧呼吸、OSA治療、脳脊髄液-脳脊髄液
はじめに
アルツハイマー病と睡眠障害は、ともに世界の健康に大きな影響を与えることが知られている。不眠症、閉塞性睡眠時無呼吸症候群(OSA)ナルコレプシーなどの睡眠障害は、個人の睡眠パターンの変化を引き起こし、ひいては個人の生活の質や健康に強い影響を与える。OSAは、ほぼ50%の個人に影響を与え、呼吸関連睡眠障害の最も一般的な形態と考えられており、有病率は約85%である(Benjafield er al)。 中枢性睡眠時無呼吸症候群や複雑型/混合型睡眠時無呼吸症候群などの他のタイプの呼吸関連睡眠障害は、はるかに少ないため(Morgenthaler et al 2006年)本レビューには含まれていない。OSAは、気道の完全または部分的な閉塞/崩壊の反復的なエピソードを特徴とすることを読者に伝えたい。したがって、OSA患者の大半は解剖学的な異常を抱えており、それが上気道拡張筋の機能障害や、呼吸のコントロールや肺活量の不安定さの原因となっているのが普通である。しかし、気道の開存性を維持する咽頭拡張筋と閉塞は、筋肉が弛緩した睡眠中にのみ発生する(White, 2005)。中等度のOSAは少なくとも成人の15人に1人が罹患しているのに対し、軽度のOSAは成人の5人に1人が罹患していることが観察されている(Young et al 2002)。それにもかかわらず、一般市民や医療関係者の認識不足のために、OSA患者の約90%はまだ診断されていない(Young et al 1997)。同様に、最近の前向き観察研究では、対象者の約81%がOSAと診断されていないと結論づけられている(Finkel er al 2009)。閉塞性睡眠時無呼吸症候群は、日中の傾眠、メタボリックシンドローム、心血管疾患、高血圧、その他の慢性的な問題だけでなく、特に注意力、記憶力、実行機能などの認知機能の低下にも関連している(Nair er al)。
アルツハイマー病は、不可逆的かつ進行性の脳疾患であり、認知能力を低下させ、最も単純な作業を遂行する能力に悪影響を及ぼし、その結果、日々の生活機能に支障をきたす(Kuo et al 2020)。アルツハイマー病は、認知症の中でも最も一般的なタイプであり、認知症の60%以上を占めている(Kalaria er al)。 アルツハイマー病の根本的なメカニズムや原因はまだ完全には解明されていないが、研究者の間では、脳内に蓄積された細胞外のβアミロイドの蓄積(プラーク)と神経原線維(タウ)内のもつれが、アルツハイマー病の特徴であるという意見が一般的である(Querfurth and LaFerla, 2010)。このアミロイド斑はOSAの人にも見られ、OSAとアルツハイマー病発症リスクの上昇との間に関連性がある可能性を裏付けている(Bubu er al)。 本研究の目的は、(i)このOSAとアルツハイマー病の関連性を評価すること、(ii)OSAとアルツハイマー病の影響を受けやすい集団を特定すること、(iii)OSAの治療がアルツハイマー病の進行に影響を与える可能性を見出すことである。
手順
全世界で発行されている生物医学雑誌の大半を占めるPubMed、Cochrane Library、Google Scholarを介した主要電子データベースを用いて、本テーマに関する英語文献のシステマティックレビューを行った。文献検索は2020年2月に実施し,以下のキーワードの組み合わせを用いた。医療主題見出し語(MeSH)として “Alzheimer’s disease”、または “Alzheimer’s dementia”、または “Alzheimer”(MeSH)または “アルツハイマー病 “と、”Obstructive Sleep Apnea”(MeSH)または “OSA”。そして、キーワードを満たす論文をレビューし、また、これらの検索された論文の参考文献を追跡することで、関連する研究を特定した。除外基準は以下の通りである。(a)動物実験、(b)症例報告、(c)ミニレビュー、システマティックレビュー、メタアナリシス、ケーススタディを含むレビュー、(d)OSA以外の研究、すなわち間欠性低酸素症、睡眠フラグメンテーション、中枢性睡眠時無呼吸症候群、混合型睡眠時無呼吸症候群に焦点を当てた研究。e)非アルツハイマー病研究、すなわち、軽度認知障害(MCI)または血管性認知症やレビー小体型認知症などの他のタイプの認知症患者のみに焦点を当てた研究(f)重複または非英語の資料。除外基準に加えて、対象としたトピックの最新の研究のみに検索を限定した。
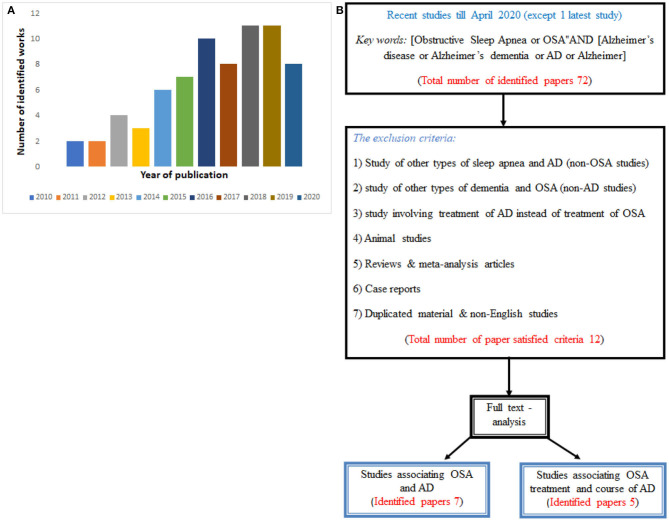
まず 2010年から 2020年の間に発表された72件の関連論文を特定した(図1A参照)。そして、除外基準と包含基準の両方を適用した結果、検索基準を満たした論文は合計で12件しかなかった。そのうち、OSAとアルツハイマー病の関連性を論じた論文はわずか7件で、OSAやアルツハイマー病の影響を受けやすい集団を見つけるために利用できる可能性があった。また、OSAの治療がアルツハイマー病の経過に影響を与える可能性があるかどうかを評価するために、5つの論文が使用された。選択戦略を含めた研究検索のフローチャートを図1Bに示す。
図1 A)今回のレビューで使用した発表年ごとの論文数のヒストグラム、(B)要求された基準を満たす論文で手順を示したフローチャート図
結果
まず、OSAとアルツハイマー病の関係を調べた研究を評価し、その後、OSAとアルツハイマー病の両方の影響を受けやすいと思われる集団を特定した。考慮した研究の主な結果を、読者の便宜のために表1にまとめた。OSAが脳脊髄液(脳脊髄液)のβアミロイド、特にアミロイドβ40およびアミロイドβ42,T-tauおよび/またはP-tauタンパク質レベルの変化を引き起こす可能性があることは、すでにいくつかの研究で明らかにされている(Bubu et al 2020,Kuo et al 2020)。間欠的な低酸素と睡眠の断片化、つまりOSAに共通するプロセスは、神経変性の変化を引き起こす基本的なプロセスであると考えられている。OSA患者の間欠的な低酸素と睡眠の断片化は、脳の構造に大きな影響を与え、βアミロイドの代謝に問題を起こす可能性がある。重度のOSA患者は、中等度のOSAの有無にかかわらず、βアミロイドアイソフォーム40(アミロイドβ40)の血漿濃度が有意に高い(Przybylska-Kuć et al 2019)。これらの血漿濃度は、低酸素症の重症度と関連している可能性があり、その結果、アルツハイマー病の発症リスクの増加も示していると考えられる。
表1 OSAがアルツハイマー病のリスク上昇と関連するという仮説を評価するために使用した研究
| 参考文献 | サンプル/性別 | 年齢 | 主な結果 |
|---|---|---|---|
| Liguori etal。(2017) | 25 OSA + / 17M 8F 10 CPAP OSA / 17M 8F 15 OSA– / 9M 6F |
67.96±7.92 66.6±7.1 66.33±8.92 |
OSA患者のβ-アミロイドレベルが低く、CSF乳酸レベルが高く、T-タウ対β-アミロイド比 |
| Bubu etal。(2019) | 516正常認知/ 263M253F798 軽度認知障害/ 479M319F 325 AD / 206M 119F |
72.3±7.1(OSA +) 73.9±7.3(OSA–) |
正常および軽度の認知障害=>(OSA +対OSA–)florbetapir-その吸収のより速い増加; β-アミロイドレベルの低下、T-タウおよびP-タウ ADの増加=>(OSA +対OSA–)影響なし |
| エリアス他 (2018) | 42 OSA / 42M 0F77 非OSA / 77M 0F |
67.7±5.4(OSA) 68.3±3.9(非OSA) |
OSA =>より高いF-Florbetaben; β-アミロイド沈着とタウ保持の増加を伴うOSAを支持する証拠はありません(BMIおよびAPOEε4中程度のβ-アミロイド沈着) |
| Liguori etal。(2019) | 20 OSA + /指定 なし15OSA– /指定なし20AD / 指定なし |
58.8±3.5(OSA +) 63.8±8.5(OSA–) 66.3±4.2(AD) |
OSA + =>最高のCSFオレキシンレベルOSA – =>最低のCSFオレキシンレベルと最高のβ-アミロイドレベル AD =>最低のβ-アミロイドレベル |
| Przybylska-Kućetal。(2019)* | 43 OSA ++ / 37M 6F 38 OSA + / 31M 7F 31 OSA– / 17M 14F |
54.4±10.4(OSA ++) 52.2±10.1(OSA +) 46.1±14.1(OSA–) |
OSA ++ =>最高のβ-アミロイド40レベル OSA + => OSAよりも高いβ-アミロイド40レベル –β-アミロイド42レベルの違いなし |
| Kong etal。(2020) | 35 OSAHS / 30M 5F 16 OSA– / 14M 2F |
39.18± 9.242.43±9.8 |
OSAHS =>Aβ 40、T-tauおよびP-タウのレベルが有意に高いOSA-のよりも |
| オーウェン等。(2020) | 34 OSA / 16M 18F | 66.7±9.7(M) 67.0±12.5(F) |
増加したβ-アミロイド負荷とのOSA重症度の関連 年齢はOSA重症度ではなくタウタンパク質の最も強力な予測因子 |
OSA 閉塞性睡眠時無呼吸症候群、OSAHS 閉塞性睡眠時無呼吸-低呼吸症候群、アルツハイマー病 アルツハイマー病、M 男性、F 女性、OSA+ は Apnea Hypopnea Index AHI ≥ 15,OSA- (“対照”) AHI ≤ 15,脳脊髄液 脳脊髄液、*) OSA++ AHI >30,OSA+ AHI (5-30)、OSA- <5; T-tau total tau; and P-tau phosphorylated-tau.
一般に、OSA患者の血圧の変化やそれに伴う高血圧には、間欠的な低酸素が関与していると考えられている(Bubu et al 2020)。また、通常、酸化ストレスを増加させ、脳脊髄液およびT-tauタンパク質レベルを変化させる原因は低酸素であることが示唆されており、すなわち、アルツハイマー病患者のアミロイドβ42濃度を低下させ、脳脊髄液乳酸レベルおよびアミロイドβ42/T-tau比を増加させることが示唆されている(Liguori et al 2017)。重要なことは、最近の縦断的研究の知見(Bubu et al 2019,Kong et al 2020)によると、低酸素は、脳脊髄液のT-tauおよびP-tauレベルを高くすることに加えて、β-アミロイド沈着の増加を加速する可能性がある。
脳脊髄液のβアミロイド動態に関連する短波睡眠とレム睡眠は、睡眠の断片化に強く影響される(Bubu er al 2020)。それらは、代謝や神経毒性のあるβアミロイドの除去に問題を起こし、その結果、記憶などの本人の認知機能が損なわれたり、アルツハイマー病の神経病理学的変化の初期兆候を誘発したりする可能性がある(Liguori et al 2017)。また、βアミロイドの沈着は、アポリポタンパクE ε4(APOE ε4)と体格指数(BMI)によって緩和されることが示唆されており、つまり、OSAの人は、OSAでない人に比べて、APOE ε4キャリアが多く、BMIが高いということである(Elias er al)。
一部の研究者は、OSAがアルツハイマー病の神経病理学的プロセスの初期の引き金になると考えている(Gagnon et al 2014)。この仮説を支持する証拠が、最近、(Liguori et al 2019)によって提示された。彼らの研究では、OSA患者の睡眠パターンに伴う脳脊髄液オレキシンレベルとβアミロイドの関連が観察された。
OSAの治療がアルツハイマー病のプロセスを修正する可能性があるかどうかを評価するために確認された最新の研究を表2に示す。先に述べたように、OSAはアルツハイマー病発症の危険因子として同定されており、したがって、手術や持続的気道陽圧(CPAP)などによるOSAの治療がアルツハイマー病発症のリスクを低減するのに役立つ可能性が示唆されている。アルツハイマー病を発症したOSA患者に対するCPAP治療の好影響は、Owen et al 2018)によって観察されている。彼らは、CPAP治療がアルツハイマー病の神経病理を穏やかにするのに役立つことを発見した。さらに最近では、OSAとアルツハイマー病の発症リスクの高さとの関連性が、(Tsai et al 2020)によって強調されている。19,890人(OSA患者3,978人、非OSA患者15,912人)という比較的大きなサンプルサイズで調査されたこの集団ベースのコホート研究では、OSA患者は非OSA患者よりもアルツハイマー病のリスクが高いことが判明した。また、OSAの治療により、アルツハイマー病の進行が有意に抑制されることも観察された。しかし、この研究では、アルコール誤用、喫煙、社会的関与、BMIなど、アルツハイマー病の他の修正可能な危険因子が考慮されていない。さらに、この研究では、アルツハイマー病とOSAの診断は標準的な臨床評価ではなく、保険請求によってのみ記録されていた。OSAの治療がアルツハイマー病の前駆症状を遅らせたり、アルツハイマー病の経過を変えたりするのに役立つという推測を検証するには、明確な医学的評価と脳画像を用いた詳細な臨床試験が必要である。
表2 OSA治療がアルツハイマー病の進行を変えるかもしれないという仮説を評価するために用いた研究
| 参考文献 | サンプル/性別 | 年齢 | 主な結果 |
|---|---|---|---|
| Bubu etal。(2019) | 516正常認知/ 263M253F798 軽度認知障害/ 479M319F 325 AD / 206M 119F |
72.3±7.1(OSA +) 73.9±7.3(OSA–) |
正常および軽度の認知障害におけるOSA治療は、ADの進行を軽減する可能性があります |
| オーウェン等。(2018) | 17 CPAP /指定なし 17非CPAP /指定なし |
69.9 63.8 (平均) |
非CPAP =>β-アミロイドおよびタウの負担に関連する OSACPAP =>この負担を保護 |
| ツァイら (2020) | 3,978 OSA / 2,622M 1,356F15,912 非OSA / 10,488M 5,424F |
40-59(70.5%)および≥60(29.5%) | OSA治療は、治療なしのOSAと比較してADのリスクを低減しました(発生率比0.23、95%CI、0.06–0.98) |
| Ju etal。(2019) | 18 OSA / 12M 6F (OSA + 11 / OSA-7) |
56.9±8.3 | OSA治療はβ-アミロイドレベルを低下させます |
| Troussièreetal。(2014) | 14 CPAP / 10M 4F9 非CPAP / 4M 5F |
73.4 77.6 (平均) |
年間MMSE低下の中央値=> CPAP [-0.7(-1.7; +0.8)]および 非CPAP [-2.2(-3.3; -1.9); p = 0.013] |
OSA閉塞性睡眠時無呼吸症候群、OSAHS閉塞性睡眠時無呼吸-低呼吸症候群、アルツハイマー病アルツハイマー病、M男性、F女性、OSA+はApnea Hypopnea Index AHI≧15,OSA-(「対照」)AHI≦15,CPAP continuous positive airway pressure、T-tau total tau; and P-tau phosphorylated-tau、CI – 信頼区間、MMSE mini mental state examination.
軽度から重度のOSA患者の睡眠障害(フラグメンテーション)は、徐波活動を著しく低下させ、やがて認知障害を引き起こす可能性がある。徐波活動が低下するほど、神経毒性のあるβ-アミロイドレベルが高くなり、プラークを引き起こし、その除去を複雑にし、それに伴い、上述のようにアルツハイマー病のリスクを高める可能性がある。Ju et al 2019)は、CPAP治療が、睡眠の断片化を減らし、徐波活動を増加させ、β-アミロイドおよびタウレベルを顕著に減少させるのに役立つ可能性を裏付ける証拠を示している。また、早期診断とCPAPによるOSAの緩和が、後年のアルツハイマー病発症のリスクを低減する可能性を示唆している。睡眠障害は、アルツハイマー病患者、特に軽度から中等度のアルツハイマー病と診断された患者によく見られる。一部の研究者は、軽度から中等度のアルツハイマー病の段階でOSAのCPAP治療を行うことで、認知障害の進行を遅らせる可能性を示唆している(Chong et al 2006,Canessa et al 2011)。Troussière et al 2014)による3年間の追跡調査の結果は、この仮説を裏付ける証拠となる。彼らの研究でも、Bubu et al 2019)が行った系統的な研究でも、CPAP治療を受けている患者には、認知機能の低下が有意に遅いことが観察された。
考察
このミニレビューの最初の部分では、以下のことを試みている研究(表1参照)を評価する。(i)OSAとアルツハイマー病の間に関連性を見出し、(ii)アルツハイマー病の典型的な徴候である脳内蓄積(除去による合併症)を示すバイオマーカーβ-アミロイドとT-タウ(P-タウ)タンパク質に注目して、OSAとアルツハイマー病になりやすい集団を特定しようとしている研究(表1参照)を評価する。これらの研究は主に、OSAによく見られる間欠的な低酸素と睡眠の断片化が、どのようにアルツハイマー病と関連しているかに焦点を当てている。検討されたすべての研究(すなわち、7つの研究)は、OSAとアルツハイマー病との関連を支持する明確な証拠を提供している。しかし、その中で、OSA患者は脳脊髄液のアミロイドβ42レベルが低くなることを示唆したのは3つの研究(Gagnon et al 2014,Liguori et al 2017,Bubu et al 2019)のみであった。さらに、OSAはアルツハイマー病の脳脊髄液バイオマーカーに影響を与えることがわかっている。OSA患者におけるアルツハイマー病の神経病理については、最近Owen et al 2020)が議論している。彼らは、OSAの重症度の増加に伴い、海馬におけるβアミロイドの負荷が増加することを示している。一方、タウタンパク質については、OSAの重症度ではなく年齢が最も強い予測因子であることがわかっている。
残念ながら、これらの研究では、OSAやアルツハイマー病に罹患しやすい集団に関する決定的な知見やコメントは得られていない。したがって、我々は、OSAの高いリスクを個人の年齢や性別の増加と関連づけた初期の疫学研究の結果を考慮している。OSAは高齢者に多く、男性の方が女性よりも罹患率が高いことを読者に伝えたい(Young et al 2002参照)。さらに、認知症と診断される可能性も、年齢に応じて指数関数的に増加する。例えば、(Qiu et al 2009)によると、高齢者(85歳以上)の3分の1以上が少なくとも1種類の認知症と診断されているという。しかし、高齢者はOSAとアルツハイマー病の両方の影響を受けやすいという広く受け入れられている仮説を確認するには、大規模な集団コホートを対象とした広範な調査がまだ必要である。
このレビューの第二の目的は、OSAの治療がアルツハイマー病の進行を変える可能性があるかどうかを明らかにすることである。「結果」の項で述べたように、OSAによる睡眠の断片化は、酸化ストレスレベルや炎症を著しく増大させ、ひいてはアルツハイマー病の病因を促進する可能性がある。表2の結果は、OSAがアルツハイマー病のリスクを高め、OSAの治療(例えば、CPAP治療)がアルツハイマー病と診断された人の認知機能低下の進行を遅らせる可能性があることを示唆する明確な証拠を示している。例えば、CPAP治療は、睡眠の断片化を減少させ、バイオマーカーであるβアミロイドおよびT-タウタンパク質(これらの蓄積はアルツハイマー病の典型的な徴候である)のレベルを安定させ、それに応じて、患者の認知機能および日中の機能を向上させるのに役立つ。Tsaiらによる大規模な集団ベースのコホート研究(2020)では、OSA患者のアルツハイマー病の有病率(0.8%)が非OSA患者の有病率(0.3%)よりもはるかに高かったことは注目すべきことである。これらの知見は、Cooke et al 2009)による初期の予備的研究の結果も支持しており、著者らは、長期的なCPAP治療が認知機能の低下速度を遅らせる可能性を示唆している。
結論
過去1世紀の間に平均寿命は顕著に延びたが、高齢者は心血管疾患、うつ病、アルツハイマー病、OSAにかかりやすいため、公衆衛生に新たな課題をもたらしている(Kuo er al 2020)。このミニレビューでは、まずOSAがアルツハイマー病と関連しているかどうかを評価し、次にアルツハイマー病患者の認知機能を改善するためのOSA治療の効果に関する最近の研究を紹介する。我々の研究では、OSAとアルツハイマー病の関連性を裏付ける明確な証拠が得られている。睡眠の断片化と断続的な低酸素状態は、OSA患者に共通して見られ、脳構造の神経変性変化を引き起こし、アルツハイマー病のバイオマーカーとしても知られるβアミロイドやT-tauタンパク質のレベルを変化させることが示されている。OSAのCPAP治療は、睡眠の断片化を減らし、徐波睡眠を改善する。その結果、OSAを治療することで、β-アミロイドやT-タウタンパク質のレベルが安定し、それに伴って認知機能も向上すると考えられる。最近の研究では、OSAの治療はアルツハイマー病のリスクを減らすだけでなく、アルツハイマー病患者にとっては認知機能の低下を遅らせるのに役立つかもしれないという仮説が支持されている。評価された研究では、どのような集団がOSAとアルツハイマー病の両方に対してより脆弱であるかという明確な結論は得られなかったが、含まれている研究と現在の疫学データに基づくと、高齢者(65歳以上)がOSAとアルツハイマー病の両方に対してより脆弱であるということが広く受け入れられている。
