Assessment of developmental neurotoxicity induced by chemical mixtures using an adverse outcome pathway concept
www.ncbi.nlm.nih.gov/pmc/articles/PMC7038628/
オンラインでは2020年2月24日に公開
Francesca Pistollato, Emilio Mendoza de Gyves, Donatella Carpi, Stephanie K. Bopp, Carolina Nunes, Andrew Worth, and Anna Bal-Pricecorresponding author
概要
背景
乳幼児は一度に複数の化学物質に曝されるため、発達期の脳の脆弱性を考慮すると、発達神経毒性(DNT)を評価するための混合物リスクアセスメント(MRA)を実施する必要がある。MRAに取り組む一つの方法として、混合物中の発達神経毒性化学物質をその作用機序(MoA)に基づいて「類似」と「非類似」に分類するが、それでも同じ有害結果に寄与すると考え、発達神経毒性アッセイを発達神経毒性特有の有害性発現経路(AOPs)で特定された共通キーイベント(CKE)にアンカーすることが考えられる。さらに、induced pluripotent stem cell (hiPSC)由来の神経細胞やグリア細胞などのヒト試験管内試験モデルを使用することで、化学物質によって誘発される副作用のメカニズムを理解し、種の外挿を避けることができる。
方法
神経細胞とアストロサイトの混合培養に分化させたHiPSC由来の神経前駆細胞を用いて、単一化学物質および異なるクラスの混合化学物質(塩化鉛(II)、メチルエチルケトンなど)の急性投与(3日間)および反復投与(14日間)による影響を評価した。塩化鉛(II)、塩化メチル水銀(重金属)クロルピリホス(農薬)ビスフェノールA(有機化合物、内分泌かく乱物質)バルプロ酸(医薬品)PCB138(残留性有機汚染物質、内分泌かく乱物質)など、子どもの学習・記憶障害などの認知機能障害に関連する化学物質を、単一の化学物質および混合物として、急性(3日間)および反復投与(14日間)した場合の影響を評価した。選定された化学物質は、その作用機序(MoA)に基づいて「類似」と「非類似」のMoA化合物にグループ分けされ、発達神経毒性に関連する現在入手可能なAOPsのCKEとして特定されたシナプス形成、神経突起伸長、脳由来向神経性因子(BDNF)タンパク質レベルへの影響が、免疫細胞化学と高コンテンツ画像解析によって評価された。
結果
非細胞毒性(IC20/100)超低毒性(IC5)中等度毒性(IC20)の濃度で、類似のMoA(BDNFレベルの変化)を介して作用する化学物質は、混合物中で発達神経毒性効果を誘発する。その結果、神経細胞数の増加、神経突起伸長およびシナプス形成の障害(数学的モデリングにより確認された最も感度の高いエンドポイント)BDNFレベルの増加により、自閉症児の脳で観察される自閉症様の細胞変化をある程度再現することができた。
結論
今回の研究成果は、ヒトiPSC由来の神経細胞と神経膠細胞の混合培養物を用いて、AOPネットワークの主要なイベントに基づいた一連のアッセイを行うことが、小児の学習・記憶障害を引き起こす可能性のある化学物質の混合物を同定するための貴重なアプローチであることを示唆している。
キーワード 混合物リスク評価、有害事象パスウェイ、ヒト誘導多能性幹細胞、神経細胞分化、子供の健康
背景
発達神経毒性(DNT)を引き起こすことが知られている化学物質は、有機溶剤や金属などの異なるクラスや、工業薬品、農薬、内分泌かく乱物質(ED)医薬品、化粧品などの異なる用途に属している。神経毒として同定されている化学物質は約218種類あり,そのうち27種類が金属または無機化合物,41種類が有機溶剤,48種類がその他の有機物質,102種類が農薬である[1]。MaffiniとNeltnerによる研究[2]では,300以上の化合物が発達神経毒性の候補物質として同定された。これらの化学物質は、食品汚染物質、食品接触材料、香料・着色料・保存料などの食品添加物など、様々な規制の対象にもなっている。上記の例は、様々な化学物質によって引き起こされる共通の、類似した、または関連した毒性作用が、別々の法律の下で規制されており、異なる規制領域にまたがる化学物質の複合作用が可能であるが、現在は考慮されていないことを示している[3]。同時に,「混合物効果」は,混合物中の最も強力な単一の化学物質によって引き起こされる効果よりも,それらの相加効果や,場合によっては相乗効果によって大きくなる可能性があることがよく知られている.胎児、乳幼児、子供を含む人間は、議論の余地なく同時に複数の化学物質に共同曝露しているため、発達途上の脳の脆弱性を考慮して、発達神経毒性の影響に関する混合物リスクアセスメント(MRA)を実施する必要がある[3]。例えば、母乳[4]や臍帯血[5]には、農薬として規制されている化学物質に加えて、化粧品として規制されている化学物質(UVフィルター、パラベン、フタル酸エステルなど)やポリ塩化ビフェニル(PCB)を含むPOPsが含まれていることが確認されており、一般的に妊娠中や新生児・幼児は複数の化学物質に同時に共同曝露されていることが確認されている。
発達神経毒性の化学物質は複数のメカニズムで同時に作用する可能性があるため、混合物の影響に対する個々の化学物質の寄与を理解することは複雑で、MRAを困難にしている。1つの可能なアプローチは、混合物中の発達神経毒性化学物質を、その作用機序(MoA)に基づいて「類似」と「非類似」に分類することであるが、それでも同じ有害結果(AO)に寄与することになる。このアプローチは,食品中の残留農薬に対する異種作用機序(MoA)の関連性に関するEFSA Plant Protection Products and their Residues(PPR)パネルの2013年の「科学的意見」[6]で推奨されており,複数の化学物質への複合暴露のリスク評価に関するより最近の一般的なガイダンスでも支持されている[7]。
本研究では,EFSAの科学的意見に沿って,選択した化学物質を2つのカテゴリーに分類した。(i) 類似したMoA。(i) 類似MoA:少なくとも1つの共通のMoAを介して作用する化学物質。ここでは、シナプス形成の変化につながる(または関連する)BDNFレベルの変化(重金属である塩化鉛(II)、殺虫剤であるクロルピリホス、有機合成物であるビスフェノールA)。ビスフェノールA(有機合成化合物)とED)(ii)BDNFレベルの変化に直接関連しないが、複数のメカニズムで作用する異種のMoA(メチル水銀(重金属)バルプロ酸(医薬品)PCB138(残留性有機汚染物質(POP))とED)。異なるクラスに属する化学物質で、少なくとも1つの共通したメカニズム(ここでは、BDNFレベルの変化、発達神経毒性 AOPsのKEと定義)で作用するものを、文献調査に基づいて探し出した(Additional file 1: Tables S1 and S2)。化学物質の適用濃度は,臍帯血,母子の血液,母乳などのヒト試料中に含まれる各化学物質の濃度を考慮して慎重に選択した(Additional file 1: Tables S1 and S2)。
さらに,発達神経毒性の原因となる環境化学物質は,複数の直接的・間接的な影響を引き起こすことが多く,その影響は,用量,脳の発達段階,曝露期間,他の環境因子との相互作用などによっても異なる可能性があることを認識する必要がある。したがって、EFSAのPPRパネルが推奨する化学物質の「類似」と「非類似」のMoA(s)への分類[6, 7]は、用量付加の評価を可能にする一方で、「汚れた」環境神経毒に適用する場合には、いくつかの制限がある。さらに,EFSAのPPRパネルは,類似したMoAで作用する化学物質だけでなく,共通のAOを生成する場合には,異なるMoAを持つ農薬の混合物の評価にも,用量付加(DA)に基づくMRA法を使用することを推奨している。実際、DAは、作用の異なる化学物質の混合物を評価する際にも、デフォルトの概念として十分に保守的であると考えられている。その結果、EFSAの意見書[6]の著者は、MoAに関係なく、規制上の実務で混合物を扱うための統一的なアプローチを提案した。
これに関連して、ある種のEDは、それらが同じ主要分子標的を共有していなくても、用量添加性を示すことが証明されている[8]。それ以来、特に内分泌系に作用する(あるいは内分泌系を経由して作用する)化学物質については、MRAにおいて作用の異なる化学物質の複合的な影響も考慮する必要性があることが、さらなる科学的証拠によって裏付けられている[6]。
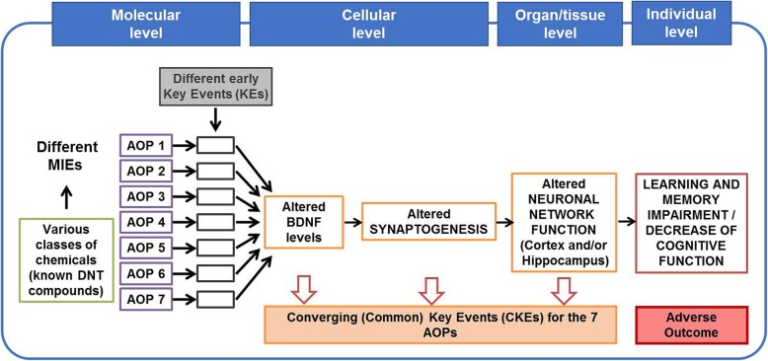
現在までに、7つの発達神経毒性のAOPが開発されており[9-15]、現在も最終的な検討が行われている[14, 16]。その中で、子どもの学習障害や記憶障害などの認知障害がAOとして特定されている。これらのAOPsは、異なる分子イニシエーションイベント(MIE)と様々な初期キーイベント(KE)によって引き起こされるが、AOの前にある3つのKEが、ほとんどのAOPsに共通するKE(CKE)である。図1にまとめたように、(i)脳由来向神経性因子(BDNF)レベルの変化、(ii)シナプス形成の変化、(iii)ニューロンネットワーク機能の変化である。
図1 同様のAOにつながる複数のMIEを持つ7つの発達神経毒性 AOP
脳由来向神経性因子(BDNF)レベルの変化、シナプス形成の変化、神経ネットワーク機能の変化)は、これら7つのAOPの大半に共通するKEとして定義されており、これらはすべて、学習・記憶障害または認知機能障害と定義される有害な結果(AO)につながる。
これらのCKEは、学習・記憶障害を引き起こすためには、AOPs内のKER(Key Event Relationship)で示されるように、因果関係で結ばれていることが必須である。BDNF-ERK-CREB(extracellular signal-regulated kinase / cyclic AMP response element-binding protein)シグナルカスケード(KE upstream)は、神経細胞の生存、分化(樹状突起や神経突起の形成)、シナプス形成、神経細胞ネットワーク形成など、脳の発達において重要な役割を果たしている[17, 18]。したがって、BDNFレベルの変化(増加または減少)は、AOP ID 12 [13]、AOP ID 13 [12]、またはAOP ID 54 [9]のKERに記載されているように、シナプス形成の変化をもたらし、神経ネットワークの機能障害につながる可能性があり、経験的なデータによって強く支持されている[19-28]。
本研究では,これらのAOPに記載されているCKEに基づいた試験管内試験を用いて,AOPネットワーク(図1)に記載されている機序的知識が発達神経毒性試験のフレームとして機能し,データの解釈を容易にし,規制目的に適用できるかどうかを調べた。
このモデルは、神経前駆細胞の分化、増殖、移動、神経細胞とグリアの分化、シナプス形成、神経ネットワークの形成と機能など、ヒトの脳の発達に重要かつ特異的なプロセスのほとんどを再現しているからである[33-35]。最近,これらの試験管内試験法が規制目的に適しているかどうかが,13の確立された半定量的な基準に基づいて評価されている[36].環境暴露に適した濃度の化学物質が、これらの主要な神経発達過程の少なくとも1つに統計的に有意な影響を与える場合、その化学物質は潜在的な発達神経毒性を持つと定義されるべきであると仮定されている[37]。
これらの主要な神経発達過程は、単一の化学物質または混合物への曝露(急性または慢性)によって定量的に評価することができる。
我々は、実生活での暴露を考慮して、主に5つの基準に基づいて化学物質の混合物を再構築した。すなわち、(i)ヒトのサンプル中に化学物質が存在すること、(ii)異なるクラスに属すること(例:農薬、工業化学物質、重金属、ポリ塩化ビフェニル、ED、薬物)(iii)AOPネットワークで特定された共通のKEを介して作用すること、(iv)EFSAの定義[6]によれば、類似および非類似のMoAを介して作用すること、(v)子供の認知障害(AO)と関連があること、である。選択された化学物質は、AOPsで仮定されているように、これらの化学物質の混合物がBDNFレベル、神経細胞の分化およびシナプス形成に影響を与えるかどうかを検証するために、概念実証として使用された。本研究の全体的な目的は、AOPネットワーク主導のテスト戦略に従うことで、単一化学物質の非神経毒性濃度が混合物の発達神経毒性効果をもたらすかどうかを明らかにすることである。
方法
ヒト誘導多能性幹細胞(hiPSC)由来の神経幹細胞(NSCs)を神経細胞とアストロサイトの混合培養に分化させた。
IMR90-hiPSC(Prof Marc Peschanski, I-Stem, Franceよりご提供)に由来する神経幹細胞(NSCs)を用いて、神経細胞とアストロサイトの混合培養で分化した神経細胞を得ました。テストシステムの特性およびこれらの細胞の培養と分化の方法に関する詳細な手順については,[38] 簡単に説明すると,神経外胚葉誘導体(ロゼット)から得られたNSCsを継代し,還元型成長因子マトリゲルを塗布した96ウェルプレート(ポリ-D-リジンでプレコート)に7000細胞/ウェル(すなわち,21.000細胞/cm2)の密度でプレーティングし,試験管内試験で21日または28日(DIV)のいずれかで分化させた。21DIVでは,ニューロン(グルタミン酸ニューロン35〜42%,GABA作動性ニューロン15〜20%,ドーパミン作動性ニューロン13〜20%)とアストロサイト(15〜20%)の混合集団が得られた[38, 39].
単一および混合化学物質への暴露
NSCsを7日間の分化(7DIV)後、塩化鉛(Lead)(Sigma, DMSO中の200mMストック溶液)Chlorpyrifos(CPF)(Sigma, DMSO中の500mMストック溶液)Bisphenol A(BPA)(Sigma, DMSO中の400mMストック溶液)で処理した。メチル水銀(II)クロリド(Methyl-Hg)(Sigma社、DMSO中の10mMストック溶液)バルプロ酸ナトリウム塩(VA)(Sigma社、精製milliQ水中の1000mMストック溶液)PCB138(Sigma社、DMSO中の100mMストック溶液)を単一の化学物質または混合物として投与した場合(すなわち。 e., すなわち、BPA、CPF、鉛を組み合わせたもの(同様のMoA化学物質(Additional file 1: Table S1))メチル水銀、PCB138,VAを組み合わせたもの(同様のMoA化学物質(Additional file 1: Table S2))あるいは6種類の化学物質をすべて組み合わせたもの(All;下記のフェーズ3を参照))を、3日間(急性期治療)あるいは14日間(化学物質を含む培地を週2回更新する反復投与治療)のいずれかで投与した。実験方法は、図2に示すように、3つのフェーズに分けて行った。
図2 3つの実験フェーズ
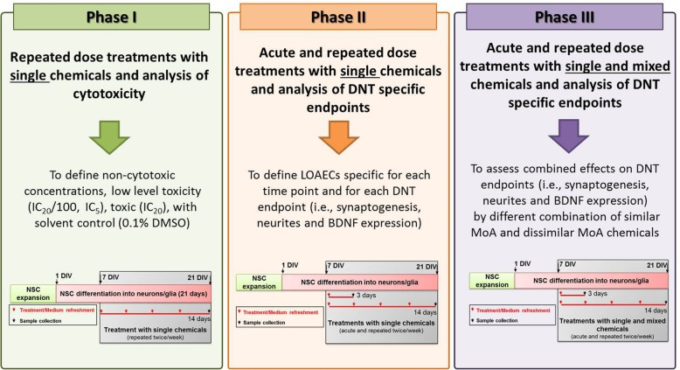
フェーズ1では、各化学物質について、それぞれの時点で、溶媒対照(0.1%DMSO)と比較して、非細胞毒性、超低毒性(IC20/100,IC5)および中等度毒性(IC20)の濃度を定義することを目的とした。フェーズ2の目的は、各化学物質について、各時点(3日および14日)で、分析した発達神経毒性エンドポイント(シナプス形成、神経突起伸長、BDNFレベル)ごとに、統計的有意性の分析に基づいて、観察可能な悪影響の最小濃度(LOAEC-syn、LOAEC-neu、LOAEC-bdnf)を定義することであった。この段階では、フェーズ1で定義した濃度(すなわち、非毒性(IC20/100)極低毒性(IC5)中等度毒性(IC20))の化学物質を単独で投与し、シナプス形成、神経突起伸長、BDNFレベルに対する影響を評価した。フェーズ3では、フェーズ2の終了時に定義されたLOAECs濃度での単一化学物質および混合物による処理を行い、可能な複合効果を評価し、フェーズ2に記載されたのと同じ発達神経毒性固有のエンドポイントを評価した。
フェーズ1では、個々の化学物質の細胞毒性に関する用量反応曲線を14日間の処理後に評価し、非細胞毒性(IC20/100)非常に低い細胞毒性(IC5)中程度の毒性(IC20)の各濃度を、各化学物質の各時点での対照培養における溶媒(0.1%DMSO)と比較して特定した(すべてSigma社製)。細胞毒性の測定には、CellTiter-Blue® 試薬をメーカーの説明に従って使用した。
フェーズ2では、フェーズ1で定義した非細胞毒性、超低細胞毒性、中等度毒性濃度(それぞれIC20/100,IC5,IC20)の化学物質を用いて、シナプス形成、神経突起伸長、BDNFタンパク質レベルへの影響を評価した。これは、発達神経毒性に関連するAOPsで定義されたKEに固定された試験管内試験アッセイで、高コンテンツイメージング(HCI)分析を用いた定量的免疫細胞化学によって評価した(Cellomics)。フェーズ2の目標は、各化学物質について、各期間(3日および14日)および発達神経毒性の各エンドポイント(LOAEC-syn(シナプス形成)LOAEC-neu(神経突起伸長)LOAEC-bdnf(BDNFタンパク質濃度))に固有の最小観察可能副作用濃度(LOAEC)を定義することであった。これらのLOAECは、統計的有意性の分析(以下に詳述)に基づき、選択した3種類の化学物質濃度(IC20/100,IC5,IC20)と溶媒対照培養(0.1%DMSO)で誘発される効果をそれぞれの時点で比較して算出し、フェーズ3において発達神経毒性特有のエンドポイントに対する混合物の効果を評価するために使用した。
フェーズ3では,フェーズ2の終了時に定義したLOAEC-syn,LOAEC-neu,LOAEC-bdnfでの単一化学物質および異なる化学物質の混合物による処理を行い,それぞれの時点での溶媒対照培養(0.1% DMSO)と比較して,各発達神経毒性特異的エンドポイントに対する複合効果および混合物特異的LOAECの可能性を評価した。3種類の混合物を作成した。(i)類似したMoAを持つ3つの化学物質を含む混合物(3-sim),(ii)類似しないMoAを持つ3つの化学物質を含む混合物(3-dissim),および(iii)6つの化学物質をすべて含む混合物(All)。混合物の調製に使用した化学物質のLOAECは、発達神経毒性エンドポイントの感度と処理の時間に応じて異なった。フェーズ3の開始時に,混合化学物質によって誘発される可能性のある細胞毒性作用を考慮して,細胞生存率分析を再度行った。これらの結果に基づき,高い毒性が観察された場合には,各発達神経毒性エンドポイント(3-Sim,3-Dissim,All)に対する混合物固有のLOAECに2の希釈係数を適用して,混合物をさらに希釈した。
CellTiter-blue®による細胞生存率の解析
分化中のIMR90-NSCsを異なる濃度の化学物質に14日間曝露して、細胞毒性曲線を決定し、非細胞毒性、非常に低い、または中程度の毒性濃度を定義し(第1段階)2回目は3日後または14日後に混合物によって誘発される可能性のある細胞毒性効果を決定した(第3段階)。レザズリンはCellTiter-Blue® 試薬の有効成分であり、生細胞に入ると赤色で高い蛍光性を持つレゾルフィンに変換され、その吸光度は分光光度計で測定される。培養後、100μLの培地/試薬を新しいプレートに移し、マルチウェル蛍光リーダー(Tecan社製)を用いて530-560nm/590nm(励起/放出)で蛍光を測定した。結果は、溶媒処理した細胞(0.1% DMSO)の平均値で正規化した。
ハイコンテントイメージング(HCI)解析による定量的免疫細胞化学(IC)の実施
3日後および14日後、細胞を4%ホルムアルデヒドで固定し、PBS 1X(w/o calcium and magnesium)で2回洗浄し、使用前にPBS 1Xで4℃で保存した。染色の準備ができたら,0.1% Triton-X-100と3.5% BSA(ウシ血清アルブミン)を含むPBS 1Xで15分間、室温で細胞を伝染処理し、さらに1X PBS(ブロッキング溶液)中の3.5% BSAとインキュベートして、抗体の非特異的結合を防いだ。シナプス形成の解析には,微小管関連タンパク質-2(MAP2,ニワトリ,1:3000,Abcam),シナプス前マーカー(SYP,ウサギ,1:300,Abcam),シナプス後密度タンパク質95(PSD95,マウス,1:300,Abcam)の各特異的抗体を用いて細胞を染色した。さらに、神経突起伸長(β-III-チューブリン(マウス、1:500,Thermofisher)染色による)およびBDNF(ウサギ、1:70,Thermofisher)レベルの分析を行った。また、ニューロフィラメント200(NF200,ウサギ、1:1000,Sigma-Aldrich社)グリア線維酸性タンパク質(GFAP、マウス、1:500,Merck-Millipore社)ネスチン(ウサギ、1:200,Sigma-Aldrich社)についても細胞を染色した。すべての一次抗体をブロッキング液で希釈し、4℃で一晩インキュベートした。細胞をPBS 1Xで2回洗浄し,さらに蛍光標識二次抗体(1:500,すべてAbcam)を用いて45分間インキュベートし,核を1μg/mLのDAPI(Thermofisher)でカウンターステインした。平均蛍光強度および細胞タイプの相対的な割合の定量化は、ArrayScanアルゴリズム「Neuronal Profiling V4.1」バイオアプリケーションを用いて行った。このアルゴリズムは、核の形態に応じて定義されたDAPI染色の周りに特定の核マスクを適用し、無効な核(すなわち また,有効な核(生きている細胞を示す均一な丸い形の核)には,すでに説明したように,抗体/抗原の染色の種類に応じて,追加の細胞体マスクを適用した[40].その他のマスクは,それぞれ神経突起とSYP,PSD95,BDNFタンパク質の蛍光強度レベルを識別するために使用した。二次抗体のインキュベーションのみで、蛍光バックグラウンドの強度レベルを決定した。ArrayScan™ XTI High Content Platform (Cellomics)は、10倍の倍率で最低12~16枚/ウェルの写真を撮影するように設定した。各条件で合計6~8回の内部複製を行った。定性的な分析のために、20倍および40倍の写真も撮影した。
ベンチマーク用量モデリング
単一の化学物質に14日間暴露した後に観察された各発達神経毒性固有のエンドポイントの摂動に対して、パラメトリックな用量反応分析を適用した。BMDExpress.2オープンアクセスソフトウェア(https://github.com/auerbachs/BMDExpress-2/wiki)を用いて、7つの異なる数学的モデル(すなわち、Hill、Power、Linear、Polynomial 2,Exponential 2,Exponential 3,Exponential 4,およびExponential 5)についてフィッティング曲線を計算した。化学物質およびエンドポイントごとに、最も適合度の高いモデル(赤池情報量が最も少なく、適合度P値が高いモデル)を選択し、反応が5%変化した場合のBench Mark Dose(BMD)を求めた(BMD5)。また、BMD5の不確実性を推定するために、上限値(BMDU)と下限値(BMDL)を算出した(Additional file 4 _Figure S10_Tables S3-S4-S5)。注目すべきは,各化学物質および各発達神経毒性エンドポイントに特有の非単調な用量反応曲線が異なる傾向と形状をたどり,2016年のEFSAガイダンス「リスク評価におけるベンチマーク用量アプローチの使用」[41]に記載されているように,混合物の反応にモデルを適用することができなかったことである。そこで,混合物中の個々の化学物質の効力を評価するために,各発達神経毒性エンドポイントについて,Parametrical dose response analysisで算出したベストフィットモデルに従って,混合物で使用される濃度を考慮した単一化学物質のBench Mark Response(BMR)を算出した。単一化学物質のBMR値は,測定された混合物の効果と比較された(未処理のコントロールに対して正規化された)。さらに、濃度付加アプローチおよびToxic Unit(TU)モデル[42]を適用し、3種類の化学物質について以下の式を考慮した。
TU=[chem1]/BMD5(chem1)+[chem2]/BMD5(chem2)+[chem3]/BMD5(chem3).
この方法によれば,TU≦1の場合,混合物による相加反応の予測値は5%以下となり,TU>1の場合,このモデルでは混合物の影響を予測することはできない。
統計解析
統計的有意性は、GraphPad Prism 5ソフトウェア(http://www.graphpad.com/)を用いて、すべての条件と溶媒コントロール(Ctr, 0.1% DMSO)(またはNSCs, 未分化細胞)を比較し、Dunnettの多重比較検定を事後検定として用いた一元配置のANOVAによって評価した。すべてのデータは、少なくとも3つの生物学的複製の平均値±標準誤差平均(S.E.M.)を表す。すべてのグラフにおいて、データポイントの上にあるアスタリスクは、対照群との有意差を示す。すべてのグラフにおいて、* p < 0.05, ** p < 0.01, *** p < 0.001.
結果
化学物質の選択基準
ヒトの疫学データやヒトのサンプル中の化学物質の存在に基づき(例.(4, 5)) に基づき、学習・記憶障害を含む小児の認知機能障害(発達神経毒性 AOPsのAO)に関連する化学物質を特定し、関連するAOPsのKEに応じて、(1) シナプス形成の変化に伴うBDNFの合成・放出の障害(類似MoA)と、(2) BDNFレベルの変化には直接関連しない複数のメカニズムによるシナプス形成の変化(非類似MoA)の2つのグループに分けた。
以上を踏まえ、以下の5つの基準で化学物質を選定した。
- 子どもの認知・学習・記憶障害に関連する化学物質(疫学研究
- 発達神経毒性 AOPsで特定されたCKEを介して作用する化学物質
- 異なるクラスの化学物質(例:農薬、工業化学物質、重金属、POPs、EDs、薬物)。
- ヒトのサンプルに含まれる化学物質(母乳、臍帯血、尿、毛髪、臍帯血漿、脳組織、母体の血液、子供の血液など
- EFSAの定義[6]によれば、類似および非類似のMoA(上記)を通じて働く化学物質。
Additional file 1: Tables S1 and S2には,上記の基準に従って選択された化学物質がまとめられている。特に、塩化鉛(Lead)クロルピリホス(CPF)ビスフェノールA(BPA)塩化メチル水銀(Methyl-Hg)PCB138,およびバルプロ酸(VA)は、以下の理由で優先的に選定された。これらの化学物質は、(i)シナプス形成の変化に対する影響が証明されている(CKE)(ii)認知機能障害への関与が証明されている(AO)(iii)疫学研究において影響が証明されている、(iv)MoAが知られている、という優先順位が付けられ、確立された基準に基づいて類似(BPA、CPF、鉛、Additional file 1: Table S1)および非類似(メチル-水銀、PCB138,VA、Additional file 1: Table S2)に分類された。
これら6種類の化学物質(単独または混合投与)の影響を、3日後または14日後に神経細胞およびアストロサイト様細胞へと分化しつつあるhiPSC由来のNSCsを用いて評価した。
対照培養した分化途上のHiPSC由来NSCsにおけるシナプス形成、神経突起伸長、BDNFタンパク質レベルの特徴づけ
シナプス形成は、Thermo-Fisher社の標準的なプロトコル(https://www.thermofisher.com/it/en/home/life-science/cell-analysis/cellular-imaging/high-content-screening/hcs-applications/hcs-synaptogenesis-assay.html)に従って、シナプス前後のタンパク質(すなわち、SYPおよびPSD95,樹状突起マーカーMAP2)の共時的な発現に基づいて決定した。また、同じ培養液を用いて、分化過程にあるIMR90-NSCsの神経突起の長さ(β-III-チューブリンで染色した細胞で評価)とBDNFタンパク質のレベルも測定した。データによると、神経細胞マーカーであるβ-III-チューブリンとMAP2の発現は時間とともに増加し、これは神経細胞の分化を示している。さらに、21日目のDIVでは、グリア線維酸性タンパク質(GFAP)を発現している細胞が約15〜20%存在し(アストロサイトを示す)ネスチンの発現を保持している細胞が約20〜30%存在した(NSCs)(図3a, b)。β-III-チューブリン染色で分析した神経突起の長さと分岐点/神経突起の数は、分化の過程で徐々に増加した(図3a、c、d)(28DIVまでの期間)。さらに、SYP(シナプス前のマーカー)とPSD95(シナプス後のマーカー)のレベルも、特に樹状突起(MAP2で染色)のレベルで、それぞれ約7倍と1.7倍(21DIV時点)に増加し、シナプスの数(神経突起内でSYP/PSD95のスポットが重なっている数)も増加した(21DIV時点で約6.5倍)(図3a, f-h)。さらに、BDNFタンパク質レベルは、増殖中のNSCsで特に高く、分化すると減少することがわかった(図3a、e)。
図3 hiPSC-NSCsが神経細胞やアストロサイトに分化する際の、シナプス形成、神経突起伸長、BDNFタンパク質レベルの特徴を示す

(a) NSCs(1DIV、上段)14日後のNSCs(14DIV、中段)28日後のNSCs(28DIV、下段)の代表的な位相差画像および免疫細胞化学(IC)画像。ネスチン(赤)微小管関連タンパク質-2(MAP2,白)とシナプス後密度タンパク質95(PSD95,赤)シナプトフィジン(SYP、緑)β-III-チューブリン(赤)と脳由来向神経性因子(BDNF、緑)グリア線維酸性タンパク質(GFAP、赤)で染色した細胞を免疫細胞化学的に表示している。(b) ネスチン、β-III-チューブリン、MAP2,GFAPを発現している細胞をDAPI染色した細胞に対する割合で示した定量化。分化後7,14,21,28DIVの細胞をNSCs(1DIV)と比較している。解析は、Array Scan vTiプラットフォームとNeuronal profiling V4.1 BioApplicationを用いて、免疫蛍光法とハイコンテントイメージング(HCI)を用いて行った。(c) β-III-チューブリン染色を用いて、ニューライト長の解析と(d)分岐点の数/ニューロンを評価した。(e) 全BDNFレベルの定量化(未分化なNSCsに正規化した平均平均強度、1DIV)。(f) PSD95(赤)とSYP(緑)で染色した28DIV分化したNSCsの代表的な免疫細胞化学像(40倍)。(g, h) PSD95およびSYPタンパク質の総量(g)および正規化した量(h)を、神経突起に局在する平均蛍光強度で表した(MAP2で染色、写真には示していない)。hでは、未分化NSCsに対する相対値を示している。Hでは、シナプスの数(すなわち、神経突起内でSYPとPSD95のスポットが重なっている数)も示している。データは3-4回の生物学的複製の平均±S.E.M.である。
単一化学物質の細胞毒性解析(第1段階
非細胞毒性(IC20/100)非常に低い毒性(IC5)中程度の毒性(IC20)の濃度を定義する目的で、6種類の単一化学物質によって誘発される細胞毒性を分析した。HiPSC由来のNSCsを7日間分化させた後、7日目のDIVから 14日間、単一化学物質に曝露し、週に2回、培地と化学物質の処理を更新した。各化学物質について、溶媒(0.1% DMSO)を含む培地との比較分析を行った。表1は、フェーズ1で試験した個々の化学物質の濃度と、比較のためにヒトのサンプル(すなわち、血液および臍帯血)で見つかった化学物質の濃度をまとめたものである。
表1 フェーズ1でテストされた化学物質の濃度とヒトのサンプルに含まれる濃度との関係
| 化学薬品 | 略語 | invitroでテストされた濃度 | 人間のサンプルで見つかった濃度 |
|---|---|---|---|
| 塩化鉛(II) | 鉛 | 200、50、12.50、3.13、0.78、0.20μM |
臍帯血: 範囲1.09–11.41μg / L➔0.0039–0.041μM 子供の血: 範囲1.71〜10μg / dL➔0.061〜0.36μM IPChem: 血液-全血:3.76–69、3.42–28.8、4.13–43.6、6.05–23.1μg / L(範囲3.42–69)➔0.012–0.25μM 臍帯血-全血(血漿を考慮、1.025 g / mL)2.68–36.4 ng /g➔0.00988–0.13μM |
| クロルピリホス | CPF | 500、125、31.25、7.81、1.95、0.49μM |
コードプラズマ: 4.65 ng /mL➔0.013μM 臍帯血: 範囲2.5から6.17 PG / gの血漿(血漿用に考慮して、1.025グラム/ mL)を➔7.3×10 – 6 – 1.8×10 – 5 μM |
| ビスフェノールA | BPA | 400、100、25、6.25、1.56、0.39、0.10μM |
子供の血清: 範囲0.85〜22.5 ng / mL➔0.0037〜0.098μM IPChem: 血液–血漿:nd- 3.5 ng / g(血漿を考慮、1.025 g / mL)➔nd-0.016μM 臍帯血-全血:nd-1.9 ng / g(血漿を考慮、1.025 g / mL)➔nd-0.0085μM |
| 塩化メチル水銀(II) | メチル-Hg | 10、2.50、0.63、0.16、0.04、0.01、0.0024、0.0006μM |
臍帯血: 範囲0.70–35μg / L➔0.0028–0.14μM 子供の血: 範囲1.46〜6.81μg / L➔0.0058〜0.027μM IPChem: 血液全血:0.11から10.2、0.002から4.17まで、0.19から7.93まで、0.13から5.95μg/ Lが(範囲0.002から10.2)➔8×10 – 6 – 0.041μM 臍帯血-全血:0.16〜14.1 ng / g(血漿を考慮、1.025 g / mL)➔0.00065〜0.058μM 臍帯血-全血:nd-8.4μg/L➔nd-0.033μM 血液–血漿:nd-4.2μg/L➔nd-0.017μM |
| バルプロ酸 | VA | 10.000、2500、625、156、39、10μM |
臍帯血: 範囲3.87–75μg / ml➔26.8–520μM |
| PCB138 | PCB138 | 100、25、6.25、1.56、0.39、0.10、0.02μM |
コードプラズマ: 範囲0.14から0.18 / mlの➔3.87×10 – 4 – 5×10 – 4 μM IPChem: コード血漿:270–460 ng /L➔0.00075–0.0013μM |
細胞毒性曲線解析に基づき、IC20/100,IC5,IC20を定義した(図4)。次に、これらの濃度を用いて、選択した発達神経毒性固有のエンドポイントに対する単一化学物質の効果を評価した(フェーズ2)。
図4 分化中のhiPSC由来NSCsにおける単一化学物質による処理に伴う細胞生存率の解析

(a)hiPSC由来NSCsを7DIV分化させた後、異なる濃度の単一化学物質で14日間処理した。14日後(すなわち21DIV)レサズリンテストを行った(b-g)。すべてのサンプルは、それぞれの時点での溶媒対照(0.1% DMSO, Ctr)で正規化した。すべての化学物質は、各濃度ごとに6つの内部複製を考慮し、3〜5回の実験的複製でテストした。測定後、正規化した値をGraphPad Prismにインポートし、非線形フィット(シグモイド用量反応(可変スロープ))を行い、(b-g)で報告されている阻害濃度(IC)値を算出した。
選択した発達神経毒性特異的エンドポイントに対する単一化学物質の影響(フェーズ2
フェーズ2では、各化学物質について、各時点(すなわち、3dおよび14d処理)および各発達神経毒性エンドポイント(すなわち、シナプス形成、神経突起伸長、BDNFレベル)に特異的なLOAECを定義し、LOAEC-syn、LOAEC-neuおよびLOAEC-bdnfの定義を可能にした。この目的のために、細胞は、フェーズ1の終了時に定義されたIC20/100,IC5,IC20の濃度で個々の化学物質で処理された(図4b-g)。3日後と14日後に細胞を固定し、シナプス形成(PSD95(シナプス後マーカー)と共局在するSYP(シナプス前マーカー))樹状突起(MAP2)神経突起伸長(β-III-チューブリン)BDNFの解析に特異的な抗体で染色した。タンパク質の量と分布の定量的な分析は、HCIによりArrayScan XTI High Content Imaging Platform (Cellomics)解析を用いて評価した。個々の化学物質が発達神経毒性のエンドポイントに及ぼす主な影響については,以下のセクションで説明し,Additional file 2に図示した。図S1~S6に示し、表2にまとめた。なお、統計的に有意な変化、すなわち、それぞれの時点で評価した神経発達の特徴(シナプス形成、神経突起伸長、BDNFレベル)が溶媒対照と比較して増加または減少した場合は、発達神経毒性効果の可能性を示唆していると考えるべきである。
表2 IC20,IC5,IC20/100で投与した化学物質の主な効果をまとめたもの
| 3日 | BPA | CPF | 鉛 | メチル-Hg | PCB138 | VA |
| シナプス形成(SYP、PSD95) | ⇓PSD95t(IC 20) | ⇑SYPt(IC 20) | ⇓PSD95n(IC 20 /100) | ⇔ | ⇑PSD95n(IC 20) | ⇔ |
| 神経突起伸長 |
⇔⇑n。神経突起 (IC 5) |
⇓⇔ | ⇔ | ⇔ | ⇑(IC 20 /100) |
⇑n。神経突起(図示せず) (IC 5) |
| BDNFレベル | ⇔ | ⇑BDNFt(IC 20) | ⇔ | ⇔ |
⇔ ⇑比(IC 20 /100) |
⇔ |
| 14日間 | BPA | CPF | 鉛 | メチル-Hg | PCB138 | VA |
| シナプス形成(SYP、PSD95) | ⇓PSD95n(IC 5) |
⇓SYPn ⇑PSD95t(IC 5) |
⇑SYPt ⇓PSD95n(IC 20 /100) |
⇓SYPn (IC 5) |
⇔ | ⇔ |
| 神経突起伸長 |
⇓n。分岐点 (IC 5) |
⇓⇔ | ⇔ |
⇓n。分岐点 (IC 20) |
⇔ | ⇔ |
| BDNFレベル |
⇔ ⇓比率(IC 5) |
⇑BDNFt(IC 20) ⇓比率(IC 20) |
⇔ | ⇓比率(IC 20) | ⇑(IC 5) | ⇑BDNFnと比率(IC 20) |
括弧内には,測定された発達神経毒性の特徴のうち少なくとも1つに統計的に有意な変化をもたらした最低濃度が示されている(Phase 2)。
試験した濃度 BPA(0.29μM、IC20/100;12.74μM、IC5;28.96μM、IC20);CPF(0.37μM、IC20/100;21.01μM、IC5;37.10μM、IC20);鉛(0.0073μM、IC20/100;0.17μM、IC5;0. 73μM、IC20);メチル水銀(0.0013μM、IC20/100;0.05μM、IC5;0.13μM、IC20);PCB138(0.0593μM、IC20/100;3.53μM、IC5;5.93μM、IC20);VA(2.1μM、IC20/100;70μM、IC5;210μM、IC20)。
ビスフェノールa(BPA)
BPAの最高濃度(28.96μM、IC20)で3日間処理したところ、それぞれの時点での溶媒対照と比較して、神経突起でPSD95の総量がわずかに減少し、SYPが増加する傾向が観察された(有意ではない)。一方、14日間の処理では、IC5(12.74μM)で神経突起レベルでPSD95がわずかに減少した(Additional file 2: Figure S1A)。シナプスの数(神経突起内でSYPとPSD95のスポットが重なっている数)は有意に変化しなかった(Additional file 2: Figure S1A)。
IC5を投与した3日後には神経突起の数の増加(図示せず)が見られたが、14日後には分岐点の数が減少し始めた(Additional file 2: Figure S1B)。
BDNFのレベルは、3日後および14日後には有意な変化は見られなかったが(追加ファイル2:図S1C)IC5を用いた場合には、神経突起と細胞体のBDNFレベルの比率の低下が観察された(追加ファイル2:図S1C)。おそらく、未処理の細胞と比較して、神経突起のBDNFレベルが細胞体よりも低くなっていると考えられる。これは、BDNFの軸索輸送が阻害されていることを示していると考えられる[25]。
クロルピリホス(CPF)
クロルピリホス(CPF)は,最高濃度(37.1μM,IC20)で3日目にSYP総量の増加が認められたが,14日目には21μM(IC5)の濃度から神経突起レベルでのSYPの減少とPSD95総量の増加が認められた(Additional file 2: Figure S2A)。さらに、IC20を14日間投与したところ、SYP/PSD95の共局在(シナプス)の減少が観察された(Additional file 2: Figure S2A)。
また、3日後および14日後には、すべての濃度で神経突起の伸長が減少する傾向が認められた(有意ではないが)(Additional file 2: Figure S2B)。
BDNFの総量は、最高濃度のCPF(IC20)で3日後および14日後に増加し(Additional file 2: Figure S2C)BDNF量の神経突起と細胞体の比率の減少はすべての条件で観察され、IC20濃度では3日後および14日後の両方で統計的に有意であった(Additional file 2: Figure S2C)。
塩化第二鉛(鉛)
最低濃度(IC20/100, 0.0073μM)の鉛でも、3日後の神経突起におけるPSD95レベルの低下が観察され、最高濃度(0.73μM, IC20)ではSYPレベルの上昇が観察された。神経突起におけるPSD95レベルの低下は、14日目の処理(最低濃度から開始)でも持続し、SYPレベルは未処理の細胞と比較してわずかに高い結果となった(Additional file 2: Figure S3A)。また、SYPとPSD95の共局在は、増加傾向にあるものの、有意な変化は見られなかった(Additional file 2: Figure S3A)。また、神経突起伸長率およびBDNFタンパク質レベルのパラメータは、調査した濃度の鉛で処理しても有意に変化しなかった(Additional file 2: Figure S3B, C)。
メチル水銀(Methyl-Hg)
3種類の濃度のメチル水銀を3日間投与したところ、SYPとPSD95のタンパク質レベルおよびそれらの共局在に有意な変化は見られなかったが、14日後のIC5(0.05μM)では、神経突起内のSYPレベルの減少が観察された(Additional file 2: Figure S4A)。3日後には神経突起のパラメータに有意な差は見られなかったが、最高濃度のIC20(0.13μM)で14日間処理したところ、わずかではあるが有意な分岐点の減少が記録された(Additional file 2: Figure S4B)。全体のBDNFレベルはすべての条件で変化しなかったが(Additional file 2: Figure S4C)IC20で14日間処理した後に、神経突起と細胞体のBDNFレベルの比率の減少が観察された(Additional file 2: Figure S4C)。
PCB138
PCB138を3日間投与したところ、SYPおよびPSD95タンパク質のレベルに有意な変化は見られなかったが、IC20濃度5.93μMで処理したところ、神経突起レベルでPSD95のわずかな増加が見られた(Additional file 2: Figure S5A)。14日間の長期投与では、SYPとPSD95のレベルおよびシナプスの数に有意な差は認められなかった(Additional file 2: Figure S5A)。
3日後、PCB138は、最低濃度(0.0593μM、IC20/100)で神経突起の伸長(すなわち、神経突起の長さと分岐点の数の両方)を誘導したが、これらのパラメータは、14日間の処理後のそれぞれの時点で、コントロールと比較して有意に変化しなかった(Additional file 2: Figure S5B)。
また、IC20/100濃度では、神経突起と細胞体のBDNFレベルの比率の増加が観察され、14日後にはIC5濃度での処理により総BDNFレベルの緩やかな増加が見られた(Additional file 2: Figure S5C)。
バルプロ酸(VA)
バルプロ酸は、シナプスタンパク質(SYP、PSD95)のレベルを3日または14日後に変化させなかった(Additional file 2: Figure S6A)。
IC5(0.07mM、図示せず)を3日間投与したところ、ニューロンあたりの神経突起数の増加が認められ、最高濃度(0.21mM、IC20)では、神経突起の長さと分岐点の数の両方が増加した。これらの違いは、14日間の長期処理では記録されなかった(Additional file 2: Figure S6B)。
BDNFのレベルと分布は、3日後には有意な変化は見られなかったが(Additional file 2: Figure S6C)14日後には、IC20濃度で処理することにより、神経突起中のBDNFレベルとBDNFの神経突起/細胞体比がともに増加した(Additional file 2: Figure S6C)。
統計的有意性の分析に基づき、各化学物質について、測定された発達神経毒性の特徴のうち少なくとも1つを統計的に有意に変化させる最低濃度を算出した(表2)。このような濃度は、各発達神経毒性エンドポイントおよび各時点(すなわち、3日および14日)に特有のものであり(LOAEC-syn、LOAEC-neuおよびLOAEC-bdnfと定義)化学物質の混合物を調製するために使用した(表3)。
表3 フェーズ3で試験した各時間間隔および発達神経毒性エンドポイントに固有のLOAECとその連続希釈液
| 3日 | BPA | CPF | 鉛 | メチル-Hg | PCB138 | VA | (μM) |
| シナプス形成 | 28.96 | 37.1 | 0.007 | 0.26 | 5.93 | 420 | LOAEC-syn |
| 14.48 | 18.55 | 0.004 | 0.13 | 2.97 | 210 | LOAEC / 2-syn | |
| 7.24 | 9.28 | 0.002 | 0.07 | 1.48 | 105 | LOAEC / 4-syn | |
| 神経突起伸長 | 12.74 | 74.2 | 1.46 | 0.26 | 0.06 | 70 | LOAEC-neu |
| 6.37 | 37.1 | 0.73 | 0.13 | 0.03 | 35 | LOAEC / 2-neu | |
| 3.19 | 18.55 | 0.37 | 0.07 | 0.015 | 17.5 | LOAEC / 4-neu | |
| BDNFレベル | 57.92 | 37.1 | 1.46 | 0.26 | 0.06 | 420 | LOAEC-bdnf |
| 28.96 | 18.55 | 0.73 | 0.13 | 0.03 | 210 | LOAEC / 2-bdnf | |
| 14.48 | 9.28 | 0.37 | 0.07 | 0.015 | 105 | LOAEC / 4-bdnf | |
| 14日間 | BPA | CPF | 鉛 | メチル-Hg | PCB138 | VA | (μM) |
| シナプス形成 | 12.74 | 21.01 | 0.007 | 0.05 | 0.06 | 2.1 | LOAEC-syn |
| 6.37 | 10.51 | 0.004 | 0.025 | 0.03 | 1.05 | LOAEC / 2-syn | |
| 神経突起伸長 | 12.74 | 74.2 | 1.46 | 0.13 | 11.86 | 420 | LOAEC-neu |
| 6.37 | 37.1 | 0.73 | 0.07 | 5.93 | 210 | LOAEC / 2-neu | |
| 3.19 | 18.55 | 0.37 | 0.03 | 2.97 | 105 | LOAEC / 4-neu | |
| 1.59 | 9.28 | 0.18 | 0.016 | 1.48 | 52.5 | LOAEC / 8-neu | |
| BDNFレベル | 12.74 | 37.1 | 1.46 | 0.13 | 3.53 | 210 | LOAEC-bdnf |
| 6.37 | 18.55 | 0.73 | 0.07 | 1.77 | 105 | LOAEC / 2-bdnf | |
| 3.19 | 9.28 | 0.37 | 0.03 | 0.88 | 52.5 | LOAEC / 4-bdnf |
細胞生存率に対する混合物の影響(第3段階
フェーズ1および2で試験した単一の化学物質が、混合物として添加された場合に、分化中のhiPSC由来NSCsに対して発達神経毒性効果を発揮するかどうかを検討した。そこで、フェーズ2の終了時に算出したLOAEC-syn、LOAEC-neu、LOAEC-bdnfから始まる濃度の化学物質を混合し、得られた混合物を必要に応じてさらに希釈し、以下のようにした。
詳細には、個々の化学物質(混合物の内部コントロール)および以下の3種類の混合物を用いて、細胞を再び3日間または14日間処理した。(i)類似したMoAを持つ3つの化学物質を含む混合物(「3-Sim」)(ii)類似しないMoAを持つ3つの化学物質を含む混合物(「3-Diss」)および(iii)6つの化学物質すべてを含む混合物(「All」)。ある化学物質と発達神経毒性のエンドポイントに対するLOAECが直ちに特定できない場合(フェーズ2で統計的有意性が得られなかったため)フェーズ3で試験した最高濃度(IC20)に2倍の係数をかけた。例えば、CPFの神経突起伸長解析では、どの濃度で試験しても神経突起関連パラメータに有意差がなかったため、CPFのIC20を2倍して(すなわち、37.1(×2)=74.2μM)フェーズ3で試験する最高濃度(推定LOAEC-neu)として保持した(表3参照)。一方,混合物の細胞毒性が高い場合は,必要に応じてLOAEC濃度を2倍,4倍,さらには8倍に希釈した。
3日後(急性)および14日後(反復投与)の細胞毒性を測定し,混合物が引き起こす可能性のある細胞毒性効果を,個々の化学物質と比較して評価した(図5)。一般的に、MoAが類似している3つの化学物質(すなわち、BPA、CPF、鉛)からなる混合物は、MoAが類似していない化学物質(すなわち、Methyl-Hg、PCB138,VA)からなる混合物よりも強力に細胞生存率を低下させた。さらに、試験した混合物の一部(例えば、神経突起関連およびBDNF関連のLOAECs混合物、図5f、gの赤い曲線)は、極めて細胞毒性が強い(細胞生存率が80%以上低下)ため、選択した発達神経毒性エンドポイントに対する混合物の効果を評価するために、これ以上検討しなかった。
図5 CellTiter-Blueアッセイを用いた混合物処理時の細胞生存率の分析

(a) hiPSC由来のNSCsを7DIV分化させた後、各発達神経毒性エンドポイント(すなわち、シナプス形成(bおよびe)神経突起伸長(cおよびf)BDNFレベル(dおよびg))に特異的なLOAECを用いて、個々の化学物質または3種類の異なる混合物で3日間(b-d)または14日間(e-g)処理した。3日後(b-d)または14日後(e-g)に、レサズリンテスト(CellTiter Blueを使用)を行った。すべてのサンプルは、それぞれの時点で、溶媒(0.1% DMSO、Ctr)を含む対照培地で正規化した。LOAEC(赤色の曲線)およびその連続希釈液(それぞれ黒色(LOAEC/2)青色(LOAEC/4)水色(LOAEC/8)の曲線)を用いて、混合化学物質が細胞毒性作用を示すかどうかを評価した。3-Sim」と表示された混合物には、類似したMoA化学物質(BDNFレベルに影響を及ぼすBPA、CPF、鉛)が含まれており、反対に類似しないMoA化学物質(Methyl-Hg、PCB138,VA)を含む混合物は「3-Diss」と表示されている。All」は6種類の化学物質すべてを含む混合物である。データは、3-4回の生物学的複製の平均値±S.E.M.である。
発達神経毒性特有のエンドポイントに対する混合物の効果(第3段階)
シナプス形成 (SYPおよびPSD95)
3日間の処理後(図 6a, c)LOAEC/2-syn濃度のBPA、CPF、Methyl-Hg、PCB138の各化学物質は、3種類の類似化学物質(「3-Sim」)または3種類の非類似化学物質(「3-Diss」)のMoA化学物質を含む混合物によるSYPの増加と同等のレベルで、総SYPの増加を誘発した(Additional file 3: Figure S7B, black curve)。これは、これらの化学物質が、これらの混合物に曝された神経細胞で観測されたSYPの発現増加の主な要因である可能性を示唆している。さらに、LOAEC/4-syn(LOAEC-synの濃度を4倍に希釈したもの、青色の曲線、Additional file 3: Figure S7A-C)の個々の化学物質では、シナプス形成に大きな変化は見られず、逆に、3種類の混合物に細胞を曝すことで影響を受けた。特に、低濃度の「3-Sim」混合液(LOAEC/4-syn)では、SYPレベルと神経突起内のSYP/PSD95オーバーラップスポットの数(すなわちシナプス)が有意に増加したが、「3-Diss」混合液や全化学物質を含む混合液(「All」)では、これらの効果はあまり顕著ではなかった(青の曲線、Additional file 3: Figure S7B, C)。PSD95のレベルは、「All」混合液で処理した場合、LOAEC/2-synの時点ですでに上昇していたが(黒の曲線、Additional file 3: Figure S7A)他の条件では変化がなかった。
図6 シナプス形成に対する混合物効果

hiPSC由来NSCsを7DIV分化させた後、単一化学物質(BPA、CPF、Lead、Methyl-Hg、PCB138,VA)および3種類の混合物を3日間(aおよびc)または14日間(bおよびd)処理した。(i)類似した3種類のMoA化学物質との混合物(「3-Sim」と表示)(ii)類似しない3種類のMoA化学物質との混合物(「3-Diss」と表示)(iii)6種類すべての化学物質との混合物(「All」と表示)。(a, b) LOAEC-syn濃度で処理した際のPSD95の総量(赤)SYPの総量(緑)SYP/PSD95のオーバーラップするスポットの数(シナプス、黄)を分析したグラフ。(c, d) 異なるLOAEC-syn濃度の混合液(表3参照)で3日間(c)または14日間(d)処理し、PSD95(赤)とSYP(緑)を染色した細胞の代表的な免疫細胞化学像(10倍の倍率、40倍の挿入図あり)。すべてのサンプルは、それぞれの時点での溶媒対照(0.1%DMSO、Ctr)で正規化した。データは3-4回の生物学的複製の平均値±S.E.M.である。
長期処理(14日間)後、個々の化学物質は有意な影響を及ぼさなかったが、LOAEC-syn濃度で類似のMoA化学物質(「3-Sim」)および「All」との混合物は、有意ではないものの、SYPレベルの上昇、PSD95およびその重なり(シナプスのマーカー)の増加傾向を促進した(図6b、dおよびAdditional file 3: Figure S7D-F)。注目すべきは、LOAEC/2-synでは、PSD95レベルは有意に変化しなかったが、BPAの単独処理および「3-Sim」混合物ではSYPレベルの増加が観察されたことであり(追加ファイル3:図S7E、黒い曲線)この条件下ではBPAがシナプス形成を増加させる主な要因であることが示唆された。
ニューライトの伸長
3日後、「3-Sim」混合液は「3-Diss」混合液よりも神経突起の長さと神経突起あたりの分岐点の数を抑制し(LOAEC/4-neu時点ですでに、図7aおよびc、およびAdditional file 3: Figure S8AおよびB、青の曲線)「3-Diss」および「All」混合液では神経突起数/ニューロンが減少した(LOAEC/4-neu時点ですでに、図7aおよびAdditional file 3: Figure S8C)。注目すべきは、CPF単独のLOAEC/2-neuでは、「3-Sim」混合液の処理で観察された効果と同様の効果が得られたことであり、「3-Sim」および「All」混合液に含まれる他の化学物質の中で、CPFが最も高い神経毒性効果をもたらす可能性があることを示している(Additional file 3: Figure S8A-Cの黒い曲線)。一方、PCB138は、LOAEC/4-neuですでに神経突起の長さと分岐点の数をわずかに増加させることがわかった(青の曲線、Additional file 3: Figure S8A, B)。このことから、PCB138は、3日間の処理後、「3-Diss」と「All」の両方の混合物において、相反する効果を引き起こす可能性があることが示唆された。神経突起の減少が観察されたにもかかわらず、興味深いことに、β-III-tubulin+ニューロンの割合は、主に「3-Sim」混合液に暴露された際に上昇し(LOAEC/2-neu濃度で26±4%)個別に試験したCPFで誘発された上昇と同等のレベルであった(Additional file 3: Figure S8D)。6種類の化学物質を含む混合物では、LOAEC/2-neu濃度でのみ、β-III-チューブリン+ニューロンの統計的に有意な発現が誘導された(24±4%、Additional file 3: Figure S8D, red curve)。逆に、「3-Diss」混合液をすべての濃度で3日間曝露しても、神経細胞数の有意な変動は見られなかった(Additional file 3: Figure S8D)。
図7 神経突起伸長に対する混合物の影響

hiPSC由来NSCsを7DIV分化させた後、単一化学物質(BPA、CPF、鉛、Methyl-Hg、PCB138,VA)および3種類の混合物を3日間(a、c)または14日間(b、d)処理した。(i)3種類の類似したMoA化学物質との混合物(「3-Sim」と表示)(ii)3種類の類似しないMoA化学物質との混合物(「3-Diss」と表示)(iii)6種類の化学物質すべてとの混合物(「All」と表示)。(a, b) LOAEC/4-neu濃度で処理した際の神経突起の長さ(黒)分岐点/神経突起の数(灰色)神経突起/ニューロンの数(紫の曲線)を分析したグラフ(表3参照)。(c, d) 神経突起伸長関連混合物(LOAEC/4-neu濃度)で3日間(c)または14日間(d)処理し、β-III-チューブリン(赤)で染色した細胞の代表的な免疫細胞化学画像(10倍の倍率、40倍の倍率の挿入図は神経突起の検出のために適用したマスクを示す)。すべてのサンプルは、溶媒のみを含む培地(0.1%DMSO、Ctr)で正規化した。データは、3-4回の生物学的複製の平均±S.E.M.で表した。
神経突起伸長パラメータの減少は、14日間の長期処理後にさらに顕著となり(図7b、d)「3-Sim」混合液ではLOAEC/4-neuですでに神経突起長の減少が最も大きくなっていた(Additional file 3: Figure S8E, dark blue curve)。注目すべきは、「3-Sim」混合液による神経突起の長さおよび神経突起の分岐点の数に対する抑制効果は、「All」混合液による抑制効果よりもさらに顕著であったことである(Additional file 3: Figure S8E, F. の黒および紺色の曲線を参照)。これは,VA(「All」混合液には含まれているが,「3-Sim」混合液には含まれていない)による逆効果によるものと考えられるが,VAは個別に試験したところ,神経突起の伸長を増加させることがわかった(LOAEC/2-neu時,Additional file 3: Figure S8E, Fの黒い曲線)。β-III-tubulin+神経細胞の割合を分析したところ、LOAEC/2-neuにおいて、3種類の混合物で処理すると、それぞれの時点で個別の化学物質または溶媒で処理した細胞と比較して、増加した(それぞれ、「3-Sim」で55±7%、「3-Diss」で44±2%、「All」で49±3%)(Additional file 3: Figure S8H)。一方、GFAP+細胞(アストロサイト)の割合は、どの混合液を使用しても有意に変化しなかった(図示せず)。
これらの結果を総合すると、「3-Sim」と「All」の混合液を14日間投与した場合、CPF(次いでLead)が神経突起伸長を低下させる主な要因であり、「3-Diss」と「All」の混合液に含まれるVAによって一部相殺されるのではないかという仮説が考えられる。
CPFとVAがそれぞれ神経毒性の主な原因であり、混合物の中で主な相殺効果を持つ化学物質であると考えられるかどうかを確認するために、細胞を14日間処理した。(i) 「3-Sim」混合液とBPAおよび鉛のみの混合液(CPFを含まず、類似のMoA化学物質)(ii) 「3-Diss」混合液とメチル-HgおよびPCB138のみの混合液(VAを含まず、類似のMoA化学物質)(iii) 「All」混合液とBPA、鉛、メチル-HgおよびPCB138の混合液(CPFおよびVAの両方を含まず)。この実験では、14 日間の処理後の神経突起伸長の測定に関連する LOAEC/2-neu および LOAEC/4-neu 濃度を検討した(表 3 参照)。得られたデータによると、元の「3-Sim」混合液と比較して、CPFの添加により、LOAEC/2-neu濃度では、生細胞数が23±7%増加した(DAPI+非pyknotic nuclei)(Additional file 3: Figure S9A, B, black bars)。また、LOAEC/2-neu濃度でVAが存在しない場合、生細胞数は31±5%(対「3-Diss」混合液)増加し(追加ファイル3:図S9A、B)両化学物質が存在しない場合、「All」混合液と比較して2.5倍増加した(LOAEC/2-neu濃度、追加ファイル3:図S9A、B)。
CPFを除去すると、「3-Sim」混合液と比較して、神経突起の長さ(追加ファイル3:図S9C、黒棒)および分岐点/神経突起の数(追加ファイル3:図S9D、黒棒)はいずれもわずかに増加しただけであった(有意ではない)。さらに、「3-Sim」混合液では増加していた神経突起数/ニューロン(LOAEC/2-neu、追加ファイル3:図S8G参照)が、CPFの非存在下ではわずかに減少していた(追加ファイル3:図S9E、黒棒)。
一方、VAの非存在下では、神経突起の長さと分岐点の数/神経突起の両方が、オリジナルの「3-Diss」混合効果と比較して減少した(それぞれ14±3%、7±4%)(Additional file 3: Figure S9C, D, black bars)。同様の効果は、VAとCPFの両方を「All」混合液から取り除いた場合にも見られ、「All」混合液と比較して、神経突起の長さが15±4%、分岐点が17±5%、さらに神経突起/ニューロンが23±3%減少した(Additional file 3: Figure S9C-E, black bars)。これらの差は、LOAEC/4の濃度で処理した場合には非常に小さいものとなった(一般的には有意ではない)(Additional file 3: Figure S9C-E, blue bars)。
これらのデータから、混合液で観察された神経突起の特徴(神経突起の長さや分岐点/神経突起)の減少をVAが真に打ち消している可能性が示唆された。一方、混合液からCPFを取り除くと、神経突起の伸長の減少をわずかに戻すことができるようだ。
BDNFレベル
BDNFレベルは、「3-Diss」混合液(LOAEC-bdnfで17±3%増加)と比較して、「3-Sim」混合液(LOAEC-bdnfで28±5%増加)と「All」混合液(LOAEC-bdnfで26±8%増加)の両方に3日間暴露した後、上昇していることがわかった(赤い曲線、図8a)。LOAEC/2-bdnfでは、「すべて」の混合液にさらされた場合にのみ、BDNFのアップレギュレーションが観察された(25±4%の増加)(黒の曲線、図8a、c)。
図8 BDNF レベルに対する混合物の影響

hiPSC 由来 NSCs を 7DIV 分化させた後、単一の化学物質(BPA、CPF、鉛、Methyl-Hg、PCB138,VA)または 3 種類の混合物を 3 日間(A、C)または 14 日間(b、d)処理した。(i)類似した3種類のMoA化学物質との混合物(「3-Sim」と表示)(ii)類似しない3種類のMoA化学物質との混合物(「3-Diss」と表示)(iii)6種類全ての化学物質との混合物(「All」と表示)。(A, B) LOAEC-bdnf(赤の曲線、3日後の処理のみ)およびその連続希釈液(それぞれ黒(LOAEC/2-bdnf)および青(LOAEC/4-bdnf)の曲線)で、単一の化学物質または混合物で処理した際に測定したBDNFの総量を示すグラフ。(c, d) BDNF関連混合物(LOAEC/2-bdnf濃度)で3日(c)または14日(d)処理し、β-III-チューブリン(赤)およびBDFN(緑)を染色した細胞の代表的な免疫細胞化学像(10倍の倍率、40倍の倍率で挿入)。分析にあたっては、すべてのサンプルをそれぞれの時点での溶媒対照(0.1%DMSO、Ctr)で正規化した。データは3-4回の生物学的複製の平均±S.E.M.である。
14日間の曝露後、LOAEC-bdnf(すなわちLOAEC/2-bdnf)以下の濃度では、CPF単独が最も強くBDNFレベルを誘導し(53±9%増加)次いで鉛およびメチル水銀が続いた(図8b)。このBDNFレベルの増加は、「3-Sim」(45±6%増加)および「All」混合物(61±7%増加)で処理したときに観察されたものと同程度であった(図8bの黒い曲線)(代表的な画像を図8dに示す)。一方、「3-Diss」混合液で処理した場合、BDNFレベルの増加はわずかであった(20±5%増)(有意ではない)(図8b)。これらの結果は、CPFが「3-Sim」および「All」混合物によって誘発されるBDNFレベルの増加の主な要因である可能性を示唆している。
表4は,各混合物および各測定エンドポイントについて算出したLOAECとともに,最も顕著な効果をまとめたものである。
表4 各時間間隔および発達神経毒性エンドポイントに固有の主効果および混合物関連LOAEC
| 3日 |
「3-シム」 同様のMoA |
「3-Diss」 異なるMoA |
‘すべて’ |
|
シナプス形成 (SYP、PSD95) |
⇑SYPt ⇑シナプス (LOAEC / 4-syn) BPA、CPF |
⇑SYPt ⇑シナプス (LOAEC / 4-syn) メチル-Hg、PCB138 |
⇑SYPt (LOAEC / 4-syn) BPA、CPF、メチル-Hg、PCB138 |
| 神経突起伸長とニューロンの割合 |
⇓n。分岐点 ⇓神経突起の長さ (LOAEC / 4-neu) ⇑β-III-チューブリン+ニューロン(LOAEC / 2-neu) CPF |
⇓n。神経突起/ニューロン (LOAEC / 4-neu) PCB138(対抗) |
⇓n。神経突起/ニューロン (LOAEC / 4-neu) ⇑β-III-チューブリン+ニューロン(LOAEC-neu) CPF PCB138(対抗) |
| BDNFレベル |
⇑総BDNF (LOAEC-bdnf) |
⇑総BDNF (LOAEC-bdnf) |
⇑総BDNF (LOAEC / 2-bdnf) |
| 14日間 |
「3-シム」 同様のMoA |
「3-Diss」 異なるMoA |
‘すべて’ |
|
シナプス形成 (SYP、PSD95) |
⇑SYPt (LOAEC / 2-syn) BPA |
⇔ |
⇑SYPt (LOAEC-syn) BPA |
| 神経突起伸長とニューロンの割合 |
⇓神経突起の長さ (LOAEC / 4-neu) ⇑β-III-チューブリン+ニューロン(LOAEC / 2-neu) CPF、リード |
⇓n。分岐点 ⇓神経突起の長さ ⇑β-III-チューブリン+ニューロン (LOAEC / 2-neu) メチル-Hg、PCB138、 VA(対抗) |
⇓n。分岐点 ⇓神経突起の長さ ⇑β-III-チューブリン+ニューロン (LOAEC / 2-neu) CPF、鉛、メチル-Hg、PCB138 VA(対抗) |
| BDNFレベル |
⇑総BDNF (LOAEC / 2-bdnf) CPF、リード |
⇔⇑総BDNF (LOAEC / 2-bdnf) メチル-Hg |
⇑総BDNF (LOAEC / 2-bdnf) CPF、鉛、メチル-Hg |
混合物における毒性の主な要因と仮定される化学物質を表44に示す。示されている場合、VA および PCB138 は相殺効果をもたらす可能性がある。
数学的モデリングによる混合物の影響の評価
テストした3種類の混合物に含まれる個々の化学物質の効力を評価するために、材料と方法に記載されているように、各発達神経毒性エンドポイントについて、混合物に使用されている濃度を考慮した単一化学物質のベンチマーク反応(BMR)を計算した。この方法により,BMRで表される単一化学物質の効力と,混合物の効果に対する個々の貢献度(未処理のコントロールに対して正規化)を評価することができた。試験した混合物の効果がしきい値(TU≦1)以下で、観察された混合物の反応が5%以上であれば、相乗的な相互作用があることが示唆された。注目すべきは、この方法を適用した結果、シナプス形成にのみ相乗効果が確認できたことである。特に以下の特徴(実線の矢印)については、3-Sim混合液をLOAEC/2-synで処理した場合の総SYP(図9a)および3-Diss混合液をLOAEC-synで処理した場合の総PSD95(図9b)3-Sim混合液をLOAEC-synで処理した場合の総PSD95(図9d)である。9b)3-Diss混合液をLOAEC/2-synで処理した場合(図9e)および全混合液をLOAEC-synで処理した場合(図9h)の全PSD95;3-Diss混合液をLOAEC/2-synで処理した場合(図9f)および全混合液をLOAEC/2-synで処理した場合(図9i)のシナプス。
図9 シナプス形成のためのベンチマーク反応(BMR)
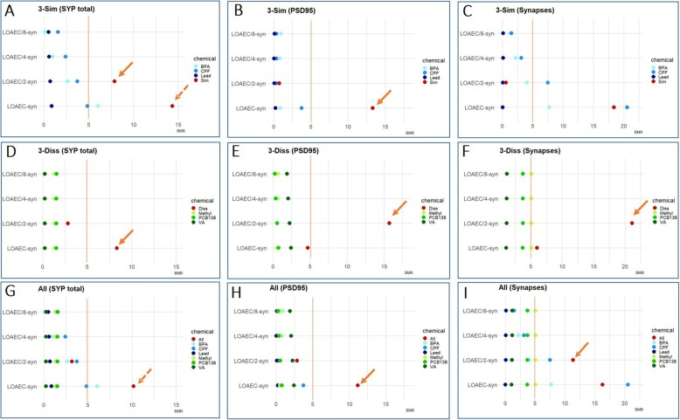
混合物(a-cでは「3-Sim」、d-fでは「3-Diss」、g-iでは「All」)で使用した濃度を考慮して計算した単一化学物質のBMRの絶対値をプロットし、シナプス形成の各特徴について混合物で実験的に観察された反応の絶対的なパーセンテージ(コントロールに正規化)と比較している:SYPの総量(a、d、g)PSD95の総量(b、e、h)シナプスの数(c、f、i)。オレンジ色の線は、Toxic Unit (TU) = 1に対応する5%の閾値を示している。このアプローチによると、単一化学物質の寄与率に基づいて計算されたTUが1以下で、混合物で実験的に観察された反応の割合が1以上の場合、相乗効果が予測される(実線の矢印で強調)。これは以下の条件で観察された。SYP総量:3-Sim混合液をLOAEC/2-synで処理した場合(a)と3-Diss混合液をLOAEC/2-synで処理した場合(d)PSD95総量:3-Sim混合液をLOAEC/2-synで処理した場合(b)3-Diss混合液をLOAEC/2-synで処理した場合(e)と全混合液をLOAEC/2-synで処理した場合(h)シナプス:3-Diss混合液をLOAEC/2-synで処理した場合(f)と全混合液をLOAEC/2-synで処理した場合(i)である。
一方、他のすべての発達神経毒性項目、特に神経細胞のβ-III-tubulin+細胞の割合(図10a、e、i)神経突起伸長関連の特徴(図10b、c、d、f、g、h、j、k、l)および総BDNFレベル(図11a-c)については、計算されたTUが1を超え、相乗効果をモデル化することができなかった。
図10 神経細胞の割合と神経突起の伸長に関するベンチマーク反応(BMR)

混合液で使用された濃度を考慮して算出した単一化学物質のBMR絶対値(a-dは「3-Sim」、e-hは「3-Diss」、i-lは「All」)をプロットし、それぞれの神経細胞のエンドポイントについて混合液で実験的に観察された反応の絶対的な割合と比較している(コントロールに正規化)。β-III-tubulin+の割合(a、e、i)神経突起の長さ(b、f、j)分岐点/神経突起の数(c、g、k)神経突起/ニューロンの数(d、h、l)。これらの評価項目について、単一化学物質の寄与を評価したところ、5%の閾値を超える反応が得られた(TU > 1)ため、このモデルでは混合効果を予測することはできない。ただし,オレンジ色の破線の矢印で示したように,混合物によって誘発された反応が個々の化学物質の寄与よりも少なくとも2倍以上大きい場合には,複合的/増強された混合物効果を仮定することができる。
図11 BDNFタンパク質レベルのベンチマーク反応(BMR)

混合物で使用した濃度に基づく単一化学物質の絶対BMR(aでは「3-Sim」、bでは「3-Diss」、cでは「All」)をプロットし、BDNFについて混合物で実験的に観察された反応の絶対割合と比較した(コントロールに正規化)。計算されたTUは1を超えていたが、オレンジ色の破線の矢印で示したように、混合物によって誘発された反応が個々の化学物質の寄与よりも少なくとも2倍以上大きい場合には、複合的/増強された混合物効果が仮説として考えられる。
加算濃度法や TU モデルはこれらの他の評価項目には適用できないが,混合物によって誘発される反応が個々の化学物質の寄与よりも少なくとも 2 倍以上大きい場合には,複合的/増強された混合物効果があると仮定した。この仮説は,特に以下の発達神経毒性エンドポイントで検討した(破線の矢印で示す)。LOAEC-synにおける3-Simおよび全混合物処理時のSYPレベル(図9aおよびg);LOAEC/2-neuにおける3-Sim混合物処理時のβ-III-tubulin+細胞の割合(図10a)LOAEC/2-neuにおける3-Diss混合物処理時のβ-III-tubulin+細胞の割合(図10e)およびLOAEC/2-neuにおける全混合物処理時のβ-III-tubulin+細胞の割合(図10i)。10i)3-Sim混合液をLOAEC/2-neuおよびLOAEC/4-neuで処理したときの神経突起の長さ(図10b)3-Sim混合液をLOAEC/2-neuで処理したときの分岐点/神経突起の数(図10c)3-Diss混合液をLOAEC/2-bdnfで処理したときのBDNFレベル(図11b)。
これらのデータを総合すると、シナプス形成は、化学物質による影響に最も敏感な発達神経毒性のエンドポイントであることが、実験データと数理モデルの両方で確認された。一方、神経細胞率、神経突起伸長、BDNFレベルに対する混合物の相乗効果の誘発は、数学的モデリングでは確認できなかったが、上述のように、これらの発達神経毒性エンドポイントに対する混合物の複合的/増強された効果が、実験データに基づいて仮説として立てられる。
考察
この試験管内試験研究で報告されたデータは、異なるクラス(工業化学物質、農薬、ED、医薬品、POPs)の個々の化学物質が(ヒトへの暴露に関連する)非常に低い細胞毒性濃度であっても、混合物中では発達神経毒性を示す可能性があることを示唆している。これらの結果は、単一の化学物質による毒性試験では不十分であることを示している。なぜならば、混合物への曝露はより高いレベルの毒性をもたらし、また、妊婦、乳児、子供を含む人間集団は、明らかに複数の化学物質に同時に曝露されているからである。言い換えれば、個々の化学物質のテストは、現実の暴露を反映していないということである。今回の研究で示されたように、神経細胞の形態分化やシナプスの形成(シナプス形成)などの主要な神経発達過程は、化学物質の混合物によって影響を受ける脆弱な段階であり、特に同様のMoAを介して作業する場合には注意が必要である。実際、急性投与(3日間)後に、類似のMoA混合物(「3-Sim」)および6種類の化学物質をすべて含む混合物(「All」)で処理すると、シナプス前(SYP)およびシナプス後(PSD95)のタンパク質レベルの増加が観察された(図6および追加ファイル3:図S7A、B、D、E)。注目すべきは、SYPまたはPSD95がそれぞれの時点でコントロール培養で見られたレベルよりも増加した場合、BPA[43]、VA[44]、周産期鉛曝露[45]などの単一化学物質への曝露ですでに報告されているように、シナプス形成が変化し、続いてニューロンネットワーク機能が異常になっている可能性を示していることである。これらの影響は,「3-Sim」と「All」の混合液では,14日間の曝露でより顕著に現れた。これは,おそらく,存在する化学物質に繰り返し曝露することで,複合的な影響が誘発されたことに関連していると考えられる。さらに、混合液の暴露により、シナプスのバイオマーカーであるSYP/PSD95の共局在は、主に神経突起レベルではなく、細胞体レベルで見られた(Additional file 3: Figure S7C, F)。
さらに、シナプス形成の変化は、同じ「3-Sim」化学物質(「MoA」化学物質よりも強力)の曝露後、特に14日間の曝露後に見られた神経突起伸長の減少にも起因すると考えられる。重要なことは、CPF単独の作用は、「3-Sim」および「All」の混合物による作用と有意な差がなかったことである(神経突起の長さおよび分岐点の数など、Additional file 3: Figure S8E, F参照)。このことは、これらの特定の発達神経毒性の特徴(シナプス形成の変化および神経突起伸長の減少)については、試験された曝露条件において、CPF(次いで鉛)が「3-Sim」混合物の毒性の最も妥当な要因であると考えられる。CPFは、他の有機リン剤と同様に、主にアセチルコリンエステラーゼ(AChE)の阻害によって作用する。しかし,いくつかの研究では,低濃度の場合,コリンエステラーゼ以外のメカニズムで作用することも示されている。CPFは、大脳皮質および海馬の初代ニューロンにおいてCREBのリン酸化を増加させ[46]、PC12細胞[47]およびラット胚性交感神経細胞の初代培養物において神経突起伸長を阻害する[48]。
表4に示すように、「3-Sim」混合物に分類された化学物質(BDNFの変化に関連する)が誘発する効果は、全体として、6種類の化学物質すべてを混合した場合と同程度の強さであることが多いが、3種類の異種化学物質を混合した「3-Diss」混合物は、それほど強力ではない。注目すべきは、混合物の相乗効果を特定するために濃度加算法とTUモデルを厳密に用いることは、本研究で分析した発達神経毒性エンドポイントの一部(すなわち、神経細胞の割合、神経突起の伸長、BDNFレベル)に対する混合物効果を予測するのに適した戦略ではないかもしれないということである。この現象は、シナプス形成、神経突起伸長、BDNF レベルが、培養時間に応じて大きく変化する動的で生物学的に複雑なプロセスであり、その結果、調査対象の化学物質によって非単調な変調が引き起こされることを考慮すると、ある程度予想されたことである。
数学的モデリングを用いても、これらの発達神経毒性エンドポイントに対する混合物の相乗効果を予測することはできなかったが、個々の化学物質のBMRと観測された混合物の反応を比較すると、特に3-Sim混合物に曝露した場合には、神経細胞の割合、神経突起の伸長、BDNFレベルにおいて、複合的な/増強された効果が誘発されることが示唆された。
例えば、チューブリン単量体上のコルチシン結合部位に結合して微小管形成を阻害する化学物質は、個々の化学物質が閾値レベル(またはそれ以下)で存在していても、CHO-K1細胞で濃度付加を誘発した[49]。実際、類似のMoAを介して作用し、同じシグナル伝達経路を標的とする化学物質は、より強力かつ不可逆的に細胞の防御・回復メカニズムを損なう可能性がある。しかし,この仮説を裏付けるためには,さらなる研究が必要である。
注目すべきは、6種類の化学物質をすべて含む混合液は、MoA混合液に比べて神経突起の長さと分岐点の数に対する悪影響が少ないことであり(図7,および追加ファイル3:図S8E、F)このことは、「すべて」の混合液中のVAの存在が反対の効果を引き起こす可能性を示唆している。実際,VAは,マウスのアルツハイマー病モデル[50]やヒトの神経芽細胞腫細胞[51]などで示されているように,神経突起の伸長を促進することがわかった(LOAEC/2-neuにおける神経突起の長さおよび分岐点/神経突起の数の両方の増加)(Additional file 3: Figure S8E, F)。
さらに、LOAEC-neu(LOAEC/2-neu)以下の濃度のCPF、Methyl-Hg、PCB138を個別に投与した場合、14日間の曝露後に神経突起数および神経細胞の割合が減少したのに対し、混合液では、特に「3-Sim」混合液において、神経突起の増加(~17%)および神経細胞の有意な増加(~55%)に示されるように、反対の(相乗効果の可能性のある)効果が得られた(Additional file 3: Figure S8G, H, 黒い曲線)。神経細胞の割合が増加したことは、神経突起の数が増加した(ただし、短くて分岐していない)ことを特徴としており、シナプス形成の変化(シナプス前後のマーカーのレベルが上昇したり、共局在化が見られなかったりすること)に寄与していると考えられる。
これらの試験管内試験の結果は、小児の神経発達障害に関する研究と一致している。例えば,自閉症児の前頭前野では,健常対照児に比べて神経細胞数の増加(約67%)が確認されており[52],自閉症児由来の神経細胞では,神経突起が短く,枝分かれしていないなど,神経突起の形態が損なわれていた[53, 54]。さらに,自閉症スペクトラム障害(ASD)のハイリスクとされる遺伝子の約80%は,初期の神経発達機能,特に神経突起の伸長とシナプスの形成に重要な役割を果たしている[55]。
上記の変化(神経細胞数の増加,神経突起数の増加,シナプス形成の変化)は,観察されたBDNFレベルの増加と関連している可能性がある。実際、同様のMoA化学物質(BPA/CPF/鉛)は、BDNFレベルを上昇させ、この増加は、6種類の化学物質すべてを併用することで、さらに顕著になった(図8)。BDNFは、神経突起の伸長、興奮性、シナプスの可塑性を調節し、神経細胞の生存と保護を促進することが知られている[56, 57]。さらに,ASD患者では,末梢血[58]と前頭葉皮質[59]の両方でBDNFレベルが上昇していることが報告されており,最近のメタアナリシスでも確認されている[60, 61]。
これらを総合すると、タンパク質レベルでのBDNFの増加、短くて分岐の少ない神経突起を特徴とする神経細胞の割合の増加、およびシナプス形成の変化は、このヒト試験管内試験モデルが「3-Sim」および「All」の混合物への曝露によってASDに類似した表現型の誘発を可能にすることを示唆している(単一化学物質への曝露では観察されない)。自閉症児の発達中の脳で観察された細胞の変化と本研究で得られた試験管内試験の結果との間に相関関係があることから、本アプローチは、発達神経毒性効果を引き起こす可能性のある混合化学物質を特定するための信頼できる戦略であると考えられる。このアプローチは、神経細胞分化の主要な段階を再現したヒトiPSC由来の神経細胞と胃細胞の混合培養と、発達神経毒性 AOPネットワークのCKEに固定された試験管内試験のアッセイに基づいている。
MRAに関するこれまでの発達神経毒性研究では,PCB(発生途上のラット腹側中脳と線条体の有機型共培養物[62]),ポリブロモジフェニルエーテル(マウス小脳顆粒ニューロンとアストロサイトの共培養物[63]),あるいは金属のみの混合物(周産期に暴露されたラットとラット初代アストロサイト[64])など,1種類の化学物質のみを含む混合物の複合的な影響を記述し,相加的あるいは相乗的な影響を強調している。また、メチル水銀やPCBなどの異なるクラスの化学物質との混合物については、相加効果も相乗効果もないと報告しているものもあり(例えば[65, 66])混合物と個別に試験した化学物質とを比較しても発達神経毒性効果に違いは見られなかった。ここでは、実際の暴露をより現実的に表現するために、意図的に異なるクラスの化学物質を選択した。
もう一つの興味深い観察結果は、単一化学物質と混合化学物質の両方を用いたアッセイにおけるLOAEC濃度の比較から得られたもので、シナプス形成の変化は、神経突起の伸長やBDNFレベルの変化よりも感度の高い発達神経毒性エンドポイントであることを示唆している。単一化学物質の場合、シナプス形成に特異的なLOAEC(最小毒性濃度)(LOAEC-syn)は、鉛(0.007 μM)が最も低く、次いでメチル水銀(0.26 μM)PCB138(5.9 μM)BPA(28.9 μM)CPF(37. μM)BPA(28.9μM)CPF(37.1μM)VA(420μM)であり、14日間の暴露では同等または場合によってはさらに低い値となった(BPA:12.74μM、CPF:21μM、鉛:0.007μM、メチル-水銀:0.05μM、PCB138:0.06μM、VA:2.1μM)(表3参照)。
混合物のLOAECsに基づくと(表4)やはりシナプス形成が最も感度の高い発達神経毒性エンドポイントであることが判明した。実際,「3-Sim」化学物質を3日間曝露した後,シナプス形成に関するLOAEC値はLOAEC/4-synと同等であった(すなわち,鉛:0.0018μM,CPF:9.28μM,BPA:7.24μM).しかし,14日後のLOAEC濃度はLOAEC/2-syn(鉛:0.0037μM,CPF:10.5μM,BPA:6.3μM)とわずかに高く,これは2週間の反復処理で防御機構が誘導され,適応的な変化が生じたためと考えられた。シナプス形成の感度が高いことは、数学的モデリングによっても確認され、混合物がシナプス形成に関連する特徴の一部に及ぼす相乗効果を予測することができた(図9,実線の矢印)。例えば、臍帯血中の鉛の濃度は0.004〜0.13μM、メチル水銀は0.003〜0.14μM、VAは27〜500μMの範囲とされている(表1)。一方、ヒトの試料から検出された BPA、CPF、PCB138 の濃度は、本研究および他の 試験管内試験 研究でテストされた濃度(BPA [67, 68]、CPF [26, 69]、PCB138 [70]など)よりも低かった。臍帯血中の BPA 濃度は 0.009μM、子供の血清中の濃度は 0.004~0.1μM であると報告されている(すなわち、14 日間の治療で使用された濃度の約 60 倍低い)。PCB138は4-5×10-4μMの範囲(すなわち、約100倍低い)CPFは〜7×10-6と0.013μMの範囲(すなわち、少なくとも1000倍低い)で検出されている(表1)。しかし、これらの化学物質が発達中の脳に到達する実際のレベルや、長年の暴露による蓄積の可能性については不明である。Sharma らは,妊娠期間中の胎児における BPA のトキシコキネティックプロファイルを予測す る妊娠生理学的薬物動態学(P-PBPK)モデルを開発した[71].血液脳関門を通過した化学物質の脳内濃度を予測するためには,他の環境化学物質の吸収,分布,代謝,排泄(ADME)や,発達中の脳に到達して蓄積する能力を推定する同様のモデルが必要である.
我々の知る限り、本研究は、異なるクラスの化学物質の混合物への曝露によって引き起こされる発達神経毒性効果について、ヒトの試験管内試験モデルを用いて報告した最初の研究であり、現在入手可能な発達神経毒性 AOPsで特定されているKEに基づいたアッセイ(シナプス形成、神経突起伸長、BDNFレベルの変化など)を行い、数学的モデリングによって裏付けられている。これらのエンドポイントにより、同様のAO(子供の学習・記憶障害や認知障害など)につながる発達神経毒性のAOPネットワークで特定された共通のKEを評価することができた[14]。個々のAOPは同じクラスに属する化学物質によって誘発される可能性が高いが、単一のAOPが相互に接続された経路を介してネットワーク(図1)に集合することは、より現実的なシナリオを表していると考えられる[14]。本研究では、CKEを用いて試験管内試験法を選択し、学習・記憶障害/認知機能障害(AO)に関与するシグナル伝達経路をより包括的に理解することができた。得られた結果は、予想された変化のパターンを確認するものであり、これらのデータは、関連するKERの記述を更新し、半定量的な理解を可能にするために使用することができる。ここで説明したアプローチは、AOPネットワークが単一の化学物質だけでなく、化学物質の混合物の試験にも適用できることを示す重要な例となっている[72]。基盤となるAOPネットワークに組み込まれたメカニズム的知識は、生成された試験管内試験データの科学的信頼性を高め、規制目的での受け入れを促進することが期待される。
最近の疫学研究によると、他の神経発達障害(注意欠陥多動性障害(ADHD)自閉症、IQ低下など)とともに、この有害な結果がますます多くなっており、環境化学物質への曝露がこれらの疾患の発症に寄与している可能性があるため、我々は子供の学習・記憶障害/認知能力の低下に焦点を当てた[1, 73]。さらに、学習・記憶テストは規制対象となる発達神経毒性試験で要求されるエンドポイントであり、現在はOECD TG 426に準じてネズミを用いて実施されている(トリガーされた場合)[74]。しかし、EFSAの科学的意見[75]によると、ガイドラインの方法論に従った学習・記憶評価は柔軟性に欠け、その感度も様々であるため、いくつかの影響が検出されないままとなる可能性がある[76]。さらに、最近、様々な関係者(規制機関、学界、産業界)の間で、化学物質の発達神経毒性可能性に関する試験を改善し、迅速化するためには、代替アプローチに基づく新しい試験の枠組みが緊急に必要であるというコンセンサスが得られている[34, 77]。この文脈において、得られたデータは、最近提案されたように、異なる規制目的のために、適用された試験管内試験アプローチがIntegrated Approaches to Testing and Assessment(IATA)に含まれる可能性を示唆している[16]。本研究で適用した一連の試験管内試験アッセイ(シナプス形成、神経突起伸長、BDNFレベル)とヒト神経細胞試験管内試験モデルの使用(異なる種間での外挿の必要性を回避)は、発達神経毒性効果、特に小児の学習・記憶障害を誘発する可能性のある化学物質を同定するための初期スクリーニングに適していると考えられる。
結論
今回得られた結果は、異なるクラスの化学物質(工業化学物質、農薬、ED、薬物、POPs)が、非細胞毒性や非常に低い細胞毒性濃度(ヒトへの曝露に関連する)で、混合物中で発達神経毒性を示す可能性を示唆している。ヒトの細胞を用いた試験管内試験モデルと、発達神経毒性 AOPsの主要なイベントに対応したアッセイを用いることで、子供の学習・記憶障害や認知障害に関わる毒性経路をより深く理解することができる。このような試験管内試験のアプローチは、得られたデータの科学的な信頼性を高め、現行のOECD 発達神経毒性 TG 426に組み込むことで、化学物質の評価を改善・迅速化し、特に最も普及している神経発達障害である子供の認知障害に関連する化学物質を特定することができる。