Contents
Arginine and Endothelial Function
www.mdpi.com/2227-9059/8/8/277/htm
要旨
アルギニン(L-アルギニン)は、タンパク質の生合成、宿主免疫応答、尿素サイクル、一酸化窒素産生など、多くの生物学的プロセスに関与するアミノ酸である。
この系統的なレビューでは、我々は、内皮機能と血管の調子の調節におけるアルギニンの機能的な役割に焦点を当てている。臨床研究と前臨床研究の両方が検討され、高血圧、虚血性心疾患、老化、末梢動脈疾患、糖尿病におけるアルギニン補給の効果を分析している。
キーワード
ADMA; アルギニン; アルギニンパラドックス; BH4; 血圧; COVID-19; 栄養補助食品; 内皮機能障害; 内皮; eNOSアンカップリング; 心不全; 高血圧; L-アルギニン; 心筋梗塞; NADPH; 一酸化窒素; 酸化ストレス; 末梢動脈疾患
1. アルギニンのプレオトロピック効果
L-アルギニン(以下、アルギニンと略す)は、健常者では合成できるが早産児では合成できないことから、準必須アミノ酸または条件付き必須アミノ酸である[1]。化学的には、アルギニンは2-アミノ-5-グアニジノペンタン酸である(図1)。その名前は、ギリシャ語のἄργυρος(銀)に由来し、硝酸アルギニン結晶の色を示す。
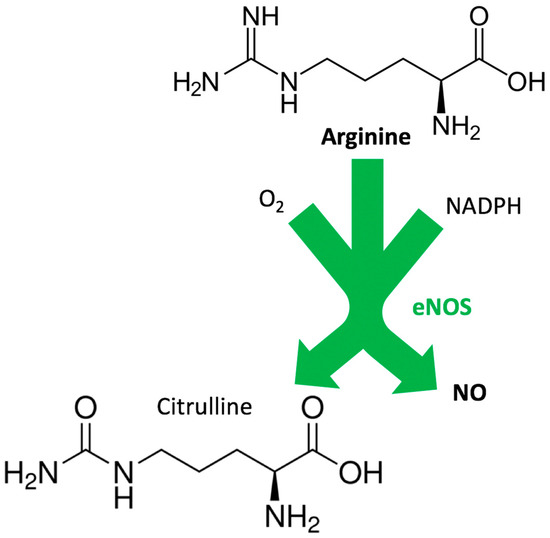
図1。一酸化窒素(NO)の合成におけるアルギニンの機能的役割。NADPH:ニコチンアミド-アデニンジヌクレオチドリン酸; eNOS:内皮NO合成酵素。
アルギニンは、いくつかの生物学的プロセスに関与している、それは他のアミノ酸の合成につながる一連の反応のための基質であり、それは2つの酵素、すなわち一酸化窒素(NO)合成酵素(NOS)とそれぞれNOと尿素の生成のために基本的であるアルギナーゼのための基質である。アルギニンは、内皮細胞によるNO産生の基質として作用することが知られており、このように血管の調子を調節し、全体的に、心血管系の恒常性を維持している[2]。
NOは、ニコチンアミド・アデニン・ジヌクレオチド・リン酸(NADPH)-フラビン・アデニン・ジヌクレオチド(FAD)とフラビン・モノヌクレオチド(FMN)を介したC末端還元酵素ドメインでの電子の移動を伴う反応で、酵素NOSによってアルギニンから合成される[3]。 4]-N 末端オキシゲナーゼドメインのヘムへのヘムへの結合では、図 1 に示すように、基質であるアルギニンがシトルリンと NO [5,6] に酸化される。アルギニンは、クレアチンやコラーゲン合成と同様に、T細胞の増殖や宿主免疫応答にも関与している[7,8,9,10,11]。
NOSには3つのアイソフォームがあり、そのうち2つは内皮性(eNOS)[12,13]と神経性(nNOS)[14,15,16]であり、3つ目は誘導性NOS(iNOS)[17,18,19]であり、サイトカインに反応して発現し、炎症反応に関連している[6,20]。NOの生成は2つのステップで起こる:第一に、NOSはアルギニンをNω-ヒドロキシ-アルギニンに水酸化する(これは酵素に大きく結合したままである);第二のステップでは、NOSはNω-ヒドロキシ-アルギニンをシトルリンとNOに酸化する[21,22,23,24,25,26,27,28,29]。
正常な状態では、NOSはアルギニン、O2、およびNADPH由来の電子のNOおよびシトルリンへの変換を触媒する(図1)。しかし、動脈硬化や糖尿病のような病理学的状態の存在下では、NOSの機能が変化し、酵素はO2のスーパーオキシド(O2-)への還元を触媒する。これは一般的に「NOS アンカップリング」と呼ばれる現象であり [30,31,32,33,34,35,36,37,38,39,40,41]、テトラヒドロビオプテリン(BH4、サプロプテリンとしても知られている)の限られたバイオアベイラビリティーとリンクしている[42,43,44,44,45,46,47]。
実際、過渡的なBH4-+ラジカルを生成するためのBH4による電子供与は、アルギニンのシトルリンへの酸化、およびNOSヘム触媒中心での鉄-鉄-NO錯体の形成に必要である[48,49,50,51]。BH4はGTPシクロヒドロラーゼI(GTPCH)によってグアニシン三リン酸(GTP)から合成され、ジヒドロ葉酸還元酵素によって7,8-ジヒドロビオプテリン(BH2)からリサイクルされる(図2)。
注目すべきことに、NOSは、NG-モノメチル-アルギニンまたはNG-ニトロ-アルギニン[52,53,54,55,56,57,58]のようなグアニジノ窒素原子で置換されたアルギニンアナログによって阻害される。
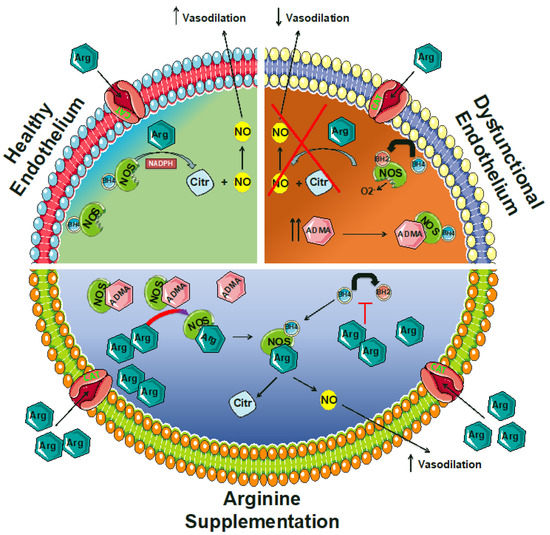
図2。内皮(dys)機能におけるアルギニンの機能的役割。ADMA:非対称ジメチルアルギニン、Arg:アルギニン、BH2:7,8-ジヒドロビオプテリン、BH4:テトラヒドロビオプテリン、CAT:カチオン性アミノ酸トランスポーター、シトルリン、NADPH:カチオン性アミノ酸トランスポーター、Citr. シトルリン;NADPH:ニコチンアミドアデニンジヌクレオチドリン酸;NO:一酸化窒素;NOS:NO合成酵素。
上述したように、尿素サイクルでは、アルギニンはマンガン金属酵素であるアルギナーゼによってオルニチンと尿素に変換される;このサイクルは、尿素の排泄を可能にするためだけでなく、酸/塩基の恒常性を維持するために重要な重炭酸塩を産生するためにも重要である[59,60,61,62,63]。
アルギナーゼは2つの異なる2つのアイソフォーム、アルギナーゼIおよびIIに存在し、それらは約60%の配列相同性を共有している;アルギナーゼIは主に肝臓に局在する細胞質酵素であるのに対し、アルギナーゼIIは広範囲に分布するミトコンドリア酵素であり、腎臓、前立腺、消化管、および血管系に発現している[64,65,66,67]。
アルギナーゼという酵素は、アルギニンと競合してNO産生を調節する重要な役割を果たしている。具体的には、アルギナーゼ活性の増加は、アルギニンのNOSに対するバイオアベイラビリティーの低下をもたらし、それによってNOの産生を減少させる可能性がある。このメカニズムは、障害された内皮機能の基礎となる必須因子として浮上している[68,69]。
具体的には、アルギナーゼ活性の増加は、高血圧、動脈硬化、糖尿病、および老化の多くの実験モデルにおいて、内皮機能障害と関連している[70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92]。
2. 生理状態におけるアルギニンとNO産生.アルギニンパラドックス
実際、内皮機能不全は、高血圧、アテローム性動脈硬化症、糖尿病、およびアテローム血栓症を含む、心血管系に影響を及ぼすいくつかの病理学的状態の主要な原因である[46,93,94,95,96,97,98,99,100,101,102,103,104,105,106,107,108,109,110,111,112,113,114,115,116,117,118,119]。
さらに、2020年4月には、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によって引き起こされるコロナウイルス疾患(COVID-19)で観察される全身性の症状が、内皮機能障害によって説明され得ることを示した最初のグループであった[120]。実際、内皮機能の変化は高血圧、糖尿病、血栓塞栓症、および腎不全と関連しており、これらはすべてCOVID-19患者では異なる程度に特徴づけられている [121,122,123]。
他の研究者も後に我々の見解を確認している [124,125,126,127,128,129,130,131,132,133]。これらの理由から、内皮機能に対するアルギニンの肯定的な効果に基づいて、我々はまた、COVID-19患者における対照的な内皮機能障害に対して、有害ではないが、アルギニンの補充が有用であり得ることを推測することができる。
アルギニン補充の潜在的な治療効果、特に心血管障害における関心の高まりは、最近になって現れてきた。障害された NO 合成は、機能不全の内皮の主な特徴と考えられている [107,134,135,136];しかしながら、いくつかの研究では、健康な被験者におけるアルギニン補給が NO 産生の有意な増加をもたらさないことが示唆されている [11,137,138,139,140]。
例えば、1 週間のアルギニンの毎日の管理は 12 人の健康な被験者の NO 生産、すなわち NO2・および NO3-の 2 つの確立された指標の血清濃度に影響を与えなかった[138]。別の研究では、20 人の健康な被験者が、持続放出型または即時放出型の両方で毎日アルギニンの補充を受けた;投与プロトコルの有効性を証明した血漿アルギニン濃度の有意な増加にもかかわらず、著者らは硝酸塩の尿中抽出における有意な差を観察しなかった[141]。
通常の条件下で有意な結果が得られなかった理由の一つは、NO合成機構が内因性アルギニンによって飽和しているように思われることである。実際、NO合成酵素のミヒャエルス・メンテン定数(Km)はマイクロモル範囲、具体的には2.9μmol/Lであり、Bredtら[142]によって実証されている。
健康なヒトで測定されたアルギニンの血漿中濃度は、このKmよりも15~30倍高いことから、基質の濃度がNO生成につながる酵素反応の非制限因子となっている。実際に酵素を生理学的に飽和させるそのような生化学的比率にもかかわらず、さまざまな研究はまた健康な被験体のアルギニンの補足の有利な効果を示している。
例えば、アルギニンの補足は運動選手で、血管拡張が筋力および回復を高める運動の間に筋肉潅流および栄養素/酸素の配達に寄与するようにテストされた[143]。議論の余地のある結果は、これらの研究から来て、時には筋肉のパフォーマンスのアルギニン補給の効果をもたらさず、時には運動能力[137,144,145,146,147,148]の有意な改善を示している。
「アルギニンパラドックス」として知られている現象は、このシナリオから生まれ、我々はアルギニンが内皮NOの生産に作用することができる代替的な方法に関する物語の一部を失っていたことを示している。
アルギニンのパラドックスはそれによって eNOS の Km を超過する 1 リットルあたり数百マイクロモルであるアルギニンの細胞内生理学的な集中にもかかわらず、外因性アルギニンの急性提供がまだ NO の生産を増加するという事実を指する[149,150,151]。
アルギニンパラドックスを説明するのに役立つかもしれないメカニズムの一つは、非対称ジメチルアルギニン(ADMA)、NOSの内因性阻害剤[152,153,154,155]の発見から来ている。アルギニンに似た構造を持つADMAは、NOS結合の直接の競合相手である。さらに、ADMAとアルギニンの両方は、カチオン性アミノ酸トランスポーター(CAT、別名「y+システム」として知られている)、塩基性アミノ酸の高親和性、Na+非依存性トランスポーター[156,157]を介して細胞内に輸送され、したがって、また、このレベルでお互いに競合している(図2)。
ADMAはNOSと細胞輸送のためにアルギニンと競合するので、NOのバイオアベイラビリティは2つの間のバランスに依存する[158]。ADMAの血漿中レベルは、高血圧、高コレステロール血症、糖尿病、およびアテローム性動脈硬化症の間に増加する[95,159,160,161,162,163,164,165,166,167,168,169,170]。
したがって、内因性アルギニンレベルの範囲にもかかわらず、それらは依然としてeNOSの飽和を保証するのに十分であり得、したがって、アルギニン/ADMA比は減少し、その結果、NO産生の正味の阻害をもたらすであろう[171,172,173]。
アルギニン/ADMA比は、動脈硬化性プラーク形成のリスクと同様に、NOのバイオアベイラビリティーの重要な指標であると広く考えられている[174]。この比率は、ADMA単独と比較して全死因死亡率のより良い予測因子であることが示されている[174,175]。
同様に、血漿ADMAレベルは高齢者集団における全死因死亡の有意な予測因子であったが、その効果はアルギニンレベルが高い被験者では消失し[176]、アルギニン/ADMA比(ADMA単独ではない)は高齢者集団における微小血管症関連脳損傷の有意な危険因子であった[177]。
アルギニン補給は、アルギニン/ADMA比を平衡化し、NOの産生を回復させることができる。言い換えれば、サプリメントの結果として増加したアルギニンの利用可能性は、eNOSを結合するADMAと競合する(図2)。この興味深いメカニズムは、増加したアルギニン利用可能性の有効性に光を当て、アルギニン補給のための更なる治療オプションを示唆している。
さらに、この現象は、ADMAレベルが研究集団で考慮されるべきであるとして、アルギニン補充研究についてのいくつかの矛盾した結果を説明することができる。具体的には、増加したADMA血漿レベルを有する心血管患者は、アルギニン補充の最良のターゲットであり得る。
アルギニンパラドックスの別の潜在的な説明は、アルギニンが細胞質内でコンパートメント化される可能性があり、NOS近傍の局所濃度は、全細胞ホモジネート中のアルギニンレベルから予想されるよりも低いかもしれないということである[178]。
3. 内皮機能障害のメカニズムとしてのNO産生障害とアルギニン介入
脂質異常症、耐糖能異常、喫煙、高コレステロール血症、および加齢を含む心血管系リスクの主要な決定因子は、内皮に直接影響を与えている [179,180,181]。これらの条件に血管系を曝露すると、高血圧、動脈硬化、糖尿病などの臨床的に関連する疾患への進行に進展し、寄与することができる初期の現象として、内皮の機能不全および変化を誘導する。
したがって、内皮は心血管系の生理学と病態生理において重要な役割を果たしている[182,183,184,185,186,187,188,189,190,191,192,193,194]。基礎となるメカニズムを理解し、内皮機能障害を予防または対抗するための治療戦略を特定するために、近年熱心な研究が行われている。
血管恒常性を調節する内皮の能力は、主にNO産生に依存しており、内皮血管拡張因子の障害は内皮機能障害の主な徴候であり、標的とすべきホットポイントとなっている。摂動した血管系における内皮NOの利用可能性の低下は、NOの合成低下に起因するか、間接的に、NO源を不活性化する活性酸素産生の増加に起因する可能性がある[195,196]。
酸化ストレスに対抗することに加えて、NO合成の刺激は、例えば、NO合成酵素に更なる基質を提供することによって、代替的かつ潜在的に効果的なアプローチを表している[197,198]。
理論的には、アルギニンの補充は、これらのニーズを満たしており、したがって、それは潜在的な治療戦略として多くの心血管障害でテストされている[199]。しかし、アルギニン補給に関するヒトの研究は、しばしば議論の源となっている。
実際、健康な被験者だけでなく、心血管障害に苦しんでいる患者では、血漿アルギニンのレベルは〜45から〜100μmol/L [137,200,201,202]、2.9μmol/L [203]のeNOS Kmよりも有意に高い範囲である。
内分泌機構もまた、アルギニンによって誘導される血管拡張に寄与する可能性がある。実際、アルギニンはランゲルハンス膵島からのインスリン [204,205,206] とグルカゴン [207] の両方の放出を刺激する。興味深いことに、アルギニンの静脈内注入は、健康なヒトで血管拡張とインスリン放出を誘導することが示されているが、インスリン分泌がオクトレオチドの共同注入によってブロックされたとき、血管拡張は発生しなかったが、一方で、血管拡張はインスリンの共同投与によって復元された[208]。
アルギニンの高用量静脈内投与(30g)は、成長ホルモン(GHs)および分泌を誘導することも示されているので、[209]、アルギニンによって誘導された血管拡張は、インスリン様成長因子-1を含むシグナル伝達経路を介してGHsによっても媒介される可能性がある[210,211]。
実質的なデータは、内皮機能障害が高齢者に非常に多いことを示している[212,213]。内皮機能障害はまた、加齢に伴う認知機能、身体機能の低下、さらには脳卒中、勃起不全、腎機能障害の病因にも関与している。加齢誘発性内皮機能障害におけるアルギニンの効果を試験した臨床試験では、議論の余地のある結果が得られている。
アルギニンの急性静脈内投与(1g/分、30分間)は、健康な高齢者において、内皮依存性血管拡張には効果がなかった[214]。同様に、アルギニンの静脈内投与は、若年者では腎血漿流量、糸球体濾過率、自然排泄、カリウレシスの有意な増加を誘導したが、高齢高血圧者では誘導しなかった[215]。
健康な閉経後女性を対象に実施された別の研究では、1 日 9g のアルギニンを 1 ヶ月間摂取した場合、血漿アルギニンは血流介在性拡張の有意な変化を伴わずに増加することが確認された[216]。逆に、健康な高齢者12名(年齢73.8±2.7歳)を対象としたプロスペクティブ、二重盲検、無作為化クロスオーバー試験では、慢性的なアルギニン補給(1日16g、2週間)により、アルギニンの血漿中濃度が著しく上昇し(114.9±11.6 vs. 57.4±5.0 mM)、内皮依存性血管拡張が有意に改善された[217]。
4. 高血圧におけるアルギニン補給
動物モデルにおける研究の大部分は、高血圧、特に塩感受性高血圧の存在下でのアルギニン補給の有益な効果を支持している。例えば、Dahl 塩感受性(DSS)ラットにおける経口 [218,219,220] および腹腔内 [221,222] の両方のアルギニン投与は、高塩食によって誘導される血圧の上昇を防ぐことが示された。
しかし、アルギニンは3週間高塩で前処理されたDSSでは効果的ではなかった[218]、アルギニンは、それが初期段階にあるときに高血圧を予防し、打ち消すことができることを示唆しているが、おそらくいくつかの変化や病理学的リモデリングがすでに発生しているときにはなかった。
アルギニン補給の結果はまた、投与方法に依存することができる。例えば、アルギニンの腎髄間質注入は、高塩分処理ラットでは血圧の上昇を防ぎ、血漿アルギニンの同様の上昇を得るために必要な静脈内投与量は血圧に影響を与えない[223]。1型糖尿病のラットモデルでは、4週間のアルギニン経口投与後に血圧の重要な低下を示している[224];アルギニン経口投与はフルクトース誘発性高血圧を予防する[225]。アルギニン経口投与は、自然発症高血圧ラットでは、腎障害を著明に減少させるが、高血圧を是正しない[226]。
高血圧におけるアルギニン補給の有益な効果は、主にNO合成への影響に起因するように見えるが、アルギニンはまた、抗酸化特性を有することが示されており、したがって、酸化還元感受性タンパク質の活性に影響を与え、血圧を低下させる[227,228,229,230,231,232,233,234]。
実際には、2ヶ月間3 g/日アルギニンのサプリメントは、糖尿病前の肥満患者の血清総抗酸化能力を増加させる[235];注意してほしい、内皮細胞で行われた試験管内試験(in vitro)実験では、アルギニンは、スーパーオキシド放出とNO [236]の細胞媒介の分解を減少させることが明らかになった。
臨床的には、アルギニンの経口投与は、本態性高血圧症患者における上腕動脈の内皮依存性のフロー介在性拡張を急性的に改善することが示されている[237]。日本人集団において、アルギニンの急性点滴静注(500mg/kg、30分)は、食塩感受性および食塩不感受性の両方の患者の動脈圧を低下させることができることが示されている[238]。
アフリカ系アメリカ人を対象に実施された同様の研究では、同量のアルギニン投与により、食塩感受性集団の方がより大きな効果で血圧を低下させることが示されている[239]。
興味深いことに、アンジオテンシン変換酵素(ACE)阻害薬と利尿薬による血圧のコントロールが3ヶ月間成功しなかった高血圧患者では、アルギニン(6g/日)の経口投与の追加は収縮期血圧と拡張期血圧の両方のレベルを低下させるのに有効であった[240]。
残念ながら、高血圧におけるアルギニン補給の効果に関する知見の多くは、小規模な臨床試験から得られており、有望な有効性にもかかわらず、さらなる調査、特に大規模な無作為化および対照試験が必要とされている。レニン-アンジオテンシン-アルドステロン系(RAAS)を調節する能力は、アルギニンが血圧を調節することができる別のメカニズムである:具体的には、アルギニンは、アンジオテンシンIIの生産と血管のトーン[241]への影響を減少させ、ACE活性を阻害する。
5. 虚血性心疾患と末梢動脈疾患のアルギニンサプリメント
内皮依存性血管拡張の維持と並行して、強化されたNOのバイオアベイラビリティーは、プロ炎症性遺伝子の活性化および内皮接着分子の発現を減少させる [242]。これらの事象は、アテローム性動脈硬化症の発症と運命を強く制御している[243,244,245]。これらの理由から、アルギニンがアテローム形成とその進化に強力な効果を持つことは驚くべきことではない。
特に、前臨床研究では、LDL受容体KOマウスの慢性アルギニン投与が動脈硬化性プラークの延長を有意に減少させることが示されている[246]。同様に、ヒトにおけるアルギニンの補充は、血小板凝集[247]の正常化によってミラーリングされた増加した単球内皮接着を、逆転させる。これらの効果は、アルギニンを冠動脈疾患(CAD)、心不全、および末梢動脈疾患(PAD)のような障害のための有望な薬剤にする。
1997年には、CADにおけるアルギニンの効果を調査している2つの重要な研究が発表された[248,249]。プラセボ対照試験では、Adamsと共同研究者は、アルギニンの経口投与(21g/日、3日間)により、早期CADにおける上腕動脈の血管拡張反応が有意に改善されたことを示した[248]。
安定型狭心症患者22名を対象とした二重盲検プラセボ対照試験では、アルギニンの投与により、わずか3日間で運動能力を改善できることが明らかになった[249]。翌年、臨床研究では、冠動脈性動脈硬化症[250]を持つ患者のアセチルコリンへの有意に強化された血管応答を示す、長期的なアルギニン補給(6ヶ月間9 g)の有益な効果を確認した。
前臨床研究は、これらの知見と一致していた。例えば、アルギニンの経口投与は、自然発症高血圧ラットのバルーン損傷頸動脈の内膜過形成を減少させた[251]。この最初の心強い証拠は、CADに対するアルギニンの効果についての更なる調査を促した。再び、4 週間のアルギニンの処置は CAD 患者の内皮機能を保存し、著しく LDL の酸化を減らした[252]。
別の研究では、高用量アルギニン補給の有効性の主要な決定因子として投与方法を強調した:動脈内注入ではなく、経口投与は、安定した狭心症[253]を持つ患者の内皮依存性の血管拡張を改善することができた。
アルギニンの治療の可能性はまた、心不全[254,255,256,257,258]と虚血再灌流傷害[259,260,261]で研究されており、しばしば議論の余地のある結果が得られている。アセチルコリンに反応する内皮依存性血管拡張と反応性充血時の虚血性血管拡張は、心不全患者の前腕部では減衰している[262]。
広岡らの論文では、アルギニンの動脈内注入が心不全患者で観察された内皮依存性血管拡張の抑制に有効であることが示されている[263]。さらに、アルギニンの経口投与(6gを1日2回、6週間)は、慢性安定型心不全患者の日常生活活動の重要な決定因子である心不全患者の持久力運動耐性を向上させた[264]。
これらの結果に沿って、クラスII/IIIの心不全患者21人を対象とした臨床研究(ニューヨーク心臓協会、NYHA)では、運動訓練後の内皮機能の改善がアルギニン輸送量の増加と関連していることが示されている[265]。
しかし、NYHAクラスIII/IV心不全患者20人を対象とした別の調査では、血中のアルギニンの実際のレベルは測定されなかったが、前腕胸水検査を用いて測定したアセチルコリンおよびニトロプルシドナトリウムに対する反応は、アルギニン(20g/日、28日間、毎日)の影響を受けないことが示された[266]。
急性心筋梗塞後の患者に外因性アルギニン(3gを1日3回、6ヶ月間)を投与しても、血管硬化の測定値や駆出率は改善されなかった;この臨床試験は、治療を受けた患者の過剰な死亡率のために中断されなければならなかった[267]。
末梢循環の改善はPAD患者において重要であり、重症例では下肢組織の広範な損傷が壊疽および切断につながる可能性があるためである[268,269,270]。PAD患者へのアルギニン静脈内投与は、ふくらはぎの血流と歩行距離を増加させることができる[271]。
同様に、急性アルギニン静注(60分で30g)は、PAD患者のNO産生と大腿動脈の血流を改善する[272]。アルギニンの2週間の経口摂取は、無痛歩行距離を増加させることができ、高コレステロール血症患者の生活の質を改善することができる[273]。
それにもかかわらず、アルギニンの短期投与がPADの治療に有効であると思われる場合、長期投与に関する結果はあまり一貫性がない。アルギニン補充の長期(6ヵ月)効果を試験する無作為化臨床試験が133人の被験者を対象に実施された。
アルギニンの血漿レベルの増加にもかかわらず、この研究では、NO依存性血管拡張、およびPAD患者の相対的な機能表現型に対するアルギニン治療の有意な効果がないことが明らかにされた[274]。
6. 糖尿病のアルギニンサプリメント
糖尿病およびその合併症における内皮機能障害の基本的な病原性の役割を考えると [275,276]、アルギニン補充の治療的使用がテストされていた。内皮の血管拡張能に対するアルギニンの直接的な影響に加えて、インスリン経路とのクロストークが示唆されている[150,277]。
特に、上述したように、アルギニンは膵臓β細胞からのインスリンの放出を誘導することができる[204,205,206]。一方、インスリンはADMA濃度を低下させ[278]、アルギニンの分泌を刺激することができる[279,280]。
インスリン受容体の刺激はNO放出を誘導し、インスリン依存性の血管拡張をもたらす[281,282,283,284,285]。注目すべきは、アルギニン移動性および内皮NO産生に対するインスリンのこのような保護効果は、糖尿病では損なわれることである[286]。したがって、糖尿病患者はアルギニン補給の最適なターゲット集団となりうる。
前臨床研究は、この理論を裏付ける:糖尿病ラットでは、アルギニンの経口投与は、内皮依存性の緩和を復元し、酸化ストレスを減少させ、内皮機能不全を逆転させる[287]。アルギニンを水道水(フリーベース、50mg/kg/日)に4ヶ月間投与すると、アルギニンとコラーゲンのグリコシル化付加体の反応性カルボニル残基との相互作用により、db/dbマウスの心臓[288]と腎臓[289]の両方の線維化を減少させることが示されており、それにより、グルコースが介在するコラーゲン構造の異常な架橋を阻害する。これらの結果は後に臨床で確認され、アルギニン遊離基2gを1日2回1gずつ経口投与することで、糖尿病患者の脂質過酸化物マロンジアルデヒドを減少させることが示された[290]。
臨床研究では、アルギニンを静脈内投与した糖尿病患者において、血圧、血小板凝集、血行動態機能の低下が確認されている[291]。健康な被験者ではアルギニン治療はインスリン受容体の感度や密度に影響を与えないようであるが[292]、インスリン抵抗性の状態では、アルギニンはインスリンの感度を改善する;実際、肥満または2型糖尿病患者におけるアルギニンの静脈内注射はインスリン応答性を刺激し、インスリン依存性の血管拡張を回復させる[151,293]。
同様に、アルギニンの経口投与は、cGMP依存性の方法で肝および末梢インスリン感受性を改善する[294]。軽度高血圧の 2 型糖尿病患者を対象に実施されたプロスペクティブなクロスオーバー臨床試験では、アルギニンの経口投与 2 時間後にアルギニンに反応して血圧が有意に低下したことが明らかになった。
全体的に、これらの研究は、少なくとも糖尿病の心血管系合併症を予防することができる予防的治療として、糖尿病患者集団におけるアルギニンの使用を立証している。アルギニンの使用のための1つの潜在的な制限は、糖尿病に特に豊富である高度なグリコシル化生成物[296]の前駆体との反応のリスクである。アルギニンへのメチルグリオキサール(糖尿病患者に豊富な[297])の添加が用量依存的な方法で強力なスーパーオキシドラジカルを生成するために試験管内試験(in vitro)で示されているので[298]、アルギニンの補充は、抗酸化物質と組み合わせることが示唆されている。
24 人の糖尿病患者を対象とした二重盲検試験では、N-アセチルシステインとアルギニンの経口投与の組み合わせを評価し、この仮説を検証した:組み合わせた治療法は、収縮期血圧と拡張期血圧、総コレステロール、C-反応性タンパク質、血管接着分子を低下させ、内皮の虚血後血管拡張時の内膜厚を改善することができた[299]。この最後の証拠は、アルギニンと抗酸化剤の組み合わせが潜在的に効果的で忍容性が高いはずであることを示している。
7. 結論と展望。治療ツールとしてのアルギニン
全体的として文献で利用可能なデータからは、特に高血圧とアテローム性動脈硬化症の進行を防止する上で、心血管疾患におけるアルギニン補給の使用を支持し、奨励している。
アルギニン補充を使用することの1つの制限は、最適なターゲット集団の選択のままである。この意味で、我々は、ADMAのレベルは、ターゲット集団の選択に非常に有用である可能性があり、ADMA/アルギニン比が増加した患者は、おそらくアルギニン補給が実際に効果的であることができる最も適した集団であると考えている。
アルギニンの使用についてのもう一つの制限は、その用量を懸念している。実際、利用可能な研究は、いくつかの異なる用量を示唆している、時々有効な、時々ない。例えば、アルギニン(9 g/日)の急性経口投与は、有効な NO 生産の誘導で成功していないことが示されている[216]。
代わりに、経口アルギニンの慢性投与(例えば、アルギニン無塩1.66 g/20 mLを含むバイアル)は、NO合成のためのアルギニンの利用に有利であることが示されており[300]、我々は、経口アルギニン(Bioarginina®の3 g/日、Farmaceutici Damor、2バイアル/日)は、非コーディングRNAの調節を介して高血圧患者における内皮機能を改善することを示すデータを持っている(Gambardellaら、個人的なコミュニケーション)。
大規模な、プロスペクティブな無作為化臨床試験は、正しい投与量の定義と一緒に、より良いアルギニン補充のためのターゲット集団を定義するために必要とされている。現在までに、アルギニン(例えば、Bioarginina®、2バイアル/日)の〜3 g/日の用量は、毒性の影響なしに、NO合成のためのアルギニンの利用を支持することで効果的であるようである。
