Contents
Are We Ill Because We Age?
www.ncbi.nlm.nih.gov/pmc/articles/PMC6951428/
オンラインで公開2019年12月18日
概要
高齢者人口の増加は、「白髪(シルバー)の津波」と呼ばれることもあり、現代社会において健康面や社会経済面での深刻な問題となっている。
科学は加齢そのものを理解する上で多大な進歩を遂げており、それは医学が寿命を延ばすのに役立っている。平均寿命の延長に伴い、慢性的な加齢関連疾患(加齢慢性疾患)の発生率も増加している。
この問題を解決するための新しいアプローチとして、ジェロサイエンスという概念がある。この概念は、加齢プロセスそのものがすべての疾患の共通の原因であることを意味している。このような考え方は、加齢そのものを病気として扱うことができ、またそうすべきだということだ。これをどのように医療現場に反映させるかは大きな課題であるが、老化を病気と考えれば問題は解決する。
しかし、加齢とは何か、その原因は何か、なぜ加齢が起こるのか、介入すべき対象は何かなど、共通の定義がない以上、加齢は病気であると結論づけることはできない。逆に、加齢は病気ではないと強く考えるべきであり、そのように治療すべきではない。しかし、加齢は、より良い機能的健康寿命を達成するために、個人レベルでの変化や適応を最適化することが可能であると思われる。
キーワード
加齢、加齢性疾患、病気としての加齢、機能的健康寿命、抗加齢医学、地球科学、適応、加齢の最適化
はじめに
私たちの社会が高齢化していることは間違いない。このことは、どんな現代社会においても、健康、社会、家族のケアに影響を及す。そのため、これらの高齢者をどのようにケアするかという問題に対する社会からの回答が、ますます緊急に必要とされている。しかし、このような状況下では、必ずしも肯定的な意見ばかりではなく、高齢者を社会から部分的に排除する、いわゆる「エイジズム」と呼ばれるような否定的な意見も多く出ている。さらに、「白髪の津波」や「シルバー津波」と呼ばれるものへの恐れもある(Bartels and Naslund, 2013; Mitchell, 2014; Gregory, 2015; Barishansky, 2016; Bluethmann et al 2016; Masselam, 2017; Berntsen et al 2019; Rotman, 2019)。
つまり、高齢化社会が社会的・医療的資源を圧倒的に利用するかどうかは、老年学者や老年医学者が答えるべき最も重要な問題なのである。呼び起こすことができる一つの反応は、ジェロントロジーまたは老年医学の分野の多くの専門家が、加齢はそれ自体が病気であるため、それ自体を治療または予防することができると主張していることである(Bulterijs et al 2015;Faragher 2015;Gems 2015;Zhavoronkov and Bhullar 2015)。さらに、この考え方は、老化がほとんどの慢性疾患の主要な危険因子であるため、あらゆる手段で老化に影響を与えたり、理想的には老化を防止したりすることで、加齢性慢性疾患(加齢慢性疾患)の発生を減少させることができるはずだという、ジェロサイエンスと呼ばれる慢性疾患に対する新しいアプローチと結びついている(Sierra, 2016a,b; Sonntag and Ungvari, 2016; Yabluchanskiy er al 2018)。この概念の最も早い翻訳は、加齢を治療可能な医学的状態として概念化しようとするフレイルティ概念の導入(Rockwood et al 2000;Fried et al 2001)である(Rodriguez-Mañas and Fried 2015;Rockwood 2016;Walston et al 2019)。このレビューでは、この新たな複雑な社会的・医学的課題への唯一の対応策が、高齢化社会のニーズによりよく答えるために加齢を病気として考えることなのか、それとも他の道を探るべきなのかを議論する。また、加齢は治療可能なのか、治癒可能なのか、病気なのかという問題とどのように関連しているのかについても検討する。そして最終的には、研究や治療に関する規制の枠組みがどのように変化し、人々の健康に影響を与えるのかを探る。
老化とは何か?
老化とは何かを理解することは、老化が病気であるかどうかを理解する上で非常に重要であり、したがって、この観点から老化の定義にアプローチしていく。老化を説明するための概念や理論は数多く(300以上)存在することを認識する必要がある(Rose et al 2012; Cannon 2015; Lipsky and King 2015; da Costa et al 2016)。この多さは、多くの考え方を生み出し、それらは完全に矛盾していることさえある。しかし、進化論や老化のフリーラジカル理論など、他よりも包括的なものもあるようである(Chandrasekaran et al 2017,Reichard 2017)。最近では、生理的調節不全の概念が、加齢のプロセスの理解をより深めるためのアプローチを試みている(Cohen et al 2013)。とはいえ、これらの300以上の理論のいずれも、この非常に複雑で多因子な現象を完全には捉えていない。老化の概念は、大まかには「時間の経過による副産物」と考えられる。これにより、加齢とは、自然に進行する生理機能の「劣化」、特定の病気への罹患率の上昇、生存能力の喪失と脆弱性の増大という加齢に伴う本質的なプロセスであり、最終的には死に至るものと定義される(Strehler and Mildvan, 1960; Birren and Zarit, 1985; Strehler, 1985)。しかし、加齢は、時間に依存した適応が最終的には不適応(dysregulated)となり、ホルミシスの原理に従わなくなり、自己排除に至る結果であると、より積極的に定義することもできる(Calabrese, 2018)。この概念は、老化がランダムで目的のないものであることを強く示唆している。
もちろん、生理学的、生物学的、分子的、機能的、あるいは社会的など、さまざまな種類の加齢がある。生命が分子、細胞、組織、臓器、システム、生物、集団と階層的に構成されているように、加齢もまた複数の組織レベルで発生し、他の組織に影響を及ぼす可能性がある。ここでは主に生物学的加齢について説明するが、生理学的加齢についても検討する。これまでに提案された最も包括的な定義の一つは、生物学的加齢(特に生物学的(細胞)現象である「老化」に関連して「セネシング」と呼ばれることもある)とは、時間の経過とともに生存確率が低下し、自己調整、修復、環境要求への適応などの生理的能力が低下する生物の変化のプロセスであるとしている(Schroots and Birren, 1988)。この定義は、生物学的加齢を定義するすべての重要な側面、すなわち、時間、変化、蓄えの減少、調節障害、および死という結末の不可逆性を統合したものである。この定義は、加齢プロセスを一次加齢と二次加齢に分けている。一次加齢は、細胞(および生物)の寿命に内在する、おそらく遺伝的に決定される限界を反映していると仮定されている(研究対象となったほとんどすべての動物種で観察された比較的一定の最大寿命を説明している)(Anstey et al 1993)。一次加齢と二次加齢は、正のフィードバックループを介してお互いに影響し合う可能性が高いことを強く強調しておきたい。老化は時間に依存した複雑なものであり、生物の様々なレベルで発生し、普遍的、進行的、不可避、不可逆的であると考えられているが、プロセスの顕著な個別性のためにある程度修正可能である(Libertini, 2015; Weiss, 2018; Michel er al)。
これらの側面はすべて、
- 細胞間コミュニケーション
- ゲノムの不安定性
- テロメアの減少
- エピジェネティックな変化
- プロテオスタシスの喪失
- 栄養感知の乱れ
- ミトコンドリア機能不全
- 細胞老化
- 幹細胞の枯渇
など、「老化の9つの特徴」として最近まとめられた(López-Otín et al 2013)。これらの特徴(あるいは同様の枠組みである柱、Kennedy et al 2014)は、老化の細胞および分子メカニズムに関する現在の知識をよくカバーしている。しかし、この分野の研究は急速に進んでおり、新しい理論やメカニズムが登場したり、他のものが破棄されたりすることで、これらのリストは今後数年のうちに変化すると思われる十分な理由がある(最近、広義の酸化ストレスについて起こったように)(Hekimi er al)。 興味深いことに、Hekimiらは、フリーラジカルが加齢プロセスに関与するという広く受け入れられている理論とは対照的に、フリーラジカルの産生増加は加齢への適応であり、したがって有益であることを示唆している(Wang and Hekimi, 2015)。新しい知識の出現によって変化するのは、老化の特徴だけではない。例えば、最近、がんの特徴が再定義され、当初の出版物で提示されていたものよりもはるかに広範なリストが含まれるようになった(Hanahan and Weinberg, 2011)。これらは、私たちの知識が常に進歩していることを示す例であり、加齢の定義を形作るものでもある。さらに、著者らは、これらのメカニズムはすべて相互に密接に関連しており、結果的に多くの関連するメカニズムを要約するのに有効であることを明確に認めている。
したがって、加齢を完全に理解するには、統合的な複雑系の枠組みが必要である。ここでは、低レベルのメカニズムが直接的な影響(例えば、がんや細胞老化の原因となる突然変異)を与えることもあれば、高レベルのプロセスを介して間接的な影響(例えば、動脈硬化に対する炎症の影響)を与えることもある。この枠組みは、「パブリック」(普遍的)なメカニズムと「プライベート」(種特異的)なメカニズムの両方を持つ、生命の樹全体にわたる老化パターンの多様性を説明するのに役立つ。
人はなぜ老いるのか?
これは非常に重要な質問であるが、答えるのは簡単ではない。どのような加齢の定義を採用するか、またどのような視点(生理学的、進化論的など)を考慮するかによって、多くの回答があり得ます(Kirkwood, 2017; Flatt and Partridge, 2018)。老化の生物学に最も当てはまると思われる定義を考えてみると、
「老化した身体のあらゆるレベルで時間に依存した疲労が生じ、生物の生理的・分子的機能を十分に維持することができなくなり、結果的に崩壊する」
と答えることができる。このような理解は、加齢が不可逆的なプロセスであることを意味するが、加齢を調整できる可能性を排除するものではない。しかし、この修正可能性は「治療可能性」とイコールではなく、したがって老化が病気であることを意味するものではない。
次に、なぜ老化するのかを概念化するためのより広い視点として、進化論的な視点が挙げられるだろう(Le Bourg, 2014; Reichard, 2017)。古典的な進化論は、高齢になると自然淘汰の力が衰えることに依拠している。集団の観点からすると、ランダムな(年齢に依存しない)死亡率は、人生の早い時期に投資された資源がフィットネスの向上により効果的であるため、高齢になっても生存する確率が低下する。この原理は、さまざまな方法で、
- 加齢の突然変異蓄積説
- 拮抗型プレオトロピー説
- 使い捨てソーマ説
の根底にある(Williams and Day, 2003; Kowald and Kirkwood, 2015)。それにもかかわらず、最近の知見では、生命の樹の中のさまざまな種がまったく老化しない(人生の時間を積み重ねても死亡率が増加しない)ことが示唆されている(Schaible er al 2015)。これらの知見は、H.サピエンスをはじめとする多くの種がなぜ老化するのかという疑問に対して、まだ十分な答えが得られていないことを意味する。それにもかかわらず、比較データは、それぞれの種が固有の加齢速度(またはその欠如)を持っており、種内の加齢速度の個体差は種間の差に比べて小さいことを示唆していることは明らかである。
疾患とは何か、そしていわゆる「加齢に伴う疾患」の本質とは?
疾患の定義は、認識論的な観点から問題がある(Scully, 2004; Doust er al 2017)。全く同じ病態を持つ個体は存在しないため、疾患の定義は似たような存在をグループ化するための練習であるとも言える。しかし、どの時点で、2つの病理学的実体が別の名前に値するほど十分に異なるのであろうか?癌は単一の病気なのか、それとも多くの関連する病気なのか?症候群(パーキンソン病、メタボリックシンドロームなど)のように様々な原因によって類似した症状が現れる場合と、病状(パーキンソン病、2型糖尿病など)のように臨床症状が異なる原因がある場合が考えられる。ごく簡単に言えば、病気を「身体のシステム、細胞、精神の最適な生理機能が、病態生理学的なプロセスに変換され、病理学的な症状を引き起こしている状態」と定義することができる。したがって、これらの症状が一体となって病気を定義することになる。病気の発生は、宿主の感受性、助長された環境、そして最後に刺激の組み合わせである。伝染病の場合、加害者は一般的に人から人へと伝播する病原体(通常はウイルス、細菌、真菌)であり、非伝染病の場合は人から人へと伝播しない環境ハザード、生活習慣、および/または遺伝によって決定される(Prüss-Ustün er al)。 このように、やはり様々な疾患は、客観的に証明された兆候や症状によって、多かれ少なかれ具体的に現れる(Poh er al)。 このような特徴を考慮すると、病気の性質によって原因や病態メカニズムが異なることは明らかである:病原体への急性または慢性的な曝露によって、炎症や自己免疫などの不適切に実行された生理学的プロセスによって、遺伝的、生化学的、または環境的な問題によって、あるいは臓器や器官系の正常な機能/適応性の失敗(調節障害)によって引き起こされ、最終的には最初の攻撃性が排除された後に慢性化する(Bury, 1982)。
人間に影響を与える病気のほとんどは慢性的なものである。WHOによれば、慢性疾患には多くの決定要因があり、社会経済的な決定要因から、一般的な修正可能な危険因子や修正不可能な危険因子を経て、高血圧、高血糖、高脂質などの中間的な危険因子にまで及んでいる(The World Health Report, 2002; WHO Global Report, 2005)。これらすべての要因は、心血管疾患、2型糖尿病、癌、慢性呼吸器疾患、神経変性疾患など、人間に影響を与える最も一般的な慢性疾患の出現を収束させ、様々な範囲で決定する。最も広く信じられているのは、これらの病気のほとんどが高齢者に発症し、影響を与えるということである。これらの疾患の世界的な発生状況を詳細に調べてみると、これらの疾患に罹患している被験者の半数は70歳未満である(WHO Global Report, 2005)。これらの疾患の原因をよく考えてみると、最も普及していて複雑に絡み合っている原因の中で、修正不可能な危険因子としての年齢は1つに過ぎず、最も決定づけているとは言い難いので、これは驚くべきことではない(Fülöp er al)。 したがって、年齢はこれらの疾患の重要な危険因子ではあるが、決定的な危険因子ではないと考えることができる。しかし、個人が加齢している場合、身体の多くのシステムの生理学的な調節不全などの生体内の蓄積された変化は、長期的に続く基礎的で有害な病理学的プロセスの臨床的な発現を可能にする(Franceschi et al 2018,Fulop et al 2018)。さらに、加齢に伴って必然的に発生する疾患はなく、したがって、加齢はリスク要因ではあるが、慢性疾患の必要かつ十分な原因ではない(Rothman et al 2008)。
以上のような慢性疾患の病態形成を3つの臨床例で説明する。
まず、がんの場合を考えてみる。これは、生涯を通じて発症する病気である(Anisimov, 2009)。腫瘍性転換を促進するためには、いくつかの「ドライバー変異」が順次発生する必要があるため、元々の発がん性の侮辱は、ほとんどの場合、より若い年齢で発生する(Busque et al 2018,Sweet-Cordero and Biegel 2019)。これがさらに発展して、臨床的に顕在化する悪性腫瘍になる場合もあれば、ならない場合もある。後者が起こるためには、この最初の侮辱から悪性腫瘍への促進を経て、宿主の抵抗力の低下を伴う(というか可能にする)発癌促進刺激が協調して作用することが必要である。これが、がんは「高齢者の病気」であるという一般的な考え方の理由である。この考え方は、臨床・疫学データの表面的な評価から来ている。しかし、90歳を超えると罹患率が低下し、多くのセンテナリアンががんから免れていることは注目に値する(Pavlidis et al 2012)。合わせて考えると、がんは若年層や中年層に始まり、加齢に伴って後に顕在化する疾患と考えられる。
2つ目の病気として考えられるのは、心血管疾患である。これらもまた、アテローム性動脈硬化症と呼ばれる炎症プロセスとして、人生の早い時期に始まる(Ross, 1999)。朝鮮戦争で死亡した若い兵士の検死では、動脈に動脈硬化性病変の兆候が発見されている(Webber er al)。 動脈硬化の進行速度は個人差があり、中には発症しない人もいる(Gurven et al 2009)。このように、多くの成人被験者は、人生のさまざまな時期に、加齢とともに増加する動脈硬化の臨床症状に悩まされる可能性がある。このことは、加齢に伴って心血管疾患の臨床症状がある程度増加し、生体の生理的変化による生涯にわたる動脈硬化のプロセスが根底にあることを強く示唆している。ここでもまた、基礎的な病理は早い年齢から発生しているが、臨床症状は年齢に応じて豊かになる可能性がある。
最後に、3つ目の例は、自然発症するアルツハイマー病(AD)などの神経変性疾患に関するものである。インス トは、それが何であれ(酸化的、代謝的、または感染的なものを含む)疾患の臨床症状が現れる数十年前に発生する(Festoff et al 2016,Le Page et al 2018)。個人の感受性と変化が、これらのインシュルトが臨床的に顕在化したADになるかどうかを決定する。この考え方をよく裏付けるのは、認知的に正常な高齢者の脳にもADプラークと呼ばれる形態的特徴が存在することである(Duan er al 2017)。このように、障害は人生の早い時期に発生するのに対し、臨床的に顕在化する疾患はずっと後になってから、通常は60歳を過ぎてから現れる。
これらの例は、一般的に加齢に関連すると考えられているこれらの疾患の加齢に起因する性質に疑問を投げかけており、さらには(その「根」、すなわち創設時の病態メカニズムがより早い年齢で存在するため)根本的な加齢プロセスを治療することで予防できる可能性もある。さらに、今日の慢性疾患のほとんどは、狩猟採集民や園芸家などにはまれな、あるいは存在しない疾患であると考えられる。それにもかかわらず、現代の狩猟採集民は加齢しており、加齢の症状は、現代社会の最も健康な高齢者に見られるもの、すなわち、皮膚のしわや、サルコペニアに関連していると思われるスピード、体力、持久力の低下に似ているようである(Fuellen et al 2019)。このように、上述の疾患は加齢の現れではなく、何十年にもわたる現代のライフスタイルや環境への曝露の累積的な影響によるものである。
要約すると、疾患とは、特異的な症状(例:脳卒中の場合は片麻痺)や非特異的な症状(例:脳卒中の場合は意識不明)によって現れる生体の恒常性の乱れである。慢性疾患には様々な発症経路があり、おそらく人生の早い段階から始まっていると思われる。しかし、最後に唯一共通する経路は、炎症かもしれない。炎症は複数の慢性疾患のリスクを高める可能性があるが、それさえも普遍的なものではない。百寿者は非常に高いレベルの炎症マーカーを持っており、一部の狩猟採集民にも同じことが言える(Salvioli et al 2009,Rubino et al 2019)。したがって、慢性疾患は、高齢者だけでなく、かなりの割合の若い患者の属性でもある。年齢は、せいぜいこれらの慢性疾患の臨床的出現に役割を果たす修正不可能な危険因子であるかもしれないが、決して原因ではない。上述の例を考えると、科学的アプローチの根底にある根本的な論理的誤りは、時間依存性と年齢依存性を混同していることかもしれない。もちろん、このことは、加齢の特徴に対する特定の介入が、慢性疾患に関連する利益を決してもたらさないことを意味するものではない。例えば、ターゲットを絞ったセノリティクス(老化細胞を除去したり、その形成を防いだりする薬剤)のアプローチが、特定の集団における特定の疾患に効果をもたらすことは可能であり、その可能性さえあるが(Kirkland et al 2017年)ジェロサイエンスの専門家でさえ、セノリティクスを広範囲に適用すると、健康に大きな悪影響を及ぼす可能性があると警告している(Blagosklonny 2018a; Attaallah et al 2019)。
老化が病気とみなされる理由は何であろうか?
この質問に対する答えは簡単ではない。直感的に
「そうだ、老化は病気であり、そういったものは治せるかもしれない」
(Caplan, 2005; Bulterijs et al 2015; Zhavoronkov and Bhullar, 2015; Stambler, 2017)
と言う人がいる一方で
「全然違う、老化は調節はできるかもしれないが、病気ではない」(Rattan, 2014)
と言う人もいるであろう。この区別は些細なことのように見えても、科学やトランスレーショナルリサーチに多くの影響を与える。なぜこのような概念が生まれたのか、そしてその結果は何なのか。疾患としての加齢という概念は、主に動物実験から来ている。というのも、いくつかの操作が寿命を延ばし、慢性疾患を減少させるのに有効であることが証明されているからだ。最も成功しているのはカロリー制限である(Colman et al 2009,Anisimov 2015,Johnson and Kaeberlein 2016,Mattson et al 2017,Kraig et al 2018)。これにより、加齢の医療化を目指した、人間における同様のアプローチへの関心が高まった(Justice et al 2018a; Blagosklonny 2018b)。社会的な観点からは、経済的、社会的、心理的に「シルバー津波」にどう対処するかの対応が求められている(Bartels and Naslund, 2013; Mitchell, 2014; Gregory, 2015; Barishansky, 2016; Bluethmann et al 2016; Masselam, 2017; Berntsen et al 2019; Rotman, 2019)。最後に、特定の慢性疾患との戦いは、十分に迅速かつ効率的ではなく、しかも非常にコストがかかる(Yabluchanskiy et al 2018; Larsen, 2019)。そのため、老化と戦うことで、医学はすべての慢性疾患の出現を同時に防ぐか、少なくとも遅らせることができるのではないかという考えが生まれた。
単純な時間の経過、つまり年代的な加齢が、容赦なく、止められないことは明らかである。最近、加齢を研究している専門家の中には、この生物学的プロセスを見直す時期に来ていると言う人もいる。加齢は、時間そのものとは異なり、操作したり、遅らせたり、場合によっては治療したりできる状態であると認識している(Gems, 2015)。彼らは、加齢を病気として認識することを阻む制度的、イデオロギー的な障壁があると主張しているが、その大きな要因は、加齢は病気ではなく、自然で良性のプロセスであり、干渉すべきではないという長年の伝統的な見解である。「加齢を病気と見なしていないために、薬を市場に出すまでのすべてのプロセスを、加齢を治療する薬に適用することができない。これは、製薬会社が加齢を治療する薬を開発する上での阻害要因となる」「加齢が病気と見なされれば、対応の仕方が変わる。加齢を治療することが医師の義務となるのです」。と述べている(Kelland, 2010; Gems, 2015)。さらに、ディリンによれば、「現在、加齢の専門家たちが、世界最大の医薬品規制機関である米国食品医薬品局に対して、加齢をそれ自体が病気であると再定義することを検討するように働きかけている “根拠のある “動きがある」とのことである(Kelland, 2010; Riera and Dillin, 2015)。このように加齢を病気として考えようとする姿勢の背景にあるprimum movensとは何であろうか。些細なことであれば、お金と言いたいところであるが、このロビー活動の裏には他の配慮があることを期待したいと思う。また、健康寿命が長くなれば(Kaeberlein, 2018)生産性の高い寿命が長くなり、年金の必要性が減るという社会的な側面からの配慮も隠れていると思われるが、これは退職前に過ごす人生の割合が増えた場合にのみ当てはまることである。その結果、デ・グレイのように、加齢の研究が遅れることを殺人に相当すると比較する著者もいるほどだ(De Grey and Rae, 2007)。
そのため、ジェロントロジーでは、老化を病気として考えることで、老化の過程(「老化病」)に介入する薬の探索を容易にし、最終的には健康寿命を延ばし、それに伴って寿命も延ばそうという動きが強くなっている(Hansen and Kennedy, 2016)。このような考え方は、老化した対象者を若返らせることを目的とする抗加齢医学に通じるものである(Gems, 2014; Longo et al 2015; de Magalhães et al 2017; Espeland et al 2017; Melo Pereira et al 2019)。したがって、加齢のプロセスに指摘された介入を行えば、病理につながる損傷を防ぐことができる。それは、身体維持のいくつかの側面に関する動物モデルで部分的に実証されたが、確かに、老化が彼らが述べる病気である場合に必要とされるような、老化を治すことを意図したものではない。あるいは、抗加齢医学が提唱するように、加齢に伴う損傷を修復することで、病態が減少するはずである。このように、「病気としての加齢」という観点から見ると、科学に欠けているのは、特定の加齢慢性疾患を調査して治すことに興味を持つのではなく、高齢者の慢性疾患のすべてに共通する原因・メカニズムとして加齢を考え、それを調査することである。このように加齢を考えると、加齢を修正することが本当にこれらの疾患の発生リスクに影響を与えるのかという根本的な疑問が生じる。加齢慢性疾患の負担を減らすために提案された介入は、同時に老化プロセスを遅らせることになるのであろうか?あるいは、加齢を加速させる疾患を予防することで加齢を遅らせることができるのであろうか?
さらに、複合的で多次元的な状態であるヘルススパンを、地球科学がどのように考えているのかという定義が根本的に欠けている(Moskalev er al 2016; Sierra, 2016a,b; Blagosklonny, 2018a)。すでに健康の定義は合意されるまでに数十年かかり、その後も医学の進歩とともに変化しているため、ヘルススパンの定義も同様に検討する必要がある。病気がないことで定義されるのか、生活の質(これは個人的で主観的なもの)で定義されるのか、あるいは究極的には老人が服用している薬の数で定義されるのか。高齢者の多くは、自分が病気であることを知らないし、感じてもいない。私たちの一人の臨床経験から、次のような例がイメージできると思う。自宅で転倒し、入院している99歳の女性のケースである。彼女は何の薬も飲んでおらず、過去10年間、医師の診察を受けていなかった。主観的な健康状態は良好なので、転倒するまで健康寿命は延びると考えられるであろうか。しかし、入院中に不整脈、高血圧、大動脈弁狭窄症、軽度のCOPD、2型糖尿病などの慢性疾患の診断を受け、治療を開始した。医師から自分の病気の重さを聞かされ、恐ろしくなったという。最終的には治療が行われ、彼女は回復し、いくつかの加齢慢性疾患に悩まされながら帰国した。もちろん、これは典型的な例ではないが、このようなケースは何百万件もあると思われる。慢性疾患と診断されたことがあっても、機能が制限されていない高齢者であれば、自己申告の健康状態はよりポジティブであることが示されている(Maddox, 1999; Yoshimitsu et al, 2017)。このことは、よく言われることとは対照的に、通常の加齢プロセスに関連するさまざまな変化それ自体は、たとえ加齢慢性疾患につながったとしても、機能性をごくわずかしか低下させないことを示唆している(Lipsky and King, 2015)。「老化は病気である」という精神に基づき、これらの人々はすべて、仮説上の健康寿命を達成するために治療されるべきだ。したがって、老化を病気であるかのように治療するための究極かつ普遍的な目標として適用される可能性のある、ヘルススパンの普遍的な定義を見つけることが最も重要になる。
ここが問題なのであるが、「病気としての加齢」を提唱する人たちは、すでに起こってしまった加齢の症状、ひいては加齢慢性疾患から(部分的にも完全にも)解放する手段(薬や処置)を見つけられると信じているようだ。一方、老化を病気ではなく、自然な(しかし修正可能な)プロセスであると考える私たちは、老化や加齢慢性疾患の症状が出る前に、関連するあらゆるレベルで生体の機能を修正し、健康寿命、加齢慢性疾患のない寿命を延ばすことを提唱している。
「老化は病気である」という概念の中で、いかにして老化科学と虚弱性が統合されているのか、そしてそのトランスレーショナル・インプリケーションとは何か?
ジェロサイエンス(すでに先に何度か触れている)は、加齢と加齢関連疾患の関係を理解することを目的とした学際的な分野である(Sierra, 2016a,b)。加齢は、遺伝性ではないほとんどの慢性疾患の主要な危険因子と考えられているため、これらの疾患の発症における加齢の役割を理解することで、疾患の予防や治療のための新たな道が開けるはずである。この言葉は、加齢の生物学に対する学際的なアプローチを表すものでもある。しかし、ある要因(加齢)が(病気の)危険因子であるからといって、それ自体が病気になるわけではない。この論理からすると、多くの代謝性疾患や心血管疾患の主要な危険因子である座りっぱなしの生活も、それ自体が病気であると考えるべきであるが、明らかにそうではない。
上述のように、現在、加齢の特徴として9つの項目が認められている(López-Otín er al 2013)。加齢慢性疾患に影響を与えることを期待して、これらの老化の特徴の1つまたはいくつかを標的にした治療法が提案されている。検討されている治療法としては、
- 幹細胞治療、免疫/炎症調整剤
- 老化細胞を除去するための老化防止剤
- テロメラーゼの活性化
- エピジェネティック調整剤
- シャペロンやタンパク質分解経路の活性化
- mTORやインスリン/IGF-1シグナル(IIS)経路の調整/阻害
- AMPKやサーチュインの活性化による食事療法
- ミトコンドリアの代謝と生成の調整
などが挙げられる(Longo et al, 2015; Vaiserman et al 2016; Fedichev, 2018; Mitchell et al 2018; Mitteldorf, 2018; Justice et al 2018b; Sharma and Padwad, 2019)。) 老化の柱のほとんどを対象とし、それによって加齢慢性疾患の減少をもたらすために、前述の介入に対する全体的なアプローチを考えられるかどうかという疑問が生じる。
動物モデルで証明されているように、これらは非常に有用な治療法であるが、いずれも老化プロセスの特定の側面を対象としている。しかし、これらはいずれも加齢プロセスの特定の側面を対象としており、ある種の栄養学的介入(カロリー制限、断食、カロリー制限の模倣など)を除けば、普遍的な調整効果を持つものはない。しかし、これらの介入であっても、プロテオスタシスなどのすべてのホールマークを対象としていない可能性がある(Witkowski et al 2018,Konopka et al 2019)。このように、提案されている介入策は、加齢の高い複雑性に取り組むものではない。その結果、加齢の複雑な性質を考慮すると、ある側面に介入した場合、他の側面への影響がどうなるかはわからない。おそらく、加齢の生理学的調節障害の概念を考慮すれば、さらに有害な不均衡が生じる可能性がある。このように、私たちは「老化とは何か」「なぜ老化するのか」という基本的な疑問に立ち戻っているのである。これらの疑問に自信を持って答えられるようになるまでは、加齢の複雑さにおけるこれらの絡み合ったプロセスすべての役割が不確かであるため、提案された治療法は短期的にも長期的にも危険なものとなる可能性がある。例えば、老化防止のための介入は、いくつかのレベルで老化を遅らせることに成功するが、同時にSenescence Associated Secretory Phenotype(SASP)を抑制することで、がんのリスクを高める可能性がある。SASPはがんに対して有害な効果と有益な効果の両方を持つ可能性があり、その相対的なバランスを詳細に研究する必要があるだろう(Blagosklonny, 2018a; Zhang er al)。 しかし、通常の臨床試験の構造を考えると、加齢バイオマーカーやその他の健康指標における短期的な利益を観察することは容易であり、より長い時間軸で起こるかもしれないがんリスクの変化を観察することは難しいかもしれない。
例えば、インフラメージング(炎症性サイトカインの上昇によって示される、炎症準備性が高まった不顕性状態)の考え方に関連して新たに概念化された免疫系の変化は、免疫老化に関連する我々の信念の多くを陳腐化させた(Franceschi et al 2018,Fulop et al 2018,Pawelec 2018)。これらの変化についてのより最近の解釈では、準超高齢者の場合(Arai et al 2015)や、高齢者向けに考案された最新のワクチン接種の場合(Lal et al 2015)に示されるように、加齢に伴う免疫の変化を長寿に必要な免疫適応と考えている。しかし、この免疫適応がうまくいかなくなると、高齢者は加齢に伴う病気が遅れて現れるようになる。このように、「加齢関連」とされるプロセスの正確な役割がわかるまでは、それを「調節」したり「治療」したりするための介入は、有益ではなく、健康寿命を延ばすどころか、非常に有害なものになる可能性があるのである。このように、加齢に伴う適応と病理を区別することは非常に重要だが、十分に強調されていない。
同じことが、フレイル(Fried et al 2001,Rockwood 2016)と呼ばれる、主に使用され研究されている表現型に関しても言える。虚弱の定義や測定法は数多くあるが、様々な測定法は虚弱の一面を捉えているに過ぎず、虚弱が何であるかは実際にはわからないことを示唆している(Theou et al 2013,Malmstrom et al 2014,Mijnarends et al 2015)。フレイルの基本的な定義を、回復力の低下につながる身体の蓄えの喪失、ひいては有害事象への対応とすれば、加齢の生理学的な定義を与えているに過ぎないことは明らかである(Fulop et al 2010; Khan et al 2019)。これを合わせて考えると、システム機能のホメオダイナミックな維持の失敗を意味することになる(Rattan, 2015)。あるいは、複数のレベルのフェイルセーフ機構が考えられ、最後のフェイルセーフ機構が消滅したときに、ほとんどの臨床症状が発生する。これは、Gavrilov夫妻が議論した冗長性の考えに戻るものである(Gavrilov and Gavrilova, 2004)。したがって、究極的には虚弱は、各個人で異なる生物学的加齢プロセスに起因する特定の状態にすぎないと思われる。このことは、臨床的虚弱の有病率が異なる加齢集団において7〜60%であることからも明らかである。この概念は、何が何でも治療すべき老化の医学化としてではなく、生物学的老化の定義として用いられれば、非常に有用なものとなるであろう(Palliyaguru et al 2019)。
これらの考察は、老化をすべての加齢慢性疾患の根源とみなし、そのためにあらゆる介入が可能であると考えるジェロサイエンスは、老化を理解するための有用なアプローチではないことを示唆している。このことはまた、加齢を病気として考えるべきではなく、加齢を調節/延期することを目的とした介入を、病気であるかのように設計すべきではないことを示唆している。したがって、私たちはなぜ老化が病気ではないのかを明確に定義し、老化や加齢関連疾患の問題にアプローチする別の方法を提案する必要がある。
老化はなぜ病気ではないのか?
ジェロス・サイエンスの観点からは、もし老化が治療可能な病気やプロセスになれば、それを治療するのは医師の義務であろう。しかし、老化しているように見えるものがすべて老化しているわけではない。老年学や老年医学の歴史の中で、以前は加齢の一部と考えられていた多くのプロセスが、現在では加齢ではなく、重なる病理であると考えられている。最良の例の1つは貧血で、何十年もの間、加齢の確固たる属性と考えられてたが、現在では加齢そのものではなく、さまざまな病理に関連していると考えられている(Halawi er al 2017)。つまり、関連する基礎的な病態メカニズムを持たない高齢者は、100歳以上になっても貧血にはならないということである。高血圧も、サルコペニアも、腎不全も、認知機能障害も同じである(Khan et al 2017,Sobamowo and Prabhakar 2017)。
では改めて、老化を概念的に病気と区別するものは何であろうか。まず、病気の範囲がほとんど限定されているのに対し、加齢の範囲は全身的で複雑である。老化は(長生きするすべての人間に関する)必然的で普遍的なプロセスであるのに対し、ほとんどの病気は個人の感受性/脆弱性に関連し、慢性的なものであってもそのほとんどが予防可能である。老化の最も重要な原因は時間であるが、病気は通常、特定の既知の原因がある。言い換えれば、老化は不可逆的で進行性であるのに対し、病気は可逆的で不連続である。最後に、最も重要なことであるが、老化は修正可能であっても治療不可能であるのに対し、病気は現在のところ方法がわからなくても最終的には治療可能であり、これは科学の進歩の問題でしかない。このような多くの本質的な違いは、加齢が「ただの」病気であるという考えを明らかに否定するものである。
さらに、同じ病気にかかっていても、その病気に関してはほとんどの人が基本的に同じであるのに対し、高齢者は一人一人違うということも述べておかなければならない。言い換えれば、加齢プロセスは、どんな病気よりもはるかに異質なものなのである(Li er al)。 この主張は、後述するように、加齢の概念や(あるとすれば)介入への異なるアプローチにつながるはずである。このことは、個人の加齢という概念が、加齢した対象者の機能性を定義するような、個人の健康状態と認識を意味することも示している。したがって、「一長一短」は加齢には通用しない。老化は適応であり、それを「治療」することは益よりも害をもたらす可能性がある。これらの議論を考慮すると、加齢は病気ではないと言えるであろう。
抗加齢医学は存在するのか?
医療分野における地球科学の傍証として、高齢者を若返らせることで老化を「治療」しようとする抗加齢医学がある(Gammack and Morley, 2004; Rattan, 2004; Bartke, 2008; Balistreri, 2018)。これは、皮膚のしわなどの加齢の外因的属性(例えば、ヒアルロン酸やボトックス注射による)(Draelos, 2008; Taub and Pham, 2018)や、サルコペニアなどの内因的属性(幹細胞治療による)(Chhetri et al, 2018)の変調によってなされる。
これらの治療法は、短期的には何らかの有益な効果があるかもしれないが、確かに因果関係のある治療法ではない(Gammack and Morley, 2004)。確かに、それらは明らかに老化の特定の側面を緩和するのに役立つかもしれないが、老化した生物のヘルススパンやグローバルな機能性を変えることはない。このように、これらの治療法は加齢の複雑さを考慮していない。確かな科学的根拠がない現在、抗加齢医学と呼ばれるものは、些細な美容的介入を除いては、医療の場には存在しないのである。
議論を深めるためには、抗加齢療法が本当に加齢を遅らせることができるかどうかを、どうやって知ることができるかということが必要だ。問題は、私たちが定義していることのほとんどが循環的で実用的ではないということである。最もマクロなレベルでは、それが寿命を延ばすかどうかを問うことができるであろう。しかし、この定義に基づけば、シートベルトや産科医療、小児の予防接種などは奇跡的なアンチエイジングのための介入と言える。老化を遅らせるための実験室での介入は、環境への依存度が高い場合もあり、どの程度老化を遅らせているかは議論の余地がある。あるいは、アンチエイジングのための介入によって、加齢慢性疾患の発生率や負担が減るかどうかを問うこともできる。しかし、上述したように、加齢そのものに影響を与えずに、現代のライフスタイルの負の側面(例えば、肥満や座りっぱなし)を打ち消すことで、これを実現できる可能性もあるし、逆に、加齢の側面を遅らせる介入を見つけても、加齢慢性疾患にはあまり影響を与えないかもしれない。最後に、アンチエイジングへの介入が、生物学的老化の指標に影響を与えるかどうかを問うことができる。もしこれらの指標が治療対象となるプロセスの特定の指標であるならば、推論は循環することになる。例えば、老化防止剤が老化細胞の数を減らすからといって、老化に影響を与えることは証明できない。ホメオスタシス調節不全指標やエピジェネティッククロックなど、生物学的年齢のより高レベルの指標は、やや有望な指標である(Belsky et al 2018)。しかし、ここでも問題があって、これらのさまざまな指標は互いに相関性が低いだけで、それ自体が老化とは何かについてのさまざまな理論に基づいている。例えば、セノリティクスがエピジェネティック・クロックを下げる(巻き戻す)としたら、これは単に、セネッセント細胞のエピジェネティック・プロファイルが異なるため、これらの細胞を排除しただけなのか?それとも、本当に残った細胞の老化に影響があったのであろうか?このように、加齢の定義には基本的な概念上の問題があり、それは抗加齢療法が成功したかどうかを定義する上でも同様の問題がある。この論理的な問題は、柱と特徴を特定することにもつながる。老化の特徴の3つ目の最も重要な基準は(発表されたリストでは常に満たされているわけではないが)「その実験的な改善により、通常の老化プロセスを遅らせ、その結果、健康寿命を延ばすことができる」というものである。その一例がメトホルミン治療である。メトホルミンは、平均して多くの慢性疾患(加齢慢性疾患)の負担を減らし、さらにはQOLを向上させることができるかもしれない。しかし、それは老化を遅らせることになるのであろうか?あるいは、加齢を遅らせるとしても、加齢を加速させる疾患を予防するために加齢を遅らせるだけなのであろうか?狩猟採集民やスポーツ選手など、メトホルミンの恩恵を受けられない人たちがいることは間違いない。彼らの老化を遅らせることはできない。では、メトホルミンは老化を遅らせるものなのか、それとも現代のライフスタイルがもたらす悪影響を一般的に抑制するものなのか。これらは同じものなのであろうか?これらの悪影響は、現在の私たちにとって老化の一部なのか、それとも永久に続くものなのか?これらの理由から、正常な加齢プロセスを定義し、それが遅延しているかどうかを測定することは問題である。また、前述のシートベルトの問題を回避する方法で健康寿命を定義することも同様に困難である。合わせて、本章の表題の質問に答えると、現段階の知識では、老化がすでに起こっているときに老化の症状を治療すると理解される抗加齢医学は、医学の中には存在しない。しかし、時間に依存したプロセスが蓄積され、老化の症状が現れる前の人生の早い時期に、老化の発生を遅らせるような介入・調整を行うことは可能かもしれない。
老化は病気ではないという概念はどのようにして生まれてくるのか
これらのことは、高齢者の健康や機能性を向上させるためにできることは何もないことを意味しているのであろうか?
高齢者が年齢を理由に「病気」とみなされることは問題なのであろうか?
高齢者は人生の最後に何を望むだろうか?何が重要なのであろうか?
年齢を重ねることが病気とみなされるかどうかは、彼らにとって本当に重要なのであろうか?
科学者たちは、高齢者が何を必要としているのか、自分たちのほうがよく知っていると思っている。
科学者は現段階で、ジェロントロジー分野での科学的発見を高齢者への介入に結びつけるには、多くのことを知っていてもまだ十分ではないと認識すべきである。しかし、新たなアプローチが必要であり、加齢プロセスを構成するさまざまな要素を細分化するのではなく、体系的な概念化を志向すべきである。したがって、年代的な加齢に対する生物学的な加齢の評価を改善することで、複雑な生理学的加齢プロセスを評価し、それらに特異的かつ共同的に対処できるようになることが期待される(Zhong er al)。 また、加齢は常に加齢慢性疾患につながるわけではなく、同じプロセスでもホームダイナミクスによって高齢者の加齢慢性疾患または成功した加齢のいずれかにつながるという概念は、介入を個別化するのに役立つだろう(Franceschi et al 2018)。さらに、加齢で生じるすべてのことが有害ではないという認識は、必要なことを強化し、有害なことに対抗する目的のある介入を設計するのに役立つ。最後に、加齢は生涯にわたるプロセスであり、慢性疾患は人生の早い時期に始まるという認識は、加齢慢性疾患に影響を与える人生の非常に早い時期の介入を設計するのに役立つ。この新しい概念は、個々の疾患の概念と加齢に伴う動的調節障害を統合するのに役立ち、この2つは相互に関連し絡み合っている。どちらか一方の優位性に応じて、それぞれ対象となる介入を行うことができる。つまり、病気としての加齢から、適応としての加齢へと移行し、その結果、加齢慢性疾患や成功した機能的健康寿命を得ることができるのである(図1)。
図1 生理学的プロセスとしての加齢の寄与の概念化
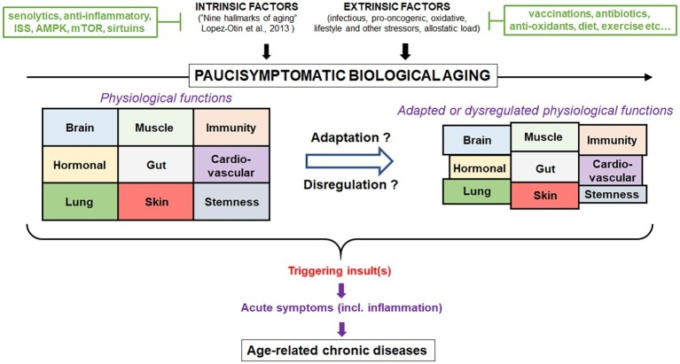
生物学的老化は、内在的要因(老化の特徴)と外在的要因(ストレス)によって生じる正常なプロセスである。寿命の間に大きな障害がなければ、生理機能が低下しても健康状態の変化に関連する症状はほとんど出ません(paucisymptomatic)。しかし、あるきっかけがあると、制御できない炎症が起こり、生理機能の活性化やバランスの乱れが続き、加齢に伴う疾患を引き起こすことがある。老化を抑制し、病気になりにくくするための介入戦略について説明する。老化は、特定の治療法を必要とする病気ではなく、多面的なプロセスであると考えられる限り、うまく調整することができる。最終的には、加齢は時間に依存した生涯にわたるプロセスであり、一定のプレッシャーの下で生体は適応したり、制御不能になったりするので、加齢が病気であるという概念は除外される。
高齢化社会に対応するために何ができるか?
老化プロセスへの直接的な介入(抗加齢医学の領域)のほかに、老化そのものの発生と加齢慢性疾患の発生の両方を遅らせるアプローチとして、人生の初期から健康的なライフスタイルを提唱する必要がある(Saint Martin et al 2017,Kaur et al 2019)。これは希望的観測のように思えるが、このアプローチは、加齢を非特異的に対象とするよりも実りあるものになる可能性が高い。加齢を測定する能力が向上すれば、これらの方法は不完全かもしれないが、健康に最も関連し、特定の個人にとって最も緊急性の高い加齢の側面に対して、より具体的なライフスタイルの介入を開発するのに役立つであろう。
だからといって、加齢に関連する生物学的経路を解明する研究をしてはいけないというわけではない。それどころか、このような研究には多くの投資がなされるべきであるが、加齢に病気がないようにするという未分化な目的ではない。目的は、できるだけ遅く、できるだけ健康的に加齢し、高齢者の自立した機能の維持に貢献することである。これは、病気をせずに年をとることはほとんど不可能だが、機能的で自立した状態を維持し、いかなる痛みにも悩まされないことは可能であり、すべての高齢者が望んでいることだと知っている多くの高齢者の願望と一致するだろう。最も重要なことは、高齢者がどれだけ長生きするかではなく、人生の最後の数年間をどのように過ごすべきかということだ。したがって、ヘルススパンとファンクションスパンを組み合わせて、ファンクショナル・ヘルススパンの時代にしてもいいのではないだろうか。
高齢者の機能的健康加齢を保証するためのアプローチは、個人ごとに異なる可能性があることを考慮して、いくつかの軸があるはずである(Neubauer et al 2017)。
おわりに
私たちの現代社会は、前例のない高齢化人口の増加に直面している。科学だけでなく、社会もこの課題に対応する必要がある。科学は、加齢プロセスの複雑さを解明し、個々の人の希望や優先順位に応じて、最適な機能を許す健康状態の維持につながる介入を保証する必要がある。慢性疾患の発生とそれに伴う機能的負担を減らすための健康的なライフスタイルもまた、可能な介入の非常に重要な側面である。
加齢は、不可逆的で止められない、時間に依存したプロセスであり、有害でも善でもないが、個々の状況に応じて評価されるべきであり、その結果、加齢した身体の機能を最適化するためにプロセスを調整する(「一長一短」ではない)個別の介入が可能となる。ここでいう加齢とは、慢性的な課題と時間の経過に伴う生体の適応と考えるべきであり、必要なプロセスではあるが、新たな課題への対応には不利になる可能性もある。新たなプロセスが発見され、システム生物学的アプローチにより、遺伝子、エピジェネティック、メタボリック、そして環境因子(栄養を含む)が統合されれば、「有害な老化」という加齢の概念にニュアンスを与えることになるだろう。
したがって、老化は病気ではなく、複雑な自然のプロセスなのである。老化が病気であれば、すべての高齢者が病気であるとみなされるであろう。しかし、究極的には、これが一般的なパラダイムであれば、これが当たり前になり、誰も病気にならなくなるであろう(万人に共通する病気はない)。老化を病気と考えない限りにおいて、老化を調節することができる。治療は、その原因が何であれ、病気のために行われるべきである。このような加齢に対するポジティブなアプローチは、それぞれの高齢者に合わせた(個別の)方法で機能的な健康寿命を保証し、”シルバー津波 “の負担を軽減するだろう。
