Are central nervous system drugs displaying anti-inflammatory activity suitable for early treatment of COVID-19?
pubmed.ncbi.nlm.nih.gov/34284539/
Paweł Grieb1,Konrad Rejdak2
1.ポーランド科学アカデミー、モサコフスキー医学研究所、ワルシャワ、ポーランド
2.ポーランド、ルブリン、ルブリン医科大学、神経学教室
オンライン公開日:2021/06/30

はじめに
米国国立衛生研究所(NIH)のCOVID-19治療ガイドライン[39]では、COVID-19の治療に関連する様々な品質の大量のデータや出版物が、非常に速いペースで出現していると指摘されている。あるものは高い評価を受けている査読付き医学雑誌に、あるものはプレプリントとして、またあるものはプレスリリースとして発表されている。これらのデータは継続的にレビューされ、科学的な厳密さと妥当性が評価され、最終的には医療従事者が遵守すべきガイドラインに組み込まれる。検証されていない治療法の使用は推奨されておらず、控えるべきである。このような治療法は、世界中で普遍的に受け入れられるべきである。一方、前述の治療ガイドラインでは、「個々の患者に何をするか、何をしないかの選択は、最終的には患者とその医療者が決めること」と認められている。COVID-19の治療における大きな問題は、質の高い試験の大部分が入院患者の治療に焦点を当てたものであり、患者が入院するのは病気が進行段階に達したときであるということである。COVID-19治療に関する最近の系統的な文献レビュー[58]では、COVID-19患者の入院期間に対する抗ウイルス剤、抗マラリア剤、粘液溶解剤などの効果を評価した試験の結果が紹介されている。COVID-19の病院前早期治療の試みの少なさを、これ以上説明することは難しいだろう。
SARS-CoV-2に対する転写反応を詳細に分析し、他の呼吸器系ウイルスに対する反応と比較した論文[5]では、COVID-19の主な特徴として、ウイルスに対する独特で不適切な炎症反応が挙げられているが、これは非常に引用されている。この不適切な炎症反応は、病気のどの段階で開始されるのかというのが切実な問題である。この不適切な炎症反応は、疾患が成熟し、明らかな肺炎の兆候が検出されるようになってから始まるのであろうか?それとも、特に様々な慢性疾患や高齢などの危険因子を持つ患者では、不適切な炎症反応は、病気の初期、病院に行く前の段階ですでに始まっているのであろうか?不適切な炎症反応が起こる可能性を避けるために、COVID-19の症状が出ていない患者や症状が出てきた患者は、早期に抗炎症剤で治療すべきではないのであろうか?悪性のCOVID-19炎症の発生を防ぐために使用できる、確立された安価な薬剤がいくつかあるのではないか?病院に到着する前のCOVID-19の段階では、発熱や痛みを抑えるためにパラセタモールがよく推奨されるが、パラセタモールの抗炎症作用はわずかで、細胞のグルタチオンを減少させる可能性がある[50]。イブプロフェンなどの非ステロイド性抗炎症薬(NSAIDs)を早期に使用することがより望ましいと考えられるが [30]、これらの人気の高い薬剤の効果は、この疾患では印象的ではないというのが一般的な認識である。
デキサメタゾンは、その抗炎症作用と免疫抑制作用のために幅広い症状で処方されるコルチコステロイドであるが、肺炎を患い酸素に依存しているCOVID-19の入院患者に投与すると、死亡率を減少させることが示されており[32,44]、現在そのような治療が推奨されている。デキサメタゾンは、その免疫抑制作用がこの環境での臨床転帰を悪化させる可能性を考慮して、初期疾患では試験されていない[31]。COVID-19の早期治療のためのより有望な薬剤は、自己免疫疾患や炎症性疾患に頻繁に使用される古い薬剤であるコルヒチンのように思われたが[37]、コルヒチンを服用している患者は重度のCOVID-19から保護されないことが判明した[6,20]。
現在、主に中枢神経系(CNS)に対する作用で知られている2つの薬剤、フルボキサミンとアマンタジンは、曝露後の予防やCOVID-19の早期治療の可能性として、最近大きな注目を集めている。いずれの場合も、抗炎症作用と中枢神経系への直接作用が重なっているためである。これらの薬剤について、薬理学の概要とCOVID-19の早期治療への再利用の可能性の根拠を以下に示す。
フルボキサミンの薬理作用
フルボキサミンは、選択的セロトニン再取り込み阻害薬(SSRI)に属し、シナプス前膜におけるセロトニン(5HT)の再取り込みを選択的に阻害することにより、セロトニン神経伝達を促進する。うつ病や不安障害の治療に広く用いられている。フルボキサミンは、他のSSRI(例:パロキセチン、セルトラリン、シタロプラム)よりも5HT受容体に対する効力は低いものの、脳内の他の受容体(例:ムスカリン系、ヒスタミン系など)に対する親和性がほとんどないか、はるかに低いという点で、このクラスの他の薬剤とは異なる[59]。特筆すべき例外は、古典的なオピオイドアンタゴニストであるナロキソンやナルトレキソンに抵抗性を示すオピオイド受容体のサブタイプであるシグマ-1受容体(S1R)であり、フルボキサミンはSSRIの中で最も活性の高いアゴニストである[28]。SSRIに属する抗うつ薬は、脳内で強力な抗炎症作用を発揮する。例えば、実験的な脳卒中において、フルオキセチンは脳内サイトカインの発現を抑制する[34]。脳内の炎症を抑制することは、これらの薬剤の抗うつ効果の重要な側面と考えられている[19]。SSRIの抗炎症作用のメカニズムとしては、前述のシグマ-1受容体が関係している。この特異な受容体は,小胞体の膜,特にミトコンドリア関連膜(MAM)と呼ばれる小胞体とミトコンドリアの境界部に存在し,細胞膜や核膜にも移動することができる。このような細胞内での局在により,この膜貫通型タンパク質は,ミトコンドリア,核,細胞外膜の間のコミュニケーションを制御することができる[53](図1)。S1Rの主要な機能の1つは,この構造体を通過するタンパク質のシャペロン化と,その機能の多能性モジュレーターとしての役割である。S1Rのアゴニストは、小胞体中の標的タンパク質のシャペロン化を促進することにより、小胞体ストレスを打ち消して脳内で抗炎症作用を発揮し、この作用がこれらの薬剤の神経保護作用に関与していると考えられている[48]。
COVID-19に対するフルボキサミン
フルオキセチンなど一部のSSRIは,HIV-1,エボラ出血熱,コクサッキーウイルスなどを含む広範囲のウイルスに対して抗ウイルス活性を示する([43]にレビューあり)。COVID-19の文脈では、これらの薬剤の免疫系への影響がさらに重要になる可能性がある。なぜなら、セロトニンは中枢および末梢の両方のメカニズムで炎症反応を抑制する免疫調節剤として作用するからである[14]。重要なことは、COVID-19の病気が重症化すると、ウイルス感染に直接関係する病気のメカニズムは重要でなくなり、病気の要因は炎症反応の過不足に関係することが多くなるということである[22,51]。すでに述べたように、フルボキサミンがSSRIの中でユニークなのは、セロトニン作動性受容体の他に、シグマ-1受容体を除いて他の受容体と相互作用しないことである。S1Rは、脳の多くの領域に存在するだけでなく、肺、心臓、肝臓などのいくつかの末梢器官にも存在している。フルボキサミンは,これらの受容体を介して,腸[2]や心臓[23]などの末梢でも抗炎症作用を発揮する。Rosenら[47]は,フルボキサミンがリポ多糖による致死的な敗血症ショックからマウスを保護し,ヒトの血液中の白血球の炎症反応を抑制することを発見し,敗血症のコントロールに有用であることを示唆している。
Lenzeら[33]は、プラセボ対照の外来試験において、軽度のCOVID-19疾患の早期治療としてフルボキサミンを投与すると、疾患の進行を完全に防ぐことを発見した。この研究では、成人COVID-19患者152名が、症状発現から7日以内にフルボキサミンを投与する群とプラセボを投与する群に無作為に分けられた。その後の2週間で、プラセボを服用していた72名のうち6名に臨床症状の悪化が見られたが、フルボキサミンを服用していた患者には見られなかった。別の研究[49]では,SARS-CoV-2ウイルスに感染した113人の患者にフルボキサミンが投与され,そのうち65人が薬を服用し,48人は治療を拒否した。2週間後、フルボキサミンを服用した患者は誰も病気の症状が出なかったのに対し、無治療のグループでは60%が症状を呈し、12.5%が入院を必要とした。
前述の2つの臨床研究は、フルボキサミンの抗炎症作用がS1Rとのアゴニズムを介していると考えられたことに端を発している。しかし、マスト細胞からのヒスタミン放出の減少、ウイルスの輸送を妨害する薬剤のリソソトロピック作用など、他のメカニズムの関与も考えられている[54]。COVID-19 [3]におけるフルボキサミンの明らかな有益性の説明として、メラトニンを代謝する肝シトクロムの阻害により、この物質の血漿レベルが大幅に上昇したことが関係しているという興味深い説明がある[57]。メラトニンは,主に松果体や消化管の細胞で産生される神経ホルモンであり,免疫系の活動を含むいくつかの生理的機能を調節することが知られている[24]。約10年前に、メラトニンが一種の「免疫バッファー」として働き、免疫抑制状態では免疫賦活作用を発揮し、急性炎症では抗炎症作用を発揮するという仮説が立てられた[11]。最近では、COVID-19に対するメラトニンの炎症反応を抑制する可能性が示唆されている[46]。フルボキサミンの安全性については、17年間の世界的な使用実績と推定2,800万人の患者のデータに基づく広範な市販後調査により、良好なプロファイルが確認されたが[8]、より最近の分析結果[52]では、ワルファリンなどの抗凝固剤との相互作用による危険性が指摘されている。COVID-19におけるフルボキサミンの臨床試験は、現在、ハンガリー(NCT04718480)米国(NCT04668950)ブラジル(NCT04727424)で実施されている。
アマンタジンの薬理作用
本薬は、A型インフルエンザウイルスのM2ビロポリンチャネルを効果的に遮断し、1966年に米国食品医薬品局(FDA)からアジア型インフルエンザの予防薬として承認された最初の抗ウイルス剤である。2009,アマンタジン(およびその誘導体であるリマンタジン)は、致死率が高いことで知られるA型インフルエンザ(特にH5N1亜型)の予防・治療薬として、世界保健機関(WHO)の「必須医薬品モデルリスト」に掲載されることが提案された[1]。残念ながら、その後すぐにインフルエンザウイルスがこれらの薬剤に対する耐性を獲得したため[27]、アマンタジンはこの環境下では推奨されなくなったが、一部のメーカーはこの薬剤の適応としてA型インフルエンザを削除しなかった。しかし、アマンタジンは、ビロポリンと相互作用し、チクングニアウイルスなど、A型インフルエンザ以外のRNAウイルスに対しても抗ウイルス活性を示す可能性があることに留意する必要がある[16]。特に興味深いのは、最近発表された無作為化プラセボ対照試験で、ボルナウイルスに感染したうつ病患者の積極的な治療としてアマンタジンが使用され、良好な結果が得られたことである[17]が、この試験の良好な結果が、アマンタジンの抗ウイルス活性に関連しているのか、抗うつ作用に関連しているのか、あるいはその両方が混ざっているのかは明らかではない。
現在、アマンタジンは主に神経系の薬として使用されている。また、外傷性脳損傷(TBI)や多発性硬化症などにも適応外で使用されている。アマンタジンは、中枢神経系への浸透性が高く、異なる神経伝達系(ドーパミン系、アドレナリン系、グルタミン酸系)に様々な影響を与える[34]。パーキンソン病では、L-DOPAによるジスキネジアを緩和するために使用されるが、活性化したミクログリアからの炎症性因子の放出を減少させ、アストロサイトにおけるグリア細胞由来向神経性因子(GDNF)の発現を増加させることにより、神経保護作用も発揮する[41]。アマンタジンの神経保護作用に重要と思われるもう一つのメカニズムは、弱いグルタミン酸/N-メチル-D-アスパラギン酸受容体アンタゴニストとしての作用で、同時にシスチン/グルタミン酸アンチポーターを活性化し、グルタチオン合成を促進することである[38]。最近の総説[15]では,試験管内試験および動物実験に基づいて同定されたアマンタジンの薬理作用の最も重要なメカニズムがまとめられ,ヒトで達成可能な濃度と関連づけられている。前述のシグマ-1受容体の他に,芳香族アミノ酸脱炭酸酵素(ドーパミン合成に関与する酵素),ニコチン受容体(a4b2およびa7),ホスホジエステラーゼ-1などが薬物作用の標的として示されている。
COVID-19のアマンタジン
アマンタジンは、SARSコロナウイルスなどのRNAウイルスを感染細胞から放出するビロポリンタンパク質チャネルを阻害するトリシクロ架橋炭化水素構造を持つアダマンタン類に属する薬剤である[56]。アダマンタンは、COVID-19にも再利用できる可能性があると思われた[55]。COVID-19におけるアマンタジンの有効性を示す証拠はまばらである。この薬剤が症候性SARS-CoV-2感染症の発症を緩和することを示唆する最初の臨床観察は、慢性神経疾患(パーキンソン病および多発性硬化症)を患う少数の患者グループに関するアンケートベースの研究であった。当初,この現象は,他の著者が示唆していたように,薬剤の抗ウイルス活性の可能性の結果として解釈されていた[4].後に、アマンタジンの抗疲労作用や覚醒促進作用など、他のメカニズムの寄与が提案された[21]。
いくつかの症例報告や小規模な観察研究では、COVID-19の曝露後予防または早期治療としてアマンタジンを投与することの潜在的な有益性が確認されているようである[13]。UK Biobankの研究[60]では、本剤の投与を受けたパーキンソン病患者の中にCOVID-19による重篤な合併症を発症した者はいなかったと報告されており、この結果は、アマンタジンがCOVID-19の感染と死亡の両方に対して保護効果を発揮しているのではないかという仮説と一致している。また、実験室で確認されたCOVID-19患者に特定の抗ウイルス薬や抗生物質を投与した場合の生存曲線と、無治療のグループの生存曲線を比較した実世界観察研究であるメキシコシティの報告[36]も注目に値する。
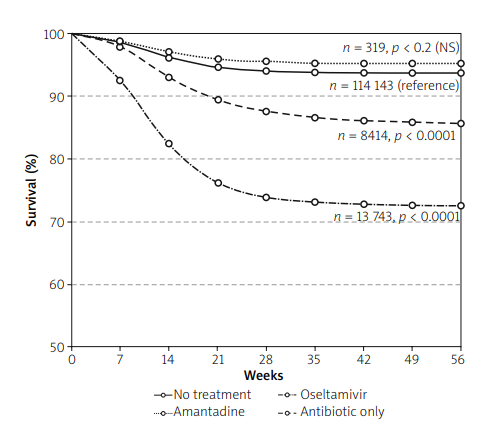
図2はその抜粋であるが、抗菌薬(オセルタミビル、抗生物質など)を投与された患者の死亡率が、無治療の患者の死亡率よりも有意に高いことが明らかになっており、かなり奇妙なデータである。考えられるのは、これらの薬剤がより重症の患者に適用され、効果がなかったということである。しかし、アマンタジンを投与された患者の生存曲線は、抗ウイルス剤や抗生物質を投与された患者の生存曲線と有意な差はなかった。この観察結果は、COVID-19におけるアマンタジンの有効性を示すものとは考えられないが(おそらくアマンタジンは重症度の低い患者に投与されたのだろう)COVID-19の設定においてこの薬剤による治療が安全であることを証明していると解釈できるだろう。ポーランドでは、有効性の正式な証明がないにもかかわらず、COVID-19のアマンタジンによる治療がメディアで提唱され、一部の医師によって宣伝され(例えば[26]を参照)かなりの人気を博した。SARS-CoV-2に感染してこの薬を服用した患者が、迅速かつ劇的な主観的改善を得たという噂が広まった。主観的な改善は、上述したアマンタジンの抗疲労作用と覚醒促進作用によるものと考えられる。
薬剤の抗ウイルス活性を調べる典型的な方法は、ミドリヒナザルの腎臓細胞株Veroにおけるウイルスの増殖に対する影響を評価することである。この実験では,アマンタジンはSARS-CoV-2の複製を阻害し,IC50濃度は83〜119μMであった[18]。ヒトに全身投与した場合、アマンタジンの最大濃度は約14.6µMであるため[7]、本剤の抗ウイルス作用は期待できない。しかし、Vero細胞を用いた試験管内試験では検出できない、制御不能な炎症の発生を妨げるメカニズムにより、重症化したCOVID-19の発生を妨げる可能性がある。第一に、本薬は、治療量を摂取した後に容易に達成できる濃度で、S1Rの強力なアゴニストであるため[15]、COVID-19では、フルボキサミンと同様に、制御不能な炎症反応の発生を抑制する可能性がある。
COVID-19におけるアマンタジンの治療活性の第2の重要なメカニズムは、カテプシンL(CatL)が関与している可能性がある。このリソソーム酵素は、SARS-CoV-2の細胞への侵入に関与していることが知られているプロテアーゼの1つである。コロナウイルスは、スパイク型糖タンパク質(S)を用いて受容体に結合し、膜融合を媒介して標的細胞にウイルスを侵入させる。コロナウイルスのSタンパク質は、ウイルス株や細胞の種類によって、1つまたは複数の宿主のプロテアーゼによって切断されることがある。Ouらの研究[42]によると、CatLは、ヒトのアンジオテンシン変換酵素2(hACE2)受容体を備えた細胞への侵入に関与している。重要なことは、ヒトの肺では、CatLは気管支上皮細胞とマクロファージに発現していることである[9]。Zhaoら[61]は、COVID-19の患者においてCatLが重要な役割を果たしていることを証明した。この著者らは、循環血中のこのタンパク質のレベルが、健康なボランティアよりもCOVID-19患者の方が有意に高いことを発見した。また、重症の患者では、軽症の患者に比べて、血漿中のCatLの濃度が著しく高かった。さらに、試験管内のSARS-CoV-2シュードウイルス感染細胞でも、CatLの上昇が認められた。さらに、アマンタジンの効果を調べたところ、SARS-CoV-2シュードウイルスを感染させた細胞では、同剤がCatL酵素活性を阻害し、細胞毒性はほとんどなく、SARS-CoV-2の細胞への侵入を有意に抑制することが判明した。最後に、偽ウイルスに感染したヒト化マウスにおいて、アマンタジンはCatLの発現を減少させた。著者らは、アマンタジンがCOVID-19の強力な治療薬となる可能性があり、ウイルス感染をきっかけにCatLの発現が増強されるという悪循環に歯止めをかけることができると結論づけている。
アマンタジンの投与によりCOVID-19患者の症状が改善したとされるのは、上述のメカニズムによるものと考えられる。もちろん、このような効果を確認するためには、前向きの対照試験が必要であることは言うまでもない。現在、初期のCOVID-19の肺炎・炎症亢進期への進行予防に対するアマンタジンの有効性を評価するプラセボ対照試験がポーランドで開始され(NCT04854759)同様の試験がデンマークでも行われている(NCT04894617)。
結論と今後の展望
フルボキサミンとアマンタジンは現在、抗ウイルス剤として確立されていない。もしSARS-CoV-2感染者の治療に有効であることが証明されれば、むしろホスト・ディレクテッド・セラピー(HDT)すなわち、ウイルスを直接標的とするのではなく、宿主の要因を標的とする薬剤に分類されるかもしれない。HDTのアプローチは医学界ではよく知られているが、主に慢性疾患、例えばウイルス性の慢性肝炎の治療に使われている[29]。このような戦略の利点は、ウイルスの突然変異が薬効に影響しないことである。その一方で、注意点もある。最近の試験管内試験およびマウスを用いた研究[12]では、一般的に使用されているNSAIDsであるイブプロフェンとメロキシカムは、ウイルスの侵入と複製には影響を与えないものの、SARS-CoV-2感染に対する炎症性サイトカイン反応を低下させ、さらに抗体反応も低下させることが明らかになった。このような効果は、ウイルスに対する免疫力の発達を妨げる可能性がある。抗炎症作用を発揮する薬剤は、たとえ初期のCOVID-19に有効であることが証明されたとしても、SARS-CoV-2に対するワクチン接種の代替手段となるべきではない。
