Apolipoprotein E in lipoprotein metabolism, health and
cardiovascular disease
概要
アポリポタンパクE(apoE)は、肝臓で合成された299アミノ酸の34 kDaの循環糖タンパク質で、トリグリセリドが豊富なリポタンパク質と関連して、循環中の酵素による脂肪分解後の残余物のクリアランスを媒介する。マクロファージでの合成は、肝臓への逆コレステロール輸送を効果的に行うために、高密度リポ蛋白質のフォーマーションを開始する。
神経系では、ApoEは細胞間で脂質を分配する機能を果たす同様のリポタンパク質を形成している。ApoEは、低密度リポタンパク質濃度とアテローム性動脈硬化のリスクに影響を与える3つの一般的なバリアント(アイソフォーム)による血漿リポタンパク質の変動の多くを占めている。
ApoE2は一般的に最も好ましく、アポEは心血管および神経病理学的健康に最も好ましい。ApoEバリアントは、位置112と158で異なるアミノ酸に関連する:ApoE2のための両方のシステイン、アポEのための両方のサイトでアルギニン、および野生型と見られているApoE3のためのそれぞれのシステインとアルギニン:。パラドックス的には、代謝ストレスの下で、apoE2のためのホモ接合性は、LDL受容体と関連タンパク質だけでなく、ヘパラン硫酸プロテオグリカンへの残余のリポタンパク質の障害結合のために、成人のdysbetalipoproteininaemiaをもたらす可能性がある。この非常にアテローム性の高い状態は、ApoEの他の変異でも見られるが、常染色体優性遺伝である。また、ApoEの変異はリポ蛋白糸球体症を引き起こすこともある。
中枢神経系では、apoEはアミロイドbタンパク質やタウタンパク質と結合し、その断片が細胞障害を起こすことがある。アポEはアルツハイマー病の発症の強い危険因子である。ApoEは、脳へのドコサヘキサエン酸の供給、免疫反応や炎症反応の調節など、健康や疾患に影響を及ぼす可能性のある他のいくつかの生理的効果を持っている。
apoEの遺伝子型解析は、リポタンパク質代謝の障害や糸球体症に応用できる可能性があり、心血管リスクの理解や、栄養学的・治療的介入の結果を知る上で、個別化医療に関連する可能性がある。apoEの定量はおそらく臨床的には有用ではないだろう。
ApoEは生物学的機能を持つペプチドを生成する可能性があり、血液脳関門の通過を可能にするナノ粒子に採用される可能性があるため、注目されている。これらの新しい知見から、治療法の選択肢が生まれるかもしれない。
キーワード
アポリポ蛋白質E;リポ蛋白質代謝;リポ蛋白質異常性貧血;リポ蛋白質異常性貧血;アポリポ蛋白質E変異.
序論
レビューの範囲
アポリポ蛋白質E(apoE)は、トリグリセリドを豊富に含むリポ蛋白質の中から発見された「アルギニンを豊富に含むプロテイン」1 であったが、現在ではゲノムにコードされた10の最も研究されている遺伝子の一つである2 。このレビューでは、ApoE,3 dysbetalipopro-teinaemia4 とアルツハイマー病5 に関する過去のレビューに続いて、ここ数年のApoE に関する開発を統合することを目的としている。
ApoEの歴史
塊状黄色腫6 を引き起こす重度の高脂血症は、フレデリクソン分類によるとIII型高脂血症と関連していることから、ApoEと関連していると考えられている。8 低密度リポ蛋白質(LDL)受容体へのapoE2(一般的な変異体)の結合はdefec-tiveであるが、システアミンで復元される。7 apoEの変異は、優勢に遺伝するdysbetalipo-proteinaemiaを引き起こすことが発見された。
アポリプロテインE
ApoEの進化
アポリポタンパクB(apoB)と関連するミクロソームトリグリセリドトランスファータンパク質は、多細胞生物における脂質輸送12のためのリポタンパク質の組み立てを可能にした。ApoEは、同様の交換可能なアポタンパク質のセットの一部として開発され、リポタンパク質の代謝制御を改善することができる。
ヒラメウオは、腸と脳で顕著に2つの形態のapoEを発現している14。ヒトのApoEは、霊長類を含む他の哺乳類のApoEとは異なり、おそらく遺伝的な「ホットスポット」で発生した突然変異によるものと考えられている。15 共通の変異体は2つのアミノ酸に存在し、3つのアイソフォームを形成している。等電点収束法により、電荷に応じてApoE2,ApoE3,アポEとラベル付けされたアイソフォームが同定された。これらのアイソフォームは、ε2,ε3,およびε4と呼ばれる対応する遺伝子に由来する。ApoEにおける追加の変異は、タンパク質上の正味の電荷を変化させることによって等電点を変化させることができる。
apoEに対応する遺伝子は動物ではε4であるが、成熟タンパク質のアミノ酸61は動物ではスレオニンであり、ヒトではアルギニンである。この突然変異に起因する中等度の高脂質血症は、ApoEの特性を変化させた。その結果、LDL高コレステロール血症は、高齢者では動脈硬化や神経病理学的障害のリスクを伴うものの、感染症に対する抵抗性を高めることで生存に有利な状態になっている可能性がある。ApoE3またはapoE2は、過去1万年の間にヒトのグループでより優れた「祖母化」により、長期生存によって選択されてきた可能性がある15。
APOE遺伝子の変異
APOE遺伝子は染色体19q13.2に位置し、4つのエクソンからなる。apoEアイソフォームをもたらす変異体は、コドン112のrs429358とコドンのrs7412である。
158. このように、ApoEまたはεバリアントの6つの組み合わせがある。米国では、E2/2,E2/3,E2/4,E3/3,E3/4,および E4/4 のおおよその有病率は、それぞれ 1,22,2,58,14,および 3%であり、データによると、アポE は黒人集団でより多く見られることが示唆されている。
16 apoEのもう一つの変異型(rs35136575)はLDLコレステロール濃度に影響を与え、白人では変動の1%、アフリカ系アメリカ人では3%、メキシコ系アメリカ人では2%の変動を説明している。
ApoEの機能
ApoEは、LDL受容体ファミリーのタンパク質とヘパラン硫酸プロテオグリカン(HSPG)のリガンドであるため、脂質とリポタンパク質の代謝に最も重要であり、循環から肝臓へのトリグリセリドを豊富に含む(apoBを含む)リポタンパク質の残余のクリアランスを促進する。脳内では、ApoE自体が脂質を同化して転送する。マウスでは、ApoE はステ ロール 6-b 水酸化酵素をアップレギュレーションすることで胆汁酸代謝を適応させ、これによりチェノデオキシコール酸をより親水性の高いムリコール酸に変換し、脂肪の吸収を減少させている。
血管機能はApoEによって様々な影響を受ける:血液脳関門の完全性の維持20 から炎症性反応まで21 。24 apoE による NF-kB 活性の調節は、周皮細胞や血液脳関門機能に影響を与える。
細胞内オルガネラの恒常性はApoEの影響を受けている可能性がある。アポEキャリアにおける初期の神経細胞機能障害はミトコンドリア機能障害と同調している27。アポEはまた、タンパク質のミスフォールディングを模倣することで小胞体ストレスを増加させる可能性がある28。ApoEからの生物学的に活性なペプチドもまた、病態生理学的な役割を持つ可能性がある29。短いカチオン性ペプチド(例えば、アミノ酸133~167)は免疫調節効果を持ち、細菌のバイオフィルムを破壊する可能性がある。
ApoEの産生
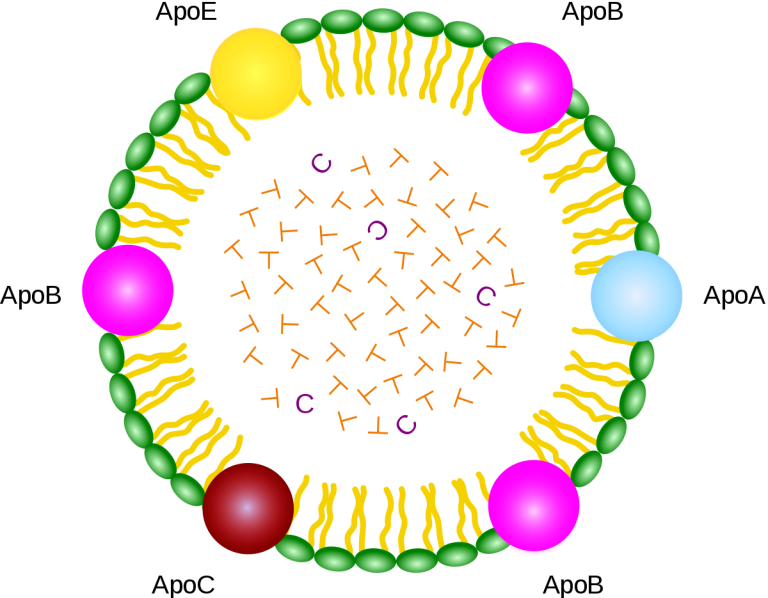
ApoEは多くの細胞で発現しているが30,特に肝臓で発現しており、中枢神経系ではアストロサイト、グリア細胞、血管細胞、脈絡叢などで広く発現している。ApoEはマクロファージや脂肪細胞で発現している。細胞外マトリックスや細胞膜上のヘパリンやHSPGへのApoEの結合は、シグナルに対する細胞の再スポン スに影響を与える可能性があり、ApoEが脾臓、肺、腎臓、卵巣、末梢神経、筋肉で発現している理由を説明することができる。apoEの生合成を図1に示す。
apoE の mRNA は、317 アミノ酸のタンパク質に翻訳され、その後、18 アミノ酸のシグナルペプチドが切断される。以前の出版物との比較可能性のために、本文書では、成熟したタンパク質に適用される番号の使用を保持している。O-グリコシル化は肝臓のスレオニン194にあるが、32,肝細胞に比べて、より広範なグリコシル化は肝循環に存在し、より多くのグリコシル化は、神経系で文書化されている。肝細胞のゴルジ体膜では、apoE は VLDL と結合し、VLDL の発育と分泌を促進する。興味深いことに、ApoE はゴルジ体で C 型肝炎ウイルスにも取り込まれ、感染性を促進し、特にアポE との結合を促進する。
脂質を含まない四量体への自己組織化が起こる可能性があるが、ApoE の大部分はリポタンパク質と結合している36。ApoE37 の正常血漿中濃度は約 1 mmol/L であり、アポB のそれと比較して、アポBを含むリポタンパク質のすべてがApoE を運ぶわけではないことを示している。
新たに合成されたApoEの一部は分解されることがあるが、分泌は、HepG2細胞におけるLDLの取り込みで見られるように、脂質の利用可能性によって増加する。40 マクロファージは内因性に産生されたApoEを外因性アポE、から分離し1、脂質代謝に異なる影響を与える。マクロファージがHDL,42とインキュベートされているときに内因性ApoEの脱落は少ないが、おそらくLDLによって提供されるのと同様のサルベージメカニズムから、N-アセチル-ロイシル-ノルロイシナルによって阻害されるシステインプロテアーゼ43がApoEを分解する。ApoEはまた、脳のさまざまな部分のバリエーションを持つner-vousシステムで17と25 kDaの間に及ぶ小さなペプチドに細胞外でキモトリプシン様のタンパク質分解開裂を経る、44。神経細胞は異なる方法でアポEを分解する。約30個のアミノ酸がカルボキシ末端から切断され、29 kDaのフラグメントと12~20 kDaの二次フラグメントが残る。これらのより小さいペプチドは、他の細胞タンパク質、細胞骨格、さらにはミトコンドリアにも複数の影響を与える。アポEのカルボキシ末端ペプチド(アミノ酸272-299)は、トランスジェニックマウスで神経障害を引き起こす45。
ApoEアイソフォームの生体内ターンオーバーを安定同位体で調べたところ、ApoE濃度はApoE2アイソフォームで最も高く、アポEアイソフォームで最も低かった。ApoE2のクリアランスはApoE3に比べて低く、アポEの産生率はApoE3やApoE2に比べて低い。アポEとVLDLとの間には優先的な関連性があった。全ApoEの分画異化率は0.49プール/日であり、リポタンパク質内では2.95プール/日であった。HDLおよびVLDL上のapoEの産生率は0.47mg/kg/日および2.6mg/kg/日であった。
ApoEと受容体との相互作用
ApoEは、肝臓で構成的に発現するHSPGとLDL受容体関連タンパク質のリガンドであり、LDL受容体のリガンドでもある。LDL受容体の活性は、細胞内のコレステロール量によって調節され、LDLやレムナントリポ蛋白質を内包してアップレギュレーションされると、コレステロールの供給を確実にする。LDL受容体に対するapoEの高い親和性は、リポタンパク質上に複数のコピーが存在するか、あるいはアポタンパク質とリポタンパク質との関連付けの際に異なるエピトープが露出している可能性がある47 。HSPG のクリアランス能力が大きいため、LDL 受容体活性がなくても残余物の蓄積を防ぐことができる。
apoEの構造を図2に示す。N-ターミナスはアポE8のリガンド活性を提供し、C-ターミナスはリン脂質、βアミロイド、タウタンパク質と相互作用する。N末端では、4つのらせんが一緒に束になり、介在するヒンジドメインは、LDL受容体結合領域の上に折り返されたC末端の位置にロックされる。この領域は、C末端がリン脂質に埋め込まれて遠ざかったときにのみ露出するようになる。これにより、ApoEはリポタンパク質上でのみ活性なリガンドであることが保証される。アミノ酸136〜150からなるリガンド領域は、正に荷電したアルギニン残基およびリジン残基を豊富に含み、HSPGおよびLDL受容体を結合する。LDL 受容体の結合活性は、apoE の N 末端ドメインと apoAi の C 末端のキメラ蛋白質に持続するため、頑健である49。
158位のアルギニンがない場合、apoE2は154位のアスパラギン酸が150位のアルギニンと塩橋を形成することを可能にする。これは、LDL受容体の結合を著しく阻害するが、HSPGへの結合はそれほど阻害されず、apoE2ホモ接合体の割合だけがdysbetalipoproteininaemiaを発症する理由を説明している。apoEのLDL受容体結合ドメイン内の変異は、LDL受容体とHSPGの結合の両方を破壊するため、代謝変化が問題を解明するまで発症が遅れているにもかかわらず、優性遺伝によって証明されたレムナント蓄積を強く引き起こす要因となる。
ヒトのapoEの61位のアルギニンはグルタミン酸255と塩橋を形成し、C末端をアポ状態に保つが、アポE15ではそうではないため、リン脂質の結合が大きくなるとLDL受容体結合領域が露出し、アポEを含むリポ蛋白質のクリアランスが促進される。
ApoEの化学修飾は、その機能を損なう可能性がある。煙に含まれる反応性アルデヒドであるアクロレインは、ApoEによるリポ蛋白質様小粒子の形成とその受容体への結合を阻害する。
リポ蛋白質のメタボリズムとApoE
リポ蛋白質上のApoEの分布
リポ蛋白質代謝におけるリポ蛋白質経路とapoEの役割を図3に示す。空腹時にはVLDLとHDLにapoEが存在するが、IDLと同様にLDLにはapoEは存在しない。LDLはIDLと同様、実質的にはapoEを持たない。食後、カイロミクロンは脂肪分解を受け、その残渣はVLDLと同様に急速に除去される。ApoEとアポCiiiはしばしばアポB含有リポ蛋白質上に共存し、ほぼ半分のVLDL上に存在する52 。
ApoEはABCA1トランスポーターからコレステロールとリン脂質を受容してHDLの生合成を開始する55が、アポEはapoE3に比べて効果が低い。このような粒子をアポEで生成する際の有効性は、ペプチドCS6253によりABCA1とABCG1を介した脂質の流出を促進し、apoE3と同様のリポ蛋白質を生成し、認知機能を改善することで改善されている56。
新たに形成された円盤状粒子は、2モルキュールのapoEを含むが、レシチン:コレステロールアシル転移酵素(LCAT)の作用によりコレステロールエステルを獲得し、LDLとほぼ同じ大きさになる。組換えApoEは、未エステル化コレステロール、コレステロールエステル、リン脂質の組成が異なる粒子を作成することができる。大きな球状のApoE含有粒子は、アポAi含有粒子よりもリン脂質トランスファータンパク質による改質を受けやすい。脳脊髄液(脳脊髄液)中に存在するリン脂質移行タンパク質57によって修飾された後でも、ApoEはより大きなHDL粒子を占有する傾向がある。
リポ蛋白質に対するアイソフォームの影響
ApoEアイソフォームは食後のリポタンパク質のメタボリズムに影響を与えることが、パルミチン酸レチニルがカイロミクロンをマークする経口脂肪チャレンジで実証されている58 。
ApoEは様々なVLDL粒子上に認められるが、アポEを有する被験者では低濃度であり、クリアランスの向上と一致している59。
空腹時血漿脂質に対する apoE の主な影響は、LDL と apoB 濃度にある。60 平均して、男性では apoE2 は LDL コレステロールを 0.24 mmol/L 低下させた。女性では0.35mmol/L、閉経前と閉経後でそれぞれ0.21mmol/Lと0.53mmol/L低下した。アポEは、男性では0.07mmol/L、女性では0.14mmol/LのLDLコレステロール濃度を上昇させた。
LDLにはApoEは含まれていないが、LDLの濃度と大きさは、性別、年齢、トリグリセリド濃度などの他の多くの要因とともに影響を与えている。LDLが小さいほど心血管リスクが高く、HDL濃度が低いことが知られている。食後のトリグリセリド濃度の増加または長期化は、コレステロールエステル転移タンパク質と肝リパーゼが、ApoE2担体のLDLをより小さな粒子にリモデリングすることを可能にする可能性がある。ApoEアイソフォームの様々な効果は、方法や参加者が異なる研究で報告されている。ApoE2キャリアは、HDLサイズが小さいHDLが多いアポEキャリアとは異なり、HDLサイズが正常なLDLが小さくなってた61。中年の健康なアラビア人のapoE2キャリアは、apoE2を持たない対照者と比較してLDLが小さいことはなかったが、apoE2と冠動脈性心疾患を持つ(高齢の)被験者ではLDLが小さいことがわかった63。
食事療法の研究では、64 アポEキャリアはLDLが大きかった。アポEを保有する個人では、脂質の多い食事から炭水化物の多い食事に変更すると、粒子径が大きくなった。これはおそらく、オレイン酸に起因するVLDL産生の増加が高トリグリセリド血症を引き起こし、LDL粒子のターンオーバーが遅くなったためである。この研究では、apoE2はより小さな粒子と関連していた。アポEキャリアでは、トリグリセリド濃度とは無関係にLDL粒子径が小さくなることが明らかになった65。家族性複合高脂血症では、LDL サイズが小さいと、apoE では相対的に乏しい大きな VLDL の高濃度との相関が見られた。
ApoEはリポタンパク質(a)のサブセット[Lp(a)]に存在している。脂質異常症の個体では、ApoEを含むLp(a)はLp(a)の約16%を占めている67,そしておそらく高トリグリセリド血症ではそれ以上になる。ApoEアイソフォームは、Lp(a)の最終濃度に影響を与えるが、ApoE含有Lp(a)には影響を与えなかった。
さらに、家族性高コレステロール血症(LDL受容体活性が低いことが推測される)に適合するLDL濃度を有する被験者では、より高いLp(a)濃度が優勢であった。興味深いことに、ApoE2ホモ接合体はLp(a)濃度への影響は予想よりも少なかったが、LDLクリアランスに障害があると疑われる患者ではLp(a)濃度の上昇を悪化させた。それにもかかわらず、apoE2の状態は冠動脈や大動脈弁疾患との関連性に変化を与えなかった。
健康と疾患におけるApoE
動物モデル
哺乳類はリポ蛋白質代謝のための類似の遺伝子を共有しているが、ヒトと他の哺乳類では血漿中のリポ蛋白質プロファイルが著しく異なっている。ヒトはLDLの濃度が高く、リポタンパク質にさらされる寿命が長い。げっ歯類を含むほとんどの動物は動脈硬化に抵抗性であるが、脂質異常症と動脈硬化を研究するために動物モデルが考案されてきた。このようなモデルでの高脂肪食は、非常に重度の高トリグリセリド血症を伴わずに20mmol/Lを超える高コレステロール血症を引き起こし、ApoE濃度は1g/Lの値に達することがある。
動脈硬化は、脂質の蓄積とマクロファージを特徴とする炎症過程の両方を伴う。ApoEは、循環単球における脂質蓄積を減少させ、単球および血管内皮における炎症性分子の発現を減少させる。条件付きApoE欠損マウスでは、急速に誘発される高脂血症がTリンパ球ヘルパー細胞1,T調節サブセット、抗体産生に変化をもたらすことが明らかになった。
ApoEノックアウトマウスでは、脳内コレステロール含量が低下し、認知機能が低下している。DHAを食事で補給することで、脳の内容量と神経・論理機能の両方が改善された。
マウスでは、脳外傷やくも膜下出血78,自己免疫性傷害79などの一次および二次傷害時の細胞の挙動やタンパク質や有機体の分解の増加に対応するオートファジーの変化に対して、ApoEの役割が評価されている。ApoEは、血液脳関門80の維持とその上を通る脂質の輸送に寄与している。ApoEのアミノ酸138~148からなるペプチドCOG1410(ただし、2つのアミノ酸が変化している)は、血液脳関門を透過し、二次障害におけるアポEの潜在的な害を防ぐ78。
心血管リスク
血管疾患の多くの危険因子がApoE濃度に影響を与えている。定期的なApoEのジェノタイピングや濃度測定はリスク評価を改善する可能性があるが、さらなる研究が必要である。
ApoEアイソフォームは、出生時からの心血管リスクに影響を与え、乳児の摂食への反応を含む81 。アポEアイソフォームは、LDLコレステロール、Lp(a)、アポB濃度の上昇とともに、頸動脈内膜厚83の増加と関連している。糖尿病では、アポEは心血管リスクの指標にもなる。
85 早期冠動脈疾患は、トリグリセリド濃度の上昇、ApoEを多く含むリポタンパク質86の増加、HDLコレステロール濃度の低下、LDL粒子の減少、Lp(a)濃度の上昇と関連しており、ApoEアイソフォームとは無関係である。
脂質プロファイルの軽度の変化による健康と心血管系リスクへの一般的な変異体の影響は、疫学研究で明らかになっているが、より重度の病理学的な後遺症も発生している。表1は、健康と疾患に対するapoEの様々な影響をまとめたものである。脂質異常症の発症は、男性では中年期、女性では閉経後に起こる。早期発症は、より重度の代謝ストレスで可能である。浸透性は、ApoE2ホモ接合性では低いであるが、優勢に遺伝する型では高い。リポ蛋白糸球体症は、一般的にdysbetalipoprotein-gomerulopathyの表現型と関連しており、凝集したリポ蛋白と血栓によるものである。ApoE豊中を伴う病理学的変化は膜性腎症に似ている。dysbetalipopro-teinaemiaでは高トリグリセリド血症が優勢である可能性があるが、高トリグリセリド血症との関連でいくつかの変異も報告されている。他の変異は、野生型と比較してLDL濃度を低下または上昇させる自然変異に関与し、1つの変異は、家族性高コレステロール血症と診断される可能性のある優性遺伝的な方法でLDL高コレステロール血症をもたらす。いくつかの変異は認知障害を引き起こすが、他の変異はアルツハイマー病のリスクを低下させる。
糖尿病性高コレステロール血症
β-リポ蛋白質異常症では、リポ蛋白質の過剰産生や更なるクリアランスの低下が代謝にストレスを与えると、主に成人男性または閉経後の女性に発生するクリアランス障害の結果として、残存リポ蛋白質が蓄積する。Dysbetalipoproteininaemiaは高度にアテローム性であるが、また、膵炎を沈殿させるトリグリセリドに富んだリポ蛋白質の蓄積をもたらす可能性がある。瘢痕性黄色腫と腱性黄色腫の両方が生じることがある。臨床では、トリグリセリドとコレステロールの両方の濃度が上昇することはまれではないが、βリポ蛋白異常症が証明されることはめったにない。ApoE2ホモ接合性はこの診断を支持するものであるが、優性遺伝性のβ-タンパク質異常症は見落とされている可能性がある。
ApoE2ホモ接合体を持つほとんどの人は、低コレステロール血症を呈し、LDL粒子が明瞭である。この間、LDL粒子は高グリセリド血症の結果としてリモデリングにより小さくなり、LDLは残りのリポタンパク質が蓄積すると検出できなくなることがある。最初はIDLや小VLDLが蓄積することがあるが、最終的にはVLDLやカイロミクロンが蓄積することがある。
84 予想通り、ApoEとアポBの濃度が高く、HDLコレステロールとアポAi濃度が低く、インスリン濃度とホメオスタティックモデル評価(HOMA)指標が高かった。興味深いことに、C反応性蛋白質濃度に差はなかった。
軽度の高トリグリセリド血症のみが存在する場合には、総コレステロール濃度が7.5 mmol/Lを超えること、腱黄色腫、早期アテローム性動脈硬化症によって定義されるように、リポ蛋白質異常症は家族性高コレステロール血症と間違われる可能性がある。支配的に遺伝性高コレステロール血症をもたらす突然変異を表1に示す。この突然変異はLDL受容体90 に高い親和性を与え、エンドソームコンパートメントでの解離を防止することで、残りのLDL受容体に結合したapoEがリソソソームでの分解の標的となるようにする。
リポタンパク質糸球体症
リポ蛋白糸球体症は、組織学的にスーダンブラックによる脂質物質の染色と糸球体中のapoEの検出により診断される。蛋白尿や腎不全を伴うことがある。正確な病因は不明であるが、腎移植後にリポ蛋白の凝集や糸球体の血栓症が再発する。リポ蛋白糸球体症をもたらすapoEの変異の多くはリポ蛋白の代謝を阻害するが、apoE2のホモ接合性はリポ蛋白糸球体症とは強く関連していないようである。92 糸球体症をもたらす突然変異はほとんどがApoEのN末端にあり、プロリンとの置換やシステインの変化により構造が大きく変化している。ApoEの構造は影響を受けているが、HSPGの結合やLDL受容体の結合は維持されている。表1に糸球体症に関連するapoEの変異を列挙した。リポ蛋白修飾治療は、この障害における凝集の量を減少させるようである。構造矯正剤は、凝集するApoEの傾向を変えることで有益であろう。そのような治療法が完成すれば、この重篤な障害に対する遺伝子編集が可能になるかもしれない。
神経系におけるApoE
動脈硬化性心血管系疾患への寄与とは別に、ApoEは神経機能や修復により直接的に影響を与え、脳脊髄液の変化は有益な情報となる可能性がある。様々な神経学的ストレスや損傷からの回復は、ApoE濃度とアイソフォームに関連して調査されている。ApoEは血漿中濃度の約20%で脳脊髄液中の主要なアポ蛋白であるが、アポBはほとんど存在しない93 。
94 アルツハイマー病とアポEの関連性は確立されている。アルツハイマー病の危険因子であるせん妄の強度は、脳脊髄液中のapoE濃度と逆相関している96 。アルツハイマー病の病態は、アミロイドβおよびタウタンパク質のクリアランス障害に関連している97 。
脳アミロイド血管症は、アミロイド蛋白の広範な沈着から急速に進行する脳出血性脳卒中の原因となっているが、アポEの有病率も増加している。
アルツハイマー病のリスクは、日常的に評価されているものよりも多くの遺伝的バリアントの影響を受けている。まれな変異型であるApoE7は、244(rs140808909)と245(rs190853081)の位置でリジンがグルタミン酸に置き換わるため、脂質異常症と記憶障害を引き起こし、有病率は1%で記憶障害のある患者に限定されていた。
ApoEアイソフォームは、神経系の他の病理学的プロセスにも影響を与える。ウィルソン病は、P型ATPアーゼ(ATP7)の機能不全が進行性肝硬変や神経疾患の原因となり、臨床症状に大きな変化が見られる。銅との結合が最も少なく、神経細胞の修復障害と関連しているアポEが過剰に発現している一方で、ApoE3ホモ接合体は認知状態が良好である102。
ApoEおよび多汗症の研究
現代の臨床検査では、計算されたLDLコレステロール濃度を用いた場合には、β-リポ蛋白質貧血は認識されないことがあるが、計算されたLDLコレステロール濃度と直接測定されたLDLコレステロール濃度との間に大きな差がある場合には、β-リポ蛋白質貧血が考慮されることがある。リポタンパク質の超遠心分離やアポタンパク質の等電点集束は、診断ラボではほとんど行われていない。電気泳動は低コストであるが、多くの臨床検査室では利用できない。
タンパク質とリポタンパク質の電気泳動
アガロースゲル電気泳動では、残余のリポ蛋白質はbroad-bバンドとして表示され、特異性は高いが感度は低い。b-バンドがブロードバンド105 を示す被験者では、apoE2 ホモ接合体の収率が低いことから、オランダや南アフリカで報告されているように、apoE の他の突然変異が糖尿病性貧血を説明する可能性があると考えられる。
アクリルアミドゲル電気泳動は、Bloom er al)。104 により、β型糖尿病蛋白質貧血の診断に有用であることが明らかにされ、β型糖尿病蛋白質貧血のワークアップに貢献している106 。サイズ排除クロマトグラフィーは、同様にLDLから残余のリポ蛋白質を識別することができる。
遺伝学的調査
遺伝子検査は実用的で手頃な価格になってきている。3つの一般的なバリアントのジェノタイピングはすぐに標準的なものになるかもしれないが、認知症のリスクに関する倫理的配慮があるかもしれない。apoE2は血管疾患から保護し、アポEは血管疾患を増強すると一般的に考えられているが、アポEの健康への影響は高齢になるほど大きくなる一方で、apoE2107については臨床では有用ではないかもしれない108。
一般的に用いられているポリメラーゼ連鎖反応109は、制限酵素消化により3つのアイソフォームを識別するApoE遺伝子の部分を増幅し、他の多くの変異が含まれているため、β-リポ蛋白質異常症の原因となっている。超遠心分離、電気泳動、クロマトグラフィーなどで残余のリポ蛋白質が確認された場合は、追加の遺伝学的検査を実施して弁膜蛋白異常症の原因を特定すべきである。
ApoE濃度
臨床における apoE 濃度の値は明らかになっていない。110 濃度はアイソフォームとトリグリセリドを多く含むリポ蛋白質の濃度に強く影響され、年齢や性別によって異なる。
最も高いApoE濃度はapoE2ホモ接合体37で、最も低いApoE濃度はアポEホモ接合体である。血漿中濃度は、ApoEと特定のリポ蛋白質との関連性ほどリスクを明らかにするものではないかもしれない。心血管リスクの高い女性のサブセットでは、HDL.112でより多くのApoEが検出された。
β型糖尿病性蛋白質異常血症におけるApoE濃度の範囲についての情報はほとんどない。高レベルのApoEはdysbetalipoproteininaemiaを示すかもしれないが、この障害はApoEの不在によるものかもしれない。
血漿中脂質修飾薬は一般にApoE濃度を低下させる。アトルバスタチン20mgまたは80mgを投与された高トリグリセリド血症の被験者は、ApoE濃度の平均値をそれぞれ38%および41%低下させたが、反応には大きなばらつきがあった115 。
115 アトルバスタチンはHDL中のApoE濃度も低下させた。神経学的機能障害のリスクは、一般的には低ApoE濃度に関連しており、特にABCA1トランスポーターの欠損に関連している可能性がある。HDL上に存在する血漿中の全ApoEのごく一部は、ポリエチレングリコール沈殿によって測定でき、その後、HDLは陽イオン交換によって分析される118。
治療法への応用
ApoEは、動脈硬化症や神経機能障害の治療だけでなく、様々な新しい応用分野においても新しい治療法を提供する可能性がある。
活性化されたマクロファージにおけるApoE発現の増加は、神経保護的である可能性があり、レチノイン酸を用いて達成することができる120。
プロブコールもまた、血漿脂質修飾活性を持つ抗酸化物質であり、ApoEの発現を増加させ、アルツハイマー病の臨床症状に好影響を与えている。
アポEの成熟は、高親和性の小分子または「構造補正因子」によって有利に修飾される可能性がある。
ApoEアイソフォームの変更
apoEの突然変異は数十年前から健康に適合しており、帰属する脂質異常症は、生活習慣、スタチン、フィブラートによって効果的に治療できる。それにもかかわらず、遺伝子編集が安全な臨床実践に翻訳されるならば、脂質異常症またはリポ蛋白質糸球体症の患者は、この治療法の恩恵を受ける可能性がある。遺伝子編集によるアルツハイマー病の予防は、血液脳関門を越えることができない限り、課題となるだろう。dysbetalipoproteininaemiaの病態が完全に理解され、予測可能でない限り、apoE2状態への変換は、高度にアテローム性の状態をもたらす可能性がある。
弁膜症性貧血は、理論的には、(組換え)apoE3の長期投与に反応する可能性がある。apoE3ドナーからの血漿注入は、膵炎を引き起こす急性重度の脂質異常症では報告されていない。
システアミンのようなアミノチオール類は、ApoE2をより機能的な形に変換するためのApoE,124の修飾に応用できる可能性がある。シスチノーシスを有するホモ接合型の apoE3 被験者では、システアミンによる治療により、いくつかの アポE が形成された。
ApoEの具体的な応用
ApoE様タンパク質またはペプチドは、リポタンパク質プロファイル、アテローム性動脈硬化、炎症、または細胞代謝、ひいては神経機能に影響を与える可能性がある。
これらの戦略は、Whiteら.125およびAnantharamaiahら.126によってレビューされている。
ペプチド Ac-hE18-NH 2 は、LDL 受容体結合ドメインからカルボキシ末端まで伸びる apoE の大部分を含んでおり、HSPG によるリポ蛋白質のクリアランスを向上させている。もう一つのペプチドである hEp は肝臓で発現し、リポ蛋白質濃度を低下させ、動脈硬化から保護することができた。
ApoE模倣ペプチドは、外傷後の血液脳関門の破壊から神経系の代謝活動を保護することができた。また、くも膜下出血でも血液脳関門を保護できる可能性がある131 。
固体脂質ナノ粒子に約 120~160 nm の大きさの apoE をコーティングすることで、血液脳関門を越えてクラスリン媒介エンドサイトーシスによる細胞内輸送が可能となり、脳への薬物送達が可能となる可能性がある133。興味深いことに、固体脂質ナノ粒子上に共有結合したApoEペプチドは、肺に投与した後、脳への送達が良好であった134。
個別化医療におけるApoE
個別化医療や精密医療では、遺伝的変異の知識とそれがリスクや介入への反応、合併症にどのように影響するかに基づいて、管理が個別化されている。脂質異常症、心血管リスク、神経変性疾患などでは、ApoEが主な原因因子ではないことがほとんどであるが、ApoEの状態を知ることは臨床現場での価値を高めることができるかもしれない。
脂肪分の多い食事の血漿コレステロール上昇効果は、アポEを有する被験者が健康的な食品を選択する際に有効であった。ApoE2キャリアは運動により脂質プロファイルの改善がみられた。血漿中脂質プロファイルは運動によって変化しなかったが、VLDL粒子のサイズは減少したが、小さなLDL粒子はapoE3/3の被験者でのみ改善した138。
脳内のDHAの生合成は、デマンドを満たしていない可能性がある。血漿中DHAの濃度が同等であるにもかかわらず、アポE対立遺伝子を持つ被験者は、脳へのDHAの取り込みが減少しており139,より多くの栄養補給の恩恵を受けるであろう。140 アポEは、アテローム性リポタンパク質レベルの設定では、n-3脂肪酸のLDL上昇効果を増強する。
ApoE遺伝子型は薬物療法への反応に影響を及ぼす可能性がある。フィブラートは、トリグリセリドだけでなく、apoBとapoEの低下にも有効であるが、apoE2のキャリアでは強力な効果があり、アポEのキャリアでは効果が最小であった。高用量の n-3 多価不飽和脂肪酸はトリグリセリドを低下させ、EPA は 4.8 g/日、DHA は 4.9 g/日の摂取で apoE を約 15%低下させた。
ApoEは新生物の広がりと成長に影響を及ぼす可能性がある。脂肪肉腫細胞はApoEを発現・分泌する。145 ApoEの発現は口腔扁平上皮癌の浸潤と相関している。146 胃癌に見られるマクロファージはApoEを含むエクソソームを分泌し、広がりを促進する。
結論
ApoE は、一般的なバリアントを持つ分子であり、個人の生涯にわたる健康や疾患に重大な影響を与える。ApoE2変異は、通常、心血管疾患や神経変性疾患のリスクが低いことに有利であるが、時折、高度なアテローム性疾患である弁膜症性貧血を引き起こすことがある。apoE のよりまれな変異もまた、しばしば優性遺伝を伴い、弁膜蛋白質異常性貧血と関連している。リポ蛋白糸球体症は、ApoEの変異によるまれな疾患で、しばしば脂質異常症を伴う。一般的な変異型であるアポEは、加齢に伴う認知能力の低下やアルツハイマー病、中等度の高コレステロール血症や動脈硬化の増加と関連している。
リポ蛋白質中のApoEの元の発見のために、アポリポ蛋白質B含有リポ蛋白質の生産とクリアランスにおけるApoEの役割を解明するために多くの研究が行われていた。最近では、細胞レベルでの重要な役割として、細胞からのコレステロールの排出、細胞間の脂質の移動、細胞の成長と修復プロセスをサポートするHDLクラスのリポタンパク質の提供が解明されている。研究では、ApoEとHSPGとの相互作用により、他の多くのプロセスを調節する可能性があることが示されている。apoEからのペプチドは、細胞に追加の効果を持つ可能性があり、様々なアイソフォームで異なっている。ApoEは、正常な機能を確保するために、神経系への、そして神経系内への多くの脂質輸送を媒介するが、また、特にアポEからの累積的な害を持つ神経系内のアミロイド原性タンパク質と相互作用する。
医療現場では、リポタンパク質の測定による血管疾患のリスクの認識と脂質修飾治療は、apoEの遺伝子型をデターマイニングしなくても成功している。しかし、リポ蛋白質異常性貧血を考慮した場合、この重篤な障害を確認し、潜在的に罹患している家族を追跡するためには、遺伝学的検査が有用である。現在、血中または脳脊髄液中のapoEの濃度は研究上の関心事である。認知症のリスクを評価するためには、そのような知識の意味合いを考慮した上で、ApoEの遺伝子型解析が好ましい。ApoEアイソフォームの知識は、生活習慣病、自動車血管疾患、神経変性疾患、炎症性疾患、さらには腫瘍性疾患に至るまで、精密医療における臨床的意思決定の一助となる可能性があるが、患者の状況に応じてこの情報を最大限に活用するためには、多くの研究が必要となるだろう。
研究では、様々な細胞株におけるApoEの代謝が非常に複雑であることが示されている。より多くの研究により、ApoE模倣ペプチドがアテローム性動脈硬化症や神経細胞の機能に好ましい影響を与える可能性がある。